Феномен «гольфного мяча»
Феномен «гольфного мяча»
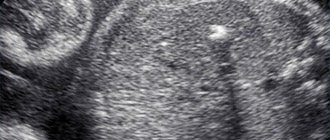
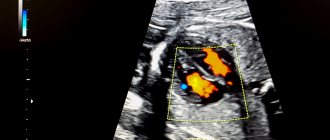
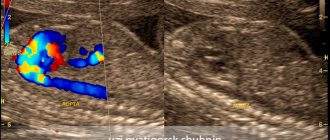
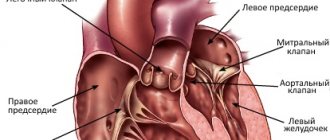
Вы пришли на второй скрининг, а Вам говорят, что у ребенка в левом желудочке гиперэхогенный фокус. «Гиперэхогенный» означает то, что на фоне тканей сердца участок обладает повышенной яркостью (плотностью). Феномен «гольфного мяча» возник по той причине, что такое гиперэхогенное включение по форме напоминает мяч, которым играют в гольф, и при сердечных сокращениях подпрыгивает cловно мячик. Чаще всего гиперэхогенный фокус (ГЭФ) обнаруживается в левом желудочке (ЛЖ), реже — в правом желудочке (ПЖ) и других камерах сердца. До сих пор остается загадкой, почему такой гиперэхогенный фокус (ГЭФ) в сердечной мышце, имеющий плотность костной ткани, бесследно исчезает после рождения.
ГЭФ в желудочках сердца плода: врачебная тактика
В большинстве случаев при обнаружении «гольфного мяча» в области сердца у ребенка необходимо продолжить наблюдение: контрольное УЗ исследование при беременности должен выполнять сертифицированный врач-диагност на современном 3D-аппарате. При подозрении на хромосомные аномалии у плода надо соглашаться на инвазивные методы исследования.
После рождения ребенка важно в первые дни и в течение первых лет жизни малыша регулярно проходить обследование у педиатра и кардиолога.
Обнаружение любых изменений в сердце у малыша – это существенный повод для внимательной оценки внутриутробного развития ребенка.
Порок развития или признак хромосомных нарушений
Избыточное пропитывание солями кальция
Да-да, именно такую реакцию у родителей может вызвать подобное заключение врача УЗИ-диагностики. На самом деле, ни то, ни другое не является истиной. Гиперэхогенный фокус в левом желудочке сердца плода — это не порок развития и не аномалия. Многие родители пугаются того, что подобного рода находка в сердце ребенка является признаком тяжелой хромосомной патологии, к примеру, наличия синдрома Дауна. На сегодняшний день нет научных доказательств, что наличие гиперэхогенного фокуса в левом желудочке сердца плода является достоверным признаком хромосомной патологии в отсутствии других ее признаков.
Почему же возникает такой фокус повышенной плотности во внутриутробном периоде? Есть несколько возможных причин.
- Избыточное пропитывание солями кальция (кальциноз) определенного участка сердечной мышцы. Чаще всего такие изменения локализуются в области сосочковых (папиллярных) мышц. Второй триместр беременности, во время которого чаще всего обнаруживаются подобные изменения, характеризуется активной минерализацией опорно-двигательного аппарата ребенка.
- Наличие дополнительной или ложной хорды в желудочке сердца ребенка. Такая ложная или дополнительная хорда не несет функциональной нагрузки, и не является патологией, а относится к малым аномалиям развития сердца (МАРС). Подобное явление — частая находка во время ультразвукового исследования. Сами хорды во внутриутробном периоде могут провоцировать отложение солей кальция, а также усиливать яркость гиперэхогенного фокуса.
- Один из признаков, указывающих на хромосомную патологию. Напомним еще раз, что при отсутствии иных достоверных признаков хромосомных патологий, наличие уплотнения или гиперэхогенного фокуса в левом желудочке сердца плода не указывает на генетические нарушения.
Какие же основные синдромы выявляет НИПТ
- Синдром Дауна (трисомия 21)
Частота встречаемости — 1:600 родов. Причем, риск трисомии 21 у плода увеличивается с возрастом женщины. Одна из форм геномной патологии, при которой чаще всего кариотип представлен 47 хромосомами вместо нормальных 46, поскольку хромосомы 21-й пары, вместо нормальных двух, представлены тремя копиями. Существует ещё две формы данного синдрома:транслокация хромосомы 21 на другие хромосомы (чаще на 15, реже на 14, ещё реже на 21, 22 и Y-хромосому) — 4% случаев, и мозаичный вариант синдрома — 5%. Характерные особенности, сопутствующие синдрому Дауна: «плоское лицо», аномальное укорочение черепа, кожная складка на шее у новорожденных, короткие конечности, открытый рот и другие признаки, которые может точно диагностировать врач-генетик.
- Синдром Эдвардса (трисомия 18)
Хромосомное заболевание характеризуется комплексом множественных пороков развития и трисомией 18 хромосомы. Описан в 1960 году Джоном Эдвардсом. Популяционная частота по миру 1:5000 на 2021 г. Дети с трисомией 18 чаще рождаются у пожилых матерей, взаимосвязь с возрастом матери менее выражена, чем в случаях трисомии 21 хромосомы. Основные признаки синдрома Эдвардса: малый вес, аномалии форм черепа, пороки сердца, дефекты межжелудочковой перегородки, умственная отсталость.
- Синдром Патау (трисомия 13)
Частота – 1:16000 родов. Характерны нарушения развития нервной системы, глаз, выраженная деформация лица, пороки развития сердца и других внутренних органов. Характерна глубокая задержка умственного развития. 90% детей умирают в возрасте до 1 года.
Что делать дальше
Генетический анализ крови
В том случае, если во время ультразвукового обследования выявлен гиперэхогенный фокус в левом желудочке сердца плода, необходимо дообследование. Что и как нужно делать дальше, определит Ваш лечащий врач. При необходимости в ряд дополнительных методов обследования могут входить:
- Генетический анализ крови, направленный на определение хромосомных аномалий плода.
- Эхокардиоскопия — диагностический метод, выполняемый в сроке с 18 до 25 недели. Оцениваются важные параметры работы сердца плода. Существуют определенные показания к данному методу: возраст старше 35 лет, сахарный диабет (СД), инфекции беременной на ранних сроках, выявление патологии сердечной мышцы (миокарда) плода на ранних сроках, отставание в развитии плода согласно срокам, имеется порок сердца у беременной или близких родственников.
В более редких случаях могут быть назначены следующие диагностические методы:
- Исследование клеток плаценты на генетические особенности плода. Подобный метод (плацентоцентез) позволяет в максимально ранние сроки определиться с диагнозом.
- Фетоскопия — исследование околоплодного пузыря. Амниоцентез — анализ состава околоплодных вод. Изучается уровень гормонов, биохимических и иммунологических показателей. Есть возможность оценить риск возникновения хромосомной аномалии.
СГЛОС — Синдром гипоплазии левых отделов сердца
Еще совсем недавно этот порок был смертельным абсолютно во всех случаях. Ребенок погибал в течение первой недели жизни, и никакой хирургической помощи ему оказать было невозможно.
Сегодня дело обстоит иначе и, если все сделано вовремя и правильно, то есть хорошие шансы его спасти. Именно спасти, т.к. сразу после рождения время его жизни отсчитывает не месяцы и дни — а часы, и даже минуты.
Слово гипоплазия означает «уменьшение в размерах». При этом пороке левый желудочек, т.е. главный, основной — почти полностью не развился. Но мало этого. Вместе с ним не развился ни вход в него, т.е. митральный клапан, ни выход, т.е. участок восходящей аорты вместе с ее клапаном. Вместо аорты имеется небольшой сосудик диаметром 1-3 миллиметра, по которому кровь поступает в коронарные артерии, а участка восходящей аорты — нет.
Огромный правый желудочек, получающий кровь из правого предсердия и левого предсердия через дефект в межпредсердной перегородке, нагнетает всю кровь в легочную артерию и легкие. Часть ее через отрытый артериальный проток поступает в большой круг, но только малая часть. Жизнь, таким образом, зависит от наличия двух сообщений — межпредсердного и межартериального, которые, во-первых, недостаточны, а во-вторых, сразу после рождения могут закрыться, как это бывает в норме. Иначе, как гемодинамической катастрофой
это назвать нельзя, и без самых экстренных мер ребенок погибнет.
Диагноз может быть установлен еще внутриутробно, и это — чрезвычайно важный момент, когда и родители, и врачи должны взвесить все имеющиеся возможности для оказания немедленной помощи. Важна тут не только подготовка к немедленным действиям, но и абсолютная решимость пройти с ребенком весь трудный поэтапный путь его дальнейшего лечения, который займет несколько первых лет его жизни.
Каждый из этих этапов для ребенка может оказаться последним, так как все они связаны с огромным риском. Но всегда, даже если это слабое утешение, надо помнить, что и вы, и врачи сделали все сегодня возможное, чтобы его спасти.
Этапы лечения
Первую операцию выполняют в первые дни жизни. Подходы к первому этапу хирургической коррекции могут быть различными и зависят от клиники, мастерства хирурга, готовность кардиохирургического стационара к выхаживанию и ведению этой экстремально сложной категории пациентов. Это может быть и операция с искусственным кровообращением, иногда — достаточно длительная, т.к. нужно сделать полную реконструкцию резко суженной восходящей аорты. Это достигается вшиванием эластичного биологического протеза такой формы, что в результате легочная артерия и аорта становятся единственным сосудом, отходящим от правого (единственного) желудочка. Чтобы обеспечить достаточное смешение крови, создают большой дефект межпредсердной перегородки, а кровоток в легкие направляют через артерио-легочный анастомоз. Как можно видеть из этого описания, это очень большая и сложная операция, которую можно делать исключительно в центрах, имеющих большой опыт операций на сердце у новорожденных детей.
Но даже в самых крупных и известных во всем мире учреждениях США смертность после этого этапа достигает 20-40 процентов.
Мы приводим эти цифры, чтобы подчеркнуть, что при синдроме гипоплазии левых отделов сердца хирургия — это единственный возможный, но далеко не безопасный путь. Но, поскольку мы говорим о спасении жизни, то даже сами попытки всегда оправданы.
В последние годы в нескольких клиниках мира внедрен метод, выживаемость после которого близка к 90% — так называемая гибридная операция стентирования открытого артериального протока и двустороннего раздельного суживания легочных артерий.
Если все прошло хорошо, то вторую операцию рекомендуют делать в 4-10 месяцев. При этом делается анастомоз между верхней полой веной и легочной артерией, или «половина» операции Фонтена. И, наконец, в возрасте полутора–двух лет ребенку делают третий этап — окончательную паллиацию по Фонтену, после которой круги кровообращения полностью разделены.
В клиниках, имеющих большой опыт подобных операций, второй и третий этапы значительно менее рискованны, чем первый — наиболее трудный. Ребенку предстоит жизнь с одним желудочком и все, сказанное выше о пороках, для которых операция Фонтена является заключительным этапом хирургического лечения, относится в полной мере и к этому пороку.
Еще 10-15 лет назад дети с синдромом гипоплазии левых отделов сердца не подлежали операции вообще. А ведь синдром — один из пяти наиболее часто встречающихся врожденных пороков сердца
. Сегодня помощь этим детям возможна, хотя и не всегда. Но если вы и ваши кардиологи это знают, то надо действовать. И пусть «надежды маленький оркестрик под управлением любви» никогда не оставляет вас на этом трудном пути.
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации