В латинском языке существует слово compensatum, что в переводе означает «уравновешивать». Компенсаторная пауза — это термин, который характеризует диастолическую паузу, наступающую после нарушения сердечного ритма. По времени такая пауза удлиненная. Ее длительность приравнивается к двум обычным для сердечного ритма паузам.
Наступает компенсаторная пауза после желудочковой экстрасистолы и длится до очередного самостоятельного сокращения.
Причины возникновения компенсаторной паузы
После экстрасистолы желудочка наблюдается рефрактерный период, характеризующийся тем, что желудочек не реагирует на следующий импульс, исходящий из синуса. Это приводит к тому, что желудочек сокращается не после первого, а после второго импульса синуса. Бывают случаи, когда сердцебиение очень редкое, конец рефрактерного периода наблюдается после экстрасистолы и до очередного импульса синуса. Такие изменения в ритме сердца могут привести к отсутствию компенсаторной паузы.
Сердечный ритм бывает номотопный и гетеротопный. Их одновременное наличие у человека называется парасистолией, которая нередко может быть причиной появления компенсаторных пауз.
Еще одной причиной их появления может стать экстрасистолическая аллоритмия, которая представляет собой серьезную патологию, связанную с нарушениями функции кровообращения и сердечного ритма.
Классификация
Синусовая
Предсердная
- предсердная
- нижнепредсердная
- левопредсердная
Из АВ-соединения
- с одновременным возбуждением предсердий и желудочков
- с предшествующим возбуждением предсердий и желудочков:
- ретроградная блокада 1 степени
- с полной ретроградной блокадой
- с полной антероградной блокадой
Желудочковая
- перегородочная
- париетальная
Виды компенсаторных пауз
Компенсаторные паузы бывают двух видов:
- Полная.
- Неполная.
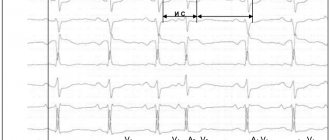
Полная компенсаторная пауза после желудочковых экстрасистол появляется как следствие того, что не наблюдается прохождения внеочередного импульса сквозь атриовентрикулярный узел. Заряд синусового узла при этом не уничтожается.
Следующий синусовый импульс доходит до желудочков в то время, когда в них происходит внеочередное сокращение. Этот период называется рефрактерным. Происходит ответ желудочков лишь на очередной синусовый импульс, что по времени равно двум сердечным циклам.
Это значит, что время, обозначающее интервалы до и после экстрасистол, приравнивается к двум нормальным интервалам R – R.
Неполная компенсаторная пауза характеризуется появлением возбуждения в эктопическом очаге. Импульс доходит до ретроградного синусового узла, после чего происходит уничтожение образовавшегося в нем заряда. В этот момент образуется очередной нормальный синусовый импульс. Это означает, что промежуток, появившийся после экстрасистолы, приравнивается к одному обычному интервалу R – R и времени, за которое экстрасистолический импульс проходит от эктопического очага до синусового узла. То есть такая ситуация говорит о том, что расстояние от синусового узла до эктопического очага влияет на паузу после экстрасистолы.
Расположение эктопического очага и атриовентрикулярного узла влияет на интервал предсердной экстрасистолы P – Q. Нахождение узла недалеко от очага значительно укорачивает P – Q.
ЭКСТРАСИСТОЛИЯ: клиническое значение, диагностика и лечение
Экстрасистолами называют преждевременные комплексы (преждевременные сокращения), выявляемые на ЭКГ. По механизму возникновения преждевременные комплексы подразделяются на экстрасистолы и парасистолы. Различия между экстрасистолией и парасистолией являются чисто электрокардиографическими или электрофизиологическими. Клиническое значение и лечебные мероприятия при экстрасистолии и парасистолии абсолютно одинаковы. По локализации источника аритмии электросистолы разделяют на наджелудочковые и желудочковые.
Экстрасистолы, несомненно, являются самым распространенным нарушением ритма сердца. Они часто регистрируются и у здоровых лиц. При проведении суточного мониторирования ЭКГ статистической «нормой» экстрасистол считается примерно до 200 наджелудочковых экстрасистол и до 200 желудочковых экстрасистол в сутки. Экстрасистолы могут быть одиночными или парными. Три и более экстрасистолы подряд принято называть тахикардией («пробежки» тахикардии, «короткие эпизоды неустойчивой тахикардии»). Неустойчивой тахикардией называют эпизоды тахикардии продолжительностью менее 30 с. Иногда для обозначения 3–5 экстрасистол подряд используют определение «групповые», или «залповые», экстрасистолы. Очень частые экстрасистолы, особенно парные и рецидивирующие «пробежки» неустойчивой тахикардии, могут достигать степени непрерывно-рецидивирующей тахикардии, при которой от 50 до 90% сокращений в течение суток составляют эктопические комплексы, а синусовые сокращения регистрируются в виде единичных комплексов или коротких кратковременных эпизодов синусового ритма.
В практической работе и научных исследованиях основное внимание уделяют желудочковой экстрасистолии. Одной из наиболее известных классификаций желудочковых аритмий является классификация B. Lown и M. Wolf (1971).
- Редкие одиночные мономорфные экстрасистолы — менее 30 в час.
- Частые экстрасистолы — более 30 в час.
- Полиморфные экстрасистолы.
- Повторные формы экстрасистол: 4А — парные, 4Б — групповые (включая эпизоды желудочковой тахикардии).
- Ранние желудочковые экстрасистолы (типа «R на Т»).
Предполагалось, что высокие градации экстрасистол (классы 3–5) являются наиболее опасными. Однако в дальнейших исследованиях было установлено, что клиническое и прогностическое значение экстрасистолии (и парасистолии) практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) экстрасистолия, включая эпизоды неустойчивой желудочковой тахикардии и даже непрерывно-рецидивирующей тахикардии, не влияет на прогноз и не представляет опасности для жизни. Аритмии у лиц без признаков органического поражения сердца называют идиопатическими. У больных с органическим поражением миокарда (постинфарктный кардиосклероз, дилатация и/или гипертрофия левого желудочка) наличие экстрасистолии считается дополнительным прогностически неблагоприятным признаком. Но даже в этих случаях экстрасистолы не имеют самостоятельного прогностического значения, а являются отражением поражения миокарда и дисфункции левого желудочка.
В 1983 г J. T. Bigger предложил прогностическую классификацию желудочковых аритмий.
- Безопасные аритмии — любые экстрасистолы и эпизоды неустойчивой желудочковой тахикардии, не вызывающие нарушений гемодинамики, у лиц без признаков органического поражения сердца.
- Потенциально опасные аритмии — желудочковые аритмии, не вызывающие нарушений гемодинамики, у лиц с органическим поражением сердца.
- Опасные для жизни ари) — эпизоды устойчивой желудочковой тахикардии, желудочковые аритмии, сопровождающиеся нарушениями гемодинамики, или фибрилляция желудочков. У больных с опасными для жизни желудочковыми аритмиями, как правило, имеется выраженное органическое поражение сердца (или «электрическая болезнь сердца», например синдром удлиненного интервала Q–T, синдром Бругада).
Однако, как было отмечено, независимого прогностического значения желудочковая экстрасистолия не имеет. Сами по себе экстрасистолы в большинстве случаев безопасны. Экстрасистолию даже называют «косметической» аритмией, подчеркивая этим ее безопасность. Даже «пробежки» неустойчивой желудочковой тахикардии тоже относят к «косметическим» ари (R. W. Campbell, K. Nimkhedar, 1990). В любом случае лечение экстрасистолии с помощью антиаритмических препаратов (ААП) не улучшает прогноз. В нескольких крупных контролируемых клинических исследованиях было выявлено заметное повышение общей смертности и частоты внезапной смерти (в 2–3 раза и более) у больных с органическим поражением сердца на фоне приема ААП класса I, несмотря на эффективное устранение экстрасистол и эпизодов желудочковой тахикардии. Наиболее известным исследованием, в котором впервые было выявлено несоответствие клинической эффективности препаратов и их влияния на прогноз, является исследование CAST. В исследовании CAST («исследование подавления аритмий сердца») у больных, перенесших инфаркт миокарда, на фоне эффективного устранения желудочковой экстрасистолии препаратами класса I С (флекаинид, энкаинид и морицизин) выявлено достоверное увеличение общей смертности в 2,5 раза и частоты внезапной смерти в 3,6 раза по сравнению с больными, принимавшими плацебо. Результаты исследования заставили пересмотреть тактику лечения не только пациентов с нарушениями ритма, но и кардиологических больных вообще. Исследование CAST является одним из основных в становлении «медицины, основанной на доказательствах». Только на фоне приема β- адреноблокаторов и амиодарона отмечено снижение смертности больных с постинфарктным кардиосклерозом, сердечной недостаточностью или реанимированных пациентов. Однако положительное влияние амиодарона и особенно β-адреноблокаторов не зависело от антиаритмического действия этих препаратов.
Выявление экстрасистолии (как и любого другого варианта нарушений ритма) является поводом для обследования, направленного прежде всего на выявление возможной причины аритмии, заболевания сердца или экстракардиальной патологии и определения функционального состояния миокарда.
ААП не излечивают от аритмии, а только устраняют ее на период приема препаратов. При этом побочные реакции и осложнения, связанные с приемом практически всех препаратов, могут быть гораздо более неприятными и опасными, чем экстрасистолия. Таким образом, само по себе наличие экстрасистолии (независимо от частоты и «градации») не является показанием для назначения ААП. Бессимптомные или малосимптомные экстрасистолы не требуют проведения специального лечения. Таким больным показано диспансерное наблюдение с проведением эхокардиографии примерно 2 раза в год для выявления возможных структурных изменений и ухудшения функционального состояния левого желудочка. Л. М. Макаров и О. В. Горлицкая (2003) при длительном наблюдении за 540 больными с идиопатической частой экстрасистолией (более 350 экстрасистол в час и более 5000 в сутки) выявили у 20% больных увеличение полостей сердца («аритмогенная кардиомиопатия»). Причем более часто увеличение полостей сердца отмечалось при наличии предсердной экстрасистолии.
Показания для лечения экстрасистолии:
- очень частые, как правило, групповые экстрасистолы, вызывающие нарушения гемодинамики;
- выраженная субъективная непереносимость ощущения перебоев в работе сердца;
- выявление при повторном эхокардиографическом исследовании ухудшения показателей функционального состояния миокарда и структурных изменений (снижение фракции выброса, дилатация левого желудочка).
Лечение экстрасистолии
Необходимо объяснить больному, что малосимптомная экстрасистолия безопасна, а прием антиаритмических препаратов может сопровождаться неприятными побочными эффектами или даже вызвать опасные осложнения. Прежде всего необходимо устранить все потенциально аритмогенные факторы: алкоголь, курение, крепкий чай, кофе, прием симпатомиметических препаратов, психоэмоциональное напряжение. Следует немедленно приступить к соблюдению всех правил здорового образа жизни.
При наличии показаний для назначения ААП у больных с органическим поражением сердца используют β-адреноблокаторы, амиодарон и соталол. У больных без признаков органического поражения сердца, кроме этих препаратов, применяют ААП класса I: Этацизин, Аллапинин, Пропафенон, Кинидин Дурулес. Этацизин назначают по 50 мг 3 раза в день, Аллапинин — по 25 мг 3 раза в день, Пропафенон — по 150 мг 3 раза в день, Кинидин Дурулес — по 200 мг 2–3 раза в день.
Лечение экстрасистолии проводят методом проб и ошибок, последовательно (по 3–4 дня) оценивая эффект приема антиаритмических препаратов в средних суточных дозах (с учетом противопоказаний), выбирая наиболее подходящий для данного больного. Для оценки антиаритмического эффекта амиодарона может потребоваться несколько недель или даже месяцев (применение более высоких доз амиодарона, например по 1200 мг/сут, может сократить этот период до нескольких дней).
Эффективность амиодарона в подавлении желудочковых экстрасистол составляет 90–95%, соталола — 75%, препаратов класса I C — от 75 до 80% (B. N. Singh, 1993).
Критерий эффективности ААП — исчезновение ощущения перебоев, улучшение самочувствия. Многие кардиологи предпочитают начинать подбор препаратов с назначения β-адреноблокаторов. У больных с органическим поражением сердца при отсутствии эффекта от β-адреноблокаторов применяют Амиодарон, в том числе в комбинации с первыми. У больных с экстрасистолией на фоне брадикардии подбор лечения начинают с назначения препаратов, ускоряющих ЧСС: можно попробовать прием пиндолола (Вискен), эуфиллина (Теопек) или препаратов класса I (Этацизин, Аллапинин, Кинидин Дурулес). Назначение холинолитических препаратов типа белладонны или симпатомиметиков менее эффективно и сопровождается многочисленными побочными явлениями.
В случае неэффективности монотерапии оценивают эффект комбинаций различных ААП в уменьшенных дозах. Особенно популярны комбинации ААП с β-адреноблокаторами или амиодароном.
Есть данные, что одновременное назначение β-адреноблокаторов (и амиодарона) нейтрализует повышенный риск от приема любых антиаритмических средств. В исследовании CAST у больных, перенесших инфаркт миокарда, которые наряду с препаратами класса I C принимали β-адреноблокаторы не было отмечено увеличения смертности. Более того, было выявлено снижение частоты аритмической смерти на 33%!
Особенно эффективна комбинация β-адреноблокаторов и амиодарона. На фоне приема такой комбинации наблюдалось еще большее снижение смертности, чем от каждого препарата в отдельности. Если ЧСС превышает 70–80 уд./мин в покое и интервал P–Q в пределах 0,2 с, то проблемы с одновременным назначением амиодарона и β-адреноблокаторов нет. В случае брадикардии или АВ-блокады I–II степени для назначения амиодарона, β-адреноблокаторов и их комбинации необходима имплантация кардиостимулятора, функционирующего в режиме DDD (DDDR). Есть сообщения о повышении эффективности антиаритмической терапии при сочетании ААП с ингибиторами АПФ, блокаторами рецепторов ангиотензина, статинами и препаратами омега-3-ненасыщенных жирных кислот.
Некоторые противоречия существуют в отношении применения амиодарона. С одной стороны, некоторые кардиологи назначают амиодарон в последнюю очередь — только при отсутствии эффекта от других препаратов (считая, что амиодарон довольно часто вызывает побочные явления и требует длительного «периода насыщения»). С другой стороны, возможно, более рационально начинать подбор терапии именно с амиодарона как наиболее эффективного и удобного для приема препарата. Амиодарон в малых поддерживающих дозах (100–200 мг в день) редко вызывает серьезные побочные явления или осложнения и является скорее даже более безопасным и лучше переносимым, чем большинство других антиаритмических препаратов. В любом случае при наличии органического поражения сердца выбор небольшой: β-адреноблокаторы, амиодарон или соталол. При отсутствии эффекта от приема амиодарона (после «периода насыщения» — как минимум по 600–1000 мг/сут в течение 10 дней) можно продолжить его прием в поддерживающей дозе — 0,2 г/сут и, при необходимости, оценить эффект последовательного добавления препаратов класса I С (Этацизин, Пропафенон, Аллапинин) в половинных дозах.
У больных с сердечной недостаточностью заметное уменьшение количества экстрасистол может отмечаться на фоне приема ингибиторов АПФ и Верошпирона.
Следует отметить, что проведение суточного мониторирования ЭКГ для оценки эффективности антиаритмической терапии утратило свое значение, так как степень подавления экстрасистол не влияет на прогноз. В исследовании CAST выраженное увеличение смертности отмечено на фоне достижения всех критериев полного антиаритмического эффекта: уменьшения общего количества экстрасистол более чем на 50%, парных экстрасистол — не менее чем на 90% и полное устранение эпизодов желудочковой тахикардии. Основным критерием эффективности лечения является улучшение самочувствия. Это обычно совпадает с уменьшением количества экстрасистол, а определение степени подавления экстрасистолии не имеет значения.
В целом последовательность подбора ААП у больных с органическим заболеванием сердца, при лечении рецидивирующих аритмий, включая экстрасистолию, можно представить в следующем виде.
- β-адреноблокатор, амиодарон или соталол.
- Амиодарон + β-адреноблокатор.
- Комбинации препаратов:
- β-адреноблокатор + препарат класса I;
- амиодарон + препарат класса I С;
- соталол + препарат класса I С;
- амиодарон + β-адреноблокатор + препарат класса I С.
У больных без признаков органического поражения сердца можно использовать любые препараты, в любой последовательности или использовать схему, предложенную для больных с органическим заболеванием сердца.
Краткая характеристика ААП
β-адреноблокаторы. После исследования CAST и опубликования результатов метаанализа исследований по применению ААП класса I, в котором было показано, что практически все ААП класса I способны увеличивать смертность у больных с органическим поражением сердца, β-адреноблокаторы стали самыми популярными антиаритмическими препаратами.
Антиаритмический эффект β-адреноблокаторов обусловлен именно блокадой β-адренергических рецепторов, т. е. уменьшением симпатико-адреналовых влияний на сердце. Поэтому β-адреноблокаторы наиболее эффективны при аритмиях, связанных с симпатико-адреналовыми влияниями — так называемые «катехоламинзависимые» или «адренергические аритмии». Возникновение таких аритмий, как правило, связано с физической нагрузкой или психоэмоциональным напряжением.
Катехоламинзависимые аритмии в большинстве случаев одновременно являются «тахизависимыми», т. е. возникают при достижении определенной критической частоты сердечных сокращений, например во время физической нагрузки частая желудочковая экстрасистолия или желудочковая тахикардия возникают только при достижении частоты синусового ритма 130 сокращений в минуту. На фоне приема достаточной дозы β-адреноблокаторов больной не сможет достичь частоты 130 уд./мин при любом уровне физической нагрузки, таким образом предотвращается возникновение желудочковых аритмий.
β-адреноблокаторы являются препаратами выбора для лечения аритмий при врожденных синдромах удлинения интервала Q–T.
При аритмиях, не связанных с активацией симпатической нервной системы β-адреноблокаторы гораздо менее эффективны, но добавление β-адреноблокаторов нередко значительно увеличивает эффективность других антиаритмических препаратов и снижает риск аритмогенного эффекта ААП класса I. Препараты класса I в сочетании с β-адреноблокаторами не увеличивают смертность у больных с им поражением сердца (исследование CAST).
При так называемых «вагусных» аритмиях β-адреноблокаторы оказывают аритмогенное действие. «Вагусные» аритмии возникают в состоянии покоя, после еды, во время сна, на фоне урежения ЧСС («брадизависимые» аритмии). Вместе с тем в некоторых случаях при брадизависимых аритмиях эффективно применение пиндолола (Вискен) — β-адреноблокатора с внутренней симпатомиметической активностью (ВСА). Кроме пиндолола к β-адреноблокаторам с ВСА относятся окспренолол (Тразикор) и ацебутолол (Сектраль), однако в максимальной степени внутренняя симпатомиметическая активность выражена именно у пиндолола.
Дозы β-адреноблокаторов регулируют в соответствии с антиаритмическим эффектом. Дополнительным критерием достаточной β-блокады является снижение ЧСС до 50 уд./мин в состоянии покоя. В прежние годы, когда основным β-адреноблокатором был пропранолол (Анаприлин, Обзидан), известны случаи эффективного применения пропранолола при желудочковых аритмиях в дозах до 960 мг/сут и более, например до 4 г в день! (R. L. Woosley et al., 1979).
Амиодарон. Амиодарон таблетки 0,2 г. (оригинальным препаратом является Кордарон) обладает свойствами всех четырех классов ААП и, кроме того, оказывает умеренное a-блокирующее действие. Амиодарон, несомненно, является самым эффективным из существующих антиаритмических препаратов. Его даже называют «аритмолитическим препаратом».
Основным недостатком амиодарона является высокая частота экстракардиальных побочных эффектов, которые при длительном приеме наблюдаются у 10–75% больных. Однако необходимость в отмене амиодарона возникает у 5–25% (J. A. Johus et al., 1984; J. F. Best et al., 1986; W. M. Smith et al., 1986). К основным побочным эффектам амиодарона относятся: фотосенсибилизация, изменение цвета кожи, нарушение функции щитовидной железы (как гипотиреоз, так и гипертиреоз), повышение активности печеночных трансаминаз, периферические нейропатии, мышечная слабость, тремор, атаксия, нарушения зрения. Большинство этих побочных эффектов обратимы и исчезают после отмены или при уменьшении дозы амиодарона. Гипотиреоз можно контролировать с помощью приема левотироксина. Наиболее опасным побочным эффектом амиодарона является поражение легких («амиодароновое поражение легких») — возникновение интерстициального пневмонита или, реже, легочного фиброза. У большинства больных поражение легких развивается только при длительном приеме сравнительно больших поддерживающих доз амиодарона — более 400 мг/сут. Такие дозы крайне редко применяют в России. Поддерживающая доза амиодарона в России обычно составляет 200 мг/сут или даже меньше (по 200 мг в день 5 дней в неделю). B. Clarke и соавторы (1985) сообщают лишь о трех случаях из 48 наблюдений возникновения этого осложнения на фоне приема амиодарона в дозе 200 мг в сутки.
В настоящее время изучается эффективность дронедарона, деривата амиодарона без йода. Предварительные данные свидетельствуют об отсутствии экстракардиальных побочных эффектов у дронедарона.
Соталол. Соталол (Соталекс, Сотагексал) таблетки 160 мг применяется в средней суточной дозе 240–320 мг. Начинают с назначения 80 мг 2 раза в день. При рефрактерных аритмиях иногда используют прием соталола до 640 мг/сут. β-адреноблокирующее действие соталола проявляется начиная с дозы 25 мг.
На фоне приема соталола имеется повышенный риск развития желудочковой тахикардии типа «пируэт». Поэтому прием соталола желательно начинать в стационаре. При назначении соталола необходимо тщательно контролировать величину интервала Q–T, особенно в первые 3 дня. Корригированный интервал Q–T не должен превышать 0,5 с. В этих случаях риск развития тахикардии типа «пируэт» менее 2%. С увеличением дозы соталола и степени удлинения интервала Q–T значительно увеличивается риск развития тахикардии типа «пируэт». Если корригированный интервал Q–T превышает 0,55 с — риск тахикардии типа «пируэт» достигает 11%. Поэтому при удлинении интервала Q–T до 0,5 с необходимо уменьшить дозу соталола или отменить препарат.
Побочные эффекты соталола соответствуют типичным побочным эффектам β-адреноблокаторов.
Этацизин. Этацизин таблетки 50 мг. Наиболее изученный отечественный препарат (создан в СССР). Для лечения аритмий применяется с 1982 г. Быстрое достижение клинического эффекта позволяет с успехом использовать Этацизин у лиц без органического поражения сердца для лечения желудочковых и наджелудочковых нарушений ритма: экстрасистолии, всех вариантов пароксизмальных и хронических тахиаритмий, в том числе мерцательной аритмии, при синдроме Вольфа–Паркинсона–Уайта. Наиболее эффективен Этацизин у пациентов с ночными аритмиями, а также при желудочковой экстрасистолии.Средняя суточная доза Этацизина составляет 150 мг (по 50 мг 3 раза в день). Максимальная суточная доза — 250 мг. При назначении этацизина для предупреждения рецидивирования мерцательной аритмии, наджелудочковых и желудочковых тахикардий его эффективность, как правило, превосходит эффективность других АПП класса I. Препарат хорошо переносится, необходимость в отмене возникает примерно у 4% больных. Основные побочные эффекты: головокружение, головная боль, «онемение» языка, нарушение фиксации взора. Обычно побочные реакции наблюдаются сравнительно редко, и их выраженность уменьшается после первой недели приема Этацизина.
Аллапинин. Отечественный препарат Аллапинин, таблетки 25 мг (создан также в СССР) применяется в клинической практике с 1986 г. Назначают по 25–50 мг 3 раза в день. Максимальная суточная доза составляет 300 мг. Аллапинин довольно эффективен при наджелудочковых и желудочковых аритмиях. Основные побочные явления — головокружение, головная боль, нарушение фиксации взора. Необходимость в отмене возникает примерно у 6% больных. Одной из особенностей аллапинина и теоретически его недостатком является наличие β-адреностимулирующего действия.
Пропафенон (Ритмонорм, Пропанорм), таблетки 150 мг, ампулы 10 мл (35 мг). Назначают по 150–300 мг 3 раза в день. При необходимости дозу увеличивают до 1200 мг/сут. Пропафенон, кроме замедления проведения, слегка удлиняет рефрактерные периоды во всех отделах сердца. Кроме того, пропафенон обладает небольшим β-адреноблокирующим действием и свойствами антагонистов кальция.
К основным побочным эффектам пропафенона относятся головокружение, нарушение фиксации взора, атаксия, тошнота, металлический вкус во рту.
Хинидин. В настоящее время в России используют в основном Кинидин Дурулес, табл. по 0,2 г. Разовая доза составляет 0,2–0,4 г, средняя суточная доза — от 0,6 до 1,0 г. Максимальная суточная доза хинидина в прежние годы (когда хинидин был основным антиаритмическим препаратом) достигала 4,0 г! В настоящее время такие дозы не используются и примерной максимальной суточной дозой хинидина можно считать 1,6 г.
В небольших дозах (600–800 мг/сут) хинидин хорошо переносится. Побочные явления возникают обычно при более высоких дозах. К наиболее частым побочным эффектам при приеме хинидина относятся нарушения функции желудочно-кишечного тракта: тошнота, рвота, понос. Реже отмечаются головная боль, головокружения, ортостатическая гипотония. Самое опасное осложнение от приема хинидина — возникновение желудочковой тахикардии типа «пируэт». По данным литературы, это осложнение наблюдается у 1–3% больных, принимающих хинидин.
П. Х. Джанашия, доктор медицинских наук, профессор С. В. Шлык, доктор медицинских наук, профессор Н. М. Шевченко, доктор медицинских наук, профессор РГМУ, Москва
Чем подобное явление грозит здоровью человека?
Компенсаторная пауза — повод для волнения, и ее появление всегда негативно влияет на насосную функцию сердца. Такое состояние может появиться после эмоционального возбуждения, большого количества выпитого кофе, злоупотребления никотином, нарушения сна.
Особую опасность представляют собой компенсаторные паузы, возникающие в результате сигналов в районе ишемических и инфарктных зон. Такие случаи, судя по статистическим данным, нередко приводят к развитию спонтанной фибрилляции желудочков, что, в свою очередь, заканчивается смертью пациента.
Компенсаторная пауза может быть свидетельством серьезных заболеваний:
- порока сердца,
- миокардита,
- ишемической болезни,
- инфаркта миокарда,
- артериальной гипертензии,
- сердечной недостаточности хронического течения.
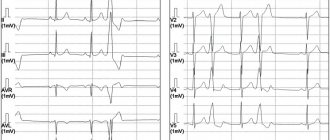
Форма
Как можно ожидать, форма желудочковых экстрасистол зависит от того, в каком отделе желудочков они возникают. Экстрасистолы из правого желудочка обычно напоминают по форме блокаду ЛНПГ, так как возбуждение левого желудочка происходит после правого. Желудочковые экстрасистолы из левого желудучка, напротив, обычно напоминают блокаду ПНПГ. Форма экстрасистол из межжелудочковой перегородки также часто сходна с блокадой ЛНПГ.
Лечение
Для того, чтобы избавиться от компенсаторных пауз, важно излечить основное заболевание, которое их спровоцировало. Для этого применяются бета-адреноблокаторы, седативные препараты и транквилизаторы, с помощью которых уменьшаются экстрасистолы. Отлично справляются с аритмией препараты, основанные на хинидине.
Кроме этого иногда необходимо прибегнуть к помощи психотерапевта.
Частота
Частоту желудочковых экстрасистол определяют за одну минуту или за другую единицу времени. Экстрасистолы могут быть как единичными (изолированные эпизоды преждевременной деполяризации), так и частыми.
Существуют различные сочетания желудочковых экстрасистол. Две экстрасистолы подряд (см. рис. 16-4) — пара, или куплет. Три и более экстрасистолы подряд — ЖТ (см. рис. 16-5). Иногда изолированные экстрасистолы возникают настолько часто (см. рис. 16-6), что за каждым нормальным синусовым комплексом следует желудочковая экстрасистола. Такие повторяющиеся группы называют желудочковой бигеминией.
Последовательность двух нормальных синусовых комплексов и желудочковой экстрасистолы — желудогковая тригеминия.
Феномен «R на T»
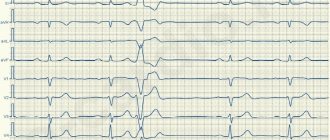
Феномен «R на T» описывает желудочковые экстрасистолы, совпадающие с вершиной зубца Т (желудочковые экстрасистолы могут также возникать в низшей точке отрицательного зубца I) предыдущего нормального комплекса (рис. 16-10, см. рис. 16-16).
Рис. 16-10. Желудочковая экстрасистола (X), близкая к вершине зубца Т предыдущего комплекса, предрасполагает к развитию ЖТ и ФЖ. Этот феномен «R на T» особенно опасен при острой ишемии или при инфаркте миокарда, а также удлинении интервала Q-T(U) (1 — запись ритма в отведении).
Такие экстрасистолы могут способствовать развитию ЖТ или ФЖ, особенно в острой стадии инфаркта или ишемии миокарда, а также при удлинении интервала Q-T. В разделе об электрической кардиоверсии сказано, что вершина зубца Г соответствует периоду, когда особенно вероятно возникновение ФЖ под действием внешнего стимула (см. гл. 15). ЖТ и ФЖ, однако, чаще не связаны с комплексом «R на T». Большинство таких комплексов не вызывает стойкой желудочковой тахиаритмии.
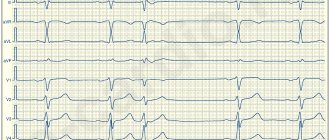
Мономорфные и полиморфные желудочковые экстрасистолы
Термины «мономорфный» и «полиморфный» описывают желудочковые экстрасистолы в любом отведении. Мономорфные желудочковые экстрасистолы имеют одинаковую морфологию в одном отведении и происходят из одного и того же анатомического участка (очага) (см. рис. 16-6). Конечно, форма экстрасистол в разных отведениях различается, как и у нормальных комплексов. Напротив, полиморфные желудочковые экстрасистолы имеют различную форму в одном и том же отведении (см. рис. 16-9).
Рис. 16-9. Полиморфные желудочковые экстрасистолы различаются по форме в одном отведении (сравните с рис. 16-6, А).
Полиморфные экстрасистолы часто, но не всегда возникают в разных участках. Мономорфные желудочковые экстрасистолы всегда монотопные, но полиморфные экстрасистолы не обязательно политопные. Мономорфные желудочковые экстрасистолы могут возникать как у здоровых лиц, так и при органических заболеваниях сердца. Частые полиморфные желудочковые экстрасистолы нередко служат проявлением органического поражения сердца.