Инфографика на конкурс «био/мол/текст»: Клинический анализ крови — самый распространенный лабораторный тест, назначаемый врачом, когда мы приходим на прием и жалуемся на плохое самочувствие. «Кровь из пальца, завтра с 8:00 до 9:30, натощак, N-ный кабинет», — такую фразу неизменно слышали несколько поколений. Однако технология исследования крови претерпела большие изменения за последние десятилетия и прошла путь от ручных методов к автоматическим. Разбираемся, как анализировали кровь вашей бабушки и почему сейчас все делается по-другому.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Клиническое значение анализа крови (фрагмент лекции проф. Е.Б.Владимирской)
Гематология:
12.03.2009
д.м.н., проф. Е.Б.ВладимирскаяНИИ детской гематологии Минздрава России
Кровь, будучи внутренней средой организма, несет в себе стигматы жизнедеятельности различных органов и систем, изучение которых имеет несомненное клиническое значение, необходимо для диагноза, прогноза течения и контроля за терапией практически всех внутренних болезней человека.
Наиболее доступным является изучение морфологического состава крови, результаты его входят в алгоритм диагностики большинства патологических процессов.
Со времен первых исследований крови под микроскопом без использования окраски (середина прошлого века) клетки крови принято было делить на красные — эритроциты (по цвету гемоглобина) и белые — лейкоциты. Лейкоциты, в свою очередь, делятся на клетки, содержащие специфическую зернистость в цитоплазме, и по отношению этой зернистости к окраске делятся на (нейтрофилы, эозинофилы и базофилы) и не содержащие — лимфоциты и моноциты. По форме ядра первые часто называют полиморфонуклеары, а вторые — мононуклеары.
В последние годы все чаще клинический анализ крови выполняется на автоматических счетчиках, что значительно повышает точность подсчета, но, однако же, не отменяет значения данных, полученных «вручную» с помощью светооптической микроскопии. Сопоставление результатов этих двух методов, вместе с используемыми референтными значениями показателей представлено в табл.1.
Таблица 1
| Автоматический подсчет | Единицы измерения | Границы нормы | Ручной подсчет |
| hgb -гемоглобин | г/литр | М: 132 — 173 Ж: 117 — 155 | Hb |
| rbc- эритроциты | 1012 /литр | М: 4,3 – 5,7 Ж: 3,8 – 5,1 | эр. |
| hct-гематокрит | % | М: 39 – 49 Ж: 35 – 45 | ht |
| mcv- средний объем эритроцита | 1 мкм3 = 1фемтолитр | 80,0 – 95,0 | Сферический индекс (3,2-3,4) |
| mch-среднее содержание гемоглобина в эритроците | пикограммы 1 гр.=1012 пикограмм | 27,0 – 31,0 | Цветовой показатель (0,85 – 1,0) Цв.пок.= Нв (г/л) х 3_____ Эр (первые три цифры) |
| mchc– средняя концентрация Нв в 1 эритроците | г/дл | 32,0 — 36,0 | |
| rdwширина распределения эритроцитов по объему | ширина гистограммы | 11,5 – 14,5 | Нет аналога |
| plt –тромбоциты | *109 /л | 150 — 400 | Тромбоциты |
| wbc- лейкоциты | *109 /л | 4,5 –11,0 | Лейкоциты |
| neu — нейтрофилы | *109 /л % | 1,8 – 5,5 47,0 – 72,0 | Нейтрофилы |
| lym – лимфоциты | *109 /л % | 1,2 – 3,0 19,0 – 37,0 | Лимфоциты |
| mon – моноциты | *109 /л % | 0,1 – 0,9 3,0 – 11,0 | Моноциты |
| eos – эозинофилы | *109 /л % | 0,02 – 0,3 0,5 – 5,0 | Эозинофилы |
| bas – базофилы | *109 /л % | 0,0 – 0,07 0,0 –1,0 | Базофилы |
Комментируя представленные в таблице данные, необходимо отметить:
- подавляющее большинство автоматических счетчиков не определяет молодые формы лейкоцитов, нормобласты и ретикулоциты — эти данные можно получить только «вручную»;
- нормативные значения никогда не выражаются одной цифрой, существует предел допустимых колебаний (он представлен в таблице для всех показателей), в который укладывается 99,9% нормы.
Проанализируем клиническое значение отдельных показателей анализа крови.
Показатели красной крови.
Анемией называется снижение гемоглобина ниже 120 г/л: легкая степень – 110-120 г/л; средняя степень – 90-110 г/л; тяжелая степень – ниже 90 г/л.
По соотношению показателей красной крови выделяют 3 вида анемии, что является отправным пунктом для дальнейшей диагностики.
Микроцитарно-гипохромные анемии:
MCV < 80 Цв.п. < 0,85
MCH < 27; MCHC < 32
- Железодефицитная анемия
- Анемия при хроническом воспалении
- Врожденная сфероцитарная гемолитическая анемия.
- Талассемия.
Нормоцитарно-нормохромные анемии:
MCV 80 – 95
MCH = 27-31; MCHC = 32-36 Цв.п. = 0,85-1,0
Острая кровопотеря.
- Анемия при хронической почечной недостаточности
- Анемия при эндокринной патологии.
- Анемия при раке.
- Гемолитические анемии, иммунные и неиммунные.
- Апластическая анемия.
- Миелодиспластический синдром.
Гиперхромно-макроцитарная анемия.
MCV > 95
MCH > 31; MCHC = 32-36 Цв.п.> 1,0
- Мегалобластная В-12 – дефицитная (пернициозная) анемия.
- Мегалобластная фолиеводефицитная анемия.
- Аутоиммунная гемолитическая анемия.
Таким образом, при выявлении снижения гемоглобина следует прежде всего определить характер анемии: нормо-, гипо- или гиперхромный.
Остановимся подробнее на железодефицитной анемии и анемии при хроническом воспалении, диагностика и лечение которых являются прерогативой врачей-терапевтов и не требуют специальных гематологических исследований.
Железодефицитная анемия (ЖДА) выявляется у 50% женщин и 40% мужчин, представляя собою одно из самых распространенных заболеваний человека. Наиболее частой причиной ЖДА является скрытая форма кровоточивости: у мужчин – из желудочно-кишечного тракта и бронхо-легочной системы, у женщин – мено-, метроррагии. Беременность – также один из факторов развития дефицита железа у женщин. Недостаточное потребление в пище мясных продуктов является другой существенной и при этом социально обусловленной причиной развития дефицита железа. У детей, рождающихся с запасом железа, получаемым от матери в последний месяц внутриутробного развития, дальнейшее поступление железа происходит только из прикорма. Таким образом, причинами развития дефицита железа у детей раннего возраста могут быть недоношенность, многоплодная беременность, позднее введение прикорма, инфекции (повышенное потребление железа микробной флорой и нарушение всасывания).
Клиническая картина ЖДА складывается из следующих клинических синдромов:
1. Анемия: слабость, сонливость, утомляемость, одышка, сердцебиение, функциональный систолический шум, плавание мушек перед глазами.
2. Сидеропенический синдром:
· сухость, ломкость, выпадение волос, ранняя седина;
· уплощение и ломкость ногтей;
· сухость кожи, гиперкератоз;
· болезненные, незаживающие трещины в углах рта, на языке, пальцах рук, ног, пятках;
· извращение вкусовых и обонятельных пристастий;
· частые инфекции;
· нарушение глотания, мышечная слабость, слабость сфинктеров (недержание мочи при смехе, кашле)
В диагностический алгоритм ЖДА, кроме подробного клинического исследования с целью выявления скрытой кровоточивости, входит обязательное определение основных показателей обмена железа. Диагноз ЖДА подтверждают следующие значения этих показателей:
- сывороточное железо ниже 12,5 мкмоль/л
- общая железосвязывающая способность (ОЖСС) выше 64,4 мкмоль/л
- ферритин сыворотки ниже 12 мкг/л.
Коррекция ЖДА проводится длительным пероральным лечением препаратами железа (6-8 недель после восстановления гемоглобина).
Необходимо проведение дифференциального диагноза между ЖДА и анемией при хроническом воспалении.
Анемия при хроническом воспалении по показателям морфологического состава крови ничем не отличается от ЖДА и также сопровождается снижением содержания сывороточного железа. Однако в основе ее развития лежит не экзогенный дефицит железа, а невозможность его утилизации. Лечение железом при такой анемии противопоказано. Дифференциальный диагноз основан на изучении показателей обмена железа и представлен в Табл.2.
Таблица 2. Дифференциальный диагноз между ЖДА и анемией при хроническом воспалении.
| Показатели | ЖДА | Анемия при хроническом воспалении |
| Сывороточное железо | Снижено | Снижено |
| ОЖСС | Повышено | Норма или снижено |
| Ферритин сыворотки | Снижен | Норма или повышен |
Подводя итог краткому анализу клинического значения морфологических показателей красной крови, следует остановиться отдельно на ретикулоцитах и нормобластах.
Морфологическим признаком, указывающим на гемолитический характер снижения гемоглобина, является рост числа ретикулоцитов. При нормальном гемоглобине число ретикулоцитов не превышает 0,5-1,5%. Ожидаемый ретикулоцитарный ответ на гемолитическую анемию при сохранном кроветворении представлен в табл.3.
Табл.3. Ожидаемый ретикулоцитарный ответ на гемолитическую анемию.
| Гематокрит, % | 45 | 40 | 35 | 30 | 25 | 20 | 15 |
| Гемоглобин, г/л | 130 | 120 | 115 | 100 | 83 | 66 | 50 |
| Ретикулоциты, % | 0,5 | 1,5 | 5 | 10 | 15 | 20 | 30 |
Динамическое наблюдение за уровнем ретикулоцитов необходимо также и для оценки ожидаемой эффективности лечения ЖДА и пернициозной анемии. Подъем ретикулоцитов закономерно наблюдается на 5-8 день лечения железом ЖДА и особенно выражен (до 60%) на 5-8 день лечения витамином В-12 пернициозной анемии. Такая реакция кроветворения на терапию этих заболеваний может рассматриваться и как подтверждение соответствующего диагноза exjuvantibus.
Нормобластоз в периферической крови бывает редко и всегда свидетельствует о серьезной патологии. Его появление закономерно наблюдается при тяжелых формах гемолитической анемии и у пациентов, перенесших спленэктомию. Обнаружение нормобластов в крови пациентов, не страдающих этой патологией, должно явиться поводом для поиска онкологической патологии.
Об эритроцитозе можно говорить при следующих показателях крови: эритроциты выше 5,7х10*12/л у мужчин и 5,2х10*12/л у женщин, гемоглобин выше 177 г/л и 172 г/л соответственно, гематокрит выше 52% и 48% соответственно.
Первичными эритроцитозами считаются редкий генетически детерминированный семейный эритроцитоз и эритремия.
Значительно чаще встречаются вторичные эритроцитозы, обусловленные повышенным образованием эритропоэтина в ответ на артериальную гипоксию или при некоторых опухолях.
Вторичные эритроцитозы могут быть разделены на следующие группы:
1. Артериальная гипоксия
- Высотная болезнь
- Хроническая легочная недостаточность
- «Синие» пороки сердца
2. Опухоли, продуцирующие эритропоэтин
- Опухоли почек, гипернефрома
- Опухоль надпочечников
- Гемангиома мозжечка
- Рак яичников
3. Локальная ишемия почек
- Киста
- Гидронефроз
- Стеноз почечной артерии
4. Вредное производство
- Кобальтовое отравление
Лечение вторичных эритроцитозов требует устранение их причины, но может быть и симптоматическим из-за угрозы тромбозов. Симптоматическое лечение эритроцитоза – кровопускание.
Показатели белой крови.
Об увеличении или уменьшении количества различных видов лейкоцитов периферической крови можно судить только по изменению абсолютного числа этих форменных элементов.
Нейтрофилезом называется увеличение числа нейтрофилов более 6х10*9/л.
Реже нейтрофилез бывает проявлением хронического миелолейкоза, сопровождается специфическими для него клиническими и гематологическими особенностями (увеличение селезенки, лимфоузлов, омоложение крови, анемия, гипертромбоцитоз, гиперплазия костного мозга, наличие Рh-хромосомы и химерного гена c-abl-bcr).
Гораздо чаще нейтрофилез является реакцией крови на воспаление, результатом воздействия бактериального эндотоксина и выброса тканями цитокинов воспаления и хемокинов. Нейтрофильный лейкоцитоз может сопровождать любое воспаление, бактериальные, грибковые и паразитарные инфекции, некротические изменения тканей, гипоксемию, интоксикацию и опухоли различной локализации. При длительном воздействии факторов, индуцирующих нейтрофилез, происходит истощение костномозгового гранулоцитарного резерва и в кровь начинают выходить молодые клетки нейтрофильного ряда (палочкоядерные, метамиелоциты и миелоциты). Такое состояние крови носит название лейкемоидной реакции нейтрофильного ряда. Иногда возникает необходимость проведение дифференциального диагноза между такой реакцией и начальной формой хронического миелолейкоза. Отсутствие анемии, гипертромбоцитоза и высокое содержание щелочной фосфатазы в нейтрофилах характерно для лейкемоидной реакции.
Нейтропения – снижение числа нейтрофилов менее 1,8 х 10*9/л.
Агранулоцитоз — снижение числа нейтрофилов менее 0,5 х 10*9/л.
Нейтропении могут быть первичными (врожденными и приобретенными), связанными с болезнями крови (острый лейкоз, аплазия кроветворения, циклическая нейтропения), и вторичными, сопровождающими заболевания, в процессе которых происходит разрушение и повышенное потребление нейтрофилов.
Ко вторичным, реактивным, нейтропениям относятся иммунные и нейтропении при тяжелых инфекциях. Нейтропения при сепсисе сопровождается обычно омоложением лейкоцитарной формулы и является плохим прогностическим симптомом, свидетельствующим об истощении кроветворения.
Необходимо остановиться на конституциональных, так называемых, безвредных нейтропениях. Около 4% людей имеют нормальный состав крови с пониженным содержанием нейтрофилов. Эта особенность, связана с генетически детерминированым быстрым перемещением нейтрофилов в ткани, где они и осуществляют присущие им защитные функции. Люди с таким составом крови обычно меньше подвержены интеркурентным инфекциям, быстрее выздоравливают от них. Однако нередко такие пациенты, к сожалению, являются предметом пристального внимания врачей, подвергаются множеству ненужных инвазивных исследований, у них развивается ятрогенная патология. Таким образом, нейтропения, не сопровождающаяся другими изменениями крови и какими–либо клиническими симптомами, не требует немедленного вмешательства. Такие пациенты нуждаются в динамическом наблюдении.
Отдельно хочется коснуться перераспределительных нейтрофилезов и нейтропений. Циркуляция нейтрофилов имеет свои особенности: половина клеток циркулирует с кровью (эти клетки и подлежат подсчету), в то время, как другая половина находится в «краевом стоянии» у стенок сосудов. Раздражение симпатической системы, спазм сосудов увеличивают число циркулирующих клеток, а раздражение парасимпатической системы, напротив, уменьшает их число. Отсюда стрессовые состояния способствуют преходящему нейтрофилезу (например, нейтрофилез у маленьких детей при крике), а ваготония – нейтропении.
Эозинофилия – увеличение числа эозинофилов выше 0,4 х 10*9/л.
Повышенный выброс эозинофилов в кровь происходит под действием ИЛ-4 и ИЛ-5, образующихся в повышенном количестве в процессе иммунологического повреждения тканей. В последнее время доказан киллерный эффект эозинофилов при некоторых гельминтозах и паразитарных инфекциях. Эозинофилия – характерная черта коллагенозов, аллергии, многих глистных и паразитарных инвазий, иммунодефицита, особенно гипер – IG-E- синдрома, и некоторых опухолей.
Моноцитоз – число моноцитов выше 0,8 х 10*9/л.
Заболевания часто, но не всегда ассоциирующиеся с моноцитозом включают в себя:
- Инфекции (особенно туберкулез, эндокардит, сифилис).
- Лихорадка неясного происхождения
- Различные формы неоплазий и миелопролиферативных болезней.
- Хронические воспаления (особенно холецистит и ревматоидный полиартрит)
- Состояние после спленэктомии.
Лимфоцитоз – увеличение числа лимфоцитов более 4,0 х 10*9/л
Среди злокачественных лимфопролиферативных заболеваний с высоким лимфоцитозом чаще всего встречается хронический лимфолейкоз, заболевание людей старше 45-летнего возраста. Отличительной особенностью этого лимфоцитоза является его моноклоновый характер и В-клеточное происхождение.
Вторичные, реактивные лимфоцитозы, носящие поликлоновый характер, сопровождают многие вирусные инфекции, некоторые воспалительные и иммунокомплексные болезни. К ним относятся:
1. Лимфотропные вирусные заболевания:
— инфекционный мононуклеоз (атипичные мононуклеары, характерная клиника);
— инфекционный лимфоцитоз (бессимптомная эпидемическая форма у маленьких детей — до 20-30 тыс.)
2. Цитомегаловирусная инфекция (атипичные мононуклеары, характерная клиника).
3. Детские инфекции: коклюш, ветрянка, продрома скарлатины.
4. Другие вирусные инфекции: краснуха, гепатит, некоторые респираторные аденовирусные инфекции в стадии реконвалесценции.
5. Воспалительные и иммунокомплексные болезни: тиреотоксикоз, язвенный колит, болезнь Крона, васкулиты.
Лимфоцитопения — снижение числа лимфоцитов ниже 1,2 х 10*9/л.
Наблюдается относительно редко, чаще всего при кортикостероидной терапии. Может также сопровождать СПИД, лимфогрануломатоз и различные хронические инфекции (например, туберкулез, диссеминированную красную волчанку, саркоидоз).
Гипертромбоцитозом считается увеличение числа тромбоцитов более 400,0 х 10*9/л.
Первичные гипертромбоцитозы сопровождают миелопролиферативные заболевания и являются следствием опухолевой трансформации мегакариоцитарного ростка костного мозга.
Вторичные реактивные гипертромбоцитозы наблюдаются:
- После оперативных вмешательств ( около 2-х недель).
- После спленэктомии (до 1 года).
- При злокачественных опухолях
- При острой постгеморрагической и гемолитической анемиях.
- При некоторых воспалениях (туберкулез, острый ревматизм, язвенный колит, остеомиелит).
Тромбоцитопения — снижение числа тромбоцитов ниже 100,0 х 10*9/л чаще всего бывает при опухолевых заболеваниях крови, апластической анемии и иммунной тромбоцитопенической пурпуре. Тромбоцитопения входит обязательной составляющей в синдром гиперспленизма при спленомегалии. Следует иметь в виду, что серьезная угроза кровоточивости возникает при снижении числа тромбоцитов ниже 20,0 х 10*9/л.
Реактивная тромбоцитопения бывает редко, может сопровождать любую иммунную патологию и диссеминированное внутрисосудистое свертывание.
СОЭ — скорость оседания эритроцитов представляет собою неспецифическую реакцию. В норме она составляет у мужчин до 50 лет — 2-15 мм в час, а у женщин до 50 лет — 2-20 мм в час. После 50 лет у мужчин до 20 мм в час, а у женщин — до 30 мм в час.
Быстрота агрегации эритроцитов зависит от их числа (при уменьшении их количества — ускоряется) и количества крупнодисперсных белков (белки воспаления, фибриноген, антитела, гамма-глобулин и др.), адсорбированных на эритроцитах и ускоряющих их оседание. Исходя из этого, понятен широкий спектр патологии, при которой может быть выявлено ускорение СОЭ.
Таким образом, анализ морфологического состава крови имеет огромное клиническое значение, а иногда является ведущим признаком в диагностике и выборе терапии многих болезней человека.
Однако следует помнить, что важнейшим звеном в таком анализе является интегральная оценка всех показателей крови и обязательное соотнесение имеющихся в крови изменений с анамнезом и клиническими проявлениями болезни.
Литература:
1. Руководство по гематологии под ред. А.И. Воробьева, Москва, 1985 г.
2. Hematology, ed. by W.S.Beck, London, 1991
3. Manual of Clinical Hematology, ed.by J.Mazza, N.Y.,1995
Теги: Лаборатория, Кровь
« Назад к списку статей Поделиться в
Что будем исследовать?
Кровь — жидкая соединительная ткань организма, состоящая из плазмы и трех типов форменных элементов: эритроцитов, тромбоцитов и лейкоцитов. Лейкоциты, в свою очередь, бывают с гранулами в цитоплазме — это нейтрофилы, эозинофилы и базофилы, — и без гранул — лимфоциты и моноциты. Для того чтобы отличить патологию от нормы, нужно знать, какова концентрация клеток крови, как они выглядят и какую функцию выполняют. Пришло время вспомнить, с кем мы имеем дело.
Рисунок 1. Форменные элементы крови [1–3]
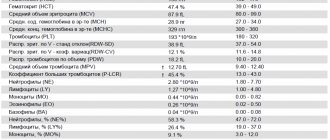
Рисунок 2. На рисунке представлены: концентрации форменных элементов крови в норме; лейкоцитарная формула — процентное соотношение разных видов лейкоцитов в крови; скорость оседания эритроцитов; концентрация гемоглобина; гематокрит в норме [4].
Итак, специалисты анализируют относительное и абсолютное содержание клеток, их морфологические характеристики, распределение по объему крови и многие другие параметры. Эти показатели могут рассказать, способны ли клетки в полной мере выполнять свои функции, а если нет, то указать на причину их «неработоспособности» и послужить основой для постановки диагноза.
Рисунок 3. Исследование крови: тогда и сейчас
Как выглядит кровь под микроскопом
Существует несколько видов кровяных клеток, перед которыми поставлены различные задачи. Одни из них функционируют только внутри кровеносной системы, другие – выходят за ее пределы. Объединяет их только то, что все они образуются в костном мозге из стволовых клеток. Процесс их формирования непрерывен, а срок жизни ограничен. Лейкоциты, тромбоциты и эритроциты – 3 форменных элемента, содержащихся в биологической жидкости. Их количество зависит от возраста человека и состояния организма в данный момент.
Эритроциты
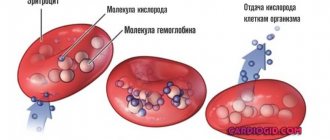
Красные кровяные тельца “забирают” кислород из легких и доставляют его ко всем органам и тканям. На обратном пути транспортируют углекислый газ к органу воздушного дыхания. Эти клетки имеют в своем составе уникальный белок – гемоглобин, состоящий из двухвалентного атома железа. Именно им обусловлен красный пигмент эритроцитов.
Каждую секунду погибает около 2-3 млн. данных телец, однако такое же их число каждую секунду и производится. Живут они приблизительно 4 месяца. В 1 куб. мл крови насчитывается около 25 млн. эритроцитов. Их общее число составляет 25 млрд. Всего лишь в одной капле крови наблюдается около 250 млн. эритроцитов.
Эритроцит под микроскопом дисковидно-вогнутой формы, диаметр которого в среднем составляет около 7-7,5 мкм, а толщина по краям – 2,5 мкм. Такая форма способствует “гладкому” прохождению красным кровяным тельцам по мелким сосудам. Со временем эритроциты утрачивают такое свойство, из-за чего задерживаются в мелких сосудах селезенки и печени. В этих органах они разрушаются.
До 80% эритроцитов имеют сферическую двояковогнутую форму. Остальные 20% могут быть овальной, серповидной, сферической (простой), чашеобразной и других форм. Изменение внешнего вида чаще обусловлено патологией (авитаминоз, анемия и т.п.).
Лейкоциты
Это белые кровяные тельца, на которых возложена защитная функция. Их принято делить на гранулоциты и агранулоцит. К первой группе относятся зернистые клетки:
- Нейтрофилы. Самая многочисленная группа лейкоцитов – до 70% от общего числа белых клеток. Основная задача – захват болезнетворных микробов. Ядерная клетка имеет округлую форму, диаметр которой может достигать 10 мкм. Ядро может иметь вид палочки или состоять из нескольких сегментов, соединенных между собой. Если количество сегментов более 8, то это указывает на развитие заболевания.
- Базофилы. Немногочисленная группа, которая представлена не более 1% от всего количества лейкоцитов. Основная задача – поддержание работы иммунной системы. Имеют округлую форму и сегментированное или палочкообразное ядро. Их диаметр достигает 7-11 мкм.
- Эозинофилы. На общее число белых кровяных клеток приходится 2-5% эозинофилов. Их гранулы окрашиваются кислым красителем – эозином. У них округлая форма и слабо окрашенное ядро, состоящее из 2-3 сегментов одинаковой величины. В диаметре эозинофилы достигают 10-11 мкм. Их цитоплазма имеет бледно-голубой цвет.
В 1 куб. мл крови наблюдается 5-10 тыс. лейкоцитов. Средний размер белых кровяных телец равняется 15 мкм. Общее их число в человеческом организме достигает суммы в 35 млрд.
Вторая группа состоит из клеток без гранул в цитоплазме:
- Лимфоциты. Ведущий компонент иммунной системы. Зная, что такое лимфоциты в анализе крови, врачи определяют иммунный статус пациента и получают информацию о наличии в организме инфекции и других заболеваний. Это круглые клетки с большим ядром, занимающим большую часть цитоплазмы. Их диаметр составляет от 7 до 10 мкм. Ядро бывает круглым, овальным или бобовидным, имеет грубую структуру. Состоит их комков оксихроматина и базироматина, напоминающих глыбы.
- Моноциты. Самые крупные из лейкоцитов, отвечающие за неспецифическую защиту организма. Их количество от 2 до 9% от всех белых кровяных клеток. Диаметр доходит до 20 мкм. Ядро крупное, занимает почти всю цитоплазму, может быть круглым, бобовидным, иметь форму гриба, бабочки.
Интересно! Если расставить лейкоциты в один ряд, можно получить расстояние в 525 км.
Лейкограмма, или лейкоцитарная формула, – соотношение в процентах различных видов лейкоцитов, определяемое при подсчёте их в окрашенном мазке крови под микроскопом. Расшифровка лейкоцитарной формулы дает несомненную пользу при диагностическом поиске, однако не всегда может в полной мере удовлетворить интерес врача в отношении какой-то хорошо маскирующейся болезни. Например, чем более выражен воспалительный процесс бактериальной этиологии, тем больше нейтрофилов в лейкоцитарной формуле. Наличие нейтрофилов разной степени зрелости говорит о тяжести бактериальной инфекции. Чем острее процесс, тем больше в крови палочкоядерных нейтрофилов.
Тромбоциты
Под тромбоцитами “скрываются” кровяные пластинки, которые регулируют процесс свертывания крови. Они выделяют фермент тромбопластин. При порезе или уколе оболочка тромбоцитов разрушается, тромбопластин высвобождается и поступает в плазму, и кровь сворачивается. Образуется тромб, который и защищает организм от кровопотери.
В 1 куб. мл крови их должно быть около 200-300 тыс. Размер каждого тромбоцита достигает около 3 мкр. Поэтому подробно рассмотреть их можно только в профессиональный микроскоп. Получается, что общее количество данных красных пластинок в крови человека составляет примерно 1250 млрд.
Вперед, в прошлое!
1965 год, 8 утра, в местной поликлинике очередь на анализы. Ваша бабушка сдала кровь, и лаборант относит ряд пробирок на исследование. Проследуем за ним в лабораторию и посмотрим, что там и как. В лаборатории мы видим врачей, склонившихся над микроскопами или работающих с пробирками. Без преувеличения можно сказать, что в молодости вашей бабушки глаз специалиста и микроскоп были основными инструментами для анализа крови. Определяют следующие основные характеристики крови: концентрация каждого типа форменных элементов, количество различных видов лейкоцитов, скорость оседания эритроцитов и концентрация гемоглобина. Помимо этого, специалист рассчитывает гематокрит — отношение объема эритроцитов к общему объему крови [5].
По порядку рас-счи-тайсь!
Первым делом производится подсчет клеток и определяется их концентрация в крови. Подсчет эритроцитов, лейкоцитов и тромбоцитов проводят в камере Горяева, названной в честь своего изобретателя. Камера Горяева — стекло с углублением и нанесенной сеткой, куда помещается разведенная в физрастворе капля крови. Для определения количества форменных элементов камеру помещают под микроскоп и считают клетки, находящиеся в больших и маленьких квадратах сетки. Для каждого типа клеток существуют свои правила подсчета и формула, по которой вычисляется их исходная концентрация с учетом разведения крови и количества квадратов сетки [6]. Изменение количества форменных элементов служит важным критерием для диагностики анемии, воспалительных и вирусных заболеваний, нарушений свертывающей системы крови и других патологических состояний [7].
Ты кто такой?
Другой этап исследования крови — дифференцировка лейкоцитов на популяции. Ей уделяется особое внимание: изменение концентрации определенного типа клеток говорит о конкретной патологии. Бактериальная инфекция, вирусы или аллергия? Лейкоциты подскажут, какой поставить диагноз и какое назначить лечение. Различение лейкоцитов доверяют только высококвалифицированному специалисту. Для начала мазок крови фиксируют в спирте и окрашивают по методу Романовского—Гимзы. Состав красителя подобран таким образом, что различные структуры клеток окрашиваются в разные цвета. Окраска зависит от способности компонентов красящей смеси связываться со структурами, содержащими кислоты или основания. Например, гемоглобин и гранулы эозинофилов приобретают красно-розовую окраску за счет эозина, а ядра форменных элементов и базофильные гранулы (имеющие сродство к основаниям) окрашиваются метиленовым синим и азуром в синий цвет [1]. Когда мазок готов, специалист в микроскоп исследует его и по внешнему виду определяет, к какому типу принадлежат разные клетки [8]. Наличие окрашенных гранул, особенности формы ядра, размер клетки — все параметры нужно держать в голове для безошибочной классификации. Обычно подсчитывали сто лейкоцитов с последующим вычислением процентного содержания, а для того чтобы не запутаться, использовали 11-клавишный счетчик [9]. Увидел в микроскоп клетку — нажми на клавишу с обозначением клетки данного типа, и в конце подсчета количество лейкоцитов каждого вида отобразится на экране счетчика [10].
Выпали в осадок
Еще одна характеристика, имеющая клиническое значение — скорость оседания эритроцитов (СОЭ). Это показатель, оценивающий скорость разделения крови на плазму и форменные элементы. В чем причина такого разделения? Макромолекулы, находящиеся в плазме крови, могут связывать одновременно два эритроцита друг с другом, в результате чего образуются «монетные столбики» [11]. Такие комплексы под действием силы тяжести оседают на дно пробирки, оставляя над собой слой прозрачной плазмы — это называется седиментацией эритроцитов. Увеличение скорости оседания эритроцитов указывает на патологические процессы, происходящие в организме, такие как воспалительные, инфекционные или онкологические заболевания [12].
Для определения СОЭ мировое признание получил метод Вестергрена, однако в России также был распространен метод Панченкова. Принцип работы методов одинаков, различаются только типы используемых пробирок. Кровь смешивают с антикоагулянтом — цитратом натрия — и помещают в капилляр — тонкую стеклянную трубочку. Эритроциты оседают на дно пробирки в течение часа, а затем измеряется высота столбика плазмы, образовавшегося сверху [13]. Таким образом получают скорость оседания эритроцитов, выраженную в мм/ч.
На вкус и цвет
Гемоглобин — красный пигмент эритроцитов, связывающий и переносящий кислород и углекислый газ. Снижение содержания гемоглобина в эритроцитах — причина анемий, сопутствующих целому ряду болезней. Концентрацию гемоглобина определяют визуально с помощью гемометра Сали. Прибор выглядит так: по центру — пробирка для анализируемой крови, а по бокам — окрашенные эталонные пробирки. В изучаемую кровь лаборант добавляет соляную кислоту — гемоглобин превращается в гемин бурого цвета. Затем кровь разводят дистиллированной водой, пока ее цвет (по субъективному мнению лаборанта!) не совпадет с цветом эталона. Уровень жидкости, получившийся в центральной пробирке, соответствует концентрации гемоглобина [14].
Как вы уже догадались, 50 лет назад при исследовании крови совершить ошибку было очень просто. Неверное определение вида лейкоцита или сбой при подсчете форменных элементов — все это приводило к неточным результатам анализа. Что было сделано для предотвращения ошибок? Вернемся в наше время и узнаем, как изучают кровь сегодня.
Объективно о псевдонаучном. Темные поля крови: Диагностика
4118 24 Апреля
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Темные поля крови: Диагностика / Автор: Алексей Водовозов Источник: / Январь 2010
Кровь – удивительное творение природы. Можно без преувеличения сказать, что она является источником жизни. Ведь именно через кровь мы получаем кислород и питательные вещества, именно с кровью уносятся из клеток «отходы производства». Любой недуг обязательно находит свое отражение в крови. На этом построен целый ряд диагностических методик. И шарлатанских тоже.
Кровь была одной из первых жидкостей, которую любознательные медики поместили под только что изобретенный микроскоп. С тех пор прошло более 300 лет, микроскопы стали намного совершеннее, но глаза врачей по-прежнему смотрят на кровь в окуляры, выискивая признаки патологии.
На стекле
Антони ван Левенгук определенно получил бы несколько Нобелевских премий, живи он в наше время. Но в конце XVII века этой награды не было, поэтому Левенгук довольствуется всемирной известностью конструктора микроскопов и славой основателя научной микроскопии. Добившись в своих приборах 300-кратного увеличения, он сделал множество открытий, в том числе первым описал эритроциты.
Последователи Левенгука довели его детище до совершенства. Современные оптические микроскопы способны давать увеличение до 2000 раз и позволяют рассматривать прозрачные биологические объекты, включая клетки нашего организма.
Другой нидерландец – физик Фриц Цернике – в 1930-х годах заметил, что ускорение прохождения света по прямой делает изображение изучаемой модели более детальным, выделяя отдельные элементы на светлом фоне. Для создания интерференции в образце Цернике придумал систему колец, которые располагались как в объективе, так и в конденсаторе микроскопа. Если правильно настроить (юстировать) микроскоп, то волны, которые идут от источника света, будут попадать в глаз с определенным смещением по фазе. И это позволяет значительно улучшить изображение изучаемого объекта.
Метод получил название фазово-контрастной микроскопии иоказался настолько прогрессивным иперспективным для науки, что в 1953 году Цернике была присуждена Нобелевская премия по физике сформулировкой «За обоснование фазово-контрастного метода, особенно за изобретение фазово-контрастного микроскопа». Почему это открытие так высоко оценили? Раньше, чтобы рассмотреть под микроскопом ткани имикроорганизмы, их приходилось обрабатывать различными реактивами– фиксаторами и красителями. Живые клетки при таком раскладе увидеть не получалось, химикаты просто убивали их. Изобретение Цернике открыло в науке новое направление – прижизненное микроскопирование.
В XXI веке биологические и медицинские микроскопы стали цифровыми, способными работать в разных режимах – как в фазовом контрасте, так и в темном поле (изображение формируется светом, дифрагированным на объекте, и в результате объект выглядит очень светлым на темном фоне), а также в поляризованном свете, который нередко позволяет выявлять структуру объектов, лежащую за пределами обычного оптического разрешения.
Казалось бы, медикам нужно радоваться: в их руки попал мощнейший инструмент изучения тайн и загадок человеческого организма. Но этот высокотехнологичный метод очень заинтересовал не только серьезных ученых, но и шарлатанов и мошенников от медицины, которые посчитали фазово-контрастное и темнопольное микроскопирование очень удачным способом выуживания энных сумм денег у доверчивых граждан.
Она живая и шевелится
У пациента, который решится пройти обследование методом «Диагностика по живой капле крови» (варианты названия – «Тестирование на темнопольном микроскопе» или «Гемосканирование»), берут каплю крови, не окрашивают, не фиксируют, наносят на предметное стекло и изучают, просматривая образец на экране монитора. По результатам исследования ставятся диагнозы и назначается лечение.
Гемосканирование можно считать венцом творения мошеннической мысли, шедевром и высшим пилотажем околомедицинского шарлатанства. Во-первых, используется реально существующее физическое явление (про Нобелевку помните?) и самая настоящая сложная медицинская аппаратура. И действительно дорогостоящая. Стоимость диагностического комплекса обходится не менее чем в 3–4 тысячи долларов, и продают его солидные поставщики серьезной медицинской техники. Аппаратура имеет все необходимые – подлинные и совершенно заслуженные – сертификаты и свидетельства. Во-вторых, никаких проблем с лицензированием. Лабораторная диагностика – вполне законный вид медицинской деятельности, а микроскоп, позволяющий осуществлять фазово-контрастное или темнопольное микроскопирование,– вполне законная медицинская диагностическая аппаратура. Мало того, она широко применяется в медицине, то есть существуют сертифицированные и дипломированные специалисты. В-третьих, действительно под микроскопом можно обнаружить массу признаков тех или иных заболеваний. Например, изменение формы эритроцитов при серповидноклеточной анемии. А еще можно увидеть внутриклеточных паразитов все в тех же эритроцитах, бартонеллами называются. И даже яйца гельминтов в крови теоретически обнаружить можно.
Арба вижу – арба пою
Так в чем же подвох? В интерпретации. В том, как объясняют «темнопольщики» те или иные изменения вкрови, как называют обнаруженные артефакты, какие диагнозы ставят ичем лечат. Разобраться в том, что это обман, сложно даже врачу. Нужна специальная подготовка, опыт работы с образцами крови, сотни просмотренных «стекол» – как крашеных, так и «живых». Как в обычном поле, такивтемном. К счастью, у автора статьи такой опыт имеется, как имеется он иутех экспертов, с которыми сверялись результаты расследования.
Правильно говорится – лучше один раз увидеть. И своим глазам человек поверит куда быстрее, чем всем устным увещеваниям. На это и рассчитывают «лаборанты». К микроскопу подсоединен монитор, который отображает все, что видно в мазке. Вот вы лично когда последний раз видели собственные эритроциты? Вот то-то и оно. Интересно ведь. А пока завороженный посетитель любуется клетками родной любимой крови, «лаборант» начинает интерпретировать то, что он видит. Причем делает это по принципу акына: «Арба вижу– арба пою». Про какую «арбу» могут напеть шарлатаны, подробно читайте во врезке.
После того как пациент будет напуган и сбит с толку непонятными, аиногда и откровенно страшными картинками, ему объявляют «диагнозы». Чаще всего много, и один кошмарнее другого. Например, расскажут, что плазма крови инфицирована грибками или бактериями. Неважно, что увидеть их даже при таком увеличении достаточно проблематично, а уж отличить друг от друга– тем более. Микробиологам приходится сеять возбудителей различных болезней на специальные питательные среды, чтобы потом можно было точно сказать, кто вырос, к каким антибиотикам чувствителен и т.д. Микроскопия в лабораторных исследованиях применяется, но либо со специфичными красителями, либо вообще с флуоресцирующими антителами, которые прикрепляются к бактериям и таким образом делают их видимыми.
Но даже если, чисто теоретически, в крови под микроскопом будет обнаружен такой гигант мира бактерий, как кишечная палочка (1–3 мкм длиной и 0,5–0,8 мкм шириной), это будет означать только одно: у пациента сепсис, заражение крови. И он должен лежать горизонтально с температурой под 40 и прочими признаками тяжелейшего состояния. Потому что внорме кровь стерильна. Это одна из основных биологических констант, которая проверяется достаточно просто– посевом крови на различные питательные среды.
А еще могут рассказать, что кровь «закислена». Смещение рН (кислотности) крови, называемое ацидозом, действительно встречается при многих заболеваниях. Вот только измерять кислотность на глаз пока никто не научился, нужен контакт датчика сисследуемой жидкостью. Могут обнаружить «шлаки» и рассказать про степени зашлакованности организма по данным ВОЗ (Всемирная организация здравоохранения). Но если поискать по документам на официальном сайте этой организации, то ни про шлаки, ни про степени зашлакованности там ни слова нет. Среди диагнозов могут встречаться синдром обезвоживания, синдром интоксикации, признаки ферментопатии, признаки дисбактериоза и масса других, не имеющих отношения либо к медицине, либо кданному конкретному больному.
Апофеоз диагностики, конечно же, назначение лечения. Оно, по странному стечению обстоятельств, будет проводиться биологически активными добавками к пище. Которые по сути ипо закону лекарствами не являются и лечить не могут в принципе. Тем более такие страшные болезни, как грибковый сепсис. Но гемосканеров это не смущает. Ведь лечить они будут не человека, а те самые диагнозы, которые ему наставлены с потолка. Ипри повторной диагностике – будьте уверены – показатели улучшатся.
Что нельзя увидеть в микроскоп
Что бы вам ни говорили «специалисты», с помощью микроскопа в капле крови, взятой из пальца, нельзя увидеть pH крови; дефицит ферментов для расщепления белков; уровень водно-солевого обмена; пищевые мутагенные/тератогенные токсины; поражение эритроцитов почечными токсинами / свободными радикалами; паразитов, грибы, бактерии, яйца глистов, цисты; активность, количество и качество иммунных клеток.
Тестирование по «живой капле крови» зародилось в США в 1970-х годах. Постепенно медицинской общественности и регулирующим органам стала ясна истинная сущность и ценность методики. С 2005 года началась кампания по запрету этой диагностики как мошеннической и не имеющей отношения к медицине. «Пациента обманывают трижды. Первый раз– когда диагностируют болезнь, которой нет. Второй раз– когда назначают долгое и дорогостоящее лечение. И третий раз– когда подделывают повторное исследование, которое обязательно будет свидетельствовать либо об улучшении, либо о возврате к норме» (доктор Стивен Баррет, вице-президент Американского национального совета против медицинского мошенничества, научный консультант Американского совета по науке и здоровью).
Взятки гладки?
Доказать, что вас обманули, практически нереально. Во-первых, как уже говорилось, не всякий врач сможет заподозрить в методике подлог. Во-вторых, даже если пациент пойдет в обычный диагностический центр и у него там ничего не найдут, можно в крайнем случае свалить все на врача-оператора, проводившего диагностику. И действительно, визуальная оценка сложных изображений целиком и полностью зависит от квалификации и даже физического состояния того, что проводит оценку. То есть метод не является достоверным, поскольку напрямую зависит от человеческого фактора. В-третьих, всегда можно сослаться на некие тонкие материи, которые пациенту понять не дано. Это последний рубеж, на котором обычно насмерть стоят все околомедицинские мошенники.
Что же мы имеем в сухом остатке? Непрофессиональных лаборантов, которые выдают случайные артефакты (аможет, и срежиссированные) вкапле крови за страшные заболевания. Ипотом предлагают лечить их пищевыми добавками. Естественно, все это за деньги, и очень немаленькие.
Имеет ли данная методика диагностическую ценность? Имеет. Безусловно. Такую же, как и традиционная микроскопия мазка. Можно увидеть, например, серповидноклеточную анемию. Или перницитозную анемию. Или другие действительно серьезные заболевания. Только вот, к огромному сожалению мошенников, встречаются они редко. Да и не продашь таким пациентам толченый мел с аскорбинкой. Им нужно настоящее лечение.
А так – все очень просто. Обнаруживаем несуществующую болезнь, а потом успешно ее излечиваем. Все довольны, особенно доволен вон тот гражданин, у которого из крови изгнали обломок антенны космической связи комара-звонца… И никому не жалко пущенных на ветер, а точнее, на обогащение мошенников, денег.
Впрочем, не всем. Некоторые отстаивают свои права во всех возможных инстанциях. В распоряжении автора есть копия письма Управления Росздравнадзора по Краснодарскому краю, куда обратились пострадавшие от гемосканирующих «врачей». Пациенту была диагностирована куча болезней, которые предлагалось лечить не меньшей кучей биологически активных добавок к пище. По результатам проверки выяснилось, что медицинское учреждение, проводившее диагностику, нарушает лицензионные требования, не заключает договор на оказание платных услуг (врач берет деньги наличными), нарушаются правила ведения медицинской документации. Были выявлены и другие нарушения.
Цитатой из письма Центрального аппарата Росздравнадзора и хотелось бы закончить статью: «Методика ‘Гемосканирование’ на рассмотрение иполучение разрешения на применение в качестве новой медицинской технологии в Росздравнадзор не представлялась и не разрешена кприменению в медицинской практике». Яснее не скажешь.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Времена меняются
Изменения видны уже на этапе забора крови: если раньше врач собирал кровь в несколько пробирок с реагентами, стеклянный капилляр и делал на стекле мазок, то сейчас используются совсем небольшие объемы — от 12 до 150 мкл [15] крови достаточно, чтобы исследовать ее по всем параметрам.
Заглянем в современную гематологическую лабораторию. Ого! Все заставлено оборудованием, и лаборанта что-то не видно… Может, отошел приготовить себе кофе? Не успеет! Анализ крови будет готов за минуту, и прибор выдаст результат в виде бумажной ленты с числами и аббревиатурами, за которыми скрываются всевозможные параметры.
Современные гемоанализаторы подразделяются на несколько классов, в зависимости от того, что они умеют делать. Каждый последующий класс — новая ступень эволюции — быстрее, точнее, совершеннее. Использование комбинации технологий творит чудеса: если первые анализаторы могли определять восемь параметров крови и не различали виды лейкоцитов [16], то новейшие приборы способны дифференцировать до семи популяций лейкоцитов [17] и в общей сложности исследовать более 40 характеристик крови.
Как сказал Артур Кларк: «Любая достаточно развитая технология неотличима от магии». И действительно, подробнейший результат за столь короткий срок не может не удивлять. Но вся магия основана на физических законах. И хотя такие названия, как электрический импеданс, светорассеяние и фотометрия на первый взгляд немного пугают, сейчас мы разберемся, какие принципы лежат в основе каждой технологии анализа.
Перепись населения
В середине прошлого века Уоллес Культер совершил революцию, запатентовав технологию автоматического подсчета клеток. Его именем назван один из лидеров в сфере производства гематологических анализаторов — компания Beckman Coulter [18]. Апертурно-импедансный метод (или метод Культера) основан на регистрации и анализе импульсов, возникающих при прохождении клетки через апертуру из одной емкости в другую, в каждой из которых находится электрод. Когда клетки в отверстии нет, через электролит между электродами свободно протекает ток под действием электрического поля. Чтобы направить клетки к апертуре, используют насос, откачивающий жидкость из одной емкости, в нее и устремляются форменные элементы. Проходя через апертуру, клетка вытесняет из одной емкости в другую объем электролита, равный своему объему. При этом возникает импульсное изменение сопротивление (импеданса) — мембрана клеток создает препятствие для свободного протекания тока. Одновременно меняется и сила тока, которую регистрирует счетчик. Число возникших импульсов соответствует количеству форменных элементов, а высота импульса пропорциональна объему клетки [19]. Используя информацию о количестве и объеме форменных элементов, прибор может рассчитать гематокрит, среднюю концентрацию гемоглобина в эритроците, ширину распределения клеток по объему и многие другие параметры [15].
Разделяй и властвуй
Дифференцировку лейкоцитов на популяции можно провести с помощью счетчика Культера, однако возникает проблема — различные виды лейкоцитов близки по объему и схожая амплитуда импульсов не всегда позволяет точно установить тип клетки. Как быть? Для решения этой загвоздки подбирают сочетания реагентов, которые изменяют размеры клеток в разной степени так, что становится возможным их разделить [15].
Но наиболее распространенный способ дифференцировки — проточная цитофлуометрия [20]. Метод работает следующим образом: клетки, находящиеся в потоке, поочередно облучаются лазером, а возникающие при этом сигналы светорассеяния и флуоресценции регистрируются детекторами и анализируются. Для того чтобы правильно определить принадлежность к популяции, исследуют сразу несколько параметров. Так, рассеяние света под малым углом дает информацию об относительном размере клеток, а рассеяние света под прямым углом позволяет «заглянуть» внутрь клетки и изучить ее внутреннюю структуру — наличие гранул и форму ядра. Еще один параметр — флуоресценция — способен рассказать о количестве антигенов и их виде на поверхности клеток — такое точно не определить на глаз. В отличие от ручных методов дифференцировки, анализируются не 100–200 клеток, а десятки тысяч в секунду! И к каждому лейкоциту индивидуальный подход: гидродинамическая фокусировка способствует тому, чтобы клетки выстраивались в ряд и облучались в проточной ячейке поодиночке. Результат подсчета появляется на экране в виде диаграмм рассеивания, где клетки со схожими свойствами формируют кластеры.
Выпали в осадок: 2.0
Современные приборы умеют измерять СОЭ двумя принципиально различными способами. Первый — модифицированный метод Вестергрена. Принцип работы не изменился со времен вашей бабушки, но за счет автоматизации стал более быстрым и точным. Второй — измерение кинетики агрегации эритроцитов оптическим методом [21]. Происходит это так: в кровь добавляется антикоагулянт, пробирки с кровью помещаются в ротор, где происходит автоматическое перемешивание. После этого анализатор отбирает часть крови в микрокапилляр, где она ускоряется и резко останавливается (так называемый метод «остановленной струи»). Остановка вызывает агрегацию эритроцитов, и в этот момент с помощью фотометра определяется оптическая плотность крови — чем плотнее будут расположены эритроциты, тем меньше света пройдет через пробу. Прибор использует полученные данные и строит кривую седиментации — ее анализ позволит представить результат в привычных единицах измерения СОЭ [22], [23].
Фото на память
Для определения концентрации гемоглобина Международный комитет по стандартизации в гематологии рекомендует метгемоглобин-цианидный метод. Однако сейчас повсеместно применяется иное исследование, не использующее токсичный цианид. Знакомьтесь, SLS-метод. Назван он по основному реагенту — лауритилсульфату натрия. SLS разрушает мембраны эритроцитов, после чего связывается с группами гема и образует стабильные комплексные соединения. Они анализируется фотометрически — через пробу крови пропускают свет лазера. Комплексные соединения поглощают часть света, в результате этого интенсивность выходящего светового потока ослабевает. Затухание измеряют с помощью фотодатчика и полученные данные преобразуют в единицы концентрации гемоглобина [24].
Лейкоцитарная формула – процентное соотношение различных форм лейкоцитов в сыворотке крови и подсчет их числа в единице объема. При наличии атипичных форм клеток проводится исследование крови под микроскопом. В отличие от эритроцитов, популяция которых является однородной, лейкоциты делятся на 5 типов, отличающихся по внешнему виду и выполняемым функциям: нейтрофилы, лимфоциты, моноциты, эозинофилы, базофилы.
Синонимы русские
Cоотношение различных форм лейкоцитов в крови, дифференцированный подсчет лейкоцитов, лейкоцитограмма, лейкограмма, формула крови, подсчет лейкоцитарной формулы.
Синонимы английские
Leukocyte differential count, Peripheral differential, WBC differential.
Метод исследования
Проточная цитофлуориметрия.
Единицы измерения
*10^9/л (10 в ст. 9/л).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за сутки перед сдачей крови.
- Не принимать пищу за 2-3 часа до исследования (можно пить чистую негазированную воду).
- Исключить физическое и эмоциональное перенапряжение и не курить за 30 минут до исследования.
Общая информация об исследовании
Лейкоциты, как и другие клетки крови, образуются в костном мозге. Основная их функция – борьба с инфекцией, а также ответ на повреждение тканей.
В отличие от эритроцитов, популяция которых является однородной, лейкоциты делятся на 5 типов, отличающихся по внешнему виду и выполняемым функциям: нейтрофилы, лимфоциты, моноциты, эозинофилы, базофилы.
Лейкоциты образуются из стволовых клеток костного мозга. Они живут недолго, поэтому происходит их постоянное обновление. Продукция лейкоцитов в костном мозге возрастает в ответ на любое повреждение тканей, это часть нормального воспалительного ответа. Разные типы лейкоцитов имеют несколько разные функции, однако они способны к координированным взаимодействиям путем «общения» с использованием определенных веществ – цитокинов.
Долгое время лейкоцитарную формулу высчитывали вручную, однако современные анализаторы позволяют гораздо точнее проводить исследование в автоматическом режиме (врач смотрит 100-200 клеток, анализатор – несколько тысяч). Если анализатором определяются атипичные формы клеток либо выявляются значительные отклонения от референсных значений, то лейкоцитарная формула дополняется микроскопическим исследованием мазка крови, который позволяет диагностировать некоторые заболевания, такие как, например, инфекционный мононуклеоз, определить степень тяжести инфекционного процесса, описать тип выявленных атипичных клеток при лейкозе.
Нейтрофилы – наиболее многочисленные из лейкоцитов – первыми начинают бороться с инфекцией и первыми появляются в месте повреждения тканей. Нейтрофилы имеют ядро, разделенное на несколько сегментов, поэтому их еще называют сегментоядерными нейтрофилами или полиморфноядерными лейкоцитами. Эти названия, однако, относятся только к зрелым нейтрофилам. Созревающие формы (юные, палочкоядерные) содержат цельное ядро.
В очаге инфекции нейтрофилы окружают бактерии и ликвидируют их путем фагоцитоза.
Лимфоциты – одно из важнейших звеньев иммунной системы, они имеют большое значение в уничтожении вирусов и борьбе с хронической инфекцией. Существует два вида лимфоцитов – Т и В (в лейкоцитарной формуле подсчета видов лейкоцитов по отдельности нет). B-лимфоциты вырабатывают антитела – специальные белки, которые связываются с чужеродными белками (антигенами), находящимися на поверхности вирусов, бактерий, грибов, простейших. Окруженные антителами клетки, содержащие антигены, доступны для нейтрофилов и моноцитов, которые убивают их. Т-лимфоциты способны разрушать зараженные клетки и препятствовать распространению инфекции. Также они распознают и уничтожают раковые клетки.
Моноцитов в организме не очень много, однако они осуществляют крайне важную функцию. После непродолжительной циркуляции в кровяном русле (20-40 часов) они перемещаются в ткани, где превращаются в макрофаги. Макрофаги способны уничтожать клетки, так же как нейтрофилы, и держать на своей поверхности чужеродные белки, на которые реагируют лимфоциты. Они играют роль в поддержании воспаления при некоторых хронических воспалительных заболеваниях, таких как ревматоидный артрит.
Эозинофилов в крови содержится небольшое количество, они тоже способны к фагоцитозу, однако в основном играют другую роль – борются с паразитами, а также принимают активное участие в аллергических реакциях.
Базофилов в крови также немного. Они перемещаются в ткани, где превращаются в тучные клетки. Когда они активируются, из них выделяется гистамин, обусловливающий симптомы аллергии (зуд, жжение, покраснение).
Для чего используется исследование?
- Для оценки способности организма противостоять инфекции.
- Для определения степени выраженности аллергии, а также наличия в организме паразитов.
- Для выявления неблагоприятного воздействия некоторых лекарственных препаратов.
- Для оценки иммунного ответа на вирусные инфекции.
- Для дифференциальной диагностики лейкозов и для оценки эффективности их лечения.
- Для контроля за воздействием на организм химиотерапии.
Когда назначается исследование?
- Совместно с общим анализом крови при плановых медицинских осмотрах, подготовке к хирургическому вмешательству.
- При инфекционном заболевании (или подозрении на него).
- Если есть подозрение на воспаление, аллергическое заболевание или заражение паразитами.
- При назначении некоторых лекарственных препаратов.
- При лейкозах.
- При контроле за различными заболеваниями.
Что означают результаты?
Лейкоцитарная формула обычно интерпретируется в зависимости от общего количества лейкоцитов. Если оно отклоняется от нормы, то ориентирование на процентное соотношение клеток в лейкоцитарной формуле может приводить к ошибочным заключениям. В этих ситуациях оценка производится на основании абсолютного количества каждого вида клеток (в литре – 1012/л – или микролитре – 109/л). Увеличение или уменьшение количества какой-либо популяции клеток обозначается как «нейтрофилез» и «нейтропения», «лимфоцитоз» и «лимфопения», «моноцитоз» и «моноцитопения» и т. д.
Референсные значения
Лейкоциты
| Возраст | Референсные значения |
| Меньше 1 года | 6 — 17,5 *10^9/л |
| 1-2 года | 6 — 17 *10^9/л |
| 2-4 года | 5,5 — 15,5 *10^9/л |
| 4-6 лет | 5 — 14,5 *10^9/л |
| 6-10 лет | 4,5 — 13,5 *10^9/л |
| 10-16 лет | 4,5 — 13 *10^9/л |
| Больше 16 лет | 4 — 10 *10^9/л |
Нейтрофилы
| Возраст | Референсные значения |
| Меньше 1 года | 1,5 — 8,5 *10^9/л |
| 1-2 года | 1,5 — 8,5 *10^9/л |
| 2-4 года | 1,5 — 8,5 *10^9/л |
| 4-6 лет | 1,5 — 8 *10^9/л |
| 6-8 лет | 1,5 — 8 *10^9/л |
| 8-10 лет | 1,8 — 8 *10^9/л |
| 10-16 лет | 1,8 — 8 *10^9/л |
| Больше 16 лет | 1,8 — 7,7 *10^9/л |
Нейтрофилы, %
| Возраст | Референсные значения |
| Меньше 1 года | 16 — 45 % |
| 1-2 года | 28 — 48 % |
| 2-4 года | 32 — 55 % |
| 4-6 лет | 32 — 58 % |
| 6-8 лет | 38 — 60 % |
| 8-10 лет | 41 — 60 % |
| 10-16 лет | 43 — 60 % |
| Больше 16 лет | 47 — 72 % |
Чаще всего уровень нейтрофилов повышен при острых бактериальных и грибковых инфекциях. Иногда в ответ на инфекцию продукция нейтрофилов увеличивается столь значительно, что в кровяное русло выходят незрелые формы нейтрофилов, увеличивается количество палочкоядерных. Это называется сдвигом лейкоцитарной формулы влево и свидетельствует об активности ответа костного мозга на инфекцию. Встречается и сдвиг лейкоцитарной формулы вправо, когда количество палочкоядерных форм уменьшается и увеличивается количество сегментоядерных. Так бывает при мегалобластных анемиях, заболеваниях печени и почек.
Другие причины повышения уровня нейтрофилов:
- системные воспалительные заболевания, панкреатит, инфаркт миокарда, ожоги (как реакция на повреждение тканей),
- онкологические заболевания костного мозга.
Количество нейтрофилов может уменьшаться при:
- массивных бактериальных инфекциях и сепсисе, в случаях когда костный мозг не успевает воспроизводить достаточно нейтрофилов,
- вирусных инфекциях (гриппе, кори, гепатите В),
- апластической анемии (состоянии, при котором угнетена работа костного мозга), B12-дефицитной анемии,
- онкологических заболеваниях костного мозга и метастазах других опухолей в костный мозг.
Лимфоциты
| Возраст | Референсные значения |
| Меньше 1 года | 2 — 11 *10^9/л |
| 1 — 2 года | 3 — 9,5 *10^9/л |
| 2 — 4 года | 2 — 8,0 *10^9/л |
| 4 — 6 лет | 1,5 — 7 *10^9/л |
| 6 — 8 лет | 1,5 — 6,8 *10^9/л |
| 8 — 10 лет | 1,5 — 6,5 *10^9/л |
| 10 — 16 лет | 1,2 — 5,2 *10^9/л |
| Больше 16 лет | 1 — 4,8 *10^9/л |
Лимфоциты, %
| Возраст | Референсные значения |
| Меньше 1 года | 45 — 75 % |
| 1-2 года | 37 — 60 % |
| 2-4 года | 33 — 55 % |
| 4-6 лет | 33 — 50 % |
| 6-8 лет | 30 — 50 % |
| 8-10 лет | 30 — 46 % |
| 10-16 лет | 30 — 45 % |
| Больше 16 лет | 19 — 37 % |
Причины повышенного уровня лимфоцитов:
- инфекционный мононуклеоз и другие вирусные инфекции (цитомегаловирус, краснуха, ветряная оспа, токсоплазмоз),
- некоторые бактериальные инфекции (туберкулез, коклюш),
- онкологические заболевания костного мозга (хронический лимфолейкоз) и лимфоузлов (неходжкинская лимфома).
Причины снижения уровня лимфоцитов:
- острые бактериальные инфекции,
- грипп,
- апластическая анемия,
- прием преднизолона,
- СПИД,
- системная красная волчанка,
- некоторые врождённые заболевания новорождённых (синдром Ди Джорджа).
Моноциты
| Возраст | Референсные значения |
| Меньше 1 года | 0,05 — 1,1 *10^9/л |
| 1 — 2 года | 0,05 — 0,6 *10^9/л |
| 2 — 4 года | 0,05 — 0,5 *10^9/л |
| 4 — 16 лет | 0,05 — 0,4 *10^9/л |
| Больше 16 лет | 0,05 — 0,82 *10^9/л |
Моноциты, %
| Возраст | Референсные значения |
| Меньше 1 года | 4 — 10 % |
| 1 — 2 года | 3 — 10 % |
| Больше 2 лет | 3 — 12 % |
Причины повышения уровня моноцитов:
- острые бактериальные инфекции,
- туберкулез,
- подострый бактериальный эндокардит,
- сифилис,
- онкологические заболевания костного мозга и лимфоузлов,
- рак желудка, молочных желез, яичников,
- заболевания соединительной ткани,
- саркоидоз.
Причины снижения уровня моноцитов:
- апластическая анемия,
- лечение преднизолоном.
Эозинофилы
| Возраст | Референсные значения |
| Меньше 1 года | 0,05 — 0,4 *10^9/л |
| 1-6 лет | 0,02 — 0,3 *10^9/л |
| Больше 6 лет | 0,02 — 0,5 *10^9/л |
Эозинофилы, %
| Возраст | Референсные значения |
| Меньше 1 года | 1 — 6 % |
| 1 — 2 года | 1 — 7 % |
| 2 — 4 года | 1 — 6 % |
| Больше 4 лет | 1 — 5 % |
Наиболее распространенные причины повышения уровня эозинофилов:
- аллергические заболевания (бронхиальная астма, сенная лихорадка, пищевая аллергия, экзема),
- заражение паразитическими червями,
- аллергическая реакция на лекарственные препараты (антибиотики, аллопуринол, гепарин, пропранолол и др.).
Более редкие причины их повышения:
- синдром Лефлера,
- гиперэозинофильный синдром,
- системные заболевания соединительной ткани,
- онкологические заболевания костного мозга и лимфоузлов.
Количество эозинофилов может снижаться при:
- острых бактериальных инфекциях,
- синдроме Кушинга,
- синдроме Гудпасчера,
- приеме преднизолона.
Базофилы: 0 — 0,08 *10^9/л.
Базофилы, %: 0 — 1,2 %.
Увеличение содержания базофилов встречается редко: при онкологических заболеваниях костного мозга и лимфоузлов, истинной полицитемии, аллергических заболеваниях.
Уменьшаться количество базофилов может при острой фазе инфекции, гипертиреозе, длительной терапии кортикостероидами (преднизолоном).
Что можно и что нельзя узнать по капле крови
Достаточно набрать в поисковике «диагностика по капле крови», всплывает масса противоречивой информации. Оказывается, по капле крови можно познать себя с головы до ног: выяснить свой генетический профиль, предрасположенность к тем или иным заболеваниям, получить свой психологический портрет, узнать о совместимости с партнером и получить прогноз продолжительности жизни. Как отличить фиктивные исследования от настоящих? Что вообще можно узнать по капле крови?
Общий анализ крови
Как только кровь впервые попала под микроскоп, и выяснилось, что она состоит из клеток, ученые поняли, что это можно использовать для диагностики. На клеточном анализе и базируется общий (он же – гематологический) анализ крови.
Общий анализ крови – это:
- подсчет клеток (сколько всего лейкоцитов, эритроцитов, нейтрофилов, тромбоцитов, и т.д.);
- дифференцировка клеток (процентное соотношение клеток одного вида к клеткам другого вида). Это позволяет сделать предположения о процессах, протекающих в организме: например, вирусная инфекция, действие токсических веществ;
- оценка качества клеток (размер клетки и ядра, зрелость, насыщение эритроцитов гемоглобином, и т.д.).
Парадокс в том, что нет ни одного диагноза, который мог бы основываться исключительно на общем анализе крови. Но одновременно гематологический анализ дает картину крови, без которой невозможно заниматься диагностикой.
Все, что кроме клеток
Кровь состоит из клеток и из жидкой части (называемой плазмой или сывороткой, в зависимости от того, содержит ли она фибрин, отвечающий за свертываемость крови, или нет).
Диагностика по плазме или сыворотке – то направление, которое сейчас развивается в мире быстрее всего: существует порядка 1000 наименований анализов: биохимические, иммунохимические, диагностика на инфекции. Плазма является молекулярным зеркалом всех наших органов и тканей, маркером всех заболеваний и инфекционных процессов.
Ждите иммунного ответа. Множество видов диагностики по сыворотке базируются на принципе иммунного ответа: любая бактерия, любой вирус, который внедряется в наш организм, оставляет в крови след в виде ответа иммунной системы, независимо от того, заболели мы или нет. Делая анализ крови, мы можем выяснить, знакома ли наша иммунная система с этим патологическим агентом (соответственно, выработан уже иммунитет или нет).
Используя принцип иммунного ответа, можно исследовать огромное количество параметров: выяснить, что вызывает у вас аллергию, выявить онкологию, гормональные нарушения, сердечно-сосудистые заболевания, нарушения мозговой ткани и многое другое.
Все это биохимия. Холестерин, билирубин, ферменты крови, альбумин и глобулины – все это предмет биохимического анализа крови. По биохимическим показателям можно оценить работу основных органов и систем (печень, почки, белковый обмен), получить информацию о метаболизме (обмен липидов, углеводов), выяснить потребность в минералах.
В глубь ядра
Относительно недавно появившиеся методы диагностики связаны с изучением ядер клеток и фрагментов ДНК.
ПЦР-диагностика. Это метод, позволяющий выявить даже малые концентрации определенных фрагментов ДНК, добившись значительного увеличения их концентрации в образце. С помощью метода ПЦР и других ДНК-методик можно, например, найти вирус иммунодефицита и гепатитов в крови и подтвердить факт инфицирования.
Бактериологическое исследование. Позволяет выделить возбудителей заболеваний из биологических материалов. «Знать врага в лицо» необходимо для того, чтобы протестировать его на чувствительность к антибиотикам и подобрать терапию, которая будет эффективна для конкретного пациента.
Когда анализы оказываются ненужными
Лишними анализы могут оказаться по двум причинам: из-за неумеренного любопытства пациента и из-за недостаточной квалификации врача.
С любопытным пациентом все понятно: в принципе, анализ на что-нибудь новенькое и интересненькое можно делать хоть каждый день – благо, сейчас существует великое разнообразие маркеров, а новые появляются едва ли не ежедневно.
Иначе обстоит дело с квалификацией врача. Действительно, равнодушный доктор может бросить: «Сдайте анализы на все инфекции». Если понимать его слова буквально, придется сдавать анализы более, чем на 200 инфекций, среди которых окажется и такая экзотика, как бореллиоз и малярия. Отсюда вывод: хороший специалист не станет направлять пациента сдавать кровь на «все инфекции» или «все аллергены». А грамотный пациент не пойдет – хотя бы потому, что этот лобовой подход обойдется ему в несколько зарплат.
Диагностика по крови – та сфера, в которой желание узнать «все и сразу», может оказаться либо разорительным, либо слишком трудоемким. Поэтому существует правило: необходимо делать скрининги, которые могут сказать нам нечто определенное, после чего при необходимости расширять границы исследования. Иными словами, нет смысла делать антитела к инсулину, не измерив уровень глюкозы.
Мастерство диагноста
Любое сверхсовременное оборудование, любые сверхновые маркеры – всего лишь инструменты, которые являются лишь дополнением к голове клинициста. К той самой голове, которая принимает решения: какие исследования назначать и как трактовать полученную информацию. Здесь потребуются и опыт, и чутье, и талант диагноста.
Врач оказывается между двух огней: с одной стороны, нет ничего печальнее, чем «проморгать» заболевание, не назначить дополнительного скрининга. С другой стороны, не менее печально для врача – положиться на свой опыт и не перепроверить предположение. Например, после однократного определения антител к инфекционным агентам, диагноз ставиться не должен: это всегда предмет повторных исследований, сравнения полученных результатов в динамике и интеллектуальной работы клинициста.
Опыт врача пригождается и в менее критических случаях – например, когда пациента ничего не беспокоит, и он хочет «просто провериться»: предварительная консультация со специалистом окажется нелишней. Слово Любови Станкевич:
«Например, передо мной юноша 16 лет. Скорее всего, ему не потребуется онкомаркер, если его ничего не беспокоит. Также не стоит обращаться к расширенному липидному профилю, если молодой человек не тучен, и если я не подозреваю у него нарушенный обмен веществ. Гематологический анализ крови, стандартная биохимия, анализ мочи – вот, что я могу ему назначить. Это тот минимум, который действительно никому никогда не повредит».
Не все удается узнать по капле крови
Но это все медицина. Людям же хочется использовать возможности анализа крови для более простых, повседневных задач, по возможности не связанных с болезнями. Реклама отвечает этим народным чаяниям и предлагает: диеты по группе крови, узнать продолжительность своей жизни на основе анализа крови, познать самого себя и узнать, какая должна быть группа крови у второй половины, чтобы вам жилось долго и счастливо.
Как понять, когда методика работает, а когда дурят нашего брата – особенно если в диагностике по крови постоянно появляется что-то новое?
Рассказывает Любовь Станкевич, медицинский директор лаборатории «Дитрикс Медикал»:
«Прежде всего, любая теория должна быть подкреплена практическими разработками. Например, есть теория о том, что каждой группе крови соответствует свой режим питания, под это даже пытаются подвести эволюционно-генетическую теорию: первая группа – охотники, вторая – собиратели, и так далее. Но где научное экспериментальное подтверждение этих соображений в условиях современного мира?
Мы можем заметить какой-то факт. Например, в Японии при приеме на работу нужно указать свою группу крови: на этом основании работодатель делает заключения о характере работника. Предположим, такая связь есть: но правильно ли мы истолковали замеченный факт? Понять это можно только после долгих лет наблюдения. Поэтому у любой методики есть важный критерий: данные, полученные в одной лаборатории, должны быть воспроизводимы в другой с точно такими же результатами. Если методика невоспроизводима, грош цена такой методике».
Благодарим за консультацию
медицинского директора лаборатории «Дитрикс Медикал» Любовь Станкевич
Полезная информация
Т. Шузель
Простой анализ мазка крови позволяет точно и быстро получить информацию. Дополнительный количественный подсчет клеток крови обеспечивается с помощью гематологического автомата – счетчика.
В мазках крови проводят подсчет и оценку различных морфологических форм клеток крови. Следует иметь в виду, что полную информацию нельзя получить только с помощью автоматических счетчиков.
В данной статье описаны способы приготовления и методы анализа мазков крови, а также получение дополнительной информации путем использования автоматических методов исследования.
ТЕХНИКА ВЫПОЛНЕНИЯ МАЗКОВ КРОВИ
Показаний к исследованию крови много, и они ориентированы не только на диагностику анемии. Большая часть системных заболеваний также приводит к изменению гемограммы, анализ которой является основой диагностики.
1. Взятие материала для исследования
Чаще всего мазок крови выполняют путем нанесения на предметное стекло капли венозной крови, взятой из пробирки, для консервирования которой используют этилендиаминтетраацетат (ЭДТА), что позволяет сохранить морфологию клеток. Необходимо соблюдать процентное соотношение кровь/антикоагулянт: избыток ЭДТА вызывает артефакт псевдотромбопении и изменяет морфологию клеток (зубчатый край эритроцитов).
Наносят материал на предметное стекло сразу после его забора, потому что при хранении возникают повреждения клеток (вакуолизация лейкоцитов, пикноз ядра1).
1 Пикноз (гр. puknosis, конденсация) [англ. pyknosis]. Трансформация ядра в клетке с конденсацией хроматина. Ядро становится гомогенным и имеет однородную окраску. Проявление этого феномена связано с гибелью клетки.
2. Способ нанесения материала
- Каплю крови наносят на поверхность предметного стекла, расположенного горизонтально, с помощью пипетки близко к его краю (фото 1).
Фото 1. Выполнение мазка крови: одну каплю крови поместить на конец предметного стекла. Другое стекло, с помощью которого необходимо сделать мазок, помещают на предметное стекло перед каплей крови приблизительно под углом 30-45° (фото 2). Путем скольжения по предметному стеклу его приближают к капле крови, пока последняя не распределится по перемещаемому краю (фото 3). После этого стекло односторонним движением смещают по поверхности предметного стекла в сторону противоположного края. Предметное стекло маркируют до или после нанесения материала, что позволяет избежать возможных ошибок.
| Фото 2. Выполнение мазка крови: стекло для выполнения мазка крови помещают на предметное стекло с каплей крови под углом 30-45°. | Фото 3. Выполнение мазка крови: предметное стекло смещают близко к капле крови до того момента, когда она начинает распределяться по всему фронту его края за счет капиллярности. |
- Цель нанесения материала на предметное стекло — получить однородный мазок с утончением на конце (хвостики, которые еще называют косичками). В этой тонкой части мазка клетки крови располагаются в один слой, что позволяет исследовать их морфологию (фото 4). На рисунке 1 показано, как должен быть выполнен мазок крови.
| Фото 4. Выполнение мазка крови: мазок крови имеет гомогенную структуру с целлюлярным истонченным монослоем, расположенным в части предметного стекла, противоположной по отношению к нанесенной на него капли крови. | Рис.1. Картина мазка после нанесения материала на предметное стекло |
- Если подсчет клеток не может быть выполнен сразу на месте, то полученные мазки, доставляемые с остальным материалом в лабораторию, не окрашивают.
- Перед проведением окраски мазки надо высушить на свежем воздухе, избегая при этом высокой температуры, потому что это может привести к возникновению артефактов вследствие деформации поверхности эритроцитов.
Эти предосторожности крайне важны, потому что при заражении животных с инвазией эритроцитов риккетсиями (Hemobartonella felis) и пироплазмами (Babesia canis) артефакты, возникшие при окраске мазков, могут затруднить идентификацию возбудителей. С помощью красителя Май-Грюнвальд-Гимза (метод Паппенгейма) получают очень качественную микроскопическую картину мазка с детализацией ядерного и цитоплазматического аппаратов клетки (приложение 1). Следует заметить, что этот метод окраски занимает много времени (более 20 минут). Кроме того, быстрое ополаскивание может вызвать повреждение исследуемого материала. Но быстрая окраска мазков (Diff-Quik, RAL) в экстренных случаях позволяет получить необходимые результаты анализа за короткий промежуток времени. Основной недостаток использования быстрых наборов (Kits) в том, что они не дают возможности достаточной детализации нюансов внутри самой клетки (генез артефактов хроматина, качественной оценки цитоплазматического состояния).
Приложение 1. Схема окраски по Май-Грюнвальд -Гимза
Схема классической окраски
— Поместить предметное стекло с нанесенным на него материалом в краску Май-Грюнвальда и выдержать в течение 4 минут. — Поместить предметное стекло с нанесенным на него материалом в краску Май-Грюнвальда, разведенную водой на 50%, и выдержать в течение 2 минут. — Сполоснуть предметное стекло дистиллированной водой. — Поместить предметное стекло в емкость с 5% раствором краски Гимза, разведенным водопроводной водой, и выдержать в течение 15 минут. — Сполоснуть предметное стекло и высушить.
Упрощенная схема
— На мазок наливают краску МайГрюнвальда-Гимза (2-3 мл), при этом предметное стекло должно быть помещено горизонтально в поддерживающее устройство. Окраску осуществляют в течение 5 минут. — Аккуратно слить краситель и нанести вновь раствор красителя Гимза, разведенный 1:10 водой экстемпоре в течение 10 минут. — Сполоснуть предметное стекло и высушить.
АРТЕФАКТЫ
- Артефакты, которые могут возникать при очень быстром или недостаточном высушивании, а также вследствие высокой температуры или избытка ЭДТА, имеют следующие проявления:
— зубчатые формы эритроцитов или эхиноцитоз (необходимо дифференцировать от акантоцитоза2); — преломления света под микроскопом в телах, расположенных на эритроцитах (необходимо дифференцировать от пироплазм или бабезий) (фото 5).
2 Акантоцитоз (гр. akanta, шип, игла; kutos, клетка) [англ. akanthocytosis]. Деформация эритроцитов, которая напоминает иглу ежа.
| Фото 5. Артефакт при неправильном высушивании эритроцитов: светопреломляющиеся тела, располагающиеся на поверхности эритроцитов. Активированный лимфоцит. |
Артефакты, возникающие в результате окраски вследствие применения старого раствора красителя или нарушения режима окраски (недостаточное время пропитывания):
— слабая окраска клеток, в основном ядерного аппарата; — депо красителя (фото 6); — псевдовключения (наложение двух элементов).
| Фото 6. Артефакт окраски: депо красителя. |
СПОСОБ СЧИТЫВАНИЯ
Анализ мазка крови осуществляют всегда одним и тем же способом, выполняя соответствующие этапы.
Сбор информации начинают с момента нанесения материала на предметное стекло, до того как проводить исследование клеток крови под иммерсией.
1. Макроскопическое обследование
- Интерпретацию мазка крова начинают путем его анализа невооруженным глазом сразу после нанесения крови на предметное стекло. На этом этапе оценивают качество полученного мазка крови (утонченность конца мазка и гомогенность, наличие агглютинации капли крови).
- Присутствие макроскопической агглютинации до высушивания и окраски характеризуется неоднородностью распределения крови на предметном стекле в виде «точечных сгустков», что свидетельствует об аутоагглютинации или присутствии эритроцитарных столбиков (фото 7).
| Фото 7. Макроскопическая агглютинация. Следует обратить внимание на отсутствие однородности крови. Эта агглютинация вызвана аутоагглютинацией или персистенцией эритроцитарных (монетных) столбиков. |
- У собаки аутоагглютинация возникает вследствие сенсибилизации эритроцитов антителами. Это является серьезным доказательством гемолитических процессов иммунной природы, тогда как наличие формирования монетных (эритроцитарных) столбиков в основном возникает в случае диспротеинемии. Чтобы различить эти два феномена, каплю крови смешивают с физраствором. Это вызывает исчезновение агглютинации в случае формирования монетного столбика. Персистенция такого состояния крови свидетельствует об аутоагглютинации.
- Макроскопическая агглютинация у кошки, проявляющаяся нагромождением эритроцитов, носит неспецифический характер и не поддается интерпретации.
Затем предметное стекло с нанесенным не нее мазком крови просушивают, окрашивают и исследуют под микроскопом.
2. Исследование мазка под малым увеличением
Первый этап микроскопического исследования материала осуществляют при малом увеличении (объектив ×10 или ×20). Это позволяет оценить качество мазка и получить первую информацию.
В области самой тонкой части мазка отмечают большое скопление лейкоцитов, что дает возможность уже при первой оценке определить их количество (фото 8).
| Фото 8. Обследование косички мазка крови при слабом увеличении. Возможен подсчет эритроцитов. На данном снимке выраженный лейкоцитоз с преобладанием нейтрофилов. | Фото 9. Обследование мазка при слабом увеличении: наблюдается скопление тромбоцитов. |
Обнаружение скоплений тромбоцитов (фото 9) свидетельствует об артефакте, который может привести к ложному выводу о тромбоцитопении.
- На уровне моноцеллюлярного слоя полное визуальное исследование предметного стекла при малом увеличении (×40) позволяет подсчитать лейкоцитарную формулу.
- Рекомендуется провести поиск ядерных эритроцитов. Если мы их обнаруживаем в большом количестве, то это свидетельствует о нарушении (речь может идти о циркуляции микрофиллярий, или мы имеем дело с аномальными клетками). Исследователь всегда акцентирует свое внимание на предполагаемом наличии макроскопической агглютинации эритроцитов (фото 10) или формировании монетных столбиков (фото 11).
- Затем исследование различных клеток проводят под большим увеличением.
| Фото 10. Обследование целлюлярного монослоя (×40): микроскопическая аутоагглютинация. | Фото 11. Исследование целлюлярного монослоя (×40): эритроцитарные столбики. |
ОЦЕНКА СОСТОЯНИЯ ЭРИТРОЦИТОВ
- Оценку состояния эритроцитов проводят под иммерсией (×100) в средней части мазка: в моноцеллюлярном слое, где они хорошо разделены и не деформированы.
- При морфологической оценке выявляют симптомы медуллярной регенерации, а также изменение размера, формы и присутствие включений.
- Нормальные эритроциты у домашних плотоядных представлены округлыми безъядерными клетками в форме двояковогнутого диска (дискоцит), диаметр которого приблизительно равен 7 мкм у собаки и 6 мкм у кошки. В моноцеллюлярной зоне они представлены моноцеллюлярным слоем, имеют округлую форму с бледным свечением в центре (практически отсутствует у кошки), окрашены в желто-оранжевый цвет (умеренная эозинофилия). При этом можно наблюдать физиологически умеренный анизоцитоз3 (фото 12).
| Фото 12. Эритроциты и нормальные тромбоциты у собаки. |
3 Анизоцитоз (гр. an, отрицательная приставка; isos, равный; kutos, клетка) [англ. anisocytosis]. Патологическое состояние эритроцитов, когда они сильно варьируются, в то время как в норме они должны быть одинаковыми. Этот термин также приемлем по отношению к вариациям диаметра лейкоцитов.
1. Признаки регенерации
- Информация, полученная при анализе крови, не указывает на причину анемии или ее регенеративный характер. Но она позволяет оценить тяжесть нарушений путем подсчета количества эритроцитов, определения концентрации гемоглобина и гематокрита.
Исследование мазков крови животного, страдающего анемией, в совокупности с гематологическим анализом, проведенным с использованием автоматизированной техники, позволяет оценить степень регенерации и в некоторых случаях выявить причину возникновения анемии.
- Патогномоничные симптомы регенерации в мазках крови следующие: полихроматофилия; анизоцитоз; тельца Гавела-Жоли; эритробласты (эритроциты, содержащие ядро), ассоциирующиеся с ретикулоцитозом, наблюдаемым при специальной окраске.
- Полихроматофилию (фото 13) определяют по наличию в крови эритроцитов большого диаметра фиолетовой окраски с элементами базофилии, которые контрастируют с оранжевым цветом нормальных эритроцитов. Эти полихроматофильные клетки соответствуют незрелым формам эритроцитов, которые широко распространены в костном мозге и визуализируются при дегенеративных изменениях костного мозга. В цитоплазме они содержат остатки рибосомальной РНК, которая придает фиолетовую окраску. Это соответствует у собаки и кошки ретикулоцитам с прижизненной окраской (мерцающий крезиловый голубой).
| Фото 13. Обследование моноцеллюлярного слоя в мазке с большим увеличением (×100). Следует отметить наличие полихроматофильных эритроцитов, анизоцитоз эритроцитов и присутствие сфероцитов. Эритробласт наблюдается внизу слева. | Фото 14. Исследование моноцеллюлярного слоя при большом увеличении (×100). Следует обратить внимание на эритроцитарный анизоцитоз и небольшие азурофильные включения круглой формы, которые содержатся в некоторых эритроцитах: тельца Гавела-Жоли. |
- Анизоцитоз (фото 14) — вариации размера эритроцитов. Увеличивается количество эритроцитов большого размера, находящихся в крови. Полихроматофилия связана с большим размером и соответствует анизоцитозу. Присутствие эритроцитов с более интенсивной окраской и большим размером эритроцитов — веский аргумент в пользу регенеративной анемии.
- Эритробласты (ядерные эритроциты, незрелые формы), обычно находящиеся в костном мозге, имеют тенденцию иногда в малом количестве появляться в циркулирующей крови здорового организма.
Они характеризуются большим размером, имеют серовато-фиолетовую цитоплазму, объемное, круглое, интенсивно окрашенное ядро. Их количество возрастает при регенеративной анемии, но присутствие только этих клеток не позволяет ставить диагноз на предполагаемое заболевание. Эритробласты можно наблюдать в большом количестве в циркулирующей крови при отравлении свинцом, выраженной септицемии, при различных заболеваниях крови (синдром миелопролиферации и т.д.).
- Для подтверждения регенеративной анемии обязательно требуется вести подсчет циркулирующих в крови ретикулоцитов после окраски голубым бриллиантовым крезилом (приложение 2). При проведении такой окраски различают зрелые формы эритроцитов с голубой интенсивной окраской цитоплазматического ретикулума. У собаки учитываются все клетки с такой окраской, тогда как у кошки подсчитываются только ретикулярные эритробласты (распознаются благодаря выраженному скоплению цитоплазматической грануляции).
Приложение 2. Методы определения количества ретикулоцитов
Выполнение метода
— Смешать 500 мкл крови с 500 мкл раствора голубого бриллиантового Крезила (1 г порошка бриллиантового голубого Крезила и 0,4 г цитрата, разведенные в 100 мл изотонического раствора). — Выдержать 10-20 минут при комнатной температуре. — Нанести данную смесь на предметное стекло, как это осуществляют для получения мазка крови. — Подсчитать количество наблюдаемых ретикулоцитов при большом увеличении (приблизительно для визуализации 100 эритроцитов в поле зрения микроскопа под иммерсией) и осуществить эту процедуру в 10 полях объектива. Полученное количество выражается в процентном содержании циркулирующих ретикулоцитов. Относительная оценка трансформируется в абсолютную величину путем умножения этого количество на общее число эритроцитов.
Интерпретация
Некоторые авторы говорят о регенерации костного мозга при количественном показателе 80 000-30 000 ретикулоцитов в мм3 у собаки и кошки. Другие говорят о0 ретикулоцитах в мм3. При сомнительной оценке, или таковой, указывающей на нижнюю границу нормы, осуществляют повторный подсчет через два или три дня. Кинетика ретикулоцитов способствует более точной интерпретации.
Тельца Гавела-Жоли (фото 14) относятся к единичным включениям малого размера, имеют азурофильную и круглую форму, присутствуют в молодых эритроцитах, находящихся в фазе созревания. Они относятся к фазе нуклеарного материала эритробластов и элиминируются при созревании. Небольшой процент (менее 1%) может присутствовать у кошек в нормальном физиологическом состоянии. Их количество возрастает при регенеративной анемии, спленэктомии, у животных при лечении глюкокортикостероидами, химиотерапевтическими препаратами.
2. Аномалии размера
- Сфероцитоз — наиболее часто встречаемая аномалия размера эритроцитов. Он свидетельствует об иммунологическом воздействии на эритроциты при развитии гемолитической анемии. Наличие сфероцитов объясняется частичным лизисом макрофагами печени и селезенки эритроцитов, покрытых антителами. Сфероциты распознаются по малому размеру, имеют однородную цитоплазму и интенсивную окраску, у них отсутствует бледное пятно в центре. Эти клетки труднее идентифицировать у кошки: здоровые эритроциты у этого вида не имеют в центре бледного окрашивания.
При гемолитической анемии, опосредованной иммуноглобулинами, мазки указывают на выраженную концентрацию сфероцитов, что ассоциируется с признаками регенерации костного мозга (присутствие полихроматофилов, телец Гавела-Жоли и анизоцитоз).
- Симптомы медуллярной регенерации с наличием эритроцитов большого (макроциты) или малого (микроциты) размера можно наблюдать в циркулирующей крови. Эти клетки имеют тинкториальные и морфологические свойства нормальных эритроцитов. Значительно сложнее выявить аномалию: необходимо оценить средний объем эритроцитов (VGM) с помощью автоматического счетчика.
Среди причин, вызывающих снижение VGM, могут быть портосистемное шунтирование или арегенеративная анемия, вызванная недостаточностью железа. Аномалия размера является ранним признаком сидеропении (низкого содержания железа). Гипохромазия (пониженное окрашивание) проявляется значительно позже и возникает через несколько месяцев с момента начала заболевания.
- Некоторые особи, относящиеся к определенным породам собак (например, пудель), имеют VGM, превышающий норму. Такие макроциты иногда выявляют в мазках крови.
3. Аномалии формы
- Эритроциты собаки и кошки, циркулирующие в крови, обычно имеют округлую форму. Повышенное содержание эритроцитов разных форм называют пойкилоцитозом (фото 15). Этот неспецифический термин обозначает вариации форм эритроцитов по отношению к физиологической норме без указания природы или тяжести нарушений. Эту аномалию относят к артефакту, или она ассоциируется с множеством системных заболеваний.
| Фото 15. Исследование моноцеллюлярного слоя при большом увеличении (×100). Следует обратить внимание на варьирующиеся формы эритроцитов (эритроцитарный пойкилоцитоз) и тромбоциты большого размера (макротромбоциты). |
- Многие термины, часть из которых предназначена для описания цитологической картины, используют для описания формы аномалий эритроцитов: кодоциты, дакриоциты, кератоциты, стоматоциты и так далее. Наличие отдельных форм является патогномоничным признаком некоторых нарушений и коррелирует с клинической картиной заболевания. При развитии пойкилоцитоза в основном следует искать выраженные расстройства, связанные с воспалительным процессом или патологией гепатобилиарной системы.
- При нарушениях метаболизма эритроциты могут быть деформированы в связи с аномалией их мембраны. Акантоциты — это деформированные эритроциты, удлиненная форма которых напоминает палец. Они образуются при аномалиях мембраны, вызванных нарушением печени (шунтирование, новообразования печени, липопротеинопатия, гиперхолистеролемия).
- Механическая фрагментация эритроцитов при нарушениях гемоциркуляции ведет к образованию шизоцитов: это фрагменты эритроцитов различных размеров, которые могут иметь неправильную форму (точек, серпа и т.д.). Они возникают вследствие турбулентности крови, например, при стенозе клапанов. Шизоциты характерны для кавального синдрома. Это выраженный гемолитический криз у особей, которые являются носителями различных паразитов, например взрослых форм Dirofilaria immitis. Они персистируют в каудальной полой вене, вызывают вторичные реологические нарушения крови. Также механическая фрагментация эритроцитов может быть вызвана иммунологическими или физическими агрессиями (ДВС, гемангиосаркомой, выраженными воспалениями и т.д.).
4. Аномалии окраски
Интенсивность окраски эритроцитов пропорциональна концентрации содержащегося в них гемоглобина.
- Гипохромия (фото 16) определяется по наличию бледности в центральной части эритроцита в связи с выраженным снижением содержания гемоглобина. Часто выявляется при сидеропенической анемии. Гемоглобин концентрируется в виде тонкого периферического кольца в эритроцитах, которые называют аннулоцитами.
| Фото 16. Исследование моноцеллюлярного слоя при большом увеличении (×100). Следует отметить наличие аннулоцитов: эритроциты имеют выраженное просветление в центре по причине сниженного содержания гемоглобина. |
Большинство подобных анемий связано с недостаточностью железа вследствие хронической потери в системе пищеварения (язвы, разрушающиеся опухоли и т.д.).
- Напротив, некоторую степень гиперхромии (оптической) можно обнаружить при гемолитической анемии по присутствию сфероцитов, униформных эритроцитов при интенсивной их окраске.
5. Наличие включений
Обычно эритроциты имеют униформную (однородную) окраску без каких-либо включений. Большое количество эритроцитарных включений идентифицировано у собаки и кошки, некоторые из них присутствуют в норме.
- Тельца Гейнца проявляются как протуберанции палевого цвета на мембране или внутри эритроцитов, вызваны окислением молекул гемоглобина. Они значительно проще идентифицируются с помощью специальных окрасок (метиленовым синим, голубым бриллиантовым крезилом), но их можно наблюдать при обычной окраске за счет большого размера.
- Присутствие телец Гейнца обычно отмечают у представителей семейства кошачьих в небольшом количестве (менее 3%). Это связано с большим содержанием сульфгидрильных групп на молекуле гемоглобина и объясняет повышенную чувствительность к процессам окисления. При большом количестве телец Гейнца у кошки предполагают в первую очередь отравление токсическими дозами препаратов, вызывающих окисление (парацетамол, потребление лука), а также заболевания, связанные с обменными процессами (диабет, гипертироидоз), или онкологической природы (злокачественная лимфома). При выраженной интоксикации окисленный гемоглобин может конденсироваться в части эритроцитов. Оставшаяся цитоплазма в оптическом поле выглядит опустошенной и образует эксцентроцит. Его морфология схожа с тельцами Гейнца.
- Исследование мазка крови позволяет выявить некоторых возбудителей заболеваний у собаки и кошки. Наиболее часто это гемобартенеллез (Hemobartonella felis) и пироплазмоз (Babesia canis).
- Гемобартенеллы имеют форму небольших кокков или палочек, локализующихся на поверхности мембраны эритроцитов, которые иногда с трудом поддаются дифференциации от артефактов, возникающих при приготовлении мазка крови.
- Пироплазмы характеризуются базофильными включениями в форме груши в цитоплазме эритроцитов. Сдвоенная форма является классической для заболевания, но интра- или экстрацеллюлярную персистенцию четырех паразитов также можно наблюдать в мазках.
- Включения вирусных частиц при заболевании чумой также можно обнаружить в эритроцитах. Они располагаются в цитоплазме, имеют округлую форму, голубой и бледно-розовый цвет. В основном их наблюдают при остром течении инфекционного заболевания, когда симптомы носят слабо специфический характер. Несмотря на редкое проявление, эти включения могут быть единственным показателем при постановке диагноза на вирусное заболевание.
ИССЛЕДОВАНИЕ ТРОМБОЦИТОВ
- Кровяные пластинки, или тромбоциты, имеют круглую или овальную форму, слабо дифференцируемый контур и зернистость розового цвета. Размер их меньше, чем у эритроцитов.
- Если обнаруживают скопления в мазке крови, то это указывает на артефактную тромбоцитопению при пункции (активация первичного гемостаза, агрегация тромбоцитов в пробирке, что исключает возможность подсчета) или на избыток EDTA.
- Количественное содержание тромбоцитов определяют под объективом с иммерсией (приложение 1). Этот метод исследования используют у кошек. Некоторые автоматы часто совершают ошибки в связи со слабой дифференциацией объема между эритроцитами и тромбоцитами, что является причиной неточного подсчета.
- Присутствие мегатромбоцитов (размер равный, иногда превышающий объем эритроцита) часто связано с ранней, а также вторичной регенерацией тромбоцитов при их деструкции или периферической утилизации. Значительно реже увеличенные в размере тромбоциты могут быть следствием дисплазии костного мозга, где затрагивается мегакариоцитарная линия клеток (при инфекционном заболевании, вызванном вирусом лейкоза у кошек).
- Присутствие микротромбоцитов в мазках крови свидетельствует об их деструкции, опосредованной иммунной реакцией (тромбоцитопеническая пурпура иммунной природы). Эти малые тромбоциты представлены их фрагментами, покрытыми антителами. Они имеют значение, аналогичное сфероцитам, которые выявляют при анемиях иммунной природы.
- Включения в тромбоцитах встречается редко, но их выявляют при инфицировании Ehrlichia platys (вызывает циклическую тромбоцитопению).
Приложение 3. Формула подсчета тромбоцитов (объектив с иммерсией)
Собака: тромбоциты/мкл. Определяют количество тромбоцитов в поле зрения микроскопа (×100, ×15 000).
Кошка: тромбоциты/мкл. Определяют количество тромбоцитов в поле зрения микроскопа с увеличением (×100, ×20 000).
Здоровое животное имеет от 8 до 25 тромбоцитов, наблюдаемых при среднем увеличении в поле зрения микроскопа. Этот подсчет позволяет идентифицировать с высокой точностью тромбоцитопению (менее 3 тромбоцитов в поле зрения) и выраженный тромбоцитоз.
ИССЛЕДОВАНИЕ ЛЕЙКОЦИТОВ
- Контроль лейкоцитов осуществляют на первом этапе исследования с помощью автоматизированного подсчета. Данное исследование проводят в косичках мазка при малом увеличении.
- Плотность лейкоцитов в конце мазка и в его центральной части позволяет определить их количество, тогда как дифференцированный подсчет 100 или 200 лейкоцитов позволяет более точно определить лейкоцитарную формулу крови, чем это можно сделать в настоящее время с помощью большинства используемых для этой цели автоматов. Качественная оценка при визуальном исследовании требует квалификации исследователя. Количество форменных элементов и лейкоцитарная формула, просчитываемые в мазках крови, должны соответствовать результатам автоматического исследования.
- Подсчет формулы или обследование линий формирующихся лейкоцитов позволяет распознать аномальные или бластные клетки в циркулирующей крови при злокачественных гемопатиях. Используемые в настоящее время автоматы, относящиеся к типу Coulter, не позволяют дифференцировать нормальные лейкоциты от аномальных. Эти клетки подсчитываются как нормальные лейкоциты, и их наличие может оказаться вне поля зрения клинициста (фото 17).
| Фото 17. Анормальные или бластные клетки, которые могут не идентифицироваться при автоматическом исследовании. |
- Далее морфологический анализ выполняют при более сильном увеличении (×40 или ×100) в зоне мазка с моноцеллюлярным слоем там, где хорошо просматривается морфология клеток. Определяют нейтрофильные гранулоциты (полинуклеарные нейтрофилы, PNN). Лимфоциты и моноциты представлены в достаточно большом количестве в циркулирующей крови, что позволяет провести морфологический анализ. У домашних плотоядных формула крови имеет нейтрофильный профиль. У молодых особей могут преобладать лимфоциты (наблюдается в возрасте до одного года).
- Наиболее частые модификации связаны с изменением морфологии полинуклеарных нейтрофилов при системных воспалительных процессах или клеточной патологии (в случае сепсиса, эндотоксимии или выраженного некроза). В таком случае мы говорим о токсической полинуклеарной нейтрофилии. Первый этап указывает на умеренную токсичность и определяется путем обнаружения телец Дойла: сероватые неравномерные включения в цитоплазме, которые вызваны агрегацией цитоплазматического ретикулума. Эти трудно обнаруживаемые цитоплазматические включения являются наиболее ранним индикатором. Диффузная базофилия цитоплазмы проявляется в более тяжелых случаях. При повышенной токсичности наблюдается два перечисленных признака: микровакуолизация цитоплазмы, имеющей картину пены («мыльные пузыри») (фото 18). В критических случаях отмечают клеточный гигантизм. Полный лизис ядерного аппарата дополняет картину.
| Фото 18. Оценка лейкоцитов. Представлен полинуклеарный нейтрофил с цитоплазматическими микровакуолями в форме «мыльных пузырей»: речь идет о токсическом «полинуклеаре». | Фото 19. Оценка лейкоцитов. Гиперсегментированный полинуклеар (более 5 долей в полинуклеарах). Обследование этих клеток указывает в основном на физиологический характер изменения клеток (старение клеток). |
- Гиперсегментация ядра (правостороннее отклонение ядра или кривой Арнета) без признаков токсичности часто является морфологическим изменением в популяции нейтрофилов (фото 19). Это состояние определяют в популяции нейтрофильных полинуклеаров по выраженной сегментации ядра (больше 5 долей), что в основном свидетельствует о старении клеток крови. Увеличение контакта с ЭДТА (длительное консервирование крови перед выполнением мазка), кортикостероидная терапия со снижением циркуляции в тканях, хроническое воспаление — причины не физиологического увеличения гиперсегментации полинуклеарных нейтрофилов.
- Для стадии неполного созревания, или «band form» (фото 20), характерна неполная сегментация ядер, имеющих форму подковы лошади или земляного ореха (арахиса). Наличие этой несовершенной стадии клеток в большом количестве ассоциируется с нейтрофилией (отклонение ядра или кривой Арнета влево). Указывает на увеличение гранулопоэза, часто вследствие роста фагоцитоза в периферической ткани, например, при остром гнойном воспалении.
| Фото 20. Оценка лейкоцитов. Молодой нейтрофильный полинуклеар, или «band form»: его ядро находится в состоянии гипосегментации и имеет форму земляного ореха. Эритроцитарный анизоцитоз также может быть отмечен. |
- Другие группы лейкоцитов также могут изменяться, что имеет следующее объяснение: лимфоциты не проявляют признаков токсичности, но реагируют при стимуляции антигеном инфекционного агента, а также при иммунном или неопластическом процессе. Эти реактивные лимфоциты, или «иммуноциты» характеризуются увеличенным размером и выраженной базофилией. Другие модификации, например азурофильные цитоплазматические включения, также могут быть обнаружены в лимфоцитах, которые называют «зернистыми лимфоцитами» (фото 21). Их наблюдают в циркулирующей крови при неспецифической стимуляции иммунной системы (вирусные заболевания, недавно проведенная вакцинация), а также в случае новообразований и некоторых хронических нарушений (эрлихиоз). Эти активированные клетки относятся NK (естественным киллерам).
| Фото 21. Оценка лейкоцитов. Следует отметить наличие лимфоцита в состоянии зернистости, который содержит азурофильные включения в цитоплазме. |
- Лейкоцитарные включения встречаются крайне редко. Они относятся к морулам эрлихоза собак (Ehrlichia canis) в моноцитах и телам Лентза при заболевании чумой, которые включаются в лимфоциты, моноциты и нейтрофильные гранулоциты.
- Наличие эритрофагоцитов (моноциты, которые фагоцитируют эритроциты) можно наблюдать при гемолизе иммунной экстрацеллюлярной природы, например при бабезиозе.
Клиницист, располагающий автоматическим оборудованием для анализа крови, которое позволяет получить результаты на период консультации, имеет большие преимущества. Тем не менее, рекомендуется проводить дополнительные исследования мазка крови для того, чтобы оценить и объяснить аномалии системных нарушений.
Приложение 4. Основные положения
Высушивание мазков крови осуществляется на свежем воздухе, без теплового источника, который может вызвать наличие артефактов, которые мешают оценке морфологического статуса клеток крови.
Макроскопическая агглютинация является физиологичной у кошки. У собаки она может соответствовать как формированию монетных столбиков, так и микроскопической агглютинации, часто возникающей при гемолитической анемии.
Необходимо уточнить наличие тромбоцитопении, определяемой при использовании автоматизированного исследования, с помощью внимательного исследования мазков, чтобы выявить скопления тромбоцитов, ответственных за псевдотромбоцитопению.
Присутствие полихроматофилов, наличие эритроцитарного анизоцитоза и Телец Гавела-Жоли на мазке крови являются симптомом регенеративной анемии.
В случае присутствия повышенного содержания активированных лимфоцитов необходимо вести систематический поиск персистенции хронического воспаления.
СВМ 5/2004