1.Что такое трансплантация сердца?
Трансплантация сердца
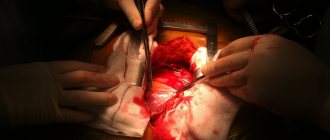
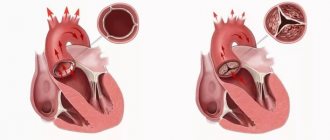
– процедура, при которой хирург удаляет сердце пациента и замещает его донорским. Во время операции механический насос заставляет кровь циркулировать по телу, в то время как хирург занимается пересадкой здорового сердца от недавно умершего донора.
Хирург присоединяет донорское сердце к основным кровеносным сосудам и подключает к нему провода, которые будут временно контролировать сердцебиение. Вся процедура занимает несколько часов.
Чтобы предотвратить отторжение донорского сердца, хирург даёт пациенту сильные медикаменты (иммунодепрессанты) сразу после операции. Подобные препараты пациенту будет необходимо принимать еще некоторое время.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
2.Реабилитация после операции
Что ожидать после операции по пересадке сердца?
После операции по пересадке сердца процесс восстановления
схож с другими операциями на сердце.
Скорее всего, вы проведёте пару недель в больнице. В некоторых случаях вам понадобиться больше времени в зависимости от того, как будет оценено состояние вашего здоровья и будут ли осложнения после операции. В больнице вы начнёте программу реабилитации при болезнях сердца
. Ваши лечащие врачи будут проверять, приживается ли донорское сердце в вашем организме.
Реабилитация после пересадки сердца
Программа реабилитации поможет вам восстановиться после пересадки сердца и вновь стать активным.
Донорское сердце может реагировать на нагрузку по-разному. Пульс не будет расти так, как раньше. Сердцебиение будет приходить в норму также по-другому. Это происходит потому, что некоторые нервные связи, отвечавшие за контроль сердца, были разрезаны в ходе операции.
Посетите нашу страницу Кардиология
3.Показания к операции по пересадке сердца
Операция по пересадке сердца проводится тогда, когда сердце перестаёт работать и пациент находится на грани жизни и смерти. Трансплантация сердца также проводится, если у пациента серьёзная болезнь сердца и наилучшие прогнозы на выздоровление даёт только операция. Пациенту может быть рекомендована пересадка сердца, если у него:
- Терминальная стадия сердечной недостаточности, ишемическая болезнь сердца, кардиомиопатия или врожденный порок сердца.
- Низкие шансы прожить дольше оного года без пересадки сердца.
- Отсутствие любых других серьёзных медицинских причин, снижающих продолжительность жизни.
- Если лечащий врач считает, что пересадка сердца увеличит продолжительность и качество жизни.
В некоторых медицинских центрах кандидаты на пересадку сердца должны представить доказательства того, что они отказались от курения и/или не злоупотребляют алкоголем продолжительное время (4-6 месяцев), перед тем как их поставят в очередь на трансплантацию.
О нашей клинике м. Чистые пруды Страница Мединтерком!
Послеоперационный период
Этот период можно условно разделить на 4 периода.
- Реанимационный период – длится примерно десять дней. Здесь пациенту проводят интенсивную терапию, направленную на предотвращение отторжения чужеродного органа, на купирование любых других осложнения типа кровотечений, аллергических реакций, скоплений жидкости в перикарде и т. д. В это время пациент очень подвержен любым вирусным, грибковым или бактериальным инфекциям. Задача медицинского персонала предотвратить такое развитие событий.
- Нахождение в больнице – пациенту придется провести в медицинском учреждении не менее 30 дней. В этот период будет разработана индивидуальная схема приема лекарственных препаратов и проведен ряд необходимых исследований.
- Постбольничный период – пациент находится дома, принимает назначенные лекарственные препараты, наблюдается у врачей и постепенно переходит к привычному образу жизни. Это время восстановления может занять около года.
- Четвертый период будет длиться всю остальную жизнь и характеризуется восстановлением частичной работоспособности и возможностью вести довольно активный образ жизни. Человек, перенесший операцию, обязан регулярно проходить обследования, которые позволят следить за процессом работы нового органа и постоянно его поддерживать. Кроме того, категорически необходимо вести абсолютно здоровый образ жизни и соблюдать рекомендуемую врачами диету.
4.Риски при пересадке сердца
Основные риски операции по пересадке сердца включают в себя:
Отторжение донорского сердца.
Чтобы проверить организм пациента, хирурги регулярно проводят биопсию тканей сердца, а также эхокардиографию, электрокардиографию или анализ крови.
Если организм пациента отторгает сердце, то прописываются дополнительные лекарства (иммунодепрессанты или стероиды), которые подавляют иммунную систему, чтобы она приняла донорское сердце. У этих лекарств могут быть побочные эффекты, самые серьёзные из которых – различные инфекции и развитие рака.
Атеросклероз артерий, который мог появиться в донорском сердце
. Обычно это осложнение и одновременно — важный ограничительный фактор, который влияет на продолжительность жизни.
О чём стоит подумать
После пересадки сердца вы должны следовать строгим правилам жизни, в которые входит ежедневный приём лекарств и регулярный медицинский уход. Под медицинским уходом подразумевается постоянные анализы (биопсия) тканей пересаженного сердца в целях предотвращения отторжения.
Кандидаты на пересадку получают сердце в соответствии с датой постановки на учёт и серьёзностью заболевания. Также не стоит забывать о том, что количество донорских органов ограничено.
История вопроса
Успехи трансплантологии связаны с развитием двух независимых сфер медицины: совершенствованием хирургической техники и методов анестезии с одной стороны, и достижениями иммунологии и фармакологии — с другой. Первое обеспечило удачное проведение операций, а второе — благополучное протекание послеоперационного периода.
Первые шаги
Еще в XVI веке итальянский хирург Гаспаро Тальякоцци после ряда неудачных экспериментов с пересадкой кожи от человека к человеку представил публике успешный результат аутотрансплантации (пересадки собственного органа реципиента, в данном случае — кожи). В 1596 году он описал свои наблюдения «силы и мощи индивидуальности» в труде «De Curtorum Chirurgia per Insitionem» (Замещающая хирургия с использованием пересадки).
Однако широкий интерес идея трансплантации органов вызвала лишь спустя 300 лет, когда хирурги массово приступили к практическим опытам. Вновь столкнувшись с проблемой отторжения, они обогатили медицину тремя важными выводами: межвидовые пересадки органов (ксенотрансплантации) всегда неуспешны; пересадки между представителями одного вида (аллогенетические трансплантации) в большинстве случаев тоже, причем повторные пересадки органов между одними и теми же донорами и реципиентами ускоряли отторжение; если между донором и реципиентом было кровное родство, вероятность благоприятного исхода операции значительно увеличивалась, причем пересадка собственных органов (аутотрансплантация) почти всегда были удачна.
Первая описанная в литературе успешная трансплантация датируется II веком нашей эры: индийский хирург Шушрата произвел пересадку кожи в ходе ринопластики.
А в III веке, если верить хроникам римской католической церкви, святые Дамиан и Косма пересадили потерявшему ногу от гангрены римскому дьякону Юстиниану конечность недавно умершего эфиопа.
Собачье сердце
В 1905 году в череде опытов по пересадке органов очередь дошла и до сердца. Первую трансплантацию сердца собаки-донора на сосуды шеи собаки-реципиента осуществили хирург, биолог и патофизиолог Алексис Каррель и физиолог Шарль Гатри, американцы французского происхождения. Донорское сердце проработало 2 часа.
В 1933 году американский физиолог Фрэнк Манн с коллегами повторил опыт Карреля и показал возможность функционирования гетеротопически (то есть размещенного в нетипичном месте) трансплантированного сердца собаки вплоть до 8 суток (собственное сердце собаки оставалось на месте и продолжало работать).
В ногу со временем шли и советские хирурги. Наиболее весомый вклад в экспериментальные основы трансплантации сердца в СССР внес Владимир Петрович Демихов. С 1946 по 1955 год он в нескольких сотнях экспериментов разработал 24 (!) варианта хирургической техники гетеротопической трансплантации сердца в грудную клетку. В некоторых опытах донорское сердце эффективно обеспечивало кровообращение собаки-реципиента в течение более чем 15 часов.
Борьба с ишемией
Самой явной проблемой, вставшей на пути хирургов, стала ишемия: в условиях недостаточного кровотока повреждались и ткани реципиента, и донорские сердца. Трансплантацию невозможно провести в сжатые сроки, поэтому хирурги и анестезиологи стали искать способы, позволяющие продлить время операции. Так были разработаны методы управляемой гипотермии и спроектированы аппараты искусственного кровообращения (ИК).
Управляемая гипотермия позволяет снизить кровопотерю, а также продлить время операции без повышения риска ишемизации тканей.
В 1953 году американские хирурги Уилфорд Нептун и Брайан Куксон с коллегами выполнили первую трансплантацию сердечно-легочного комплекса собаки в условиях глубокой гипотермии (во время операции в комнате поддерживалась температура порядка минус 4 °С).
В 1957 году американцы Уильям Вебб и Хизер Говард повторили этот эксперимент, подключив собаку-реципиента к аппарату ИК. Позднее они сообщили о пересадке в тех же условиях изолированного сердца. Они накладывали девять анастомозов между аортой, легочной артерией, легочной и полой венами. Правда, этот трансплантат профункционировал всего 7 часов.
К середине 60-х Норман Шумуэй и Ричард Лоуэр с коллегами из клиники при Стэнфордском университете разработали методику трансплантации сердца, которая используется по сей день: с использованием «локальной гипотермии» — местного охлаждения до 18–21 °С. С этого момента для успешного проведения операции осталось только одно препятствие — иммунологическое отторжение.
Причины отторжения
В 1952 году иммунологи Жан Доссе (Франция) и Барух Бенасерраф (США) вместе с генетиком Джорджем Снеллом (США) обнаружили, что важнейшие антигены, участвующие в отторжении трансплантата, – антигены главного комплекса гистосовместимости (HLA). За это открытие в 1980 году они были удостоены Нобелевской премии.
Существует порядка 150 вариантов антигенов HLA, и у каждого человека на мембранах клеток присутствует по шесть вариантов таких антигенов. Следовательно, возможно более триллиона их комбинаций – вероятность существования двух людей с одинаковыми комплексами HLA-антигенов близка к нулю, конечно, если они не однояйцевые близнецы. Идеально, если у донора и реципиента наблюдается несовпадение лишь одного антигена из шести. Операции проводят и в том случае, если не совпадают два, однако при этом увеличивается риск развития иммунологического отторжения.
На практике определение совместимости тканей — гистотипирование — осуществляется по лимфоцитам крови.
Со стороны «хозяина» основные эффекторы трансплантационного отторжения – это цитотоксические CD8 T-клетки и CD4 Т-клетки. Последние привлекают в зону отторжения трансплантата клетки воспаления (в том числе макрофаги). Распознание трансплантационных антигенов происходит либо непосредственно на клетках трансплантата, либо в ближайшей лимфоидной ткани.
Немалую роль в отторжении трансплантата могут сыграть и антитела в организме реципиента (например, появившиеся из-за предшествующего переливания цельной крови). Взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, они инициируют систему комплемента и каскад реакций, приводящий к закупорке сосудов.
Иммуносупрессия
Первыми веществами, которые начали использовать для подавления иммунного ответа, стали кортикостероиды.
В 1948 году американский врач Филип Хенч, применив кортизон в лечении ревматоидного артрита, показал, что препарат обладает выраженным противовоспалительным действием. В 1952 году американский хирург Роджер Бэйкер с коллегами продемонстрировал, что кортизон может использоваться и для иммуносупрессии после трансплантации.
В 1962 году американцы Уиллард Гудвин и Мэтт Мимс впервые использовали азатиоприн — иммуносупрессивный препарат, обладающий наибольшей активностью в отношении Т-лимфоцитов, для предотвращения острого отторжения трансплантированной почки. Пациентам с пересаженным сердцем также планировалось назначать азатиоприн в сочетании с кортикостероидами.
Очередь человека
Человеку сердце было впервые пересажено в 1964 году. Джеймс Харди с коллегами трансплантировали сердце крупного шимпанзе, весившего более 43 кг, больному 68 лет с тяжелой формой ИБС в терминальной стадии прогрессирующей сердечной недостаточности. Вначале трансплантат работал удовлетворительно, однако через час после отключения аппарата ИК развилась острая сердечная недостаточность, обусловленная объемной перегрузкой трансплантата, и больной погиб.
Первая аллогенетическая трансплантация сердца человеку была проведена три года спустя в Кейптауне южноафриканским хирургом Кристианом Барнардом, прошедшим стажировку под руководством Нормана Шумуэя. Бригада доктора Барнарда пересадила сердце 25-летней девушки, погибшей в автомобильной аварии, 55-летнему диабетику, перенесшему три инфаркта и страдавшему от застойной сердечной недостаточности. Трансплантация прошла удачно, но на 18-е сутки после операции пациент умер от двусторонней пневмонии. Через месяц в этой же клинике была выполнена вторая трансплантация донорского сердца, после которой реципиент прожил полтора года, умерев от хронического отторжения.
В СССР первая успешная трансплантация сердца была осуществлена в 1987 году знаменитым врачом-трансплантологом академиком АМН СССР Валерием Ивановичем Шумаковым (1931–2008).
Успех первого клинического опыта увлек медицинское сообщество, и к решению задачи трансплантации сердца обратились хирурги всего мира. Однако большинство пациентов умирало вскоре после проведения операции, и интерес исследователей начал угасать: если в 1968 году было проведено 100 трансплантаций сердца, то в 1970 — всего 18. Главной причиной смерти оставалось отторжение пересаженных органов.
Лишь четверо из прооперированных в период с 1967 по 1973 год прожили с новым сердцем дольше года; с 1974 по 1983 год годичная выживаемость увеличилась до 60 %, а вот пятилетняя составила лишь 21 %.
Иммунологи и фармакологи берутся за дело
В 1983 году увенчались успехом клинические исследования нового иммуносупрессора — циклоспорина, нерибосомного полипептида, получаемого из почвенных грибов вида Beauveria nivea. Его выделили в 1970 году в рамках программы по скринингу новых антибиотиков. В 1972 году бельгийский иммунолог Жан-Франсуа Борель открыл способность циклоспорина ингибировать культуру лимфоцитов при отсутствии общего цитостатического эффекта. В конце 70-х британский хирург Рой Калне провел первые испытания эффективности циклоспорина после трансплантации сердца и почек на экспериментальных животных. Его внедрение в широкую практику открыло новую эру в трансплантации сердца, поскольку позволило значительно продлить жизнь пациентов после трансплантации. В 1994 году было одобрено использование для послеоперационной терапии еще одного нового иммуносупрессора — такролимуса (FK-506) из группы макролидов, продуцируемого актиномицетом Streptomyces tsukubaensis. В 1987 году японские иммунологи Шиничи Савада и Джен Судзуки в экспериментах in vitro обнаружили, что такролимус в 100 раз активнее циклоспорина подавляет пролиферацию Т-лимфоцитов. В исследованиях на крысах, собаках и приматах, проводившихся с 1988 по 1993 год, такролимус обеспечивал профилактику отторжения трансплантата в дозах в 10–100 раз более низких, чем циклоспорин, и с меньшим количеством побочных эффектов. Впрочем, модификации циклоспорина, разработанные в то же время, обладали аналогичными преимуществами.
Последние успехи иммуносупрессии связаны с поли- и моноклональными антителами (подробно об этом мы рассказывали в КС № 5 (118) 2013, статья «Достижения фармацевтики: моноклональные антитела»), позволяющими предотвратить стероид-резистентное — не купируемое даже пульс-терапией метилпреднизолоном — отторжение тканей, которое встречается с частотой 10–18 %.
В настоящее время используется трехкомпонентная схема иммуносупрессивной терапии: циклоспорин А или такролимус в сочетании с метилпреднизолоном и микофенолата мофетилом (цитостатиком, который наиболее эффективен в отношении лимфоцитов). Препараты антилимфоцитарных антител (ALG, ATG, ОКТ-3) применяются в качестве вводной терапии, а также при выраженных признаках отторжения или стероид-резистентном отторжении.