Коронарная ангиография не всегда позволяет выявить стеноз коронарных сосудов сердца
Коронарная ангиография не всегда позволяет выявить стеноз коронарных сосудов сердца
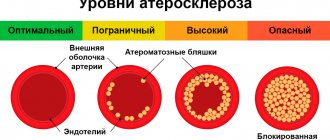
Стеноз коронарных сосудов сердца – это достаточно распространенное заболевание — оно встречается в 30-40% случаях обращения к кардиологу. Последствиями стеноза являются сердечная недостаточность, развитие ишемической болезни сердца, инфаркт миокарда и тромбоз. В запущенном случае заболевание повышает вероятность развития расслаивающей аневризмы, которая может привести к внутреннему кровотечению. При отсутствии адекватной медикаментозной терапии наступает летальный исход.
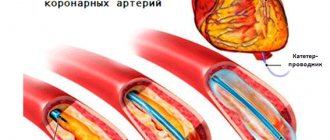
«Золотым стандартом» выявления стенозов коронарных артерий по – прежнему является коронарная ангиография (КАГ), но и этот метод имеет свои ограничения.
Для примера можно привести историю болезни пациентки 58 лет, с гипертонической болезнью в анамнезе, которая обратилась в клинику Медсервис. До этого она была госпитализирована в стационар с болевым синдромом в грудной клетке.
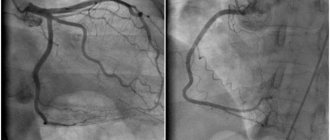
На основании результатов электрокардиограммы, клинических и лабораторных данных был выставлен диагноз инфаркта миокарда (без зубца q). Была выполнена коронарная ангиография, где гемодинамически значимых стенозов не выявлено.
Через месяц после госпитализации, при динамическом наблюдении в клинике «Медсервис», пациентка прошла эхокардиографию (ЭхоКГ — ультразвуковое исследование сердца) с оценкой сократимости миокарда и коронарных артерий. При отсутствии явных визуальных нарушений сократимости, при оценке деформации миокарда методом анализа функции левого желудочка (АФЛЖ) выявлена зона сегментарных нарушений в передне- перегородочной стенке сердца, а также небольшое ускорение кровотока в среднем сегменте передней межжелудочковой ветви (ПМЖВ). Пациентка проходила лечение.
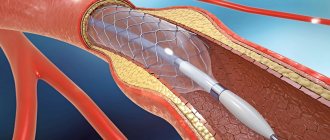
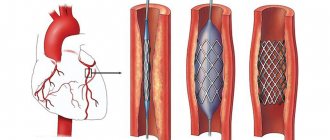
При повторном прохождении коронарной ангиографии гемодинамически значимых сужений не выявлено. Но при внутрисосудистом ультразвуковом исследовании выявлен протяженный гемодинамически значимый стеноз ПМЖВ (75%, протяженность 25мм). Пациентке выполнено стентирование пораженного участка.
В настоящее время пациентка по-прежнему регулярно наблюдается в клинике «Медсрвис». Стенокардии не о АФЛЖ участок нарушенной сократимости имеется, но его площадь уменьшилась. Ультразвуковые исследования коронарных артерий показали, что кровоток в передней межжелудочковой ветви нормальный.
Таким образом, использование всех доступных методов в диагностике и лечении больных с ИБС, обычно дает полное представление о пациенте и помогает правильному лечению.
В статье представлены клинико-диагностические критерии гемодинамически значимого артериального протока у недоношенных детей, а также современные подходы его коррекции.
Hemodynamically significant patent ductus arteriosus in preterm infants
The article presents the clinical diagnostic criteria for hemodynamically significant ductus arteriosus in preterm infants, as well as modern approaches to correction.
Открытый артериальный проток (dustus arteriosus, боталлов проток) — сосуд, соединяющий аорту и легочную артерию, сохранивший нормальную для плода структуру после истечения срока его закрытия. ОАП является одним из наиболее распространенных пороков: по клиническим данным, частота его составляет 10-18% от всех ВПС. Длительно (в течение нескольких недель) функционирующий артериальный проток у недоно-шенных детей, как правило, является признаком морфо-функциональной незрелости сердечно-сосудистой системы [2, 6]. Случаи, при которых его функционирование сопровождается заметными (регистрируемыми при помощи клинико-инструментальных методов) нарушениями центральной и региональной гемодинамики принято обозначать термином гемодинамически значимый функционирующий артериальный проток (ГЗ ФАП) [1, 4]. Вероятность его продолжительного функционирования тем больше, чем меньше гестационный возраст ребенка, его масса тела и чем тяжелее состояние новорожденного. По данным допплеровской эхокардиографии, у доношенных детей в первые сутки жизни артериальный проток полностью спадается в 50% случаев, на вторые сутки — в 90%, а к 96 ч. жизни он не определяется ни у кого. При массе тела, равной 1500-2000 г, к этому возрасту ОАП сохраняется у 7% детей, при массе тела от 1000 до 1500 г — у 21% и менее 1000 г — у 42% новорожденных[3]. У недоношенных детей с массой тела менее 1200 г, требующих интенсивной терапии, проток остается открытым в 85% случаев. По некоторым данным, вне зависимости от гестационного возраста, ФАП осложняет 35% длительных ИВЛ у новорожденных [8].
ОАП после рождения закрывается под влиянием кислорода. Однако при гипоксии или гипероксии в крови увеличивается количество активных кислородных радикалов, стимулирующих накопление в легких проста-гландина Е, который расслабляет мышцы артериального протока, и он остается открытым. Из-за разницы давления в аорте и легочной артерии развивается сброс крови из большого круга кровообращения в малый, т.е. лево-правый шунт. Из-за меньшей растяжимости миокарда у незрелых детей, особенно на фоне относительно больших объемов внутривенно вводимой жидкости резко повышается конечное диастолическое давление в левых предсердии и желудочке. Вторично возрастает легочное венозное давление, что вызывает застой в легких или застойную легочную гипертензию. Отсюда, чем меньше гестационный возраст ребенка, тем быстрее возникает у него сердечная недостаточность, но тем ниже у него и градиент давления между легочной артерией и аортой и меньше величина лево-правого шунта. При широком артериальном протоке во время диастолы через него осуществляется ретроградный ток в аорте и мозговых сосудах, что может, с одной стороны, приводить к ишемии мозга и внутримозговым кровоизлияниям, а с другой стороны, снижать перфузионное давление и кровоток в тканях [1, 4, 6]. Основными антенатальными факторами, способствующими ФАП, являются: недоношенность, пренатальное применение нестероидных противовоспалительных средств, применение энзапростала в родах, отсутствие антенатальной профилактики РДС. В поснатальном периоде причинами ФАП могут быть асфиксия при рождении, РДС, применение сурфактанта, пневмоторакс, анемия, избыточная инфузионная терапия, фототерапия (транзиторный вазодилатирующий эффект, ослабляющий первичную констрикцию артериального протока) [1].
В зависимости от сроков клинических проявлений осложнения ГЗ ФАП можно подразделить на ранние (в первые семь дней после рождения) и поздние (на 2-й — 4-й неделях жизни).
Ранние осложнения: усугубление тяжести РДС на фоне адекватной респираторной терапии, развитие внутрижелудочковых кровоизлияний, легочное кровотечение, развитие энтероколита, артериальная гипотония, снижение диуреза, метаболический или смешанный ацидоз [4, 6].
К поздним осложнениям относится появление классических признаков застойной сердечной недостаточности. Рядом исследователей показано, что ГЗ ФАП является фактором, увеличивающим риск развития бронхолегочной дисплазии и ретинопатии недоношенных [3, 4]. Не исключена его роль в развитии перивентрикулярной лейкомаляции [1].
Для исключения ГЗ ФАП проводится клиническое обследование и инструментальное (рентгенологическое и эхокардиографическое).
- Клиническими признаками ФАП являются усиленный сердечный толчок, систолический шум во 2-3-м межреберье слева от грудины, скачущий пульс, сниженное диастолическое давление, снижение диуреза, метаболический ацидоз, кровянистое отделяемое из трахеи, увеличение печени [1, 5].
- Рентгенологическое обследование является вспомогательным методом. Диагностически значимые признаки на рентгенограмме грудной клетки: усиление сосудистого рисунка, увеличение левого предсердия и левого желудочка, подчеркнутость междолевой плевры.
- Эхокардиография и допплерография являются наиболее объективными методами диагностики ГЗ ФАП. ЭХО-КГ признаки гемодинамически значимого лево-правого шунтирования крови у недоношенных проявляются на 1-7-й день (в среднем — на 2-3 дня) раньше клинических [1, 6].
Показаниями для проведения новорожденным ЭХО-КГ в течение первых 48 часов после рождения являются: срок гестации менее 30 недель, а также срок гестации 31-34 недели, если ребенку проводится ИВЛ, вводился сурфактант, развилось легочное кровотечение [1]. Повторное исследование проводится через 48 часов после предыдущего, если у недоношенного отмечается: увеличение потребности в кислороде или «ужесточение» параметров вентиляции, развитие смешанного/метаболического ацидоза, инфекционный токсикоз, появление систолического шума [5, 6].
Основные критерии гемодинамической значимости ОАП:
- Диаметр артериального протока более 1,5 мм у новорожденных весом < 1500 г или более 1,4 мм/кг у новорожденных весом > 1500 г
- Наличие лево-правого шунтирования крови по протоку
- Наличие ретроградного кровотока в постдуктальной аорте, составляющего > 50% антеградного кровотока
Дополнительные критерии гемодинамической значимости ОАП:
- Отношение размера левого предсердия к корню аорты (LA/Ao) > 1,4
- Диастолическая скорость кровотока в легочной артерии > 0,2 m/s
- Отношение сердечного выброса левого желудочка к кровотоку в верхней полой вене (LVO/SVC) > 4
- Отношение конечного диастолического размера левого желудочка к корню аорты (LV/Ao) > 2,1
- Индекс сосудистой резистентности (IR) в передней мозговой артерии > 0,8
- Наличие диастолического обкрадывания или антеградного кровотока в почечной и/или мезентериальной артериях (IR) = 1,0)
Открытый артериальный проток можно считать гемодинамически значимым, если имеются все основные критерии и один из дополнительных [1, 5].
Более чем у 50% недоношенных с массой тела менее 1000 г неоспоримо требуется закрытие ГЗ ФАП. Существует медикаментозный и хирургический методы коррекции, однако сохраняется неопределенность относительно сроков и методов этого лечения:
1. Медикаментозное лечение основано на подавлении синтеза простагландинов — одного из основных факторов, поддерживающих проток открытым. С этой целью используют внутривенное введение нестероидных противовоспалительных препаратов — ингибиторов циклоксигеназы (индометацин, ибупрофен) [7].
Обязательными условиями для их применения являются: проведение курса лечения в первые 3-4 дня жизни, не позднее 7 дней жизни, возможность мониторинга витальных функций. Основными побочными эффектами препарата являются нарушение функции тромбоцитов, гипербилирубинемия (вытеснение билирубина из комплекса с альбумином) и почечные дисфункции (блокада синтеза простагландинов в почках), поэтому противопоказаниями к его применению считают гипербилирубинемию более 200 мкмоль/л, ΟΠΗ и геморрагический синдром. Для профилактики олигурии индометацин рекомендуют применять с фуросемидом (5 мг/кг) или допамином (3-4 мкг/(кг · мин) [8].
2. Хирургическая перевязка ОАП показана при отсутствии эффекта от 2-кратного применения медикаментозной терапии, при широком артериальном протоке с затянувшейся пневмонией и у детей старше 3 недель. Непосредственные показания формулируют по прогрессивно нарастающему РаСо2 до 60 мм рт. ст., растущей потребности в увеличении Fio2 для поддержания Ро2 выше 80% и ИВЛ более 7-9 сут. Оптимальный срок лигирования артериального протока — вторая неделя жизни [4].
Таким образом, гемодинамически значимый ФАП остается острой проблемой в выхаживании и лечении недоношенных детей. Своевременная диагностика и рациональная терапия имеют огромное влияние на прогноз жизни и здоровья таких детей.
Е.В. Волянюк
Казанская государственная медицинская академия
Волянюк Елена Валерьевна — кандидат медицинских наук, ассистент кафедры педиатрии и неонатологии
Литература:
1. Дегтярев Д.Н., Крючко Д.С., Феоктистова Е.В. Тактика ведения недоношенных детей с гемодинамически значимым функционирующим артериальным протоком. Проект методических рекомендаций. Москва, РАСПМ, 2009. — 22 с.
2. Прахов А.В. Неонатальная кардиология. Н. Новгород: Изд-во Нижегородской гос. мед. академии, 2008. — 388 с.
3. Прахов А.В., Гапоненко В.А., Игнашина Е.Г. Болезни сердца плода и новорожденного ребенка. Н. Новгород: Изд-во Нижегородской гос. мед. академии, 2001. — 188 с.
4. Разумовский А.Ю., Лужина М.Ю., Феоктистова Е.В. Гемодинамически значимый открытый артериальный проток у новорожденных с низкой массой тела: взгляд хирурга. Москва, Вопросы практической педиатрии, 2007. — Т. 2, № 1. — С. 27-32.
5. Виноградова И.В., Краснов М.В., Иванова Н.Н. Особенности состояния сердечно-сосудистой системы у новорожденных с экстремально низкой массой тела. Медицинский альманах. — 2009 г. № 4, — С. 103-106.
6. Дегтярев Д.Н., Малышева Е.В., Вакуева Т.И. Особенности постнатальной адаптации недоношенных детей с сочетанной перинатальной патологией, осложненной наличием гемодинамически значимого функционирующего артериального протока. Вопросы практической педиатрии, 2006. 1 (1): С. — 16-20.
7. Markus Sperandio et al. Effectiveness and Side Effects of an Escalating, Stepwise Approach to Indomethacin Treatment for Symptomatic Patent Ductus Arteriosus in Premature Infants Below 33 Weeks of Gestation, Pediatrics. December 2005; 116: 1361-1366.
8. Bacalari E., Claure A., Consalos A. Patent ductus arteriosus and respiratory outcome in premature infants. Biol Neonate 2005; 88, 192-201.