Причины стеноза коронарных артерий
Основная причина стеноза – атеросклероз, при котором на стенках сосудов скапливаются холестериновые отложения, постепенно образующие бляшки, закупоривающие просвет.
Также в число провоцирующих факторов входят:
- аномалии развития коронарных сосудов (извилистость, неправильное расположение);
- кардиомиопатии;
- эндартериит;
- системные заболевания (васкулиты, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли;
- трансплантация сердца.
Повышают риск сужения сосудов:
- наследственная предрасположенность;
- гипертония;
- сахарный диабет;
- патологии щитовидной железы;
- лишний вес;
- малоподвижный образ жизни;
- курение;
- частые стрессы;
- пожилой возраст.
Стенозы в онкологии
Злокачественные опухоли нередко перекрывают просвет полых органов, нарушая их функции. При этом состояние больного всегда значительно ухудшается, прогноз становится более серьезным. Если радикальная операция по поводу злокачественного новообразования невозможна, то врач проводит паллиативное хирургическое вмешательство, чтобы устранить стеноз, восстановить функции органа, улучшить состояние больного.
Состояние больного улучшается, когда начинается распад опухоли – она больше не перекрывает просвет органа. Опухоль распадается под действием химиотерапии, реже – самостоятельно. Вещества, которые выделяются в кровь во время массивного распада опухолевых клеток, отравляют организм и способны приводить к тяжелым осложнениям.
Симптомы стеноза коронарных артерий
Основной признак сужения коронарных артерий – дискомфорт, жжение и болевые ощущения в области сердца, возникающие при физических и эмоциональных нагрузках. Возможны жгучие боли длительностью от 30 секунд до 10 минут, ирраидиирующие в лопатку и левую руку.
Клинические проявления могут включать:
- приступы головокружений;
- учащение сердцебиения;
- нарушение сердечного ритма;
- повышение давления;
- одышку;
- слабость.
В некоторых случаях болезнь длительное время протекает бессимптомно и проявляет себя только при полной закупорке сосуда тромбом либо атеросклеротической бляшкой, что причиняет ишемию и инфаркт миокарда. Именно инфаркт является основной причиной смерти (90%) от сердечных заболеваний.
Обычно сердце испытывает кислородное голодание при перекрытии просвета на 51%. Если же артерия сужается на 75%, то любые физические нагрузки могут причинить инфаркт, сопровождающийся некрозом сердечных тканей. Но в связи с индивидуальными особенностями организма одни люди ощущают ухудшение состояние уже при 44%, а другие не замечают изменений даже при сужении на 75%.
Профилактика стеноза шейного отдела
Для предотвращения развития заболевания следует использовать профилактические мероприятия:
- разминание шеи — исключение гиподинамии;
- ЛФК;
- правильная осанка, в том числе во время работы за компьютером;
- правильное питание;
- при необходимости своевременное обращение к специалисту.
Отзывы пациентов говорят о том, что при обращении в медицинское учреждение на ранних стадиях в течение 6-12 недель болевой синдром у большинства из них исчезает. В запущенных случаях, как правило, стеноз позвоночной артерии шейного отдела требует стационарного лечения в течение длительного времени.
Диагностика стеноза коронарных артерий
Чтобы определить степень повреждений, врач направляет пациента на диагностическое обследование:
- биохимический анализ крови;
- анализ крови на содержание холестерина и глюкозы;
- нагрузочные тесты (тредмил-тест, велоэргометрию);
- стресс-ЭхоКГ;
- электрокардиографию;
- суточное мониторирование по Холтеру;
- ультразвуковое исследование сердца и сосудов;
- коронарную ангиографию;
- компьютерную или магнитно-резонансную томографию грудной области.
Особенности диагностики
Врач начинает с беседы с пациентом, в ходе которой выясняет:
- жалобы на момент обращения;
- предрасполагающие к заболеванию факторы;
- перенесенные ранее заболевания.
Для врача важно положение тела, которое вынужден принимать пациент, он пальпирует позвоночник с целью определения пораженного отдела.
Пациенту назначают дополнительное обследование:
- рентген позвоночника в двух проекциях для определения костных наростов, выявления разрушенных и сросшихся позвонков, нарушения структуры суставов, наличия новообразований, определения их размера, расположения и структуры;
- КТ позвоночника, чтобы найти причину развития болезни с учетом мельчайших изменений;
- МРТ (при отсутствии противопоказаний), чтобы обнаружить изменения хрящей, нервов и сосудов;
- миелограмма, чтобы найти изменения структуры спинного мозга, проходимости канала и состояния спинномозговой жидкости.
Лечение стеноза коронарных артерий
Метод терапии врач подбирает в зависимости от степени развития патологических изменений, причины стеноза, наличия сопутствующих заболеваний, возраста и общего состояния здоровья пациента.
Консервативное лечение включает:
- медикаментозную терапию (лекарственные препараты врач подбирает индивидуально);
- диетотерапию;
- изменение образа жизни (отказ от вредных привычек, умеренные физические нагрузки).
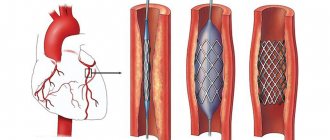
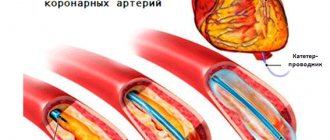
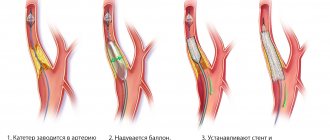
В тяжелых случаях показано хирургическое вмешательство. Обычно выполняют стентирование (расширяют сосуд баллончиком и закрепляют стентом) или шунтирование (создают обходной путь для кровотока).
Прием (осмотр, консультация) врача-сердечно-сосудистого хирурга первичный
1850 руб
Записаться
Почему возникает шейный стеноз?
Стеноз позвоночного канала шейного отдела развивается по нескольким причинам:
- Перелом позвоночника со сдавлением позвонков (компрессионный);
- Врожденные патологические изменения в строении позвонков;
- Воспалительные заболевания позвоночника;
- Болезнь Бехтерева;
- Опухолевые процессы;
- Грыжа межпозвоночного диска;
- Хронические заболевания суставных поверхностей позвоночника;
- Спайки после операции;
- Избыточный вес;
- Смещение межпозвоночного диска;
- Костные разрастания и остеофиты;
- Нарушение строения задней желтой связки;
- Остеохондроз.
Стеноз сосудов шеи развивается вследствие уменьшения полости, где находится спинной мозг, нервы и сосуды позвоночника. Сначала жалобы возникают при определенных поворотах и наклонах, затем нарушается кровоток и положение усугубляется.
Со временем давление спинномозговой жидкости повышается, провоцируя застойные и воспалительные процессы.
Одним из самых опасных морфологических субстратов ишемической болезни сердца (ИБС) является атеросклеротическое поражение ствола левой коронарной артерии (СЛКА). Гемодинамически значимое поражение СЛКА встречается в 6-11% случаев [3]. Однако изолированный устьевой стеноз СЛКА, по данным литературы [2], наблюдается менее чем у 1% пациентов и сопровождается неблагоприятным прогнозом для жизни. Летальность при консервативном лечении достигает 35% в течение 4 лет и 56% за 6 лет наблюдения [7]. Безусловно, единственно возможным методом лечения данного вида поражения коронарного русла является хирургическое вмешательство [4]. В настоящий момент существует несколько способов реваскуляризации миокарда при стенозе СЛКА. Основным и наиболее распространенным способом является аортокоронарное шунтирование (АКШ). Это «золотой стандарт» лечения подобного типа поражения. Однако наряду с шунтирующими операциями также применяются методики прямых реконструкций при локальном поражении СЛКА. К таким операциям относятся: эндартерэктомия и пластика СЛКА. Подобные вмешательства выполняют в мире уже на протяжении 25 лет. Если эндартерэктомия в виду сложности и неопределенности прогноза постепенно утратила свое значение, то пластика СЛКА заплатой из ксено- или обработанного аутоперикарда применяется и имеет очень хорошие как непосредственные, так и отдаленные результаты [1, 5, 6, 8, 9].
В связи с бурным развитием в течение последних лет интервенционной кардиологии активно практикуются методики эндоваскулярной ангиопластики стеноза СЛКА. Однако, несмотря на постоянно совершенствуемые стенты, пока не удается добиться надежного долгосрочного результата подобных вмешательств. Последние сообщения указывают на сохраняющийся высокий риск рестеноза и возврата стенокардии в отдаленном периоде. Поэтому на данный момент можно сказать, что поиск оптимальных способов выполнения реваскуляризации миокарда при различных анатомических вариантах поражения СЛКА продолжается.
Мы представляем случай непосредственного шунтирования СЛКА правой внутренней грудной артерией.
Пациент Х.
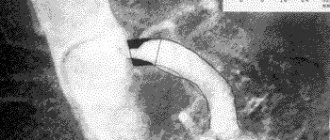
, 55 лет, поступил в клинику с жалобами на одышку и боли давящего характера за грудиной без иррадиации, возникающие при небольшой физической нагрузке (ходьба до 100 м, подъем на 1-й этаж), повышение АД до 200/90 мм рт.ст., учащенное сердцебиение. Коронарный анамнез — 4 года. Обследован: электрокардиограмма (ЭКГ) — синусовый ритм, ЧСС 70 уд/мин, признаки гипертрофии левого желудочка (ЛЖ); эхокардиограмма (ЭхоКГ) — фракция выброса (ФВ) ЛЖ 53-55%, локальная сократимость — без четких зон гипокинеза. Коронароангиография (КАГ): правый тип кровоснабжения, устьевой критический стеноз СЛКА, стеноз 30% правой коронарной артерии в среднем отделе, остальные венечные артерии без гемодинамически значимых сужений (рис. 1).
Рис. 1. Коронароангиография до операции. Стрелкой отмечен стеноз устья левой коронарной артерии.
Учитывая критическое поражение СЛКА, высокий класс стенокардии на фоне медикаментозной терапии, по жизненным показаниям больному выполнена прямая реваскуляризация миокарда. Учитывая изолированное локальное (только устье) поражение и достаточную длину, принято решение о выполнении шунтирования непосредственно самого ствола ЛКА.
Техника операции.
Доступ — срединная стернотомия. Выделена правая внутренняя грудная артерия (ГА) в лоскуте. Начато искусственное кровообращение (ИК) по схеме аорта-правое предсердие. Легочный ствол (ЛС) обойден и взят на держалку. Пережата восходящая аорта (ВА). Ретроградная фармакохолодовая кардиоплегия раствором Кустодиол (1 л). Установлен дренаж ЛЖ через правую верхнюю легочную вену. ВА полностью поперечно пересечена по уровню синотубулярного гребня. Стенка аорты изнутри атеросклеротически изменена, кальцинирована с переходом бляшек на устье ЛКА, которые и создают стеноз (рис. 2). Нижняя полуокружность корня аорты взята на держалки и подтянута вверх и выведена в рану, вследствие чего полностью и широко визуализирован СЛКА (рис. 3). Продольная артериотомия СЛКА на расстоянии 5 мм от устья: артерия дистальнее разреза практически не изменена, просвет проходим для бужа 3,0 мм. Сформирован анастомоз конец в бок с правой внутренней грудной артерией нитью пролен 8/0. Целостность аорты восстановлена обвивным швом нитью пролен 4/0 (рис. 4). Снят зажим с аорты. Ритм сердца восстановился самостоятельно. Стандартное окончание операции. Продолжительность И.К. составила 109 мин, пережатия аорты — 65 мин. Послеоперационный период протекал гладко, приступы стенокардии не рецидивировали. Срок госпитализации — 6 сут. Перед выпиской выполнена контрольная коронарошунтография: анастомоз правой внутренней ГА со СЛКА проходим, гемодинамически значимых препятствий кровотоку не выявлено (рис. 5). Наблюдается в течение 4 лет. Стенокардии нет. Толерантность к физическим нагрузкам высокая.
Рис. 2. Поперечная аортотомия. Атеросклеротическая бляшка, перекрывающая устье левой коронарной артерии, указана стрелкой.
Рис. 3. Мобилизация корня аорты. Нижняя полуокружность корня аорты взята на П-образную держалку, визуализирован ствол ЛКА; ЛКА — левая коронарная артерия; Ао — аорта.
Рис. 4. Схема операции. 1 — ствол левой коронарной артерии; 2 — ствол правой коронарной артерии; 3 — правая внутренняя грудная артерия; 4 — восходящая аорта; 5 — легочный ствол.
Рис. 5. Коронарошунтография на 4-е сутки после операции. Стрелкой отмечен анастомоз между правой внутренней грудной артерией и стволом ЛКА.
На сегодняшний день не существует единой хирургической тактики в отношении лечения пациентов с устьевым поражением СЛКА. Предложены различные методики операций, каждая из которых имеет свои достоинства и недостатки, а их отдаленные результаты продолжают изучаться. Наиболее безопасным и изученным в отдаленном периоде является АКШ ветвей ЛКА. Однако при использовании венозного материала в качестве шунта к бассейну огибающей артерии с течением времени происходит пролиферация интимы с последующим фиброзом и постепенным его закрытием. К тому же отсутствует физиологическая перфузия миокарда проксимальнее анастомозов, так как реализуется только ретроградный кровоток [2-4].
Эндоваскулярные методики привлекательны и малоинвазивны, однако их безопасность при стволовом поражении продолжает обсуждаться. Кроме того, они сомнительны в отношении долгосрочного прогноза и имеют высокий риск развития рестеноза. Более того, стентирование СЛКА не всегда возможно из-за анатомических особенностей строения или характера поражения. Также остается актуальной проблема вмешательства при незащищенном стволе ЛКА.
Реконструктивные операции на СЛКА также привлекательны, так как позволяют восстановить физиологический антеградный кровоток. Данный подход позволяет использовать в дальнейшем эндоваскулярные методики при прогрессировании атеросклероза в дистальных отделах ЛКА, так как формируется достаточно широкое устье СЛКА. К недостаткам можно отнести риск фиброзно-склеротического изменения пластического материала с возможной дальнейшей деформацией и стенозом просвета артерии. Изучение отдаленных результатов использования заплат из аутоперикарда, аутовен или аутоартерий продолжается [3, 4, 6].
При проведении пластических операций на СЛКА большое значение имеет доступ к зоне реконструкции. J. Hitchcock и соавт. [5] используют трансаортальный доступ, при котором аорта пересекается широко поперечно на уровне коронарных артерий с продолжением разреза на устье СЛКА до уровня неизмененной стенки. Ствол легочной артерии при этом берется на держалку и отводится в сторону. J. Villemot и соавт. [9] предлагают дополнительно полностью пересекать легочный ствол, таким образом получая более широкий доступ к СЛКА, его бифуркации и проксимальным отделам передней межжелудочковой и огибающей артерий.
Предложенная нами методика также имеет свои преимущества и ограничения. Ограничение заключается в том, что применять ее возможно только в случае изолированного локального устьевого поражения ЛКА и при отсутствии признаков атеросклероза в передней межжелудочковой и огибающей артериях. Преимущество доступа заключается в использовании лигатур-держалок, которые позволяют значительно развернуть корень аорты в рану и таким образом улучшить экспозицию СЛКА. Также преимуществом можно назвать и относительную простоту выполнения обычного маммарно-коронарного анастомоза. Более того, кондуит из внутренней ГА наиболее долговечен в отдаленном периоде. Наконец, наличие только одного анастомоза, накладываемого наиболее проксимально, сохраняет антеградный физиологический кровоток по коронарным сосудам. Немаловажным моментом является и то, что кондуит находится под аортой. Это значительно упрощает действия хирурга при необходимости какого-либо повторного вмешательства в будущем, сводя к минимуму риск повреждения функционирующего шунта при рестернотомии и кардиолизе. Хороший клинический и ангиографический результат свидетельствует о высокой эффективности примененной нами методики.
На представленную методику в 2015 г. коллектив авторов получил патент на изобретение № 2551187.
Конфликт интересов отсутствует.