Медицинский редактор: Строкина О.А. — терапевт, врач функциональной диагностики. Ноябрь, 2021.
Синдром ранней реполяризации желудочков (СРРЖ) – это медицинское понятие, которое включает в себя только изменения ЭКГ без характерных внешних симптомов. Считается, что СРРЖ – вариант нормы и не представляет угрозы для жизни больного.
Однако в последнее время к этому синдрому стали относиться с настороженностью. Он распространен достаточно широко и встречается в 2-8% случаев у здоровых людей. Чем старше становится человек, тем меньше шансов обнаружить у него СРРЖ, это связано с возникновением по мере увеличения возраста других кардиальных проблем, сходных по электрокардиографическим признакам.
Наиболее часто синдром ранней реполяризации желудочков диагностируют у молодых мужчин, активно занимающихся спортом, у мужчин, ведущих сидячий образ жизни, и у лиц с темной кожей (африканцев, азиатов и латиноамериканцев).
Причины
Точные причины СРРЖ на сегодняшний день не установлены. Однако выделен ряд факторов, которые способствуют возникновению синдрома реполяризации:
- прием некоторых медикаментов, например а2-адреномиметиков (клонидин);
- семейная гиперлипидемия (повышенное содержание жиров в крови);
- дисплазия соединительной ткани (у лиц с СРРЖ чаще обнаруживают ее симптомы: гиперподвижность суставов, «паучьи» пальцы, пролапс митрального клапана);
- гипертрофические кардиомиопатии.
Кроме того, данную аномалию нередко диагностируют у людей с врожденными и приобретенными пороками сердца и при наличии врожденной патологии проводящей системы сердца.
Также не исключается генетическая природа заболевания (имеются определенные гены, которые отвечают за возникновение СРРЖ).
Синдром преждевременного возбуждения желудочков.
Нарушения ритма сердца считаются важной кардиологической проблемой, поскольку нередко осложняют течение и ухудшают прогноз многих заболеваний и являются одной из самых частых причин внезапной смерти.
Особый интерес как клиницистов, так и электрофизиологов вызывает синдром преждевременного возбуждения желудочков (СПВЖ), который в одних случаях, при отсутствии клинических проявлений, может быть электрокардиографической находкой, а в других – сопровождаться опасными для жизни тахиаритмиями.
Несмотря на успехи, достигнутые в изучении СПВЖ, вопросы его диагностики, тактики ведения больных и лечения остаются актуальными и в настоящее время.
Определение. Классификация
СПВЖ (синдром предвозбуждения, преэкситации, preexcitation syndrome) – это ускоренное проведение импульса возбуждения от предсердий к желудочкам по дополнительным аномальным проводящим путям. В результате часть миокарда или весь миокард желудочков начинают возбуждаться раньше, чем при обычном распространении возбуждения по атриовентрикулярному узлу, пучку Гиса и его ветвям.
Согласно рекомендациям группы экспертов ВОЗ (1980) преждевременное возбуждение желудочков, не сопровождающееся клинической симптоматикой, называют «феноменом предвозбуждения», а в случае, когда имеются не только электрокардиографические признаки предвозбуждения, но и развиваются пароксизмы тахиари.
Анатомическим субстратом СПВЖ служат пучки специализированных мышечных волокон вне проводящей системы сердца, способные проводить электрические импульсы к разным участкам миокарда, вызывая их преждевременное возбуждение и сокращение.
Дополнительные предсердно-желудочковые соединения классифицируют по их расположению относительно фиброзных колец митрального или трикуспидального клапанов, типу проводимости (декрементный тип – нарастающее замедление проведения по дополнительному пути в ответ на увеличение частоты стимуляции – или недекрементный), а также по их способности на антеградное, ретроградное или сочетанное проведение. Обычно дополнительные проводящие пути имеют быстрое недекрементное проведение, аналогичное таковому в нормальной ткани проводящей системы Гиса–Пуркинье и миокарда предсердий и желудочков.
В настоящее время известно несколько видов аномальных проводящих путей (трактов):
- предсердно-желудочковый (Кента), соединяющий миокард предсердий и желудочков в обход атриовентрикулярного узла;
- атрионодальный (Джеймса), расположенный между синоатриальным узлом и нижней частью атриовентрикулярного узла;
- нодовентрикулярный (Махейма), связывающий атриовентрикулярный узел (или начало пучка Гиса) с правой стороной межжелудочковой перегородки или разветвлениями правой ножки пучка Гиса;
- атриофасцикулярный (Брешенмаше), соединяющий правое предсердие с общим стволом пучка Гиса.
Существуют также и другие дополнительные пути проведения, в том числе «скрытые», способные проводить электрический импульс ретроградно от желудочков к предсердиям. У небольшой (5–10 %) части больных имеется несколько аномальных путей проведения.
В клинической практике выделяют:
- синдром Вольфа–Паркинсона–Уайта (синдром WPW), обусловленный наличием пучков Кента;
- синдром Клерка–Леви–Кристеско (синдром CLC, синдром укороченного интервала Р-Q (R)), обусловленный наличием пучка Джеймса.
Электрокардиографические проявления СПВЖ зависят от степени преэкситации и постоянства проведения по дополнительным путям. В связи с этим выделяют следующие варианты синдрома:
- манифестный СПВЖ (на ЭКГ постоянно имеются признаки предвозбуждения);
- интермиттирующий (преходящий) СПВЖ (на ЭКГ признаки предвозбуждения имеют преходящий характер);
- латентный СПВЖ (ЭКГ в обычных условиях нормальная, признаки предвозбуждения появляются только в период пароксизма тахикардии или при провокации – физической нагрузке, электрофизиологическом исследовании (ЭФИ), вагусных или медикаментозных пробах);
- скрытый (на стандартной ЭКГ изменения не выявляются из-за проведения возбуждения по дополнительным путям только ретроградно).
Распространенность
По разным данным, распространенность СПВЖ в общей популяции составляет примерно 0,15 %. При этом пароксизмы тахиаритмий возникают у каждого второго пациента (в 80–85 % случаев – ортодромная тахикардия, 20–30 % – фибрилляция предсердий (ФП), 5–10 % – трепетание предсердий и антидромная тахикардия). Скрытый СПВЖ выявляют у 30–35 % больных.
СПВЖ – это врожденная аномалия, но клинически может проявиться в любом возрасте, спонтанно или после какого-либо заболевания. Обычно данный синдром манифестирует в молодом возрасте. В большинстве случаев иной патологии сердца у пациентов нет. Однако описываются сочетания СПВЖ с аномалией Эбштейна, кардиомиопатиями, пролапсом митрального клапана. Существует предположение о наличии взаимосвязи между СПВЖ и дисплазией соединительной ткани.
В семьях больных, страдающих этим синдромом, был выявлен аутосомно-доминантный тип наследования дополнительных проводящих путей у родственников I, II, III степени родства с различными клинико-электрокардиографическими проявлениями.
Частота случаев внезапной смерти у пациентов с СПВЖ составляет 0,15–0,6 % в год. Почти в половине случаев остановка сердца у лиц с СПВЖ – его первое проявление.
Исследования больных с СПВЖ, перенесших остановку сердца, ретроспективно определили ряд критериев, с помощью которых можно выявить лиц с повышенным риском внезапной смерти. К ним относят наличие следующих признаков:
- укороченного интервала R-R – менее 250 мс во время спонтанной или индуцированной ФП;
- симптоматической (гемодинамически значимой) тахикардии в анамнезе;
- множественных дополнительных путей;
- аномалии Эбштейна.
История
ЭКГ с укороченным интервалом P-Q и одновременно уширенным комплексом QRS впервые описали A. Cohn и F. Fraser в 1913 г. Единичные подобные случаи были описаны в последующем и некоторыми другими авторами, однако в течение многих лет причиной такой картины ЭКГ считалась блокада ветвей пучка Гиса.
В 1930 г. L. Wolff, J. Parkinson и P. White представили доклад, в котором электрокардиографические изменения такого типа рассматривали как причину пароксизмальных нарушений ритма сердца. Эта работа дала основание для проведения всесторонних исследований, направленных на выяснение патогенеза указанных изменений на ЭКГ, названных в последующем синдромом Вольфа–Паркинсона–Уайта.
Спустя два года M. Holzman и D. Scherf предположили, что в основе синдрома WPW лежит распространение импульса возбуждения по дополнительным предсердно-желудочковым путям. В 1942 г. F. Wood предоставил первое гистологическое подтверждение наличия мышечного соединения между правым предсердием и правым желудочком, выявленного при аутопсии больного 16 лет с эпизодами пароксизмальной тахикардии в анамнезе.
Несмотря на эти данные, активный поиск альтернативных механизмов развития синдрома продолжался до 1970-х, когда ЭФИ и хирургические методы лечения подтвердили теорию дополнительных проводящих путей.
Патогенез
Проведение импульсов от предсердий к желудочкам при СПВЖ происходит одновременно по нормальной проводящей системе сердца и по дополнительному пути. В проводящей системе на уровне атриовентрикулярного узла всегда наблюдается некоторое замедление проведения импульсов, не характерное для аномального тракта. В результате этого деполяризация определенного участка миокарда желудочков начинается преждевременно еще до распространения импульса по нормальной проводящей системе.
Степень предвозбуждения зависит от соотношения скоростей проведения в нормальной проводящей системе сердца, прежде всего в атриовентрикулярном узле, и в дополнительном пути проведения. Увеличение скорости проведения по дополнительному проводящему пути или замедление скорости проведения по атриовентрикулярному узлу приводят к повышению степени предвозбуждения желудочков. В некоторых случаях деполяризация желудочков может быть целиком обусловлена проведением импульсов по дополнительному пути. В то же время при ускорении проведения импульсов по атриовентрикулярному узлу или замедлении проведения по дополнительному пути степень аномальной деполяризации желудочков снижается.
Основное клиническое значение дополнительных путей проведения состоит в том, что они нередко включаются в петлю кругового движения волны возбуждения (re-entry) и способствуют таким образом возникновению наджелудочковых пароксизмальных тахиаритмий.
При СПВЖ чаще всего встречается ортодромная реципрокная наджелудочковая тахикардия, при которой импульс проводится антеградно по атриовентрикулярному узлу, а ретроградно – по дополнительному проводящему пути. Пароксизм ортодромной наджелудочковой тахикардии характеризуется частыми (140–250 в 1 мин), лишенными признаков преэкситации нормальными (узкими) комплексами QRS. В ряде случаев после комплекса QRS наблюдаются инвертированные зубцы Р, что указывает на ретроградную активацию предсердий.
При антидромной наджелудочковой тахикардии импульс циркулирует в противоположном направлении: антеградно – по аномальному проводящему пути, ретроградно – по атриовентрикулярному узлу. Пароксизм антидромной наджелудочковой тахикардии у больных с СПВЖ проявляется на ЭКГ частым регулярным ритмом (150–200 в 1 мин) с желудочковыми комплексами по типу максимально выраженной преэкситации (QRS і 0,11 с), после которых иногда выявляются инвертированные зубцы Р.
У 20–30 % пациентов с СПВЖ возникают пароксизмы ФП, при которых в результате антеградного проведения по дополнительному пути большого числа предсердных импульсов частота сокращений желудочков (ЧСЖ) может превышать 300 в 1 мин.
Клиника
Во многих случаях СПВЖ протекает бессимптомно и выявляется только электрокардиографически. У 50–60 % больных имеются жалобы на приступы сердцебиений, одышку, боль или дискомфорт в груди, чувство страха и обмороки. Особую опасность при СПВЖ приобретают пароксизмы ФП, поскольку они сопровождаются большой ЧСЖ, гемодинамическими нарушениями и нередко могут трансформироваться в фибрилляцию желудочков. В таких случаях у больных не только наблюдают синкопальные состояния, но и имеется высокий риск внезапной смерти.
Независимыми факторами риска развития ФП у пациентов с СПВЖ являются возраст, мужской пол и наличие в анамнезе синкопальных состояний.
Диагностика
Основным методом диагностики СПВЖ является ЭКГ.
При синдроме WPW на фоне синусового ритма выявляют укорочение интервала P-Q (<0,12 с) и D-волну (пологий наклон в первые 30–50 мс) на восходящей части зубца R или нисходящей части зубца Q, комплекс QRS обычно расширен (і0,11 с). Характерно также отклонение сегмента SТ и зубца Т в сторону, противоположную D-волне и основному направлению комплекса QRS.
Электрокардиографическими признаками синдрома CLC являются укорочение интервала P-Q (R), продолжительность которого не превышает 0,11 с, отсутствие в составе комплекса QRS дополнительной волны возбуждения – D-волны, наличие неизмененных (узких) и недеформированных комплексов QRS (за исключением случаев сопутствующей блокады ножек или ветвей пучка Гиса).
При СПВЖ, обусловленном функционированием пучка Махейма, определяется нормальный интервал P-Q при наличии D-волны.
Одновременное функционирование пучков Джеймса и Махейма приводит к появлению на ЭКГ признаков, характерных для синдрома WPW (укорочение интервала P-Q (R) и наличие D-волны).
В связи с распространением в последние годы хирургических методов лечения больных с СПВЖ (деструкция аномального пучка) постоянно совершенствуются способы точного определения его локализации.
На ЭКГ местоположение пучка Кента обычно определяют по направлению начального моментного вектора деполяризации желудочков (первых 0,02–0,04 с), который соответствует времени формирования аномальной D-волны. В тех отведениях, активные электроды которых располагаются непосредственно над участком миокарда, возбуждающимся аномально за счет пучка Кента, регистрируется отрицательная D-волна. Это указывает на распространение раннего аномального возбуждения в сторону от активного электрода данного отведения.
Особый практический интерес представляют возможности метода пространственной вектор-электрокардиографии, позволяющего с высокой точностью установить локализацию дополнительных проводящих путей.
Более подробную, по сравнению с данными ЭКГ, информацию о местоположении дополнительных путей проведения можно получить с помощью магнитокардиографии.
Однако наиболее достоверными и точными являются методы внутрисердечного ЭФИ, в частности эндокардиальное (предоперационное) и эпикардиальное (интраоперационное) картирование. При этом с помощью сложной методики определяют область наиболее ранней активации (предвозбуждения) миокарда желудочков, которая соответствует локализации дополнительного аномального пучка.
Лечение
У больных с бессимптомным течением СПВЖ лечения обычно не требуется. Исключение составляют лица, в семейном анамнезе которых были случаи внезапной смерти, спортсмены и те, чья работа связана с опасностью для самих себя и окружающих (например, водолазы и летчики).
При наличии пароксизмов наджелудочковой тахикардии лечение заключается в купировании приступов и их профилактике с помощью различных медикаментозных и немедикаментозных методов. При этом важное значение имеет характер аритмии (орто-, антидромная тахикардия, ФП), ее субъективная и объективная переносимость, ЧСЖ, а также наличие сопутствующих органических заболеваний сердца.
При ортодромной реципрокной наджелудочковой тахикардии импульс возбуждения проводится антеградно нормальным путем, поэтому ее лечение должно быть направлено на угнетение проводимости и блокаду импульсов в атриовентрикулярном узле. С этой целью используют рефлекторные вагусные пробы, которые наиболее эффективны при возможно более раннем применении.
Препаратом первого ряда для купирования ортодромной реципрокной наджелудочковой тахикардии считают аденозин, потенциальным недостатком которого является преходящее повышение возбудимости предсердий, способное провоцировать их экстрасистолию и фибрилляцию сразу же после купирования пароксизма такой тахикардии. Другим средством выбора для купирования ортодромной тахикардии при отсутствии выраженной артериальной гипотензии и тяжелой систолической сердечной недостаточности принято считать верапамил. В качестве препаратов второго ряда обычно используют b-адреноблокаторы.
При неэффективности этих средств применяют новокаинамид с целью блокады проведения через добавочный атриовентрикулярный путь. По своей безопасности и эффективности новокаинамид является препаратом выбора при лечении тахикардии с широкими комплексами QRS, когда диагноз ортодромной реципрокной наджелудочковой тахикардии вызывает сомнения.
Препаратами резерва являются амиодарон, соталол и антиаритмические препараты (ААП) 1С класса: пропафенон или флекаинид.
При антидромной реципрокной наджелудочковой тахикардии импульс проводится ретроградно через атриовентрикулярный узел, поэтому применение верапамила, дилтиазема, лидокаина и сердечных гликозидов для ее купирования противопоказано в связи со способностью данных препаратов ускорять антеградное проведение по добавочному пути и тем самым увеличивать ЧСЖ. Применение этих средств, а также аденозина может провоцировать переход антидромной наджелудочковой тахикардии в ФП. Препаратом выбора для купирования такой тахикардии является новокаинамид, при неэффективности которого используют амиодарон или ААП 1С класса.
При возникновении пароксизма ФП основной целью медикаментозной терапии является контроль частоты ритма желудочков и замедление проводимости одновременно по добавочному пути и АВ узлу. Препаратом выбора в таких случаях также является новокаинамид. Высокоэффективно и внутривенное введение амиодарона и ААП 1С класса.
Следует отметить, что применение верапамила, дигоксина и b-адреноблокаторов при ФП с целью контроля ЧСЖ у лиц с СПВЖ противопоказано из-за их способности увеличивать скорость проведения по добавочному пути. Это может перенести фибрилляцию с предсердий на желудочки.
Для профилактики пароксизмов наджелудочковых тахиаритмий, обусловленных наличием дополнительных проводящих путей, используют ААП IА, IС и III классов, обладающие свойством замедлять проведение по аномальным путям.
К немедикаментозным методам купирования приступов наджелудочковых тахиаритмий относят трансторакальную деполяризацию и предсердную (чреспищеводную или эндокардиальную) электрокардиостимуляцию, а для их профилактики – катетерную или хирургическую абляцию добавочных путей.
У больных с СПВЖ электрическую кардиоверсию применяют при всех формах тахикардии, которые сопровождаются выраженными нарушениями гемодинамики, а также при неэффективности медикаментозной терапии и в случаях, когда она вызывает ухудшение состояния больного.
Радиочастотная катетерная абляция добавочных путей является в настоящее время основным методом радикального лечения СПВЖ. Показаниями к ее выполнению являются высокий риск внезапной смерти (прежде всего наличие пароксизмов ФП), неэффективность или плохая переносимость медикаментозной терапии и профилактики приступов наджелудочковой тахикардии, а также нежелание больного принимать ААП. В случае выявления короткого эффективного рефрактерного периода аномального тракта у лиц с редкими и нетяжелыми пароксизмами аритмии, вопрос о целесообразности абляции в целях профилактики внезапной смерти решается индивидуально.
Перед катетерной абляцией выполняется ЭФИ, цель которого – подтверждение наличия дополнительного проводящего пути, определение его электрофизиологических характеристик и роли в формировании тахиаритмии.
Эффективность радиочастотной катетерной абляции высока (достигает 95 %), а летальность, связанная с процедурой, не превышает 0,2 %. Наиболее частыми серьезными осложнениями данного метода лечения являются полная атриовентрикулярная блокада и тампонада сердца. Рецидивы проведения по дополнительному пути возникают приблизительно в 5–8 % случаев. Повторная радиочастотная абляция, как правило, полностью устраняет проведение по дополнительным путям.
В настоящее время область применения хирургической деструкции добавочных путей значительно сузилась. При тех же показаниях, что и к катетерной абляции, к хирургическому лечению прибегают в случаях невозможности выполнения последней по техническим причинам или ее безуспешности, а также при необходимости проведения операции на открытом сердце в связи с сопутствующей патологией.
Литература
- Сычев О.С. Нарушения ритма сердца // Руководство по кардиологии / Под ред. В.Н. Коваленко. – К.: Морион, 2008. – С. 1059-1248, 1215-1218.
- ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation // Circulation. – 2006. – № 114. – P. 257-354.
- ACC/AHA/ESC Guidelines for the management of patients with supraventricular arrhythmias – executive summary // JACC. – 2003. – № 8. – Р. 1493-1531.
- Griffin B., Topol E. Manual of Cardiovascular Medicine. – The Lippincott Williams & Wilkins, 2004. – P. 1248.
- Hanon S., Shapiro M., Schweitzer P. Early history of the preexcitation syndrome // Europace. – 2005. – № 7. – P. 28-33.
- Keating L., Morris А., Brady W.О. Electocardiographic Features of Wolff–Parkinson–White syndrome // Emerg. Med. J. – 2003. – № 20. – Р.491-493.
Н.Т. Ватутин, Н.В. Калинкина, Е.В. Ещенко.
Донецкий национальный медицинский университет им. М. Горького;
Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины.
Укркардіо
Виды
Выделяют два варианта СРРЖ:
- без поражения сердечно-сосудистой и других систем;
- с вовлечением сердечно-сосудистой и других систем.
С точки зрения характера течения различают СРРЖ преходящий и постоянный.
По локализации ЭКГ-признаков врач А.М. Скоробогатый предложил следующую классификацию:
- 1-й тип – с преобладанием признаков в отведениях V1-V2;
- 2-й тип – с преобладанием в отведениях V4-V6;
- 3-й тип (промежуточный) – без преобладания признаков в каких-либо отведениях.
Признаки СРРЖ
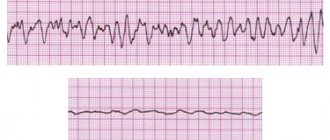
Характерных клинических признаков синдрома ранней реполяризации желудочков не существуют. Имеются лишь специфические изменения на ЭКГ:
- изменения сегмента ST и зубца T;
- в ряде ответвлений подъем сегмента ST выше изолинии на 1-2-3 мм;
- нередко подъем сегмента ST начинается после зазубрины;
- сегмент ST имеет закругленную форму и непосредственно переходит в высокий положительный T-зубец;
- выпуклость сегмента ST обращена книзу;
- основание зубца T широкое.
Деполяризация и реполяризация
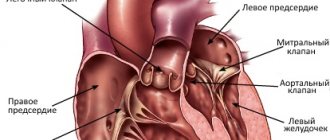
В разделе «Основные принципы электрокардиографии и нарушения» рассматривается общее понятие «электрическое возбуждение», которое означает распространение электрических импульсов по предсердиям и желудочкам. Точное название электрического возбуждения, или активации сердца, – деполяризация. Возврат кардиомиоцитов к состоянию расслабления после возбуждения (деполяризации) – реполяризация. Эти термины подчёркивают, что в состоянии покоя клетки миокарда предсердий и желудочков поляризованы (их поверхность электрически заряжена). На рисунке 2-1, А изображено состояние поляризации нормальной мышечной клетки предсердий или желудочков
Рис. 2-1. Процессы деполяризации и реполяризации А – мышечная клетка сердца в состоянии покоя поляризована, т.е. наружная поверхность клетки заряжена положительно, а внутренняя – отрицательно; Б — при возбуждении клетки (S) происходит её деполяризация (возбуждённый участок электроотрицателен по отношению к соседним участкам); В – полностью деполяризованная клетка заряжена положительно внутри и отрицательно – снаружи; Г – реполяризация происходит, когда клетка возвращается из состояния возбуждения в состояние покоя. Направление деполяризации и реполяризации указано стрелками. Деполяризации (возбуждению) предсердий на ЭКГ соответствует зубец Р, а деполяризации желудочков – комплекс QRS. Реполяризации желудочков соответствует комплекс ST-T.
Внешняя сторона клетки в состоянии покоя заряжена положительно, а внутренняя сторона – отрицательно [около -90 мВ (милливольт)]. Поляризация мембраны обусловлена разницей концентраций ионов внутри и вне клетки.
При возбуждении мышечной клетки сердца происходит её деполяризация. В результате внешняя сторона клетки в области возбуждения становится отрицательной, а внутренняя сторона – положительной. Возникает разница электрического напряжения на внешней поверхности мембраны между деполяризованным участком в состоянии возбуждения и невозбуждённым поляризованным участком см. рис. 2-1, Б. Затем возникает небольшой электрический ток, который распространяется вдоль клетки до её полной деполяризации см. рис. 2-1, В.
Направление деполяризации показано стрелкой см. рис. 2-1, Б. Деполяризация и реполяризация отдельных мышечных клеток (волокон) происходит в одном направлении. Однако во всём миокарде деполяризация идёт от внутреннего слоя (эндокардиального) к наиболее удалённому слою (эпикардиальному), а реполяризация – в противоположном направлении. Механизм этого различия до конца не ясен.
| Примечание: Деполяризация миокарда желудочков происходит от эндокарда к эпикарду, а реполяризация – от эпикарда к эндокарду. Это обусловлено тем, что длительность ТМПД в субэпикардиальных отделах желудочков на 0,03-0.04 с меньше, чем в субэндокардиальных отделах, и процесс реполяризации раньше начнётся именно под эпикардом. | |
Деполяризующий электрический ток регистрируют на электрокардиограмме в виде зубца Р (возбуждение и деполяризация предсердий) и комплекса QRS (возбуждение и деполяризация желудочков).
Через некоторое время полностью охваченная возбуждением деполяризованная клетка начинает возвращаться к состоянию покоя. Этот процесс называют реполяризацией. Небольшой участок на внешней стороне клетки вновь приобретает положительный заряд см. рис. 2-1, Г, затем процесс распространяется вдоль клетки до её полной реполяризации. Реполяризации желудочков на электрокардиограмме соответствуют сегмент ST, зубцы и (реполяризация предсердий обычно скрыта потенциалами желудочков).
На электрокардиограмме отражена электрическая активность всех клеток предсердий и желудочков, а не отдельных клеток. В сердце деполяризация и реполяризация обычно синхронизированы, поэтому на электрокардиограмме можно записать эти электрические потоки в виде определённых зубцов (зубцы P, T, U, комплекс QRS, сегмент ST).
| Любая электрокардиограмма – и нормальная, и патологически изменённая – отражает два основных процесса: деполяризацию – распространение импульса по миокарду – и реполяризацию – возвращение возбуждённого миокарда в состояние покоя. | |
Диагностика
Так как данный синдром является электрокардиографическим феноменом, установить его можно только при определенном обследовании:
- ЭКГ;
- УЗИ сердца (эхокардиография): стресс-эхокардиография (на предмет нарушения сократительной способности желудочков)
- эхокардиография покоя;
Помимо этого, проводят тесты на велоэргометре или тредмиле: после физической нагрузки частота сердечных сокращений повышается, и ЭКГ-признаки СРРЖ исчезают.
Используют пробу с калием: после приема хлорида калия, панангина или ритмокора не меньше 2-х грамм выраженность ЭКГ-признаков синдрома реполяризации усиливается.
Пробу с изопротеренолом и атропином не применяют из-за выраженных побочных явлений.
Важно разграничить СРРЖ и инфаркт миокарда, перикардит, синдром Бругада. С этой целью проводят дифференциальную диагностику.
Внезапная остановка сердца ассоциированная с ранней реполяризацией
МЕТОДЫ. Мы рассмотрели данные 206 пациентов в 22 центрах, которые были реанимированы после остановки сердца из-за идиопатической фибрилляции желудочков и оценили распространенность электрокардиографической ранней реполяризации. Последний определялся как повышение QRS-ST-соединения, по меньшей мере, на 0,1 мВ от исходного уровня в нижнем или боковом отведении, проявляющееся как блуждание или насечка QRS. Контрольная группа включала 412 пациентов без сердечных заболеваний, которые соответствовали возрасту, полу, расе и уровню физической активности. Последующие данные, которые включали результаты мониторинга с имплантируемым дефибриллятором, были получены для всех пациентов.
РЕЗУЛЬТАТЫ. Ранняя реполяризация была более частой у лиц с идиопатической фибрилляцией желудочков, чем у контрольных субъектов (31% против 5%, р <0,001). Среди субъектов исследования те, у кого была ранняя реполяризация, чаще были мужчинами и имели в анамнезе синкопальное состояние (обморок) или внезапную остановку сердца во время сна, чем пациенты без ранней реполяризации. У восьми испытуемых происхождение эктопии, которая инициировала желудочковые аритмии, были расположены в участках, соответствующих локализации аномалий реполяризации. Во время среднего (± SD) наблюдения в 61 ± 50 месяцев мониторинг дефибриллятора показал более высокую частоту рецидивов фибрилляции желудочков у пациентов с аномалией реполяризации, чем у пациентов без такой патологии (отношение рисков, 2,1, 95% доверительный интервал , От 1,2 до 3,5, P = 0,008).
ВЫВОДЫ. Среди пациентов у которых в анамнезе есть идиопатическая фибрилляция желудочков наблюдается повышенная распространенность ранней реполяризации.
Внезапная остановка сердца остается. Одна из основных проблем общественного здравоохранения, которая ежегодно составляет около 350 000 смертей в Соединенных Штатах. Несмотря на достижения в области неотложной медицинской помощи, только 3-10% пациентов, у которых случилась остановка сердца вне больницы, успешно реанимируются. Большинство таких внезапных остановок сердца вызвано желудочковыми тахиаритмиями, которые встречаются у лиц без структурной болезни сердца в 6-14% случаев. Некоторые из последних случаев связаны с хорошо распознанными электрокардиографическими аномалиями, которые влияют на реполяризацию желудочков (например, длинные или короткие интервалы QT или синдром Бругада), тогда как в других случаях, когда нет признаков во время синусового ритма, описываются как идиопатическая фибрилляция желудочков. Ранняя реполяризация является обычной электрокардиографической находкой, которая затрагивает от 1 до 5% людей. Хотя это состояние обычно считается доброкачественным, его потенциальная аритмогенность была предположена экспериментальными исследованиями. Однако подтверждающих клинических доказательств нет. Мы провели исследование случай-контроль, включавшее 206 пациентов с идиопатической фибрилляцией желудочков, чтобы оценить распространенность ранней реполяризации и оценить ее потенциальную связь с любыми наблюдаемыми аритмиями и последующим исходом, контролируемым имплантируемыми дефибрилляторами.
Методика.
ИЗУЧЕНИЕ НАСЕЛЕНИЯ. Случаи заболевания людей в возрасте до 60 лет регистрировались в 22 территориальных центрах занимающихся аритмиями. Все пациенты с диагнозом идиопатической фибрилляции желудочков в этой возрастной группе были отобраны из баз данных пациентов, которые получили имплантируемый дефибриллятор; Все пациенты в возрасте 60 лет и старше были исключены, чтобы минимизировать риск субклинической структурной болезни сердца. Устное информированное согласие было получено от всех зачисленных пациентов.
Мы оценивали базовые электрокардиограммы на наличие ранней реполяризации, которая определялась как повышение QRS-ST-соединения (точка J) по меньшей мере в двух отведениях во время имплантации дефибриллятора. Амплитуда высоты точки J должна была быть по крайней мере на 1 мм (0,1 мВ) выше базового уровня, либо как смазывание QRS (плавный переход от сегмента QRS к сегменту ST), либо надреза (положительное J-отклонение вписанное на S-волне) в нижнем отведении (II, III и aVF), боковом отведении (I, aVL и V4 до V6) или обоих. Передние грудные отведения (от V1 до V3) были исключены из анализа, чтобы избежать включения пациентов с дисплазией правого желудочка или синдромом Бругада.
На основании опубликованных рекомендаций пациенты были классифицированы как имеющие идиопатическую фибрилляцию желудочков, если у них не было структурной болезни сердца, выявленных нормальными эхокардиографическими бивентрикулярными размерами и функцией, не было выявлено ишемической болезни коронарных артерий при коронарной ангиографии или нагрузочных тестах, а также не было выявлено никаких аномалий реполяризации. Пациенты были исключены, если они имели интервал QT с поправкой на частоту сердечных сокращений (QTc) менее 340 мс (короткий интервал QT) или более 440 мс (длительный интервал QT) в начале исследования и перед аритмией. Также исключались пациенты с синдромом Бругада, определяемые по блокаде правой ветви п. Гиса и повышение сегмента ST (> 0,2 мВ) в грудных отведениях V1-V3 без вмешательства или после инфузии блокатора натриевых каналов (антиаритмиков). Кроме того, были исключены пациенты с катехоламинергическими аритмиями, определяемые как аритмии во время инфузии катехоламинов или нагрузочного тестирования.
Мы оценили распространенность и амплитуду ранней реполяризации в контрольной группе из 412 испытуемых. Эта группа была составлена сотрудниками здравоохранения с нормальными эхокардиографическими бивентрикулярными размерами и функцией и без синкопальных состояний (обмороков) в анамнезе. Для согласования использовались следующие факторы (возраст, пол, раса и уровень физической активности).
Сбор данных.
Мы собрали следующие клинические данные: синкопальные состояния в анамнезе, внезапная остановка сердца, внезапная смерть в семейном анамнезе (у родственников) (в возрасте <60 лет), уровень физической активности (> 10 часов или ≤10 Часов активности в неделю), результаты усредненной по сигналам электрокардиографии (как стандартной амплификации, так и высокой амплификации) и результаты фармакологического тестирования и инвазивного электрофизиологического тестирования. Электрокардиографические показатели измерялись с использованием автоматизированного онлайн-программного обеспечения и проверялись вручную. Интервал QTc рассчитывали после коррекции сердечного ритма с помощью формулы Базетта.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ. Мы проводили электрофизиологическое исследование с использованием многоэлектродных катетеров, вводимых чрескожно через бедренные сосуды. Запрограммированную желудочковую стимуляцию выполняли с использованием максимум двух или трех желудочковых экстрастимуляций из двух отдельных участков желудочков. Фибрилляция желудочков считалась индуцируемой, если она продолжалась более 30 секунд или требовала электрической кардиоверсии. Ни один пациент не имел индуцируемой мономорфной желудочковой тахикардии.
В случае субъектов с рецидивирующей фибрилляцией желудочков, несмотря на введение антиаритмических препаратов, выполнялась катетерная абляция, направленная на инициирующую желудочковая эктопию, как описано ранее. Такая эктопия была локализована путем картирования самой ранней электрической активности, либо Пуркинье, либо миокарда, относительно начала комплекса QRS. Абляция выполнялась с использованием радиочастотной энергии.
ТЕРАПИЯ И ПОСЛЕДУЮЩАЯ ДЕЯТЕЛЬНОСТЬ. Все пациенты с эпизодами получали имплантируемый дефибриллятор, который обеспечивал точную информацию о рецидиве фибрилляции желудочков. Пациенты наблюдались регулярно каждые 6-12 месяцев для клинического осмотра и проверки устройства или, по мере необходимости, в случае появления симптомов или разряжения батареек устройства. В субъектах с рецидивирующими аритмиями выбор антиаритмических препаратов производился лечащими врачами.
СТАТИСТИЧЕСКИЙ АНАЛИЗ. Непрерывные переменные указывались как среднее ± SD или медианы (с 25-м и 75-м процентилями), в зависимости от ситуации. Сравнение между этими двумя группами проводилось с t-критерием Стьюдента или непараметрическим критерием Уилкоксона, в зависимости от случая, и с t-критерием Стьюдента для парных данных. Категориальные переменные сравнивались с точным тестом Фишера. Распространенность ранней реполяризации сравнивалась между субъектами исследования и контрольной группой с использованием логистического регрессионного анализа (сообщалось как отношение шансов с 95% доверительными интервалами) и корректировалось на соответствие переменных. Число рецидивов фибрилляции желудочков сравнивалось с использованием теста Уилкокинсона, а частота рецидивов оценивалась с использованием актуарных кривых. Для оценки относительного риска, связанного с ранней реполяризацией, использовались коэффициенты опасности от моделей пропорционального риска Кокса. Все тесты были двухсторонними, а значение Р менее 0,05 считалось статистически значимым.
РЕЗУЛЬТАТЫ.
РАННЯЯ РЕПОЛЯРИЗАЦИЯ.
В группе пациентов с идиопатической фибрилляцией желудочков было 123 мужчины и 83 женщины со средним возрастом 36 ± 11 лет. Контрольная группа включала 412 человек, которые соответствовали возрасту (36 ± 12 лет), полу (270 мужчин и 142 женщины), расе (380 белых, 27 азиатов и 5 негров) и физической активности (44 субъекта занимались больше чем 10 часов активности в неделю).
Ранняя реполяризация произошла у 64 пациентов (31%) по сравнению с 21 контрольной группой (5%, Р <0,001) и была выше по величине у субъектов исследования, чем у контрольных испытуемых (точка J Высота 2,0 ± 0,9 мм против 1,2 ± 0,4 мм, P <0,001). После корректировки на возраст, пол, расу и уровень физической активности отношение шансов на наличие ранней реполяризации у субъектов исследования по сравнению с контрольными субъектами составило 10,9 (95% доверительный интервал [ДИ], 6,3-18,9).
Случаи с ранней реполяризацией чаще встречались у мужчин, имели в анамнезе необъяснимый обморок или внезапную остановку сердца во время сна и имели более короткий интервал QTc, чем у пациентов без ранней реполяризации.
На начальной стадии ранняя реполяризация присутствовала в передний отведениях у 28 субъектов, в боковых отведениях у 6 испытуемых, а также у нижних и базальных отведений у 30 пациентов. Эта картина считалась реполяризацией, а не поздней деполяризацией из-за ее более медленной записи, спонтанного колебания морфологического рисунка или амплитуды перед устойчивыми комплексами QRS и амплитуды, изменяющейся одновременно с сегментом ST. Отсутствие поздних потенциалов на электрокардиографии с высокой амплификацией дополнительно поддерживало реполяризационный паттерн. Эта картина происходила в изоляции или сопровождалась отрицательным увеличением T-зубца или дискретным подъемом сегмента ST (горизонтальная или отображающая вверх изогнутость). Электрокардиограммы, которые были получены за несколько недель до внезапной остановки сердца, были доступны для 22 субъектов и показали картину ранней реполяризации (как описано выше).
Электрокардиографию выполняли в течение аритмического периода (включая частоту желудочковой эктопии и эпизоды фибрилляции желудочков) у 18 субъектов все исследования показали последовательное увеличение амплитуды ранней реполяризации по сравнению с исходным уровнем. Амплитуда J-точки увеличилась с 2,6 ± 1 мм до 4,1 ± 2 мм (P <0,001). В большинстве случаев эктопия имела положительный QRS морфологический паттерн в отведениях V1 до V2, что указывало на возникновение из левого желудочка и короткий интервал взаимодействия, инициирующий фибрилляцию желудочков (в среднем, 326 ± 41 мс, диапазон от 260 до 400) .
Нагрузочные тесты или инфузия изопротеренола последовательно уменьшали или устраняли раннюю реполяризацию. Изопротеренол, введенный двум субъектам во время повторных эпизодов фибрилляции желудочков, устранил все аритмии, когда частота сердечных сокращений синусового узла была увеличена более чем на 120 ударов в минуту. Напротив, бета-блокаторы усиливали аномалии реполяризации. Их неэффективность приводила к попыткам катетерной абляции желудочковых преждевременных сокращений, которые приводили к фибрилляции желудочков у некоторых субъектов.
КОРРЕКТИРОВКА ЭКТОТИИ В РАННЕЙ РЕПОЛЛАРИЗАЦИИ. Картирование было выполнено у восьми пациентов. В двух случаях, картирование обоих желудочков не показало результатов во время деполяризации желудочков, которые совпадали с широкими терминальными QRS аномалиями, подтверждая, что последний был связан с реполяризацией. Всего 26 эктопических паттернов были картированы либо на миокард желудочка (16 паттернов), либо на ткань Пуркинье (10 паттернов). У шести пациентов с ранней реполяризацией, зарегистрированной только в нижних отделах, вся эктопия возникла из нижней стенки желудочка. У двух пациентов с широко распространенной ранней реполяризацией, которая регистрировалась как низкими, так и боковыми линиями, эктопия возникла из нескольких регионов. Катетерная аблация устраняла всю эктопию у пяти испытуемых и не устраняла состояние у трех испытуемых.
ВЗАИМОСВЯЗЬ СУБЬЕКТОВ. Таблица 2 суммирует результаты в течение среднего периода в 61 ± 50 месяцев (медиана, 51 месяц, межквартильный диапазон от 19 до 90) После начального события, при этом ни один субъект не потерял контроль. Аритмические рецидивы были более частыми у субъектов с ранней реполяризацией, чем у пациентов без такой реполяризации (41% против 23%). Коэффициент риска рецидива составил 2,1 (95% ДИ, от 1,2 до 3,5, Р = 0,008), даже после поправки на пол. У трех пациентов с наивысшим уровнем J-точки (> 5 мм) было более 50 эпизодов фибрилляции желудочков, приведшим к смерти в одном случае. Четырем больным с множественными эпизодами назначали хинидин, что уменьшало аномалии реполяризации и устраняло рецидивы аритмии.
ОБСУЖДЕНИЕ. Внезапная остановка сердца от аритмии может возникать у лиц, у которых нет структурного сердечного заболевания или очевидных электрокардиографических нарушений во время синусового ритма. В нашем исследовании такие субъекты исследования имели значительно более высокую распространенность ранней реполяризации, чем контрольные субъекты, у которых распространенность была сходной с таковой среди здоровых субъектов в ранее сообщавшихся исследованиях. Почти у трети пациентов были доступны электрокардиограммы, полученные до остановки сердца, и они показали раннюю реполяризацию, которая показала, что эта аномалия не может быть результатом травмы после внезапной остановки сердца, реанимации или препаратов, используемых для реанимации.
Маловероятно, что эта аномалия более распространена среди выживших пациентов с сердечными заболеваниями, чем среди не выживших, поскольку единственным наиболее важным фактором, определяющим успешную реанимацию, является доступ к быстрой дефибрилляции. Эта электрокардиографическая картина также была связана с увеличением частоты рецидивов желудочковых аритмий во время мониторного наблюдения дефибриллятора.
Наши результаты показывают связь между ранней реполяризацией и внезапной остановкой сердца, вывод, который противоречит, казалось бы, доброкачественной природе этого распространенного явления. Во-первых, это открытие может быть связано с определением ранней реполяризации, поскольку мы специально включили аномалии в нижне-боковые отведения, в то время как широкое традиционное определение ранней реполяризации включало в себя различной амплитуды, конфигурации и протяженности электрокардиографических паттернов, чаще всего в правых грудных отведениях. Во-вторых, немногие из субъектов исследования в нашем исследовании относились к подгруппам, у которых высокая распространенность ранней реполяризации (например, у спортсменов и чернокожих), что предполагает, что кофакторы влияют на ассоциацию с внезапной остановкой сердца. В-третьих, благоприятный характер ранней реполяризации оспаривается экспериментальными данными, свидетельствующими о наличии формы трансмуральной электрической неоднородности , может быть резко усилен при определенных условиях (использование специфических лекарств и различных уровней автономного тонуса и электролитов), что приводит к злокачественным аритмиям . Потенциальная аритмогенность, таким образом, зависит от дефектной модуляции реполяризации, которая соответствует динамическим изменениям, временным образом связанным с аритмиями, которые мы наблюдали в нашем случае.
Взаимосвязь между этой электрокардиографической картиной и злокачественными аритмиями подтверждается усиленной реполяризацией до наступления аритмии у субъектов исследования и возникновения триггерных сокращений в области ранней реполяризации. Хинидин, который, как было показано, восстанавливает трансмуральную электрическую однородность и отменяет аритмическую активность в этом состоянии, уменьшает электрокардиографическую картину и устраняет повторяющиеся аритмии у четырех субъектов.
Наконец, хотя, насколько нам известно, ни одно многоцентровое исследование не изучало ассоциацию между ранней реполяризацией и внезапной остановкой сердца, отдельные сообщения (в основном из Юго-Восточной Азии) описали пациентов, у которых внезапная остановка сердца была связана с аномальными J-волнами. Аномалия реполяризации, которая регистрируется в передне-боковой области может быть маркером базовой электрической уязвимости, которая увеличивает риск смертельных аритмий в условиях, которые необходимо исследовать. Эти условия включают наличие генетических дефектов, связанных с каналами сердечных ионов, что подтверждается тем фактом, что у 10 из наших пациентов была внезапная остановка сердца в семейном анамнезе.
Эти результаты потенциально важны для оценки пациентов с синкопальными состояниями (обмороками) или семейной историей внезапной смерти. Аритмии, связанные с аномалией реполяризации, могут быть ответственными за долю необъяснимых смертей, преимущественно у молодых мужчин, как сообщалось ранее. Такие аритмии могут также быть причиной некоторых недиагностированных причин обморока, которые, как сообщалось, увеличивают риск преждевременной смерти.
Результаты нашего исследования, которые требуют подтверждения со стороны других исследователей, имеют несколько ограничений. Хотя когорта включала субъектов со строго определенными общими чертами, сбор данных был неравномерным среди центров. В нашем изучаемом населении у нас не было субъектов со структурной болезнью сердца и у не много спортсменов или чернокожих, поэтому результаты могут не относиться к этим подгруппам. Самое главное, хотя наши результаты свидетельствуют о том, что ранняя реполяризация является маркером расстройства, связанного с злокачественными аритмиями, исследования предсказывают благоприятный курс для большинства из этих пациентов. Необходимы дальнейшие исследования для выявления факторов, которые модулируют лежащую в основе аритмогенность и предсказывают, какие пациенты подвергаются риску.
В заключение, это многоцентровое исследование показало более высокую, чем ожидалось, распространенность ранней реполяризации у пациентов моложе 60 лет, у которых была идиопатическая фибрилляция желудочков, которая вызвала обморок и внезапную остановку сердца.
Лечение синдрома ранней реполяризации желудочков
Специфического лечения синдром реполяризации не требует. Единственное, что предлагается пациенту – это наблюдение у кардиолога.
Тем не менее, человеку с СРРЖ необходимо исключить употребление алкоголя и интенсивные физические нагрузки, чтобы не спровоцировать приступ тахикардии.
В некоторых случаях производят радиочастотную аблацию дополнительного пучка инвазивным способом (катетер подводится к месту пучка и уничтожает его).
Иногда применяют энерготропную терапию (витамины группы В, карнитин, препараты фосфора и магния, мексидол, кудесан), антиаритмические препараты (амиодарон).
Важно! Пациенту следует сохранять все прежние ЭКГ, что требуется для исключения диагноза инфаркта миокарда при возникновении болей в сердце.