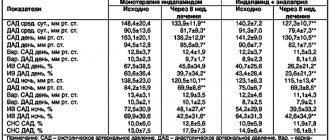
В настоящее время для выявления больных с высоким риском развития угрожающих жизни аритмий используются различные электрокардиографические методы: ЭКГ высокого разрешения (ЭКГ ВР), анализ вариабельности сердечного ритма (ВСР), холтеровское мониторирование. Динамика показателей данных методов достаточно хорошо изучена в остром, подостром и отдаленном периодах инфаркта миокарда [1, 2].
В меньшей степени изучены электрокардиографические маркеры внезапной сердечной смерти при ишемии миокарда [3]. В связи с этим обращают на себя внимание данные о возможности использования оценки изменений длительности и амплитуды QRS-комплекса при ишемии миокарда (стресс-тест, острый коронарный синдром (ОКС), хроническая ишемическая болезнь сердца) по данным ЭКГ ВР [4–9] и анализ вариабельности сердечного ритма [10]. В доступной нам литературе мы не встретили достаточно полных данных о динамике амплитудных и временных характеристик комплекса QRS и показателей ВСР у больных ОКС.
Целью настоящего исследования явилось изучение показателей ЭКГ ВР и ВСР у больных ОКС для оценки электрической нестабильности миокарда и тяжести течения заболевания.
Единая причина электрической нестабильности проводящих путей при всех структурно-патологических заболеваниях сердца.
Хабчабов Р.Г.
Дагестанская государственная медицинская академия, кафедра поликлинической терапии, кардиологии и общей врачебной практики, Махачкала.
Хабчабов Рустам Газимагомедович, кандидат медицинских наук. Адрес и работа: г. Махачкала, площадь Ленина 1, инд. 367000. Дагестанская государственная медицинская академия (ДГМА), кафедра поликлинической терапии, кардиологии и общей врачебной практики. Тел, сот. 8963-413-67-20, дом. 8(8722) 60-25-70, электр. адрес
Резюме
Причина развития жезнеугрожающих аритмий, которая приводит к внезапной и общей смертности от сердечно-сосудистых заболеваний до сих пор остаётся не ясной, в этом направлении ведутся поиски всех кардиологов мира. Повреждение соединительнотканной изоляционной оболочки проводящих путей сердца может привести к трепетанию предсердий или желудочков с последующим развитием мерцания, раннее такую причину не рассматривал ни кто, как электрическую нестабильность сердца.
Ключевые слова: электрическая нестабильность сердца, трепетание, мерцание.
Сердечно-сосудистые заболевания (ССЗ) являются ведущими причинами инвалидности и смертности трудоспособного населения во всём мире. В России распространённость ССЗ растёт, а по смертности от них наша страна находится на одном из первых мест в мире, что обуславливает необходимость поиска врачами современных и эффективных методов их лечения и профилактики.
Прочитав статью до конца, многие поймут, что мы в своей жизни сами не осознавая этого, смоделировали электрическую систему подобной своему сердцу, в котором есть электростанции, проводящие пути, электрогенераторы, трансформаторная станция и тд.
Многие авторы в проводимых исследованиях по электрической нестабильности сердца (ЭНС) часто акцентируют своё внимание только на некротическо-рубцовые процессы (НРП) в миокарде при ишемической болезни сердца (ИБС). Но развитию общей и внезапной сердечной смерти (ВСС) подвержены больные и с другими ССЗ, такие заболевания авторы, почему-то игнорируют, между тем, очевидно, что ЭНС едина для всех структурных патологий сердца (СПС) и больные умирают не от инфарктов миокарда (ИМ), а от летальных аритмий.
Если проанализировать все аритмии, то они хорошо поддаются разуму, но причина развития трепетания остаётся не понятным, а механизм мерцания запутан, из-за наличия противоречий в учениках по электрокардиографии (ЭКГ).
В молодом возрасте трепетание и мерцание, встречаются у больных ревматизмом, миокардитом, митральными пороками сердца, а в пожилом и старческом возрасте – чаще всего при ишемической болезни сердца, остром ИМ, хронической сердечной недостаточности, митральном стенозе, гипертонической болезни, кардиомиопатии, миокардите и тд. [9,10].
Определяющим условием для возникновения летальных аритмий признается наличие СПС, которая превращается в нестабильный субстрат под действием различных функциональных факторов. В качестве таких структурных изменений, предопределяющих развитие жизнеугрожающих аритмий (ЖА), могут выступать: выраженная гипертрофия, дилатация, аневризма сердца, некротические и склеротические процессы миокарда, воспаление с отеком миокардиальной ткани и тд. Эти изменения, по данным многих исследователей, составляют анатомический субстрат с различными механизмами возникновения ЖА [11].
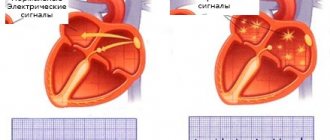
Из определения учебников по ЭКГ [9,10]: Трепетание предсердий и желудочков – это правильное и ритмичное движение мощной волны возбуждения по одному и тому же пути с развитием механизма re-entry (но какова причина и как образуется такой механизм макро — re-entry, исследователям на тот период осталось не понятным). Мерцание предсердий и желудочков – это беспорядочное, хаотичное возбуждение и сокращение отдельных групп мышечных волокон, каждая из которых фактически является своеобразным эктопическим очагом импульса. Прочитав это определение и вернувшись назад в главу «функция автоматизма», в ней можно прочитать, что функцией автоматизма обладают клетки синоатриального узла (СУ) и проводящей системы сердца: атриовентрикулярного (АВ) соединения, проводящей системы предсердий и желудочков, а сократительный миокард лишён функции автоматизма [9,10]. Это говорит о том, что при мерцательной аритмии не могут генерировать «отдельные группы мышечных волокон» и никакой «электрической нестабильности миокарда» не существует, миокард всего лишь проводит электрические импульсы, но не генерирует их, даже если миокард или кардиомиоциты меняют свои свойства. Некоторые могут возразить, что может миокард и лишён электрической активности, но в миокарде может быть зона негомогенности после перенесенного ИМ, которая может мешать проведению электричества, на самом деле электрические импульсы легко обходят такую зону, даже при обширных НРП. В то же время можно предположить о множественной генерации эктопических очагов (ЭО), которые расположенные в дистальных проводящих путях сердца (ППС), мощность их слабая, но они хорошо мерцают, как «гирлянды» на ёлке и запускают механизм микро — re-entry. Миокард действительно не может сам по себе эктопировать, так как все эктопические узлы расположены вдоль ППС, как бусы на нитке и имеют единую соединительнотканную изоляционную оболочку (СТИО), которая начинается от СУ. Без повреждения этой оболочки электрические импульсы не могут выходить на миокард и только волокна Пуркинье не имеют такой оболочки, через них и возбуждается миокард (не во всех учебниках указывается, что и в предсердиях есть волокна Пуркинье).
Прежде всего, надо отметить, что ППС расположены так же, как и электрические провода в стенах наших домов, они тоже имеют изоляционную оболочку, но в стене провода не подвижны и мало изнашиваются, а в рабочем миокарде с наличием СПС они быстро могут придти в негодность, и часто происходит их повреждение с развитием блокад или повреждением только СТИО. Интересным может показаться и то, что в наших домах есть своеобразные волокна Пуркинье – это розетки, включатели и тд., где провода оголены.
Во многих случаях при выраженных СПС может образоваться перерастяжение с разрывом или надрывом только СТИО основных ППС (кстати, подобный механизм описан в болезни Альцгеймера, когда атеросклерозом повреждается миелиновая оболочка нерва и нервные импульсы рассеиваются в окружающую ткань, вероятно, возможно и атеросклеротическое повреждение ППС?), что способствует активизации близлежащего ЭО. Это приводит к тому, что электрический импульс, вышедший из ЭО, будет проходить через такое повреждение по наименьшему пути сопротивления (электрический импульс, не будет разветвятся на множество мелких проводящих путей и проходить сквозь расположенные в них эктопические узлы), он будет вырываться на миокард мощным электрическим импульсом (70-80% от всего электрического импульса, как раз этот механизм развития трепетания и описан в учебниках по ЭКГ, но причина такого явления осталась непонятна исследователям), вследствие чего и образовываются крупные F волны трепетания. Если это произойдет в предсердиях, то такой мощный электрический импульс будет закручиваться в миокарде по типу механизма макро — re-entry, а АВ узел не дополучит полноценный электрический импульс и только лишь со 2-3 и тд. эктопического возбуждения АВ узел сможет трансформировать полноценный электрический импульс для желудочков. Чем продолжительнее будет трепетание, тем больше снижаются компенсаторные силы основного ЭО и как только он ослабнет, произойдёт активизация множества более мелких ЭО, что приведёт к мерцанию.
Можно задать вопрос, почему теория повреждения СТИО верна? Дело в том, что самый мощный источник эктопии при суправентрикулярной пароксизмальной тахикардии и трепетании предсердий находится в предсердиях (мерцание не в счёт, она обусловлено множественной эктопией), но на ЭКГ наблюдается разная картина, почему? Потому, что в первом случаи электрическому импульсу приходится преодолевать препятствия, проходя через множество мелких проводящих путей и эктопических узлов в предсердиях, а затем он выходит на миокард не столь мощным импульсом для того, чтоб закрутить волну макро — re-entry. А во втором случаи он беспрепятственно вырывается мощным электрическим импульсом на миокард через повреждение СТИО и закручивает волну макро — re-entry. Такой механизм макро — re-entry и дает небольшую разницу в ЧСС между суправентрикулярной пароксизмальной тахикардией и трепетанием предсердий. Иными словами говоря, пароксизмальная тахикардия повреждает СТИО ППС и переходит в трепетание, но источник эктопии остается прежним, то есть – это один и тот же вид аритмии, только с разным механизмом действия. Такой же механизм развития трепетаний желудочков.
Надо отметить, что в основном пароксизмальная тахикардия приводит к повреждению СТИО, хотя и само повреждение СТИО может активизировать ЭО с развитием трепетания, яркий пример этому появление некротической зоны при ИМ. При развитии острого ИМ, некроз миокарда не всегда повреждает СТИО основных проводящих путей желудочков, даже при обширном инфаркте, но если это происходит, может сразу активизироваться ЭО с развитием трепетания и последующим мерцанием желудочков.
Обычно только в двух случаях может развиться аритмия (экстрасистолия, желудочковая или пароксизмальная тахикардия): 1. Сверхмощное поступление электрических импульсов к одному из эктопических узлов, чему может способствовать и симпатическая стимуляции бета – адренорецепторов. 2. Наоборот сверхнизкая мощность поступления электрических импульсов, чему может способствовать и влияние парасимпатической иннервации. То есть не только ЧСС влияет на развитие аритмии, но и напряжение тока в проводящей системе. Выглядит это так, если в ваш дом поступает недостаточная или сверхмощная частота электроэнергии, то чтобы у вас не вышла из строя вся электротехника, вы отключаетесь от центральных сетей и включаете собственный электрогенератор. Экстрасистолия, желудочковая и пароксизмальная тахикардия, как раз пытаются перебить нестабильную работу центрального генератора (этот эффект можно назвать защитным механизмом эктопических узлов от нестабильной мощности электрических импульсов СУ или проводящего АВ узла). В некоторых случаях мощность сработавшего эктопического генератора может стать не управляемой в подаче электрических импульсов в обратном направлении, что приводит к временной или постоянной дезактивации синусового или АВ узла, а при истощении компенсаторных сил основного ЭО развивается множественная эктопия (мерцание). Нервная регуляция СУ более совершена благодаря одновременному участию в ней симпатического и парасимпатического отделов вегетативной нервной системы, что стабилизирует мощность электрических импульсов.
Дополнительными факторами в развитии аритмий с наличием СПС может быть: 1. Слабость проксимального эктопического узла (блокада I,II,III – по типу АВ блокады), вследствие чего к дистальному узлу поступают слабые электрические импульсы и он активизируется (то есть, иногда существует синдром слабости эктопического узла). 2. Перерастяжение проводящих путей (особенно в местах расположения эктопических узлов) при выраженных гипертрофиях, дилатациях и тд., приводит к удлинению электропроводимости, что так же способствует задержке электрических импульсов и активизации ЭО.
Пусковым фактором для повреждения СТИО ППС при СПС, могут быть любые резкие движения или повреждения миокарда: все виды тахикардий и экстрасистолий, подскок артериального давления (АД), увеличение сократимости миокарда (особенно при патологически сниженной сократимости), НРП, воспаление миокардиальной ткани и тд.
По локализации, наиболее тонкими и легко повреждаемыми сегментами в желудочках являются правая ножка и передняя ветвь левой ножки. Далее в убывающем порядке по их ранимости можно расположить основной ствол левой ножки, пучок Гиса и, наконец, заднюю ветвь левой ножки. Однако нарушение проводимости может иметь место в любом сегменте или в нескольких сегментах одновременно [10]. Вероятнее всего, в предсердиях чаще всего повреждаются проводящие пути Венкебаха, Бахмана и Тореля.
В некоторых случаях, при проведении электрической кардиоверсии можно прерывать трепетание или мерцание предсердий на начальном этапе (пароксизмальная, персистирующая), при этом разряжаются все центры генерации, и может возобновиться электрическая стабильность сердца с нормальной работой СУ. При развитии трепетания предсердий, возможно, медикаментозное подавление эктопической активности на 5-7 дней с переводом трепетания в мерцание, это даст время для благоприятного рубцевания соединительной тканью повреждения ППС, после чего можно предпринять попытку восстановления работы СУ. Профилактическое использование репарантов у больных со СПС, может способствовать предупреждению повреждения СТИО ППС, кстати, к таким репарантам относятся; оротат калия, АТФ и солкосерил. Реанимационные мероприятия с использованием дефибриллятора при трепетании и мерцании желудочков у больных со СПС редко бывают успешными. Возможно, экстренное использование аппарата, типа искусственного водителя ритма и наличием зонда в виде длинной изоляционной иглы до оголённого наконечника, который можно экстренно ввести к миокарду, через межрёберное пространство сразу после безуспешных реанимационных мероприятий, позволит заработать сердцу и восстановить кровообращение в жизненно важных органах, а в последующем можно установить и кардиостимулятор. Дополнительные реанимационные мероприятия с использованием такого кардиостимулятора хороши тем, что в этой ситуации уже нечего терять, больной практически мертв.
Далее мы проанализируем литературу с современными взглядами авторов и исследователей по проблеме ЭНС. Прежде всего, надо отметить, что многие авторы пишут о электрической нестабильности миокарда, хотя правильнее будет писать «электрическая нестабильность сердца». Так же, многие авторы пытаются подогнать ЭНС, под какое-то одно структурно-патологическое заболевание сердца и чаще всего, это острый ИМ.
Для возникновения угрожающих жизни ЖА (устойчивая ЖТ, ФЖ) требуется сочетание нескольких причин, предрасполагающих к ЭНМ: наличие субстрата (структурное заболевание сердца), модулирующего дисфункцию вегетативной нервной системы и пусковых факторов ЖА. Морфологическим субстратом, создающим негомогенность проведения импульса после ИМ, является пограничная с некротизированной тканью зона миокарда, образованная из переплетенных между собой островков жизнеспособных миокардиальных волокон и соединительной ткани. В этом месте путь проведения импульса удлиняется из-за того, что островки соединительной ткани становятся барьерами на пути волны возбуждения, а скорость проведения замедляется в результате нарушения параллельной ориентации мышечных волокон. Таким образом, зоны миокарда с задержанной желудочковой деполяризацией могут представлять собой анатомо-физиологический субстрат для re-entry – основного механизма развития ЖА [1,4,22]. В этом исследовании автор был близок к истине, но не смог понять, что источником развития ЖА становится не пограничный миокард, а повреждение в этой зоне некрозом СТИО основных ППС с развитием трепетания желудочков.
Как свидетельствуют результаты работы J.D. Kramer и соавт., необязательно наличие длинного пути вращения импульса, достаточно наличия небольшого диаметра ткани миокарда, изменившего свои электрофизиологические свойства вследствие острой ишемии миокарда или гетерогенности его структуры из-за фиброзно-некротических изменений, что бы запустить механизм re-entry [17]. Волокна проводящей системы более устойчивы к гипоксии и ишемия миокарда наврядли сможет привести к механизму re-entry, а фиброзно-некротические изменения способны повредить СТИО ППС и запустить механизм макро — re-entry в миокарде с развитием трепетания.
Согласно современным представлениям, этиология и патогенез ЖА у больных ИБС предполагают взаимодействие множества факторов: структурных изменений в сердце [20], электрической нестабильности миокарда, нейрогуморальных механизмов [15], суточных биоритмов [12], генетических дефектов [16].
Предложено множество неинвазивных методик для стратификации риска у пациентов со структурными дефектами миокарда. К сожалению, возможности большинства из них ограничены. Фракция выброса менее 40%, неустойчивая желудочковая тахикардия (ЖТ) при холтеровском мониторировании и электрофизиологическом исследовании у пациентов, перенесших острый ИМ, на сегодняшний день остаются основными прогностическими маркерами высокого риска ВСС [14]. Как продемонстрировало одно из последних исследований, проведенное среди пациентов с имплантированными кардиовертерами-дефибрилляторами, внезапное возникновение желудочковой тахикардии или фибрилляции желудочков (ФЖ), как правило, встречается при сохраненной фракции выброса; при сниженной сократимости перед приступами ЖТ или ФЖ обычно отмечается постепенное усиление желудочковой эктопической активности. Не подлежит сомнению, что наличие сердечной недостаточности является важным аритмогенным фактором и маркером риска внезапной аритмической смерти у больных ИБС. Наличие аневризмы сердца, постинфарктных рубцов и клинических проявлений сердечной недостаточности увеличивает вероятность неблагоприятного исхода. Снижение сократимости левого желудочка повышает риск ВСС не только при ИБС, но и у больных с другими заболеваниями сердца [13].
Другим важнейшим фактором риска ВСС больных ИБС является ишемия миокарда. Это нарушение, как уже было сказано выше, является основной причиной внезапной ВСС. Выраженное (более 50%) атеросклеротическое сужение коронарных артерий выявляется примерно у 90% внезапно умерших [2]. Степень поражения коронарных артерий играет важную роль в развитии ЖА и ВСС [8]. Большое число клинических исследований показывает, что, как симптомная, так и безболевая ишемия миокарда являются информативным маркером риска ВСС больных различными формами ИБС [19,27]. Ишемия миокарда, электрическая нестабильность и дисфункция левого желудочка составляют так называемый треугольник риска внезапной смерти больных ИБС [18].
Особенно неблагоприятно сочетание двух факторов риска ВСС – частая желудочковая экстрасистолия и дисфункция левого желудочка со снижением фракции выброса < 40 %. По данным исследования GISSI-2, риск внезапной аритмической смерти в этом случае увеличивается в 16 раз [3].
Одним из факторов риска ВСС считается наличие выраженной гипертрофии левого желудочка, в частности, у больных с артериальной гипертонией [24] и гипертрофической кардиомиопатией [28].
Дискуссия о предвестниках ФЖ продолжается в литературе достаточно давно, однако, и здесь нет определенности. Используемые в настоящее время факторы риска возникновения ЖА у больных ИБС обладают недостаточной чувствительностью и специфичностью. Это побуждает к поиску новых маркеров электрической нестабильности миокарда [26].
Помимо указанных, известны другие факторы риска внезапной смерти, в частности, нарушение вегетативной регуляции сердца с преобладанием симпатической активности. Важнейшим маркером этого состояния служит снижение вариабельности ритма сердца (ВРС) [21], а также увеличение продолжительности и дисперсии интервала QT [25]. Снижение вариабельности ритма и удлинение интервала QT считаются дополнительными показателями электрической нестабильности миокарда [18].
В отношении ВРС, дисперсии интервала QT и поздних потенциалов желудочков (ППЖ), от себя могу добавить несколько моих заключительных выводов из защищённой диссертационной работы. Изначальное ухудшение показателей ВРС у пациентов в постинфарктном периоде связано с тем, что они находятся в тревожно-депрессивном состоянии после перенесенного острого ИМ. Депрессии встречается у 82% больных в постинфарктном периоде [7]. У таких пациентов развивается страх смерти и тревога за свое здоровье, они лишены эмоций радостного восприятия окружающего их мира и становятся замкнутыми, вследствие чего начинает преобладать активность симпатической нервной системы (СНС) над парасимпатической нервной системой (ПСН). По мере того как активизируется позитивное психо-эмоциональное состояние пациентов, они начинают выходить из депрессии, стабилизируется и работа ПСН, что приводит к колебаниям синусового ритма. Надо отметить, что психо-эмоциональное состояние пациентов может быть позитивным и негативным в различное время суток. В любой момент позитивное психо-эмоциональное состояние пациента, перенесшего ИМ, может смениться на негативное и даже стрессовое состояние, а это приведет к гиперактивности СНС, что в сочетании с атеросклеротическими изменениями в коронарных артериях может привести к их спазму и появлению новых некротических очагов в миокарде.
Не все исследователи, психо-эмоциональные состояния относят к традиционным факторам риска ИБС, хотя длительный спазм даже интактных коронарных артерий вследствие активизации СНС является основным механизмом развития приступов стенокардии и ИМ. Часто такой спазм связан с негативным психо-эмоциональным состоянием пациента, а это говорит о том, что ИБС, прежде всего, является кардио-неврологическим заболеванием. Доказательством этого служит снижение ВРС у большинства пациентов с наличием эпизодов ишемии по результатам суточного мониторирования ЭКГ (СМЭКГ), а это означает, что такие пациенты нуждаются в дополнительном психо-неврологическом лечении. Многие аппараты СМЭКГ имеют программу анализа ВРС, но специалисты чаще выдают общесуточное заключение, хотя их можно фрагментировать по 5-минутным промежуткам и проводить корреляцию с ишемическими эпизодами. Это даст информацию специалистам о резком снижении цифровых значений ВРС перед развитием эпизода ишемии, и разграничить пациентов с неустойчивой нервной системой. Такую корреляцию ВРС можно проводить и с началом развития аритмий. Возможно, когда специалисты станут более детально расшифровывать ВРС по данным СМЭКГ, роль этого метода исследования станет более заметна в диагностике и лечении ИБС.
В постинфарктном периоде ППЖ улучшаются незначительно, чем показатели дисперсии интервала QT. Вероятно, это связано с тем, что наличие ППЖ в большей степени связано с гибелью проводящих путей сердца (ветви ножек пучка Гиса или основных стволов волокон Пуркинье), которые полностью блокируются негомогенной некротической зоной и в последующем рубцовыми изменениями миокарда, вследствие чего электрическому импульсу приходится возвращаться и выходить через другие проводящие пути на миокард. Либо проводящие пути сердца не полностью блокируются рубцовыми изменениями миокарда и тогда электрическому импульсу приходится пробиваться через частично негомогенные зоны.
В отличие от ППЖ, замедление восстановительных процессов интервала QT в меньшей степени связано с патологическими изменениями проводящих путей сердца, а возможно и вообще не бывает таковой связи у 50% пациентов перенесших ИМ (особенно у больных с не Q-ИМ). В острой стадии ИМ, замедление дисперсии интервала QT чаще связано с наличием некроза и реинфарктной зоной миокарда, которая имеет большую площадь негомогенности на 20-40%, чем в рубцовом периоде, что в последующем приводит к улучшению процессов реполяризации. Возможно, в тех единичных случаях, когда улучшаются показатели ППЖ в постинфарктном периоде, может иметь связь редких случаев способности организма вырабатывать стволовые клетки, вследствие этого происходит частичный рост новых проводящих путей сердца (ветвь ножки пучка Гиса или волокон Пуркинье) в обход рубцовой зоны, что приводит к восстановлению проводимости электрических импульсов и устранению ППЖ.
Уже написав статью, я прочитал множество литературы, включая анатомию и физиологию сердца, но ни где не нашёл упоминания о наличии изоляционной оболочки основных ППС. Пишется о существовании небольшом количестве Р–клеток и клеток Пуркинье (атипичные, специализированные), которые обладают электропроводящей функцией, большую часть миокарда – 99% составляют кардиомиоциты (типичные, рабочие) обладающие сократительной функцией, а между ними Т–клетки (переходные). Логически понятно, что все эти клетки и кардомиоциты миокарда проводят электрические импульсы и речь идёт о волокнах Пуркинье, где проводящая система оголяется и не имеет СТИО. В литературе пишется о существовании СТИО синусового и АВ узла, а стало быть, должна существовать изоляционная оболочка между основными проводящими путями и сократительными кардиомиоцитами, иначе не понятно, зачем вообще нужны основные ППС!
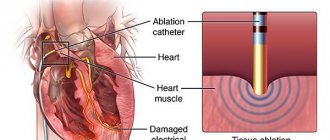
В заключении отмечу, что в настоящие время знания об формирования проводящей системы далеки от полных, особенно это касается формирования проводящей системы. Прогресс в изучении дополнительных путей проведения импульса обязан только ЭКГ исследованиям и не является доказательным. Чтоб иметь полную картину всех особенностей миокарда и электрофизиологии сердца нужно знать, что между предсердиями и желудочками есть соединительнотканный каркас, который не позволяет возбуждаться желудочкам вместе с предсердиями. В этом каркасе и есть врождённый раскрывающийся дефект (именно это дефект и прижигается при абляции), а не дополнительный путь проведения (пучок Кента), при повышении давления в предсердии или желудочке, а возможно, и в них обеих, через этот дефект и начинают периодически преждевременно возбуждаться желудочки (синдром WPW). При синдроме CLC тоже отсутствует дополнительный путь проведения (пучок Джеймса), а имеется врождённое периодическое нарушение трансформации электрических импульсов с ускоренным их проведением через АВ узел. В результате этого, часть электрических импульсов проходят через АВ узел без трансформации, укорачивается интервал PQ. Таким образом, можно отметить; 1. Дополнительные пути проведения отсутствуют между предсердиями и желудочками, а если бы они существовали, то электрические импульсы проходили бы через них постоянно, от рождения и до смерти, так как в проводящих путях нет клапанов, а эти синдромы предвозбуждения бывают приходящими. 2. Так называемые дополнительные пути проведения Кента, Джеймса и Махайма описываются как мышечные пучки, но весь миокард – это одна большая мышца, то есть множество мышечных пучков и почему некоторые из них стали дополнительными путями проведения не понятно!
Литература
1. Бузиашвили Ю.И., Хананашвили Е.М., Асымбекова Э.У. и др. Взаимосвязь между жизнеспособностью миокарда и наличием поздних потенциалов желудочков у пациентов, перенесших инфаркт миокарда. // Кардиология. — 2002. — № 8. — C. 4-7.
2. Вихерт А.М., Велищева Л.С., Матова Е.Е. Географическое распространение и патология внезапной смерти в Советском Союзе. В кн. Внезапная смерть: Материалы 1-го Советско-американского симпозиума. // Под ред. А.М. Вихерта, Б. Лауна. — М. :Медицина. — 1980. — С.40-54.
3. Гиляров М.Ю. Сулимов В.А. Лечение нарушений сердечного ритма у пациентов с недостаточностью кровообращения. // РМЖ Кардиология. — 2010. — № 22 (18). — C. 1298-1301.
4. Гришаев С.Л. Электрическая нестабильность миокарда у больных ишемической болезнью сердца. // Русский медицинский журнал. — 2003. — № 2. — C. 13-18.
5. Мурашко В.В., Струтынский А.В. Электрокардиография: учебное пособие. // 4-е изд. — М.: МЕДпресс, 2000. – 312 с.
6. Орлов В.Н. Руководство по электрокардиографии. // 4-е стер. изд.-М.: Медицинское информационное агентство. — 2004. — 528 с.
7. Осадчий, К.К. Депрессия, тревога и ишемическая болезнь сердца: что необходимо знать кардиологу? / К.К. Осадчий // Кардиология. — 2009. — № 5. — C. 70-77.
8. Савельева И.В. Стратификация больных с желудочковыми нарушениями ритма по группам внезапной смерти. // Кардиология. — 1997. — № 8. — C. 82-96.
9. Шалыгин Л.Д., Лядов К.В., Пяткина Т.В. Адекватная антиаритмическая хронотерапия больных с ИБС. // 2001 конф. “Кардиология – ХХI век”.
10. Bigger J.T., Fleiss J.L., Kjeiger R. et al. Therelationships among ventricular arrhythmias, left ventricular dysfunction and mortality in the 2 years after myocardial infarction. // Circulation. — 1984. — v.69. — Р. 250.
11. Buxton A.E., Kirk M.M., Miehaud G.T. Current approaches to evaluation and management of patients with ventricular arrhythmias. // Med Health R I — 2001 Feb — 84(2). -Р. 58-62.
12. Chen S.W. A wavelet-based heart rate variability analysis for the study of nonsustained ventricular tachycardia. // Trans Biomed Eng — 2002 Jul — № 49(7). — Р.736-742.
13. Elhendy A., Sozzi F.B., van Domburg et al. Relation between exercise-induced ventricular arrhythmias and myocardial perfusion abnormalities in patients with intermediate pretest probability of coronary artery disease. // Eur J Nucl Med. — 2000 Mar — № 27(3). — Р. 327-332.
14. Gardner P.I., Ursel P.C., Fenoglio J.J. et al. Electrophysiologic and anatomic basis for fractionated electrograms recorded from healed myocardial infarcts. // Circulation. — 1989. — № 72. — Р. 596-611.
15. Goldstein S., Bayes-de-Luna A., Gumdo-Soldevila J. Sudden cardiac death. // Armonk: Futura. — 1994. — 343 p.
16. Gottlieb L.S., Weisfeldt M., Ouyang P. et al. Silent ischemia as a marker for early unfavorable outcomes in patients with unstable angina. // New Engl. J. Med. — 1986. — v.314. — Р. l214.
17. Kaasik A., Ristimae T., Soopold U. et al. The relationship between left ventricular mass and ventricular late potentials in patients with first myocardial infarction. // J Coronary Artery Disease. — 2001 Oct. — № 4(1). Р. 60.
18. Kleiger R.E., Miller J.P., Bigger J.T. et al.Decreased heart rate variability and its assocition with increased mortality after acute myocardial infarction.// Amer. J. CardioL. — 1987. — v.59. — Р. 256 — 262.
19. Kulakowski P., Malik M. Ventricular signal averaged electrocardiography. Risk of Arrhythmia and Sudden Death ed. // London. — 2001. — Р. 167-179.
20. Messerii F.N. Ventura H.O. Elizari D.J. et al. Hypertension and sudden death, increased ventricular ectopic activity in left ventricular hypertrophy. // Amer. J. Med. — 1984. — v.77. — Р. 18.
21. Morti V., Bayes-de-Luna A., Arriola J. et al. Value of dynamic QTc in arrhythmology. // New Trends Arrhyth. — 1988. — v.4. — Р. 683.
22. Myeburg R.J., Spooner P.M. Opportunities for sudden death prevention: directions for new clinical and basic research. // Cardiovasc Res — 2001 May — № 50(2). — Р. 177-185.
23. Nademanee K, Intarachot V., Josephson M. et al. Prognostic significance of silent myocardial ischemia in patients with unstable angina. // J. Amer. Coil. Cardiol. — 1987. — v.10. — Р.1.
24. Nicod H., Polikar R., Petersoh K.L. Hypertrophic cardiomyopathy and sudden death. // new Engl. Med. — 1987. — v. 316. — P. 780.
25. Podrid Ph.J., Kowey P.R. Handbook of cardiac arrhythmia. // Baltimore, Williams & Wilkins. — 1996. — 459 p.
26. Priori S.G., Barhanin J., N.W.Hauer R., et al. Genetic and molecular basis of cardiac arrhythmias: impact on clinical management. // Circulation. — 1999 Feb 2. — № 99(4). — Р. 518-528.
27. Rocco M.B., Nabel E.G., Campbell S. et al. Prognostic significance of myocardial ischemia detected by ambulatory monitoring in patients with stable coronary artery disease.// Circulation. — 1988. — v.78. — Р. 877.
28. Saeed M., Link M.S., Mahapatra S. et al. Analysis of intracardiac electrograms showing monomorphic ventricular tachycardia in patients with implantable cardioverter-defibrillators. // Am J Cardiol — 2000 Mar 1- № 85(5). — Р. 580-587.