- Главная /
- Отделения /
- Компьютерная томография /
- КТ с определением коронарного кальция
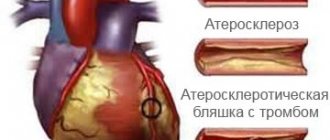
КТ с определением коронарного кальция — безболезненный способ определить риск развития атеросклероза. Метод основывается на измерении содержания кальция в бляшках стенок сосудов. Если в коронарных артериях выявлено большое количество кальция, это свидетельствует о наличии атеросклеротических бляшек и, как следствие, ишемические изменения сердца. В клиническом центре на Яузе тест проводится на новейшем оборудовании, что дает возможность прогнозировать развитие патологии, своевременно подобрать эффективные методы профилактики и лечения.
1.Что такое скрининг коронарного кальция?
Cкрининг коронарного кальция – это специальное рентгеновское исследование (компьютерная томография), при котором проверяются скопления кальция в коронарных артериях. Скрининг коронарного кальция позволяет определить болезни сердца на раннем этапе и выяснить их серьёзность.
Коронарные артерии доставляют кровь к сердцу. Как правило, в коронарных артериях не содержится кальция. Коронарный кальций может быть признаком ишемической болезни сердца (ИБС).
КТ позволяет сделать несколько изображений сердца «по слоям». Эти изображения могут использоваться для просмотра на компьютере или распечатываться.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Материал и методы
Проведен анализ литературы в поисковых системах Pubmed, GoogleScholar, Scopus и РИНЦ cписком ключевых слов «coronary artery calcification», «coronary artery calcification score», «кальциноз коронарных артерий», «кальциевый индекс». В данный обзор включена 51 работа по исследованиям, проведенным с 1990 по 2021 г., в которых описывались использование различных шкал для оценки степени тяжести поражения коронарных артерий, а также исследования, в которых изучались результаты прямой реваскуляризации миокарда при кальцинозе коронарных артерий.
Патогенез кальциноза коронарных артерий
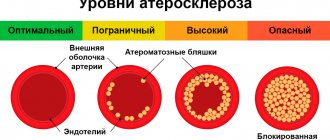
Долгое время считалось, что механизмы развития ККА представляют собой пассивный дегенеративный процесс и некую конечную стадию атеросклероза, что подтверждалось корреляцией степени кальциноза с возрастом пациента [5]. Современные исследователи склоняются к тому, что кальциноз артерий является активным процессом, в основе которого лежат механизмы, регулирующие обмен кальция, в частности механизмы роста и формирования костей [6]. Существует концепция, рассматривающая атеросклероз как хронический воспалительный процесс, индуцирующий остеогенную дифференцировку гладкомышечных клеток сосудов (ГМКС), которая приводит к ККА [7]. Не вызывает сомнений, что кальцификация бляшек начинается уже на стадии формирования липидных полос и только прогрессирует на всех остальных этапах атерогенеза. В настоящее время считается, что механизм кальциноза коронарных артерий аналогичен процессу формирования костной ткани.
Существует два признанных морфологических типа ККА: атеросклеротическая кальцификация с преимущественным поражением интимы и кальциноз медиального слоя артерий. При первом типе происходит индукция остеогенной дифференциации ГМКС медиаторами воспаления и липидами атеросклеротических бляшек [7]. Развитие событий по второму сценарию ассоциировано с преклонным возрастом, диабетом и хроническим заболеванием почек (ХЗП). Ранее считавшийся доброкачественным процессом, кальциноз медии способствует повышению артериальной жесткости, что увеличивает риск неблагоприятных сердечно-сосудистых событий [8]. Кальциноз коронарных артерий в том и другом варианте приводит к снижению эластичности стенки артерии, патологическим вазомоторным ответам и нарушению перфузии миокарда [9].
Известно, что бляшка, имеющая кальцинированную покрышку, намного более устойчива и резистентна к разрывам, чем «мягкая» бляшка и даже нормальная сосудистая стенка [10]. По-видимому, такой вывод применим только в случае гомогенной кальцификации. Согласно отдельным исследованиям, у пациентов при остром коронарном синдроме выявляются множественные мелкие включения кальция, называемые «пестрыми» или «пятнистыми», тогда как при хроническом течении ИБС определяются более крупные и равномерные кальцинаты [11]. Считается, что зона, образующаяся между кальцинированной покрышкой и некальцинированной сосудистой стенкой, является зоной потенциального разрыва [12]. При проведении ЧКВ высока вероятность развития диссекции именно в такой зоне; описано, что большие бляшки с явной «пятнистой» кальцификацией имеют тенденцию к разрыву [13].
В развитии кальциноза играют роль остеопонтин, остеопротегерин, RANKL, фетуин-А, костные морфогенетические белки. Все эти вещества вырабатываются в сосудистой стенке в процессе прогрессирования атеросклероза; доказано их участие в регуляции кальцификации бляшки. В ряде исследований выявлена связь уровня остеопонтина с уровнем коронарного кальция, измеренным с помощью мультиспиральной компьютерной томографии (МСКТ) [14]; предложено рассматривать остеопонтин как независимый фактор риска сердечно-сосудистых событий. Показано, что остеопонтин и костный морфогенетический белок 7-го типа определяют дифференциацию ГМКС в остеобластоподобные клетки и индуцируют процессы отложения кальция в стенке сосудов, а остеопротегерин играет ингибиторную роль в сосудистой кальцификации [15—17]. В норме между регуляторами кальцификации существует баланс, а ККА может развиваться при нарушении баланса в пользу индукторов. Точные механизмы этого процесса еще предстоит изучить.
Распространенность кальциноза коронарных артерий
Распространенность ККА зависит от возраста и пола. По данным большинства авторов, в возрастной категории старше 70 лет ККА встречается более чем у 90% мужчин и более чем у 67% женщин [18]. Высокий риск развития ККА отмечается у пациентов с высоким индексом массы тела, повышенным артериальным давлением, дислипидемией, гипергликемией, семейной предрасположенностью, ХЗП, высоким уровнем фибриногена и повышенным уровнем С-реактивного белка [19], т. е. при всех общепризнанных факторах рисках атеросклероза.
Диагностика
Компьютерная томография (КТ) является основой неинвазивной диагностики ККА; метод способен количественно оценивать кальциноз и обладает высокой чувствительностью и специфичностью. Мультиспиральная компьютерная томография (МСКТ) основана на измерении и компьютерной обработке разности ослабления рентгеновского излучения по плотности тканей. Для количественной оценки степени ККА используется расчетный показатель — кальциевый индекс (КИ). КИ коррелирует с тяжестью коронарного атеросклероза, наличием гемодинамически значимых стенозов коронарных артерий и риском развития коронарных осложнений [20]. Используется подсчет КИ по методике, предложенной в 1990 г. A. Agatston и соавт. [21]: КИ вычисляют путем умножения площади кальцинированного поражения коронарной артерии на условный фактор плотности. Фактор плотности вычисляют по пиковой плотности зоны кальциноза, выражаемой в единицах Хаунсфилда (G. Hounsfield) — HU. Он принимается за 1 ед. для кальцинатов плотностью 130—199 HU, за 2 ед. — для кальцинатов плотностью 200—299 HU, за 3 ед. — для кальцинатов плотностью 300—399 HU и за 4 ед. — для кальцинатов плотностью 400 HU и более. Так, например, при выявлении кальцината площадью 6 мм2 с пиковой плотностью 265 HU КИ составит 12 ед. (6×2), а для кальцината той же площади, но с пиковой плотностью 432 HU — уже 24 ед. (6×4). Суммарный К.И. вычисляется как сумма индексов, определенных на всех томографических срезах. Также предложены алгоритмы подсчета объемного КИ и подсчета массы фосфата кальция [22]. American College of Cardiology и American Heart Association (2010 г.) считают целесообразным неинвазивно измерять степень ККА для оценки риска сердечно-сосудистых заболеваний у бессимптомных пациентов с промежуточным риском (10-летний риск 10—20%); класс рекомендации IIa [23].
Показано, что по мере увеличения кальциевого индекса теряется чувствительность и повышается специфичность при прогнозировании ИБС [24]. Другими словами, при тяжелом кальцинозе коронарных артерий и очень высоком КИ детализировать топографию поражения и его степень становится сложно. Исходя из этого, Z. Qian и соавт. предложили отдельные методики оценки кальциноза атеросклеротических бляшек (lesion-specificscore) и коронарных артерий (vessel-specificscore) как дополнение к уже существующей шкале по Agatston. Использование lesion-specific and vessel-specific calcium score увеличивает чувствительность исследования (при 80% специфичности), что превосходит традиционный показатель шкалы Agatston при прогнозировании ИБС [25].
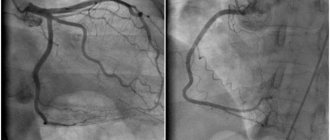
Коронарная ангиография обладает более низкой чувствительностью по сравнению с КТ-сканированием при определении ККА, но в то же время обладает высокой специфичностью. По данным ангиографии ККА оценивается с использованием следующих критериев: 1) оценка кальциноза целевого сосуда по 4-балльной шкале (0 — нет кальциноза, 1 — едва заметный кальциноз, 2 — легко визуализируемый, умеренный кальциноз и 3 — тяжелый кальциноз), 2) глубина кальциноза после введения контраста (поверхностный при кальцинозе ближе к просвету сосуда, глубокий — при кальцинозе ближе к адвентиции), 3) определяется ли ККА достоверно в двух и более ортогональных проекциях и 4) определяется ли ККА на участках, отличных от целевого сосуда [26].
Внутрисосудистое ультразвуковое исследование (ВСУЗИ) — более точный метод диагностики коронарных артерий, чем ангиография, с высокой чувствительностью (90—100%) и специфичностью (99—100%). Кальцинированная бляшка при ВСУЗИ представляет собой эхогенную тень с акустическим затемнением, а степень кальциноза может быть оценена несколькими показателями. В соответствии с диапазоном кальцифицированного поражения по ВСУЗИ выделяют 4 класса: класс 1 (угол кальцинированного поражения от 0 до 90°), класс 2 (угол ККА от 91 до 180°), класс 3 (угол ККА от 181 до 270°) и класс 4 (угол ККА от 271 до 360°). Расположение кальция определяется как поверхностное (присутствует в интимальном слое), глубокое (присутствует в медиально-адвентициальном слое) и смешанное. Кальциевые депозиты оцениваются в самой толстой атеросклеротической бляшке [27].
Оптическая когерентная томография (ОКТ) является оптическим аналогом внутрисосудистого ультразвука; она также обладает высокой чувствительностью и специфичностью для идентификации ККА. Различие в физическом принципе действия двух данных методов заключается в том, что при ОКТ для исследования биологических тканей используется не акустическая волна, а излучение инфракрасного света с длиной волны около 1300 нм. Однако разрешение ОКТ (до 10—20 мкм) примерно в 10 раз выше, чем у ВСУЗИ (до 100—150 мкм), что позволяет дифференцировать интиму, медию и адвентицию. H. Yabushita и соавт. [28] при анализе данных ОКТ описали специфические особенности каждого типа атеросклеротической бляшки: фиброзная бляшка характеризуется однородной областью высокого сигнала с низким затуханием, кальцинированная — хорошо очерченной областью с низким уровнем сигнала и четкими границами и богатая липидами бляшка — областью с низким сигналом и диффузными границами. Несмотря на высокое разрешение, у ОКТ есть ряд недостатков, которые могут создать проблему при измерении площади кальцификации и визуализации глубоких сосудистых структур. Так, максимальная глубина проникновения сигнала составляет 1—2 мм (у ВСУЗИ — до 4—8 мм), а абсорбция гемоглобином и рассеивание на эритроцитах ведут к сильному затиханию сигнала [29].
Таким образом, сегодня в распоряжении клиницистов есть диагностические инструменты, позволяющие оценить кальциноз коронарных артерий и качественно, и количественно. Однако надо признать, что удобные и неинвазивные методы пригодны в большей степени для скрининга коронарной болезни. Для детальной же оценки, включающей протяженность кальциноза, вовлечение дистальных сегментов артерии, требуются дорогостоящая инвазивная методика и, возможно, сопоставление ее данных с данными, полученными интраоперационно.
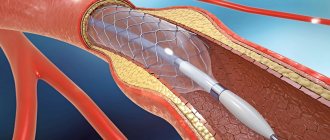
Чрескожное коронарное вмешательство
Коронарный кальциноз повышает вероятность развития осложнений ангиопластики и поэтому зачастую является причиной отказа от ее выполнения [30]. Давление, оказываемое на стенку сосуда при раздувании баллона, может оказаться неравномерным по причине различной степени выраженности кальциноза; это увеличивает риск диссекции, острой окклюзии сосуда, возможность последующего рестеноза и развития неблагоприятных сердечно-сосудистых событий [31]. Выраженный ККА создает сложности при доставке устройства, повышает риск эмболизации сосуда, что в свою очередь приводит к увеличению частоты перипроцедурного ИМ [32].
С внедрением голометаллических стентов (ГМС) ранняя и долгосрочная выживаемость улучшилась. Однако неполное раскрытие стента, асимметричное раскрытие, некорректная установка или смещение стента, наблюдавшиеся при выраженном ККА, повышали риск рестеноза и тромбоза стента [33].
Использование стентов с лекарственным покрытием (СЛП) оказалось более эффективным. Согласно результатам исследования TAXUS-IV, у пациентов с кальцинированными поражениями частота развития ишемии в бассейне целевого сосуда в течение 1 года была на 56% ниже при применении СЛП по сравнению с ГМС (5,1% против 11,9%, p
=0,09), однако у пациентов с некальцинированными коронарными артериями это различие оказалось существенно большим (на 75% ниже и 4,3% против 15,7%,
p
<0,0001) [3]. Аналогичные результаты описаны в метаанализе B. Zhang и соавт. (2015): применение СЛП значительно снижает необходимость повторных реваскуляризаций целевых сосудов по сравнению с ГМС у пациентов с ККА (8,5% против 16,0%; относительный риск: 0,50; 95% доверительный интервал: 0,38—0,65;
p
<0,00001) [34]. Однако существуют и исследования, сообщающие о сходных показателях тромбоза и рестеноза СЛП и ГМС у пациентов с ККА, с сопоставимыми показателями смертности и ИМ [2, 3].
Таким образом, при последовательном изучении результатов эндоваскулярного лечения больных ИБС с кальцинированными коронарными артериями показано, что наилучшие результаты получены при имплантации стентов с лекарственным покрытием. С другой стороны, проводилось сравнение результатов стентирования с таковыми у больных без кальциноза. Они свидетельствуют о более высокой частоте рестеноза и повторной реваскуляризации у пациентов с ККА [35].
Потенциальные факторы риска рестеноза и повторной реваскуляризации, такие как неполное раскрытие стента, повреждение лекарственного покрытия стента вследствие ККА, а также использование других устройств (в том числе ротационной атерэктомии), могут напрямую способствовать гиперплазии неоинтимы [36].
Режущие и надсекающие баллонные катетеры не удаляют кальций, а улучшают эластичность стенок артерий путем создания дискретных разрезов в атеросклеротической бляшке, что позволяет увеличить площадь работы на пораженных участках артерии и уменьшить сужение стента, предотвращая диссекцию сосудов. Показанием к режущему баллону является относительно короткое поражение (<20 мм). Для пролонгированных и циркулярных поражений использование таких баллонов не рекомендуется. Кроме того, давление в режущем баллоне не должно превышать 12 атм, чтобы избежать врезания лезвия баллона в стенку сосуда [37].
Ротационная атерэктомия в отличие от режущего баллона иссекает твердую ткань коронарного кальция с образованием мелких частиц (<10 мкм), не затрагивая мягкую эластичную ткань. Пациенты с ККА, подвергающиеся ротационной атерэктомии, имеют повышенный риск тромбоза, развития феномена «no-reflow» с увеличением риска перипроцедурного ИМ [38]. Однако применение ротационной атерэктомии признано клинически эффективным у пациентов с ККА [39]. В целях улучшения прогноза после воздействия рекомендуется имплантация СЛП. Существует ряд исследований, сообщающих о благоприятных долгосрочных результатах после имплантации СЛП с предшествующей ротационной атерэктомией [40].
Лазерная коронарная атерэктомия использует импульсную энергию эксимерного или гольмиевого лазера, генерирующую переходные волны высокой энергии; происходит фотоакустическое воздействие на резистентные атеросклеротические поражения. Несмотря на то что метод был введен более двух десятилетий назад, в силу его неопределенных результатов, а также ввиду появления СЛП лазерная ангиопластика потеряла практическое значение как самостоятельное вмешательство и ее использование ограничивается несколькими центрами. В некоторых исследованиях продемонстрированы потенциальные процедурные осложнения, такие как диссекция сосудов (особенно сосудов с поверхностным кальцием), перфорация, а также высокий риск рестеноза [41]. Тем не менее процедура может быть использована у пациентов с ККА с целью разрушения кальция перед имплантацией стента в случаях наличия риска неполного раскрытия стента [42].
Орбитальная атерэктомия, подобно ротационной, оказывает дифференциальное аблационное воздействие на твердые и мягкие поверхности, производя частицы размером <2 мкм при воздействии центробежной силы на стенку сосуда. Устройство позволяет операторам контролировать глубину аблации путем увеличения скорости вращения (от 60 000 до 120 000 об/мин). Как и ротационная, орбитальная атерэктомия улучшает эластичность стенок артерий для уменьшения процедурных осложнений и облегчения имплантации стента. Согласно данным, полученным J. Chambers и соавт., использование орбитальной атерэктомии при выраженном коронарном кальцинозе не только способствовало лучшей доставке стента, но также улучшало ранние и 30-дневные клинические исходы по сравнению с результатами ранее проведенных исследований у аналогичной когорты пациентов [43].
Таким образом, эволюция эндоваскулярной реваскуляризации и анализ ее результатов позволяют оптимистично смотреть на перспективы лечения больных с коронарной болезнью, однако изучение ближайших и отсроченных результатов показывает меньшую эффективность лечения в том случае, если коронарные артерии кальцинированы.
Операция коронарного шунтирования
Тот факт, что кальциноз коронарных артерий является предиктором худшего прогноза ЧКВ, заставляет клиницистов считать приоритетным методом лечения в этой ситуации хирургическую реваскуляризацию. Однако вопрос о прогностическом значении ККА для пациентов, перенесших КШ, остается неясным, и имеющиеся данные не позволяют сделать основательных выводов. Существует лишь несколько исследований, направленных на решение данного вопроса. Представляет интерес работа M. Castagna и соавт., высказавших суждение о более частом развитии кальцификации аутовенозных шунтов у пациентов с исходным кальцинозом нативных коронарных артерий [44].
В анализе K. Ertelt и соавт. сообщается о 755 пациентах с ОКС, которые были включены в исследование ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy Trial) со сроком наблюдения 1 год после проведенного КШ [45]. Авторами было обнаружено, что выраженное кальцинированное поражение КА являлось независимым предиктором основных неблагоприятных сердечно-сосудистых событий: при сравнении годичной смертности у пациентов с выраженным (n
=103), умеренным (
n
=249) и отсутствующим кальцинозом (
n
=403) она составила соответственно 11,8, 3,7 и 4,5%,
р
=0,006.
В аналогичное исследование C. Bourantas и соавт. (2015 г.) вошли 1545 пациентов (896 из реестра SYNTAX и 645 — из реестра SYNTAX CABG) для наблюдения в течение 5 лет после К.Ш. Сравнивались пациенты с выраженным кальцинозом (n
=548) и без выраженного кальциноза коронарных артерий (
n
=997). У пациентов с выраженным ККА наблюдалась более высокая смертность: 17,1% против 9,9%,
p
<0,001, однако частота неблагоприятных нефатальных сердечно-сосудистых событий в группах оказалась сходной (26,8% против 21,8%,
p
=0,057). Более высокая смертность в группе выраженного кальциноза частично была объяснена наличием более тяжелой сопутствующей патологии (почечная недостаточность, гипертония) и мультифокальным атеросклерозом [1]. Существенным ограничением исследования является тот факт, что характеристика кальциноза проводилась на основе ангиографических данных без использования МСКТ или ВСУЗИ.
Медикаментозное лечение
На сегодняшний день не существует общепринятого консервативного лечения ККА. Роль статинов в лечении пациентов с ККА не ясна. Согласно многочисленным исследованиям, терапия статинами не оказывает существенного влияния на ККА артерий [46]. Отдельные исследователи даже высказывают мнение, что статины способны усиливать процесс кальцификации [47]. Нерандомизированные исследования показывали регрессирование ККА при использовании блокаторов кальциевых каналов, гормональной терапии, а также препаратов, связывающих фосфаты [48, 49].
Отдельного упоминания в медикаментозной терапии заслуживает оценка влияния приема кальциевых добавок. На основании результатов крупного исследования EPIC-Heidelberg, в которое было включено 24 тыс. человек в возрасте от 35 до 64 лет, авторы утверждают, что употребление кальциевых добавок может достоверно увеличивать риск развития инфаркта миокарда [50]. По некоторым данным, риск инфаркта миокарда увеличивается при употреблении кальциевых добавок в дозе более 800 мг/сут [7]. Существуют и исследования, приведшие к противоположному выводу: употребление кальция в пищу не оказывает значительного влияния на кальциноз сосудов и сердечно-сосудистые события [51].
2.Зачем измерять коронарный кальций?
Скриннинг коронарного кальция проводится, если вы входите в группу риска сердечных заболеваний. Скрининг коронарного кальция не рекомендован всем людям, как обычная процедура для проверки на ишемическую болезнь сердца (ИБС).
Скрининг коронарного кальция не подходит вам, если:
- Вы не входите в группу риска ишемической болезни сердца (ИБС);
- У вас уже диагностированы болезни сердца.
Этот тест также не подходит мужчинам младше 40 и женщинам младше 50, т.к. у молодых людей нет отложений коронарного кальция.
Посетите нашу страницу Кардиология
Нужна ли специальная подготовка
Если есть вероятность беременности, об этом необходимо сообщить лечащему врачу. В остальном пациента могут попросить не употреблять кофеинсодержащих напитков или не есть накануне теста. Поскольку курение также может исказить результаты скрининга, на консультации кардиолога могут порекомендовать воздержаться от него.
При обычных обстоятельствах этот специфический тест назначают редко: как правило, для постановки диагноза достаточно медосмотра и других исследований. Если обследование пройдено и результаты томографии отрицательные, это расценивается как большой риск развития ишемической болезни сердца. У пациента появляется шанс предотвратить нежелательный сценарий, изменив образ жизни, занявшись спортом и наладив правильное питание.
Опытные кардиологи порекомендуют и другие эффективные способы снизить риски. Главное – прислушаться к советам и задуматься о собственном здоровье!
3.Как проводится скрининг?
Компьютерная томография тела проводится технологом и расшифровывается радиологом. Другие доктора также могут пользоваться полученными снимками.
Вас попросят снять все ювелирные украшения и раздеться. Вам дадут пелёнку, чтобы накрыться во время процедуры. Вам нужно будет лечь на стол, к которому прикреплён томограф.
Затем стол въезжает в томограф, и он движется вокруг вашего тела, делая снимки. Вы можете слышать шумы во время процедуры. Во время процедуры важно оставаться неподвижным.
Если необходимо, то могут провести миелографию, т.е. КТ с использованием специального красителя. Контрастное вещество, как правило, вводится в вену на руке. После этого ждут некоторое время, чтобы краситель распространился по организму.
Процедура занимает от 30 до 60 минут.
Как подготовиться к скринингу коронарного кальция?
Перед скринингом коронарного кальция сообщите своему доктору о возможной или подтверждённой беременности. Вас могут попросить не есть и не пить ничего кофеинсодержащего некоторое время перед тестом.
О нашей клинике м. Чистые пруды Страница Мединтерком!