Селезёночная артерия — это кровеносный сосуд, который снабжает кровью селезёнку. Селезёнка — это орган, участвующий в кроветворении и регуляции иммунной системы. Аневризма селезёночной артерии является третьим по распространённости типом аневризмы, встречаясь у 1% всех пациентов, проходящих через сосудистые хирургические отделения. Под аневризмой подразумевается локальное расширение с диаметром артерии более чем 10 мм.
Аневризма селезёночной артерии представляет собой большую опасность, которая заключается в возможности её разрыва с профузным кровотечением и гибелью больного. Установленный диагноз селезёночной аневризмы является показанием к хирургическому вмешательству по её устранению, так как спасти больного с разрывом аневризмы удаётся крайне редко.
Что такое аневризма
Селезеночная артерия залегает вдоль или позади верхнего края поджелудочной железы и распадается на мелкие сосуды в воротах селезенки. При аневризме происходит ее патологическое расширение под влиянием ряда внутренних и внешних факторов:
- многоплодная беременность;
- заболевания поджелудочной железы;
- узелковый периартериит (воспаление стенки артерии);
- красная волчанка;
- различные травмы;
- сосудистые патологии печени.
Риск развития аневризмы поджелудочной железы или селезенки увеличивается после 50 лет. Чаще заболевание диагностируется у женщин, чем у мужчин, особенно при наличии осложнений при беременности.
Симптомы болезни
В большинстве случаев заболевание протекает бессимптомно. О мешотчатой аневризме селезеночной артерии и о том, что это такое, пациенты узнают случайно в результате обследования близлежащих органов. Признаком патологии могут быть боли в животе, тошнота и рвота. При крупных аневризмах у людей худощавого телосложения возникают негативные ощущения в левом подреберье.
Болезнь может долгое время протекать латентно. Если происходит разрыв, обильное внутреннее кровотечение дает о себе знать бледностью кожи, общей слабостью, снижением артериального давления и частоты пульса, появлением липкого холодного пота. При пальпации выявляется болезненность живота.
Причины
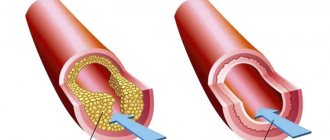
Такая патология, как аневризма сосуда, возникает, когда сосудистая стенка ослаблена и под давлением крови деформируется. Причин появления аневризм существует несколько. Заболевание может возникнуть вследствие таких факторов:
- Атеросклероз сосудов, который ослабляет сосудистые стенки.
- Повышенное артериальное давление.
- Различные опухоли и серьезные травмы.
- Аневризма может возникнуть и в результате генетических изменений: сбоев при формировании соединительной ткани, врожденных патологий кровообращения.
В каких случаях нужна операция
Чаще лечение проводится хирургическим путем. Оно необходимо, когда диаметр аневризмы достигает 5-6 см. В этом случае риск разрыва существенно увеличивается. Выбор методики осуществляется врачом с учетом целого ряда факторов.
Способы лечения аневризмы селезеночной артерии:
- Аневризморафия. Метод применяется при локализации аневризмы в дистальном отделе артерии и представляет собой ушивание аневризматического мешка.
- Резекция аневризмы со спленэктомией. Устранение патологического участка артерии происходит с последующим удалением селезенки. Хирургическая операция проходит открыто или с применением лапароскопии (манипуляции выполняются через микронадрезы с применением лапароскопа, оснащенного видеокамерой, и микроинструментов).
- Эмболизация спиралями. Это современный высокотехнологичный метод лечения аневризм. Цель хирургического вмешательства заключается в прекращении кровотока в аневризматическом мешке путем введения спирали. Имплантация последней производится через микрокатетер.
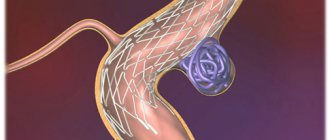
- Стентирование. Задача при проведении операции аналогичная предыдущей методике — исключение патологического сосуда из кровотока. В артерию через микрокатетер имплантируется стент-графт (протез в форме трубки). После его установки изменяется направление кровотока, аневризма со временем тромбируется. Аневризматический мешок оказывается изолированным из системы кровообращения после проведения операции, поэтому риск разрыва и кровотечения исключается.
Стентирование и эмболизация аневризмы селезеночной артерии — наиболее современные малоинвазивные методы хирургического вмешательства. При плановом проведении операции они гарантируют благоприятный прогноз.
Аневризма селезеночной артерии (АСА) была описана M. Beaussier в 1770 г. По данным аутопсий, при специальном осмотре селезеночной артерии ее аневризмы обнаруживали в 10% случаев [1], что свидетельствует об их нередко бессимптомном существовании. АСА величиной от 5 см и более считаются гигантскими [2—5], к 2005 г. описано всего 18 случаев подобных аневризм [5]. К 2015 г. при анализе электронных баз данных найдено уже 69 публикаций, в которых сообщалось о 78 пациентах с АСА величиной более 5 см [2]. В источнике литературы [6] описана гигантская АСА размером 30×20×20 см. Благодаря широкому применению современных диагностических методов АСА все чаще стали выявлять прижизненно. Тем не менее аневризмы этой локализации, в том числе гигантские, как правило, оказываются случайными находками при инструментальных обследованиях, а также во время оперативных вмешательств, производимых по совершенно иным показаниям. Помимо истинных АСА, стенка которых имеет 3 сосудистых слоя, существуют и ложные аневризмы, в их структуре отсутствуют один или два сосудистых слоя (чаще адвентиция). К формированию псевдоаневризм может приводить повреждение стенки селезеночной артерии при панкреатите [7], что необходимо учитывать при ведении таких пациентов [8]. Помимо панкреатита, факторами, способствующими образованию АСА, могут быть портальная гипертензия, атеросклероз, заболевания соединительной ткани, травмы, многократная беременность, септические состояния, операции трансплантации печени [5, 9—11].
АСА, особенно имеющие небольшие размеры, могут долгие годы оставаться бессимптомными [2], но при их внезапном разрыве возникают опасные для жизни кровотечения в брюшную полость, забрюшинное пространство, желудок [12, 13], петли кишечника [14, 15], поджелудочную железу и вирсунгов проток [2, 16, 17]. Спонтанные разрывы происходят у 2—10% больных, чаще при гигантских (до 28%) и псевдоаневризмах (до 37%), при этом летальность достигает 40% [2].
Лечение АСА хирургическое. Из открытых вмешательств применяются аневризмэктомия, в том числе с сопутствующей спленэктомией, перевязка селезеночной артерии. Нередко объем хирургического вмешательства приходится расширять с вовлечением прилежащих к АСА органов, таких как поджелудочная железа, толстый кишечник, желудок, что значительно усложняет операцию [2, 4, 13, 16, 18]. В ряде случаев по этим причинам, а также ввиду тяжелого состояния пациента или наличия у него серьeзных сопутствующих заболеваний открытое вмешательство может оказаться невозможным либо очень опасным.
В последнее время для лечения АСА все чаще применяются чрескожные эндоваскулярные вмешательства: эмболизация полости аневризмы и/или проксимального отрезка селезеночной артерии с помощью специальных спиралей или эмболизирущих средств (этилен-винил-алкоголь-кополимер, N-бутил-2-цианоакрилат), блокирование устья аневризмы с помощью стент-графта, введение тромбина в полость аневризмы. Выбор эндоваскулярной методики зависит от размера аневризмы, состояния ее устья (узкое или широкое), ее расположения на протяжении селезеночной артерии, наличия определенных эмболизирующих средств, предшествующего опыта подлобных вмешательств [3, 19—23].
Приводим два клинических наблюдения пациентов с большими АСА, в лечении которых успешно применена транскатетерная проксимальная эмболизация селезеночной артерии.
Больной Ю
., 62 года, в 2011 г. при проведении спиральной компьютерной томографии (СКТ) коронарных артерий в поле зрения томографа захвачены верхние отделы брюшной полости и забрюшинного пространства. В надпочечниках найдены образования размером 2×3 и 4×2,5 см, которые при дальнейшем обследовании оказались доброкачественными опухолями без гормональной активности, а в области тела поджелудочной железы также случайно обнаружено образование размером 4,5×4 см (рис. 1),
Рис. 1. Спиральная компьютерная томограмма селезеночной артерии пациента Ю., 2011 г. Аневризма 4,5×4,0 см (указана стрелкой). которое интерпретировано как панкреатическая киста. Через 1 год при УЗИ гепатобилиарной зоны в проекции поджелудочной железы также выявлено жидкостное образование размером 4,4×4,1×4,8 см с неоднородной структурой, без признаков кровотока при цветовом допплеровском картировании (ЦДК), также расцененное как киста.
В конце 2015 г. пациент госпитализирован по поводу гипертонического криза в отделение кардиологии и ему проведена СКТ для оценки выявленных в 2011 г. опухолей надпочечников, размеры и структура которых остались неизмененными. Также подтверждено наличие образования в области тела поджелудочной железы. Применение контрастной методики прояснило природу этого образования — АСА, размер которой увеличился за 4 года до 5,1×6,3×6,2 см. В пристеночной области аневризмы определены тромботические массы с включениями кальция, размер нетромбированной части полости составил 4,1×4,7×5,2 см. При трехмерной реконструкции четко определялись проксимальный приносящий и дистальный выносящий сегменты селезеночной артерии (рис. 2 и 3).
Рис. 2. Спиральная компьютерная томограмма селезеночной артерии пациента Ю., 2015 г., контрастное усиление. Аневризма 6,3×6,2 см (указана стрелкой).
Рис. 3. Спиральная компьютерная томограмма селезеночной артерии пациента Ю., 2015 г., контрастное усиление, 3D-реконструкция. 1 — аневризма 5,1×6,3×6,2 см, 2 — приводящий сегмент селезеночной артерии, 3 — отводящий сегмент селезеночной артерии. Сдавленное аневризмой тело поджелудочной железы было истончено, а вирсунгов проток расширен до 5 мм. Больной консультирован хирургом, который сделал заключение о высоком риске осложнений в случае использования открытого хирургического вмешательства в связи с особенностями расположения аневризмы, еe плотным контактом с тканью поджелудочной железы.
24.02.16 больной госпитализирован в Краевую клиническую больницу № 2 Хабаровска для проведения плановой ангиографии, которая подтвердила наличие большой АСА размером 6×6 см, расположенной ближе к аорте, без четко выраженной шейки (рис. 4).
Рис. 4. Ангиограмма селезеночной артерии пациента Ю. от 24.02.16. Аневризма 6×6 см (указана стрелкой). Принято решение о необходимости эндоваскулярной эмболизации проксимального сегмента селезеночной артерии в связи с большими размерами аневризмы и увеличением ее в динамике, что определяло высокий риск разрыва. 24.08.16 пациенту произведена селективная катетеризация селезеночной артерии с последовательной эмболизацией ее проксимального сегмента отделяемыми мини-спиралями СООК размером 15×15, 10×8, 8×5мм. Контрольная ангиография показала значительное замедление контрастирования полости аневризмы (рис. 5).
Рис. 5. Ангиограмма селезеночной артерии пациента Ю. от 24.08.16. 1 — проксимальный сегмент эмболизирован мини-спиралями СООК, 2 — мини-спирали в просвете аневризмы, кровоток в аневризме редуцирован.
На 3-и сутки после эндоваскулярной эмболизаци сделана контрольная СКТ: аневризма полностью тромбирована, накопления контрастного препарата нет, в просвете сегментов селезеночной аретерии расположены мини-спирали (рис. 6).
Рис. 6. Спиральная компьютерная томограмма селезеночной артерии пациента Ю., 26.08.16, контрастное усиление. 1 — аневризма заполнена тромботическими массами, кровоток в ней отсутствует, 2 — эмболизирующие мини-спирали в проксимальном сегменте селезеночной артерии.
Послеоперационный период протекал без осложнений, на 8-й день пациент выписан домой. При контрольной СКТ через 5 мес полость аневризмы остается полностью тромбированной, проксимальный отрезок селезеночной артерии заполнен эмболизирующими спиралями.
Пациентка Р
., 34 года, поступила в хирургическое отделение 11.03.18 с жалобой на резкую слабость, кровавую рвоту. В анамнезе хронический гепатит смешанной этиологии (HCV-инфекция и злоупотребление алкоголем), ассоциированный с циррозом печени, класса С по классификации Чайлда — Пью, портальная гипертензия, асцит, спленомегалия. В 2006 г. оперирована по поводу проникающего ножевого ранения брюшной полости. При поступлении состояние тяжелое, кожные покровы бледные, пульс 114 в 1 мин, АД 60/40 мм рт.ст. При эзофагогастроскопии выявлена язва нижней трети пищевода без признаков продолжающегося кровотечения. Проводили гемостатическую терапию (переливание эритроцитной массы, свежезамороженной плазмы), в ходе которой состояние улучшилось, стабилизировалась гемодинамика. 13.03.18 при УЗИ в проекции головки поджелудочной железы обнаружено жидкостное образование 6,7×7,5 см с толстыми стенками. Через 3 сут при повторной эхографии отмечено увеличение его размеров до 8,2×7,1 см. 21.03.18 пациентке произведена операция: лапаротомия, гастротомия, ревизия желудка. Обнаружена деформация задней стенки желудка из-за пульсирующего опухолевидного образования в сальниковой сумке, при пункции которого через заднюю стенку желудка получена артериальная кровь. Дефект в области пункции ушит узловыми швами. Интраоперационно выполнена ультразвуковая допплерография, выявлен артериальный (пульсирующий) кровоток в просвет образования. Принято решение закончить операцию ушиванием тела желудка, дренированием брюшной полости. 23.03.18 выполнена органов брюшной полости с контрастным усилением, выявлена частично тромбированная мешотчатая аневризма (вероятно, псевдоаневризма) селезеночной артерии размером 7,8×5,7 см (рис. 7).
Рис. 7. Спиральная компьютерная томограмма селезеночной артерии пациентки Р., контрастное усиление. Частично тромбированная аневризма 7,8×5,7 см (указана стрелкой). В связи с большими размерами аневризмы, которые увеличились в динамике за 3 сут, что создавало высокий риск разрыва, принято решение об эндоваскулярном хирургическом вмешательстве. 28.03.18 пациентке произведены катетеризация правой бедренной артерии, ангиография чревного ствола, подтвердившая диагноз аневризмы селезеночной артерии (рис. 8).
Рис. 8. Ангиограмма селезеночной артерии пациентки Р. Контраст в полости аневризмы (указано стрелкой). В область шейки аневризмы установлен стент-графт. На контрольной ангиограмме сохранялось заполнение аневризмы кровотоком. Выполнена эмболизация селезеночной артерии отделяемыми периферическими спиралями 0,035”. Во время установки спиралей произошла дислокация стент-графта в дистальную часть селезеночной артерии. На контрольной ангиограмме отмечено снижение кровотока в области аневризмы (рис. 9).
Рис. 9. Ангиограмма селезеночной артерии пациентки Р. Проксимальный отдел эмболизирован спиралями (указано стрелкой), кровоток в аневризме снижен. На 5-е сутки после эндоваскулярного вмешательства выполнена контрольная СКТ с контрастным усилением: отмечены пристеночный тромбоз селезеночной артерии от устья в зоне эмболизации, отсутствие накопления контраста в аневризме, гетерогенность ее содержимого, признаки тромбоза аневризмы (рис. 10).
Рис. 10. Спиральная компьютерная томограмма селезеночной артерии пациентки Р., контрастное усиление, 5-е сутки после эндоваскулярного вмешательства. Тромбоз в зоне эмболизации спиралями (указано стрелкой). Кровоток в аневризме отсутствует, полость ее тромбирована. 09.04.18 больная выписана на 12-е сутки после эндоваскулярного вмешательства в удовлетворительном состоянии. Наблюдается в поликлинике по месту жительства.
Наше первое наблюдение подтверждает, что даже довольно большие АСА могут протекать бессимптомно и оказываются случайной находкой при обследовании или проведении хирургических операций по иным показаниям. Во втором случае клиника желудочного кровотечения с кровавой рвотой и геморрагическим шоком не исключала возможного прорыва псевдоаневризмы через заднюю стенку желудка. В обоих случаях при первоначальном обследовании аневризмы расценены как кисты поджелудочной железы. Поэтому представляется целесообразным при выявлении подобных образований, имеющих большие размеры и особенно признаки васкуляризации при эхографии с цветным допплеровским картированием, проводить мультиспиральную КТ с контрастным усилением, позволяющим достаточно точно установить диагноз АСА.
Необходимость оперативного лечения в приведенных наблюдениях продиктована не только большими размерами аневризм, но еще и тем, что в динамике произошло увеличение их размеров (во втором случае очень быстро, в течение 3 сут), что создавало очень высокий риск разрыва. Имеются данные о том, что блокирование гигантских АСА стент-графтом может оказаться неэффективным из-за его пролабирования и последующей миграции в полость аневризмы через широкое устье, которое еще и затрудняет проведение стент-графта в дистальный по отношению к аневризме сегмент селезеночной артерии [20]. В наших наблюдениях эффективной оказалась именно эмболизация проксимальной части селезеночной артерии. Немаловажно и то, что использование этой методики позволяет сохранить селезенку, кровоснабжение которой продолжает осуществляется через короткие желудочные, желудочно-сальниковые и панкреатические коллатерали. Еще одним преимуществом эндоваскулярных методик лечения АСА является возможность их использования в ситуациях, когда открытое хирургическое вмешательство невозможно или сопряжено с высоким операционным риском, обусловленным как анатомическими особенностями расположения аневризмы, так и состоянием больного.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail
Лечение в домашних условиях
Своевременная диагностика дает шанс замедлить развитие болезни с помощью медикаментов. Наибольшую информативность при аневризме селезенки дает лучевая диагностика. Она включает:
- Ангиографию (рентгенологическое исследование артерий и вен). Метод позволяет выявить локализацию патологического расширения и наличие внутреннего кровотечения. Диагностика проводится с введением в сосуд контрастного вещества и одновременно исследования артерии рентгеновским аппаратом.
- Рентгенография. Диагностика также проводится рентгеновскими лучами, но с применением специальной бумаги для получения спроецированного изображения анатомических структур.
- КТ и МРТ. Эти методы играют большую роль в дифференциальной диагностике и позволяют установить точное местонахождение аневризмы.
- УЗИ с доплером. Диагностический метод дает возможность исследовать кровоснабжение органов и на основании полученных данных установить наличие патологии.
Инструментальная диагностика позволяет точно установить локализацию патологии и степень риска развития осложнений у пациента. Если небольшая аневризма обнаружена на ранней стадии, возможна медикаментозная терапия под постоянным наблюдением врача.
Она включает прием бета-блокаторов, препаратов, назначаемых при гипертонии, высоком уровне холестерина. Медикаменты замедляют рост аневризмы, но не могут полностью от нее излечить. Принимать препараты пациент может в домашних условиях. Если требуется инъекционное введение, возможно амбулаторное лечение.
Диагностика аневризмы
В нашем отделении сосудистой хирургии силами опытных врачей-флебологов выполняется качественная диагностика любых форм аневризм с помощью современных инструментальных методик:
· вентрикулография и ангиография – инвазивные исследовательские методы, предполагающие введение в русло сосудов в зоне поражения контраста. Такие исследования позволяют обнаружить аневризмы сосудов, их расслоение, признаки разрыва или тромбоза;
· ЭХО сердца, УЗДГ артерий – применяется для диагностики аневризм, локализующихся вне головного мозга;
· ультразвуковое исследование сосудов, допплерография;
· КТ с применением контраста – позволяет выявить признаки расслоения аневризмы.
Обнаружить признаки кровотечения или тромбоза артерий также можно при проведении лабораторных исследований крови.
Профилактика аневризмы селезеночной аорты
Пациентам, которые входят в группу риска, рекомендуется соблюдать ряд рекомендаций:
- меньше употреблять в пищу животных жиров и обогатить рацион овощами и фруктами;
- держать под контролем уровень холестерина с помощью анализов крови;
- отказаться от сигарет и спиртных напитков;
- вести здоровый образ жизни;
- держать под контролем показатели артериального давления;
- при появлении подозрительных симптомов обращаться к врачу;
- сделать профилактическое УЗИ органов брюшной полости.
Поскольку уровень смертности при аневризме составляет 40-50%, своевременная профилактика позволит избежать серьезных осложнений и предотвратить разрыв сосуда.
Остались вопросы про аневризму селезеночной артерии?
Бесплатная консультация специалистов AngioClinic
Автор
Салмина Дарья Владимировна
Врач генетик. Окончила Челябинскую Государственную медицинскую академию. Прошла интернатуру в Северо-Западном Государственном медицинском университете имени И.И. Мечникова.