Гепарин гель я 1000ме/г 30г №1
Наименование
Гепарин гель 1000ЕД/1г 30г
Описание
Гель от бесцветного до светло-желтого цвета со специфическим запахом.
Основное действующее вещество
Гепарин натрия
Форма выпуска
Гель
Дозировка
1000ЕД/1г
Фармакологическое действие
Фармакологические исследования показывают, что при наружном применении гель Гепарин обладает выраженным противоэкссудативным, противоотечным, антигрануломатозным, противовоспалительным и антикоагулянтным действием.
Показания к применению
— симптоматическое лечение и уменьшение отеков и кровоподтеков после тупой травмы (например, после ушиба); — симптоматическое лечение заболеваний поверхностных вен (варикозное расширение, флебит, перифлебит, тромбофлебит), варикозных язв, варикофлебита, состояния после удаления большой подкожной вены бедра в составе комплексной терапии.
Способ применения и дозы
1-3 раза в день на пораженный участок кожи наносят 3-10 см геля и осторожно втирают. Из-за ограниченного опыта применения препарата у детей и по причине того, что имеется недостаточное количество данных исследований, использовать этот препарат при лечении детей не следует.
Применение при беременности и в период лактации
Применение при беременности возможно только по показаниям под медицинским контролем. Возможно применение при лактации по показаниям.
Влияние на способность к управлению автотранспортом и другими потенциально опасными механизмами
Препарат не влияет на способность управлять транспортными средствами и потенциально опасными механизмами.
Меры предосторожности
При наличии признаков кровотечения следует тщательно взвесить возможность применения геля Гепарин. Гель Гепарин не следует применять при кровотечениях, наносить на открытые раневые поверхности, мокнущую экзему или на слизистые оболочки, а также на инфицированные участки при наличии гнойных процессов. Проникновение гепарина в здоровую кожу описано в случае местного применения; поэтому при подозрении на тромбоэмболические осложнения должна быть проведена проверка количества тромбоцитов для дифференциальной диагностики гепарин-индуцированной тромбоцитопении типа II. Таким образом, регулярная проверка количества тромбоцитов у пациентов с тромбоэмболическими осложнениями в анамнезе необходима при каждом применении гепарина (перед началом приема гепарина, в первый день после начала применения и затем регулярно каждые 3-4 дня в ходе лечения вплоть до его окончания). Гель Гепарин содержит в качестве вспомогательных веществ метилпарагидроксибензоат и пропилпарагидроксибензоат, поэтому его нельзя применять у пациентов с аллергией на парабены.
Применение в педиатрии
Из-за ограниченного опыта применения препарата у детей и по причине того, что имеется недостаточное количество данных исследований, использовать гель при лечении детей не следует.
Взаимодействие с другими препаратами
Противосвертывающее действие гепарина усиливается при одновременном применении антикоагулянтов, антиагрегантов и нестероидных противовоспалительных препаратов. Алкалоиды спорыньи, тироксин, тетрациклин, антигистаминные средства и никотин уменьшают действие гепарина.
Противопоказания
— известная гиперчувствительность к гепарину или любому компоненту лекарственного средства; — гепарин-индуцированная тромбоцитопения типа II (ГИТ типа II, опосредованная иммунитетом) в анамнезе.
Состав
на одну тубу: активное вещество — гепарина (в виде гепарина натрия) — 1000 МЕ/г; вспомогательные вещества — карбопол 980 NF, левоментол, метилпарагидроксибензоат (Е-218), пропилпарагидроксибензоат (Е-216), спирт этиловый ректификованный из пищевого сырья, триэтаноламин, вода очищенная.
Передозировка
В связи с малой системной абсорбцией передозировка маловероятна. До настоящего времени явления передозировки при использовании геля Гепарин не описаны. При длительном применении на большие поверхности возможны геморрагические осложнения. Лечение: отмена препарата. При необходимости применяют антагонист гепарина — протамина сульфат (1% раствор).
Побочное действие
Аллергические реакции на гепарин после нанесения препарата на кожу очень редки. Однако в отдельных случаях могут наблюдаться реакции повышенной чувствительности, такие как покраснение кожи и зуд, которые быстро исчезают после прекращения применения препарата. Частота возникновения гепарин-индуцированной опосредованной антителами тромбоцитопении типа II (количество тромбоцитов
Условия хранения
Хранить при температуре не выше 25°C. Хранить в недоступном для детей месте.
Купить Гепарин гель д/нар.прим.1000МЕ/г в тубах 30г в уп №1 в аптеке
Цена на Гепарин гель д/нар.прим.1000МЕ/г в тубах 30г в уп №1
Инструкция по применению для Гепарин гель д/нар.прим.1000МЕ/г в тубах 30г в уп №1
На сегодняшний день псориаз считают одним из самых распространенных хронических дерматозов. По разным данным [1], этим заболеванием страдает от 0,2 до 8% населения земного шара.
Начало заболевания неодинаково у разных больных. Провоцирующими факторами могут быть травмы кожи, стресс, применение некоторых медикаментов, злоупотребление алкоголем, инфекционные заболевания (особенно вызванные стрептококком и вирусами) и др. [2, 3].
Мужчины и женщины страдают псориазом одинаково часто, но у девушек, как правило, псориаз возникает в более раннем возрасте: так, первые признаки заболевания появляются у девушек в возрасте 16-20 лет, а у мужчин — в 18-32 года [4]. Высокая вероятность манифестации псориатического процесса сохраняется и в возрасте от 40 до 50 лет [5]. Городское население заболевает значительно чаще сельского, что, по всей видимости, связано с неблагоприятной экологической ситуацией, ускоренным темпом жизни, различными стрессовыми ситуациями и прочими негативными психоэмоциональными факторами [6]. Чаще в начале заболевания высыпаний немного, они характеризуются мономорфной сыпью в виде папулезных элементов диаметром от 1-3 мм до 2-3 см и более, розового цвета, покрытых серебристо-белыми чешуйками. Как правило, на этом этапе степень тяжести и распространенность псориатического процесса оценивается как легкая (PASI≤10). Эффлоресценции длительное время могут сохраняться на одних и тех же местах, особенно на волосистой части головы и в области крупных суставов. На этом этапе, как правило, терапия псориаза не вызывает больших затруднений, и пациенту вполне достаточно назначения соответствующей диеты, проведения общеукрепляющих мероприятий и наружной терапии [7].
При псориазе легкой степени наиболее часто применяют смягчающие и увлажняющие средства, сочетая их с другими активными местными средствами. Кератолитические препараты уменьшают выраженность гиперкератоза и смягчают псориатические чешуйки, что в свою очередь способствует их удалению. Как и смягчающие средства, кератолитические также принято сочетать с другими препаратами. Различные лекарственные формы глюкокортикостероидов (ГКС) наиболее часто используют для лечения псориаза, однако их системная абсорбция приводит к возникновению ряда серьезных побочных эффектов.
Применение ретиноидов в течение 12 нед показывает хорошую клиническую эффективность, причем она может быть повышена при совместном использовании с ГКС.
В процессе развития заболевания, при увеличении числа элементов, их периферическом росте папулы сливаются и образуют бляшки разнообразных размеров и очертаний. В этот момент псориатические поражения характеризует высокая степень распространенности, выраженность эритемы и инфильтрации, что утяжеляет состояние больного. Как правило, степень тяжести и распространенности псориатического процесса (PASI) оценивается как средняя (10≤PASI≤30) или как тяжелая (30≤PASI≤72). Излюбленная локализация псориаза — разгибательные поверхности конечностей, особенно в области локтевых и коленных суставов. Высыпания могут поражать кожу туловища; часто поражается волосистая часть головы.
Лечение псориаза — сложная терапевтическая задача [8]. В соответствии с патогенетическими процессами терапия псориаза направлена на устранение воспаления, подавление пролиферации эпителиоцитов, нормализацию их дифференцировки. Во многих случаях терапевтические мероприятия могут быть успешными, так как имеется ряд методов терапевтического воздействия при этом дерматозе, но, к сожалению, все эти мероприятия дают лишь временный эффект [9]. Фармакотерапия и фототерапия могут очистить пораженные участки кожи и облегчить неприятные симптомы, однако ремиссия обычно кратковременна и в течение года у большинства пациентов наблюдается рецидив заболевания.
Для лечения псориатического процесса средней и тяжелой степеней назначают системную терапию: фототерапию, применение аналогов витамина А и различные варианты иммуносупрессии.
Фототерапия блокирует репликацию ДНК, понижая пролиферацию клеток кожи; этот метод достаточно эффективен, однако сопряжен с риском развития рака кожи, по причине чего его назначают больным старше 50 лет с интенсивным инвалидизирующим псориазом.
Аналоги витамина А главным образом назначают для лечения тяжелых и редких форм псориаза. Эти препараты обладают противовоспалительными свойствами, снижающими пролиферацию клеток кожи. Однако и их применение ассоциируется с тяжелыми нежелательными явлениями, в том числе такими, как повреждение печени и эмбриональные дефекты.
Псориаз — заболевание мультифакториальное. Несомненно, большую роль в его патогенезе играют изменения иммунной системы либо генетически обусловленные, либо приобретенные под влиянием внешних и внутренних факторов.
Нарушения иммунной системы выявляют как на клеточном, так и на гуморальном уровнях и заключаются они в активации иммунологических реакций, сопровождаясь изменениями содержания иммуноглобулинов основных классов, циркулирующих иммунных комплексов, пула лимфоцитов в периферической крови, В- и Т-популяций и субпопуляций лимфоцитов, клеток-киллеров, фагоцитарной активности сегментоядерных лейкоцитов. Для нормализации этих процессов используют различные препараты, относящиеся к группе иммуносупрессантов.
Метотрексат — аналог фолиевой кислоты, ингибитор синтеза ДНК обладает способностью останавливать деление клеток. Обычно метотрексат назначают для лечения очень тяжелых форм псориаза, не поддающихся лечению другими средствами, однако его применение сопряжено с подавлением всех делящихся ростков и ассоциируется с поражением печени.
Иммуносупрессоры, такие как циклоспорин, оказывают селективное действие на Т-клетки. Циклоспорин обычно используют в терапии тяжелого чешуйчатого псориаза, но и его применение ограничено лишь лечением больных с резистентной формой псориаза из-за нежелательных явлений, таких как почечная недостаточность, парестезии и гирсутизм.
Широкое применение для лечения псориаза в последние годы получили препараты генной инженерии — моноклональные антитела (МАТ). Названия препаратов, созданных на основе МАТ, отражают их структуру и основные свойства. Так, препараты с окончанием «-цепт» блокируют цитокины и, соответственно, предотвращают кооперацию клеток; препараты с окончанием «-ксимаб» содержат животные МАТ и, связываясь с фактором некроза опухоли α, блокируют его; с окончанием «-мумаб» — только человеческие (гуманизированные) МАТ с аналогичным механизмом действия.
МАТ в терапии псориаза характеризует высокая эффективность. За счет проявления антицитокиновой активности они воздействуют целенаправленно на звенья патологического процесса, в итоге заметно улучшается качество жизни больных, а также достигается длительный период ремиссии этого заболевания [10].
Назначение таких препаратов при их высокой клинической эффективности сопряжено с рядом противопоказаний и с появлением нежелательных реакций в виде тошноты, головной боли, снижения артериального давления. Были описаны случаи развития определенных аутоиммунных заболеваний, а также обострения инфекционных процессов на фоне их длительного применения. На сегодняшний день назначение МАТ остается терапией «избранных», так как широкое использование этих препаратов сдерживается их значительной курсовой стоимостью [11].
Высокая клиническая эффективность препаратов, позволяющих воздействовать на иммунологические механизмы развития псориаза, на сегодняшний день не вызывает сомнений, но остается актуальной проблема разработки новых иммунотропных средств, применение которых наряду с высокой эффективностью будет характеризоваться низким уровнем нежелательных явлений и доступностью для широкого использования в повседневной медицинской практике.
Современное становление российской фармацевтической отрасли в рамках стратегии развития фармацевтической промышленности Российской Федерации (РФ) на период до 2021 г. позволило вывести на рынок ряд высокотехнологичных отечественных фармакологических препаратов, характеризующихся высоким профилем эффективности и безопасности. Следует отметить и их низкую себестоимость, что позволяет значительно снизить курсовую стоимость лечения по сравнению с зарубежными препаратами.
Результатом многолетней напряженной работы стал первый представитель нового поколения синтетических пептидных иммунодепрессантов — Тимодепрессин
.
Тимодепрессин
разработан коллективом исследователей ООО «Фарма Био» в содружестве с Медицинским радиологическим научным центром РАМН (Обнинск) и Институтом иммунологии МЗ РФ (Москва). Препарат разрешен Фармкомитетом Министерства здравоохранения РФ к медицинскому применению в 2000 г. (регистрационное удостоверение номер: Р №000022/01-2000; Р №000022/02-2000; Р №000022/03-2000; Р №000022/04-2000).
Тимодепрессин
— синтетический дипептид, состоящий из D-аминокислотных остатков глютаминовой кислоты и триптофана.
Тимодепрессин
(γ -D-глутамил-D-триптофана динатриевая соль) — индивидуальное химическое соединение пептидной природы, полученное методом химического синтеза в результате структурно-функциональных исследований биологически активных низкомолекулярных пептидов. Выпускается препарат в виде 0,1% раствора для инъекций в ампулах по 1 мл (по 5 ампул в упаковке), а также в виде назального спрея во флаконах по 5 мл (0,5 мг).
Состоящий из неприродных D-аминокислот, соединенных γ -пептидной связью, Тимодепрессин
представляет собой новый класс синтетических пептидных препаратов, селективно блокирующих процессы пролиферации клеток-предшественников иммунитета. Специфические свойства препарата
Тимодепрессин
позволяют избирательно подавлять функциональную активность иммунокомпетентных клеток, тормозить развитие аутоиммунных процессов, не затрагивая клетки других органов и тканей, сводя при этом к минимуму риск возникновения побочных эффектов.
Тимодепрессин
можно применять как в виде монотерапии, так и в комплексном лечении больных при различных заболеваниях. Препарат разрешен для лечения и профилактики аутоиммунных болезней различного генеза: аутоиммунных первичных и вторичных цитопений, гипопластических анемий, ревматоидного артрита, псориаза; в качестве цитопротекторной терапии для защиты и сохранения стволовых клеток, для предотвращения гранулоцитопении, при цитостатических химиотерапевтических воздействиях.
Вводят препарат Тимодепрессин
внутримышечно и интраназально. На начальном этапе лечения препарат назначают системно; курс лечения и режимы дозирования подбирают индивидуально в зависимости от динамики клинических проявлений. Разовая доза составляет 1 мл 0,1% раствора, максимальная разовая доза — 2 мл 0,1% раствора. Препарат вводят ежедневно однократно.
Тимодепрессин
применяют у взрослых и детей с двухлетнего возраста, используют как в монотерапии, так и в комплексном лечении и профилактике псориаза: препарат вводят внутримышечно по 1-2 мл раствора ежедневно в течение 7-10 дней, затем 2 дня перерыв, далее цикл повторяют. В зависимости от клинической ситуации можно проводить от 3 до 5 циклов.
Интраназально Тимодепрессин
назначают преимущественно в качестве поддерживающей терапии и для профилактики рецидивов, а также при лечении детей. Препарат вводят по 1-2 дозы (0,5 мг) спрея назального в каждый носовой ход ежедневно в течение 7-10 дней, курс лечения может быть продолжен после 2-дневного перерыва.
Пациентам с генерализованной псориатической эритродермией Тимодепрессин
вводят внутримышечно по 2 мл раствора ежедневно в течение 14 дней, затем интраназально с одновременным добавлением ГКС в средних дозах.
Сравнительный анализ результатов в рамках отделений, курируемых профессорско-преподавательским составом кафедры дерматовенерологии педиатрического факультета ГБУ ВПО Российского научно-исследовательского медицинского университета им. Н.И. Пирогова, в период с 2000 по 2013 г. продемонстрировал высокую клиническую эффективность включения препарата Тимодепрессин
в схемы лечения больных псориазом. Причем выраженность терапевтического действия препарата
Тимодепрессин
не определялась особенностями клинического варианта псориаза — благоприятные результаты после проведенного лечения с примерно одинаковой частотой прослеживались при различных формах псориаза, что приводило к значительному улучшению качества жизни больных. В отдельных случаях по силе терапевтического ответа и динамике регресса псориатического процесса
Тимодепрессин
превосходил рутинные методики лечения псориаза. Применение препарата
Тимодепрессин
не сопровождалось развитием побочных эффектов, присущих известным иммунодепрессантам; кроме того, он удобен в применении как в стационаре, так и в амбулаторной практике.
Хронический цистит: новое в диагностике и лечении
Если диагноз хронического бактериального цистита в большинстве случаев не вызывает затруднений, то лечение не всегда оказывается эффективным, а прогноз не всегда благоприятным, так как в ряде случаев не удается выявить, а затем и устранить причину возникновения заболевания. Лечение хронических циститов требует от врача широкого кругозора, знаний проблем гинекологии, неврологии, иммунологии. В период становления болезни структурные изменения опережают клинические проявления, и, наоборот, в процессе выздоровления нормализация нарушенных функций наступает раньше восстановления поврежденных структур, т. е. морфологические проявления запаздывают по сравнению с клиническими [16]. Только зрелые эпителиоциты резистентны к бактериям, в то время как барьерная функция эпителия при наличии эпителиоцитов с умеренно дифференцированной ультраструктурой нарушена. Для лечения и профилактики хронических рецидивирующих инфекций нижних мочевых путей применяется этиотропная антибактериальная терапия 7–10-дневными курсами. Исследования Возианова А. Ф., Романенко А. М. с соавт. (1994) показали, что полное восстановление зрелых поверхностных клеток эпителия мочевого пузыря после их повреждения длится не менее 3 недель [26]. Таким образом, при отсутствии настороженности у лечащего врача и отсутствии должного внимания к длительности патогенетического лечения, очередной рецидив может наслоиться на репаративную фазу предыдущего процесса. Это в свою очередь приводит к усилению коллагенообразования, дискорреляциям и склерозу подэпителиальных структур, играющих основную роль в гомеостазе слизистой оболочки мочевого пузыря, его иннервации [27]. Таким образом возникает замкнутый круг: неадекватное лечение — хроническое воспаление — реактивные изменения и рубцевание подслизистых структур — гипоксия ткани — незавершенная регенерация эпителия — очередное обострение процесса.
Лечение хронических рецидивирующих циститов:
- Этиологическое — антибактериальная терапия.
- Патогенетическое — коррекция анатомических нарушений, коррекция иммунных нарушений, улучшение микроциркуляции, лечение ИППП, коррекция гормональных нарушений, лечение воспалительных и дисбиотических гинекологических заболеваний, коррекция гигиенических и сексуальных факторов, местное лечение.
- Профилактическое — растительные диуретики, антибактериальная терапия (в том числе посткоитальная профилактика).
Этиологическое лечение — это антибактериальная терапия, основанная на следующих принципах: длительность (до 7–10 дней); выбор препарата с учетом выделенного возбудителя и антибиотикограммы; назначение антибиотиков с бактерицидным действием. Препаратами, к которым выделен наибольший процент чувствительных штаммов возбудителей мочевой инфекции в России, являются: фосфомицин — 98,6%, мециллинам — 95,4%; нитрофурантоин — 94,8% и ципрофлоксацин — 92,3% [28]. Наиболее предпочтительными являются норфлоксацин, ципрофлоксацин, пефлоксацин и левофлоксацин из-за отсутствия нежелательных побочных реакций.
Выбор антибактериального препарата должен производиться на основе данных микробиологического исследования. Если при остром неосложненном цистите предпочтение следует отдавать коротким курсам антибактериальной терапии (3–5-дневным), то при хроническом рецидивирующем — продолжительность антибактериальной терапии должна составлять не менее 7–10 дней для полной эрадикации возбудителя, который при хронических циститах может локализоваться в подслизистых структурах стенки мочевого пузыря [1, 5].
Антибактериальная терапия. Препаратами выбора являются фторхинолоны (ципрофлоксацин, офлоксацин, норфлоксацин, левофлоксацин, ломефлоксацин), которые обладают очень высокой активностью в отношении E. сoli и других грамотрицательных возбудителей уроинфекций. Нефторированные хинолоны — налидиксовая, пипемидовая, оксолиновая кислоты утратили свое лидирующее значение, в связи с высокой резистентностью к ним микрофлоры, и не могут являться препаратами выбора при рецидивирующих инфекциях мочевых путей [18, 29].
Выбор фторхинолонов обусловлен широким спектром антибактериальной активности, особенностями фармакокинетики и фармакодинамики, созданием высоких концентраций в крови, моче и тканях. Биодоступность фторхинолонов не зависит от приема пищи, они обладают длительным периодом полувыведения, что позволяет принимать препараты 1–2 раза в сутки. Их отличает хорошая переносимость и возможность применения при почечной недостаточности. Для норфлоксацина период полувыведения 3–4 часа, для лечения обострения цистита рекомендуется принимать по 400 мг 2 раза в день 7–10 дней. Ципрофлоксацин считается наиболее мощным антибиотиком из группы фторхинолонов, поскольку, обеспечивая бактерицидный эффект в небольших концентрациях, обладает широким спектром антибактериальной активности и быстро распределяется и накапливается в тканях и биологических жидкостях с высокими интрацеллюлярными концентрациями в фагоцитах (принимают 500 мг 2 раза в день). В настоящее время созданы препараты, обеспечивающие удобство приема — 1 раз в день. Примером может быть Ифиципро® ОД, который является новой формулой с постепенным высвобождением ципрофлоксацина.
При выявлении ИППП необходим курс антибактериальной терапии с включением макролидов, тетрациклинов, фторхинолонов, направленный на эрадикацию возбудителя, с последующим контролем микрофлоры.
Патогенетическое лечение начинают с рекомендаций по соблюдению режима труда и отдыха и назначения соответствующего питания. Назначают обильное питье. Усиленный диурез способствует вымыванию бактерий и других патологических примесей. Уменьшаются дизурические явления вследствие действия концентрированной мочи на слизистую оболочку мочевого пузыря. Пища должна быть полноценной по содержанию белков и витаминов и способствовать кишечной перистальтике. В настоящее время разработаны патогенетически обоснованные алгоритмы консервативной терапии воспалительных заболеваний нижних мочевых путей [18].
Наличие современных антибиотиков и химиотерапевтических препаратов позволяет быстро и эффективно вылечивать рецидивы инфекций мочевыводящих путей и проводить профилактику их возникновения. Необоснованность и нерациональность антибактериальной терапии являются факторами, приводящими к хронизации процесса и нарушениям иммунорегуляторных механизмов с развитием иммунодефицитных состояний. Важно, что иммунодефицитное состояние может не иметь клинических проявлений [30]. Понятие «иммунодефицит» включает состояния, при которых наблюдается отсутствие или снижение уровня одного или нескольких факторов иммунитета. Исследования, проведенные в нашей клинике, показали, что у пациенток с хроническими циститами имеются отклонения в иммунном статусе в виде повышения или понижения показателей от среднестатистической нормы у 33,3%. Альтернативой назначению антибактериальных препаратов является стимуляция иммунных механизмов организма пациента при назначении иммунотерапевтических препаратов. Одним из таких препаратов является лиофилизированный белковый экстракт, полученный путем фракционирования щелочного гидролизата некоторых штаммов E. coli. Препарат выпускается в капсулах, имеет торговое наименование Уро-Ваксом. Стимуляция неспецифических иммунных защитных механизмов Уро-Ваксомом является приемлемой альтернативой низкодозной длительной химиопрофилактике инфекций мочевыводящих путей [31].
Заслуживает внимания применение поливалентных бактериофагов в лечении хронического рецидивирующего цистита, что особенно актуально для пациентов с поливалентной аллергией к антибактериальным препаратам или наличием полирезистентных возбудителей. Несмотря на отсутствие плацебо-контролируемых исследований применения пиобактериофагов, клиническая эффективность указанных препаратов не вызывает сомнений [18].
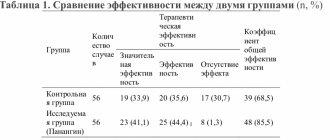
Важнейшим звеном патогенетической терапии цистита, способной предотвратить хронизацию воспаления, является иммуномодулирующая терапия. Регуляторами иммунных реакций являются цитокины, основная их составляющая — интерфероны (ИНФ). Функции ИНФ в организме разнообразны, однако наиболее важной функцией ИНФ является антивирусная. Кроме того, ИНФ участвуют также в антимикробной защите, обладают антипролиферативными, иммуномодулирующими свойствами. ИНФ способны модулировать активность и других клеток, например нормальных киллеров, увеличивать лизис клеток-мишеней, продукцию иммуноглобулинов, фагоцитарную активность макрофагов и их кооперативное взаимодействие с Т- и В-лимфоцитами. Гамма-ИНФ ингибирует рост опухолевых клеток и подавляет внутриклеточное размножение бактерий и простейших [9, 30]. Существуют препараты, содержащие экзогенные ИНФ. Однако индукторы ИНФ имеют преимущества перед ними, поскольку лишены антигенных свойств, синтез их в организме всегда строго сбалансирован и, таким образом, организм огражден от перенасыщения интерферонами [32]. Впервые для комплексного лечения хронических рецидивирующих циститов нами был применен тилорон, торговое название препарата «Лавомакс®» (таблетки 125 мг). Прием препарата «Лавомакс®» позволил добиться ремиссии заболевания у 90%, эрадикация микрофлоры в моче достигнута в 66,7%. Результаты наших исследований показали несомненную перспективность использования Лавомакса® не только для лечения, но и для профилактики хронических циститов.
Хронический процесс, с учетом сопутствующей патологии пациенток, требует обязательного применения препаратов для борьбы с гипоксией тканей — антигипоксантов (Солкосерил 200 мг по 1 таблетке 2 раза в день, курс 14 дней); венотоников (Эскузан 20); антиагрегантов, которые улучшают «текучесть» крови по капиллярам. Типичным представителем группы антиагрегантов является Трентал, оказывающий сосудорасширяющее, антиагрегантное, ангиопротективное действие (100 мг 2–3 раза в сутки, курсом до 30 дней), действующее вещество — пентоксифиллин. Пентоксифиллин-Акри удобен в приеме, так как имеет таблетированную форму 100 мг, улучшает микроциркуляцию и снабжение тканей кислородом в основном в конечностях, центральной нервной системе, в меньшей степени в почках. Существует масса препаратов, улучшающих артериальное и венозное кровообращение. Однако на сегодняшний день есть препарат, который способен восстанавливать микроциркуляцию и тонус мышц мочевого пузыря; доказано его благотворное влияние на показатели иммунитета. Это хорошо зарекомендовавший себя в лечении заболеваний предстательной железы Простатилен — комплекс полипептидов, выделенных из тканей предстательной железы крупного рогатого скота [33]. Нас заинтересовала способность пептидов (цитомединов) выступать в организме в качестве биорегуляторов. Действие их предположительно осуществляется через рецепторы, расположенные на поверхности клеток. В результате их введения в организм происходит выброс эндогенных регуляторных пептидов, пролонгируется эффект цитомединов [34]. Традиционно используемый в лечении патологии мужской половой сферы препарат «Витапрост®» (суппозитории ректальные 50 мг) был впервые применен в клинике урологии Нижнего Новгорода для лечения хронических рецидивирующих циститов у женщин. Изучая капиллярный кровоток в слизистой мочевого пузыря у пациенток с хроническим рецидивирующим циститом методом лазерной допплеровской флоуметрии (ЛДФ) [35, 36], мы получили объективно доказанный эффект от применения этого препарата (рис. 3). На рис. 3 а мониторинг до лечения, показатель микроциркуляции (ПМ) — 4,7 перфузионных единицы. На рис. 3 б мониторинг после лечения (ПМ — 18,25 перфузионных единицы).
До лечения у больных выявлялся застойный тип кровотока со сниженной активностью компонентов микроциркуляторного русла и ишемией тканей. Примененный в качестве патогенетической терапии в лечении хронических циститов биостимулирующий препарат «Витапрост®» способствовал быстрому исчезновению воспалительного процесса, стимуляции регенераторных процессов, что мы контролировали КП ОКТ. Назначенный препарат позволил достичь быстрого эффекта анальгезии, помог достичь социальной адаптации пациенток в достаточно в короткий срок.
Лечение рецидивирующих инфекций нижних мочевых путей, протекающих на фоне ИППП, при наличии диспластических процессов в задней уретре, зоне шейки мочевого пузыря, мочепузырного треугольника должно быть направлено на эрадикацию атипичных возбудителей, восстановление муцинового слоя уротелия. Образование мукополисахаридного слоя, покрывающего в норме эпителий мочевого пузыря, считается гормонально-зависимым процессом: эстрогены влияют на его синтез, прогестерон на его выделение эпителиальными клетками. Применение женских половых гормонов интравагинально ведет к пролиферации влагалищного эпителия, улучшению кровоснабжения, восстановлению транссудации и эластичности стенки влагалища, увеличению синтеза гликогена, восстановлению популяции лактобацилл во влагалище, кислого рН. Примером эстрогена для лечения урогенитальных нарушений является препарат эстриола — Овестин, имеется таблетированная форма 2 мг и в виде вагинальных свечей по 0,5 мг. При использовании любой формы Овестин назначается 1 раз в сутки.
При наличии выраженного болевого синдрома назначают нестероидные противовоспалительные препараты, подавляющие синтез простагландинов, оказывающие выраженное обезболивающее действие. Назначают индометацин, диклофенак и другие. Препараты используются в обычных дозах в течение 10–21 дня, поддерживающие дозировки до 2 месяцев. Эффект от нестероидных противовоспалительных препаратов, как правило, сохраняется в течение 3–4 месяцев после их отмены [1].
Назначение антигистаминных и антисеротониновых препаратов необходимо для устранения этиологического и патогенетического факторов. Это может быть препарат «Перитол» — блокатор Н1-гистаминорецепторов с выраженным антисеротониновым действием. Он также стабилизирует тучные клетки и препятствует их дегрануляции с освобождением биологически активных веществ. Антихолинэстеразная активность его сказывается на накопительной функции мочевого пузыря. Препарат принимают с 2 мг — 1 раз в день, постепенно увеличивая дозу до 4 мг — 3 раза в сутки в течение 3–4 недель. Задитен (кетотифен) назначается в дозе 0,5–1 мг — 2 раза в сутки 2–3 месяца. Назначаются и другие антигистаминные препараты (Диазолин, Тавегил, Кларитин) в обычном режиме в течение 1–3 месяцев.