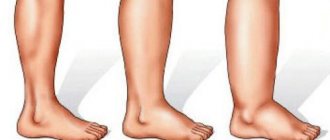
Главная » Статьи » Опухла рука после капельницы: что делать и стоит ли звать врача?
Назначение капельницы при алкогольной интоксикации является делом вполне обычным, так как капельные инъекции действуют гораздо быстрее препаратов, поступающих через уколы или таблетки. Этот способ позволяет вводить в организм большое количество жидкости на протяжении длительного времени, а также регулировать скорость её подачи.
С помощью капельниц из крови выводятся токсины, восполняется водно-солевой баланс. Достаточно безобидная процедура иногда имеет неприятные последствия в виде отёка руки, один вид которого способен напугать пациента.
Причины отечностей
Неприятная реакция организма на капельницу имеет несколько причин, зависящих как от профессионализма медработников, так и от физиологических особенностей больного. Даже по скорости развития отёка в месте введения иглы опытный врач может быстро определить причины его возникновения и сразу же оказать помощь.
Попадание мимо вены
Наиболее часто отёчность вызывается попаданием вводимого препарата в мягкие ткани. Случается, что игла проходит вену насквозь или не попадает в неё совсем, тогда вместо крови лекарство проникает в периферийные ткани, провоцируя мгновенный отёк. Рука опухает буквально на глазах, увеличиваясь в два-три раза, возникают болевые ощущения, жжение, онемение конечности.
С одной стороны, виной может быть неопытность медработника: для того, чтобы найти вену и точно попасть в неё, требуются определённые навыки. Однако бывает, что от природы или от постоянных инъекций вены пациента плохо прощупываются, тогда введение капельницы становится настоящим испытанием для всех участников процедуры. Отёки в случае попадания лекарства под кожу устраняются достаточно быстро и не представляют серьёзной угрозы.
Абсцесс
Гораздо хуже дела обстоят с абсцессами, возникающими в результате нарушения элементарных правил асептики. Поводом для образования гнойной полости под кожей способна послужить любая мелочь: плохая обработка кожных покровов в месте введения иглы, недостаточная стерильность расходных материалов, несоблюдение санитарно-противоэпидемиологического режима в процедурном кабинете.
Подкожное воспаление протекает не так стремительно, как отёк, поэтому обнаружится оно не раньше, чем спустя несколько часов после внутривенной инъекции. Симптомами абсцесса служат покраснение и опухоль руки в области укола, сопровождаемые болями, а также повышением температуры тела. Воспалительный процесс угрожает серьёзными осложнениями, поэтому при первых признаках необходимо в срочном порядке обратиться к хирургу.
Аллергия
При применении капельницы отёк руки может быть вызван также аллергией на используемые для инъекции лекарственные средства. Внешне аллергическая реакция проявляется в виде точечных покраснений наподобие «крапивницы» или напряжением и зудом тканей, как при отёке Квинке. Первые симптомы появляются уже через полчаса и усиливаются по нарастающей, что само по себе является тревожным «звоночком».
Чаще всего аллергии наблюдаются при введении некоторых видов антибиотиков, анальгетиков, сульфаниламидных препаратов. Обычно пациенты предупреждают врачей о противопоказаниях по известным им лекарствам, но бывают ситуации, когда больной оказывается не в курсе индивидуальной непереносимости конкретного препарата.
Причины появления синяков
Синяк или гематома у онкологических больных встречаются часто, потому что химиотерапия связана с внедрением в организм посредством разрушения кожных покровов — внутривенными введениями лекарств, что не всегда удается без кровоизлияния в кожу и клетчатку вокруг сосуда. Противоопухолевые лекарства изменяют состав крови, в частности численность тромбоцитов, увеличивая кровоточивость, а также впятеро повышают вероятность образования тромбов, тогда как хронически существующая варикозная болезнь увеличивает тромбообразование всего лишь вдвое.
Злокачественная опухоль меняет реологические свойства крови, приводя к образованию тромбов. У каждого пятого пациента ещё до операции выявляют скрытый тромбоз. При раке кишечника и поджелудочной железы обильное образование тромбов может быть первым признаком злокачественного заболевания. Химиотерапия, как и метастатическая стадия любой опухоли, увеличивает вероятность тромбоза в среднем в пять раз. В организме онкологического больного одновременно сосуществуют два процесса — избыточная кровоточивость и повышенная свертываемость.
Факторы риска тромбозов у онкобольных как у всех «обычных» людей: большой вес и возраст «после 40», хронические болезни сосудов и сердца, сахарный диабет, гипертония и конечно варикозная трансформация вен нижних конечностей.
К этим стандартным причинам у онкологического пациента примешиваются специфические, то есть инициируемые злокачественной опухолью и усугубляемые необходимым лечением:
- сдавливание опухолевым конгломератом кровеносных и лимфатических сосудов;
- лимфостаз после удаления подмышечных лимфоузлов, в результате облучения или удаления клетчатки малого таза с лимфоузлами, а также блок метастатическим паховыми узами оттока лимфы из ноги;
- длительный приём гормональных препаратов;
- стимуляция красного ростка кроветворения эритропоэтинами;
- постоянно установленный для частых вливаний лекарств венозный катетер;
- вынужденное из-за слабости ограничение подвижности;
- операции и облучение, а также побочные эффекты химиотерапии на сосуды и форменные элементы крови.
Для инициации тромба внутри сосуда больному раком достаточно всего трёх поводов и не обязательно сразу всех:
- повреждение внутренней оболочки сосуда, что для обычно для внутривенной химиотерапии;
- застой крови, что называют «нарушением кровообращения», в том числе в результате опухолевого конгломерата;
- избыточная свертываемость вместе с нарушением формирования сгустков.
Запись на консультацию круглосуточно
+7+7+78
Другие причины появления уплотнений, гематом и шишек
Мы уже разобрались, что все достаточно просто: введение иглы в вену само по себе является травмой. К этой травме могут присовокупиться другие:
- При повреждении кровеносного сосуда иглой кровь попадает в межклеточное пространство. Там она загустевает и меняет цвет, образуя гематомы, которые обычно сами рассасываются.
- Когда ставят капельницу, например, от алкоголя, достаточно часто ткани вокруг вены травмируются. Из-за этого образуются рубцы, из которых кровь протекает в ткани. В этом случае образовываются шишки.
- Разрыв тканей вокруг вены ведёт к попаданию лекарства под кожу, из-за чего образуются уплотнения.
- Плохая свертываемость крови становится причиной серьёзных кровоизлияний.
- Если игла слишком длинная, она может проколоть вену насквозь. Этот тоже ведёт к появлению гематом и уплотнений.
- При неаккуратной или неправильной постановке иглы может быть повреждена стенка вены.
Если возникают болезненные ощущения и отек во время установки капельницы, нужно сразу обратиться к медсестре. Были случаи, когда пациенты просто терпели боль, что заканчивалось весьма плачевно.
Выезд оплачивается отдельно — от 550 рублей
Заказать звонок
Звоните:
+7 (499) 455-08-05
Возможные осложнения
Если не придать отеку руки после капельницы значения и не сообщить о болезненных ощущениях врачу, безобидная гематома может перерасти в серьезную патологию.
- Флебит возникает в том случае, когда стенка сосуда воспаляется из-за повреждения иглой или действия лекарства. Причиной флебита может стать аллергическая реакция на препарат. Симптомы патологии: кожа краснеет и температура на поврежденном участке повышается; по линии вены появляются полосы красного цвета, рука сильно болит и опухает. Заболевание лечится амбулаторным путем.
- Тромбофлебитом называется закупорка сосуда тромбом. Причиной патологии также является повреждение или попадание инфекции в вену. Рука отекает, место введения иглы уплотняется, кожа краснеет и повышается температура. Особо опасен отрыв тромба, поэтому важно незамедлительно обратиться к врачу при первых симптомах.
- Тромбоэмболией называют закупорку вены тромбом, при которой нарушается кровоток. Симптомы следующие: образование гнойной шишки, сильный отек руки, пульсирующая боль, повышение температуры. Лечится заболевание мазями и антибиотиками, которые провоцируют вскрытие шишки.
- Флегмона является гнойным воспалением, которое появляется в результате неправильного ввода иглы в вену, в результате чего лекарство попадает в жировую прослойку. Очаг заболевания не ограничен, оно распространяется по тканям. Симптомы: интоксикация, сильнейшие боли и отек, сильное повышение температуры. Сначала инфильтрат твердый на ощупь, но постепенно размягчается. Эта болезнь требует экстренного хирургического вмешательства и приёма антибиотиков.
При появлении таких симптомов, как повышение температуры, резкая пульсирующая боль и гнойные образования, необходимо сразу обратиться к врачу. При самолечении возможно развитие одной из описанных патологий.
Причины флебита
Почему воспаляются вены? Повреждающие факторы могут иметь механический, термический, химический, биологический характер и воздействовать на сосудистую стенку непосредственно, либо опосредованно, через характеристики протекающей крови, состояние окружающих тканей, защитный потенциал организма и др.
В первом случае речь идет о т.н. первичном флебите вследствие:
- Травматизации при заборе крови или инъекции (некачественные иглы и/или слишком частые процедуры). Например — флебит верхних конечностей.
- Ожога от попадания в вену химически агрессивного вещества.
- Внутри или внесосудистого препятствия к оттоку крови, приводящего к нарушению питания и снабжения кислородом венозной стенки.
- Инфицирования венозной стенки при травмах, операциях, пункциях.
- Воспалительных изменений венозной стенки аллергического происхождения.
- Венозного застоя, спровоцированного длительными статическими нагрузками, избыточным напряжением и/или весом, болевым синдромом. Например, послеродовый флебит и др.
Во-втором, о т.н. вторичном воспалительном повреждении венозной стенки при:
- Проникновении инфекции из ближних и дальних очагов с током крови и лимфы.
- Онкологических процессах.
- Недугах, сопровождающихся изменением свойств крови.
- Варикозной болезни.
- Общем снижении защитного потенциала организма вследствие различных причин.
Воздействие причинного фактора не всегда заканчивается серьезным поражением венозной стенки. Исходно здоровый сосуд (в сбалансированном окружении) в большинстве случав способен быстро и без последствий залечить полученное повреждение, не давая ему повода перерасти в длительный болезненный процесс.
Ослабить восстановительный потенциал венозной стенки способны следующие факторы (их можно смело именовать предрасполагающими к развитию флебита):
- гиподинамия и/или длительное стояние на ногах;
- избыточная масса тела;
- курение;
- пожилой возраст;
- длительная вынужденная неподвижность (например, вследствие травм);
- некорректное питание и/или несоблюдение питьевого режима (ухудшают свойства крови — например, повышают вязкость);
- физические и эмоциональные перегрузки (последние со временем ослабляют иммунную систему организма, снижая способность всех тканей противостоять различным агрессивным воздействиям).
Флебит при беременности
Значимыми предрасполагающими к повреждению венозной стенки факторами при беременности являются:
- большая масса тела;
- ограничение движений;
- длительное напряжение;
- болевой синдром;
- инъекции лекарственных препаратов;
- застойные явления в нижней части тела;
- изменения свойств крови и др.
Как лечить
Перед тем, как заниматься лечением, нужно убедиться, что шишка или уплотнения после капельницы не имеет признаков гнойного заражения. Помните, если у вас поднялась температура, наблюдается сильная отечность и пульсирующая боль, заниматься самолечением ни в коем случае нельзя! Необходимо сразу позвать врача, иначе последствия будут очень печальными.
Если же мы имеем дело точно не с абсцессом, то справиться с отеком можно самостоятельно. Во-первых, если отек появился вследствие неправильной установки иглы и попадания лекарства в мягкие ткани, нужно позвать медсестру. Она переставит иглу и даст некоторые рекомендации по борьбе с отечностью. Помочь могут как медикаментозные, так и народные средства.
Медикаментозное лечение
Для терапии обычно применяют мази, в составе которых есть гепарин и/или троксерутин: мазь Вишневского, Кетанов, Метирулацил, Гепариновая мазь, Димексид. Наносят мази каждый час.
Есть у этих препаратов противопоказания:
- язвено-некротические кожные процессы;
- повышенная проницаемость сосудов;
- с осторожностью нужно использовать мази людям с пониженной свертываемостью крови.
Димексид используют для компресса. Для этого смешайте препарат с водкой 1:1, а затем разведите смесь дистиллированной водой 1:4. Шишку нужно смазать жирным кремом (можно детским), чтобы избежать ожога. Ватку или марлю смочить в растворе, приложить к опухшему месту и накрыть пленкой. Оставить повязку на 7-8 часов.
Из лекарственных препаратов для борьбы с отечностью используют также Детралекс, Магнезию для компресса. Никогда не пренебрегайте йодной сеткой – это хоть и простое, но проверенное и эффективное средство. Сеточку из йода необходимо наносить на поврежденный участок кожи 1-2 раза в день, через приблизительно равные временные промежутки. Обязательно убедитесь, что у вас нет аллергии на йод.
Народные средства
Народная медицина богата на способы борьбы с отечностью после капельницы от запоя в Москве. В основном используют компрессы, самые популярные из которых мы сейчас разберем:
- Спиртовой. Компресс готовится из воды и спирта, которые смешивают в равных пропорциях. Чтобы предотвратить ожог кожи, её нужно смазать жирным кремом и только после этого накладывать повязку. Смачиваем в растворе кусочек ваты, ткани или ватный диск, прикладываем к уплотнению. Сверху накрываем пленкой или полиэтиленовым пакетом, укладываем ещё один слой ваты и перевязываем бинтом. Не снимать повязку в течение 5-6 часов.
- Компресс из листьев лопуха или капусты. Берём лист капусты или лопуха и мнём его в руках до тех пор, пока он не увлажнится. Затем накладываем на припухлость и перебинтовываем. Менять листья нужно по мере их высыхания.
- Из алоэ. Алоэ – растение, известное своим противовоспалительным действием, поэтому компресс из него поможет быстро снять отек. Лист растения необходимо промыть, разрезать вдоль на две части, мякоть измельчить. Получившуюся кашицу приложите к больному участку кожи и зафиксируйте бинтом. Повязку можно оставить на ночь.
- Овощные компрессы. Возьмите картофелину, огурец или морковь, натрите их на тёрке. Заверните кашицу в марлю и держите на воспаленном участке до высыхания компресса.
- Медовые лепёшки. Мед помогает уплотнению после капельницы быстро рассосаться. Для приготовления лепёшки возьмите 1 столовую ложку меда и смешайте её с небольшим количеством муки. Приложить лепёшку можно также на ночь.
Если отечность руки сопровождается абсцессом, немедленно обращайтесь к врачу. Самостоятельное лечение может привести к еще большим проблемам. Врач же назначит курс терапии или вскроет «шишку», чтобы вычистить из неё гной.
Введение
Радиочастотная и криотермическая катетерные абляции в настоящее время являются широко распространенными видами немедикаментозного лечения нарушений ритма сердца, став реальной альтернативой лекарственной терапии. Обязательным элементом любых катетерных вмешательств является транссосудистый доступ, включающий в себя пункцию бедренных и, реже, подключичных, кубитальных или яремных вен. В настоящее время для внутрисосудистого доступа обычно пунктируют правую и/или левую бедренные вены [1].
Как известно, любое катетерное вмешательство сопряжено с определенным риском осложнений со стороны места пункции сосуда. Среди осложнений, связанных с катетерными абляциями, особого внимания заслуживает тромбоз места пункции бедренных вен. Это связано с потенциальной опасностью развития тромбоэмболических осложнений, обусловленных проксимальной локализацией венозного тромбоза (ВТ) [2].
Значимость проблемы и факторы риска.
Согласно данным различных международных наблюдений, частота возникновения тромбоза места пункции бедренных вен после катетерных вмешательств составляет от 0,3 до 3% [1, 3], однако на сегодняшний день эта проблема является недостаточно изученной. Статистические данные противоречивы, что связано с обсервационным характером исследований, так как наряду с работами, в которых проводили обследование всех пациентов после вмешательств, были исследования, в которых верификация ВТ места пункции была предусмотрена у пациентов только при наличии клинических симптомов [4—10, 13]. В 2017 г. был проведен метаанализ, объединивший данные публикаций 1987—2013 гг. по изучению венозных тромбоэмболических осложнений (ВТЭО) у пациентов после электрофизиологических исследований (ЭФИ), радиочастотных (РЧА) и криотермических катетерных абляций, результаты которого представлены в табл. 1 и 2
Таблица 1. Исследования по выявлению симптомного ВТЭО Примечание. Здесь и в табл. 2: НМГ — низкомолекулярный гепарин.
Таблица 2. Бессимптомные ВТЭО у пациентов после катетерных абляций [3].
Как уже было сказано ранее, значение связанных с катетерными электрофизиологическими вмешательствами ВТЭО обусловлено их чрезвычайно высоким потенциальным риском для здоровья и жизни пациента: к наиболее эмбологенным относят тромбозы бедренных и подвздошных, а также нижней полой вен [2].
Основные звенья патогенеза тромбоза места пункции бедренных вен после катетерных вмешательств соответствуют триаде Вирхова: стаз крови, повреждение эндотелия и гиперкоагуляция. А непосредственными причинами могут выступать повреждение эндотелия сосудистой стенки при пункции вены и необходимость иммобилизации пациентов после катетерного вмешательства [14, 15].
Факторы риска развития ВТЭО у пациентов после катетерных вмешательств.
Обсуждаемая категория тромбозов в экспертных документах и рекомендациях упоминается редко в связи с отсутствием данных, полученных в результате специально спланированных исследований. Рекомендации ISTH 2021 г., посвященные диагностике, лечению и профилактике ВТЭО, вне связи с катетерными вмешательствами предполагают ориентироваться на два аспекта: 1) является ли данный эпизод ВТ первым или повторным для пациента и 2) имеется ли обратимый фактор, приведший к развитию тромбоза, на основании чего ВТ дифференцируют как спровоцированные или неспровоцированные [16].
Клиническими факторами риска развития ВТ являются возраст старше 40 лет, артериальная гипертония, сердечная недостаточность, варикозное расширение вен нижних конечностей, ВТЭО в анамнезе, сахарный диабет, ожирение, аутоимунные процессы, онкологические заболевания (наибольший риск при наличии метастазов, а также после химиотерапии), прием эстроген-гестагенных препаратов (в качестве контрацептивов или гормональной заместительной терапии) и многие другие [2]. Некоторые из этих факторов являются модифицируемыми, следовательно, в большинстве случаев на них можно повлиять и тем самым снизить риск возможных тромбоэмболических событий перед планируемым катетерным вмешательством. Однако ряд клинических факторов, такие как возраст, анамнез ВТЭО, являются немодифицируемыми.
К немодифицируемым факторам также относят тромбофилии, под понятием которых понимают врожденное или приобретенное патологическое состояние, характеризующееся склонностью к повышенной свертываемости крови и, соответственно, повышению риска образования тромбов [2]. Высоким тромботическим риском обладают: дефицит естественных антикоагулянтов (антитромбина III, протеинов С и S), мутации Лейдена и протромбина, антифосфолипидный синдром. Также показана связь развития ВТЭО с полиморфизмами в генах фолатного цикла: метилентетрагидрофолатредуктазы (MTHFR), редуктазы (MTRR) и метионинсинтазы (MTR), что имеет значение как фактор риска ВТЭО в случае гипергомоцистеинемии. Однако самостоятельную клиническую значимость генетически обусловленные нарушения фолатного цикла вряд ли имеют в связи с их небольшой распространенностью в популяции. Поиск врожденных тромбофилий оправдан у лиц молодого возраста (до 50 лет), особенно при повторных ВТЭО и в случаях, когда не удалось найти факторы, непосредственно спровоцировавшие тромбоз [2].
Такие факторы, как длительность вмешательства и «суммарный» диаметр интродьюсеров (суммарный диаметр «пункционного отверстия»), также могут сыграть свою роль в патогенезе ВТ после катетерных вмешательств. Эти факторы были изучены в проспективном исследовании G. Moubarak и соавт. [12]. В исследование были включены 220 пациентов, которым проведены внутрисердечные ЭФИ либо РЧА в правых отделах сердца. В ходе процедуры у всех больных проводили пункцию правой бедренной вены с установкой от 1 до 3 интродьюсеров. Средняя продолжительность процедур составляла 45 мин. Всем пациентам через 6 ч после катетерного вмешательства проводили ультразвуковое дуплексное сканирование (УЗДС) места пункции бедренной вены, выявившее ВТ в 5% случаев: в 7 случаях пристеночный и в 4 случаях флотирующий В.Т. Важно отметить, что клинических проявлений тромбоза ни у одного из пациентов не наблюдали. В качестве факторов, ассоциированных с развитием ВТ, авторы указывали время процедуры (90 мин против 45 мин) и суммарный диаметр использованных интродьюсеров (13 French против 12 French).
Диагностика ВТЭО после катетерных вмешательств.
В соответствии с позицией экспертов, отраженной в рекомендациях международного общества специалистов по тромбозу и гемостазу (International Society on Thrombosis and Haemostasis — ISTH) 2016 [16], для больного с клиническими проявлениями, позволяющими заподозрить ВТ, диагностический алгоритм состоит из оценки клинической вероятности развития тромбоза, определения уровня Д-димера и проведения УЗДС сосудов. У больных с низкой либо умеренной вероятностью развития ВТ нормальный уровень Д-димера позволяет исключить тромбоз и дополнительная диагностика в таких случаях не показана. Пациентам с низкой и умеренной вероятностью развития ВТ, но имеющим повышение уровня Д-димера, а также пациентам с высокой предтестовой вероятностью развития ВТ рекомендовано выполнение УЗДС.
Пациенты, у которых запланировано проведение внутрисердечного ЭФИ либо РЧА, с точки зрения клинических факторов риска могут представлять собой достаточно разнородную популяцию. Наряду с пациентами молодого возраста есть больные, у которых сочетание клинических факторов (артериальная гипертония, сердечная недостаточность, сахарный диабет, онкологическая патология) и технических аспектов самой процедуры (ее продолжительность, большой суммарный диаметр пункционного отверстия, длительная иммобилизация) могут повысить риск развития осложнений [2, 12]. Однако невысокая частота развития ВТЭО, описанная в литературе, позволяет отнести внутрисердечное ЭФИ и РЧА к вмешательствам, ассоциированным с низким риском развития ВТЭО [3—13].
Вопрос о роли определения уровня Д-димера в диагностике ВТ у пациентов после катетерных абляций является спорным. Ориентироваться на уровень Д-димера у этой категории пациентов для исключения или подтверждения ВТ не представляется возможным, так как несмотря на высокую чувствительность этот показатель обладает низкой специфичностью [2] и может быть повышен, в том числе на фоне пристеночных и межмышечных гематом, которые достаточно часто формируются у пациентов в области пункции.
Вопрос о рутинном анализе крови для определения уровня Д-димера всем пациентам перед РЧА специально не изучался. Как уже было сказано ранее, пациенты, подвергаемые катетерным вмешательствам, в большинстве случаев относятся к группе с низкой вероятностью развития ВТЭО. Согласно современным международным рекомендациям Американской коллегии торакальных врачей (American college of chest physicians — АССР) [17] таким пациентам при наличии у них нормального уровня Д-димера проведение дообследования для дальнейшего исключения ВТ не показано в связи с низкой вероятностью ВТЭО. Однако остается неясной ситуация в случае выполнения вмешательства у больных с умеренным/высоким риском ВТ (больных пожилого возраста, имеющих ВТЭО в анамнезе, при наличии онкологической патологии). В подобных клинических ситуациях низкая специфичность Д-димера также, вероятнее всего, будет ограничивать его диагностическую ценность. Тем не менее вопрос о возможности выявить больного с повышенным риском тромбоза после вмешательств представляет научный и практический интерес. Оценка предиктивной значимости Д-димера в отношении тромботических осложнений у коморбидных, пожилых больных, пациентов с факторами риска ВТ требует дальнейшего изучения [17, 18].
Основными клиническими проявлениями тромбоза вен нижних конечностей являются боль, отек, изменение цвета кожных покровов. Однако особенность локализации ВТ у пациентов после катетерных вмешательств, а именно в области подвздошно-бедренного сегмента, обусловливает часто их бессимптомный характер. В таких случаях единственным способом верификации ВТ является выполнение УЗДС: при формировании тромбов в просвете вены визуализируются структуры различной эхогенности, плотности и степени окклюзии [19, 20]. В ряде исследований [11—13] было показано, что при проведении УЗДС тромбоз места пункции бедренных вен у пациентов после РЧА был верифицирован в 0—0,75% случаев, при этом ни один из них не сопровождался клиническими симптомами.
Вероятно, частота развития бессимптомного ВТ может быть выше указанной ранее, так как в ряде работ УЗДС выполняли больным только при наличии симптомов и этот факт не позволяет говорить об истинной частоте ВТ после катетерных вмешательств [3—10].
Профилактика ВТЭО у пациентов после катетерных вмешательств.
Важными аспектами в профилактике ВТЭО у пациентов после катетерных вмешательств являются наиболее раннее удаление венозных интродьюсеров, минимальная длительность использования давящих повязок (в случае необходимости) в месте пункции вены, а также ранняя активизация пациентов [3, 12].
При выполнении внутрисердечного ЭФИ и РЧА у пациентов без фибрилляции предсердий (ФП) интраоперационное использование нефракционированного гепарина (НФГ) рекомендовано только в случаях длительного времени операции, а также при высоком риске ВТЭО [3, 21]. В исследовании М. Scheinman и соавт. [6] во время абляций НФГ не применяли, и частота ВТ составила 0,13%; в ряде других исследований, предусматривавших введение гепарина во время вмешательства [4, 5], частота ВТ была 0,3—0,56%. Однако немногочисленность исследований не позволяет сравнивать частоту развития ВТ в месте пункции на фоне интраоперационного введения гепарина и без него.
Таким образом, пациентам без ФП и, в связи с этим, не имеющим показаний к длительной терапии пероральными антикоагулянтами, адекватное введение гепарина во время катетерного вмешательства является залогом отсутствия ВТ места пункции.
Пациентам с ФП, которым проводится крио- или радиочастотная катетерная абляция устьев легочных вен, основу профилактики возникновения ВТ составляет как интра-, так и постоперационная антикоагулятная поддержка [3]. Во время абляции этим пациентам необходимо создание антикоагуляционного фона с использованием НФГ с поддержанием целевого уровня АСТ не менее 300 с. Эти рекомендации в том числе применимы к пациентам, получавшим антикоагулянтную терапию (АКТ) до операции [3, 21—24].
В исследовании L. Haman и соавт. с целью профилактики ВТЭО у пациентов при радиочастотных воздействиях в левых отделах сердца по поводу ФП рассматривалось подкожное введение низкомолекулярного гепарина (НМГ) в терапевтической дозе по массе тела пациента первые 1—2 сут, в последующем назначали антиагрегантную терапию ацетилсалициловой кислотой (АСК) в дозе 200 мг/сут на срок до 1 мес (следует отметить, что в соответствии с рекомендациями того времени назначение АСК было предусмотрено, а в настоящее время нет). За время наблюдения у 3 (0,75%) из 400 больных был диагностирован ВТ на основании клинических проявлений [11].
АКТ при лечении ВТЭО у пациентов после катетерных вмешательств.
Специальных исследований с целью определения тактики лечения ВТЭО у пациентов после катетерных вмешательств не проводилось, и указаний на алгоритм лечения в действующих рекомендациях нет. Также указанную нами группу пациентов не включали в исследования и регистры ни с варфарином, ни с новыми пероральными антикоагулянтами (НОАК).
Как уже было сказано ранее, сформировавшийся ВТ в месте пункции бедренной вены после катетерного вмешательства обладает высоким потенциальным риском для жизни пациента. Именно поэтому в случае его верификации требуется назначение АКТ.
Наиболее изученным и широко применяемым антагонистом витамина К является варфарин, эффективность которого при лечении ВТЭО убедительно доказана в многочисленных клинических исследованиях. Однако длительная терапия варфарином сопряжена с рядом сложностей, таких как необходимость подбора индивидуальной дозы препарата, потребность в постоянном (не реже 1 раза в месяц) лабораторном контроле уровня антикоагуляции — международное нормализованное отношение (МНО), множественные пищевые и лекарственные взаимодействия, влияние генетических особенностей пациентов (носительство полиморфизмов генов CYP2C9
и
VKORC1
) на антикоагулянтный эффект и риск геморрагических осложнений. Ограничения в применении варфарина стимулировали разработку и внедрение новых оральных антикоагулянтов, действие которых направлено на различные точки приложения в свертывании крови:
1. Прямые ингибиторы тромбина: дабигатрана этексилат.
2. Прямые ингибиторы фактора Xа: ривароксабан, апиксабан, эдоксабан.
Прямых сравнений препаратов из группы НОАК при лечении ВТ, не связанных с катетерными вмешательствами, не проводилось. В каждом из исследований дабигатран, ривароксабан и апиксабан сравнивали с эноксапарином и/или варфарином, поэтому говорить о преимуществах какого-либо одного из препаратов НОАК является неоправданным. Важно отметить, что несмотря на узкое терапевтическое окно и сложности лабораторного контроля варфарин продолжает оставаться широко назначаемым препаратом. При наличии онкологической патологии в соответствии с современными рекомендациями назначение НМГ предпочтительнее.
Длительное время стандартная терапия ВТ предусматривала назначение парентеральных антикоагулянтов (НМГ в терапевтической дозе) с последующим переходом на пероральный прием антагонистов витамина К на протяжении как минимум 3 мес. Современные рекомендации по лечению ВТ, не связанного с катетерными вмешательствами, предполагают возможность начинать лечение с прямых пероральных антикоагулянтов: в случае ривароксабана и апиксабана — без предварительного использования НМГ, в случае дабигатрана и эдоксабана — после короткого стартового курса парентеральных антикоагулянтов [17].
Пациенты без ФП не нуждаются в длительной АКТ. Тем не менее в случае формирования ВТ требуется назначение антикоагулянтов. Однако, как уже было сказано ранее, вопрос о предпочтительном препарате не изучался, а продолжительность терапии остается объектом дискуссии.
Для больных с ФП важной особенностью является исходная потребность в постоянной АКТ. Обновленные рекомендации АССР выступают за предпочтительное использование НОАК у таких пациентов [17]. Однако важно отметить тот факт, что лечебная доза ривароксабана при ВТ является выше профилактической, назначаемой пациентам с ФП: по 15 мг дважды в сутки на протяжении 3 нед с последующим переходом на прием препарата в дозе 20 мг/сут. При этом коррекция дозы ривароксабана в соответствии со скоростью клубочковой фильтрации (СКФ) не учитывается. Для апиксабана режим дозирования при лечении ВТ также отличается от профилактической дозы у пациентов с ФП: в течение первой недели препарат назначается в дозе по 10 мг дважды в сутки с последующим переходом на дозировку 5 мг дважды в сутки. Таким образом, лечебная доза этих препаратов выше той, которая назначается пациентам с ФП в профилактических целях. Однако данные о коррекции дозы НОАК при лечении ВТ в современных рекомендациях отсутствуют.
В нашем обзоре мы неоднократно указывали на то, что ВТ проксимальной локализации является потенциально жизнеугрожающим осложнением. В связи с этим пациентам с ФП в случае выявления ВТ в месте пункции бедренной вены после катетерных вмешательств целесообразен переход на лечебную дозу препарата и возобновление профилактической дозы после лизиса тромба при УЗ-контроле. Однако на сегодняшний день этот вопрос не изучен.
Вопрос о сроках продолжения АКТ у пациентов с ФП после катетерной абляции с целью профилактики ВТЭО был изучен в исследовании L. Prudente и соавт. [9]. Исследователи оценивали различные сроки назначения терапии эноксапарином у 539 пациентов с ФП, которым была проведена РЧА устьев легочных вен. Всем пациентам был отменен прием варфарина за 4 дня до вмешательства под контролем МНО (целевой уровень на фоне отмены препарата — менее 2,0). Во время абляции вводили НФГ в дозе 130 Ед/кг массы тела и далее по 23 Ед/кг каждый 1 ч 30 мин под контролем уровня АСТ (целевой уровень — 300—350 с). Через 4 ч после процедуры всем пациентам была возобновлена АКТ варфарином на фоне подкожного введения НМГ в лечебной дозе 1 мг/кг. Были рассмотрены 3 схемы терапии НМГ после абляции: 1) в дозе 1 мг/кг каждые 12 ч на протяжении 5 сут; 2) в дозе 1 мг/кг каждые 12 ч на протяжении 3 сут; и 3) 0,5 мг/кг каждые 12 ч на протяжении 5 сут. На основании сопоставимой частоты ВТ после вмешательств авторы сделали вывод о том, что назначение эноксапарина в дозе 0,5 мг/кг каждые 12 ч на протяжении 5 сут также эффективно, как и доза 1 мг/кг каждые 12 ч в эти же сроки.
Как предотвратить появление отека
Конечно, не допустить отечность куда лучше, чем потом с ней бороться. Вот несколько рекомендаций по профилактике отека руки после капельницы:
- Во время установки капельницы нужно максимально расслабиться, потому что напряженные мышцы легче повредить.
- Чтобы препарат не попал в мягкие ткани, лекарство нужно вводить медленно, плавно.
- Чтобы быстрее остановить кровотечение, держите ватку со спиртом после процедуры не менее 10 минут.
- Следите за стерильностью иглы и кожи, особенно это касается капельницы на дому.
- Есть врачи с «легкой рукой», именно к ним желательно попасть на процедуру. Такой врач введет иглу правильно и практически безболезненно, что снизит риск появления отечности. Можно вызвать такого профессионала на дом.
Половая активность
Вы можете возобновить половую активность __________________.
Вы можете начать принимать лекарство для достижения эрекции вечером того дня, когда вам извлекут катетер. Возможно, вам придется принимать одно из таких лекарств ежедневно в течение 1 года после операции.
Ваш врач или медсестра/медбрат предоставят вам информацию о графике приема лекарства. Следуйте этому графику до послеоперационного приема у хирурга. Ниже приводятся варианты такого графика:
| Лекарство | Обычная доза | Ударная доза |
| sildenafil citrate (Viagra®) |
|
|
| sildenafil citrate (непатентованное лекарство) |
|
|
| tadalafil (Cialis®) в таблетках по 20 мг |
|
|
| tadalafil (Cialis) в таблетках по 5 мг |
|
|
Информация об ударной дозе
- Когда вы принимаете ударную дозу, делайте это натощак. Выпейте лекарство примерно за 2 часа до ужина.
- Лекарство начинает действовать спустя 30–60 минут. Оно будет сохраняться в организме до 8 часов. В любое время в течение этих 8 часов попытайтесь достичь сексуального возбуждения от контакта с партнером или от самостоятельной стимуляции. Запишите, что произошло, и расскажите об этом своему врачу на следующем приеме.
- Если у вас не появилось никакой реакции после приема ударной дозы в течение 4 недель, позвоните своему врачу. Он может направить вас к нашим специалистам по вопросам сексуального здоровья.
Вернуться к началу