Проблему, при которой плохо сворачивается кровь, называют нарушением свертываемости крови. Она вызывается тем, что не происходит нормально закупорка сосудов при их повреждении.
Когда все хорошо, то при кровотечении в месте раны кровь начинает сгущаться, что предотвращает большую ее потерю. Но иногда этот сложный механизм не срабатывает, и это приводит к сильному или длительному кровотечению.
Когда кровь плохо сворачивается, то это не всегда приводит к наружной ее потере. Это также может проявляться в виде кровоизлияний под кожу или в головной мозг.
Причины
Нарушения свертываемости крови разделяют в зависимости от этиологии – на приобретенные, генетически обусловленные и врожденные, а также аутоиммунные.
Нарушения свертываемости крови могут быть обусловлены наследственными патологиями, но не только. На развитие заболевания могут оказать влияние и генетические болезни. Например, у новорожденного ребенка могут диагностировать гемофилию или заболевание Виллебранда.
Также нарушение может быть вызвано нехваткой витамина К. Кроме того, подобные проблемы могут быть следствием онкологических заболеваний печени и других органов.
Чаще всего нарушения свертываемости крови возникают при инфекционном гепатите или образовании рубцов, которые обычно появляются при циррозе.
Продолжительное использование сильных антибиотиков или лекарственных средств для устранения трмбообразования также могут вызвать нарушения свертываемости крови.
Роль гемокоагуляции
Тромбоцитарный процесс сложный и поэтапный. Гемокоагуляция – это реакция, способная защитить организм при повреждении сосудов от значительных кровопотерь. В противном случае наступит внезапная смерть. Ведь плохая свертываемость чревата кровотечением, остановить которое затруднительно.
Если свертываемость в норме, то даже при сильном повреждении сосудов кровь свернется за 7 минут. Сформируется тромб, который убережет организм от кровопотерь и остановит кровотечение. Механизм гемокоагуляции заключается в:
- образовании тромбоцитарного сгустка,
- выработке фибрина волокнистого нитевидного вещества, способствующего образованию тромба,
- вовлечении в процесс плазменного белка – фибриногена.
Так происходит цепная реакция. Активируются факторы интенсивного свертывания крови и вступают в реакцию с ионами кальция, преобразуя фибриноген и тромбин в нерастворимые желеобразные вещества. Фибрин преобразуется в длинную тонкую сеть, и при попадании в нее форменных кровяных клеток появляется тромб.
Симптомы
Основные симптомы заболевания:
- Высыпания на коже. В зависимости от причины плохой свертываемости на коже могут появляться как мелкие точечные кровоизлияния (петехии), так и обширные гематомы.
- Носовые кровотечения.
- Кровоизлияния в слизистые оболочки полости рта, носа, кишечника. Последний вариант может привести к появлению примеси крови в каловых массах.
- Кровоизлияния в головной мозг. Возникают при хрупкости сосудов и низкой свертываемости крови.
- При травме, порезе, ушибе кровь долго не останавливается.
- Кровоизлияния в суставы, мышцы и внутренние органы может наблюдаться при наследственном заболевании гемофилией. Синяки (гематомы) могут образовываться даже при незначительном механическом повреждении.
Как устроено свертывание крови
Остановка кровотечения основана на той же идее, что используют домохозяйки для приготовления холодца — превращении жидкости в гель (коллоидную систему, где формируется сеть молекул, способная удержать в своих ячейках тысячекратно превосходящую ее по весу жидкость за счет водородных связей с молекулами воды). Кстати, та же идея используется в одноразовых детских подгузниках, в которые помещается разбухающий при смачивании материал. С физической точки зрения, там нужно решать ту же самую задачу, что и в свертывании — борьбу с протечками при минимальном приложении усилий.
Свертывание крови является центральным звеном гемостаза (остановки кровотечения). Вторым звеном гемостаза являются особые клетки — тромбоциты, — способные прикрепляться друг к другу и к месту повреждения, чтобы создать останавливающую кровь пробку.
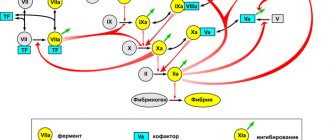
Общее представление о биохимии свертывания можно получить из рисунка 1, внизу которого показана реакция превращения растворимого белка фибриногена в фибрин, который затем полимеризуется в сетку. Эта реакция представляет собой единственную часть каскада, имеющую непосредственный физический смысл и решающую четкую физическую задачу. Роль остальных реакций — исключительно регуляторная: обеспечить превращение фибриногена в фибрин только в нужном месте и в нужное время.
Рисунок 1. Основные реакции свертывания крови. Система свертывания представляет собой каскад — последовательность реакций, где продукт каждой реакции выступает катализатором следующей. Главный «вход» в этот каскад находится в его средней части, на уровне факторов IX и X: белок тканевый фактор (обозначен на схеме как TF) связывает фактор VIIa, и получившийся ферментативный комплекс активирует факторы IX и X. Результатом работы каскада является белок фибрин, способный полимеризоваться и образовывать сгусток (гель). Подавляющее большинство реакций активации — это реакции протеолиза, т.е. частичного расщепления белка, увеличивающего его активность. Почти каждый фактор свертывания обязательно тем или иным образом ингибируется: обратная связь необходима для стабильной работы системы.
Обозначения: Реакции превращения факторов свертывания в активные формы показаны односторонними тонкими черными стрелками. При этом фигурные красные стрелки показывают, под действием каких именно ферментов происходит активация. Реакции потери активности в результате ингибирования показаны тонкими зелеными стрелками (для простоты стрелки изображены как просто «уход», т.е. не показано, с какими именно ингибиторами происходит связывание). Обратимые реакции формирования комплексов показаны двусторонними тонкими черными стрелками. Белки свертывания обозначены либо названиями, либо римскими цифрами, либо аббревиатурами (TF — тканевый фактор, PC — протеин С, APC — активированный протеин С). Чтобы избежать перегруженности, на схеме не показаны: связывание тромбина с тромбомодулином, активация и секреция тромбоцитов, контактная активация свертывания.
[1], рисунок адаптирован
Фибриноген напоминает стержень длиной 50 нм и толщиной 5 нм (рис. 2а). Активация позволяет его молекулам склеиваться в фибриновую нить (рис 2б), а затем в волокно, способное ветвиться и образовывать трехмерную сеть (рис. 2в).
Рисунок 2. Фибриновый гель. а — Схематическое устройство молекулы фибриногена. Основа ее составлена из трех пар зеркально расположенных полипептидных цепей α, β, γ. В центре молекулы можно видеть области связывания, которые становятся доступными при отрезании тромбином фибринопептидов А и Б (FPA и FPB на рисунке). б — Механизм сборки фибринового волокна: молекулы крепятся друг к другу «внахлест» по принципу головка-к-серединке, образуя двухцепочечное волокно. в — Электронная микрофотография геля: фибриновые волокна могут склеиваться и расщепляться, образуя сложную трехмерную структуру.
[2–4]
Рисунок 3. Трехмерная структура молекулы тромбина. На схеме показаны активный сайт и части молекулы, ответственные за связывание тромбина с субстратами и кофакторами. (Активный сайт — часть молекулы, непосредственно распознающее место расщепления и осуществляющее ферментативный катализ.) Выступающие части молекулы (экзосайты) позволяют осуществлять «переключение» молекулы тромбина, делая его мультифункциональным белком, способным работать в разных режимах. Например, связывание тромбомодулина с экзосайтом I физически перекрывает доступ к тромбину прокоагулянтным субстратам (фибриноген, фактор V) и аллостерически стимулирует активность по отношению к протеину C.
[5]
Активатор фибриногена тромбин (рис. 3) принадлежит к семейству сериновых протеиназ — ферментов, способных осуществлять расщепление пептидных связей в белках. Он является родственником пищеварительных ферментов трипсина и химотрипсина. Протеиназы синтезируются в неактивной форме, называемой зимогеном. Чтобы их активировать, необходимо расщепить пептидную связь, удерживающую часть белка, которая закрывает активный сайт. Так, тромбин синтезируется в виде протромбина, который может быть активирован. Как видно из рис. 1 (где протромбин обозначен как фактор II), это катализируется фактором Xa.
Вообще, белки свертывания называют факторами и нумеруют римскими цифрами в порядке официального открытия. Индекс «а» означает активную форму, а его отсутствие — неактивный предшественник. Для давно открытых белков, таких как фибрин и тромбин, используют и собственные имена. Некоторые номера (III, IV, VI) по историческим причинам не используются.
Активатором свертывания служит белок, называемый тканевым фактором, присутствующий в мембранах клеток всех тканей, за исключением эндотелия и крови. Таким образом, кровь остается жидкой только благодаря тому, что в норме она защищена тонкой защитной оболочкой эндотелия. При любом нарушении целостности сосуда тканевой фактор связывает из плазмы фактор VIIa, а их комплекс — называемый внешней теназой (tenase, или Xase, от слова ten — десять, т.е. номер активируемого фактора) — активирует фактор X.
Тромбин также активирует факторы V, VIII, XI, что ведет к ускорению его собственного производства: фактор XIa активирует фактор IX, а факторы VIIIa и Va связывают факторы IXa и Xa, соответственно, увеличивая их активность на порядки (комплекс факторов IXa и VIIIa называется внутренней теназой). Дефицит этих белков ведет к тяжелым нарушениям: так, отсутствие факторов VIII, IX или XI вызывает тяжелейшую болезнь гемофилию (знаменитую «царскую болезнь», которой болел царевич Алексей Романов); а дефицит факторов X, VII, V или протромбина несовместим с жизнью.
Такое устройство системы называется положительной обратной связью: тромбин активирует белки, которые ускоряют его собственное производство. И здесь возникает интересный вопрос, а зачем они нужны? Почему нельзя сразу сделать реакцию быстрой, почему природа делает ее исходно медленной, а потом придумывает способ ее дополнительного ускорения? Зачем в системе свертывания дублирование? Например, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа); это выглядит совершенно бессмысленным.
В крови также присутствуют ингибиторы протеиназ свертывания. Основными являются антитромбин III и ингибитор пути тканевого фактора. Кроме этого, тромбин способен активировать сериновую протеиназу протеин С, которая расщепляет факторы свертывания Va и VIIIa, заставляя их полностью терять свою активность.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин. Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы их инактивировать. Активированный протеин С производит несколько протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их полностью терять свою кофакторную активность. Таким образом, тромбин — продукт каскада свертывания — ингибирует свое собственное производство: это называется отрицательной обратной связью. И опять у нас регуляторный вопрос: зачем тромбин одновременно ускоряет и замедляет собственную активацию?
Эволюционные истоки свертывания
Формирование защитных систем крови началось у многоклеточных свыше миллиарда лет назад — собственно, как раз в связи с появлением крови. Сама система свертывания является результатом преодоления другой исторической вехи — возникновения позвоночных около пятисот миллионов лет назад. Скорее всего, эта система возникла из иммунитета. Появление очередной системы иммунных реакций, которая боролась с бактериями путем обволакивания их фибриновым гелем, привело к случайному побочному результату: кровотечение стало прекращаться быстрее. Это позволило увеличивать давление и силу потоков в кровеносной системе, а улучшение сосудистой системы, то есть улучшение транспорта всех веществ, открыло новые горизонты развития. Кто знает, не было ли появление свертывания тем преимуществом, которое позволило позвоночным занять свое нынешнее место в биосфере Земли?
У ряда членистогих (таких, как рак-мечехвост) свертывание также существует, но оно возникло независимо и осталось на иммунологических ролях. Насекомые, как и прочие беспозвоночные, обычно обходятся более слабой разновидностью системы остановки кровотечения, основанной на агрегации тромбоцитов (точнее, амебоцитов — дальних родственников тромбоцитов). Этот механизм вполне функционален, но накладывает принципиальные ограничения на эффективность сосудистой системы, — так же, как трахейная форма дыхания ограничивает максимально возможный размер насекомого.
К сожалению, существа с промежуточными формами системы свертывания почти все вымерли. Единственным исключением являются бесчелюстные рыбы: геномный анализ системы свертывания у миноги показал, что она содержит гораздо меньше компонентов (то есть, устроена заметно проще) [6]. Начиная же с челюстных рыб и до млекопитающих системы свертывания очень похожи. Системы клеточного гемостаза также работают по схожим принципам, несмотря на то, что мелкие, безъядерные тромбоциты характерны только для млекопитающих. У остальных позвоночных тромбоциты — крупные клетки, имеющие ядро.
Подводя итог, система свертывания изучена очень хорошо. В ней уже пятнадцать лет не открывали новых белков или реакций, что для современной биохимии составляет вечность. Конечно, нельзя совсем исключить вероятность такого открытия, но пока что не существует ни одного явления, которое мы не могли бы объяснить при помощи имеющихся сведений. Скорее наоборот, система выглядит гораздо сложнее, чем нужно: мы напомним, что из всего этого (довольно громоздкого!) каскада собственно желированием занимается только одна реакция, а все остальные нужны для какой-то непонятной регуляции.
Именно поэтому сейчас исследователи-коагулологи, работающие в самых разных областях — от клинической гемостазиологии до математической биофизики, — активно переходят от вопроса «Как устроено свертывание?» к вопросам «Почему свертывание устроено именно так?», «Как оно работает?» и, наконец, «Как нам нужно воздействовать на свертывание, чтобы добиться желаемого эффекта?». Первое, что необходимо сделать для ответа — научиться исследовать свертывание целиком, а не только отдельные реакции.
Лечение
Чтобы лечение этого состояния было эффективным, нужно определить причины заболевания. Очень важно своевременно выявлять и лечить основные нарушения – патологии печени или онкологические поражения.
К дополнительным методам терапии относят:
- инъекционное применение витамина К;
- препараты для улучшения свертываемости;
- переливание замороженной плазмы крови;
- другие средства – к ним относят гидроксимочевину и опрелвекин, которые помогают устранять проблемы с тромбоцитами.
В рацион больного следует включить продукты с высоким содержанием кальция, фолиевой кислоты, викасола, аминокислот.
К ним относят молочные продукты: сыр, творог, кефир. Также устранить симптомы патологии поможет рыба и мясо. Не менее важно есть листовые овощи – зеленый лук, шпинат, белокочанную капусту.
Диагностика патологии
Диагностические процедуры выполняются врачами нескольких специализаций: неонатологом, педиатром, генетиком и гематологом. При сопутствующих патологиях могут потребоваться консультации с гастроэнтерологом, ортопедом, отоларингологом и неврологом.
Семейным парам из группы риска следует посетить врача до зачатия ребенка. Молекулярно-генетическое исследование биоматериалов будущих родителей позволит учесть риск рождения ребенка с гемофилией. После зачатия возможно выполнение пренатальных скринингов. Их результаты подтвердят или опровергнут факт наследования гемофилии ребенком.
Неонатальные тесты, выполняемые в первые дни жизни малыша, оказываются не менее эффективности. Коагулограмма дает неонатологу исчерпывающие сведения о продуцировании факторов свертываемости организмом новорожденного.
При гемартрозах ребенку назначается рентгенографическое исследование суставов. Ультразвуковая диагностика выполняется при обнаружении признаков внутренних кровотечений и забрюшинных гематом.