Начало инфаркта миокарда в большинстве случаев трудно перепутать с каким-либо другим заболеванием, кроме стенокардии. Оно сопровождается явными симптомами: длительными приступами боли, удушья, повышенной потливостью, чувством страха смерти. Заболеванию подвержены пациенты, которые наблюдаются у врачей с ИБС или стенокардией. Однако инфаркт миокарда может настигнуть и человека, у которого ранее практически не проявлялись симптомы сердечно-сосудистых заболеваний. При первых признаках приступа важно своевременно вызвать скорую и довериться профессиональным кардиологам.
Клиническое биохимическое исследование крови
Биохимический анализ крови
— лабораторный метод исследования, который отражает функциональное состояние органов и систем организма.
Биохимический анализ крови показан
, даже если у человека отсутствуют жалобы. По изменениям в химическом составе крови можно установить, какой из органов функционирует с отклонением от нормы, что может свидетельствовать о развитии заболевания и необходимости срочного лечения.
Маркеры повреждения миокарда и сердечной недостаточности:
Миоглобин
– гемопротеин, в больших количествах содержащийся в скелетной мускулатуре и в небольшом количестве в сердечной мышце. Принимает участие в тканевом дыхании. При инфаркте миокарда концентрация миоглобина в крови повышается через 2 часа, однако это неспецифический маркёр инфаркта миокарда, так как в сердечной мышце содержится небольшое количество миоглобина. Данный маркер используется в диагностике инфаркта миокарда в комплексе с другими биохимическими тестами.
Тропонин I
– белок, специфический маркёр поражения сердечной мышцы, используемый в диагностике инфаркта миокарда. Повышение тропонина I отмечается уже через 4 – 6 часов после приступа. Данный тест позволяет диагностировать даже микроскопические участки повреждения миокарда.
КФК-МВ
– креатинфосфокиназа-МВ
— изофермент креатинфосфокиназы, характерный для ткани сердечной мышцы.
Определение активности КФК-МВ- имеет большое значение при диагностике инфаркта миокарда и мониторинге постинфарктного состояния, позволяя оценить объём поражения и характер восстановительных процессов. Диагноз острого инфаркта миокарда подтверждается также наблюдением характерной динамики показателя, серийное определение КФК-MB с интервалом 3 часа в течение 6 — 9 часового периода при неспецифических изменениях ЭКГ более информативно, чем единичное измерение. Уровень КФК-МВ может быть измерен как в весовом выражении, так и в единицах активности. В настоящее время для диагностики инфаркта миокарда предпочтительным является определение не активности, а массы КФК-МВ.
Для адекватной оценки соотношения концентрации КФК-MB и общей активности креатинфосфокиназы введён расчётный относительный индекс RI = КФК-MB (мкг/л) / КФК общ. (Ед/л) х 100 (%). Для повреждения сердечной мышцы характерен RI > 2,5 — 3%.
Маркер сердечной недостаточности ProBNP
– это предшественник мозгового натрийуретического пептида — BNP (BNP — brain natriuretic peptide). Название «мозговой» связано с тем, что впервые он был выявлен в мозгу животных. У человека основным источником ProBNP является миокард желудочков, он высвобождается в ответ на стимуляцию кардиомиоцитов желудочков, например при растяжении миокарда при сердечной недостаточности. ProBNP расщепляется на два фрагмента: активный гормон BNP и N — терминальный неактивный пептид
NT — proBNP
. В отличие от BNP, для
NT — proBNP
характерны более длительный период полувыведения, лучшая стабильность in vitro, меньшая биологическая вариабельность и более высокие концентрации в крови. Перечисленные особенности делают этот показатель удобным для использования в качестве биохимического маркера хронической сердечной недостаточности. Определение уровня
NT — proBNP
в плазме крови помогает оценить степень тяжести хронической сердечной недостаточности, прогнозировать дальнейшее развитие заболевания, а также оценивать эффект проводимой терапии.
Отрицательная предсказательная ценность теста более 95% — то есть, нормальный уровень NT-proBNP
с высокой вероятностью позволяет исключить сердечную недостаточность (например, в случаях одышки, обусловленной резким обострением хронического обструктивного лёгочного заболевания, или отеков, не связанных с сердечной недостаточностью). Следует отметить при этом, что
NT-proBNP
не должен использоваться в качестве единственного критерия.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА: СОВРЕМЕННЫЕ ТРЕБОВАНИЯ Д.С.Бенево…
Главная \ Публикации \ ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА: СОВРЕМЕННЫЕ ТРЕБОВАНИЯ Д.С.Беневоленский
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА: СОВРЕМЕННЫЕ ТРЕБОВАНИЯ Д.С.Беневоленский Представительство (Дания)
Резюме: Лабораторные методы на сегодняшний день играют ключевую роль в диагностике инфаркта миокарда. Однако все существующие на сегодняшний день биомаркеры некроза кардиомиоцитов не идеальны. Наиболее чувствительны и специфичны тропонины
I иT. Наименее специфичен миоглобин, но он быстрее появляется в крови после инфаркта. Промежуточными характеристиками обладает третий рекомендованный биомаркер – креатинкиназаMB. Для точного определения верхней границы нормы для биомаркеров аналитический метод должен обладать высокой чувствительностью и специфичностью. В результате использования производителями разных наборов антител в иммунохимической реакции и отсутствия четкой стандартизации концентрации биомаркеров, измеренные на разных анализаторах, часто не совпадают. Каждый анализатор имеет свои референтные диапазоны. Это относится, прежде всего, к тропонину. В кардиологии очень важна быстрота постановки диагноза, поэтому все большее значение приобретает проведение анализа непосредственно у постели больного. Некоторые современные анализаторы, как напримерRadiometer AQT90FLEX, позволяют очень просто получить высококачественный результат измерения биомаркеров.
Ключевые слова: инфаркта миокарда, диагностика, тропонин, миоглобин, креатинкиназа
MB.
Сегодня биохимические маркеры играют ключевую роль в точной диагностике инфаркта миокарда, и, что очень важно, в оценке риска неблагоприятного исхода и выборе наиболее адекватного метода лечения. Впервые лабораторный метод диагностики инфаркта миокарда (измерение активности аспартатаминотрансферазы в крови) был применен более 50-ти лет назад [5]. С тех пор роль лабораторных методов в кардиологии постоянно возрастала. Произошел знаменательный переход от измерения активности аспартатаминотрансферазы и лактатдегидрогеназы к трем широко применяемым сегодня биомаркерам: миоглобину, креатинкиназе MB (КФК-MB) и тропонинам I и T. Вначале результаты лабораторных исследований рассматривались лишь как дополнение к клиническому обследованию и ЭКГ. Но в 2000 году и затем в 2007 году решением наиболее авторитетных американских, европейских и международных кардиологических ассоциаций диагноз инфаркта миокарда был впрямую связан с повышением уровня биомаркеров (предпочтительно тропонина) в крови [12]. Все остальные методы клинического и функционального обследования призваны лишь подтвердить ишемическую природу наблюдаемого некроза миокарда. В опубликованном документе подчеркивается ключевая роль биомаркеров в диагностике: «Термин инфаркт миокарда следует использовать при наличии данных о некрозе миокарда на фоне клинической картины, соответствующей ишемии миокарда». Причем под данными о некрозе миокарда понимается «выявление роста и/или падения уровня сердечных биомаркеров (предпочтительно тропонина) с, по крайней мере, одной величиной, превышающей верхний референтный предел», а достаточным свидетельством ишемии считается хотя бы одно из следующего: • Наличие симптомов ишемии; • Изменения ЭКГ, свидетельствующие о появлении ишемии (появление изменений ST-T или появление блока левой ножки пучка Гиса); • Развитие патологического зубца Q на ЭКГ; • Данные лучевой диагностики, свидетельствующие о потере жизнеспособного миокарда или появлении локального нарушения движения стенки. Почему же в лабораторной диагностике центральное место заняло измерение уровня тропонина? В таблице 1 приведены свойства идеального биомаркера инфаркта миокарда.
Таблица 1. Свойства идеального биомаркера некроза миокарда [3].
| · Абсолютная специфичность для миокарда : Биомаркера не должно быть ни в каких других тканях организма. · Специфичность для необратимого повреждения : Биомаркер должен отличать обратимое (ишемия) от необратимого повреждения (некроз). · Быстрый выход в кровь : Биомаркер должен быстро выходить в кровь после некроза. Биомаркеры с более низкой молекулярной массой обычно быстрее появляются в крови. Растворимые цитоплазматические биомаркеры – быстрее, чем структурные. · Высокая чувствительность : Биомаркер должен содержаться в миокарде в высокой концентрации, а в крови полностью отсутствовать как в норме, так и при любой патологии, кроме некроза миокарда. Выброс биомаркера при некрозе должен быть мощным. · Стабильное увеличение уровня : Для надежного измерения уровень биомаркера должен оставаться повышенным в течение часов или дней после некроза. · Предсказуемое выведение : Кинетика выведения должна быть предсказуемой, и не зависеть от сопутствующих заболеваний, таких как почечная недостаточность или поражение печени. · Полное освобождение : Некротизированные миоциты должны полностью освобождаться от биомаркера. Количество биомаркера в крови должно быть пропорционально степени некроза (размеру инфаркта). · Измерение доступными методами : Природа биомаркера должна позволять применение доступного, надежного, быстрого, точного и экономичного метода измерения. |
На сегодняшний день ни один из существующих биомаркеров не удовлетворяет всем перечисленным критериям. Наиболее близки к идеалу тропонины I и T. Их основное преимущество – уникальная специфичность для миокарда. Тропонины – белки сократительного аппарата мышц. Они входят в состав тропонин-тропомиозинового комплекса тонких миофибрилл. Этот комплекс регулирует взаимодействие сократительных белков актина и миозина и, тем самым, обеспечивает смену сокращения или расслабления мышц. Имеются три типа тропонина – C,I иT. Все они – небольшие белки с молекулярной массой 20–40 тыс. ТропонинT связывает остальные тропонины и тропомиозин в единый комплекс. В расслабленной мышце тропонин I предотвращает взаимодействие головки миозина с актином и препятствует сокращению. Возбуждение кардиомиоцита приводит к повышению внутриклеточной концентрации ионовCa2+, которые связываются с тропонином C. Конформация всего комплекса изменяется, и актин освобождается от ингибирующего влияния тропонина I – происходит сокращение мышцы. Тропонин C – один из очень консервативных белков. Так, тропонинCиз скелетных мышц человека отличается от тропонина C из сердца быка лишь одной аминокислотой [10]. Другими словами, тропониныCсердца и медленных скелетных мышц практически идентичны. Напротив, сердечные изоформы тропонинов I иTэкспрессируются только в сердце, тогда как изоформы аналогичных тропонинов быстрой и медленной скелетных мышц – это продукты других генов. Будучи частью сократительного аппарата, тропониныIиT присутствуют в клетках миокарда в высокой концентрации. В крови здоровых людей концентрация этих белков крайне мала, но в случае инфаркта миокарда она возрастает в десятки раз (рис.1), причем повышенная концентрация сохраняется в течение нескольких дней, в некоторых случаях до одной, а для тропонина T и двух недель. По общему мнению экспертов, концентрация тропонинов в крови возрастает лишь при необратимом разрушении (некрозе) кардиомиоцитов, хотя причины некроза могут быть разные. К сожалению, тропонины – структурные белки, и они появляются в крови не сразу, обычно через 4-6 часов после инфаркта. Правда, повышение чувствительности современных тестов все более сокращает это время. Кинетика выведения тропонинов неоднозначна и зависит от функции почек. Тропонины I иT содержатся в миокарде в эквимолярном количестве, они оба уникальны для сердца, и хотя это разные белки, с точки зрения диагностики инфаркта миокарда, оба тропонина I иT совершенно равнозначны, и все международные рекомендации не делают различия между ними.Если нет возможности измерить концентрацию тропонина, то международные рекомендации предлагают в качестве альтернативы измерить уровень креатинкиназы MB (по массе, а не по активности!) [7]. До недавнего времени именно этот показатель был «золотым» стандартом в лабораторной диагностике инфаркта миокарда в силу его относительной специфичности для миокарда. Креатинкиназа MB – фермент, катализирующий перенос высокоэнергетического фосфата с креатинфосфата на АТФ и участвующий в транспорте энергии от митохондрий к сократительному аппарату. Для интенсивной и непрерывной работы сердцу нужен постоянный приток энергии, поэтому этот фермент содержится к кардиомиоцитах в большом количестве. Креатинкиназа состоит из двух субъединиц и имеет молекулярную массу около 42 тыс. Известны два вида субъединиц MиB, и соответственно три изофермента MM, BB и MB. КФК-MM преобладает в скелетных мышцах, и на долю КФК-MB приходится лишь 1–3%. В миокарде основной изофермент также КФК-MM, но примерно 15% приходится на долю КФК-MB. Поэтому повышение уровня КФК-MB в крови специфично (но не абсолютно!) для поражения миокарда. Активность гена, кодирующего субъединицуB, может повышаться, например, в регенерирующей скелетной мышце, что снижает специфичность этого биомаркера. КреатинкиназаMB – менее чувствительный биомаркер, чем тропонин. Показано, что почти у 30% больных, поступивших с болью в груди, без подъема сегментаST на ЭКГ и без повышения уровня креатинкиназы КФК-MB, в действительности был инфаркт миокарда, как показало измерение уровня тропонина. Для пациентов, поступивших в течение 6 часов с начала болевого международные рекомендации предусматривают определение раннего биомаркера некроза миокарда в дополнение к сердечному тропонину [7]. Миоглобин – наиболее изученный биомаркер для этой цели. Это небольшой гем-содержащий растворимый белок скелетных мышц и миокарда (м.м. 17 500). Его основная функция – транспорт кислорода в мышцах. Благодаря высокой растворимости и небольшому размеру, миоглоблин быстро освобождается при поражении мышц и выводится почками. Основной недостаток миоглобина, как биомаркера, – низкая специфичность. Нормальный уровень миоглобина помогает исключить диагноз инфаркта миокарда. Но его повышение может быть связано и с различными поражениями скелетных мышц.Каковы же нормальные концентрации биомаркеров в крови, и что считать доказанным повышением их уровня? Согласно рекомендациям Национальной академии клинической биохимии (США) и Международной федерации клинической химии и лабораторной диагностики, для каждого биомаркера необходимо установить верхнюю границу нормальных значений на основе исследования группы здоровых людей, не имеющих заболеваний сердца в анамнезе [1,2]. Для тропонинов (T и I) и креатинкиназы MB пороговым значением для выявления поражения сердца признан 99-й процентиль результатов измерения в группе здоровых людей. Это означает, что у 99 % здоровых людей уровень соответствующего аналита в плазме оказывается ниже указанного порога. Наоборот, превышение этого порога свидетельствует о поражении миокарда. Причем для креатинкиназы MB исследования должны быть проведены отдельно для мужчин и женщин, так как у мужчин величина 99-го процентиля в 2–3 раза выше, чем у женщин. Имеются и расовые различия. Для концентрации миоглобина в качестве границы нормы принят 97,5-й процентиль. В идеале каждая лаборатория должна установить собственный референтный диапазон, но, учитывая сложность проведения такого исследования, допускается ориентироваться на цифры, приведенные производителями.В приведенном выше определении инфаркта миокарда очень важны слова «рост или падение» уровня биомаркера. То есть в идеале нужно выявить новый пик концентрации биомаркера в крови, соответствующий клинической картине. Для этого концентрацию биомаркера необходимо измерить минимум дважды, причем измерить количественно. Для большинства пациентов показано взятие проб крови при поступлении и через 6-9 часов [7]. После подтверждения диагноза инфаркта миокарда последующие измерения биомаркеров поражения миокарда (примерно раз в сутки) позволяет оценить размер инфаркта и оценить риск осложнений для данного пациента. Точная оценка риска сердечно-сосудистого заболевания исключительно важна для принятия клинического решения, поскольку для выбора наилучшего способа лечения каждого конкретного пациента необходимо взвесить преимущества, опасность и стоимость различных методов лечения [4]. Из перечисленных биомаркеров труднее всего измерить в крови концентрацию тропонина, поскольку в норме она исключительно низка. Для точного определения верхней границы нормы (99-го процентиля) аналитическая чувствительность метода измерения должна быть достаточной для определения концентрации тропонина в крови если не всех, то, по крайней мере, многих здоровых людей. На рис.2 показано «истинное» распределение концентрации тропонина I в крови у здоровых людей и больных инфарктом миокарда. Граница нормы на уровене 99-го процентиля распределения концентрации тропонина I у здоровых людей наилучшим образом позволяет отличить больных от здоровых [2]. Если метод анализа имеет предел обнаружения (1), то этот порог можно установить достаточно точно определить. Метод с пределом обнаружения (2), безусловно, выявит большинство больных с инфарктом миокарда, но истинная граница нормы остается неизвестной, а потому у части больных поражение миокарда остается недиагностированным. Согласно рекомендации Международной федерации клинической химии и лабораторной медицине (IFCC), для снижения влияния неспецифических факторов аналитическая чувствительность должна быть примерно в 5 раз ниже клинически значимого порогового уровня [9]. Кроме того, погрешность измерения на пороговом уровне должна быть достаточно низка [1]. Погрешность определяется величиной коэффициента вариации (CV), который равен: CV = SD/M*100%, где M – среднее арифметическое результатов измерения данной концентрации, а SD – стандартное отклонение. На уровне верхней границы нормы погрешность должна составлять не более 10%, иначе тест будет давать много ложно-положительных и ложно-отрицательных результатов.К сожалению, изложенные рекомендации далеко не всегда выполняются в реальной жизни. На официальном сайте Международной федерации по клинической химии и лабораторной медицине [https://www.ifcc.org/PDF/IFCC_Troponin_Web_Page_Table_of_Assays_Oct_2008.pdf] приведены аналитические характеристики для 19 тестов на тропонины IиTразных производителей (данные на октябрь 2008). Лишь у 12 из них предел обнаружения меньше верхней границы нормы, то есть для остальных тестов верхняя граница нормы (99-й процентиль) фактически не была установлена. С точностью измерения дело обстоит еще хуже. Даже на уровне, в два раза превышающем границу нормы, коэффициент вариации не превышает 10% лишь у восьми тестов. Таким образом, аналитическое качество – очень важная и до конца не решенная тема, на которую стоит обратить пристальное внимание.Все имеющиеся на сегодняшний день методы определения концентрации тропонина основаны на иммунохимической реакции, так называемом «сэндвич»-анализе. Качество получаемого результата зависит от правильности выбора антител. Тройной комплекс из тропонинов I,TиC, попадая из разрушенных кардиомиоцитов в кровь, распадается на свободный тропонин T и двойной комплекс из тропониновIиC. Это и есть основные формы тропонинов в крови. В крови под действием протеаз начинается отщепление концевых фрагментов молекул тропонина (рис. 3). Поэтому используемые для анализа антитела должны взаимодействовать с центральной, наиболее стабильной частью молекулы тропонина. Кроме того, тропонин I может быть в фосфорилированной/ дефосфорилированной, а также окисленной/ восстановленной формах. Связывание антител, выбранных для анализа, не должно зависеть от химической модификации молекулы тропонинаI. Помимо этого, центральная часть молекулы тропонина I – объект взаимодействия с аутоантителами, которые, блокируя связывание антител теста, могут приводить в ложно-отрицательным результатам анализа. Наличие аутоантител к тропонину I – достаточно распространенное явление. Они обнаружены у 5,5 % людей без признаков сердечно-сосудистых заболеваний и у 21 % больных с острым коронарным синдромом [6]. Попытки производителей преодолеть указанные трудности и подобрать наилучшее сочетание антител для анализа приводят к использованию антител к разным эпитопам. В результате использования производителями разных наборов антител в иммунохимической реакции и отсутствия четкой стандартизации концентрации биомаркеров, измеренные на разных анализаторах, часто не совпадают. При практически идеальной корреляции величин, полученных наилучшими методами измерения, абсолютная величина концентрации может различаться на порядок. Поэтому прямое сравнение абсолютных значений невозможно, а границы нормы должны быть определены отдельно для каждого анализатора. И хотя клиническая интерпретация результатов с учетом соответствующих референтных диапазонов в целом совпадает для всех тестов, эта ситуация создает очевидное неудобство. Здесь необходим вдумчивый клинико-лабораторный консилиум для выработки общих правил оценки результатов, полученных, например, на портативных анализаторах у постели больного и в центральной лаборатории, для каждой конкретной больницы. В диагностике и лечении инфаркта миокарда критическую роль играет время. Реперфузия, начатая в течение первого часа после начала инфаркта миокарда, сопровождалась 1% летальностью, тогда как то же лечение, начатое через 6 и более часов, приводило к 10% летальности [11]. По общему мнению клиницистов и врачей-лаборантов, время до получения ответа из лаборатории о концентрации сердечных биомаркеров в пробе крови не должно превышать 60 мин [7].В действительности мало где круглосуточно обеспечивается такая скорость выполнения анализов. Поэтому Национальной академией клинической биохимии (США) даны следующие четкие рекомендации [8]: · Лаборатория должна измерить сердечные биомаркеры в течение 1 часа, лучше — за 30 и менее минут. Время рассчитывается от забора пробы до сообщения результата. · Учреждения, неспособные постоянно обеспечить получение результатов измерения сердечных биомаркеров примерно за 1 час, должны использовать анализаторы у постели больного. Приближение анализаторов к больному, то есть перемещение их из лаборатории в клинические отделения, несет с собой новые проблемы. Прежде всего, необходимо обеспечить максимальную простоту работы при минимальной потребности в обслуживании. Анализатор будет использовать персонал клинического отделения, не имеющий специального лабораторного образования. Следует учитывать и текучесть кадров, часто препятствующую своевременной дополнительной подготовке персонала. При этом необходимо обеспечить лабораторное качество анализа (высокую чувствительность и точность измерения) и достаточную производительность. Оптимальной схемой считается сохранение контроля лабораторных специалистов за всеми приборами, расположенными в отделениях. Подключение анализатора к внутрибольничной информационной системе, обеспечивающей возможность удаленного доступа с лабораторного компьютерного терминала, значительно облегчает такой контроль. Примером анализатора, наиболее полно соответствующего всем указанным требованиям, служит новый иммунофлюоресцентный анализатор AQT90FLEX производства (Дания), показанный на обложке этого журнала. Это достаточно компактный настольный прибор, способный измерять все указанные биомаркеры некроза миокарда (тропонин I, креатинкиназу MB, миоглобин). Уже на будущий год к ним присоединится и тропонинT. Кроме того, можно измерить биомаркеры сердечной недостаточности (NT-proBNP), активации системы свертывания (D-димер), воспаления (СРБ) и беременности (β-субъединицу человеческого гонадотропина). Оператор может свободно выбрать необходимые параметры, измерение которых идет параллельно. Важно, что не требуется никакой предварительной обработки пробы крови. Для измерения нужно лишь вставить закрытую стандартную вакуумную пробирку с пробой в анализатор, выбрать параметры и получить результат и закрытую же пробирку. Контакт с кровью или отходами в процессе анализа исключен. Все процессы максимально автоматизированы, есть возможность подключения анализатора к информационным системам. Все это позволяет легко использовать анализатор для экспресс-диагностики непосредственно в отделении. В то же время, результат измерения соответствует самым высоким лабораторным стандартам. Врачам не придется больше уточнять диагноз, посылая пробу в центральную лабораторию. В таблице 2 приведены данные по аналитическому качеству измерения основных биомаркеров некроза миокарда. Таблица 2. Аналитическое качество измерения анализатора AQT90FLEX.
| Параметр | Предел обнаружения | Граница нормы (99-й процентиль) | 10 % CV | Диапазон |
| Тропонин I | 0,0095 мкг/л | ≤ 0,023 мкг/л | 0,039 мкг/л | 0,010-50 мкг/л |
| Креатинкина MB | 0,53 мкг/л | ≤ 7,2 мкг/л | < 5мкг/л | 2-500 мкг/л |
Результаты измерения тропонина на AQT90 FLEX практически идеально коррелируют с результатами лабораторного анализатора TnI-Ultra ADVIA Centaur (Siemens) и коэффициент корреляции R2 = 0,984. Таким образом, современные требования к лабораторной диагностике инфаркта миокарда сводятся к быстрому и точному определению биомаркеров (предпочтительно тропонина). Для этого помимо лабораторных необходимы и внелабораторные анализаторы, которые бы были просты в обращении и давали бы количественный результат, сопоставимый по точности с данными лаборатории. Применение подобных анализаторов непосредственно в отделениях скорой помощи и отделениях реанимации позволит повысить качество медицинской помощи в неотложных ситуациях. Список литературы 1. Apple FS, Jesse RL, Newby LK, Wu AH, Christenson RH. National Academy of Clinical Biochemistry and IFCC Committee for Standardization of Markers of Cardiac Damage Laboratory Medicine Practice Guidelines: Analytical issues for biochemical markers of acute coronary syndromes. Circulation. 2007 Apr 3;115(13): e352-5. 2. Apple FS, Quist HE, Doyle PJ, Otto AP, Murakami MM. Plasma 99th percentile reference limits for cardiac troponin and creatine kinase MB mass for use with European Society of Cardiology/American College of Cardiology consensus recommendations. Clin Chem. 2003 Aug;49(8): 1331-6. 3. Cardiovascular biomarkers : pathophysiology and disease management (edited by David A. Morrow).2006 Humana Press Inc. p.6. 4. Criteria for Evaluation of Novel Markers of Cardiovascular Risk. A Scientific Statement From the American Heart Association. Circulation. 2009; 119: 2408-2416. 5. Karmen A, Wroblewski F, LaDue JS. Transaminase activity in human blood. J Clin Invest 1954;34:126–133. 6. Kim Pettersson, Susann Eriksson, Saara Wittfooth, Emilia Engström, Markku Nieminen and Juha Sinisalo. Autoantibodies to Cardiac Troponin Associate with Higher Initial Concentrations and Longer Release of Troponin I in Acute Coronary Syndrome Patients. Clinical Chemistry. 2009;55:938-945. 7. Morrow DA, Cannon CP, Jesse RL, Newby LK, Ravkilde J, Storrow AB, Wu AH, Christenson RH, Apple FS, Francis G, Tang W. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: Clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Clin Chem. 2007 Apr; 53(4): 552-74. 8. National Academy of Clinical Biochemistry: Laboratory Medicine Practice Guidelines: Evidence-Based Practice for Point-of-Care Testing. (Editor James H. Nichols) AACCPress. 2006. 9. Panteghini M, Gerhardt W, Apple FS, Dati F, Ravkilde J, Wu AH. Quality specifications for cardiac troponin assays. Clin Chem Lab Med. 2001 Feb;39(2):175-9. 10. Romero-Herrera, A. E.; Castillo, O.; Lehmann, H. : Human skeletal muscle proteins: the primary structure of troponin C. J. Molec. Evol. 8: 251-270, 1976. 11. Rosalki SB, Roberts R, Katus HA, Giannitsis E, Ladenson JH, Apple FS. Cardiac biomarkers for detection of myocardial infarction: perspectives from past to present. Clin Chem. 2004 Nov;50(11): 2205-13. 12. Thygesen K, Alpert JS, White HD on behalf of Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction. Circulation. 2007 Nov 27; 116(22): 2634-53.
Рисунок 1. Рост уровня маркеров в крови при инфаркте миокарда [7].
Рисунок 2. Предел обнаружения у хорошего (1) и недостаточно чувствительного теста (2) по отношению к истинной границе нормы для концентрации тропонина I.
Рисунок 3. Факторы, влияющие на выбор антител для определения тропонина I.
Новости все
06.07.2021 Х Балтийский форум » Актуальные проблемы анестезиологии и реаниматологии» 30 июня — 3 июля 2021
03.06.2021 Состоялась 7я Конференция «Лабораторная диагностика неотложных состояний 2021»
11.05.2021 Конференция «Лабораторная диагностика неотложных состояний 2021 г.» 3 июня, Новотель, Санкт-Петербург
22.01.2021 Семинар для руководителей ветеринарных клиник
09.04.2020 Производители и поставщики призвали упростить регистрацию медизделий
Методы диагностики
Физикальное обследование
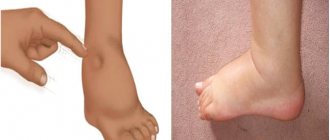
Первичная диагностика инфаркта миокарда, которую проведут прибывшие врачи, заключается, прежде всего, в осмотре пациента и опросе относительно жалоб на состояние здоровья. Данное заболевание можно спутать с приступом стенокардии, особенно если она проявилась впервые. Характер болевых ощущений схож – они распространяются от грудины в левую руку (включая пальцы), плечо, лопатку, шею, челюсть. Отличие инфаркта – в более сильной и острой боли, которая не снимается приемом нитроглицерина.
Болевой синдром при инфаркте миокарда может длиться около суток, сопровождаться слабостью, падением артериального давления, рвотой. Пациент находится в эмоциональном возбуждении, в отличие от приступа стенокардии, когда больные, напротив, стараются двигаться как можно меньше.
Врач измеряет давление (чаще всего оно снижается на 10-15 мм) и пульс, проверяет возможные дисфункции левого желудочка, миокарда, выслушивая тоны сердца.
Лабораторные анализы
На госпитальном этапе диагностика инфаркта заключается в проведении биохимического и общего анализов крови. При данном заболевании в составе крови происходят заметные изменения:
- повышается уровень лейкоцитов, показатели АЛТ, АСТ, холестерина, фибриногена;
- снижается скорость оседания эритроцитов, показатель альбумина.
Это показатели некроза, рубцевания тканей сердечной мышцы и наличия воспаления. У больного фиксируется полиморфно-клеточный лейкоцитоз.
Лабораторным способом диагностики инфаркта миокарда проверяется и уровень ферментов сыворотки крови. В ней появляются маркеры, свидетельствующие о некрозе миокарда, – в частности сократительный белок тропонин, который не обнаруживается у здорового человека. К маркерам также относятся КФК, миоглобин, появляющиеся в сыворотке крови в первые часы после начала заболевания.
Ряд биохимических реакций в крови не являются специфическими для инфаркта, поэтому чрезвычайно важно доверить диагностику высококвалифицированным врачам и клинике с широкими техническими возможностями.
Электрокардиография
ЭКГ при инфаркте миокарда – один из наиболее действенных, объективных и информативных способов диагностики. При возможности обратитесь за неотложной помощью к врачам кардиологической бригады – в оснащении их автомобиля обязательно находится портативный электрокардиограф, который позволит в кратчайшие сроки диагностировать заболевание.
ЭКГ-оборудование улавливает электрические импульсы, которые генерируются сердечной мышцей, и регистрирует их на бумаге. На основании анализа кардиограммы квалифицированный врач может определить:
- локализацию некроза (задняя, передняя или боковая стенка, перегородка, базальная стенка и др.);
- величину и глубину поражения;
- стадию процесса;
- появившиеся осложнения.
Врач обращает внимание на характер зубцов электрокардиограммы, анализирует повышение уровня отдельных сегментов. В частности, крупноочаговый трансмуральный инфаркт миокарда характеризуется появлением патологического зубца Q.
Исследование занимает около 10 минут и не вызывает неприятных ощущений. При инфаркте ЭКГ может проводиться каждые полчаса для постоянного обновления данных.
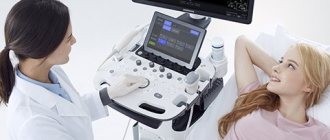
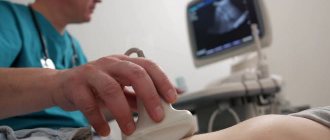
Эхокардиография
Более распространенное среди пациентов название эхокардиографии – УЗИ сердца. Это чрезвычайно эффективный инструмент диагностики острого инфаркта миокарда и других видов этой патологии.
Исследование не связано с болезненными ощущениями и занимает 20-25 мин. Врач смазывает грудную клетку больного специальным гелем и водит по ней ультразвуковым датчиком. Эхокардиограф считывает полученные данные о состоянии миокарда, перикарда, крупных сосудов, клапанов, а врач сразу анализирует их. Преимуществом метода является возможность за кратчайший срок визуально оценить функциональность работы органа и диагностировать нарушения регионарной сократимости.
Режим допплера, в котором работают современные УЗИ-аппараты, позволяет оценить качество кровотока в сердце, определить наличие в них тромбов. Также анализируются звуковые сигналы сердца, измеряется давление в полостях органа, изучаются осложнения.
Рентгенография
Для объективного прогноза развития осложнений при инфаркте миокарда в рамках диагностики проводится рентгенография грудной клетки.
Среди опасных осложнений чаще всего этим методом диагностируется отек легких, который является одним из явных признаков острой левожелудочковой недостаточности. На снимке фиксируется нарушение кровотока в верхних отделах легких, легочной артерии, расплывчатый рисунок сосудов и др. Также при инфаркте вероятно расслоение аорты, другие изменения в грудной ее части. Рентгенография позволяет диагностировать нарушения кровоснабжения органов, располагающихся в непосредственной близости от сердца.
Среди рентгенологических методов, применяемых в кардиологии для определения инфаркта, также распространены коронароангиография и мультиспиральная компьютерная томография сердца. С их помощью определяется место и характер сужения коронарной артерии.
Анализы крови определяющие риск развития инфаркта и инсульта
Указанные ниже анализы крови, помогают определить риск развития ишемической болезни сердца, инсульта, периферических сосудов и при необходимости назначить лечение.
Липопротеин — А (Lp (а)) — белок крови, уровень которого указывает на повышенный риск развития сердечного приступа и инсульта.
Нормальное значение:
Желаемый уровень для взрослых: не более 30 мг / дл.
Подготовка к сдаче анализа:
Кровь берется для анализа после 12-часового голодания (за исключением употребления воды). Для получения более точных результатов, необходимо воздерживаться от проведения исследования, по крайней мере, в течение двух месяцев после перенесенного сердечного приступа, операции, инфекции, травмы или беременности.
Липопротеин А является липопротеидом низкой плотности (LDL), к которому присоединен белок называемый «апо». В настоящее время не полностью известно, какую функцию в организме выполняет липопротеин А, однако известно, что содержание в крови липопротеина А выше, чем 30 мг / дл, повышает риск развития инфаркта миокарда и инсульта. Кроме того, высокий уровень липопротеина А может привести к развитию жировой эмболии и повышает риск развития тромбов.
Особенно важно привести уровень ЛПНП (липопротеидов низкой плотности) к норме при повышенном содержании липопротеина А. Причинами высокого содержания липопротеина А являются заболевания почек и некоторые семейные (генетические) нарушения липидного обмена. Аполипопротеин А1 (Аpо А1) — является основным белком ЛПВП (липопротеидов высокой плотности). Низкий уровень аполипопротеина А1 указывает на повышенный риск развития ранних сердечно-сосудистых заболеваний. Апо 1 чаще бывает снижен у пациентов страдающих гиподинамией, ожирением или употребляющих в пищу высокое количество жиров.
Нормальное значение:
Желаемый уровень для взрослого: более 123 мг / дл.
Подготовка к сдаче анализа:
Кровь должна быть забрана для анализа после 12-часового голодания (за исключением употребления воды). Для получения более точных результатов, необходимо воздерживаться от проведения исследования, по крайней мере, в течение двух месяцев после перенесенного сердечного приступа, операции, инфекции, травмы или беременности.
Аполипопротеин В (аpоВ) — основной белок, содержащийся в холестерине. Новое исследование предполагает, что ApoB является более лучшим общим маркером риска развития сердечно-сосудистых заболеваний, чем ЛПНП.
Нормальное значение:
Менее 100 мг / дл для лиц с низким / средним риском. Менее 80 мг / дл для лиц с высоким риском, например, с сердечно-сосудистыми заболеваниями или сахарным диабетом.
Подготовка к сдаче анализа:
Кровь должна быть забрана для анализа после 12-часового голодания (за исключением употребления воды). Для получения более точных результатов, необходимо воздерживаться от проведения исследования, по крайней мере, в течение двух месяцев после перенесенного сердечного приступа, операции, инфекции, травмы или беременности.
Фибриноген — белок, содержащийся в крови и участвующий в системе свертывания крови. Однако, высокие уровни фибриногена могут повысить риск развития инфаркта миокарда и сосудистых заболеваний.
Нормальное значение:
Менее 300 мг / дл.
Подготовка к сдаче анализа:
Кровь должна быть забрана для анализа после 12-часового голодания (за исключением употребления воды). Для получения более точных результатов, необходимо воздерживаться от проведения исследования, по крайней мере, в течение двух месяцев после перенесенного сердечного приступа, операции, инфекции, травмы или беременности.
Повышенный уровень фибриногена чаще выявляется возрастных пациентов, у пациентов с повышенным артериальным давлением, массой тела и ЛПНП. С другой стороны, более низкий уровень фибриногена выявляется у пациентов употребляющих алкоголь и регулярно получающих физическую нагрузку. Рост уровня фибриногена наблюдается с менопаузой.
Высокочувствительный С-реактивный белок (протеин) (СRP) — белок, содержащийся в крови, который называют «маркером воспаления», то есть его наличие указывает на воспалительный процесс в организме. Воспаление является нормальным ответом на многие физические состояния, включая лихорадку, травмы и инфекции. Но, воспалительный процесс, локализованный в стенке сосуда, играет важную роль в инициации и прогрессировании сердечно-сосудистых заболеваний. Воспаление (т.е. набухание и повреждение) внутренней стенки артерий является важным фактором риска развития таких сердечно-сосудистых заболеваний как, атеросклероз, инфаркт миокарда, внезапная смерть, инсульт, образование тромбов, а также заболеваний периферических артерий.
В Health Study Гарвардского Университета, в результате проведенных исследований, повышенный уровень CRP был более точным маркером развития коронарных заболеваний, чем уровень холестерина. В исследовании оценивались двенадцать различных маркеров воспаления у здоровых женщин в постменопаузе. После трех лет, С реактивный белок был самым сильным предиктором риска. Женщины в группе с самыми высокими уровнями CRP более чем в четыре раза чаще, умерли от ишемической болезни сердца, или пострадали от нефатального инфаркта или инсульта.
Совсем недавно, исследование JUPITER (Обоснование использования статинов для первичной профилактики) показало, что статины предотвращают болезни сердца и снижают риск инсульта, сердечного приступа, смерти у лиц с нормальным уровнем ЛПНП (плохой холестерин), но повышенным уровнем высокочувствительного С-реактивного белка (CRP).
В то время как повышенный уровень холестерина, ЛПНП и триглицеридов и низкий уровень ЛПВП являются независимыми факторами риска развития болезней сердца, высокочувствительный С — реактивный протеин предоставляет дополнительную информацию о воспалительном процессе в артериях, что невозможно определить по липидному спектру.
Нормальное значение:
Меньше, чем 1,0 мг / л = низкий риск развития сердечно-сосудистых заболеваний; 1,0 — 2,9 мг / л = промежуточный риск развития сердечно-сосудистых заболеваний; более 3,0 мг / л = высокий риск развития сердечно-сосудистых заболеваний.
Иногда определяются уровни CRP 50 мг/л и выше, но обычно, уровень С — реактивного протеина выше 10 мг/л обусловлен иным воспалительным процессом, например, инфекцией, травмой, артритом, и т.д.
Таким образом, тестирование не должно происходить во время болезни или травмы. CRP должен быть исследован для оценки риска развития сердечно-сосудистых заболеваний у практически здоровых лиц, которые недавно не переносили то или иное инфекционное заболевание или другие серьезные заболевания. Те пациенты, у которых уровень CRP при исследовании, составил выше 10 мг/л, должны быть обследованы для выявления источника воспалительного процесса.
Подготовка к сдаче анализа:
Этот тест может быть выполнен в любое время дня, без какой бы то ни было подготовки. Единственным условием является — отсутствие острого воспаления.
Миелопероксидаза (МPО) — является маркером воспалительного процесса в артериях. В результате подобного процесса зачастую происходит разрушение атеросклеротических отложений в стенке сосуда, приводящее к тромбозу. Высокий уровень миелопероксидазы, в сочетании с другими факторами риска (CRP, ЛПНП, повышение артериального давления, лишний вес) является точным критерием повышенного риска развития сердечного приступа, инфаркта миокарда, внезапной смерти, инсульта или заболеваний периферических сосудов, в том числе у практически здоровых людей.
Нормальное значение:
Менее чем 400 мкм.
Подготовка к сдаче анализа:
Этот тест может быть выполнен в любое время дня и не требует голодания.
N-терминальный про-мозговой натрийуретический пептид (N-проМНП, NT-proBNT) — пептид, который продуцируется в предсердиях и желудочках сердца в ответ на повышение растяжимости кардиомиоцитов и увеличение давления в камерах сердца. Измеряя концентрацию NT-proBNP, можно судить о количестве синтезированного мозгового натрийуретического пептида. Уровень NT-proBNT тесно коррелирует с фракцией выброса левого желудочка и систолическим давлением в легочной артерии. Повышение уровня NT-proBNP указывает на высокую вероятность сердечной недостаточности и целесообразность соответствующего обследования для подтверждения диагноза.
Нормальное значение:
Менее чем в 125 пг / мл.
Подготовка к сдаче анализа:
Этот тест может проводиться в любое время в течение дня, голодание не требуется.
Уровень липопротеин — ассоциированной фосфолипазы (ЛП-ФЛА2, PLAC).
Высокие уровни липопротеин-ассоциированной секреторной фосфолипазы а2 (ЛП-ФЛА2) указывают на повышение риска развития сердечно-сосудистых заболеваний. Однако, в некоторых случаях, причиной повышенного уровня может быть не артериальная причина.
Нормальное значение:
Менее 200 нг / мл — относительно низкий риск развития сердечно-сосудистых заболеваний;
Между 200-235 нг / мл — средний риск развития сердечно-сосудистых заболеваний;
Более 235 нг / мл — высокий риск развития сердечно-сосудистых заболеваний.
Подготовка к сдаче анализа:
Кровь должна быть забрана для анализа после 12-часового голодания (за исключением употребления воды). Для получения более точных результатов, необходимо воздерживаться от проведения исследования, по крайней мере, в течение двух месяцев после перенесенного сердечного приступа, операции, инфекции, травмы или беременности.
Отношение альбумина к креатинину в моче. (Ualb / Cr). Появление альбумина в моче является признаком заболевания почек, сахарного диабета и сердечно-сосудистых осложнений.
Нормальное значение:
Более 30 мг / г указывает на повышенный риск сердечно-сосудистых заболеваний и диабетической нефропатии.
Более 300 мг / г указывает на клиническую нефропатию.
Подготовка к сдаче анализа:
Анализ мочи может быть проведен в любое время в течение дня и не требует поста.
Лабораторные анализы — способ диагностики хронической сердечной недостаточности
Хроническая сердечная недостаточность (ХСН) — заболевание, при котором снижается насосная функция сердца. Оно не может выбрасывать необходимое количество крови, из-за чего страдают органы и ткани. Чтобы выявить заболевание, необходима консультация кардиолога. Но предварительно можно сдать анализы, которые помогут специалисту в диагностике сердечной недостаточности. 1.Общий анализ крови. При прогрессирующей ХСН возможно развитие железодефицитной анемии в связи с нарушением всасывания железа в кишечнике или недостаточным поступлением железа с пищей.
2.Общий анализ мочи. Возможно появление протеинурии, цилиндрурии, как маркеров нарушения функционального состояния почек при хронической сердечной недостаточности.
3.Биохимический анализ крови: • Для диагностики возможных нарушений функции печени — АСТ, АЛТ, общий белок, билирубин. АСТ и АЛТ всегда сдаются в паре, чтобы врач мог увидеть и разделить поражения сердца и печени. Их повышение, в большинстве случаев, говорит о проблемах с мышечными клетками сердца, возникновении инфаркта миокарда. • ЛДГ (лактатдегидрогеназа) и КФК (креатинфосфокиназа) и особенно ее МВ-фракции (МВ-КФК) — возрастают при остром инфаркте миокарда. • Миоглобин — увеличивается в результате распада мышечной ткани сердца или скелета. • Электролиты (ионы К , Na , Cl-, Ca2 ) — повышение калия влечет за собой нарушение сердечного ритма, возможное развитие возбуждения и мерцания желудочков; низкий уровень калия может вызвать снижение рефлексов миокарда; недостаточное содержание ионов натрия и увеличение хлоридов чреваты развитием сердечно-сосудистой недостаточности. • Холестерин — его избыток служит риском развития атеросклероза и ишемической болезни сердца. Повышение уровня холестерина (при значительном нарушении функции печени — гипохолестеринемия), триглицеридов, липопротеинов низкой и очень низкой плотности, снижение липопротеинов высокой плотности возможно при ишемической болезни сердца. • С-реактивный белок — появляется в организме при воспалительном процессе или уже произошедшем некрозе тканей, поскольку в сыворотке крови здорового человека он содержится в минимальных значениях.
4. Мозговой натрийуретический пептид (BNP) — используется в качестве маркера при диагностике сердечной недостаточности. Уровень BNP повышен у пациентов с дисфункцией левого желудочка. При этом содержание BNP в плазме крови достоверно коррелирует с функциональными классами хронической сердечной недостаточности. Определение уровня BNP в плазме крови помогает оценить степень тяжести хронической сердечной недостаточности, прогнозировать дальнейшее развитие заболевания, а также оценивать эффект проводимой терапии.
5. Коагулограмма — даст представление о процессе свертываемости крови, ее вязкости, возможности возникновения тромбов или, наоборот, кровотечений. Может сдаваться дополнительно к остальным анализам.
Сдать необходимые анализы можно в ФГБУ «НМИЦ ТПМ» Минздрава России. К вашим услугам комфортный процедурный кабинет и полностью оснащенная лаборатория. Большинство анализов выполняется в течение 1 рабочего дня.
Подробнее по ссылке