Алена Якименко, Анастасия Свешникова, Елена Артеменко, Михаил Пантелеев «Природа» №2, 2014
Об авторах
| Алена Олеговна Якименко ( |
| Анастасия Никитична Свешникова ( |
| Елена Олеговна Артеменко — научный сотрудник ЦТПФХФ РАН. Занимается исследованием реорганизации цитоскелета тромбоцитов при активации и механизмов, приводящих к формированию прокоагулянтных активированных тромбоцитов. |
| Михаил Александрович Пантелеев — доктор физико-математических наук, профессор, заведующий лабораторией молекулярных механизмов гемостаза ЦТПФХФ РАН. Лауреат премии им. Р. В. Хохлова (2002) и премии Европейской академии (2007). Область научных интересов — механизмы регуляции гемостаза и тромбоза, биохимия и биофизика свертывания крови, математическое моделирование биологических систем. |
Важнейшую роль тромбоцитов в живом организме открыл итальянский врач и патолог Джулио Биццоцеро, который в 1882 г. провел ряд блестящих экспериментов, имея в своем распоряжении лишь световой микроскоп. Сегодня у нас куда больше измерительных приборов и вычислительных машин, выполняющих сложнейшие математические расчеты, однако множество вопросов остаются открытыми. Известно, что тромбоциты играют ключевую роль в остановке кровотечения из раны (гемостазе) и опасном перекрывании здорового сосуда (тромбозе). Однако до сих пор неясно, как именно функционирует система гемостаза. Какие причины приводят к ее переключению с защиты организма на развитие угрожающих жизни патологий? Какова роль тромбоцитов в регуляции процессов гемостаза и тромбоза? Не знаем мы, и зачем тромбоциты устроены так сложно, и не представляем всю последовательность событий, обеспечивающих формирование тромба в месте повреждения, а экспериментальные данные приносят с собой новые загадки.
Строение
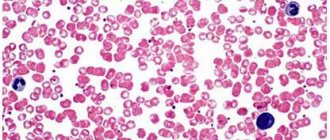
Рис. 1.
Микрофотография неактивированных тромбоцитов []
Тромбоциты (от греч. θρομβοζ — ‘сгусток’ и κυτοζ — ‘клетка’) — специализированные безъядерные клетки крови, имеющие форму диска диаметром около 3 мкм и толщиной около 0,5 мкм (рис. 1). Образуются они при фрагментации больших клеток костного мозга — мегакариоцитов и циркулируют в кровотоке в концентрации 200–400 тыс. клеток в 1 мкл крови. Живут тромбоциты в кровотоке в среднем 5–9 дней, а затем разрушаются в селезенке и печени.
Устроен тромбоцит довольно сложно. Снаружи он ограничен билипидным слоем мембраны, многочисленные впячивания которой (открытая канальцевая система) дают запас поверхности для изменения формы (рис. 2). Поддерживает ее и одновременно позволяет сильно менять цитоскелет (каркас) клетки. Внутри находятся эндоплазматический ретикулум (хранилище ионов кальция, необходимых для сигнализации и выполнения тромбоцитом своих функций) и митохондрии (органеллы, обеспечивающие дыхание). В цитозоле присутствуют гранулы, содержащие вещества, выплескивающиеся при активации клетки (переходе в новое состояние) во внеклеточное пространство. В плотных гранулах содержатся нуклеотиды (АТФ, АДФ, ГТФ, ГДФ), серотонин, ионы кальция в высокой концентрации, в α-гранулах — различные белки (в том числе факторы свертывания крови), а в лизосомах — некоторые ферменты (коллагеназа, эластаза и др.).
Рис. 2.
Схема строения тромбоцита []
После активации тромбоцита на внешней поверхности его мембраны появляется отрицательно заряженный липид — фосфатидилсерин. С ним с помощью ионов кальция связываются некоторые факторы свертывания, формируя специальные комплексы. Они во много раз ускоряют реакции, приводящие к желированию плазмы крови у места повреждения (этот процесс называется плазменным гемостазом). Иными словами, фосфатидилсерин обеспечивает прокоагулянтную, способствующую плазменному гемостазу, функцию тромбоцитов.
Почему же век этих клеток крови столь недолог (эритроциты, например, живут три-четыре месяца), ведь в норме, в отсутствие серьезных повреждений сосудов, они практически не работают? Почему они имеют вид дисков? Зачем тромбоциту митохондрии, если его энергетические расходы крайне скромны? Зачем природе понадобилось ускорять реакции плазменного свертывания на клеточных мембранах? Для чего α-гранулы содержат белки свертывания, которые есть и в плазме крови? Это только некоторые из вопросов, не имеющих пока четких ответов.
К чему приводит нарушение агрегации тромбоцитов
Если процесс агрегации нарушен, это может привести к негативным последствиям. Так, если активность бесцветных кровяных клеток повышена, то это может привести к инсульту, инфаркту. А если выработка тромбоцитов понижена, то это может приводить к большой потере крови: человек страдает частыми кровотечениями, которые долго не прекращаются, приводят к истощению и анемии.
Именно для того, чтобы предотвратить эти последствия, проводится анализ агрегации тромбоцитов. Показанием к прохождению анализа являются:
- Частые кровотечения (носовые, маточные)
- Плохо заживающие раны.
- Синяки, которые появляются от малейшего ушиба.
- Постоянная отечность.
Активация
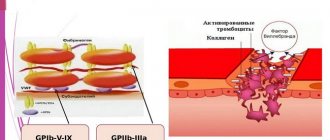
Для выполнения своей основной функции — заделывания повреждения в стенке сосуда — тромбоциты должны перейти в активное состояние. Как и у большинства клеток нашего организма, этот процесс протекает по следующей схеме: сигнал — рецептор — внутриклеточный сигнал — усилитель — регулятор — ответ (рис. 3). Сигналом к активации служит появление в кровотоке агониста — специальной сигнальной молекулы, которая должна появляться только при необходимости и связываться со специфической молекулой, пронизывающей мембрану тромбоцита (рецептором). Агонист взаимодействует с одним «хвостом» рецептора, выступающим снаружи, и это приводит к изменению другого, со стороны цитозоля, где появляется следующая сигнальная молекула — вторичный мессенджер. Он запускает синтез еще нескольких мессенджеров, те, в свою очередь, — еще нескольких, и так сигнал распространяется в цитозоле и усиливается с помощью каскада внутриклеточных реакций, что в конечном итоге приводит к комплексному ответу тромбоцита. Важно, что в тромбоците существуют специальные регуляторные системы, модулирующие концентрации внутриклеточных мессенджеров на разных этапах активации, чтобы, например, не было реакции на следовые количества агониста.
Рис. 3.
Схема активации тромбоцита
Как же эта схема реализуется в нашем организме? В сосудах тромбоциты выталкиваются эритроцитами из основного потока и движутся вдоль стенок, проводя своего рода мониторинг их состояния. Одним из первых сигналов к активации тромбоцитов становится коллаген — основной белок соединительной ткани, обнажающийся при повреждении сосуда. Обнаружив коллаген, они связываются с ним через специальные рецепторы, одновременно активируясь и прочно прикрепляясь к месту повреждения. Взаимодействие тромбоцита с коллагеном и ведет к запуску упомянутого внутриклеточного сигнального каскада и появлению в цитозоле вторичного мессенджера — инозитолтрифосфата (ИФ3). Эта маленькая водорастворимая молекула способна быстро передвигаться в цитозоле и служит сигналом к выходу ионов кальция из внутриклеточных хранилищ. А повышение его внутриклеточной концентрации может приводить к разнообразным ответам тромбоцита: выплескиванию содержимого гранул (секреции), изменению формы, прикреплению к стенке сосуда (адгезии), скреплению с другими тромбоцитами (агрегации), появлению прокоагулянтной активности (рис. 4). После того, как кровеносная система уже распознала повреждение сосуда, в крови появляются еще три природных активатора тромбоцита — тромбин, АДФ и тромбоксан A2. Белок тромбин образуется из предшественника, протромбина, в плазме крови, но массово — уже на мембранах активированных тромбоцитов. При секреции их плотных гранул выбрасывается большое количество АДФ (маленькая молекула, выполняющая в клетках в основном энергетические функции), и гораздо меньше АДФ высвобождается из поврежденных клеток эндотелия, выстилающего внутреннюю поверхность сосудов. Из арахидоновой кислоты, находящейся в мембранах активированных тромбоцитов, синтезируется тромбоксан А2. Связывание этих трех активаторов со своими рецепторами на мембране тромбоцита приводит, как и в случае с коллагеном, к появлению ИФ3 в цитозоле и повышению в нем концентрации кальция (рис. 4). Таким образом, все три растворимых активатора и коллаген действуют по одному пути, однако вызывают разные тромбоцитарные ответы. Например, тромбоксан А2 провоцирует выброс плотных гранул, а АДФ — нет. Активация отдельно коллагеном или тромбином вызывает все перечисленные ответы одновременно, а совместно — приводит к появлению группы прокоагулянтных тромбоцитов и синтезу тромбина на их мембранах. Видимо, существуют еще недостаточно изученные различия в сигнализации, запускаемой разными агонистами. Чтобы случайная активация не превращала тромбоцит в настоящую «бомбу», несущуюся в кровотоке и запускающую всю систему свертывания, в организме неповрежденные клетки эндотелия постоянно выделяют простациклин и оксид азота, которые блокируют активацию клеток, препятствуя повышению в них концентрации кальция.
Рис. 4.
Схема основных путей активации тромбоцита и его ответных реакций:
АДФ
— аденозиндифосфат,
ИФ3
— инозитолтрифосфат,
ЭПР
— эндоплазматический ретикулум
Сигнализация — один из самых сложных и плохо изученных разделов в исследовании тромбоцитов. По устройству каждого рецептора и сигнального пути существует множество вопросов, и самый простой из них: зачем вообще столько активаторов?
Выводы
Подгруппа больных с артериальной гипертонией, живущих в Китае, у которых имеется сниженное число тромбоцитов и повышенный уровень гомоцистеина в крови, характеризуется наиболее высоким риском развития инсульта, но такой риск снижается на 73% за счет применения ФК.
В случае подтверждения полученных данных сниженное число тромбоцитов и повышенный уровень гомоцистеина в крови могут служить биомаркерами для выявления лиц с высоким риском развития инсульта, у которых особенно эффективным может быть применение ФК.
Цитоскелет и изменение формы
Цитозоль тромбоцита пронизан трехмерной сетью из водонерастворимых белковых нитей (филаментов), которая формирует цитоскелет. Филаменты состоят из полимеризованного белка актина и обеспечивают изменение формы тромбоцита при активации. Кроме того, непосредственно под плазматической мембраной находится мембранный скелет, связанный с цитоплазматическими «хвостами» некоторых рецепторов. Состоит он из коротких актиновых филаментов, соединенных друг с другом с помощью специальных белков. Мембранный скелет не только поддерживает плазматическую мембрану, регулируя контуры клетки, и стабилизирует ее, предотвращая фрагментацию, но и регулирует распределение в плоскости мембраны рецепторов, прикрепленных к нему. Также предполагают, что он играет важную роль в регуляции различных внутриклеточных событий, которые запускаются при активации.
Рис. 5.
Сканирующие электронные микрофотографии процесса распластывания активированного тромбоцита (
а–г
) по поверхности []
Интересно, что цитоскелет — структура динамичная, благодаря которой тромбоцит может не только менять форму, но и отращивать «щупальца» (филоподии). С их помощью он распластывается по поверхности поврежденного сосуда (рис. 5) и легче прилепляется к другим тромбоцитам (рис. 6). Относительно недавно было обнаружено, что при сильной активации (одним тромбином или вместе с коллагеном) тромбоциты разделяются на две группы (субпопуляции), сильно отличающиеся по свойствам и даже форме, что предполагает принципиально разную организацию в них цитоскелета. Одни из них («обычные» активированные) имеют вид амеб — комков с филоподиями, другие (прокоагулянтные, так как на внешней поверхности их мембраны много фосфатидилсерина) — шариков без «щупалец». Полученные в нашей лаборатории данные свидетельствуют о том, что некоторые мембранные рецепторы, отвечающие за связывание клеток с поверхностью и друг с другом, у тромбоцитов из двух субпопуляций неодинаково прикреплены к цитоскелету. А это значит, что они могут по-разному взаимодействовать с поврежденной сосудистой стенкой и друг с другом в формирующемся тромбе.
Последовательность процессов при перестройке цитоскелета тромбоцита вообще изучена пока достаточно мало, а тут уже новый вопрос: зачем одним клеткам при активации становиться «амебами», а другим — «шариками»?
Расшифровка анализа на агрегацию тромбоцитов
В анализе на агрегацию тромбоцитов о хорошем кроветворении говорят показатели 25 – 75%. Это значит, что ткани и органы нормально снабжаются кислородом, и тромбы отсутствуют.
Норма тромбоцитов
| Возраст | Показатель, х 10^9/л |
| Новорождённый | 100–420 |
| Ребёнок до года | 160–320 |
| 1–4 года | 150–300 |
| 15–18 лет | 180–340 |
| Мужчины старше 18 лет | 180–400 |
| Женщины старше 18 лет | 150–380 |