Согласно классическим представлениям, ренин-ангиотензиновая система (РАС) играет ключевую роль в регуляции уровня АД и водно-электролитного баланса. Исследованиями последних десятилетий показано большое значение повышения активности РАС в формировании и прогрессировании артериальной гипертензии (АГ), сердечной недостаточности (СН), хронических заболеваний почек (ХЗП), системного атеросклероза [24, 52, 66]. Кроме того, РАС непосредственно участвует в процессах роста и дифференцировки тканей, модуляции процессов воспаления и апоптоза, а также потенциации синтеза и секреции целого ряда нейрогуморальных субстанций [39]. Основным кондуктором, обеспечивающим практически все известные эффекты РАС, является ангиотензин II. Последний реализует свои тонические влияния посредством стимуляции специфических рецепторов. Установлено, что активация АТ1- и АТ2-рецепторов приводит к противоположным результатам. АТ1-рецепторы обусловливают вазоконстрикторный эффект, стимулируют освобождение вазопрессина, альдостерона, эндотелина, норадреналина, кортикотропин-рилизинг-фактора. Физиологическая роль АТ3-, АТ4- и АТх-рецепторов продолжает изучаться.
В исследованиях in vitro и in vivo установлено, что ангиотензин II способствует накоплению коллагенового матрикса, продукции цитокинов, адгезивных молекул, активации внутриклеточной сигнальной системы (multiple intracellular signaling cascades) посредством стимуляции киназы митоген-активирующего протеина (mitogen-activated protein), киназы тирозина и различных факторов транскрипции [41].
Многочисленными исследованиями подтверждено участие активации РАС в процессах ремоделирования сердца. Так, большое значение придается участию ангиотензина II в процессах формирования патологической гипертрофии левого желудочка (ЛЖ), которая связана не только с увеличением массы миокарда, но и ассоциируется с качественными изменениями в кардиомиоците и накоплением внеклеточного коллагенового матрикса [1, 2]. Ангиотензин II непосредственно способствует повышению экспрессии генов фетального фенотипа [22], таких как гены тяжелых цепей β-миозина, скелетного α-актина, предсердного натрийуретического фактора. Увеличение экспрессии фетальных изоформ контрактильных протеинов приводит к повышению массы ЛЖ [27] с последующим снижением вначале релаксационной, а затем и тотальной насосной функции сердца [21]. Кроме того, ангиотензин II способствует экспрессии immediate-early или фетальных генов, таких как jun B, βgr-1, c-myc, c-fos, c-jun, ответственных за интенсивность внутриклеточного протеинсинтеза [5]. И хотя роль активации этих генов до конца не ясна, многие исследователи связывают повышение их экспрессии с нарушением внутриклеточного сигнального каскада и активизацией фетального типа обмена веществ [82].
Установлено, что ангиотензин II может играть центральную роль и в процессах ремоделирования артерий, интенсификации оксидантного стресса и апоптоза [81]. Кроме того, ангиотензин II может принимать участие в формировании и прогрессировании артериальной гипертензии [56, 63], сердечной недостаточности [75], атеросклеротического повреждения сосудов [7, 20], диабетической и недиабетической нефропатий [8], ангиопатий при сахарном диабете [8, 9], эклампсии беременных, болезни Альцгеймера и многих других заболеваниях [65, 68].
Необходимо отметить, что неблагоприятное влияние ангиотензина II в отношении прогрессирования кардиоваскулярных заболеваний осуществляется независимо от его вазопрессорного эффекта [6]. Вместе с тем участие большинства молекулярных и клеточных механизмов РАС в прогрессировании кардиоваскулярных заболеваний подтверждено в экспериментальных исследованиях, или in vitro. В этой связи клиническое и прогностическое значение многих из них еще придется установить [52, 53].
Таким образом, ангиотензин II представляется центральным звеном в сложном каскаде активации РАС, оказывающей негативное влияние на структурные и функциональные характеристики сердечно-сосудистой системы. Вместе с тем секреция ренина является первым и важнейшим этапом в повышении синтеза ангиотензина I, ангиотензина II и других продуктов каскада РАС в целом [57]. Причем реализация всех последующих эффектов РАС модулируется влиянием ренина на специфические рецепторы [36, 44]. Последние представлены не только в мезангиальной ткани почек, как это предполагалось ранее, но и в субэндотелии артерий, в том числе ренальных и коронарных [4]. Ренин обладает высокой аффинностью к формированию специфической связи с собственными рецепторами. Связанный с рецептором ренин индуцирует серию внутриклеточных процессов, результатом которых является повышение образования ангиотензина II [43]. Необходимо отметить, что описанный тип рецепторов обладает способностью связывать и проренин с последующей реализацией процессов активации синтеза ангиотензина II. В настоящее время установлено, что проренин является мощным предиктором возникновения микрососудистых осложнений при сахарном диабете, хотя механизм, лежащий в основе этого процесса, до конца не ясен [23]. В связи с этим ограничение активности компонентов РАС рассматривается как эффективный способ медикаментозного вмешательства при прогрессировании кардиоваскулярных заболеваний.
Необходимо отметить, что в последние годы фармакологический контроль за активностью РАС осуществлялся в направлении ограничения продукции ангиотензина II за счет ингибирования ангиотензинпревращающего фермента, блокады рецепторов ангиотензина II и альдостерона, а также благодаря ограничению секреции ренина, преимущественно путем использования бета-адреноблокаторов [11, 61, 74]. В то же время многочисленные исследования показали, что адекватное снижение активности РАС скорее постулируется, чем реально достигается. Установлено, что использование ингибиторов ангиотензинпревращающего фермента (ИАПФ) или антагонистов рецепторов ангиотензина (АРА) часто ассоциируется с активацией альтернативных путей активации РАС. Так, для ИАПФ это сопряжено с повышением активности тканевых химаз и протеаз, а также секреции ренина и альдостерона, а для АРА — с увеличением синтеза ангиотензина II и альдостерона без соответствующего увеличения пула эндогенного брадикинина [3, 45]. В клиническом смысле этот феномен проявляется в так называемом ускользании (escape phenomenon) антигипертензивного и органопротекторного эффектов блокаторов РАС при их длительном применении. К попыткам преодоления указанного феномена относятся использование комбинаций «ИАПФ + АРА», «ИАПФ + бета-адреноблокатор», «ИАПФ + спиронолактон (эплеренон)». Появление прямых ингибиторов ренина (ПИР), способствующих снижению секреции последнего и ограничивающих интенсивность продукции ангиотензина II, стало рассматриваться как возможный способ достижения более полного контроля за активностью РАС и преодоления escape phenomenon [10].
Кирены — новый класс антигипертензивных лекарственных средств
Первые ПИР (эналкирен, ремикирен, занкирен) были синтезированы в середине 70-х годов прошлого столетия [30], а клинические результаты, касающиеся их использования у здоровых волонтеров и пациентов с АГ, стали доступны с конца 80-х годов [54]. Вместе с тем исследователи столкнулись с рядом трудностей, преимущественно связанных с чрезвычайно низкой биодоступностью ПИР в желудочно-кишечном тракте (менее 2), коротким периодом полужизни и низкой стабильностью компонентов в таблетированной форме, что существенным образом ограничивало потенциальный терапевтический потенциал киренов вообще [50, 59]. В связи с этим в течение достаточно длительного времени кирены не рассматривались как перспективный класс антигипертензивных лекарственных средств, тем более что 90-е годы прошлого столетия являлись периодом расцвета ИАПФ, а конец тысячелетия — АРА. Первый успех к киренам пришел только после синтеза CGP 60536 — непептидного низкомолекулярного ингибитора ренина, пригодного для приема внутрь, получившего название алискирена [78]. К настоящему времени препарат прошел все этапы клинических испытаний и с апреля 2007 года рекомендован для лечения АГ в США и странах Евросоюза [78].
Ежегодно в мире отмечается более 15 млн новых случаев инфаркта миокарда (ИМ). Отдаленные последствия ИМ сказываются спустя многие месяцы и годы. По данным Американской ассоциации сердца (2004), в течение 6 лет после ИМ, несмотря на оптимальное лечение, 18 % мужчин и 35 % женщин переносят повторный ИМ, 7 % мужчин и 6 % женщин внезапно умирают, 22 % мужчин и 46 % женщин становятся инвалидами из-за развития тяжелой сердечной недостаточности, а у 30–40 % больных появляется дисфункция левого желудочка (ЛЖ).
Активация циркулирующих и локальных (миокардиальных) нейрогуморальных систем играет важную роль в патогенезе ИМ и его осложнений. В ранние сроки ИМ повышенный выброс нейрогуморальных вазоконстрикторов (прежде всего катехоламинов, ангиотензина II [АII] и эндотелина) способствует развитию коронароспазма, приводя к расширению зоны инфаркта, возникновению острой сердечной недостаточности (ОСН) и жизнеугрожающих нарушений ритма сердца. Нейрогуморальная активация при ИМ первоначально носит компенсаторный характер для поддержания адекватной насосной функции сердца в ответ на гемодинамическую перегрузку и уменьшение массы функционирующего миокарда, однако в последующем может приобретать дезадаптивный характер. Сохраняющаяся длительное время повышенная активность нейрогуморальных систем приводит к развитию ремоделирования ЛЖ, проявляющегося аномальной ригидностью миокарда, снижением коронарного резерва, нарушением диастолической и систолической функций ЛЖ, дилатацией его полости и появлением симптомов хронической сердечной недостаточности (ХСН). Большинство нейрогуморальных сдвигов опосредуется в виде вазоконстрикторных и вазодилататорных реакций. Первые реализуются через симпато-адреналовую (САС), ренин-ангиотензин-альдостероновую системы (РААС), вазопрессин, антидиуретический гормон (АДГ), серотонин, эндотелин, тромбоксан А2; вторые – через калликреин-кининовую систему, систему натрийуретических пептидов (НУП), простагландины I2 и Е2, эндотелий-зависимый расслабляющий фактор, адреномедуллин и др.
Коррекция активности нейрогуморальных систем у больных в ранние и отдаленные сроки ИМ является одним из основных направлений лечения заболевания и профилактики его осложнений. В настоящее время с этой целью применяются блокаторы β-адренергических и ангиотензиновых рецепторов, ингибиторы ангиотензинпревращающего фермента (ИАПФ) и антагонисты альдостерона. На разных стадиях клинических испытаний также находится несколько новых групп препаратов (ингибиторы ренина, блокаторы вазопептидаз, НУП, антагонисты вазопрессиновых и эндотелиновых рецепторов).
Бета-адреноблокаторы (БАБ)
БАБ снижают потребность миокарда в кислороде, улучшают коронарный кровоток, способствуя уменьшению ишемии и ограничению размеров зоны некроза. По результатам мета-анализа 22 рандомизированных исследований, включивших более 25 тыс. пациентов (H. Dargie, 2001), выявлено, что длительный прием БАБ приводил к снижению общей смертности на 23 %, внезапной смерти на 26 %, количества повторных ИМ на 41 %, случаев фибрилляции/трепетания предсердий на 59 % и тяжелых желудочковых нарушений ритма сердца на 70 %.
В ранние сроки ИМ более детально изучены атенолол и метопролол, при длительном применении – карведилол, метопролол и пропранолол. Предпочтение отдается селективным БАБ, однако есть основания считать, что благоприятное действие при ИМ свойственно всем препаратам этого класса, кроме обладающих внутренней симпатомиметической активностью [1].
Учитывая результаты исследования COMMIT/CCS-2, Американская коллегия кардиологов не рекомендует внутривенное введение БАБ больным ИМ, кроме случаев, когда требуется контроль артериального давления (АД) [2]. Европейские (ESC) и российские эксперты предлагают более широкое применение внутривенных БАБ у больных с тахикардией, артериальной гипертензией (АГ) и в случаях рецидивирования болевого синдрома [1, 3]. Специалисты сходятся во мнении, что пероральный прием БАБ в отсутствие противопоказаний необходимо начинать всем пациентам с первых суток ИМ и продолжать неопределенно долго, прекращая лечение лишь при возникновении серьезных побочных эффектов.
Наибольший эффект от приема β-блокаторов отмечается у больных со сниженной сократительной функцией ЛЖ, а также при наличии электрической нестабильности миокарда. Назначение β-блокаторов противопоказано при развитии кардиогенного шока, тяжелой обструктивной болезни легких в стадии обострения, аллергических реакциях. При наличии относительных противопоказаний, таких, например, как сахарный диабет, и обструктивных заболеваний легких вне обострения, а также у больных с выраженным нарушением сократимости ЛЖ лечение β-блокаторами следует проводить очень осторожно, начиная с минимальных доз.
Ингибиторы АПФ
ИАПФ тормозят превращение ангиотензина I в мощный вазоконстриктор АII, уменьшают выброс норадреналина из окончаний нейронов и секрецию АДГ, а также альдостерона; увеличивают образование брадикинина и уровень циркулирующих НУП, оказывают разнообразные гемодинамические эффекты: уменьшают сосудистое сопротивление и нормализуют диастолическое наполнение ЛЖ за счет регресса его гипертрофии. ИАПФ уменьшают агрегацию тромбоцитов, положительно влияют на реологические свойства крови и дисфункцию эндотелия, обладают противовоспалительным, антиаритмическим, антиишемическим и антиангинальным эффектами.
Большое практическое значение ИАПФ имеют в терапии ОСН, а также как средство профилактики ХСН у больных, перенесших ИМ. Раннему назначению ИАПФ (с первых суток ИМ) были посвящены исследования CONSENSUS II, CATS, SMILE, GISSI-3, ISIS-4, PRACTICAL, CCS-I и FAMIS.
Исследование CONSENSUS II, в котором изучалось применение эналаприла внутривенно, а затем и перорально с первых суток ИМ, было досрочно остановлено из-за недостоверного увеличения смертности на 9 % в основной группе за счет более частого развития артериальной гипотонии. Однако у больных крупноочаговым ИМ эналаприл уменьшал процессы ремоделирования ЛЖ, улучшал прогноз жизни и достоверно снижал частоту осложнений [4].
В исследовании ISIS-4 через 5 недель лечения в группе каптоприла отмечено достоверное снижение смертности на 7 % – преимущественно у пациентов с передней локализацией ИМ и старше 70 лет [5].
В исследовании SMILE у пациентов с передним ИМ без предшествующей тромболитической терапии (ТЛТ), получавших зофеноприл, через 6 недель лечения отмечено недостоверное снижение общей смертности на 25 %, смертности от СН на 31 %, внезапной смерти – на 63 %. Риск развития тяжелой ХСН достоверно снижался на 46 %. Через год наблюдения достоверное снижение общей смертности составило 29 %. Наибольшая эффективность лечения отмечена при повторных ИМ, а также у больных АГ и сахарным диабетом [6].
В исследовании GISSI-3 смертность в группе больных ИМ, получавших лизиноприл, через 6 недель была достоверно ниже на 11 % [7]. Эффективность раннего назначения лизиноприла подтверждена и у больных ИМ после ТЛТ [8].
Раннее добавление фозиноприла к терапии больным с передним ИМ, прошедшим ТЛТ, приводило к достоверному снижению смертности и частоты развития тяжелой СН на 36 %, причем улучшение прогноза не зависело от влияния на ремоделирование ЛЖ [9].
Позднее назначение ИАПФ (с третьих суток ИМ) изучалось в исследованиях SAVE, TRACE, AIRE и PREAMI. В исследовании SAVE больным с бессимптомной дисфункцией ЛЖ назначался каптоприл в возрастающей дозировке. Выявлено достоверное снижение смертности на 21 %, риска развития тяжелой ХСН на 37, повторного ИМ на 25 % [10].
При назначении рамиприла, начиная с 3–10-х суток заболевания, у больных с признаками СН в остром периоде ИМ выявлено достоверное снижение смертности на 27 %, при этом больший эффект отмечен у больных старше 65 лет и с сопутствующей АГ [11]. В аналогичной работе отечественных авторов также выявлено положительное влияние терапии рамиприлом на показатели гемодинамики и сократительной функции ЛЖ у больных ИМ, осложненным СН [12].
В исследовании PREAMI была продемонстрирована эффективность периндоприла в уменьшении процессов ремоделирования ЛЖ и снижении частоты развития ХСН у пожилых больных, перенесших ИМ [13].
Ряд исследований был посвящен сравнению эффективности ИАПФ между собой у больных ИМ. В исследовании PRACTICAL отмечена большая эффективность эналаприла по сравнению с каптоприлом по влиянию на смертность и показатели глобальной сократимости миокарда ЛЖ через 3 месяца лечения [14]. В работе Н.Б. Сидоренковой и соавт. (1999) выявлена более выраженная по сравнению с эналаприлом антиангинальная и антиаритмическая активность фозиноприла при раннем назначении больным передним ИМ [15].
Мета-анализ крупных исследований показал, что назначение ИАПФ приводит к снижению риска смерти после инфаркта на 26 %, повторного ИМ на 20 %, госпитализаций по поводу ХСН на 27 %.
В настоящее время необходимость применения ИАПФ начиная с первых суток у больных ИМ не подвергается сомнению. Тем не менее нет единого мнения: назначать ли ИАПФ всем больным или только высокого риска? Так, Американская ассоциация сердца рекомендует назначение ИАПФ всем пациентам в отсутствие гипотонии с последующим определением через 6 недель необходимости продолжения терапии. По рекомендациям ESC (2008) ИАПФ необходимо назначать только больным с фракцией выброса (ФВ) ЛЖ < 40 % или признаками СН, а их длительный прием не является обязательным для больных, перенесших ИМ без АГ, признаков СН и с сохранной систолической функцией ЛЖ. Эксперты ВНОК подчеркивают, что ИАПФ особенно эффективны у больных с обширным некрозом миокарда, сниженной ФВ ЛЖ (< 40 %), симптомами СН, сахарным диабетом. Вместе с тем они улучшают прогноз и у больных без клинически значимого снижения ФВ. Лечение ИАПФ следует начинать как можно раньше, при стабилизации гемодинамики и в отсутствие противопоказаний продолжать неопределенно долго.
Блокаторы ангиотензиновых рецепторов (БАР)
Несмотря на высокую эффективность ИАПФ у больных ИМ, эти препараты могут вызывать такие побочные явления, как сухой кашель, ангионевротический отек, головная боль, что делает невозможным их прием 10–20 % больных, а также артериальную гипотензию, способствующую дальнейшему ухудшению коронарной перфузии. ИАПФ нарушают деградацию брадикинина, стимулируют синтез простагландинов и оксида азота, но их влияние на РААС весьма нестабильно. Они нарушают действие АII на все типы ангиотензиновых рецепторов: и те, которые определяют негативные реакции (AT1), и те, которые опосредуют потенциально выгодные органопротективные эффекты (АТ2). Еще одним фактором, лимитирующим действие ИАПФ, является существование локальных “неАПФ-зависимых” путей образования АII. В связи с этим применение препаратов, блокирующих РААС на рецепторном уровне, представляется более оправданным. БАР обладают меньшим количеством побочных эффектов по сравнению с ИАПФ (в частности, не обладают эффектом “первой дозы”), вызывают менее выраженную гиперренинемию, снижают уровень альдостерона в крови и способны вызывать регресс гипертрофии ЛЖ. Они повышают фибринолитическую активность крови, благоприятно влияют на дисфункцию эндотелия [16] и замедляют процессы ремоделирования ЛЖ [17].
Сравнительные исследования ИАПФ и БАР при ХСН дали противоречивые результаты. В исследовании ELITE было выявлено достоверное снижение риска смерти (особенно внезапной) у больных ХСН, принимавших лозартан, по сравнению с каптоприлом [18]. Однако исследование ELITE II, в котором сравнивались те же препараты, не подтвердило преимуществ БАР перед ИАПФ по влиянию на прогноз больных ХСН [19]. Целесообразность комбинированной терапии ИАПФ и БАР у больных ХСН изучена в ряде исследований. Одновременное начало лечения этими препаратами значительно увеличивало число побочных эффектов без дополнительного влияния на заболеваемость и смертность, однако добавление БАР (кандесартана или валсартана) к терапии у больных, уже принимавших ИАПФ, приводило к достоверному снижению смертности и частоты госпитализаций по поводу прогрессирования ХСН на 13–15 % [20, 21].
Первые данные о применении БАР у больных ИМ подтвердили гипотезу об их позитивном влиянии на клинико-гемодинамические показатели, сопоставимом с эффектами ИАПФ, при меньшем количестве побочных явлений [22, 23]. А.Н. Пархоменко и соавт. (2000) выявили безопасность совместного применения ирбесартана и каптоприла начиная с первых суток ИМ, при этом отмечены более выраженный, чем при самостоятельном применении каптоприла, гемодинамический эффект и сопоставимое влияние на размер некроза, а также процессы раннего ремоделирования сердца [24]. Аналогичные результаты были получены при совместном назначении эналалрила и лозартана [35].
Первым крупным исследованием, в котором изучались эффективность и безопасность применения БАР (лозартана) в сравнении с ИАПФ (каптоприлом) у больных ИМ с клиническими проявлениями ОСН, стало исследование OPTIMAAL (n = 5477, средний срок наблюдения – 2,7 года). Уровень общей смертности в группе лозартана был незначительно выше (18 против 16 %), но сердечно-сосудистая смертность отмечалась достоверно чаще. Не было выявлено значимых различий в способности препаратов предотвращать внезапную смерть и ухудшение течения СН. Количество побочных эффектов и частота отмены препаратов были меньше в группе лозартана [26]. Возможно, полученные результаты были следствием недостаточной дозы лозартана (50 мг/сут) или неадекватной схемы титрования препарата.
В исследовании VALIANT (n = 14703) оценивалась эффективность валсартана по сравнению с каптоприлом и их комбинацией у больных ИМ, осложненным ОСН и/или систолической дисфункцией ЛЖ. После 36 месяцев наблюдения не было отмечено значимых различий смертности во всех трех группах, не было различий и в сердечно-сосудистой смертности, риске повторного ИМ или появления ХСН. Побочные эффекты встречались реже при приеме валсартана, чем каптоприла, но при комбинации препаратов частота побочных эффектов была существенно выше. Результаты исследования доказали, что валсартан может быть альтернативой ИАПФ у больных ИМ, но гипотеза преимущества более полной блокады РААС при сочетании ИАПФ и БАР не подтвердилась [27]. Согласно европейским и российским рекомендациям, ИАПФ и БАР могут применяться у больных, перенесших ИМ на альтернативной основе, в зависимости от переносимости и некоторых других соображений, включая экономические. Опыт длительного применения БАР после ИМ значительно меньше, поэтому к назначению БАР следует прибегать в случаях непереносимости ИАПФ при ФВ ≤ 40 % и/или СН и наличии АГ.
Антагонисты альдостерона
Положительное влияние антагонистов альдостерона на течение отдаленного периода ИМ было выявлено в исследовании EPHESUS, в котором участвовали 6632 больных ИМ, осложненным развитием ОСН или дисфункции ЛЖ [28]. Пациентам основной группы дополнительно к стандартной терапии назначали селективный блокатор альдостерона эплеренон. Через 16 месяцев отмечено достоверное снижение общей смертности (14,4 % по сравнению с 16,7 % в контрольной группе) и частоты госпитализаций по сердечно-сосудистым причинам. Снижение смертности было обусловлено уменьшением частоты внезапной смерти. Наибольший эффект от терапии эплереноном отмечен при его раннем назначении (на 3–7-е сутки ИМ [29].
D. Fraccarollo и соавт. (2005) в эксперименте выявили преимущество совместного назначения эплеренона и БАР ирбесартана по влиянию на процессы постинфарктного ремоделирования ЛЖ [30].
Применение неселективного антагониста альдостерона спиронолактона при ИМ изучалось только в небольших работах. По данным M. Hayashi и соавт. (2003), раннее назначение спиронолактона больным с первичным передним ИМ позволяет предотвращать ремоделирование ЛЖ за счет подавления активности синтеза миокардиального коллагена [31]. Длительная комбинированная терапия спиронолактоном и БАР (лозартаном) у больных ИМ после успешной ТЛТ замедляла прогрессирование ХСН и снижала летальность по сравнению с монотерапией лозартаном [32].
По рекомендациям ВНОК и ESC назначение антагонистов альдостерона показано больным, перенесшим ИМ, с ФВ < 40 % в сочетании с симптомами СН или страдающим сахарным диабетом. Обязательным условием для начала лечения являются уровень креатинина в крови: у мужчин – < 220 мкмоль/л, у женщин – < 177 мкмоль/л, а также концентрация калия не более 5 ммоль/л.
Прямые ингибиторы ренина
Первые ингибиторы ренина (эналкирен, ремикирен, занкирен) были синтезированы еще в середине 1970-х гг., однако их клиническое применение лимитировалось низкой биодоступностью в желудочно-кишечном тракте, коротким периодом полужизни и низкой стабильностью компонентов в таблетированной форме [33]. Первый успех к киренам пришел после синтеза алискирена – непептидного низкомолекулярного ингибитора ренина. В 2007 г. алискирен был рекомендован для лечения АГ в США и Европе, а год спустя появились сведения об эффективности его применения у больных ХСН [34].
В 2010 г. были представлены результаты двух исследований, посвященных применению алискирена у больных ОКС. В исследование ASPIRE были включены 820 пациентов, перенесших ИМ в предшествующие 2–6 недель, с признаками дисфункции ЛЖ (ФВ < 45 % и зона акинезии > 20 %). Больные были распределены в две группы: в одной из них пациенты получали алискирен, в другой – плацебо на фоне оптимальной стандартной терапии, включившей статины, БАБ, дезагреганты и ИАПФ. Достоверных изменений показателей, отражающих структуру и функцию ЛЖ, в группе алискирена по сравнению с плацебо через 36 недель лечения не отмечено [35]. В исследовании AVANT GARDE-TIMI 43 (n = 1101) изучалась необходимость раннего блокирования РААС для снижения гемодинамической нагрузки у больных ОКС с сохраненной функцией ЛЖ. Больным в дополнение к стандартной терапии назначались валсартан, алискирен, их комбинация или плацебо. Преимуществ блокирования РААС по снижению уровня мозгового НУП валсартаном, алискиреном или их комбинацией по сравнению с плацебо выявлено не было [36]. Таким образом, результаты исследований ASPIRE и AVANT GARDE-TIMI 43 ставят под сомнение перспективы применения прямых ингибиторов ренина у больных после ИМ.
Ингибиторы вазопептидаз
Блокада нейтральной эндопептидазы (НЭП) способствует увеличению продолжительности жизни НУП за счет уменьшения их деградации. Ингибирование вазопептидаз является привлекательным подходом к лечению СН. На стадии клинических исследований находится несколько препаратов, одновременно блокирующих НЭП и АПФ. Одновременное ингибирование АПФ и НЭП усиливает натрийуретическое и вазодилатирующее действия НУП, подавляет образование АII и увеличивает период полураспада других сосудорасширяющих пептидов, включая брадикинин и адреномедуллин. Доклинические и первые клинические исследования препаратов показали их высокую эффективность для лечения ХСН: уменьшалось ремоделирование сосудов и гипертрофия миокарда, развивалось натрийуретическое, диуретическое и антипрофилеративное действия [37].
Наиболее изученным ИАПФ/НЭП является омапатрилат. Результаты ранних клинических исследований продемонстрировали высокую эффективность препарата у пациентов с ХСН и АГ, однако позднее проведенные исследования показали, что омапатрилат не имеет преимуществ перед ИАПФ эналаприлом при лечении пациентов как с ХСН, так и АГ [38].
При этом частота развития ангионевротического отека при лечении омапатрилатом была значительно выше, что является серьезным препятствием для его внедрения в широкую медицинскую практику. На экспериментальных моделях ИМ омапатрилат превосходил ИАПФ, однако применение ингибиторов вазопептидаз в клинических условиях у больных ИМ изучено недостаточно.
Антагонисты эндотелиновых рецепторов
Блокада эндотелиновых рецепторов может быть одним из новых путей лечения СН, в т. ч. у больных, перенесших ИМ. Выделяют неселективные антагонисты ЕТА- и ЕТВ-рецепторов (босентан, энрасентан и тезосентан натрий) и селективные антагонисты ЕТА-рецепторов (амбрисентан, атрасентан, дарусентан и ситаксентан). Наиболее обнадеживающими являются результаты применения препаратов этой группы для лечения легочной гипертензии.
Применение антагонистов эндотелиновых рецепторов при ИМ изучено только в экспериментальных работах. Предпосылкой к их использованию у больных ИМ может послужить исследование G. Niccoli и соавт. (2006), обнаруживших, что высокий уровень эндотелина-1 связан с возникновением феномена no-reflow при чрескожной реваскуляризации миокарда у пациентов с первичным ИМ. Эти данные позволяют предположить, что применение антагонистов эндотелина-1 может оказаться эффективным в лечении и предупреждении феномена no-reflow при экстренных и отсроченных эндоваскулярных вмешательствах [39].
Натрийуретические пептиды
Препарат несиритид структурно идентичен эндогенному мозговому НУП человека, продуцируется Е. coli при использовании рекомбинантной ДНК-технологии. В 2001 г. несиритид был одобрен FDA для лечения ОСН и рекомендован в качестве терапии первой линии у больных с остродекомпенсированной СН. В 2005 г. мета-анализ нескольких крупных исследований по применению несиритида при декомпенсации ХСН, проведенный Sackner-Bernstein и соавт., показал, что препарат может увеличивать краткосрочный риск смерти и ухудшать функцию почек, однако эти данные в последующем не подтвердились. Тем не менее роль несиритида в лечении СН по-прежнему нуждается в уточнении.
Не меньший практический интерес представляет применение НУП у больных ИМ. По данным H.H. Chen и соавт. (2009), инфузия низких доз несиритида в течение 72 часов у пациентов с передним ИМ подавляет секрецию альдостерона, предохраняет структуру и функцию ЛЖ с увеличением его ФВ и уменьшением конечно-диастолического объема (КДО) через месяц [40].
R.J. Hillock и соавт. (2008) показали, что назначение пациентам с ИМ несиритида индуцирует повышение уровней кардиопротективных биомаркеров и благоприятное ремоделирование ЛЖ. У пациентов, получивших несиритид, КДО не повысилось и наблюдалось снижение конечно-систолического объема ЛЖ по данным ЭхоКГ, кроме того, отмечено повышение уровня НУП и циклического ГМФ [41].
M. Kitakaze и соавт. (2007) выявили, что добавление к реперфузионной терапии при ИМ человеческого предсердного НУП (72-часовая инфузия ПНУП после чрескожного коронарного вмешательства) привело к уменьшению зоны инфаркта на 14,7 % и достоверному повышению ФВ ЛЖ через 6–12 месяцев по сравнению с группой плацебо, но при этом значительно чаще развивалась артериальная гипотония [42].
Предварительные данные показывают эффективность применения НУП у больных ИМ, однако только проведение более масштабных исследований позволит определить их место в лечении ИМ и его осложнений.
Антагонисты рецепторов вазо-прессина
Антагонисты вазопрессиновых рецепторов уменьшают вазоконстрикцию и способствуют акварезу, не оказывая негативного влияния на электролитный баланс. Выделяют неселективные антагонисты V1А/V2-рецепторов (кониваптан) и селективные антагонисты V1A-(релковаптан), V1B(неливаптан) и V2-рецепторов (толваптан, сатаваптан, мозаваптан и ликсиваптан). Применение кониваптана и толваптана одобрено в США и Европе для коррекции гипонатриемии, в т. ч. у больных ХСН. Добавление толваптана к стандартной терапии больным с остродекомпенсированной СН улучшает клинические проявления заболевания, но не влияет на смертность и основные сердечно-сосудистые осложнения [43]. Опыт применение препаратов данной группы при ИМ ограничен экспериментальными данными.
Таким образом, к настоящему времени разработано несколько методов фармакологической коррекции активности нейрогуморальных систем у больных ИМ. Наиболее перспективными из исследуемых новых препаратов представляются натрийуретические пептиды, возможности клинического применения которых требуют изучения в крупных исследованиях.
Фармакокинетические и фармакодинамические эффекты алискирена
Алискирен обладает благоприятными физико-химическими свойствами, включая высокую растворимость (> 350 мг/мл при pH = 7,4) и гидрофильность, что существенно улучшает биодоступность препарата [79]. В экспериметальных условиях было установлено, что после приема первой дозы пик плазменной концентрации достигается через 1–2 часа, биодоступность находится в пределах 16,3 %, а период полужизни составляет 2,3 часа [79]. У здоровых волонтеров фармакокинетические качества препарата оценивались в диапазоне доз от 40 до 1800 мг/сут. [4]. Оказалось, что плазменная концентрация алискирена прогрессивно возрастает после приема ранжированных доз 40–640 мг/сут, достигая максимума через 3–6 ч. Средний период полужизни составляет 23,7 часа. Причем стабильность плазменного содержания алискирена наблюдается через 5–8 дней постоянного приема [45]. Кроме того, исследователи отметили способность препарата к умеренной кумуляции при использовании в высоких дозах, а также наличие прямой зависимости уровня биодоступности от приема пищи [4]. Необходимо отметить, что фармакокинетические характеристики алискирена не зависят от гликемии натощак и плазменной концентрации гликозилированного гемоглобина [81]. Кроме того, препарат имеет сопоставимый кинетический профиль у представителей различных рас и этнических групп [69]. Алискирен умеренно связывается с протеинами плазмы крови, причем интенсивность этого взаимодействия не зависит от его плазменной концентрации [4]. Элиминация препарата осуществляется в неизмененном виде преимущественно с желчью, экскреция с мочой составляет менее 1 % [16]. Особенностями препарата являются низкая конкурентность с другими лекарственными средствами за связь с белками плазмы крови и отсутствие необходимости в деградации на цитохромах системы Р450. Алискирен в широком диапазоне доз не оказывает клинически значимого влияния на метаболизм варфарина, ловастатина, атенолола, целекоксиба, циметидина и дигоксина [17–19]. Кроме того, препарат в суточной дозе 300 мг внутрь не изменяет фармакокинетический профиль других антигипертензивных лекарственных средств, таких как рамиприл (10 мг/сут), амлодипин (10 мг/сут), валсартан (320 мг/сут), гидрохлортиазид (25 мг/сут) [70].
Алискирен представляет собой высокоселективный непептидный ингибитор синтеза ренина, превосходящий в этом отношении других представителей этого класса [37, 40, 50]. Препарат не оказывает дополнительного ингибирующего влияния на другие аспартатные пептидазы, такие как катепсин D и пепсин, ни в экспериментальных, ни в клинических условиях [79]. Причем алискирен приводит к значительной блокаде секреции ренина даже в относительно низких дозах и при ограниченной биодоступности [25, 26].
Ранние исследования первой и второй фазы показали, что препарат способствует эффективной блокаде РАС и дозозависимому снижению уровня системного АД [45]. Так, у здоровых волонтеров препарат при однократном приеме по сравнению с плацебо приводит почти к 80 % редукции исходной концентрации ангиотензина II, хотя содержание ренина в плазме при этом снижается более чем в десять раз. Увеличение времени наблюдения с одного до восьми дней при продолжении постоянного приема алискирена способствовало сохранению глубокой блокады РАС за счет редукции плазменного пула ангиотензина II на 75 % от исходного уровня. В дозе 160 мг/сут алискирен оказывает такое же депрессирующее влияние на плазменную концентрацию ангиотензина II, как и ИАПФ эналаприл в дозе 20 мг/сут. Кроме того, в дозе более 80 мг/сут препарат способствует существенному регрессу плазменного содержания альдостерона (Nussberger et al., 2002).
В когорте пациентов с АГ на протяжении четырех недель терапии алискирен в дозе 75 мг/сут приводил к редукции плазменной активности ренина (ПАР) на 34 ± 7 % от исходного уровня, после повышения дозы до 150 мг/сут препарат способствовал снижению ПАР на 27 ± 6 % к исходу восьмой недели постоянного приема [78]. Необходимо отметить, что первоначальное значительное снижение активности ренина плазмы крови сопровождается постепенным его повышением, не достигающим исходного уровня. Важно, что этот феномен не сопровождается потерей антигипертензивного эффекта препарата [45, 78]. Тем не менее возможность реализации феномена «ускользания» секреции ренина из-под влияния алискирена привела к необходимости продолжения исследований в направлении оценки перспектив эффективности комбинации ПИР и АРА, также способных редуцировать активность ренина плазмы. Так, в небольшом пилотном перекрестном исследовании было установлено, что алискирен в дозе 300 мг/сут превосходит валсартан в дозе 160 мг/сут в отношении редукции активности ренина плазмы крови. Вместе с тем комбинация алискирена и валсартана в половинных суточных дозах оказалась предпочтительней по сравнению с изолированным использованием каждого из препаратов по способности блокировать активность РАС. Это выразилось в более глубоком снижении не только ПАР, но и уровней ангиотензина II и ангиотензина II. Исследователи пришли к заключению о синергичности влияния обоих препаратов на активность РАС [3]. Аналогичные данные были получены O’Brien et al. (2007) при применении алискирена (150 мг/сут) в комбинации с гидрохлортиазидом, рамиприлом или ирбесартаном у пациентов с мягкой и умеренной АГ [46]. Оказалось, что алискирен способствовал достоверной редукции ПАР на 65 % (p <� 0,0001) от исходного уровня, тогда как рамиприл и ирбесартан в монотерапии приводили к 90% и 175% снижению ПАР соответственно. Добавление алискирена к антигипертензивным лекарственным средствам не отражалось на дополнительном снижении ПАР, но приводило к достижению более эффективного контроля за величиной офисного АД и суточным профилем АД [46].
Таким образом, алискирен способен осуществлять достаточно серьезную блокаду РАС, что сопровождается ожидаемыми клиническими эффектами в виде редукции сосудистого тонуса и снижения системного АД. Однако препарат не лишен и принципиально негативных качеств, связанных прежде всего с реализацией феномена «ускользания» ПАР, что в принципе характерно для всех лекарственных средств, опосредующих свой фармакодинамический эффект путем хронической блокады РАС [31]. Установлено, что теоретические опасения, касающиеся снижения эффективности алискирена вследствие восстановления секреции ренина или наличие синдрома отмены после внезапного отказа от лечения, не подтверждаются клиническими наблюдениями [28, 55].
НА ПОДСТУПАХ К РЕНИНУ: 110 ЛЕТ ПОИСКА
Пожалуй, сегодня нет более распространённой хронической болезни, чем гипертония (повышенное артериальное давление). Даже медленное и как бы незаметное её течение в конце концов приводит к фатальным последствиям — инфарктам, инсультам, сердечной недостаточности, поражению почек. Ещё в позапрошлом веке учёные выяснили, что в почках вырабатывается белок — ренин, вызывающий повышение давления крови в сосудах. Но лишь спустя 110 лет совместными усилиями биохимиков и фармакологов удалось найти эффективное средство, способное противостоять опасному действию давно известного вещества.
Наука и жизнь // Иллюстрации
Рис. 1. Клетки печени постоянно выбрасывают в кровоток длинный пептид ангиотензиноген.
Рис. 2. Сердечно-сосудистый континуум: путь от гипертонии до поражения сердца, сосудов, почек и других органов.
Рис. 3. Прямой ингибитор ренина (ПИР) встраивается в активный центр ренина и не даёт ему расщепить ангиотензиноген.
‹
›
В начале 1990-х годов в России стало расти число сердечно-сосудистых больных. И до сих пор в нашей стране уровень смертности среди трудоспособного населения превышает европейские показатели. Особенно неустойчивыми к социальным катаклизмам оказались представители мужской половины населения. По данным Всемирной организации здравоохранения, продолжительность жизни мужчин составляет в нашей стране всего лишь 59 лет. Женщины оказались выносливее — они живут в среднем 72 года. Каждый второй гражданин нашей страны умирает от сердечно-сосудистых заболеваний и их последствий — инфарктов, инсультов, сердечной недостаточности и пр.
Одна из главных причин сердечно-сосудистых заболеваний — атеросклеротическое поражение сосудов. При атеросклерозе утолщается внутренняя оболочка сосуда, образуются так называемые бляшки, которые суживают или полностью закупоривают просвет артерии, что нарушает кровоснабжение жизненно важных органов. Основная причина атеросклеротического поражения сосудов — нарушение жирового обмена, в основном повышение содержания холестерина.
Другая, не менее важная и наиболее распространённая причина сердечно-сосудистых заболеваний — гипертоническая болезнь, которая проявляется устойчивым повышением артериального давления. Повышение артериального давления также приводит к поражению сосудов. А именно, просвет сосуда суживается, его стенка утолщается (развивается гипертрофия мышечного слоя), нарушается целостность внутренней выстилки сосуда — эндотелия. Такие изменения называются ремоделированием сосудов. Всё это приводит к тому, что поражённый атеросклерозом сосуд теряет эластичность, перестаёт пульсировать под действием кровотока. Если здоровые сосуды можно сравнить с гибкими каучуковыми трубками, передающими пульсовую волну и гасящими турбулентность кровотока, то патологические сосуды похожи на металлический трубопровод. Ремоделирование сосудов способствует прогрессированию атеросклероза.
Гипертония как причина инфарктов и инсультов
Гипертония зачастую протекает как бы незаметно. Больные не знают о том, что больны, не меняют образ жизни, не обращаются к врачу и не принимают лекарства. Между тем гипертонию по её разрушающему действию на организм вполне можно назвать «тихим убийцей». Если болезнь развивается быстро, то она приводит к прогрессированию атеросклероза и в конечном итоге — к инфаркту, инсульту, гангрене нижних конечностей. Если же болезнь протекает длительно и организм успевает приспособиться к закупорке сосудов, развивается поражение сердечной мышцы (сначала гипертрофия, а затем — атрофия миокарда, что приводит к хронической сердечной недостаточности), почек (альбуминурия — потеря белка с мочой, нарушение почечной функции и в итоге — почечная недостаточность) и нарушение обмена веществ (непереносимость глюкозы, а потом сахарный диабет).
Причины гипертонии до конца не изучены, хотя исследования в этом направлении ведутся уже более столетия. Как возникает гипертония и почему вызывает такие смертельно опасные осложнения? Ответ на эти вопросы дает биохимия.
Молекулы, повышающие давление
О роли биохимических нарушений в развитии гипертонии стало известно достаточно давно. В 1897 году профессор физиологии Каролинского университета в Стокгольме, финн по происхождению, Роберт Тигерстедт на международной конференции в Москве сообщил о сделанном им открытии. Вместе со своим помощником Пером Густавом Бергманом он обнаружил, что внутривенное введение экстракта почек вызывает повышение давления у кроликов. Вещество, повышающее давление, учёные назвали ренином. Доклад Тигерстедта не произвёл сенсации, более того — исследование сочли мелким, незначащим, сделанным ради очередной публикации. Разочарованный профессор прекратил свои изыскания и в 1900 году вернулся в Хельсинки. Бергман занялся врачебной практикой, и о пионерской работе скандинавских физиологов научный мир забыл на 40 лет.
В 1934 году канадский учёный, работавший в Калифорнии, Гарри Голдблатт, вызвал симптомы артериальной гипертонии у собак путём пережатия почечной артерии и приступил к выделению белкового вещества — ренина из почечной ткани. Так было положено начало открытиям в области механизма регуляции артериального давления. Правда, получить препарат чистого ренина Голдблатту удалось только через 30 лет.
Буквально год спустя после первой публикации Голдблатта, в 1935 году, сразу две исследовательские группы — из Буэнос-Айреса под руководством Эдуардо Мендеза и американская под руководством Ирвинга Пэйджа — независимо друг от друга, также используя технику пережатия почечной артерии, выделили другое вещество, повышающее артериальное давление. В отличие от крупной белковой молекулы ренина, это был небольшой пептид, состоящий всего из восьми аминокислот. Американские исследователи назвали его гипертензином, а аргентинские — ангиотонином. В 1958 году во время неформальной встречи за бокалом мартини учёные сравнили результаты полученных исследований, поняли, что имеют дело с одним и тем же соединением и пришли к компромиссному соглашению о химерном названии открытого ими пептида — ангиотензин.
Итак, основные соединения, повышающие давление, были открыты, не хватало только связующих звеньев в механизме развития гипертонии. И они появились. В конце 50-х годов ХХ века сформировалась концепция о функционировании ренин-ангиотензиновой системы (РАС).
Классическое представление о том, как функционирует РАС, показано на рис. 1.
Именно ангиотензин II, воздействуя на определённые рецепторы, приводит к росту артериального давления, а при длительной активации РАС — к драматическим последствиям в виде поражения сердца, сосудов, почек и в конечном итоге — к смертельному исходу (рис. 2).
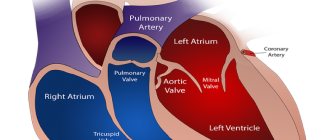
Обнаружено несколько типов рецепторов ангиотензина II, самые изученные из которых рецепторы 1-го и 2-го типов. Когда ангиотензин II взаимодействует с рецепторами 1-го типа, организм отвечает спазмом сосудов и повышением выработки альдостерона. Альдостерон — гормон коры надпочечников, отвечающий за задержку жидкости в организме, что также способствует повышению артериального давления. Так что рецепторы 1-го типа отвечают за «вредное» действие ангиотензина II, то есть за повышение артериального давления. Взаимодействие ангиотензина II c рецепторами 2-го типа, напротив, приводит к благоприятному эффекту в виде расширения сосудов.
Как выяснилось, губительное действие ангиотензина II не исчерпывается повышением давления. Последние исследования показывают, что связывание ангиотензина II с рецепторами 1-го типа способствует развитию атеросклероза. Оказалось, что ангиотензин II вызывает воспалительные процессы в стенках кровеносных сосудов, способствует образованию активных форм кислорода и в результате нарушает структуру и функции эндотелия — клеток, выстилающих стенки сосудов. Нарушение функции эндотелия приводит к развитию атеросклероза и ремоделированию стенок сосудов.
Итак, ренин-ангиотензиновая система (РАС) играет ключевую роль как в повышении давления, так и в развитии атеросклероза. Учёные нашли, что гены, отвечающие за работу белков, вовлечённых в РАС, определяют предрасположенность человека к гипертонии и сердечно-сосудистым заболеваниям. Если определённые гены активны, то РАС тоже гиперактивируется, и вероятность развития гипертонии и сердечно-сосудистых заболеваний возрастает в несколько раз.
Поиск лекарств от гипертонии. Три мишени в молекулярной цепочке
Как только сформировалось представление о ренин-ангиотензиновой системе (РАС), в ней сразу выявились три молекулярные мишени, с помощью которых можно было предотвратить развитие гипертонии. Поэтому стратегия поиска новых лекарственных препаратов развивалась по трём основным направлениям (см. рис. 1): поиск ингибиторов ренина; поиск ингибиторов ангиотензин-превращающего фермента (АПФ); поиск блокаторов рецепторов ангиотензина II 1-го типа (БРА).
Самой привлекательной мишенью для фармакологов был и остается фермент — ренин, поскольку именно он является ключевой молекулой РАС. Если нет ренина — не вырабатывается и ангиотензин II. Однако первые игибиторы (вещества, блокирующие активность) ренина, разработанные ещё в 60-е годы прошлого века, не удалось внедрить в практику из-за неудовлетворительных фармакологических свойств и высокой стоимости синтеза. Они плохо всасывались в желудочно-кишечном тракте, и их приходилось вводить внутривенно.
После неудачи с ренином фармакологи занялись поиском другой молекулярной мишени. Найти её учёным помогла ядовитая змея Bothrops gararaca, укус которой приводит к длительному и порой фатальному падению артериального давления. В 1960 году бразилец Сергио Ферейро занялся поиском вещества, содержащегося в яде и вызывающего «паралич сосудов». В 1968 году обнаружили, что искомое вещество является ингибитором некоего фермента, превращающего ангиотензин I в ангиотензин II. Так был открыт ангиотензин-превращающий фермент (АПФ). В 1975 году появился каптоприл — первый синтетический ингибитор АПФ, который можно было принимать в виде таблеток и эффективность которого другие ингибиторы АПФ не смогли превзойти. Это был прорыв и настоящий успех в лечении гипертонии. Сейчас число ингибиторов АПФ очень велико, их более 30.
Наряду с успехами появились данные о побочных эффектах каптоприла и других ингибиторов АПФ, в частности о появлении сыпи, зуда, мучительного сухого кашля. Кроме того, даже в максимальных дозах ингибиторы АПФ не могут полностью нейтрализовать губительное действие ангиотензина II. К тому же образование ангиотензина II при лечении ингибиторами АПФ очень быстро восстанавливается за счёт альтернативных механизмов. Это так называемый эффект ускользания, который заставляет врачей увеличивать дозу или менять препарат.
В Европе и США за последние 10 лет ингибиторы АПФ уступили лидирующее место новому классу препаратов — блокаторам ангиотензиновых рецепторов (БРА). Современные БРА полностью выключают «вредные» рецепторы 1-го типа, не затрагивая «полезные» рецепторы 2-го типа. Эти препараты, первым из которых был лозартан, практически не оказывают побочного действия, характерного для ингибиторов АПФ, в частности не вызывают сухой кашель. БРА ничуть не уступают ингибиторам АПФ в снижении давления и не только. Как показывают последние исследования, ингибиторы АПФ и блокаторы ангиотензиновых рецеторов (БРА) предотвращают поражения сердца и сосудов и даже способствуют улучшению состояния сосудов и миокарда, поражённых при гипертонии.
Любопытно, что если каптоприл до сих пор не уступает по эффективности более новым ингибиторам АПФ, то БРА всё время совершенствуются. Новые БРА более специфичны к рецепторам 1-го типа и дольше сохраняют свою активность в организме.
Последний штурм
Несмотря на успехи ингибиторов АПФ и БРА фармакологи не оставили надежду «побороть» вещество, играющее ключевую роль в гипертонии, ренин. Уж очень привлекательна цель — выключить молекулу, «запускающую» биохимический каскад РАС.
От ингибиторов ренина ожидали более полной блокады системы синтеза ангиотензина II. Фермент ренин катализирует процесс превращения ангиотензиногена, то есть в биохимическом каскаде он взаимодействует только с одной молекулой (рис. 3). Это означает, что у ингибиторов ренина не должно быть существенных побочных эффектов, в отличие от ингибиторов АПФ, которые воздействуют не только на АПФ, но и на другие регуляторные системы.
Многолетние поиски ингибиторов ренина увенчались синтезом нескольких молекул, одна из которых, алискирен, в 2007 году уже появилась в арсенале американских врачей. У прямых ингибиторов ренина (ПИР) много преимуществ. Они легко переносятся пациентами, медленно выводятся из организма, хорошо (лучше ингибиторов АПФ) снижают давление, не вызывают эффекта отмены при прекращении приёма.
Итак, с ренина началось наше повествование, им же оно и закончится. Развитие науки наконец дало учёным возможность «подступиться» к белку, открытому 110 лет назад, на совершенно новом молекулярном уровне. Но возможно, и новый препарат — это лишь начало. Оказалось, что ренин не только фермент, но и гормон, взаимодействующий со специальными рецепторами, открытыми в 2002 году. Вполне вероятно, что ингибиторы ренина могут не только блокировать его ферментативную активность, но также препятствовать связыванию ренина с рениновыми рецепторами. Такая возможность сейчас активно изучается. Следующим шагом на пути поиска новых препаратов для лечения гипертонии может стать синтез блокаторов рениновых рецепторов или даже терапия на уровне генов. Перспективна также разработка ингибиторов ферментов синтеза альдостерона и других ферментов — эндопептидаз. Но это уже тема другой статьи.
В любом случае в скором будущем больным будут доступны препараты, намного превосходящие все известные сегодня и способные переломить ужасающую статистику смертности от сердечно-сосудистных заболеваний. Всё это благодаря научному поиску и внедрению разработок учёных во врачебную практику.
***
По некоммерческому названию лекарства от гипертонии можно сделать вывод о механизме его действия. Ингибиторы ангиотензин-превращающего фермента (АПФ) имеют в названии окончание -прил (эналаприл, лизиноприл, рамиприл). Блокаторы ангиотензиновых рецепторов (БРА) — окончание сартан (валсартан, ирбесартан, телмисартан). Прямые ингибиторы ренина (ПИР) можно отличить по окончанию кирен (алискирен, ремикирен, эналкирен).
Не следует путать некоммерческое название с торговой маркой. В наименованиях торговых марок оригинальных препаратов обычно нет никаких правил и закономерностей.
Словарик к статье
Блокаторы — вещества, блокирующие взаимодействие физиологически активных веществ с рецепторами.
Ингибиторы — вещества, блокирующие активность ферментов.
Рецепторы — белковые молекулы на поверхности клеточной мембраны. Взаимодействие с ними других молекул приводит к запуску цепочки реакций внутри клетки.
Ферменты — белковые молекулы, катализирующие процессы в живой клетке.
Органопротекторные качества алискирена
Установлено, что хроническая блокада РАС у пациентов с АГ способствует улучшению клинических исходов не только за счет редукции АД, но и, возможно, благодаря эффективной органопротекции [12, 13, 34]. Вместе с тем вклад внутренних качеств антигипертензивных лекарственных средств в редукцию глобальной величины кардиоваскулярного риска широко дискутируется [77]. Полагают, что именно осуществление контроля за величиной АД является основной детерминантой в реализации органопротекторных эффектов антигипертензивной терапии [12, 60, 73]. Тем не менее ПИР потенциально могут оказывать благоприятное влияние на органы-мишени и клинические исходы [28]. Предполагается, что алискирен может оказывать органопротекторное влияние посредством ингибирования специфических рецепторов ренина [44], представленных в мезангиальной ткани почек, в субэндотелии ренальных и коронарных артерий [4]. Кроме того, существуют доказательства благоприятного влияния алискирена на активность локальной почечной РАС [38].
В эксперименте доказана способность алискирена индуцировать вазодилатацию почечных артерий и способствовать повышению минутного диуреза [32], приводить к реверсии альбуминурии, а также способствовать редукции гипертрофии ЛЖ [48]. При этом рено- и кардиопротекторные качества алискирена были сопоставимы с таковыми у валсартана [48].
При проведении клинических исследований алискирен продемонстрировал позитивное влияние в отношении редукции альбуминурии, предотвращения снижения скорости клубочковой фильтрации и увеличения креатинина плазмы крови [66]. Причем нефропротекторная активность препарата не уступала АРА лосартану. Кроме того, алискирен способен снижать выраженность провоспалительной и нейрогуморальной активации не только в эксперименте [42], но и в клинических условиях [59]. Показаны возможность реверсии гипертрофии ЛЖ при длительном назначении алискирена и потенциация этого эффекта при добавлении лосартана [58].
Переносимость и безопасность алискирена в монотерапии и при комбинированном назначении
Алискирен показал высокую безопасность как у здоровых волонтеров при проведении испытаний первой фазы, так и у пациентов с АГ. Частота нежелательных побочных эффектов или побочных реакций, повлекших за собой отказ пациентов от продолжения исследования, была сопоставима с таковой в группах плацебо. Наиболее часто среди побочных эффектов регистрировались усталость, головная боль, головокружение и диарея [29, 62, 76]. Необходимо отметить, что частота возникновения побочных эффектов зависит от дозы препарата [62, 76]. Важно, что алискирен не оказывает влияния на метаболизм эндогенного брадикинина и субстанции Р, поэтому препарат не приводит к манифестации кашля и ангионевротического отека так часто, как ИАПФ. В целом переносимость алискирена сопоставима с таковой у АРА и плацебо [15].
Алискирен не только хорошо переносится пациентами с нарушениями функции печени, но и имеет фармакокинетический профиль, не зависящий от тяжести печеночной недостаточности [71]. Существуют данные о безопасности применения алискирена у пациентов с почечной недостаточностью, сахарным диабетом, ожирением, метаболическим синдромом и сердечной недостаточностью [4, 33], а также у лиц старших возрастных групп [68]. Вместе с тем существует потенциальная опасность ухудшения почечной функции на фоне использования алискирена в монотерапии или при комбинировании его с АРА у больных со стенозом ренальных артерий, при проведении парентеральной анестезии, а также в когорте лиц, получающих ингибиторы ЦОГ-2 [4].
В заключение необходимо отметить, что новый класс антигипертензивных лекарственных средств, безусловно, заслуживает внимания. Вместе с тем в отношении клинической эффективности ПИР и алискирена в частности требуется проведение дополнительных исследований по увеличению объема доказательств, касающихся возможного благоприятного влияния на органы-мишени. Объем существующих данных, касающихся перспектив использования ПИР при лечении не только АГ, но и СН и сахарного диабета, в настоящее время ограничен. Однако высокая безопасность, хорошая переносимость, благоприятный терапевтический профиль, возможность широкого комбинирования с различными лекарственными средствами позволяют надеяться, что ПИР займут достойное место среди антигипертензивных лекарственных средств.
Прямой ингибитор ренина — алискирен при лечении артериальной гипертензии
Ренин-ангиотензин-альдостероновая система играет ключевую роль в регуляции уровня артериального давления и водно-электролитного баланса. Прямой ингибитор ренина — алискирен, уменьшая активность ренина плазмы, оказывает кардио- и нефропротекторный эффекты. Антигипертензивный эффект не зависит от пола, расы, возраста, индекса массы тела. Антигипертензивный эффект алискирена и ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина II, антагонистов кальция сопоставим. Алискирен эффективен у пациентов с ожирением, сахарным диабетом, нарушенной функцией почек и метаболическим синдромом.
Direct renin inhibitors — aliskiren in the treatment of arterial hypertension
Renin-angiotensin-aldosterone system plays a key role in the regulation of blood pressure and fluid and electrolyte balance. Direct renin inhibitor — aliskiren, decreasing plasma renin activity, providing cardio- and nephroprotective effects. Antihypertensive effect is independent of gender, race, age, body mass index. Antihypertensive effect of aliskiren and the angiotensin converting enzyme inhibitors, angiotensin II receptor blockers, calcium antagonists is comparable. Aliskiren is effective in patients with obesity, diabetes, renal dysfunction and metabolic syndrome.
В ходе изучения ренин-ангиотензин-альдостероновой системы (РААС) были разработаны подходы по регулированию ее фармакологической активности. Первый компонент РААС — ренин был идентифицирован 110 лет назад. В дальнейшем было показано его значение в регуляции активности РААС при патологических состояниях, ставшее основой для разработки прямых ингибиторов ренина (ПИР). РААС играет ключевую роль в регуляции уровня артериального давления (АД) и водно-электролитного баланса. Повышение активности РААС играет большую роль в формировании и прогрессировании артериальной гипертензии (АГ), хронической сердечной недостаточности (ХСН), хронических заболеваниях почек, системном атеросклерозе. РААС непосредственно участвует в процессах роста и дифференцировки тканей, модуляции процессов воспаления и апоптоза, а также потенциации синтеза и секреции целого ряда нейрогуморальных субстанций. Основные эффекты РААС реализуются через ангиотензин ІІ (АТІІ) посредством стимуляции специфических рецепторов. Активация рецепторов ангиотензина подтипа 1 (АТ1) приводит к вазоконстрикции, стимулирует высвобождение вазопрессина, альдостерона, эндотелина, норадреналина. Физиологическая роль других подтипов рецепторов ангиотензина (АТ3, АТ4 и АТх) продолжает изучаться. АТІІ способствует накоплению коллагенового матрикса, продукции цитокинов, адгезивных молекул, активации внутриклеточной сигнальной системы, повышению экспрессии генов фетального фенотипа, играет большую роль в ремоделировании миокарда и гипертрофии левого желудочка (ЛЖ), АТІІ участвует в процессах ремоделирования артерий, интенсификации оксидантного стресса и апоптоза, содействует формированию и прогрессированию АГ, ХСН, атеросклеротическому повреждению сосудов, диабетической и недиабетической нефропатии, ангиопатии при сахарном диабете (СД), эклампсии беременных, болезни Альцгеймера. Прогрессирование кардиоваскулярных заболеваний не зависит от вазопрессорного эффекта АТІІ [1].
Секреция ренина является первым этапом в повышении синтеза АТІ, АТІІ и других продуктов каскада РААС. Реализация последующих эффектов РААС модулируется влиянием ренина на специфические рецепторы, индуцируя увеличение АТІІ [2].
До недавнего времени существовали следующие ингибиторы РААС — ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов АТII (БРА). Механизм действия иАПФ следующий: подавляется активность АПФ, что приводит к уменьшению эффектов АТII и замедлению деградации вазопрессоров (брадикинина и простагландина Е2). БРА конкурентно ингибируют рецепторы АТII и уменьшают эффекты АТII. Рецепторы к ренину и проренину расположены на поверхности клетки. Активация ренином клеточного сигнального пути приводит к фиброзу и клеточной гипертрофии. В последние годы контроль за активностью РААС осуществлялся путем ограничения продукции АТІІ, блокады рецепторов АТІІ и альдостерона, благодаря ограничению секреции ренина, преимущественно путем использования β-адреноблокаторов. Многочисленные исследования показали, что адекватное снижение активности РААС с помощью иАПФ, БРА или альдостерона скорее постулируется, чем реально достигается, так как развивается феномен «ускользания» антигипертензивного и органопротекторного эффектов блокаторов РААС при их длительном применении. Для преодоления указанного феномена используются комбинации иАПФ + БРА, иАПФ + β-адреноблокатор, иАПФ + спиронолактон. Появление ПИР рассматривается как способ достижения более полного контроля активности РААС и преодоления феномен «ускользания» [3].
Первые ПИР синтезированы в 70-х годах ХХ века, но первым препаратом, пригодным для приема внутрь, стал алискирен (А). А., связываясь с активной частью молекулы-мишени, предотвращает ее взаимодействие с ангиотензиногеном. Уменьшая активность ренина плазмы (АРП), А. оказывает кардио- и нефропротекторный эффекты. Ингибиторы РААС стимулируют АРП, в результате наблюдаются следующие эффекты: вазоконстрикция в клубочке, воспаление, фиброз (почки); гипертрофия, фиброз, вазоконстрикция (сердце); гиперплазия, гипертрофия, воспаление, окисление липидов, фиброз (сосуды); вазоконстрикция (мозг). А. действует в точке активации РААС и уменьшает АРП. В отличие от иАПФ и БРА, А уменьшает уровень АТI, АII и АРП. Ренин обладает ферментативной, а также рецептор-опосредованной активностью [4].
Фармакокинетика А. Клинические исследования показали, что переносимость А сопоставима с плацебо. Продолжительность действия этого препарата превышает 24 часа, а почечная вазодилатация может сохраняться до 48 часов. Период полувыведения А составляет примерно 40 часов, что обеспечивает однократный прием в сутки. Рекомендованная стартовая доза А составляет 150 мг с дальнейшим увеличением до 300 мг. Фармакокинетические характеристики А не зависят от гликемии натощак и концентрации в плазме крови гликолизированного гемоглобина. Элиминация препарата осуществляется в неизмененном виде с желчью, экскреция с мочой составляет <1%. Исследования первой и второй фазы показали, что препарат способствует эффективной блокаде РААС и дозозависимому предотвращению повышения уровня АД [5]. Полный антигипертензивный эффект наступает через 2 недели и не зависит от пола, расы, возраста, индекса массы тела. А обладает минимальным риском лекарственных взаимодействий, не требует коррекции дозы при хронической почечной недостаточности (ХПН), при поражении печени. Добавление А к ловастатину, атенололу, варфарину, фуросемиду, дигоксину, целекоксибу, гидрохлоротиазиду (ГХТЗ), рамиприлу, валсартану, метформину и амлодипину не приводило к клинически значимому увеличению экспозиции А. Совместное его применение с аторвастатином приводило к 50% увеличению Cmax (максимальная концентрацию препарата) и AUC (площадь под кривой «концентрация — время») после приема нескольких доз. Совместное применение 200 мг кетоконазола 2 раза в день с А приводило к 80% увеличению уровня А в плазме. При совместном применении А с фуросемидом AUC и Cmax фуросемида снижались на 30 и 50% соответственно [6]. Не требуется коррекции дозы А у пациентов с ХПН. У пациентов с ХПН отмечается умеренное (~двухкратное) увеличение экспозиции А, но оно не коррелировало с тяжестью поражения почек и клиренсом креатинина. Клиренс А составлял 60–70 % у здоровых. Почечный клиренс А уменьшался с увеличением тяжести поражения почек. Поскольку поражение почек оказывает только умеренное влияние на экспозицию А, то коррекция дозы А, скорее всего, не требуется у пациентов с гипертензией и поражением почек. Не требуется коррекции дозы А и у пациентов поражением печени. Не было отмечено достоверной корреляции между экспозицией А и тяжестью поражения печени. А способен осуществлять блокаду РААС, что приводит к снижению сосудистого тонуса и системного АД. Однако препарат не лишен и негативных качеств, связанных с феноменом «ускользания», что характерно для всех лекарственных средств, блокирующих активность РААС. Снижение эффективности А вследствие восстановления секреции ренина или наличия синдрома отмены не подтверждается клиническими наблюдениями [7].
Антигипертензивная эффективность А. АРП — показатель, необходимый не только для диагностики редко встречающихся вторичных форм АГ (реноваскулярной). Клиническое и прогностическое значение АРП заключается в следующем: показатель повышается при АГ в сочетании с другими факторами риска (мужской пол, курение, СД 2-го типа, ожирение (Ож.), метаболический синдром) и при наличии поражения органов мишеней (ПОМ) (стойкое снижение скорости клубочковой фильтрации); рост АРП ренина бывает ятрогенным, спровоцированным иАПФ и/или диуретиков (петлевые, тиазидовые), обусловливающих почечные потери натрия: при этом наблюдается дальнейшая активация РААС, что приводит к утрате контроля над АД и прогрессирование ХСН; увеличение АРП всегда предрасполагает к усугублению ПОМ и потенциально фатальных сердечно-сосудистых осложнений (ССО) и почечных осложнений; повышенная АРП — самостоятельный фактор для фармакологического воздействия ПИР, позволяющего добиться снижения АД и торможения прогрессирования ПОМ. А. может претендовать на роль эффективного антигипертензивного препарата в режиме монотерапии и в комбинациях с другими препаратами. Показаниями к применению ПИР являются: гиперрениновые варианты АГ, норморениновые АГ, при которых проренин и опосредованная активация прорениновых рецепторов приводит к деструкции тканей. ПИР показаны не только при реноваскулярной АГ и ХСН, но и при увеличенной плазменной концентрации проренина (АГ с гиперактивацией симпатической нервной системы, метаболический синдром, СД 2-го типа, менопауза).
Монотерапия А. обеспечивает дозозависимое снижение диастолического АД (ДАД) и систолического АД (САД) у пациентов с мягкой и умеренной АГ [8]. Оценка эффективности и безопасности А. у 672 больных АГ I-II степеней (ст.) в 8-недельном плацебо-контролируемом исследовании выявило дозозависимое снижение САД и ДАД. Антигипертензивное действие А сохранялось в течение двух недель после его отмены; А хорошо переносился; частота нежелательных явлений не отличалась от плацебо. А — торговое название расилез (Р) — в дозе 150 мг снижает САД на 13 мм рт. ст., а ДАД на 10,3 мм рт. ст., а в дозе 300 мг снижает САД от 15 до 22 мм рт. ст. (в зависимости от ст. АГ), а ДАД — на 11 мм рт. ст. А обеспечивает контроль АД в ранний утренний период. После отмены А не возникает феномена «рикошета» [8]. Объединенный анализ клинических исследований, включавших 8481 больного [9]. получавших монотерапию А или плацебо, показал, что однократный прием А в дозе 150 или 300 мг/сут., обусловливал снижение САД на 12,5 и 15,2 мм рт. ст. соответственно, по сравнению со снижением на 5,9 мм рт. ст. у пациентов, получавших плацебо (p<0,0001). ДАД снижалось на 10,1 (на дозе 150 мг) и 11,8 мм рт. ст. (на дозе 300 мг) соответственно (в группе плацебо — на 6,2 мм рт. ст., р<0,0001). Различий в антигипертензивном эффекте А у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено. При применении иАПФ увеличиваются концентрации проренина и АРП (снижается эффективность иАПФ). При увеличении дозы иАПФ достоверно нарастает АРП и плазменная концентрация АТI [10]. Исследование А в сравнении с иАПФ у пациентов с мягкой и умеренной АГ установило следующее: А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия). А ± гидрохлортиазид (ГХТЗ) достоверно больше снижает ДАД и САД, чем рамиприл ± ГХТЗ через 26 недель лечения. А достоверно больше снижает ДАД и САД, чем рамиприл через 12 недель лечения (монотерапия) у пациентов с АГ II ст. Терапия А обеспечивает достоверно лучший контроль АД по сравнению с рамиприлом. САД и ДАД возвращаются к исходному уровню более быстро после отмены рамиприла, чем после отмены А. Сравнение гипотензивной эффективности А, ирбесартана и рамиприла после пропущенной дозы показало следующее: после пропущенной дозы достигнутое снижение АД было достоверно больше в группе А., чем в группе рамиприла [11]. Достоверно больший процент снижения АД поддерживается после пропущенной дозы А по сравнению с ирбесартаном или рамиприлом. Возвращение к исходному АД происходит более плавно после отмены А., чем рамиприла. А. и эналаприл почти в равной степени уменьшают плазменную концентрацию АТП, но в отличие от А прием эналаприла приводил к более чем 15-кратному росту АРП. В условиях низкосолевой диеты индуцированная А органная (в частности, почечная) вазодилатация может сохраняться до 48 часов. Провоцировать подъем АРП могут препараты, стимулирующие натрийурез (тиазидовые и петлевые диуретики). Назначение А. в этой ситуации один из наиболее действенных подходов к устранению реактивного повышения АРП при комбинации с иАПФ и тиазидовым диуретиком.
В 2009 г. опубликованы результаты мультицентрового контролируемого клинического исследования, в котором у 1124 больных АГ сравнивали эффективность А и ГХТЗ (начальная антигипертензивная терапия); при необходимости к этим препаратам присоединяли амлодипин [12]. К завершению периода монотерапии (12-я неделя) стало ясно, что А приводит к более выраженному снижению АД, чем ГХТЗ (-17,4/-12,2 мм рт. ст. против -14,7/-10,3 мм рт. ст., р<0,001). Эти результаты важны, поскольку большинство пациентов, страдающих АГ, исходно нуждаются в комбинированной антигипертензивной терапии. Оптимизация комбинированной антигипертензивной терапии важна у пациентов с Ож. при этом у А имеются дополнительные преимущества [13]. Больные с Ож, у которых полная (25 мг/сут) доза ГХТЗ не приводила к снижению АД, были рандомизированы на группы, которым назначали амлодипин + ГХТЗ (10/25 мг/сут), ирбесартан + ГХТЗ (300/25 мг/сут) и А. + ГХТЗ (300/25 мг/сут). По мере нарастания ст. Ож антигипертензивная эффективность схем лечения (БРА + ГХТЗ, антагонист кальция + ГХТЗ) снижается. В группе с Ож. III ст. (ИМТ≥40 кг/м2) только у 50% удалось достичь целевого АД с помощью ирбесартана + ГХТЗ, у 43,8% — с помощью амлодипина + ГХТЗ и лишь у 16,7% — с помощью ГХТЗ. При менее выраженном (I–II ст.) Ож более чем у 40% пациентов, получавших БРА + ГХТЗ или амлодипин + ГХТЗ, и более чем у 60% больных, принимавших только ГХТЗ, целевое АД не было достигнуто. В группе пациентов с Ож. I-II ст., получавших А. + ГХТЗ, целевого АД достигли 56,7% больных, а с Ож. III ст. — 68,8%. АГ, сочетающаяся с Ож, часто ассоциируется с увеличением активности РААС и трудно корригируется, поэтому в таких случаях может быть назначен А.
Установлена способность А. снижать АД и уменьшать альбуминурию [14]. В исследовании AVOID [15] у 599 больных диабетической нефропатией с АГ оценивали влияние комбинации максимальных доз лозартана и А на альбуминурию (по соотношению альбумин/креатинин мочи). Присоединение А (300 мг/сут) к лозартану (100 мг/сут) сопровождалось достоверным уменьшением соотношения альбумин/креатинин мочи на 20% в группе в целом (100%), а у 24,7% — на 50% и более. В группе лозартан + плацебо, уменьшение соотношения альбумин/ креатинин мочи на 50% и более достигнуто только у 12,5% пациентов (р<0,001). ПИР могут уменьшить альбуминурию как в режиме монотерапии, так и при комбинации с БРА, позволяющей достичь оптимальной ст. блокады РААС, обеспечивающей устранение генерализованной и локально-почечной дисфункции эндотелия.
А при комбинированной терапии АГ. У пациентов с мягкой и умеренной АГ без и с Ож. А. + ГХТЗ обеспечивают достоверное снижение ДАД и САД. Большее количество пациентов достигают контроля уровня АД с комбинацией А + ГХТЗ, чем при использовании других комбинаций с ГХТЗ [16]. У пациентов с АГ и СД А + рамиприл достоверно лучше снижают АД, чем оба компонента монотерапии. А обеспечивает достоверно лучший контроль АД, чем рамиприл [17]. У пациентов с мягкой и умеренной АГ А + валсартан достоверно лучше снижают АД, чем оба компонента монотерапии [18]. А достоверно снижает АД при комбинировании с амлодипином в дозе 5 мг/сут. А увеличивает уровень контроля АД по сравнению с амлодипином в дозе 5 мг/сут [19]. А. ± ГХТЗ эффективны при долгосрочной терапии АГ. А + валсартан ± ГХТЗ обеспечивают долгосрочную гипотензивную эффективность (промежуточный анализ 6 месяцев терапии) [20].
В 2009 г. опубликован дизайн исследования ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal Endpoints) (часть программы ASPIRE HIGHER), в котором изучается влияние двойной блокады РААС с помощью комбинации А и стандартной терапии (иАПФ или БРА) у больных СД 2-го типа с высоким риском ССО и почечных осложнений, частично обусловленных ростом АРП. Первичная цель данного исследования состоит в оценке эффективности добавления А к стандартной терапии по влиянию на комбинированную конечную точку (сердечно-сосудистая смерть и осложнения: успешная реанимация, нефатальный ИМ, нефатальный инсульт, незапланированная госпитализация по причине ХСН; развитие терминальной ХПН, удвоение сывороточного креатинина, смерть от причин, связанных с поражением почек) [21]. Данное исследование должно продлиться около 4 лет, а результаты его призваны обосновать применение комбинации А. с иАПФ или БРА для торможения прогрессирования кардиоренального синдрома при СД 2-го типа. Наибольшую эффективность А можно ожидать при тех вариантах АГ, при которых отмечается тенденция к повышению АРП (формирующаяся эссенциальная АГ, Ож., метаболический синдром, СД 2-го типа, ХПН). Подавляющему большинству больных АГ уже на первом этапе лечения необходима комбинированная антигипертензивная терапия и, как показано в одном из недавно опубликованном клиническом исследовании [22], в составе комбинаций А сохраняет свою активность независимо от исходной АРП. Рост АРП у больных АГ рассматривается как диагностический маркер и как независимый фактор риска потенциально фатальных ССО. Фармакологическая модуляция АРП представляет собой один из наиболее перспективных подходов к управлению риском ССО у больных АГ, сочетающейся с поражением почек, метаболическим синдромом и Ож. [23]. Исследование AVOID (Aliskiren in the eValuation of prOteinuria In Diabetes) (часть программы ASPIRE HIGHER) спланировано для оценки возможностей конкретного антигипертензивного препарата в защите органов-мишеней в различных ситуациях, характеризующихся очень высоким риском потенциально фатальных осложнений (гипертрофия ЛЖ, CД 2-го типа, ХСН). Промежуточные результаты позволяют утверждать, что прямая блокада ренина с помощью А является одной из наиболее доступных стратегий для улучшения долгосрочного прогноза. В исследовании ALLAY (The Aliskiren Left Ventricular Assessment of Hypertrophy) А вызывал уменьшение индекса массы миокарда ЛЖ, отражающее регресс его гипертрофии, у больных АГ и избыточной массой тела. Комбинация А и лозартана обеспечивала дальнейшее снижение индекса массы миокарда ЛЖ на дополнительные 20% по сравнению с монотерапией лозартаном, однако данное различие не достигло статистически достоверной величины [24]. По результатам исследования ALOFT (ALiskiren Observation of heart Failure Treatment study), присоединение А к стандартной схеме лечения ХСН с признаками неблагоприятного прогноза (стойкое повышение плазменной концентрации натрийуретического пептида) и АГ позволило добиться дальнейшего улучшения соотношения величины митральной регургитации к площади митрального отверстия и трансмитрального кровотока. Благодаря А удалось достичь снижения концентрации маркеров дезадаптивной нейрогуморальной активации (плазменные уровни мозгового натрий-уретического пептида и его N-аминотерминального предшественника (NT-pro BNP), концентрация альдостерона в моче, АРП) [25]. Перспективы в применении А с целью торможения развития поражения почек определяются его высокой безопасностью, очевидно, значительно превосходящей другие блокаторы РААС (иАПФ, БРА и антагонисты альдостерона) в связи с меньшим риском нарастания креатининемии и калиемии. Экскретируясь преимущественно с желчью, а не с мочой [5], А сохраняет антигипертензивное действие, но не приводит к ухудшению почечной функции у больных со стойким снижением скорости клубочковой фильтрации. Именно в нефрологии агрессивная блокада РААС с помощью одновременно применяемых нескольких классов лекарственных препаратов может оказаться эффективной с точки зрения предупреждения терминальной ХПН. А уменьшает альбуминурию (достоверно превосходящее монотерапию каждым из препаратов) и вероятность необратимого ухудшения функции почек в группе пациентов (при протеинурии >1 г/сут), что показано в исследовании COOPERAТЕ (COmbination treatment of angiOtensin-II recePtor blockEr and angiotensin-conveRting-enzyme inhibitor in non-diAbeTic rEnal disease) [26]. Исследование ONTARGET (OngoiNg Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) показало, что комбинация иАПФ и БРА сопряжена с большей вероятностью артериальной гипотензии и гиперкалиемии, а, по сравнению с монотерапией этими препаратами, ассоциируется с ростом частоты начала программного гемодиализа и удвоения креатининемии у больных с высоким риском и ПОМ [27]. Объектами демонстрации нефропротективных свойств А. могут быть следующие клинические ситуации: АГ/метаболический синдром или СД 2-го типа с альбуминурией; АГ, ассоциированная со стойким снижением скорости клубочковой фильтрации; АГ при хронических заболеваниях почек с протеинурией (в том числе нефротической) и без нее (например, тубуло-интерстициальные нефропатии); реноваскулярная АГ различного происхождения; пациенты, у которых по разным причинам отмечено нарастание креатининемии или гиперкалиемии при применении иАПФ или БРА; терминальная ХПН, в том числе леченная программным гемодиализом или постоянным амбулаторным перитонеальным диализом; реципиенты почечного трансплантата [28, 29].
Новый класс антигипертензивных лекарственных средств (ПИР) требует проведения дополнительных исследований в отношении увеличения объема доказательств, касающихся замедления прогрессирования ПОМ.
А, очевидно, показан большинству категорий пациентов, страдающих АГ, и это обстоятельство нашло отражение в российских рекомендациях по АГ по диагностике и лечению АГ (четвертый пересмотр, 2010) в качестве дополнительного класса антигипертензивных препаратов для комбиированной терапии [30]. При развитии поражения почек А может оказаться эффективным для предупреждения терминальной ХПН и улучшения прогноза этих больных.
Н.А. Андреичев, З.М. Галеева
Казанский государственный медицинский университет
Андреичев Наиль Александрович — кандидат медицинских наук, доцент кафедры факультетской терапии и кардиологии
Литература:
1. Bauer J.H., Reams G.P. The angiotensin II type 1 receptor antagonists. A new class of antihypertensive drugs // Arch. Intern. Med. — 1995. — Vol. 155 (13). — Р. 1361-1368.
2. Kim S., Iwao H. Molecular and cellular mechanisms of angiotensin II-mediated cardiovascular and renal diseases // Pharmacol. Rev. — 2000. — Vol. 52 (1). — Р. 11-34.
3. Brown M. J. Aliskiren // Circulation. — 2008. — Vol. 118 (7). — Р. 773-784.
4. Nguyen G., Delarue F., Burckle C. et al. Pivotal role of the renin/prorenin receptor in angiotensin II production and cellular responses to rennin // Clin. Invest. — 2002. — Vol. 109 (11). — Р. 1417-1427.
5. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by the orally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. — 2002. — Vol. 39 (1). — Р. 1-8.
6. Zhao C., Vaidyanathan S., Dieterich H. A. et al. Assessment of the pharmacokinetic interaction between the oral direct renin inhibitor aliskiren and furosemide: a study in healthy volunteers // Clin. Pharmacol. Ther. — 2007. — Vol. 81 (Suppl 1). — S. 110 (PIII-78).
7. Gradman A.H., Kad R. Renin inhibition in hypertension // Am. Coll. Cardiol. — 2008. — Vol. 51 (5). — S. 519-528.
8. Oh B.-H., Mitchell J., Herron J.R. et al. Aliskiren, an oral renin inhibitor, provides dose-dependent efficacy and sustained 24-hour blood pressure control in patients with hypertension // Am. Coll. Cardiol. — 2007. — Vol. 49. — S. 1157-1163.
9. Fisher N.D., Jan Danser A.H., Nussberger J. et al. Renal and hormonal responses to direct renin inhibition with aliskiren in healthy human // Circulation. — 2008. — Vol. 117 (25). — S. 3199-3205.
10. Dahlo F.B., Anderson D.R., Arora V. et al. Aliskiren, a direct renin inhibitor, provides antihypertensive efficacy and excellent tolerability independent of age or gender in patients with hypertension (abstr) // Clin. Hypertension. — 2007. — Vol. 9 (Suppl. A). — S. A157.
11. Andersen K., Weinberger M.H., Egan B. et al. Comparative efficacy and safety of aliskiren, an oral direct renin inhibitor, and ramipril in hypertension: a 6-month, randomized, double-blind trial // Hypertension. — 2008. — Vol. 26. — S. 589-599.
12. Schmieder R.E., Philipp T., Guerediaga J. et al. Long-Term Antihypertensive Efficacy and Safety of the Oral Direct Renin Inhibitor Aliskiren. A 12-Month Randomized, Double-Blind Comparator Trial With Hydrochlorothiazide // Circulation. — 2009. — Vol. 119. — S. 417-425.
13. Prescott M.F., Boye S.W., Le Breton S. et al. Antihypertensive efficacy of the direct renin inhibitor aliskiren when added to hydrochlorothiazide treatment in patients with extreme obesity and hypertension // Am. Coll. Cardiol. — 2007. — Vol. 49 (9, Suppl. A). — S. 370A. — (P. 1014-169).
14. Persson F., Rossing P., Schjoedl K.J. et al. Time course of the antiproteinuric and antihypertensive effects of direct renin inhibition in type 2 diabetes // Kidney Int. — 2008. — Vol. 73 (12). — S. 1419-1425.
15. Parving H.H., Persson F., Lewis J.B. et al. AVOID Study Investigators. Aliskiren combined with losartan in type 2 diabetes and nephropathy // N. Engl. J. Med. — 2008. — Vol. 358 (23). — S. 2433-2446.
16. Jordan J., Engli S., Boye S.W. et al. Direct renin inhibition with aliskiren in obese patients with arterial hypertension // Hypertension. — 2007. — Vol. 49. — S. 1-9.
17. Uresin Y., Taylor A., Kilo C. et al. Efficacy and safety of the direct renin inhibitor aliskiren and ramipril alone or in combination in patients with diabetes and hypertension // Renin. Angiotensin Aldosterone Syst. — 2007. — Vol. 8. — S. 190-198.
18. Oparil S., Yarrows S., Patel S. et al. Efficacy and safety of combined use of aliskiren and valsartan in patients with hypertension: a randomised, double-blind trial // Lancet. — 2007. — Vol. 370. — S. 221-229.
19. Drummond W., Munger M.A., Essop M.R. et al. Antihypertensive efficacy of the oral direct renin inhibitor aliskiren as add-on therapy in patients not responding to amlodipine monotherap // Clin. Hypertension. — 2007. — Vol. 9. — S. 742-750.
20. Chrysant S.G., Murray A.V., Hoppe U.C. et al. Long-term safety, tolerability and efficacy of aliskiren in combination with valsartan in patients with hypertension: a 6-month interim analysis // Curr. Med. Res. Opin. — 2008. — Vol. 24 (4). — S. 1039-1047.
21. Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal Endpoints (ALTITUDE): rationale and study design // Nephrol Dial Transplant. — 2009. — Vol. 24 (5). — S. 1663-1671.
22. Stanton A.V., Dicker P., O’Brien E.T. Aliskiren monotherapy results in the greatest and the least blood pressure lowering in patients with high- and low-baseline PRA levels, respectively // Am. J. Hypertension. — 2009. — Vol. 22. — S. 954-957.
23. Мухин Н. А., Фомин В. В. Активность ренина плазмы — фактор риска и самостоятельная мишень антигипертензивной терапии: роль алискирена // Consilium Medicum. — Т. 11. — 2009. — № 10. — С. 3-6.
24. Solomon S.D., Appelbaum E., Manning W.J. et al. Effect of the Direct Renin Inhibitor Aliskiren, Either Alone or in Combination With Losartan, Compared to Losartan, on Left Ventricular Mass in Patients With Hypertension and Left Ventricular Hypertrophy // The Aliskiren Left Ventricular Assessment of Hypertrophy (ALLAY) Trial. Presented al the American College of Cardiology. 57th Annual Scientific Session, March 31, 2008.
25. Mc. Murray J.V., Pitt B., Latini R. et al. Effects of the oral direct renin inhibitor aliskiren in patients with symptomatic heart failure // Circulation-Heart Failure. — 2008. — Vol. 1. — S. 17-24.
26. Nakao N., Yoshimura A., Morita H. et al. Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease (COOPERAТЕ): a randomised controlled trial // Lancet. — 2003. — Vol. 361 (9352). — S. 117-124.
27. Mann I.F., Schmieder R. E., Mc.Queen M. et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial // Lancet. — 2008. — Vol. 372 (9638). — S. 547-553.
28. Чазова И.Е., Фомин В.В., Пальцева Е.М. Прямой ингибитор ренина алискирен — новые возможности защиты почек при артериальной гипертонии // Клиническая нефрология. — № 1. — 2009. — C. 44-49.
29. Чазова И.Е., Фомин В.В. Прямой ингибитор ренина алискирен: возможности коррекции кардио-ренального синдрома // Системные гипертензии. — 2009. — № 4. — C. 53-58.
30. Диагностика и лечение артериальной гипертензии: Российские рекомендации // Системные гипертензии. — 2010. — № 3. — C. 5-26.