Первые симптомы
Инфаркт легкого проявляет себя не сразу. Первые два–три дня после закупорки сосуда человек может не подозревать о проблемах. Многие путают первые симптомы с дискомфортом, возникающим при стенокардии. Иногда возможна боль, как при остром животе. Вас должны насторожить следующие симптомы:
- боль в груди, имеющая острый характер;
- усиление болезненных ощущений при кашле, учащенном дыхании, наклонах тела;
- одышка, возникающая на ровном месте, без физнагрузки;
- при кашле отхаркивается кровь (не у всех, примерно в половине случаев), редко бывает полноценное легочное кровотечение;
- носогубный треугольник и пальцы конечностей становятся синюшного цвета;
- холодный липкий пот во время болевых приступов;
- икота;
- общее недомогание, возможно повышение температуры;
- у некоторых больных открывается рвота.
Предрасположенность к инфаркту легкого есть у людей, страдающих тромбофлебитом и тромбозом, гипертензией легких, частыми рецидивами тромбоэмболии легочной артерии. Факторы риска – возраст старше 60 лет, лишний вес, беременность и роды (или кесарево сечение).
Чем опасен инфаркт легкого
При закупорке крупной артерии состояние больного быстро ухудшается. Усиливаются болевые ощущения и лихорадка, появляются панические атаки, возникают приступы удушья. Если человека не доставить в больницу, его ждут тяжелые последствия, вплоть до летального исхода.
При проблеме с мелким или средним сосудом патологическое состояние развивается медленнее, первое время симптомы не выражены. Но, если не заняться лечением, возникают осложнения:
- постинфарктная пневмония связана с застойными явлениями в тех участках легкого, где было нарушено кровоснабжение;
- абсцесс легкого – запущенная стадия инфекционного процесса, гнойное расплавление тканей, впоследствии – образование полости в легком;
- некроз пораженных тканей вследствие развивающейся ишемии и прекращения питания части органа.
Об опасности инфаркта и эффективности коронарного стентирования
Что мы знаем об инфаркте? О том, что это тяжелое, смертельно опасное состояние, слышали практически все. В относительно недавнем прошлом спасение жизни человека с обширным инфарктом считалось поистине замечательным итогом лечения, а при самом благоприятном течении заболевания это были долгие месяцы строгого режима, медленное восстановление, потеря трудоспособности. Сегодня медицина ставит уже другие задачи: не просто спасти, но вернуть человека к привычной жизни, и важную роль здесь играет оказание специализированной медицинской помощи. Вместе с тем, сохранение здоровья сердца зависит и от нас самих.
КОНСТАНТИН АЛЕКСЕНДРОВИЧ КИРЕЕВ, руководитель Центра рентгенэндоваскулярных диагностки и лечения об опасности инфаркта и эффективности коронарного стентирования:
— В первую очередь, необходимо понимать, что представляет собой острый инфаркт миокарда. Это некроз, то есть отмирание участка сердечной мышцы, развивающийся в результате внезапного, остро возникшего нарушения кровотока в системе коронарной (относящейся к сердцу) артерии. Закупорка ветви коронарной артерии может быть вызвана ее тромбозом, реже эмболией или длительным (более получаса) стойким спазмом.
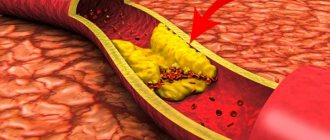
Наиболее частой причиной инфаркта становится атеросклероз, когда на стенках сосудов происходит образование атеросклеротических бляшек: они сужают просвет коронарных артерий, а также могут способствовать разрушению их стенок, что провоцирует образование тромбов и закупорку.
Острый инфаркт вызывает необратимые изменения в сердечной мышце: гибель части функциональных мышечных клеток сердца (некроз) и последующее их замещение соединительной тканью, то есть формирование постинфарктного рубца. Рубец на миокарде остается на всю жизнь. Рассосаться он не может, и о перенесенном инфаркте сердце помнит всегда. Впоследствии нарушение кровоснабжения миокарда может привести к расстройству сердечной деятельности: развивается сердечная недостаточность, т. е, сердце не выполняет своих функций в полном объеме, соответственно, для полноценного существования всего организма попросту не хватает «мощности».
Говоря простым языком, из-за острого нарушения кровообращения сердце постепенно начинает «умирать», и чтобы спасти человеку жизнь, как можно скорее необходимо восстановить кровообращение. При несвоевременном оказании медицинской помощи человек с инфарктом может погибнуть в течение первых суток. В целом прогноз исхода инфаркта зависит от величины очага поражения миокарда, тяжести течения, возраста больного, развития осложнений. Но в любом случае на прогноз заболевания влияет своевременность начала лечения и его адекватность.
В Челябинской области ежегодно регистрируется свыше 5000 инфарктов миокарда, и по-прежнему это заболевание остается одной из основных причин преждевременной смерти. Долгое время в лечении острого инфаркта в нашей области действовала далеко не самая передовая стратегия. По показаниям проводилась тромболитическая терапия, то есть введение препаратов, рассасывающих тромб и восстанавливающих проходимость сосуда. Такая помощь оказывалась и бригадами скорой медицинской помощи до госпитализации, и в реанимационных отделениях стационаров. Успех лечения зачастую зависел от правильно выбранного препарата, своевременности начала его применения. Безусловно, о высокой эффективности лекарственной терапии не было и речи: очень высокий процент летальных исходов (около 16−20%), а если человек оставался жив, то становился инвалидом, его сердце не могло работать должным образом.
Ситуация принципиально изменилась в 2011 году, когда в рамках программы модернизации здравоохранения в Челябинске начали выполнять экстренные операции при острых инфарктах миокарда — чрескожные коронарные вмешательства, в том числе стентирование коронарных артерий. Это был бесспорный прорыв для челябинского здравоохранения.
Коронарное стентирование является самым эффективным способом лечения острого инфаркта миокарда за счет полноценного устранения нарушений кровообращения путем прямого и непосредственного воздействия на инфаркт. Суть метода заключается в том, чтобы в пораженный сосуд через лучевую артерию (на запястье) установить специальный стент с целью восстановления кровотока. Стент — это металлическая сетчатая конструкция, напоминающая полую трубку маленького диаметра. С помощью специального баллона стент в сложенном виде заводится в артерию, под контролем рентген-аппарата доставляется в место сужения сосуда, затем при раздувании баллона под давлением расправляется и имплантируется, расширяя и поддерживая пораженный сосуд в области закупорки или критического сужения и восстанавливая кровоток. Также для того, чтобы сделать вмешательство наиболее эффективным и безопасным, применяется широкий спектр специальных препаратов.
Преимущества стентирования заключаются еще и в том, что эта операция малотравматична, практически безболезненна, имеет малое количество осложнений, позволяет сократить длительность пребывания в стационаре с 15−17 до 7−11 дней, делает возможной раннюю активность пациента и направление его на реабилитацию в санаторно-курортных условиях. Благодаря стентированию при острых инфарктах миокарда летальность снизилась почти вдвое, и на сегодняшний день составляет около 6%. Но самое главное, что после инфаркта пациент может вернуться к нормальной, полноценной жизни, к своей работе.
КОММЕНТАРИЙ ЕВГЕНИЯ МИХАЙЛОВА, главного внештатного кардиолога Южно-Уральской дирекции здравоохранения, кандидата медицинских наук:
— При инфаркте в первые три часа погибает примерно половина толщины сердечной мышцы, в следующие три часа мышца погибает на всю толщину. Поэтому стентирование в остром периоде инфаркта миокарда эффективно, если оно проведено как можно раньше, не позже первых 6 часов от момента развития инфаркта, оптимально — до 2−3 часов. Восстановление кровотока в закупорившейся артерии в этом временном промежутке, до развития необратимых изменений в миокарде, резко уменьшает площадь инфаркта, а иногда позволяет «оборвать» его развитие. Когда же мы вмешиваемся уже по истечении этих 6 часов, мы можем только уменьшить площадь некроза, но не спасти от инфаркта миокарда. Из-за того, что пациенты поступают к нам слишком поздно, половина из них не выживает.
Здесь очень многое зависит от того, как быстро больной или его родственники вызовут бригаду скорой помощи. Люди должны знать клинические проявления инфаркта миокарда. Если внезапно появились сильные, как правило, пугающие боли за грудиной, которые не снимаются приемом нитроглицерина, — медлить нельзя, срочно вызывайте «скорую». Таким образом, первая помощь будет оказана уже на месте: бригада проводит интенсивную терапию для купирования болей и растворения тромба, в максимально сжатые сроки доставит в стационар. Но еще раз повторю, самое главное — вызвать «скорую помощь» вовремя!
О работе рентген-хирургической службы
Четыре дня в неделю мы принимаем пациентов из 4 районов Челябинска и 7 муниципальных образований Челябинской области, это население 700 тысяч человек. На сегодняшний день для Дорожной клинической больницы чрескожные коронарные вмешательства — одно из приоритетных направлений работы. Нужно отметить, что неотложную помощь мы оказываем всем без исключения, а не только прикрепленным гражданам. Среди больниц сети здравоохранения «РЖД-Медицина» от Калининграда до Хабаровска у нас самый большой объем экстренных операций коронарного стентирования.
Мы заинтересованы в том, чтобы пациент, который к нам приехал больным, вышел от нас относительно здоровым, относительно быстро, чтобы он мог вернуться в строй с минимальной потерей качества жизни. К этому прилагаются все усилия. Очень четко отлажены все действия медицинского персонала для скорейшего определения тактики лечения — от приемного отделения до поступления больного в рентгеноперационную или реанимацию. Мы не просто стремимся к тому, чтобы оказывать эту помощь как можно быстрее, но и имеем для этого все возможности.
Эффективным результатам способствует и то, что практическая работа всегда ведется в тесной связке с наукой. На базе дорожной больницы работают две основные кафедры Южно-Уральского государственного медицинского университета, что означает внедрение современных технологий в лечебный процесс, непрерывное повышение квалификации специалистов, обеспечение консультативной помощью, совместный анализ проводимого лечения, клинических случаев.
Свою работу всегда нужно оценивать в соответствии с мировыми стандартами, чтобы можно было понять, хорошо мы работаем или плохо. Так, считается, что медицинская организация работает хорошо, когда у 70% пациентов с инфарктами выполняются операции коронарного стентирования. У нас в 2021 г. этот показатель равнялся 76%. По моему мнению, сегодня для спасения жизни и сохранения здоровья людей делается все, что нужно.
Как не «дожить до инфаркта»
Существуют основные факторы риска, которые могут привести к развитию инфаркта миокарда. На некоторые из них мы можем воздействовать, на другие — нет. Нельзя повлиять, к примеру, на пол (мужчины более подвержены ишемической болезни сердца), возраст, семейный анамнез, наследственную предрасположенность. Однако мы можем существенно ослабить неблагоприятное действие таких факторов, как артериальная гипертензия, курение, сахарный диабет, повышенный уровень холестерина, избыточный вес, малоподвижный образ жизни. Все эти факторы, как в совокупности, так и каждый самостоятельно провоцируют развитие атеросклероза, который, как я уже говорил, и является основной причиной инфаркта миокарда.
Мы проводили исследование медико-социального статуса, качества жизни, наличия факторов риска атеросклероза в группе пациентов с диагнозом «инфаркт миокарда». В анкетировании принимали участие 200 человек, все жители г. Челябинска, в возрасте до 65 лет (эта возрастная группа — угрожаемая по преждевременной смерти, поколение, которое через 10 лет даст ожидаемый средний показатель продолжительности жизни в стране).
По результатам исследования выяснилось, что образ жизни наших пациентов оставляет желать лучшего. Курит каждый второй пациент, у 90% стаж курения составляет более 20 лет, 2/3 пациентов выкуривают в день пачку сигарет и более. Артериальная гипертензия выявлена у 70% пациентов, при этом антигипертензивные препараты принимают только 20% из них; сахарный диабет — у 40%, повышенный холестерин — у 42%, ожирение — у 55%, то есть у каждого второго исследуемого.
При этом каждый третий из 200 пациентов — с повторным инфарктом, потому что люди пренебрегают вторичной профилактикой, в частности, медикаментозной терапией, отказом от вредных привычек. Многие пациенты, после стентирования чувствуя себя практически здоровыми, хотят поскорее забыть о болезни. Однако забывать о ней нельзя. Чтобы сердце работало качественно, в течение года нужно принимать специальные препараты для разжижения крови, улучшающие сердечный выброс, способствующие минимальному изменению миокарда после инфаркта, статины для снижения уровня холестерина. Также необходимо отказаться от курения, алкоголя, следить за весом, придерживаться определенной диеты и т. д. Итог несоблюдения этих рекомендаций всегда плачевный.
Отмечу, что количество пациентов, у которых инфаркт не связан с атеросклерозом, а обусловлен, скорее всего, резким спазмом коронарной артерии на фоне сильного стресса либо большой потерей жидкости и, как следствие, сгущением крови и образованием тромба, в группе исследуемых очень и очень незначительно.
Действительно, люди мало задумываются о своем здоровье, игнорируют тревожные симптомы из-за безответственного к себе отношения либо по незнанию, хотя необходимой информации достаточно и в СМИ, и в интернете, есть очень хорошие ролики социальной рекламы. Но граждане просто не обращают на это внимания.
Сегодня возможности медицины позволяют сохранить жизнь пациентам даже с тяжелым инфарктом. Но настороженность в этом плане должна быть не только у врачей, но и у обычных людей. Без этого никакие технологии не помогут. Атеросклероз — очень злобное заболевание, оно поражает много сосудов, и не только относящихся к сердцу, но и в мозге, конечностях. Поэтому так важно должное внимание к своему здоровью.
Откажитесь от вредных привычек и «быстрого питания», добавьте больше физической активности в свою жизнь, хотя бы 30 минут в день посвящайте физическим упражнениям, пешим прогулкам на свежем воздухе. А еще не пропускайте профосмотры и вовремя обращайтесь к врачу.
Даже если проходить диспансеризацию один раз в три года, это позволит выявить имеющиеся проблемы со здоровьем, скорректировать их, пока не прозвенел колокол. Сейчас есть очень хорошие и доступные лекарства, которые могут не просто улучшить ситуацию, а реально повлиять на прогноз для жизни человека. Инфаркт можно предупредить, и не ценой каких-то невероятных усилий или средств. Надо быть лишь немного внимательнее к себе.
Поделиться
Как проводят диагностику
При подозрении на инфаркт легкого пациента осматривают пульмонолог и кардиолог. На первом этапе врач проводит опрос пациента и слушает его с помощью фонендоскопа. Насторожить должны мелкие хрипы, шум трепания плевры, систолические шумы и другие специфические признаки. У больного наблюдается учащенное дыхание, а при пальпации области живота обнаруживается увеличенная и болезненная печень.
Важное исследование – рентген легких. Делают снимки в прямой и боковой проекциях, выявляют выпот в плевральной полости, деформацию и расширение корня легкого. Состояние легочного кровообращения оценивают с помощью ангиопульмонографии – рентгена с контрастом, введенным в артерии.
Для полноты клинической картины необходимо сдать общий анализ крови и пройти ЭКГ. Пациента также могут отправить на ультразвуковую допплерографию нижних конечностей, чтобы оценить состояние вен, наличие тромбоза.
Неинвазивная вентиляция легких при остром инфаркте миокарда
Острая сердечная недостаточность (ОСН) при инфаркте миокарда (ИМ) — неспособность сердца, как насоса, перекачивать необходимый объем крови (минутный объем сердца (МОС) л/мин), адекватный метаболическим нуждам организма (обеспечение основного обмена), которая манифестируется тяжелыми гемодинамическими расстройствами и нарушением газообменной функции легкого. Несостоятельность насосной способности сердца, вследствие ишемического повреждения миокарда левого желудочка, ведет к развитию гипоксемии — раннему и постоянному признаку недостаточности кровообращения, лежащей в основе клинических признаков ОСН. В основе гипоксемического синдрома по механизму снижения насыщения крови кислородом участвуют две составляющие гипоксемии — центральная (кардиогенная — застой крови в легком) и периферическая (циркуляторная — замедление периферического тканевого кровотока).
В зависимости от выраженности клинических проявлений, согласно предложенной классификации T. Killip, J. Kimball, выделяют 4 степени ОСН при ИМ:
I степень — отсутствие клинических проявлений сердечной недостаточности;
II степень — хрипы в легких при аускультации, выслушиваемые на площади менее 50% легочных полей, или наличие тахикардии в сочетании с III тоном при аускультации сердца — систолический ри;
III степень — хрипы в легких при аускультации более 50% легочных полей в сочетании с ри;
IV степень — отек легкого, клиника кардиогенного шока [1].
Стандартная медикаментозная терапия (СМТ) острого инфаркта миокарда (ОИМ), осложненного ОСН, достаточно хорошо разработана и регламентирована. Госпитальная летальность ИМ, осложненного ОСН, составляет 24%, в тяжелых случаях, с необходимостью проведения искусственной вентиляции легких (ИВЛ) с помощью интубации трахеи, по данным отечественных и зарубежных авторов, достигает 52% [2, 3, 4, 6, 7, 8, 9, 12].
В последних фундаментальных работах, включающих метаанализ большого количества исследований ОСН, показана высокая эффективность основных методов неинвазивной (масочной) искусственной вентиляции легких (НИВЛ) при лечении кардиогенного отека легких (КОЛ), рефрактерного к СМТ: постоянное положительное давление в дыхательных путях (СРАР — Continuous Positive Airway Pressure), поддержка повышенным давлением на вдохе (PSV — Pressure Support Ventilation), поддержка повышенным давлением в конце выдоха (PEEP — Positive End-Expiratory Pressure) [13, 15, 19].
Руководство Британского торакального общества рекомендует использовать СРАР у пациентов с сохраняющейся гипоксемией на фоне комплексного медикаментозного лечения ОСН и резервировать использование двухуровневой вентиляции — PSV + PEEP для пациентов, у которых СРАР не принес улучшения [5].
В настоящее время в медицинской литературе представлены единичные сообщения, посвященные применению НИВЛ при лечении КОЛ у пациентов с ОИМ [16, 17, 18]. В этих публикациях было документировано, что сочетание поддержки вдоха с положительным давлением в дыхательных путях в конце выдоха (PSV + PEEP) более эффективно для снижения работы дыхания и уменьшения респираторного дистресса, чем только СРАР [10, 11, 14].
Все вышеизложенное явилось целью настоящей работы — изучение эффективности различных методов НИВЛ у пациентов с ОИМ, осложненным ОСН III–IV степени, рефрактерной к проведению стандартной медикаментозной терапии.
Материалы и методы. В изучаемую группу входили 94 пациента с ОИМ, средний возраст которых составил 67,4 ± 5,5 года. Критериями включения были: крупноочаговый ОИМ, осложненный ОСН III–IV степени по классификации Killip–Kimball, дыхательной недостаточностью и периферической гипоксемией (частота дыхательных движений (ЧДД) в покое > 25 в мин, НвО2 — чрескожно < 90%), сохраняющимися в течение 1 часа на фоне проводимой СМТ.
СМТ включало: кислород через носовые канюли или лицевую маску, дезагреганты и антикоагулянты, петлевые диуретики, нитроглицерин, ингибиторы АПФ, бета-блокаторы; пациентам с ОСН IV степени дополнительно назначали катехоламины.
С целью объективизации эффективности проводимого лечения, всем пациентам проводилось зондирование правых отделов сердца с измерением среднего давления в правом предсердии (ПП), систолического и диастолического давления в правом желудочке (СДПЖ, ДДПЖ), систолического и диастолического давления в легочной артерии (СДЛА, ДДЛА), давления заклинивания легочной артерии (ДЗЛА), с расчетом сердечного (СИ) и ударного индексов (УИ), индекса ударной работы левого и правого желудочка (ИУРЛЖ, ИУРПЖ), общего периферического сосудистого сопротивления (ОПСС), общего легочного сопротивления (ОЛС). До и после 60 мин НИВЛ проводился забор проб крови из легочной и периферической артерии с определением кислотно-щелочного состояния крови (КЩС), концентрации гемоглобина (Нв), напряжения кислорода и углекислого газа (рО2, рСО2), насыщения Нв кислородом (НвО2) и расчетом индекса доставки кислорода (ИДО2), индекса потребления кислорода (ИПО2), процента шунтирования крови в легких (Qs/Qt). НИВЛ проводили на аппарате РВ-7200 (USA) атмосферным воздухом (FiO2 — 21%) в трех режимах: СРАР, PSV и PSV + PEEP. В 85% случаях использовалась лицевая маска, а в 15% — назальная.
В зависимости от проводимого режима НИВЛ больные с ОИМ, осложненным ОСН, были распределены на три группы: группа А-1 масочная CPAP — 19 пациентов (11 мужчин, 8 женщин), средний возраст по группе — 59,7 ± 10,8 года; группа А-2 с режимом вентиляции PSV — 27 пациентов (24 мужчины и 3 женщины), средний возраст составил 68,3 ± 10,9 года; группа А-3 сочетанный режим вентиляции PSV + PEEP — 48 пациентов (34 мужчины и 14 женщин), средний возраст по группе — 60,7 ± 12,5 года. По возрасту пациенты групп А-1, А-2 и А-3 были сопоставимы и статистически не отличались друг от друга (р > 0,05).
В группе А-1 течение ОИМ осложнилось ОСН III степени у 15 пациентов, ОСН IV степени — у 4. В группе А-2 ОСН III степени регистрировалась у 22 пациентов, СН IV степени — у 5. В группе А-3 ОСН III степени отмечалась у 38 пациентов, СН IV степени — у 10. При режиме искусственной вентиляции PSV давление на вдохе в среднем составило 17,0 ± 5,9 см Н2О; при PEEP давление на выдохе в среднем составляло 5,4 ± 1,4 см Н2О; среднее инспираторное давление PSV + PEEP — 17,6 см Н2О.
Дозы и темп введения препаратов СМТ у всех пациентов до и во время НИВЛ были практически одинаковы (р > 0,05). При сравнении исходных показателей гемодинамики и газообмена между группами А-1, А-2 и А-3 не было отмечено достоверных различий (р > 0,05).
Статистическая обработка проводилась с использованием прикладного рабочего пакета статистического анализа Statistica v.6.0, использовались параметрические и непараметрические критерии достоверности.
Результаты лечения и их обсуждение. Динамика показателей центральной гемодинамики и газового состава крови у пациентов ОИМ с ОСН под влиянием различных режимов вспомогательной вентиляции при спонтанном дыхании (группы А-1, А-II, А-III) представлены в
,
,
.
Респираторная поддержка в режиме СРАР от 5,0 до 13 см Н2О приводила к клиническому улучшению у 93% пациентов, что выражалось в уменьшении возбуждения пациентов, снижении тахикардии и одышки, улучшении периферического кровообращения (изменении в положительную сторону цвета, температуры и влажности кожных покровов), при этом существенно уменьшались или полностью исчезали влажные застойные хрипы в легких. Положительная клиническая динамика сопровождалась статистически достоверными снижением преднагрузки (ДЗЛА мм рт. ст.) на 25% и постнагрузки (ОПСС) на 13,5% для левого желудочка на фоне уменьшения частоты сердечных сокращений (ЧСС) на 10,3%, ростом насосной функции левого желудочка (ИУРЛЖ) на 8,3%, снижением индекса работы правого желудочка на 13,3%.
Снижение ДЗЛА косвенно свидетельствовало о разгрузке малого круга кровообращения, что привело к достоверным положительным изменениям показателей газообмена: увеличению оксигенации артериальной (НвО2а, %) на 5,6% и смешанной венозной крови (НвО2ла, %) на 11,2% с статистически достоверным уменьшением шунтирования крови в легких на 43%. Уменьшение процента шунтирования крови в легких, с улучшением оксигенации артериальной крови, сопровождалось достоверным ростом доставки кислорода к исполнительным органам и тканям: ИДО2 увеличился на 6% (р < 0,0005) с достоверным снижением ИПО2 на 12,2% (р < 0,01), что связано с уменьшением работы дыхательной мускулатуры на фоне снижения ЧДД на 23,1%.
Таким образом, суммарно респираторная поддержка в виде СРАР со средним давлением 9,0 ± 0,3 см водного столба приводила к достоверному снижению ЧДД, ЧСС, гидростатического легочного капиллярного давления, шунтирования крови в легких, постнагрузки для левого желудочка и сопровождалась ростом оксигенации артериальной и венозной крови, ударного индекса и доставки кислорода к исполнительным органам и тканям.
Респираторная поддержка с помощью PSV также приводила к быстрому клиническому улучшению и стабилизации состояния пациентов в 91% случаев. Данные гемодинамики и газообмена представлены в .
Поддержка давлением на вдохе приводила к достоверному снижению гидростатического давления в легочном капилляре (ДЗЛА), систолического давления в легочной артерии и правом желудочке соответственно на 19,2%, 20% и 25%, что сопровождалось уменьшением работы правого желудочка на 16,2% и восстановлением эффективности работы левого желудочка сердца на 17,5%. Суммарно эти изменения способствовали достоверному снижению ЧСС на 7,4%.
Респираторная поддержка давлением на вдохе у пациентов группы А-2 приводила к эффективному улучшению показателей газообмена: уменьшению шунтирования крови в легких на 35,1%, восстановлению оксигенирующей функции легкого — нарастанию содержания кислорода в артериальной крови на 4,5%, увеличению доставки кислорода на 12,9% и уменьшению индекса потребления О2 на 7,2%. Статистически достоверное снижение ЧСС на 13,3% косвенно свидетельствует об улучшении газообменной функции легкого, подтверждаемом снижением РСО2 в артериальной крови на 5,6%. В свою очередь, уменьшение ЧДД способствует снижению энергозатрат на работу дыхательной мускулатуры, приводящему к уменьшению ИПО2.
Респираторная поддержка в режиме PSV + PEEP у пациентов группы А-3 также приводила к быстрому клиническому улучшению и стабилизации состояния в 92% случаях наблюдения. Положительная клиническая динамика подтверждалась объективными данными, представленными в .
Из таблицы видно, что НИВЛ в режиме PSV + PEEP сопровождалась достоверным уменьшением ЧСС на 14,2%, снижением гидростатического легочного капиллярного давления на 26%, при увеличении показателя работы левого желудочка на 14,4%, и повышением давления в правом предсердии на 83,3%. Увеличение давления в правом предсердии (показатель центрального венозного давления) обусловлено увеличением внутригрудного давления за счет повышенного давления на вдохе и выдохе дыхательного цикла НИВЛ (в среднем на 17,6 см Н2О), что сопровождается повышением сопротивления притоку крови к правому желудочку. Показатели артериального давления, сопротивлений большого и малого кругов кровообращения, давлений и работы правого желудочка достоверно не изменялись.
Из таблицы следует, что НИВЛ в режиме PSV + PEEP приводила к быстрому уменьшению одышки (ЧДД уменьшилось на 30%), улучшению показателей оксигенации артериальной и смешанной венозной крови соответственно на 6% и 9,8%, снижению степени шунтирования венозной крови в легких на 31,8% и увеличению доставки кислорода к исполнительным органам и тканям на 4%. Улучшение газообменной функции легкого документируется снижением рСО2 в артериальной крови на 7,8%.
При ретроспективном анализе (за один год) историй болезней больных ОИМ, осложненным ОСН, которым проводилась стандартная искусственная вентиляция легкого с помощью интубации трахеи, госпитальная летальность составила 39,6%. В наших исследованиях, в целом по группе больных ОИМ, осложненным ОСН, которым проводилась НИВЛ в различных режимах, госпитальная летальность составила 25,5% (24 пациента).
Заключение
При инфаркте миокарда имеет место нарушение сократительного состояния сердечной мышцы, ведущее к снижению насосной деятельности сердца и, как следствие, к повышению конечно-диастолического давления, в частности, в полости левого желудочка. Физиологически значимое увеличение конечно-диастолического давления левого желудочка или давления в левом предсердии неизменно приводит к ретроградному увеличению давления в сосудах легких и формирует посткапиллярную, пассивную легочную гипертензию. В соответствии с уравнением Старлинга, при повышении гидростатического давления в малом круге кровообращения происходит увеличение скорости фильтрации жидкости через микрососудистый эндотелий в легочном интерстиции. Когда жидкость фильтруется быстрее, чем удаляется лимфатической системой, происходит развитие периваскулярного, интерстициального, а затем и альвеолярного отека легких.
На первом этапе компенсации при повышении интерстициального давления происходит стимуляция J-рецепторов с увеличением объема вентиляции, что способствует увеличению оттока лимфы и, как следствие, минимизирует риск прогрессирующего внутритканевого отека и последующего альвеолярного наводнения.
С механической точки зрения, задержку жидкости в малом круге кровообращения можно представить как рестриктивные расстройства, проявляющиеся изменением легочных объемов, уменьшением эластических свойств легочной ткани за счет отека интерстиция, наводнения альвеол — функциональных единиц, что суммарно ведет к снижению газообменной функции легкого.
Гемодинамический фактор — повышение давления в венозном русле малого круга кровообращения при ОИМ — сопровождается гетерогенными нарушениями вентиляции легкого, носящими ретстриктивный (снижение эластичности легочной ткани) и обструктивный (повышение сопротивления дыхательных путей за счет отечности и спазма бронхов) характеры.
Прогрессивное уменьшение емкости легкого и его растяжимости приводят к росту отрицательного давления в плевральной полости, необходимого для осуществления вдоха; следовательно, к нарастанию «работы дыхания», увеличивая долю от минутного объема сердца, необходимую для энергетического обеспечения механики дыхания.
Все вышеперечисленные изменения ведут к нарушениям вентиляционно-перфузионных соотношений, лежащих в основе кардиогенно-дыхательной гипоксемии, которые усугубляются появлением дополнительных внутрилегочных шунтов кровотока, по объему достигающих более 10% от МОС.
У больных ОИМ, осложненным острой левожелудочковой недостаточностью, «работа дыхания» повышена из-за снижения растяжимости легочной ткани и повышения сопротивления дыхательных путей (интерстициальный и бронхиальный отеки), энергетические затраты на работу дыхания в условиях сниженного СИ достигают 30% от сердечного выброса. Следовательно, снизив энергетические затраты на работу дыхания с помощью НИВЛ, можно уменьшить долю СИ, направленную к дыхательной мускулатуре, перераспределив ее к другим отделам сердечно-сосудистой системы.
НИВЛ при спонтанном дыхании пациента с повышенным давлением в различных режимах (CPAP, PSV PEEP), помимо снижения работы дыхания, способствует «выдавливанию» жидкой части крови из альвеол и интерстиции легочной ткани в кровеносное русло, что обеспечивает более эффективный газообмен и нивелирует отрицательный эффект шунта в легком.
Таким образом, респираторная поддержка в различных режимах — СРАР, PSV и PSV + PEEP — оказалась эффективным методом лечения КОЛ, рефрактерного к стандартной медикаментозной терапии, у пациентов с ОИМ. На фоне НИВЛ наблюдалось клиническое улучшение и положительные изменения показателей не только гемодинамики, но и газообмена. Эффективность различных методик НИВЛ и характер их воздействия на такие показатели, как ЧДД, ЧСС, ПП, СДЛА, ДЗЛА, ИДО2, рО2а, рО2ла и Qs/Qt, оказались сходными. Отличие отмечено при использовании PSV и PSV + PEEP в степени влияния на рост ИУРЛЖ и снижение напряжения СО2 в артериальной крови.
Можно предполагать, что режимы респираторной поддержки с использованием PSV и PSV + PEEP будут более эффективны у пациентов с ОИМ, осложненным ОСН с сопутствующей гиповентиляцией и гиперкапнией.
Хотя оба метода — PSV и СРАР — демонстрируют сходную эффективность, с практической точки зрения СРАР дешевле и доступнее при применении в клинической практике, поэтому именно СРАР можно считать предпочтительным методом у пациентов, переносящих ОИМ с кардиогенным отеком легкого.
По вопросам литературы обращайтесь в редакцию.
А. М. Шилов, доктор медицинских наук, профессор С. П. Грачев, кандидат медицинских наук, доцент ММА им. И. М. Сеченова, Москва
Лечение и профилактика
Для устранения болевого синдрома больному назначают ненаркотические (реже наркотические) анальгетики. Для профилактики дальнейшего тромбоза применяют коагулянты. А чтобы стимулировать растворение уже образовавшихся тромбов – стрептокиназу и урокиназу, тканевый активатор плазминогена.
Если есть подозрение на постинфарктную пневмонию, назначают антибиотики. Препараты предписаны перорально и в виде капельниц. В случаях, когда консервативное лечение не дает ожидаемого эффекта, показано хирургическое вмешательство – эмболэктомия из легочной артерии.
Чтобы избежать проблемы в дальнейшем, рекомендуется не запускать и вовремя лечить тромбофлебиты. Поскольку инфаркт легкого в подавляющем большинстве случаев развивается именно на их фоне. Поэтому для профилактики необходимо:
- носить компрессионные чулки;
- делать лечебную гимнастику;
- регулярно посещать флеболога, если есть склонность к варикозу и тромбозам.
Если наблюдаете у себя симптомы инфаркта легкого, незамедлительно обратитесь к врачу. В медицинском вы получите консультацию пульмонолога. При необходимости вас осмотрят хирург и кардиолог. В клинике вы также сдадите анализы и пройдете необходимые исследования. При своевременно начатой терапии прогноз – благоприятный.