Причины варикоза пищевода
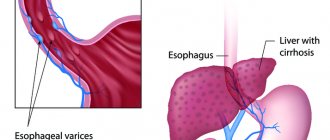
Заболевание развивается на фоне повышенного давления в портальной вене (она же воротная), но его возникновению могут способствовать другие патологии (гипертоническая болезнь, врожденные аномалии и так далее). Варикоз пищевода, причины которого кроются в патологических изменениях воротной вены, нередко начинает прогрессировать при ранее диагностированных тяжелых заболеваниях печени или поджелудочной железы – циррозе, опухолях, недостаточности. Болезнь нередко развивается и на фоне тяжелых заболеваний щитовидной железы, в таком случае речь будет идти о патологических нарушениях со стороны полой вены.
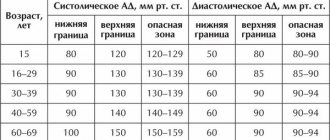
По статистике, варикоз пищевода чаще диагностируется у мужчин в возрасте 50 лет и старше.
КЛІНІЧНИЙ ДІАГНОЗ ПОРТАЛЬНОЇ ГІПЕРТЕНЗІЇ
При фізикальному дослідженні найпростіше виявити асцит, жовтяницю, павукоподібні ангіоми на шкірі, еритему долонь, атрофію яєчок, гінекомастію, контрактури Дюпюїтрена і атрофію м’язів. Можуть бути також прояви портосистемної енцефалопатії — у важких випадках астериксиз (ляпаючий або “пурхаючий” тремор кистей) і летаргія, у легких — дратівливість, порушення сну. У більшості хворих з ПГ виявляють також спленомегалію, хоча розмір селезінки погано корелює з портальним венозним тиском і її збільшення може бути викликане іншими захворюваннями. На гіпердинамічний стан можуть вказувати високий (скачучий) пульс, теплі, добре перфузовані кінцівки в поєднанні з артеріальною гіпотензією.
Ознаками портосистемних колатералей є дилятовані вени на передній поверхні живота (умбілікально-епігастральні шунти), “голова медузи” становить собою звивисті колатеральні вени навколо пупка. Внутрішні гемороїдальні вузли не є специфічною знахідкою, але також можуть бути проявом колатералізації. Натомість видимі колатеральні судини на спині вказують не на власне портальну гіпертензію, а на обструкцію на рівні нижньої порожнистої вени. Її рідкісною причиною може бути компресія нижньої порожнистої вени регенеративними вузлами при цирозі печінки.
Асцит легко виявити при великій кількості рідини — у таких випадках живіт тугий, можна виявити балотування рідини. Однак невеликий асцит діагностують інструментально, наприклад, з допомогою ультрасонографії. Парацентез допомагає встановити етіологію асциту: на його портальну (неперитонеальну) етіологію вказує сироватково-асцитичний градієнт альбуміну (SAAG) понад 1,1 г/дл (11 г/л). Однак цим методом не можна розрізнити печінкову і надпечінкову ПГ, наприклад, при застійній серцевій недостатності. Недавні дослідження вказують на зниження SAAG після встановлення трансюгулярних портосистемних шунтів (TIPS).
Лабораторні дослідження загалом не є специфічними щодо виявлення ПГ. Відзначають збільшення протромбінового часу і тромбоцитопенію. У хворих з цирозом печінки ці показники вважають предикторами наявності стравохідних вариксів (див. нижче). Гіпоальбумінемія вказує на важкість ураження печінки і непрямо — на ПГ. Подібно гіпонатріємія і низька концентрація натрію в сечі можуть бути наслідком ретенції води і натрію при портальному гіпертензивному синдромі.
Варикоз пищевода: симптомы
В зависимости от степени развития выделяют следующие признаки:
- Первая степень. Диаметр вен увеличен не более чем на 3 мм, возможно формирование единичных узлов. Диагностировать заболевание возможно только эндоскопическим методом, клинические признаки отсутствуют.
- Вторая степень. Достаточно опасный период варикоза пищевода – симптомы отсутствуют (даже слизистая органа пока остается без изменений), но одновременно с этим контур вен уже становится нечетким, при рентген-диагностике обнаруживаются утолщения на венах (предвестники узелков). Уже на этом этапе возможно кровотечение, которое при отсутствии немедленной медицинской помощи часто приводит к летальному исходу.
- Третья и четвертая степени варикоза пищевода характеризуются выраженной симптоматикой – больного часто беспокоит изжога, в области грудины возникают боли, возможна одышка, причем, не только при физической активности, но и в покое. Нередко заболевание диагностируется только на поздних стадиях своего развития, когда появляются первые кровотечения, кровь при этом выделяется непосредственно из пищевода или обнаруживается в рвотных массах.
Эндоскопическая диагностика, лечение и профилактика кровотечений портального генеза
Кровотечение из варикозно расширенных вен (ВРВ) пищевода – завершающее звено в последовательности осложнений цирроза печени. Летальность при первом эпизоде желудочно-кишечного кровотечения достигает 50%. Сегодня из всех доступных методов диагностики эзофагогастродуоденоскопия признана золотым стандартом как в выявлении ВРВ пищевода и желудка, так и в выборе лечебной тактики. Основными источниками кровотечения из верхних отделов пищеварительного тракта являются ВРВ пищевода, преимущественно его дистальных отделов. Лечение варикозного кровотечения включает три основных направления: лечение активного кровотечения (состоявшегося кровотечения), профилактику рецидива кровотечения и профилактику первого кровотечения. Эндоскопическое лечение считается частью комплексного терапевтического и хирургического лечения и направлено на остановку кровотечения или эрадикацию варикозных вен как потенциального источника кровотечения. Временные методы гемостаза направлены на остановку кровотечения высокой интенсивности для стабилизации состояния больного и последующего применения одного из методов окончательного гемостаза. Постоянный эндоскопический гемостаз при кровотечении из ВРВ пищевода и желудка может быть осуществлен с использованием нескольких технологий – лигирования, склеротерапии, введения клеевых композиций. Наиболее популярно эндоскопическое лигирование. В статье рассматриваются эндоскопические методы лечения и профилактики кровотечений из ВРВ пищевода в соответствии с национальными клиническими рекомендациями.
Рисунок. Эндоскопическая картина до (A) и после (Б) лигирования
Введение
По данным мировой статистики развитых стран, 90% случаев портальной гипертензии развивается на фоне цирроза печени (ЦП). Кровотечение из варикозно расширенных вен (ВРВ) пищевода – завершающее звено в последовательности осложнений ЦП, вызванных прогрессирующим фиброзом ткани печени, блоком тока крови через ее ткань, развитием синдрома портальной гипертензии, за которым следует сброс крови по путям коллатерального кровообращения, в том числе прогрессирующее расширение вен пищевода с их последующим разрывом. Сегодня усилия врачей направлены на предотвращение развития последовательных стадий портальной гипертензии и поиск терапевтических и хирургических методов, позволяющих радикально уменьшить давление в системе воротной вены и тем самым предупредить риск развития кровотечения из ВРВ пищевода. Другим подходом к предупреждению гастроэзофагеальных кровотечений портального генеза является использование местной эндоскопической терапии, направленной на эрадикацию ВРВ с целью профилактики их разрыва [1–4].
Угроза пищеводно-желудочного кровотечения считается основным, но, как правило, запоздалым показанием к хирургическому лечению синдрома портальной гипертензии у 25–35% больных ЦП. Летальность при первом эпизоде желудочно-кишечного кровотечения достигает 50%. У 60% пациентов, перенесших кровотечение из ВРВ пищевода и желудка в прошлом, в течение первого года возникает рецидив, вследствие которого умирают еще от 30 до 70% больных. Таким образом, именно гастроэзофагеальные кровотечения делают портальную гипертензию у больных ЦП хирургической проблемой. Неудовлетворительные результаты хирургического лечения больных с угрозой портального кровотечения послужили толчком к развитию малоинвазивных эндоскопических методик [3].
Эндоскопическая диагностика варикозного расширения вен пищевода и желудка
В настоящее время из всех доступных методов диагностики эзофагогастродуоденоскопия (ЭГДС) является золотым стандартом как в выявлении ВРВ пищевода и желудка, так и в выборе лечебной тактики. Эндоскопическое исследование позволяет определить не только наличие, но и локализацию варикозных вен, оценить степень их расширения, состояние стенки вен, слизистой оболочки пищевода и желудка, выявить сопутствующую патологию, а также стигматы угрозы кровотечения [2].
Независимо от степени выраженности ВРВ эндоскопическое исследование следует проводить очень аккуратно, принимая во внимание, что само исследование может спровоцировать манифест кровотечения. При этом следует обращать внимание на адекватность проведения местной анестезии, избегать форсированного проведения аппарата и быстрой инсуффляции воздуха в просвет желудка, предупреждая срыгивание воздуха и избыточные рвотные позывы. Приступая к исследованию, надо убедиться в готовности проведения эндоскопического гемостаза в случае кровотечения. Приоритетным считается использование ультратонких аппаратов и трансназального исследования.
Для оценки степени выраженности ВРВ пищевода применяют две равнозначные классификации. Более ранняя классификация K.J. Paquet (1983) предусматривала четыре степени заболевания:
- 1-я степень: единичные эктазии вен (верифицируются эндоскопически, но не определяются рентгенологически);
- 2-я степень: единичные хорошо отграниченные стволы вен, преимущественно в нижней трети пищевода, которые при инсуффляции воздуха отчетливо выражены. Просвет пищевода не сужен, слизистая оболочка пищевода над расширенными венами не истончена;
- 3-я степень: просвет пищевода сужен за счет выбухания ВРВ в нижней и средней третях пищевода, которые частично спадаются при инсуффляции воздуха. На верхушках ВРВ определяются единичные красные маркеры или ангиоэктазии;
- 4-я степень: в просвете пищевода множественные варикозные узлы, не спадающиеся при сильной инсуффляции воздуха. Слизистая оболочка над венами истончена. На верхушках вариксов определяются множественные эрозии и/или ангиоэктазии (супервариксы).
В 1997 г. N. Soehendra и K. Binmoeller предложили классификацию ВРВ отдельно для пищевода и желудка.
Варикозное расширение вен пищевода:
- 1-я степень: диаметр вен не превышает 5 мм, вытянутые, располагаются только в нижней трети пищевода;
- 2-я степень: диаметр вен от 5 до 10 мм, извитые, расположены в средней трети пищевода;
- 3-я степень: диаметр более 10 мм, напряженные, с тонкой стенкой, расположены вплотную друг к другу, на поверхности вен «красные маркеры».
Варикозное расширение вен желудка:
- 1-я степень: диаметр вен не превышает 5 мм, плохо различимы над слизистой оболочкой желудка;
- 2-я степень: диаметр от 5 до 10 мм, единичные, полипоидного вида;
- 3-я степень: диаметр более 10 мм, в виде обширных конгломератов узлов полипоидного вида с истончением слизистой оболочки.
При ВРВ желудка выделяют два основных типа поражения в зависимости от локализации вен и распространенности поражения с вовлечением пищевода. Сочетанные поражения пищевода и желудка (Gastroesophageal Varices – GOV):
- тип I – гастроэзофагеальные ВРВ с распространением на кардиальный и субкардиальный отделы малой кривизны желудка (GOV 1);
- тип II – гастроэзофагеальные ВРВ от эзофагокардиального перехода по большой кривизне по направлению к дну желудка (GOV 2).
Изолированный желудочный варикоз (Isolated Gastric Varices – IGV) подразделяется на изолированное поражение фундального отдела желудка (IGV 1) и форму с преимущественным поражением антрального отдела (IGV 2) [1].
Основными источниками кровотечения из верхних отделов пищеварительного тракта являются ВРВ пищевода, преимущественно его дистальных отделов. ВРВ желудка встречаются реже и обычно хуже диагностируются из-за особенностей строения слизистой оболочки, сложности осмотра кардии в положении ретрофлексии, особенно на фоне продолжающегося кровотечения. Расширение венул и капилляров слизистой оболочки и подслизистого слоя желудка приводит к портальной гипертензивной гастропатии, которая при эндоскопическом исследовании характеризуется наличием очагов красных пятен на слизистой оболочке, гиперемией, мозаичностью рисунка слизистой оболочки, а в более тяжелых случаях диффузными темно-красными пятнами или внутрислизистыми геморрагиями. Считается, что до 25% кровотечений может быть обусловлено гастропатией.
Стратегия комплексного лечения пациентов с портальным кровотечением на фоне цирроза печени
Лечение варикозного кровотечения включает три главных направления:
- лечение активного кровотечения (состоявшегося кровотечения);
- профилактику рецидива кровотечения;
- профилактику первого кровотечения.
Безусловно, эндоскопическое лечение является лишь частью комплексного терапевтического и хирургического лечения и направлено на остановку кровотечения или эрадикацию ВРВ как потенциального источника кровотечения.
При выборе лечебной тактики у больных ЦП необходимо оценить ее функциональное состояние. Для этого применяется классификация Чайлда – Пью.
При циррозе печени функциональных классов А и В проведение хирургического вмешательства, направленного на снижение портальной гипертензии, считается возможным. При декомпенсированном ЦП (класс С) риск операции предельно высок, и при возникновении кровотечений из ВРВ пищевода и желудка приоритет следует отдавать консервативным или миниинвазивным методам лечения.
Основными причинами пищеводно-желудочных кровотечений при портальной гипертензии являются:
- гипертонический криз в портальной системе (повышение портосистемного градиента > 12 мм рт. ст.);
- трофические изменения слизистой оболочки пищевода и желудка вследствие нарушения гемоциркуляции и воздействия кислотно-пептического фактора;
- нарушения свертывающей системы.
Единого мнения, какой из этих факторов основной, в настоящее время не существует [1, 5–7].
Главные задачи лечения – остановка кровотечения, возмещение кровопотери, лечение коагулопатии, предотвращение рецидивов кровотечения, ухудшения функции печени и осложнений, обусловленных кровотечениями (инфекции, печеночная энцефалопатия и т.д.) [1, 5–7].
Отметим, что за последние несколько лет стандарты претерпели изменения. Ряд положений получил подтверждение с позиции доказательной медицины. При наличии кровотечения первостепенными задачами лечения являются остановка кровотечения и стабилизация гемодинамики путем восполнения объема циркулирующей крови с использованием свежезамороженной плазмы.
Оказание помощи при остром кровотечении из ВРВ пищевода у больных ЦП следует начинать с применения вазоактивных препаратов. Препаратом выбора считается терлипрессин (Реместип, «Ферринг»). При остром кровотечении рекомендуется внутривенное струйное введение препарата в дозе 1,0 мг (10 мл) с интервалом 4–6 часов до остановки кровотечения. Введение препарата продолжается в течение последующих 3–5 дней с его отменой при условии отсутствия кровотечения в течение 24–48 часов. Важный момент: способ введения терлипрессина позволяет применять его на этапе догоспитальной медицинской помощи [8].
В настоящее время накоплена достаточная доказательная база применения терлипрессина при остром кровотечении из ВРВ пищевода у больного ЦП. Через пять минут после внутривенного струйного введения 2 мг терлипрессина достоверно (на 30%) снижается градиент венозного давления в печени и кровоток в воротной вене.
Кроме того, в плацебоконтролируемых исследованиях показано, что применение терлипрессина позволяет остановить кровотечение из ВРВ пищевода в течение 12 часов у 70% больных ЦП. Коэффициент выживаемости через месяц после острого кровотечения из ВРВ пищевода по сравнению с группой плацебо достоверно выше – 90 и 62% соответственно [9].
Обратите внимание: наряду с назначением вазоактивных препаратов с первых дней рекомендуется проводить антибактериальную терапию для профилактики портально-системной энцефалопатии. При снижении уровня гемоглобина крови
На фоне проводимой терапии сразу при поступлении в стационар проводится эндоскопическое исследование, целью которого является установление источника кровотечения и эндоскопический гемостаз. При неэффективности эндоскопического гемостаза или массивном кровотечении показано проведение баллонной тампонады как временного метода гемостаза. При неэффективности комплексной терапии и эндоскопического гемостаза, раннем рецидиве кровотечения рассматривается вопрос о наложении трансъюгулярного портосистемного шунта или оперативном вмешательстве.
Эндоскопическое лечение и профилактика кровотечений портального генеза
Методы гемостаза, применяемые при остановке кровотечений портального генеза, можно разделить на временные и постоянные. Временные направлены на остановку кровотечения высокой интенсивности для стабилизации состояния больного и последующего применения одного из методов окончательного гемостаза. Временный гемостаз достигается установкой зонда-обтуратора Сенгстакена – Блэкмора или стента Даниша.
После постановки диагноза «кровотечение из ВРВ пищевода или желудка» и извлечения эндоскопа незамедлительно вводят зонд-обтуратор Сенгстакена – Блэкмора и раздуваются манжетки, за счет чего достигается надежный гемостаз.
Больные тяжело переносят процедуру введения зонда в носоглотку (равно как и пребывание его в носоглотке в течение нескольких часов), поэтому перед его введением обязательно проводится премедикация (1,0 мл 2%-ного раствора промедола).
Зонд-обтуратор вводят через носовой ход, заводя желудочный баллон глубоко в желудок. Предварительное измерение расстояния от мочки уха до мечевидного отростка позволяет правильно расположить зонд-обтуратор в пищеводе и желудке. Затем при помощи градуированного шприца, присоединенного к катетеру желудочного баллона, в последний вводят воздух 150 см3 (но не воду!) и катетер перекрывают зажимом. Зонд подтягивают до ощущения упругого сопротивления, что обеспечивает сдавление вен в зоне кардии. После этого зонд фиксируют к верхней губе липким пластырем.
Пищеводный баллон раздувают редко, только если продолжается срыгивание кровью. В противном случае достаточно раздувания только желудочного баллона. Воздух в пищеводный баллон вводят небольшими порциями, первоначально 60 см3, впоследствии – по 10–15 см3 с интервалом 3–5 минут. Соблюдение этих условий необходимо для того, чтобы дать возможность органам средостения адаптироваться к их смещению раздутым баллоном. Общее количество нагнетаемого воздуха в пищеводном баллоне доводят обычно до 80–100 см3 в зависимости от выраженности дилатации пищевода и переносимости пациентом давления баллона на средостение.
После установки зонда аспирируют желудочное содержимое и промывают желудок холодной водой. Контроль за кровотечением осуществляется путем динамического наблюдения за желудочным содержимым, поступающим по зонду после тщательного промывания желудка. Во избежание пролежней на слизистой оболочке пищевода через четыре часа пищеводный баллон распускают и, если в этот момент в желудочном содержимом примесь крови не появляется, пищеводную манжетку оставляют спущенной. Желудочную манжетку распускают позже – через 1,5–2 часа. У больных с удовлетворительной функцией печени зонд должен находиться в желудке еще в течение 12 часов для контроля за желудочным содержимым. После удаления зонда-обтуратора необходимо сразу рассмотреть вопрос о выполнении одного из вариантов постоянного эндоскопического гемостаза. В случае рецидива кровотечения зонд-обтуратор должен быть введен вновь, баллоны раздуты, а больному ЦП (классы А и В) предложена операция или эндоскопический гемостаз, поскольку возможности консервативной терапии считаются исчерпанными [1].
При неэффективности временного гемостаза с использованием зонда Сенгстакена – Блэкмора в качестве альтернативной технологии можно применить установку стента Даниша. Это пластиковый самораскрывающийся покрытый стент, для имплантации которого не требуется проведения эндоскопического или рентгенологического контроля. Степень компрессии раскрытого стента позволяет достигать надежного гемостаза в срок от двух до 14 дней. Пероральное питание можно осуществлять непосредственно после установки стента. Впоследствии стент удаляют и решают вопрос о дальнейшем лечении и необходимости проведения окончательного гемостаза.
Постоянный эндоскопический гемостаз при кровотечении из ВРВ пищевода и желудка может быть осуществлен с использованием нескольких технологий – лигирования, склеротерапии, введения клеевых композиций. Помимо достижения окончательного гемостаза показаниями к вмешательствам подобного рода являются профилактика первого эпизода кровотечения (первичная профилактика) и профилактика рецидива кровотечения (вторичная профилактика) из ВРВ пищевода у больных с портальной гипертензией при невозможности хирургического лечения.
Для лигирования ВРВ используется специальное устройство – лигатор. Лигатор состоит из нескольких частей: дистального колпачка с лигатурами, винта-рукоятки, при помощи которого сбрасываются лигирующие кольца, и соединяющей их металлической или капроновой струны, которая проводится через инструментальный канал. Дистальный колпачок сделан из ригидного прозрачного пластика, надевается на дистальный конец эндоскопа. На наружной поверхности колпачка расположены растянутые латексные кольца-лигатуры. Процесс освобождения (сбрасывания) кольца-лигатуры осуществляется путем натягивания закрепленной на нем нити. Устройство собирается непосредственно перед использованием в единую конструкцию. В своей работе мы чаще используем лигирующую систему Speedband Superview Super7TM. Такой выбор обусловлен максимальным удобством и безопасностью данной системы благодаря ее конструктивным особенностям. У данной лигирующей системы натягивающаяся нить располагается в специальном канале колпачка, что исключает ее попадание в поле зрения и срабатывание автоматической светокоррекции эндоскопа. Это в свою очередь значительно улучшает визуализацию, а следовательно, и безопасность самой процедуры.
Операцию проводят под внутривенной анестезией. Спокойное состояние больного позволяет минимизировать технические трудности на этапе проведения дистального конца аппарата с лигирующим устройством в просвет пищевода, а также является важным моментом профилактики кровотечения и разрыва варикса при лигировании.
Проведение аппарата в пищевод может сопровождаться определенными трудностями. Колпачок с лигатурами на дистальном конце эндоскопа обладает ригидностью и встречает естественное сопротивление на уровне грушевидного синуса и нижнего глоточного сфинктера. Аппарат проводится до области пищеводно-желудочного перехода при минимальной инсуффляции воздуха во избежание срыгивания и разрыва вариксов. Детальный осмотр желудка с диагностической целью, особенно в инверсионном положении, нецелесообразен. Дистальный колпачок с предустановленными кольцами значительно сужает поле зрения и его освещенность. К моменту принятия решения о лигировании диагностические вопросы должны быть полностью решены. При необходимости контрольного диагностического исследования его лучше провести непосредственно перед лигированием.
После проведения эндоскопа с лигирующим устройством приступают к лигированию, при этом начинают с области эзофагокардиального перехода, чуть выше зубчатой линии.
Кольца накладываются по спирали. Необходимо избегать наложения лигатурных колец в одной плоскости по окружности для профилактики дисфагии в ближайшем и отдаленном периодах.
Выбранный варикозный узел на аспирации максимально втягивается в просвет лигирующего колпачка. После этого лигатуру сбрасывают на основание узла. Тогда становится видно, что лигированный узел меняет окраску на синюшную. Необходимо возобновить подачу воздуха и несколько извлечь эндоскоп: данные манипуляции позволяют удалить лигированный узел из цилиндра. В зависимости от степени выраженности ВРВ за сеанс накладывается до десяти лигатур (см. рисунок).
Лигирование ВРВ при продолжающемся или состоявшемся кровотечении имеет некоторые технические особенности. Первую лигатуру необходимо накладывать на источник кровотечения. Затем лигируются остальные ВРВ.
В первые сутки после лигирования назначают только питье холодной воды, со вторых суток – определенное питание (стол № 1). Следует избегать больших глотков. Пища должна быть прохладной, жидкой или протертой. При болях целесообразно назначать Алмагель А с местным анестетиком. При интенсивных болях за грудиной рекомендуется применение анальгетиков группы нестероидных противовоспалительных препаратов. Болевой синдром обычно купируется к третьим суткам.
Со вторых по седьмые сутки после лигирования узлы некротизируются, уменьшаются в размерах, густо покрываются фибрином с последующим отторжением некротических тканей вместе с лигатурами и образованием поверхностных изъязвлений. Язвы заживают к 14–21-му дню, оставляя звездчатые рубчики без стеноза просвета пищевода. К концу второго месяца после лигирования подслизистый слой замещается рубцовой тканью, а мышечный остается интактным.
В отсутствие осложнений контрольная ЭГДС выполняется через месяц после операции. Дополнительные сеансы лигирования назначаются при недостаточности первого сеанса, а также при возникновении со временем новых стволов варикозных вен.
Эндоскопическое склерозирование ВРВ пищевода основано на облитерации варикозных вен после введения в просвет вены склерозанта через эндоскоп с помощью длинной иглы. Наряду с интравазальным способом склеротерапии существует метод паравазального введения склерозанта, в результате чего происходит сдавление варикозных узлов – первоначально за счет отека, а затем за счет образования соединительной ткани.
Для интравазального введения чаще используют натрия тетрадецилсульфат (Тромбовар) 5–10 мл на одну инъекцию. Применяется также 3%-ный раствор Этоксисклерола. После введения склерозанта необходимо сдавить вену в местах пункции. Это обеспечит образование тромба в результате отека эндотелия сосуда. За один сеанс тромбируют не более двух варикозных стволов вен во избежание усиления застоя в варикозных венах желудка. Для паравазального введения из склерозирующих агентов обычно используется Этоксисклерол, который содержит 5–20 мг полидоканола в 1 мл этилового спирта. Чаще применяется Этоксисклерол 0,5%. При каждой инъекции вводят не более 3–4 мл склерозанта. Обычно осуществляют от 15 до 20 инъекций. За один сеанс расходуется до 24–36 мл склерозанта. Вводимый по инъектору склерозант создает по обеим сторонам варикозной вены плотный отек, сдавливающий сосуд.
Процедура выполняется под внутривенной анестезией. Склеротерапия начинается от области эзофагокардиального перехода и продолжается в проксимальном направлении.
По окончании сеанса склеротерапии варикозные вены практически не определяются в отечной слизистой оболочке. Подтекание крови из мест проколов обычно незначительно и не требует принятия дополнительных мер.
Ближайший период после сеанса склеротерапии обычно не сопровождается болевыми ощущениями. Больному разрешают пить и принимать жидкую пищу через 6–8 часов после процедуры.
После первого сеанса склеротерапии через пять дней процедуру повторяют. При этом стараются охватить участки пищевода с ВРВ, которые оказались вне зоны действия первого сеанса склеротерапии. Третий сеанс склеротерапии проводят через 30 дней. При этом оценивают эффективность проводимого лечения, динамику уменьшения степени ВРВ и отсутствие угрозы кровотечения. Четвертый сеанс склеротерапии назначают через три месяца.
Глубокий рубцовый процесс в подслизистом слое пищевода и желудка при повторных сеансах склеротерапии предотвращает возможность развития предсуществующих венозных коллатералей и варикозной трансформации. Лечение продолжается до достижения эффекта эрадикации либо положительного результата. Для этого требуется в среднем четыре-пять сеансов склеротерапии в год. Динамический контроль осуществляется в последующем один раз в шесть месяцев. При необходимости лечение повторяется.
В настоящее время после внедрения в клиническую практику методики лигирования варикозных вен многоэтапная склеротерапия, сопровождающаяся большим числом осложнений, не является методом первой линии эндоскопического гемостаза и профилактики кровотечения и используется в комбинации с лигированием в качестве пособия, позволяющего добиться радикальности вмешательства
В случаях, когда склеротерапия не позволяет остановить кровотечение (при варикозном расширении вен желудка), применяют цианоакрилатные клеевые композиции. Используют два тканевых клея: N-бутил-2-цианоакрилат (гистоакрил) и изобутил-2-цианоакрилат (букрилат). При попадании в кровь цианоакрилат быстро полимеризуется (20 секунд), вызывая облитерацию сосуда, за счет чего достигается гемостаз. Через несколько недель после инъекции клеевая пробка отторгается в просвет желудка.
Время проведения инъекции ограничено 20 секундами из-за полимеризации гистоакрила. Несоблюдение данного условия приводит к преждевременному застыванию клея в инъекторе, что не позволяет широко применять данный метод в лечении и профилактике кровотечений из ВРВ пищевода и желудка.
Заключение
Решение клинической проблемы кровотечения из ВРВ пищевода требует слаженных действий специалистов различных специальностей: гепатологов, эндоскопистов, хирургов, а постоянное совершенствование профессиональных знаний и практических умений врачей позволят сохранить жизнь наших пациентов.
Лечение
Лечение варикоза вен пищевода начинается с выяснения истинных причин развития заболевания. Если диагностируется патология печени, щитовидной или поджелудочной железы, то обязательно проводится ее лечение – нужно ликвидировать провоцирующий фактор или ослабить его влияние. Из лекарственных препаратов назначают витаминные комплексы, антациды и вяжущие средства. Если диагностировано кровотечение, то всегда есть риск повторного его развития. В таком случае назначают:
- переливание крови;
- кровоостанавливающие препараты;
- введение специального зонда, которым можно сдавить сосуды.
Варикоз пищевода, кровотечение при котором наблюдается слишком часто, требует оперативного метода лечения.
Хирургическое вмешательство проводится также при отсутствии эффекта от терапевтического лечения. Купируется ли в этом случае варикоз пищевода? Прогноз более благоприятный – выживаемость больных увеличивается в 3 раза. После любого лечения нужно соблюдать диетические рекомендации врачей, регулярно проходить обследования и исключать чрезмерные физические нагрузки.
Более подробно о том, что такое варикоз пищевода и к какому врачу следует обращаться, можно узнать на страницах нашего сайта Добробут.ком.
2.Каковы симптомы кровотечения из варикозно расширенных вен?
Как мы уже говорили, сами по себе варикоз вен пищевода не вызывает никаких неприятных ощущений. Но если происходит разрыв вены и начинается кровотечение, это опасно и требует неотложной медицинской помощи. Симптомами варикозного расширения вен пищевода или желудка и начала кровотечения из них может быть:
- Рвота с кровью;
- Черный или кровянистый стул;
- Низкое артериальное давление;
- Учащенное сердебиение;
- Шок (в особо серьезных случаях).
Посетите нашу страницу Гастроэнтерология
Диагностика
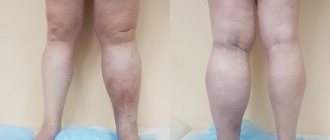
Базовое обследование для подтверждения диагноза варикозной болезни нижних конечностей, уточнения степени и характера нарушений включает (5, англ.):
- Клинический осмотр. Флеболог определяет ход и состояние видимых поверхностных вен, изменения кожи и мягких тканей, наличие отеков. Проводятся функциональные пробы, позволяющие оценить вертикальный рефлюкс и выявить примерный уровень горизонтального рефлюкса. Опрос пациента, направлен на уточнение предрасполагающих и провоцирующих факторов, давность и особенности развития заболевания.
- Ультразвуковое исследование. При варикозе наибольшей информативностью обладает не обычное УЗИ, а оценка кровотока с помощью УЗДГ (УЗДС). Исследование показывает скорость движения крови, наличие патологических вено-венозных забросов, нарушения проходимости сосудов. Такая информация необходима врачу для подбора необходимой схемы лечения.
- Гемостазиограмма (анализы крови для комплексной оценки свертывающей системы).
Подготовка к минифлебэктомии. Нанесение разметки на перфоранты голени, проведение УЗДГ исследования вен.
По показаниям проводится мультиспиральная компьютерная томография (МС КТ) — высокотехнологичное исследование в некоторых случаях становится основной методикой для определения картины поражения венозной системы.
В современной медицине применяются и другие диагностические методики – плетизмография, лазерная доплеровская флоуметрия. Они не доступны широкому кругу пациентов, полученные результаты обычно не являются критичными при определении лечебной тактики. Обычно достаточно базового обследования, которое при необходимости дополняется консультациями узких специалистов (эндокринолога, гематолога, кардиолога и других). Ранее выделяли несколько стадий варикоза ног. В настоящее время при постановке диагноза флебологи пользуются классификацией хронических заболеваний вен CEAP, которая включает характеристику случая по клиническому, этиологическому, анатомическому и патофизиологическим признакам.
ОЦІНКА ПОРТАЛЬНОЇ ГІПЕРТЕНЗІЇ
Найкращим, хоч і непрямим, методом оцінки портального тиску вважається вимірювання тиску заклинювання в печінкових венах — ТЗПВ (wedged hepatic venous pressure — WHVP), який вимірюється шляхом заведення балонного катетера (з яремного, плечового або стегнового доступу) під флюороскопічним наведенням у печінкову вену і “заклинення” його в малій гілці (введення до упору) або (що вважають ще ліпшим) — шляхом роздування балона і оклюзії більшої гілки печінкової вени. Завжди виконується корекція WHVP з урахуванням підвищення внутрішньочеревного тиску (наприклад при асциті) шляхом віднімання вільного тиску в печінковій вені — ВТПВ (free hepatic vein pressure — FHVP) або внутрішньочеревного тиску в порожнистій вені, які вважають внутрішнім нульовим рівнем. Його вимірюють при спущеному балоні. Отримане значення є градієнтом тиску в печінковій вені — ГТПВ (the hepatic venous pressure gradient — HVPG). Показник, як звичайно, вимірюється тричі; якщо він визначений технічно правильно, то є добре відтворюваним і дуже надійним. Оскільки вимірюється градієнт тиску між синусоїдами (а не гілками ворітної вени) і печінковою веною, ГПВТ буде підвищеним при внутрішньопечінкових причинах портальної гіпертензії, таких як цироз, однак нормальним при передпечінкових причинах, таких як тромбоз портальної вени. Нормальні показники ГПВТ — 3–5 мм рт. ст. Було доведено, що WHVP дуже тісно корелює з портальним тиском як при алкогольних, так і неалкогольних цирозах. ГПВТ і зміни його показників, які відбуваються протягом певного часу, мають передбачувальну цінність щодо розвитку варикозного розширення вен стравоходу, ризику варикозної кровотечі, розвитку неварикозних ускладнень портальної гіпертензії і смерті. Одиночні вимірювання корисні для прогнозу як компенсованого, так і декомпенсованого цирозу, тоді як повторні вимірювання застосовують для моніторингу ефективності медикаментозної терапії і перебігу захворювання печінки. Обмеженнями для широкого використання вимірювань ГПВТ є відсутність відповідного досвіду у практикуючих лікарів і недотримання ними рекомендацій, які дають змогу отримувати надійні і відтворювані показники, а також інвазійність процедури.
Дуплексна допплерівська ультрасонографія
Ультрасонографія є безпечним, недорогим і ефективним методом скринінгу ПГ. Вузлувата структура печінки, спленомегалія і наявність колатеральної циркуляції дають підстави підозрювати цироз печінки і ПГ. Вивчають також діаметр спланхнічних судин, напрям і швидкість кровоплину, зміни діаметра судин при диханні, індекс портального венозного застою, індекс пульсативності та індекс резистентності печінкової, верхньої брижової і селезінкової артерій та печінковий судинний індекс. У нормі діаметр ворітної вени не перевищує 13 мм при спокійному диханні, при глибокому він може збільшуватися на 50%. Розширеною вважають вену з діаметром >15 мм при спокійному диханні. При підвищенні тиску кровоплин у ворітній вені уповільнюється і стає монотонним (без дихальних коливань) і врешті-решт повністю зворотним, спрямованим у бік функціонуючих портокавальних шунтів.
Однак відтворюваність кількісних ультразвукових параметрів, їх точність недостатня, вони залежать як від техніки дослідження, так і від добових ритмів, стану симпатичної нервової системи, медикації тощо. Так, наприклад, діаметр ворітної вени може збільшуватися при тривалій застійній серцевій недостатності (водночас із нижньою порожнистою веною). Тому саму по собі дуплексну допплерівську ультрасонографію не рекомендують застосовувати для встановлення точного діагнозу ПГ, неясним залишається її діагностичне значення саме для ранніх стадій ПГ (у більшості таких досліджень обстежувалися пацієнти з важким цирозом і вираженою ПГ). І все ж таки цей метод цінний для первинного обстеження, він також допомагає виявити етіологію ПГ, наприклад, обструкцію судин на різному рівні, високочутливий щодо виявлення функціонуючих портокавальних анастомозів. Після накладання TIPS або портокавальних анастомозів допплерівська ультрасонографія відіграє велике значення у контролі прохідності шунта.
Комп’ютерна томографія є тестом з якісним (не кількісним) значенням, якщо ультрасонографія не дала чітких результатів. На відміну від ультрасонографії, на результати КТ не впливає наявність газу в кишківнику. Реконструкція будови судинного дерева з допомогою 3-D технології дає змогу точно відтворити будову портальної венозної системи і колатералей. Частою знахідкою при портальній гіпертензії під час КТ є дилятація нижньої порожнистої вени. Однак КТ не дає змоги оцінити потік крові по венозних і артеріальних судинах. МЯР дає змогу, крім якісної, також отримати певну кількісну інформацію, наприклад, оцінити венозний потік по ворітній і непарній венах. Однак вона не виключає необхідності інвазивних досліджень.
У випадках сумніву в генезі ураження печінки доцільною може бути її пункційна біопсія: некроз третьої зони, наприклад, свідчить про портальну гіпертензію, вторинну до серцевої недостатності, а нормальна паренхіма печінки — про підпечінкову причину ПГ. Протипоказанням для біопсії печінки є коагулопатія і виражений асцит.
Таблиця 1. Причини портальної гіпертензії та градієнт тиску в печінковій вені
| ГТПВ | |||
| Рівень оклюзії | Нормальний | Нормальний або підвищений | Підвищений |
| Підпечінкові синдроми ПГ | Тромбоз ворітної вени Тромбоз селезінкової вени Спланхнічна артеріовенозна фістула | ||
| Внутрішньопечінкові синдроми ПГ Переважне ураження на пресинусоїдальному рівні | Шистосомоз, первинний біліарний цироз, ідіопатична ПГ (рання стадія)* Вузлова регенеративна гіперплазія* | Мієлопроліферативні захворювання*† Полікістозна хвороба*† Метастази в печінку*† Гранульоматозні захворювання † (саркоїдоз, туберкульоз)*† | |
| Переважне ураження на синусоїдальному або постсинусоїдальному рівні | Синдром Бадда-Кіарі‡ | Цироз печінки Шистосомоз, первинний біліарний цироз, ідіопатична ПГ (пізня стадія) Гострий і фульмінантний гепатит Гострий алкогольний гепатит Хвороба Вільсона Венооклюзійна хвороба Синдром Бадда-Кіарі‡ | |
| Постпечінкові синдроми ПГ | Обструкція нижньої порожнистої вени Правошлуночкова серцева недостатність Стискаючий перикардит Недостатність тристулкового клапана | ||
* Рідкісні причини ПГ. † За умови ураження синусоїдів. ‡ Ураження синусоїдів слабке.