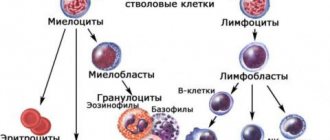
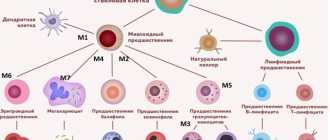
Апластическая анемия – серьёзное нарушение формирования, развития и созревания клеток крови. Оно характеризуется угнетением кроветворной функции костного мозга, что проявляется дефицитом образования белых и красных кровяных клеток, а также тромбоцитов. Иногда наблюдается недостаток формирования только эритроцитов. Заболевание считается одним из самых тяжёлых расстройств гемопоэза и при отсутствии адекватного лечения может стать причиной летального исхода в течение нескольких месяцев. Оно в одинаковой степени поражает пациентов мужского и женского пола в возрасте от десяти до двадцати пяти лет или старше пятидесяти. Согласно медицинской статистике каждый год диагностируют два случая патологии на один миллион человек.
Пройти диагностику и лечение апластической анемии в Москве предлагает отделение гематологии ЦЭЛТ. Наша многопрофильная клиника одна из первых в РФ начала деятельность на рынке платных медицинских услуг и успешно продолжает её уже третье десятилетие. В отделении гематологии ведут приём ведущие отечественные специалисты, в арсенале которых имеется современная лечебно-диагностическая база, позволяющая точно ставить диагноз и проводить лечение в соответствии с международными стандартами. Стоимость услуг доступна в нашем прайс-листе, который мы регулярно обновляем. Во избежание недоразумений просим Вас уточнять цифры у операторов нашей информационной линии.
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая – под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
- Воздействии ионизирующего излучения или химических веществ в виде ароматических соединений, мышьяка, пестицидов;
- Попадании в организм инфекционных агентов (возбудители гепатитов “D”, “B”, цитомегаловируса, ДНК-содержащего вируса Эпштейна-Барр);
- Приёме миелотоксических препаратов при прохождении курса лечения транквилизаторами, противосудорожными, антитиреоидными и антиопухолевыми средствами;
- Развитии ряда аутоиммунных процессов (красная системная волчанка, поражение соединительной ткани – синдром Шегрена).
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Патогенез заболевания
Апластическая анемия вызвана подавлением процесса производства кровяных телец в костном мозге. Возможен повышенный уровень разрушения и уничтожения клеток собственными антигенами. Изучается механизм апоптоза (самопроизвольного уничтожающего процесса эритроцитов). Его приравнивают к «запрограммированному суициду».
- Установлена повышенная активность ферментов деструктивного действия в крови, дефицит нуклеиновых кислот. Разрушение эритроцитов наблюдается внутри костного мозга на всех уровнях созревания. Снижается продолжительность жизни красных кровяных клеток. Поскольку утилизация железа нарушается, излишки откладываются в печени и селезенке. Образуется повышение уровня гормона эритропоэтина, но костный мозг не реагирует на его приказы.
- Со снижением гранулоцитов блокируется их функция по участию в иммунной защите организма. Соответственное проявление сниженной свертываемости происходит из-за тромбоцитопенического синдрома.
Количество лимфоцитов увеличено. Костный мозг становится «пустым» (панмиелофтиз). Выраженный недостаток кислорода в тканях вызывает дистрофические изменения во внутренних органах. Особенно страдают эндокринные железы.
Классификация апластической анемии
| Форма патологии | Чем отличается? |
| По продолжительности течения | |
| Острая | Не более одного месяца |
| Подострая | От одного месяца до полугода |
| Хроническая | Более полугода |
| По степени тяжести при избирательной аплазии | |
| Умеренная | Гранулоцитов менее 0,0х109/л, тромбоцитов менее 20,0х109/л. |
| Тяжёлая | Гранулоцитов менее 0,5х109/л, тромбоцитов менее 20,0х109/л. согласно результатам диагностики клеточность костного мозга составляет менее трети от нормы. |
| Очень тяжёлая | Гранулоцитов более 0,5х109/л, тромбоцитов более 20,0х109/л. |
Основные причины развития анемии у онкологических пациентов
Снижение уровня эритроцитов и гемоглобина может развиваться вследствие снижения их образования, ускоренного разрушения или в результате потери. Каждой из этих причин способствуют собственные факторы, которые рассмотрим подробнее:
- Недостаточная выработка форменных элементов крови и гемоглобина может развиваться при поражении костного мозга, недостатке железа в организме или некоторых витаминов (фолиевая кислота, витамин В12). Данные состояния могут быть напрямую связаны с напрямую с онкологическим заболеванием. Например, потеря железа может развиваться в результате постоянной рвоты, отсутствия аппетита и нарушения его всасывания в кишечнике, который поражен опухолевым процессом. Некоторые виды препаратов, которые назначают при злокачественных опухолях, подавляют рост не только раковых клеток, но и клеток крови, которые активно делятся. Также анемия может развиваться при непосредственном поражении костного мозга опухолевым процессом.
- Ускоренное разрушение эритроцитов отмечается при воздействии различных лекарственных препаратов и при аномальной активности иммунной системы. Разрушение эритроцитов непосредственно в сосудах называется внутрисосудистым гемолизом. Этот процесс протекает в норме после завершения жизненного цикла эритроцитов, который составляет 120 дней. Однако при воздействии различных факторов (прием антибиотиков, цитостатиков, присоединение вторичной инфекции и др.), этот срок значительно уменьшается, что и приводит к развитию анемии.
- Кровопотеря у онкологических пациентов может быть как острой, так и хронической. Первый вариант встречается при проведении хирургического лечения рака, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента.
Установление точной причины анемии играет решающее значение при выборе метода лечения. Кроме того, врач учитывает степень тяжести, тип анемии, общее состояние пациента и другие параметры. Получить эту информацию можно на диагностическом этапе.
Запись на консультацию круглосуточно
+7+7+78
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
- шум в ушах;
- появление одышки даже при несущественных усилиях;
- неприятное покалывание в области грудной клетки.
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
- даже после незначительной компрессии или ударах кожного покрова на нём появляются синяки и кровоизлияния;
- на теле, руках и ногах можно увидеть сыпь в виде мелких точек;
- наблюдается кровоточивость дёсен;
- спонтанные кровотечения из носа;
- обильные менструации (у женщин).
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
- недоразвитие черепа и головного мозга;
- снижение размеров и массы почек (гипоплазия);
- интенсивная окраска отдельных участков кожи – гиперпигментация;
- сильное снижение слуха и нарушения речевой функции из-за него.
Возможные осложнения
При апластической анемии возможны следующие последствия:
- различные кровотечения – геморрагические осложнения. Самое опасное осложнение – геморрагический инсульт (определенный участок головного мозга пропитывается кровью, в результате чего гибнет);
- анемическая кома – отсутствие реакции на происходящее из-за утраты сознания, возникающее в результате поступления недостаточного количества кислорода к головному мозгу, что вызвано значительным снижением количества эритроцитов;
- при наличии хронических заболеваний ухудшается состояние внутренних органов.
- осложнения инфекционного характера – развитие заболеваний, которые вызваны различными микроорганизмами (бактерии, грибы, вирусы);
Если при данном заболевании не проводится лечение, в 90% случаев пациент умирает в течение года.
Апластическая анемия: диагностика
Перед тем, как приступить к лечению заболевания, гематологи ЦЭЛТ проводят комплексную диагностику, направленную на точную постановку диагноза и выявление этиологического фактора. Она включает в себя:
- осмотр у гематолога;
- общий и биохимический анализы крови;
- забор образца костного мозга и его исследование – стернальная пункция.
При наличии заболевания у пациента выявляют серьёзное снижение гемоглобина, вплоть до критического уровня – 20-30 г/л, наблюдается агранулоцитоз – снижение зернистых лейкоцитов и моноцитов. Количество лимфоцитов может быть в норме или сниженным, тромбоцитов – всегда снижено, иногда их не обнаруживают вовсе. Скорость оседания эритроцитов – повышается до 4-60 мм/ч. Исследование образца костного мозга выявляет повышенное содержание жировой ткани – 90%, включающее в себя элементы стромы и лимфы, а вот гематогенные клетки имеются в очень малом количестве.
Профилактика
Клинические рекомендации врачей предусматривают два варианта профилактики: первичный и вторичный.
Первичная рассчитана на относительно здорового человека. Чтобы предупредить развитие анемии, необходимо правильно питаться и заниматься посильными видами спорта. Не следует забывать о регулярных процедурах по укреплению иммунитета. Также необходимо периодически проходить профилактические осмотры у терапевта, а при выявлении недугов сразу приступать к лечению.
Вторичная профилактика проводится для замедления прогрессирования уже подтвержденной болезни. С этой целью необходимо принимать назначенные медикаменты, тщательно следить за здоровьем, а при появлении новых симптомов сразу обращаться за медицинской помощью.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии – очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
- Глюкокортикоидов – при выявлении аутоиммунных механизмов и формировании антител против собственных кровяных клеток;
- Цитостатиков – при отсутствии эффекта от лечения глюкокортикоидами при аутоиммунной анемиии;
- Циклоспорина «А» – для подавления производства ФНО и интерферона “y”;
- Анаболиков – для стимулирования функции кроветворения;
- Андрогенов – для стимулирования образования красных кровяных клеток.
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию – хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении урологии. К ним можно записаться на цистоскопию мочевого пузыря.
В ЦЭЛТ вы можете получить консультацию гематолога.
- Первичная консультация — 3 500
- Повторная консультация — 2 300
Записаться на прием
Записавшись на прием гематолога, вы сможете получить всестороннюю консультацию. В компетенции врача находится лечение различных заболеваний крови, большинство из которых можно выявить на ранних стадиях и назначить своевременное лечение, позволяющее справиться с болезнью быстро и легко.
Анемии, патология гемостаза, онкогематология
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Апластическая анемия (АА) – заболевание, являющееся следствием исчезновения или резкого уменьшения в костном мозге полипотентных стволовых клеток, количество которых снижается до 1% и ниже, что приводит к опустошению или аплазии костного мозга. Морфологически это проявляется панцитопенией в анализах периферической крови, отсутствием кроветворных клеток в пунктате костного мозга.В крови панцитопения характеризуется лейкопенией за счет нейтропении с относительным лимфоцитозом, отсутствием ретикулоцитов. При обнаружении таких изменений необходимо обязательно исключить все возможные причины аплазии (вирусные инфекции, злокачественные заболевания, заболевания крови (лимфопролиферативные заболевания), системные коллагенозы, контакт с химическими веществами, радиация), у взрослых провести трепанобиопсиюдля гистологического исследования костного мозга.
АА впервые была описана Эрлихом в 1888 году. Частота АА составляет 2 – 4 случая на 1 млн. населения в США и Европе, тогда как в некоторых странах Восточной Азии АА встречается значительно чаще. Так, в Таиланде и Японии заболеваемость АА составляет 11 – 14 случаев на 1 млн. населения.
АА наиболее часто выявляется в двух возрастных группах: 20 – 25 лет и старше 60 лет. Статистически значимая разница в частоте заболеваемости между мужчинами и женщинами отсутствует.
Этиология и патогенез
АА могут быть врожденными, но чаще носят приобретенный характер. Врожденные, генетически обусловленные АА впервые были описаны Фанкони в 1927 году.
Врожденные АА клинически проявляются недостаточностью костного мозга в первые годы жизни ребенка и нередко сочетаются с такими врожденными дисплазиями, как диспигментация кожи, гипоплазия почек и селезенки, отсутствие или гипоплазия лучевой кости, микроцефалия, врожденные пороки сердца и умственное или половое недоразвитие. Кариологические исследования при этом варианте АА часто выявляют различные хромосомные нарушения. Среди детей с анемией Фанкони отмечается также высокая частота заболеваемости острым лейкозом и другими неоплазиями.
При вторичных АА костномозговая недостаточность обусловлена либо прямым токсическим воздействием радиации или химических соединений на стволовые клетки, либо аберрантным ответом, обусловленным вирусными инфекциями (гемофагоцитарный синдром). Наиболее частыми заболеваниями, провоцирующими развитие АА, являются злокачественные заболевания, заболевания крови (лимфопролиферативные заболевания), системные коллагенозы. Увеличение периферических лимфоузлов, печени и селезенки не характерно дляАА. Более того, обнаружение увеличенной селезенки на ранней стадии заболевания ставит под сомнение диагноз АА, свидетельствует в пользу гепатит-ассоциированной аплазии. Однако, длительное течение заболевания может сопровождаться увеличением печени и селезенки вследствие посттрансфузионного гемосидероза. В случаях с выявленной причиной АА, такое состояние необходимо рассматривать, как вторичную аплазию кроветворения.
Истинной (идиопатической приобретенной) АА является состояние, связанное сгибелью неизмененных стволовых клеток. При идиопатических формах, при которых причина, обусловившая аплазию костного мозга неясна, предполагается Т-клеточно-опосредованная деструкция полипотентных стволовых гемопоэтических клеток костного мозга. У больных с идиопатической формой АА в крови обнаружено повышенное количество активированных цитотоксических Т-лимфоцитов, повышенная выработка γ-интерферона и фактора некроза опухоли, которые вызывают гибель собственных стволовыхклеток костного мозга. Причем причина аутосенсибилизации Т-лимфоцитов противсобственных стволовых клеток остается неясной.
Классификация апластических анемий.
1. Идиопатические апластические анемии
— врожденная (анемия Фанкони)
— приобретенная
2. Вторичные апластические анемии, вызванные:
— лекарственными препаратами (хлорамфинекол, нестероидные противовоспалительные препараты, противосудорожные средства, цитотоксические препараты)
— вследствие воздействия ионизирующей радиации
— химическими воздействиями (бензол и его производные, пестициды, лакокрасочные материалы)
— вирусными инфекциями (Эпштейн-Барр, гепатиты, парвавирус, цитомегаловирус, ВИЧ)
— аутоиммуными заболеваниями (СКВ, эозинофильный фасциит, гипериммуноглобулинемия)
— другими причинами (беременность, тимома)
Клиника АА
Все клинические проявления АА являются следствием костномозговой недостаточности, интенсивность их зависит от выраженности и скорости прогрессирования панцитопении.Течение АА может быть острым, подострым и хроническим.
У больных АА обычно имеется анемический синдром в сочетании с геморрагиями на коже, слизистых оболочках и инфекционными осложнениями. Доминирующие симптомы АА отличаются в зависимости от сроков развития заболевания.
Известно, что эритроциты циркулируют в периферической крови в течение 3 – 4 месяцев, поэтому симптомы анемии могут развиваться только при длительном угнетении кроветворения более 1 – 2 месяцев. В результате продолжительного отсутствия продукции эритроцитов происходит постепенное снижение концентрации гемоглобина на 25 – 50%, то есть до 90 – 70 г/л, что может быть причиной появления симптомов анемии.
Наоборот, при быстрой гибели подавляющего числа стволовых клеток уже через неделю истощается гемопоэз, прекращается продукция тромбоцитов и лейкоцитов, а количество циркулирующих эритроцитов остается нормальным. Далее ещё в течение недели происходит снижение количества тромбоцитов, что приводит к появлению геморрагического синдрома, на фоне полного отсутствия анемических жалоб. До появления кровоточивости организм компенсирует недостаток тромбоцитов за счет имеющихся, которые в норме жизнеспособны в среднем 10 – 11 суток. Причем, снижение тромбоцитов в циркуляции происходит раньше на несколько дней, чем появление геморрагий, так как основное их количество представлено пристеночным пулом, который составляет основную массу тромбоцитов периферической крови и расходуется медленнее. Геморрагический синдром при тромбоцитопении связан с неадекватной трофикой и повреждением эндотелия, повышенной ломкостью мелких сосудов и проявляется кровоточивостью слизистых (носовые, маточные кровотечения), петехиальными высыпаниями на коже. Считается, что угрожающим для жизни состоянием является кожный геморрагический синдром на верхней половине туловища, особенно на лице, при котором резко повышается риск кровоизлияния в головной мозг.
Что касается лейкоцитов, в особенности нейтрофилов, то их количество снижается наиболее интенсивно. Срок жизни гранулоцитов не более недели, причем в периферической крови они циркулируют несколько дней, затем поступают в окружающие ткани, где осуществляют основную фагоцитарную функцию. Поэтому даже на фоне полного отсутствия нейтрофилов в периферической крови (агранулоцитоза) инфекционные осложнения наступают не сразу, а, как правило, через 5 – 7 дней, и имеют свои особенности. У таких больных часто имеет место высокая лихорадка при отсутствии источника инфекции. Так, при одышке не удается прослушать хрипы, при болях в животе крайне размыты симптомы раздражения брюшины. Для установки диагноз пневмонии и перитонита в таком случае крайне важны инструментальные методы исследования (рентгенологические и ультразвуковые), при использовании которых можно увидеть инфильтрацию ткани легких, появление уровней жидкости в кишечнике при его атонии, утолщение стенки кишки и другие. У больных с агранулоцитозом при появлении лихорадки крайне высок риск развития септического шока в связи с отсутствием барьерной функции лейкоцитов. Такие больные при развитии лихорадки в обязательном порядке нуждаются в исследовании крови на стерильность. Мало того, диагноз сепсиса при агранулоцитозе может устанавливаться даже вопреки классическому определению сепсиса, то есть без наличия «первичного очага». Наиболее частой причиной сепсиса при агранулоцитозе является «нормальная» флора кишечника (сапрофиты или условно патогенные бактерии).
При остром течении АА имеют место бурно прогрессирующий геморрагический синдром, обусловленный глубокой тромбоцитопенией, и тяжелые инфекционные осложнения вследствие почти полного отсутствия гранулоцитов. Больные с подобным течением АА, требуют экстренной госпитализации в гематологическое отделение и проведение антибактериальной, заместительной, часто интенсивной терапии, специализированного лечения. Без адекватной помощи, такие пациенты, как правило, погибают в течение нескольких дней или недель от появления первых признаков заболевания.
При среднетяжелом (подостром) течении АА слабость и повышенная утомляемость длительно остаются основными жалобами больного, затем из-за тромбоцитопении могут появиться симптомы геморрагического диатеза.
Для вторичных АА, которые клинически могут проявлять себя спустя недели и даже месяцы после контакта с этиологическим фактором, более свойственно хроническое течение. При вторичной АА чаще, чем при идиопатической форме, развивается ремиссия заболевания и может наступить полное выздоровление после прекращения действия этиологического фактора.
Лабораторные данные
Картина периферической крови у 90% больных АА характеризуется панцитопенией: анемией, лейко- и тромбоцитопенией.
Анемия носит нормохромный характер. Число ретикулоцитов снижено до 0 – 0,3%.
Лейкопения обусловлена гранулоцитопенией, причем содержание лимфоцитов обычно не изменено, что создает впечатление лимфоцитоза, который при АА носит относительный характер. Выраженность лейкопении во многом определяет тяжесть течения заболевания: число лейкоцитов < 0,5 х 109/л наблюдается больных с тяжелой АА, число лейкоцитов < 0,2х109/л – при сверхтяжелой АА.
Тромбоцитопения обнаруживается уже на ранних этапах заболевания и является наиболее стойким гематологическим симптомом.
Пунктат костного мозга в подавляющем большинстве случаев очень беден, т.е. содержит небольшое количество гемопоэтических клеток, большинство из которых – лимфоциты. Однако, поскольку процесс аплазии костного мозга происходит неравномерно и отдельные очаги нормального кроветворения сохраняются, можно получить деятельный костный мозг с почти нормальным клеточным составом (при панцитопении в анализе периферической крови!). Все это позволяет сделать заключение о том, что миелограмма при АА не имеет определяющего диагностического значения.
Ключевым методом для диагностики АА у взрослых является гистологическое исследование костного мозга. Для проведения этого исследования проводят трепанобиопсию, результаты которой при АА говорят о тотальном преобладании жировой ткани над деятельным костным мозгом.
При биохимическом исследовании крови у большинства больных АА выявляется высокий уровень сывороточного железа, повышение уровней ЛДГ и трансаминаз, повышенное содержание эритропоэтина.
Диагноз АА основывается на сочетании панцитопении периферической крови, снижении клеточности костного мозга при стернальной пункции и обнаружении жирового костного мозга при его гистологическом исследовании, при этом исключаются другие причины развития аплазии кроветворения.
Критерии панцитопении: Hb< 110 г/л, гранулоциты < 2,0 х109/л, тромбоциты < 100 х109/л.
Классификация АА по степени тяжести указана в таблице.
Классификация АА по степени тяжести
| Форма заболевания | Критерии |
| Нетяжелая АА | — пациент не отвечает критериям тяжелой и сверхтяжелой форм; — гранулоциты > 0,5 х 109/л. |
| Тяжелая АА | — гранулоциты < 0,5 х 109/л; — тромбоциты < 20 х 109/л. |
| Сверхтяжелая АА | — гранулоциты < 0,2 х 109/л. |
Как видно из таблицы, тяжесть АА определяется не концентрацией гемоглобина, учитывает только тяжелую тромбоцитопению, а основным фактором, определяющим тяжесть состояния больного, является уровень нейтрофилов в периферической крови. Это связано с имеющейся возможностью протезировать эритроцитарную и тромбоцитарную функцию переливанием эритроцитарной и тромбоцитарной массы, получаемых от доноров, и отсутствием методов коррекции нейтропении.
Дифференциальный диагноз
АА иногда приходится дифференцировать с заболеваниями, которые могут сопровождаться панцитопенией:
— острые лейкозы;
— мегалобластная анемия;
— идиопатический миелофиброз;
— гиперспленизм;
— миелодиспластический синдром (МДС).
При острых лейкозах с гипоплазией кроветворения, в отличие от АА, в костном мозге обнаруживаются на фоне костномозговой гипоплазии скопления бластных клеток, а при мегалобластных анемиях – мегалобластическое кроветворение.
У больных с идиопатическим миелофиброзом и гиперспленизмом почти всегда присутствует выраженная спленомегалия, которая всегда отсутствует при АА. Кроме того, при трепанобиопсии в первом случае выявляется миелофиброз, а во втором – костномозговая гиперплазия.
Сочетание панцитопении и костномозговой гипоплазии может наблюдаться у 10% больных с миелодиспластическим синдромом. Однако, при МДС, наряду с гипоплазией кроветворения, присутствуют его диспластические черты в виде мегалобластоидности, наличия двуядерных эритробластов, телец Хавелла – Жолли, сидеробластов (эритроцитов, содержащих гранулы железа), иногда – увеличенное содержание бластных клеток, а также присутствие Пельгеровской аномалии гранулоцитов (нарушение сегментации ядра) и микроформ мегакариоцитов. Кроме того, при МДС, как правило, обнаруживаются хромосомные нарушения, которые отсутствуют при АА.
Лечение
Единственным методом лечения больных АА, обеспечивающим высокую выживаемость (78 – 90%) и даже полное выздоровление больных, является аллогенная трансплантация костного мозга (АТКМ).
АТКМ от HLA-совместимого донора считается методом выбора у больных АА, если они отвечают следующим критериям:
1. наличие HLA-совместимого родственного донора костного мозга;
2. тяжелая или сверхтяжелая форма АА;
3. возраст больного не старше 40 лет;
4. короткий гемотрансфузионный анамнез.
В качестве родственных доноров используются,как правило, только родные братья и сестры.
Стандартный мягкий режим подготовки больного (кондиционирования) к трансплантации костного мозга включает применение циклофосфана в дозе 50 мг/кг с –5 по –2 дни, антилимфоцитарного глобулина (АЛГ) с –5 по –3 дни и метилпреднизолона с –5 по –3 дни. Основной целью такого кондиционирования является иммуносупрессия, направленная на предотвращение отторжения трансплантата, которое при такой схеме снижается с 30% до 5%.
В качестве посттрансплантационной иммуносупрессии, направленной на подавление «реакции трансплантат против хозяина» (РТПХ), которая наблюдается как в острой форме, так и хронической (чаще), используется циклоспорин А в дозе 5 мг/кг в сутки в течение 12 месяцев в сочетании с короткими курсами метотрексата по 15 мг/м2 в +1, +3, +6, +11 дни.
Такая же схема кондиционирования и профилактики РТПХ применяется при использовании костного мозга HLA-совместимых неродственных доноров. Однако, трансплантация костного мозга от неродственных доноров дает значительно худшие результаты: только 29% больных АА были живы через 2 года после неродственной трансплантации.
Важное значение в эффективности трансплантации костного мозга имеют предшествующие гемотрансфузии: у больных, не получавших гемотрансфузии в 80% случаев удается получить полную ремиссию с пятилетней выживаемостью около 70%, тогда как у больных с сенсибилизирующей гемотрансфузионной терапией полная ремиссия достигается только в 50% случаев.
Опыт лечения АА введение гемопоэтических клеток выявил преимущество трансплантации костного мозга над использованием мобилизированных стволовых клеток, полученных из периферической крови донора.
Количество мононуклеаров при инфузии костного мозга должно быть не менее 3,0х109/кг при минимальном количестве CD 34+ стволовых клеток 2,6 х106/кг.
Исходя из предположения о роли супрессивного действия собственных сенсибилизированных Т-лимфоцитов на стволовые клетки костного мозга (с их последующим апоптозом), было предложено использование иммуносупрессоров с анти-Т-лимфоцитарным действием в лечении АА у больных. Таким :
— не имеющих HLA-совместимых доноров,
— больных с нетяжелой АА, которые зависят от гемотрансфузий,
— больных с тяжелой и сверхтяжелой формами АА старше 40 – 45 лет.
В качестве основной терапии АА используется схема с обязательным сочетанием патогенетического лечения (иммуносупрессивныепрепараты и спленэктомия), трансфузионной терапии и антимикробных препаратов.
Патогенетическое лечение
Чаще всего лечение начинается с антилимфоцитарного (антитимоцитарного) глобулина (АТГ: атгам, тимоглобулин). Препараты вводятся в/в медленно в течение 12 часов, после пробы на чувствительность, доза препарата составляет 20 мг/кг/cутки. Общее количество на курс составляет 4введения. Для профилактики сывороточной болезни используется преднизолон в дозе 1 мг/кг или метилпреднизолон 125 – 250 мг/сут (до и после АТГ) в сочетании с антгистаминными препаратами (до и после АТГ). С 14 дня курса (1 день курса отсчитывается с первого дня введения АТГ) необходимо отменять преднизолон. Отменяют его за неделю, постепенно уменьшая дозу (ежедневно на 1/3 – 1/2). Эффект от лечения АЛГ наблюдается у половины больных, причем в 15% достигаются полные ремиссии.
Вторым иммуносупрессором, который широко используется в лечении АА является циклоспорин А (СуА), который блокирует продукцию интерлейкина-2 (ИЛ-2), ответственного за пролиферацию цитотоксических Т-лимфоцитов.Применяется СуА в дозе 5 – 10 мг/кг в сутки при длительности курса не менее 12 месяцев. Во время приема СуА должны назначаться препараты магния (Магне В6, Магнерот), обязательно мониторироваться печеночные (билирубин, АЛТ, АСТ), почечные показатели (креатинин). Как и при использовании АЛГ, эффективность его составляет 50 – 60%, однако, по-видимому, этот препарат не обеспечивает достаточную иммуносупрессию и его отмена приводит к рецидиву заболевания.
В настоящее время наиболее часто используется комбинированная схема лечения, включающая введение АЛГ в течение 4 дней, а с 14 дня – применение СуА в течение 12 месяцев. Частота ответа на комбинированную терапию довольно высокая и достигает80% при тяжелой АА с пятилетней выживаемостью 75%. При неэффективности сочетанного использования АТГ + СуА возможно второе (через 3 – 6 месяцев) и третье (через 6 – 12 месяцев) введение АЛГ или замена одного курса АТГ спленэктомией.
Схема лечения апластической анемии (* — вместо АТГ возможно проведение спленэктомии)
При использовании АТГ нередко развивается сывороточная болезнь. Она проявляется у 50% больных спустя 5 – 14 дней после окончания введения препарата сыпью, артралгиями, лихорадкой, лабораторными признаками гепатита, подъемом артериального давления. В таких случаях целесообразно назначать преднизолон в дозе 0,5 – 1 мг/кг до купирования симптомов, при отсутствии эффекта или выраженных симптомах сывороточной болезни проводят плазмаферез.
Трансфузионная терапия
В последние годы у больных, ответивших на терапию АЛГ+СуА, производится спленэктомия, которая обнаружила свое положительное действие еще до внедрения в практику иммуносупрессивных средств.
Поддерживающая (заместительная) терапия, обеспечивающая удовлетворительное качество жизни больных, имеет большое значение в терапии апластической анемии:
1. Эритроцитарную массу следует переливать при снижении гемоглобина до 80 г/л, когда у больных обычно появляются симптомы тканевой гипоксии.
2. Показанием к переливанию тромбоцитарной массы являетсяснижение числа тромбоцитов менее 20 х 109/л или геморрагический синдром в виде кровоточивости слизистых и/или в сочетании с высыпаниями на коже верхней половины туловища (на фоне лечения АТГ трансфузии необходимо проводить при уровне тромбоцитов 40 – 60 109/л).
Трансфузий компонентов крови следует избегать в тех случаях, когда у больного имеются HLA-совместимые родственники и предполагается проведение трансплантации костного мозга. Этим предотвращается сенсибилизация больных и уменьшается риск отторжения трансплантата. Длительная гемотрансфузионная терапия приводит к развитию гемосидероза, поскольку в пакете эритромассы содержится 200 – 250 мг железа.
Для борьбы с посттрансфузионным гемохроматозом, усугубляющим костномозговую недостаточность и способствующего развитию цирроза печени и поджелудочной железы, используется хелаторная терапия. Её начинают при увеличении ферритина сыворотки> 1000 мкг/л. Основными препаратами, образующими комплекс с железом в крови и выводящими его с мочой, что препятствует развитию гемосидероза, являются десферал (дефероксамин) по 500 мг в день в/в (обычно используется на фоне гемотрансфузий или раз в неделю), а также новый, выводящий избыток железа препарат эксиджад (деферазирокс), который удобен способом приема – внутрь по 20 мг/кг/сутки.
Антимикробная терапия
У больных с тяжелой гранулоцитопенией (< 0,5х109/л) назначается КСФ, стимулирующий гранулоцитопоэз, но не влияющий на другие ростки кроветворения.
Больным АА с глубокой нейтропенией и лихорадкой показана терапия антибиотиками широкого спектра действия под контролем бактериологического исследования крови и мочи, обязательна изоляция больных в стерильные палаты. Антибиотики необходимо назначать при снижении нейтрофилов ниже 0,5 х 109/л всем больным, причем при нормальной температуре использовать профилактические дозы, при подъеме выше 37,5 0С – использовать цефалоспорины 3-его и 4-ого поколения, только максимальные лечебные дозы.
В случае отсутствия эффекта от антибиотической терапии у лихорадящих больных обязательно проводится обследование на аспергиллез (галактомонан в сыворотке крови), пневмоцистную инфекцию (бронхоскопия с бронхоальвеолярным лаважем – БАЛ), герпетическую инфекцию (ПЦР – в сыворотке крови). Даже при отрицательных результатах культуральных исследований применяются противогрибковые препараты: кетоконазол, флуконазол, интраконазол.
Под влиянием современной терапии период развернутых клинических проявлений может смениться состоянием клинико-гематологической компенсации и даже полной ремиссии, при которой исчезают все признаки болезни. В дальнейшем состояние клинико-гематологической ремиссии может смениться рецидивом заболевания. Полное выздоровление наблюдается у 15 – 50% больных АА, после аллогенной трансплантации костного мозга.
Оценка эффективности терапии проводится через 3, 6, 9, 12, 18, 24 месяца от начала терапии:
Ремиссия (полная, частичная)– полная нормализация, частичная нормализация показателей крови (Hb> 100 г/л, гранулоциты > 1,5 х 109/л, тромбоциты > 100 х 109/л) и отсутствие зависимости от гемотрансфузий.
Клинико-гематологическое улучшение – улучшение показателей крови (Hb> 80 г/л, гранулоциты > 1,0 х 109/л, тромбоциты > 20 х 109/л) и отсутствие или уменьшение зависимости от гемотрансфузий.
Течение и прогноз
До использования трансплантации костного мозга и иммуносупрессивной терапии 25% больных АА умирали в течение 4-ех месяцев от момента диагностики заболевания, а менее половины жили больше года. Трансплантация костного мозга приводит к значительному улучшению прогноза при АА и излечению 80% больных, не получавших трансфузии компонентов крови и 60% больных, которым трансфузии производились. Иммуносупрессивная терапия вызывает полную или частичную ремиссию у половины больных, однако у части из них (15%) развивается рецидив заболевания. Более того, на фоне почти десятилетней полной ремиссии заболевания, у 40% больных имеющийся дефект стволовой клетки может проявиться развитием пароксизмальной ночной гемоглобинурии, миелодиспластического синдрома или острого миелобластного лейкоза.
При диагностике заболевания прогноз во многом зависит от абсолютного числа нейтрофилов и тромбоцитов. Исключительно плохой прогноз у больных с постгепатитной аплазией.
У взрослых
Апластическая анемия – явление достаточно редкое. У взрослых данное заболевание развивается остро с рецидивами и осложнениями. Апластической анемии подвержены одинаково, и женщины, и мужчины. Чаще молодого возраста.
Если своевременно начать лечение, то шансы есть. В чем же заключается лечение данного заболевания? Лечение будет заключаться в гемотрансфузии. То есть переливание крови и ее компонентов. А именно – эритроцитарная масса.
Хлористый кальций тоже используется в лечении. Витамин А, фолиевая кислота. Антибиотики – пенициллин и стрептомицин. Длительный курс лечения гормонами. К ним относят преднизалон и кортикозон.
перейти наверх
У детей
Апластическая анемия у детей протекает не так тяжело, как у взрослых. С чем это может быть связано. Чаще у детей данное заболевание возникает как следствие вируса. А именно – дети, перенесшие вирусную инфекцию. Наследственные факторы тоже имеют место при заболевании. По статистике, вирусная инфекция – гепатит становится причиной апластической анемии. У детей осложнения наблюдаются реже. Диагностика будет заключаться в исследовании мочи и крови. А также анамнез и осмотр.
Лечение данного заболевания будет заключаться в приеме антибиотиков по возрастным показаниям. Симптоматическое лечение показано в любом возрасте. Конечной точкой будет пересадка костного мозга, но при условии необратимых осложнений.
перейти наверх