Комплексная терапия артериальной гипертензии
Под «артериальной гипертензией» (АГ) подразумевают синдром повышения артериального давления (АД). Различают АГ первичную («гипертоническая болезнь» — ГБ) и вторичную («симптоматическая» АГ).
Под ГБ принято понимать хронически протекающее заболевание, основным проявлением которого является стойкое повышение АД, не связанное с наличием патологических процессов, при которых повышение АД обусловлено известными, в современных условиях часто устранимыми причинами «симптоматических» АГ. В силу того, что ГБ — гетерогенное заболевание, имеющее довольно отчетливые клинико-патогенетические варианты с существенно различающимися на начальных этапах механизмами развития, в научной литературе вместо обозначения ГБ часто используется АГ.
Хорошо известно, что АГ — самое распространенное сердечно-сосудистое заболевание, опасное прежде всего своими осложнениями. Данные ряда крупных эпидемиологических исследований однозначно свидетельствуют о том, что риск развития ишемической болезни сердца (ИБС), мозгового инсульта, сердечной недостаточности, заболеваний периферических артерий в популяции значительно (иногда в несколько раз) возрастает у лиц с повышенным АД по сравнению с лицами с нормальным АД.
Распространенность АГ весьма высока в любой развитой стране мира. Россия, к сожалению, в этом отношении не является исключением. В исследовании С. А. Шальновой и других было показано, что среди взрослого населения России АГ страдают 39,3 % мужчин и 41,1 % женщин (табл. 1).
Высокая распространенность АГ в России в значительной степени является причиной крайне высоких показателей смертности в нашей стране. Согласно сведениям, которые содержатся в Демографическом ежегоднике России, в 2001 г. от болезней системы кровообращения умерли 1 253 103 человека, в том числе от цереброваскулярных болезней — 475 163 человека (для сравнения: от онкологических заболеваний в 2001 г. умерли 294 063 человека).
АГ играет особую роль в патогенезе всех типов мозгового инсульта. Считается, что она является основной причиной около 70 % случаев этого заболевания. В ходе Фремингемского исследования было продемонстрировано, что стандартизованный по возрасту риск мозгового инсульта среди больных с АГ (систолическое АД выше 160 мм рт. ст. и/или диастолическое АД выше 95 мм рт. ст.) составил 3,1 для мужчин и 2,9 для женщин. Достаточно четко прослеживается прямая и статистически достоверная связь между смертностью от мозгового инсульта и распространенностью АГ в той или иной стране (коэффициент корреляции 0,78).
Можно без преувеличения сказать, что смертность от цереброваскулярных заболеваний в нашей стране приобрела катастрофический характер. Так, в опубликованных недавно в журнале Heart данных о сердечно-сосудистой смертности в различных странах мира (всего приводятся данные по 48 странам из разных частей света) Россия по числу смертей от цереброваскулярных заболеваний стойко заняла первое место как среди мужчин, так и среди женщин. Причем абсолютные показатели смертности по России превышают значения в других странах в несколько раз. Так, в 1995–1998 гг. стандартизованный по возрасту показатель смертности от цереброваскулярных заболеваний у мужчин в России составил 203,5 случаев на 100 000 человек, тогда как в США — 29,3, а в Канаде — 27,8.
Все современные рекомендации по лечению АГ четко определяют основную цель терапии как снижение сердечно-сосудистой и почечной заболеваемости и смертности. Для достижения этой цели в первую очередь необходимы снижение АД до нормального уровня, а также коррекция всех модифицируемых факторов риска: курение, дислипидемия, гипергликемия, ожирение — и лечение сопутствующих заболеваний: сахарного диабета и т. д.
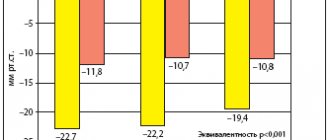
Снижение систолического и диастолического АД до уровня < 140/90 мм рт. ст. способствует уменьшению вероятности развития сердечно-сосудистых осложнений. Это было наглядно продемонстрировано некоторыми исследованиями, в частности MRFIT (рис. 1). Именно поэтому целевым уровнем АД при лечении АГ считается < 140/90 мм рт. ст. Данные ряда недавно проводившихся исследований свидетельствуют о том, что при хорошей переносимости терапии целесообразно добиваться снижения АД до определенных значений, но не ниже 110/70 мм рт. ст. У больных с АГ и сахарным диабетом или заболеваниями почек целевое АД составляет < 130/80 мм рт. ст.
Необходимость снижения АД можно убедительно проиллюстрировать на примере того факта, что за последние 20 лет реализация комплекса мер по борьбе с АГ в США привела к исчезновению злокачественной АГ, уменьшению смертности от мозгового инсульта на 60%, снижению сердечно-сосудистой смертности в 2 раза.
Способы достижения целевого уровня АД
Немедикаментозные. Мероприятия по изменению образа жизни рекомендуются всем больным с АГ, в том числе получающим медикаментозную терапию, особенно при наличии факторов риска. Эти мероприятия включают в себя: отказ от курения, нормализацию массы тела (индекс массы тела < 25 кг/м2), снижение потребления алкоголя < 30 г/сут у мужчин и < 20 г/сут у женщин, регулярные динамические физические нагрузки по 30–40 мин не менее 4 раз в неделю, снижение потребления поваренной соли до 5 г/сут, изменение режима питания с увеличением потребления растительной пищи, уменьшением потребления животных жиров, включением в рацион продуктов, богатых калием, кальцием (овощи, фрукты, зерновые) и магнием (молочные продукты).
Недавно завершившиеся исследования Oxford Fruit and Vegetable Study и TOHP-II еще раз отчетливо продемонстрировали влияние диеты с высоким содержанием фруктов и овощей на уровень АД. В исследование Oxford Fruit and Vegetable Study были включены 670 лиц с нормальным АД. Всем, входящим в основную группу, следовало придерживаться диеты, обогащенной овощами и фруктами, тогда как в контрольной группе не было дано никаких диетических рекомендаций. Период наблюдения составил 6 мес. Суточное потребление овощей и фруктов в основной группе возросло на 112 г, в контрольной группе — на 8 г. Соблюдение диеты ассоциировалось со снижением систолического АД в среднем на 2,0 мм рт. ст., а диастолического — на 1,6 мм рт. ст. (p < 0,05), в то время как в группе контроля первый показатель повысился на 1,4 мм рт. ст., а снижение диастолического АД составило только 0,3 мм рт. ст. При этом динамики, связанной с уровнем холестерина, не было отмечено ни в одной из групп.
Медикаментозная терапия. Основным показанием для назначения антигипертензивной терапии служит степень сердечно-сосудистого риска (табл. 2).
При АГ I и II степени у больных с высоким или очень высоким риском развития сердечно-сосудистых осложнений гипотензивные препараты должны назначаться немедленно. При умеренном риске допустимо наблюдение в течение 3 мес с регулярным контролем АД до принятия решения о начале терапии. Лечение назначают при устойчивом повышении АД > 140/90 мм рт. ст.
В группе низкого риска рекомендуются 3–12-месячный период наблюдения и немедикаментозная терапия перед началом медикаментозного лечения. Показанием к началу такого лечения служит устойчивый уровень АД в пределах 140–159/90–99 мм рт. ст.
При АГ III степени необходимо немедленно назначать антигипертензивную лекарственную терапию.
Помимо терапии гипотензивными препаратами, больным, относящимся к группе высокого риска сердечно-сосудистых осложнений, показана терапия, направленная на профилактику других факторов риска, в первую очередь нарушенного липидного обмена. Снижение риска осложнений достигается назначением антикоагулянтов, прежде всего ацетилсалициловой кислоты.
Основные группы антигипертензивных препаратов
В Российских рекомендациях по лечению АГ второго пересмотра, представленных на Российском национальном конгрессе кардиологов 2005 г., в группу препаратов, рекомендованных для терапии АГ, помимо диуретиков, β-адреноблокаторов, антагонистов кальция (АК), ингибиторов ангиотензинпревращающего фермента (иАПФ), блокаторов рецепторов ангиотензина I (БРА), α-адреноблокаторов, включены агонисты I1-имидазолиновых рецепторов (АИР). Последним отводится определенная роль в терапии больных с метаболическим синдромом и сахарным диабетом, отмечается, что они могут назначаться в качестве монотерапии или в сочетании с другими гипотензивными препаратами при неэффективности других средств.
Монотерапия или комбинированная терапия
Выбирая между монотерапией и комбинированной терапией, врач должен ориентироваться прежде всего на исходный уровень АД, наличие осложнений или их отсутствие. На основании результатов многоцентровых международных исследований можно предполагать, что монотерапия будет эффективна в основном у больных с I степенью АГ. Так, по данным исследования ALLHAT, только у 60 % пациентов с АГ I и II степени монотерапия оказалась эффективна; в исследовании HOT на монотерапии остались лишь 25–50 % пациентов с АГ I и III степени: в ходе исследований, в которых принимали участие больные с сахарным диабетом, подавляющее большинство пациентов получали минимум два препарата, тогда как при диабетической нефропатии для достижения целевого уровня АД в среднем требовалось два-три препарата, в дополнение к базовой терапии.
В соответствии с исходным уровнем АД, наличием осложнений и факторов риска целесообразно начинать терапию либо с низкой дозы одного препарата, либо с низкодозовой комбинации.
Преимуществом монотерапии является то, что при неэффективности лечения на начальном этапе врач может либо сменить класс препарата, либо увеличить дозу ранее принимавшегося средства, это даст возможность подобрать лекарство индивидуально для каждого пациента. Однако в большинстве случаев такая процедура является трудоемкой, кроме того, она часто ведет к потере доверия не только к проводимой терапии, но и к лечащему врачу, что, в свою очередь, не способствует повышению комплаентности.
Очевидным недостатком схемы терапии, предусматривающей начало лечения с приема сразу двух препаратов, даже в низких дозах, является опасность назначения больному «ненужного» средства. Однако у комбинированной терапии преимуществ все же больше: во-первых, применение препаратов с разными механизмами действия позволяет более эффективно контролировать АГ и ее осложнения; во-вторых, при использовании комбинированной терапии появляется возможность назначать препараты в низких дозах, при этом уменьшается вероятность развития нежелательных эффектов; в-третьих, в настоящее время стали доступны фиксированные лекарственные комбинации, позволяющие назначать два препарата в одной таблетке, что заметно повышает комплаентность.
В настоящее время эффективными и безопасными считаются следующие комбинации препаратов: иАПФ + диуретики; диуретики + β-адреноблокаторы; диуретики + БРА; антагонисты кальция (АК) (дигидропиридиновые) + β-адреноблокаторы; АК (дигидропиридиновые) + БРА; АК + иАПФ; АК (дигидропиридиновые) + диуретики; α-адреноблокаторы + β-адреноблокатор (рис. 2).
| Рисунок 2. Возможные комбинации различных классов антигипертензивных препаратов. (Из Европейских рекомендаций по лечению АГ) |
Руководствуясь данными многочисленных исследований, доказавших положительное влияние отдельных комбинаций препаратов на конечные точки, ведущие фармакологические компании стали предлагать комбинированные антигипертензивные препараты. Так, в последние годы на фармакологическом рынке появились комбинации препаратов длительного действия с фиксированными дозировками: диуретик + БРА (ко-диован, гизаар); иАПФ + диуретик (ко-ренитек, нолипрел, рениприл ГТ); АК (дигидропиридиновый) + β-адреноблокатор (логимакс); диуретик + β-адреноблокатор (атегексал композитум); на сегодняшний день единственная комбинация АК + иАПФ (тарка).
Вопрос о преимуществах применения той или иной группы гипотензивных препаратов, той или иной комбинации является достаточно сложным и неоднозначным, однако результаты многоцентровых рандомизированных исследований в целом доказывают, что назначение любого из существующих режимов лечения АГ снижает общий риск сердечно-сосудистых событий, причем чем ниже АД, тем меньше вышеупомянутый риск.
Во всех случаях рекомендуется использовать препараты пролонгированного действия, обеспечивающие эффект в течение суток, это уменьшает вариабельность АД и, возможно, обеспечивает лучшую органопротекцию и снижение числа сердечно-сосудистых осложнений. Кроме того, благодаря удобству однократного приема препаратов повышается приверженность пациентов к лечению.
Современными международными рекомендациями по лечению АГ достаточно четко определено, когда и каким препаратам врач должен отдавать предпочтение. Главным аргументом в пользу назначения конкретной группы препаратов служат так называемые дополнительные показания. Так, дополнительными показаниями к назначению дигидропиридиновых АК являются пожилой возраст, изолированная систолическая АГ, наличие стенокардии, атеросклероз периферических артерий, в частности атеросклероз сонных артерий. Пульс-урежающие АК недигидропиридинового ряда, дилтиазем и верапамил-SR, целесообразно использовать у пациентов с суправентрикулярной тахикардией. Доказано, что БРА замедляют прогрессирование хронической почечной недостаточности при АГ в сочетании с сахарным диабетом, а также обеспечивают обратное развитие гипертрофии левого желудочка. Блокатор альдостероновых рецепторов (спиронолактон) оказался эффективен у больных с хронической сердечной недостаточностью и пациентов, перенесших инфаркт миокарда.
Все эти дополнительные показания вытекают из результатов конкретных контролируемых исследований, продемонстрировавших преимущества именно дигидропиридиновых АК у данных категорий больных. Следует помнить, что дигидропиридиновые АК — одна из немногих групп препаратов, которые врач может назначать беременным с АГ.
Практикующие врачи при подборе терапии АГ не всегда следуют международным рекомендациям и нередко сами определяют приоритеты терапии. Интересно, что наиболее часто во всем мире назначаются АК: рынок АК составляет около 35 %, что существенно больше, чем у других групп гипотензивных препаратов; так, рынок иАПФ и БРА, вместе взятых, составляет только 39 % мирового рынка (16 и 23 % соответственно). В России же ситуация принципиально иная: по частоте использования иАПФ и БРА уверенно лидируют, занимая 47 % рынка, в то время как на долю АК приходится всего 13,9 %, что практически совпадает с частотой использования диуретиков. Однако еще более настораживает тот факт, что у нас до сих пор в основном назначаются АК первого поколения, регулярное лечение которыми, как отмечается в ряде работ, не может считаться ни достаточно эффективным, ни безопасным. Ярким примером этому служит анализ структуры продаж АК в одной из аптек в центре Москвы, проведенный во II квартале 2003 г., который показал, что 48 % продаж всех дигидропиридиновых АК до сих пор приходится на короткодействующие препараты первого поколения.
Говоря об эффективности и безопасности длительного приема антигипертензивных препаратов, используемых для лечения АГ, необходимо напомнить, что все крупные исследования по изучению влияния на «конечные точки» проводились и проводятся только с оригинальными препаратами. Единственным недостатком оригинальных препаратов является их высокая стоимость, что нередко ограничивает возможности комплексной терапии. Создание дженериков — копий оригинальных препаратов — существенно снижает стоимость лечения, однако порождает проблему оценки эквивалентности дженериков оригинальным препаратам. На сегодняшний день в России зарегистрировано около 60 дженериков эналаприла, порядка 30 дженериков амлодипина, более 10 дженериков индапамида, а недавно появился первый дженерик фозиноприла, биоэквивалентный оригинальному препарату
Понятно, что практикующему врачу трудно разобраться в таком многообразии препаратов, тем более что компании-производители в большинстве случаев не предоставляют данные о фармацевтической и фармакокинетической эквивалентности оригинальному препарату. Знакомство врачей с такими данными могло бы существенно облегчить проблему выбора препарата. В отсутствие подобной информации специалистам остается ориентироваться только на личный опыт, а также на результаты немногочисленных клинических исследований, посвященных сравнению оригинальных препаратов и дженериков или различных дженериков друг с другом.
Литература
- Шальнова С. А., Деев А. Д., Вихирева О. В. и др. Распространенность артериальной гипертонии в России. Информированность, лечение, контроль//Профилактика заболеваний и укрепление здоровья. 2001. № 2. С. 3–7.
- Демографический ежегодник России — 2002. М., 2002.
- D’Agostinio R. B., Wolf P. A., Belanger A. J., Kannel W. B. Stroke risk profile: adjustment for antihypertensive medication: the Framingham Study//Stroke. 1994; 25: 40–43.
- Mancia G. Prevention and treatment of stroke in patients with hypertension//Clin. Therapeutics. 2004; 26: 631–648.
- Levi F., Lucchini F., Negri E., La Vecchia C. Trends in mortality from cardiovascular and cerebrovascular diseases in Europe and other areas of the world//Heart. 2002; 88: 119–124.
- Opie L. H., Schall R. Evidence-based evaluation of calcium channel blockers for hypertension: equality of mortality and cardiovascular risk relative to conventional therapy//J. Am. Coll. Cardiol. 2002; 16: 39 (2): 315-22. Erratum in: J. Am. Coll. Cardiol. 2002; 17: 39 (8): 1409–1410.
- Staesssen J., Ji-Guang Wang, Thijs L. Calcium-channel blockade and cardiovascular prognosis: recent evidence from clinical outcome trials// Am. J. Hypertens. 2002; 15: 85–93.
- Poole-Wilson P., Lubsen J., Kirwan B. et al. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): a randomised controlled trial//Lancet. 2004; 364: 849–857.
- Guidelines Committee. 2003 European Society of Hypertension-European Society of Cardiology guidelines for the management of arterial hypertension//J. Hypertension. 2003; 21: 1011–1053.
- Марцевич С. Ю., Кутишенко Н. П., Дмитриева Н. А. Проблема выбора лекарственного препарата при лечении артериальной гипертонии//Кардиоваскулярная терапия и профилактика. 2004. № 3.
- Комитет экспертов ВНОК. Профилактика, диагностика и лечение артериальной гипертензии. Российские рекомендации (второй пересмотр)// приложение к ж. «Кардиоваскулярная терапия и профилактика». 2004.
- Schrader J., Luders S., Kulschewski A. et al. MOSES Study Group. Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention: principal results of a prospective randomized controlled study (MOSES)//Stroke. 2005; 36 (6): 1218–1226.
В. А. Егоров Ю. Э. Семенова, кандидат медицинских наук Ю. В. Лукина, кандидат медицинских наук ГНИЦ профилактической медицины, Москва
Классификация
Средства, уменьшающие стимулирующее влияние адренергической иннервации на сердечно–сосудистую систему: 1. Агонисты имидазолиновых I1–рецепторов 2. Центральные a2–адреномиметики 3. Блокаторы рецепторов: • a–адреноблокаторы; • b–адреноблокаторы; • a,b–адреноблокаторы.
Вазодилататоры: 1. Блокаторы кальциевых каналов 2. Активаторы калиевых каналов 3. Артериолярные вазодилататоры 4. Артериолярные и венозные вазодилататоры.
Диуретики (мочегонные средства).
Средства, влияющие на функции ангиотензина II: 1. Ингибиторы ангиотензинпревращающего фермента (иАПФ) 2. Блокаторы АТ1–рецепторов ангиотензина II 3. Ингибиторы вазопептидазы.
Сосудодвигательный центр продолговатого мозга регулирует АД при участии пресинаптических рецепторов – имидазолиновых I1–рецепторов и a2–адренорецепторов. Эти рецепторы, стабилизируя пресинаптическую мембрану, препятствуют выделению норадреналина к прессорным нейронам, что сопровождается снижением центрального симпатического тонуса и ростом тонуса блуждающего нерва. Основное значение в поддержании нормального АД имеют I1–рецепторы, локализованные в вентролатеральном ядрах продолговатого мозга; меньшую роль играют a2–рецепторы ядра солитарного тракта. Вероятный эндогенный лиганд имидазолиновых рецепторов – декарбоксилированный метаболит аргинина агмантин.
Переносимость иАПФ
Предмет особого внимания первостольников, как специалистов, отпускающих препарат, — побочные эффекты иАПФ. Несмотря на в целом благоприятный профиль безопасности, неблагоприятные реакции — слабое звено препаратов этой группы.
О чем предупредить клиента?
- На фоне приема иАПФ в 1–10 % случаев развивается сухой кашель [6]. По способности его вызывать разные представители группы практически не различаются между собой, и замена одного иАПФ на другой не позволяет улучшить переносимость в этом отношении [11].
- При приеме монопрепаратов иАПФ крайне редко может возникать отек Квинке (но чаще, чем при приеме других антигипертензивных) [2]. Считается, что ЛС этой группы не вызывают это осложнение, а облегчают его возникновение у предрасположенных пациентов. Отпуская иАПФ, уместно подчеркнуть, что при появлении сложностей с дыханием и одышки необходимо немедленно связаться с лечащим врачом [11].
Причина кашля на фоне приема иАПФ окончательно не определена. Предполагается, что ведущую роль играет накопление в слизистой оболочке бронхов брадикинина, который активируется при блокаде ангиотензина II [11].
Ингибиторы вазопептидазы
Омапатрилат обладает свойством иАПФ и ингибитора вазопептидазы (нейтральная эндопептидаза эндотелия2). Блокада вазопептидазы препятствует протеолизу натрийуретических пептидов, брадикинина и адреномедуллина. Это обеспечивает выраженный гипотензивный эффект, улучшение почечного кровотока, повышение экскреции ионов натрия и воды, а также тормозит продукцию коллагена фибробластами сердца и сосудов. Выявлена клиническая эффективность омапатрилата при стенокардии и ХСН (снижение летальности, рост толерантности к физической нагрузке, улучшение функционального класса).
Диуретики
Механизм антигипертензивного действия диуретиков связан со способностью препаратов уменьшать объем циркулирующей жидкости, прежде всего за счет снижения реабсорбции ионов натрия в почечных канальцах. В результате уменьшения нагрузки жидкостью снижается общее периферическое сопротивление сосудов и уровень АД. Гипотензивное действие диуретиков дополняется способностью этих препаратов уменьшать чувствительность стенки сосудов к естественным вазопрессорам (в том числе адреналину), в поддержании которой участвуют ионы натрия.
Наибольшее распространение в качестве антигипертензивных средств получили тиазидные и тиазидоподобные диуретики: гидрохлортиазид, хлорталидон, индапамид и др. Петлевые диуретики применяют лишь для купирования гипертонических кризов. Длительный прием любых диуретиков опасен развитием электролитного дисбаланса, поэтому при их назначении рекомендуется мониторинг содержания электролитов в плазме крови. При использовании тиазидных и тиазидоподобных диуретиков ежедневно в малых дозах риск осложнений терапии минимизируется без существенной потери необходимого гипотензивного действия.
Тиазидным и тиазидоподобным диуретикам можно отдать предпочтение при изолированной систолической АГ у лиц старшего возраста, при сопутствующей ХСН, женщинам с АГ в перименопаузальном периоде. Диуретиками удобно дополнять уже назначенные схемы лечения для достижения целевого уровня АД.
Антагонисты кальция (блокаторы медленных кальциевых каналов)
Согласно классификации по В. Nаuler все антагонисты кальция (АК) делятся на 3 группы: производные дигидропиридинов (нифедипин, исрадипин, амлодипин и др.), бензотиазепинов (дилтиазем), фенилалкиламинов (верапамил). АК ограничивают поступление ионов Са2+ в клетку, снижая способность мышечного волокна развивать сокращение. Вследствие ограничения поступления ионов Са2+ в клетку развиваются 3 основных эффекта, в той или иной степени свойственных всем АК: снижение сократимости миокарда (отрицательный инотропный эффект), уменьшение тонуса гладкой мускулатуры артерий (вазодилатирующий эффект), изменение порога возбуждения кардиомиоцитов проводящей системы (характерно для пульс–урежающих АК – верапамила и дилтиазема). Известно, что дигидропиридиновые АК могут повышать частоту сердечных сокращений, особенно на начальном этапе лечения.
АК снижают тонус артериол, с чем в основном и связано их антигипертензивное действие. За счет этого параллельно увеличивается почечный кровоток, что обеспечивает небольшой натрийуретический эффект, дополняемый уменьшением образования альдостерона под воздействием АК. Блокирование ионов Са2+ на уровне тромбоцитов приводит к снижению их агрегационной готовности.
Будучи высоко активными средствами, АК обладают целым рядом преимуществ, который нередко называют «метаболической нейтральностью»: препараты группы не влияют на липидный, углеводный, минеральный и пуриновый обмен. Поскольку АК улучшают коронарный и церебральный кровоток, их применение обосновано при АГ с сопутствующей ИБС или цереброваскулярной недостаточностью.
Агонисты имидазолиновых I1–рецепторов
Препараты, относящиеся к данной группе – моксонидин, рилменидин стимулируют имидазолиновые рецепторы, что приводит к торможению активности сосудодвигательного центра и симпато–адреналовой системы. Снижается периферическое сопротивление сосудов, сердечный выброс и как результат – АД.
Следует помнить, что агонисты имидазолиновых рецепторов могут усилить брадикардию и торможение атрио–вентрикулярной проводимости при их совместном использовании с b–адреноблокаторами.
Несмотря на то, что агонисты имидазолиновых рецепторов эффективно контролируют АД, терапевтические возможности этой группы препаратов (влияние на прогноз больных АГ, рациональное комбинирование с другими препаратами) требуют дальнейшего изучения.
a1–адреноблокаторы
Механизм антигипертензивного действия a1–адреноблокаторов (празозина, доксазозина) заключается в конкурентной блокаде a1–адренорецепторов гладкомышечных клеток сосудов, что препятствует избыточной стимуляции этих рецепторов катехоламинами. Происходит снижение периферического сопротивления сосудов и падение АД.
Важным свойством a1–адреноблокаторов является их благоприятное влияние на липидный профиль (повышение содержания антиатерогенных липопротеинов высокой плотности, снижение атерогенных липопротеинов низкой плотности и триглицеридов). При применении a1–адреноблокаторов высок риск развития гипотонии первой дозы, компенсаторной тахикардии, учащения мочеиспускания (a1–адренорецепторы подтипа А располагаются в простатической части уретры).
Ингибиторы ангиотензинпревращающего фермента
Ингибиторы АПФ – группа лекарственных средств, влияющих на многочисленные патологические звенья, приводящие к функциональным и структурным изменениям, которые лежат в основе различных заболеваний сердечно–сосудистой системы. Механизм действия иАПФ заключается в связывании ионов цинка в активном центре ангиотензинпревращающего фермента – ключевого фермента РААС и блокировании реакции перехода ангиотензина I в ангиотензин II, что снижает активность РААС как в системном кровотоке, так и на тканевом уровне (почки, миокард, головной мозг). Параллельно, благодаря ингибированию АПФ тормозится деградация брадикинина, что также способствует вазодилатации. В результате происходит системная артерио– и венодилатация, снижается пред– и постнагрузка на сердце, при наличии гипертрофии миокарда левого желудочка начинается процесс ее обратного развития (кардиопротекция). Похожий процесс наблюдается в мышечном слое артериальных сосудов (ангиопротекция). Ингибиторы АПФ тормозят пролиферацию мезангиальных клеток в почках, что используется в нефрологии (нефропротекция). Уменьшение продукции альдостерона ведет к снижению реабсорбции натрия и воды в проксимальных и дистальных канальцах нефронов.
Ингибиторам АПФ отдают предпочтение при наличии у больного АГ сопутствующей ХСН, постинфарктного кардиосклероза, сахарного диабета и его осложнений (в том числе нефропатии). Способность иАПФ восстанавливать функцию эндотелия используется при наличии у пациента дислипидемии и диффузных атеросклеротических поражений. При назначении иАПФ следует откорректировать дозу других антигипертензивных средств (особенно тиазидных диуретиков), если больной их принимает. Снижение АД на фоне иАПФ в большинстве случаев происходит плавно, в течение нескольких недель. Несмотря на то, что иАПФ в большинстве случаев достаточно хорошо переносятся, всегда следует помнить о возможности развития следующих побочных реакций, характерных для этой группы препаратов: сухой кашель, гиперкалиемия и нарушение функции почек, ангионевротический отек (на любом сроке лечения).
Ингибиторы АПФ противопоказаны при беременности ввиду опасности тератогений, одно– или двустороннем стенозе почечных артерий, стенозе устья аорты, митральном стенозе, обструктивном варианте гипертрофической кардиомиопатии.
Лекарственные средства, влияющие на ренин–ангиотензиновую систему
Ренин–ангиотензин–альдостероновая система (РААС) играет важную роль в регуляции АД, сердечной деятельности, водно–электролитного баланса. Ее активность возрастает при артериальной гипертензии, хронической сердечной недостаточности и диабетической нефропатии. При остром инфаркте миокарда активность РААС повышается уже в первые сутки, при осложненном течении инфаркта миокарда чрезмерная активация РААС сохраняется длительно после выписки больного из стационара. Высокая активность ренина и повышенное содержание ангиотензина II в крови являются показателями неблагоприятного прогноза у пациентов с сердечно–сосудистыми заболеваниями.
Для фармакологической блокады РААС используют иАПФ и непептидные антагонисты рецепторов ангиотензина II.