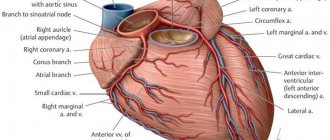
Mandeep Singh, MD; David R. Holmes, Jr, MD; A. Jamil Tajik, MD; и Gregory W. Barness, MD
Почти 8 миллионов людей в США страдают ИБС. К сожалению, количество пациентов ИБС, у которых невозможно выполнить хирургические или эндоваскулярные вмешательства продолжает расти. Для таких больных при неэффективности медикаментозной терапии, УНКП стала новым, неинвазивным, амбулаторным методом лечения, который улучшает качество жизни, снижая количество эпизодов ишемии миокарда, позволяющим повысить уровень физической активности. Мы сообщаем о клиническом случае 56-летней женщины, страдающей тяжелой ИБС, несмотря на максимально возможную медикаментозную терапию, которая прошла сеансы ЕЕСР, так как другие виды реваскуляризации были не возможны. После курса терапии ЕЕСР у нее были зафиксированы значительное уменьшение эпизодов стенокардии, полное исчезновение признаков ишемии миокарда по данным нагрузочной сцинтиграфии миокарда. Данный случай подтверждает то, что УНКП является безопасным и эффективным методом лечения, уменьшающим симптомы ишемии миокарда у пациентов, которым стандартная чрескожная или хирургическая реваскуляризация миокарда невозможны.
АКШ- аортокоронарное шунтирование; ИБС; ЭКГ- электрокардиография; УНКП= Усиленная наружная контрпульсация.
Стандартная терапия пациентов с симптоматичной ИБС в настоящее время включают фармакологическое лечение (β-адреноблoкаторы, блокаторы кальциевых каналов, нитраты), чрескожное коронарное вмешательство, и хирургическую реваскуляризацию. Ограничения каждой из этих стратегий включают связанные с процедурами смертность и заболеваемость, побочные действия лекарственных средств, рестенозы после чрескожных вмешательств и время – зависимую недостаточность шунтов после операции аортокоронарного шунтирования. И хотя большинству пациентов показано проведение медикаментозной терапии, у многих из них не наблюдается полного исчезновения симптомов болезни, только при использовании лекарств. К тому же, наблюдается рост числа пациентов, которые не подходят для традиционных процедур реваскуляризации. Тяжелое поражение дистальных отделов коронарного русла ограничивает возможность реваскуляризации. Среди пациентов, перенесших операцию реваскуляризации и нуждающихся в повторных процедурах, смертность и заболеваемость, связанные с повторными процедурами, значительно выше, что зачастую служит причиной для исключения их из кандидатов на повторные процедуры реваскуляризации. Поэтому у этих пациентов не наблюдается оптимального купирования симптомов болезни.
Недавно терапевтические возможности были расширены, возможностями трансмиокардиальной реваскуляризации или чрескожной лазерной реваскуляризации миокарда, минимально инвазивной операции АКШ, чрескожной электрической стимуляции нервов. Также были применены разнообразные терапевтические подходы, включающие использование факторов роста.
Более новые методы лечения все еще находятся в стадии экспериментальных разработок, или же с ними было проведено очень ограниченное количество клинических исследований. Много новых приборов используются инвазивно, что связано со значительным риском появления осложнений. Усиленная внешняя контрпульсация (УНКП) была представлена как неинвазивная, нетравматичная процедура для амбулаторного лечения пациентов с ИБС. УНКП увеличивает перфузионное давление в коронарных артериях в результате диастолического увеличения и снижает потребность миокарда в кислороде. Мы представляем клинический случай пациента, который прошел лечение с помощью УНКП, а также обзор литературы и информации, касающийся настоящего состояния технологии УНКП.
История болезни
Женщина в постменопаузальном периоде, 56 лет, страдающая гипертонией, гиперлипидемией, и с 10-летним стажем инсулинозависимого сахарного диабета, с рефрактерной стенокардией напряжения IV ФК, несмотря на применение оптимальной антиангинальной терапии, включавшей дилтиазем (медленно высвобождающая форма) 300 мг/день; атенолол, 100 мг/день; пероральные нитраты, 60 мг/день. С 1996 г. она страдала тяжелой ИБС с приступами типичной стенокардии., ранее выполнена коронарная ангиография с чрескожным вмешательством на правой коронарной артерии. Вследствие сохранения стенокардии и тяжелой ИБС, она перенесла операцию АКШ в июле 1996 г., с маммарокоронарным шунтированием передней нисходящей коронарной артерии (ПНА) и венозным шунтированием I диагональной ветви, интермедианной артерии и правой коронарной артерии.
Через 1 год, стенокардия напряжения рецидивировала. Ангиография выявила поражение ствола ЛКА и 3-сосудистое поражение с окклюзией венозных шунтов. Шунт к ПНА был хорошо проходим, 80% сужение венозного шунта в ПКА устранено путем стентирования.
Через 2 месяца после процедуры, у пациентки развилась клиника прогрессирующей стенокардии напряжения и покоя, и в течение года от коронарного вмешательства, она была госпитализирована с диагнозом нестабильная стенокардия. Она жаловалась на частые приступы стенокардии, которые возникали как в состоянии покоя, так и при минимальных физических нагрузках. Она принимала от 1 до 4 таблеток нитроглицерина под язык ежедневно. Во время выполнения нагрузочной (АТФ) сцинтиграфии миокарда с талием выявлено снижение АД на нагрузке, сопровождавшееся болью в груди и изменениями на ЭКГ.
Выявлены дефекты перфузии апикальных, нижних и нижнесептпальных сегментов со снижением миокардиального резерва. Повторная коронарная ангиография выявила 50% стеноз дистальной части ствола ЛКА и 75% стеноз в проксимальной трети ПНА. Заболевание прогрессировало как в венозных шунтах, так и в коронарных артериях, включая как тяжелое поражение ПНА, дистальные места введения шунта, так и в ПКА. Шунт к ПКА артерии был окклюзирован. Эхокардиография показала нормальную систолическую функцию левого желудочка. Вопрос о процедуре повторной реваскуляризации не рассматривался из-за тяжелого поражения дистального русла. Несмотря на активное медикаментозное лечение с применением аспирина, нитратов, блокаторов ангиотензинконвертирующего фермента, бета-адреноблокаторов, статинов, витаминов Е и С, пациентка продолжала жаловаться на частые приступы стенокардии покоя и малых напряжений. Дальнейшее усиление медикаментозной терапии было невозможным, из-за того, что АД было на пограничном уровне (90/70 мм рт. ст.), и наблюдалась синусовая брадикардия. Поэтому больная была направлена на сеансы УНКП.
Материал и методы
В период с 2007 по 2013 г. на базе отделения кардиохирургии № 2 Ростовской областной клинической больницы (Ростов-на-Дону), выполнено более 5000 коронарных шунтирований, из них 60 пациентам выполнено АКШ в cочетании с ТМЛР. Информированное согласие было получено от каждого пациента. Критериями включения в исследование были диффузное поражение КА, атеросклеротическое изменение дистального русла или наличие мелких, неподходящих для шунтирования КА, сохранение в области операции жизнеспособного миокарда. Если имелась возможность прямой реваскуляризации хотя бы одной КА, выполняли АКШ, которое дополняли ТМЛР в тех зонах, которые не были доступны реваскуляризации. Критериями исключения были тяжелая хроническая обструктивная болезнь легких (объем форсированного выдоха за 1 с <55% от прогнозируемого значения); острый период инфаркта миокарда; тяжелые нарушения ритма; декомпенсированная сердечная недостаточность.
Исследуемую группу составили 52 мужчины и 8 женщин в возрасте от 46 лет до 81 года (средний возраст 65,9±7,3 года). Большинство больных (n
=44) имели стенокардию напряжения IV Ф.К. Общая сводная характеристика больных представлена в табл. 1.
Таблица 1. Общая характеристика больных Примечание. ФВ ЛЖ — фракция выброса левого желудочка, ИМ — инфаркт миокарда, ХСН — хроническая сердечная недостаточность.
Больным для объективизации состояния выполнялись коронароангиография, холтеровское мониторирование ЭКГ. Определение класса стенокардии проводилось согласно рекомендациям Канадского сердечно-сосудистого общества и модифицированного протокола Брюса. До хирургического лечения пациенты не в состоянии были выполнять нагрузочные пробы (тредмил-тест) из-за выраженной стенокардии. Для диагностики жизнеспособности миокарда проводили сцинтиграфию миокарда и ЭхоКГ. Все операции выполнялись стандартно: в условиях искусственного кровообращения и фармакохолодовой кардиоплегии раствором Кустодиол. Во всех случаях сначала выполнялось АКШ, затем ТМЛР — после наложения шунтов и восстановления кровотока в КА в условиях искусственного кровообращения (ИК). Во всех случаях лазерную реваскуляризацию выполняли с помощью отечественной ЭКГ-синхронизированной лазерной установки Перфокор. После расположения рукоятки манипулятора над поверхностью сердца подавали импульс, синхронизированный с ЭКГ пациента относительно зубца R. Пенетрация всей толщи миокарда при помощи 500 Вт СО2-лазера происходила за один импульс, что подтверждалось появлением пульсирующей струи крови из трансмиокардиального канала, а также данными чреспищеводной эхокардиографии в виде пузырьков газа в полости Л.Ж. При этом нарушений ритма не возникало, а кровотечение из канала останавливалось самостоятельно либо прижатием марлевым тупфером или салфеткой в течение 2 мин. В плевральную полость устанавливался активный дренаж, и грудную клетку ушивали по стандартной методике.
У всех пациентов оценивали показатели госпитальной, отдаленной и общей летальности, а также динамику таких клинических параметров, как ФК стенокардии, потребность в приеме нитроглицерина, толерантность к физическим нагрузкам, сократимость миокарда, ФВ ЛЖ, перфузия миокарда. Динамику качества жизни определяли по анкетам SF-36, при этом оценивали психоэмоциональное и физическое состояние больных в различные сроки после операции. Рассчитывали показатели выживаемости, свободы от возврата стенокардии и инфаркта миокарда в отдаленные сроки.
Пациенты находились под клиническим наблюдением в ближайшем послеоперационном периоде (в стационаре или 30 дней амбулаторно) и отдаленном периоде: через 3, 6 и 12 мес после операции и далее выборочно до 10 лет после операции (в среднем через 7,5±0,9 года). В каждом интервале у больных оценивались основные неблагоприятные сердечные события, класс стенокардии, ФВ ЛЖ и необходимость повторных реваскуляризаций.
В первые часы после операции проводился инвазивный контроль гемодинамики, мониторинг ЭКГ, газового состава крови, кислотно-щелочного состояния и биохимических показателей, включая ферменты-маркеры некроза миокарда. Анализ ЭКГ в первые часы после ТМЛР показал, что, несмотря на воздействие лазера на миокард, данных за повреждение миокарда или его ишемию не выявлено.
Протокол лечения УНКП
Все потенциальные пациенты для получения сеансов УНКП имели подробную медицинские документы, кроме того, они подверглись тщательному физикальному осмотру, во время которого обращали внимание на симптомы болезни, ранее выполненные процедуры реваскуляризации, и документы подтверждающие ИБС (таблица 1). Особые предосторожности были приняты для того, чтобы выявить у пациентов наличие каких-либо противопоказаний к проведению данной процедуры (таблица 2).
Принцип работы УНКП состоит в последовательном наполнении и выкачивании воздуха из манжет, обернутых вокруг икр, бедер пациента. Наполнение и выкачивание воздуха в манжетах синхронизировано с сердечным циклом, и контролируется сигналами ЭКГ, которые обрабатываются микропроцессором (рис.1). В результате компрессии мышц нижних конечностей увеличивается диастолическое давление в аорте, что приводит к увеличению перфузионного давление в коронарных артериях. Сеансы продолжаются обычно 1 час в день, общий курс состоит из 35 часов в течение 7 недель.
Таблица 1. Показания для лечения УНКП
| Cимптомы ишемии миокарда (соответствующие III-IV ФК), несмотря на проведение оптимальной медикаментозной терапии. Пациенту не показана хирургическая или чрескожная реваскуляризация. ИБС подтверждена наличием: стеноза >70%, по крайней мере, в 1 из основных эпикардиальных коронарных артерий и/или шунта, или сцинтиграфических или эхокардиографических признаков инфаркта миокарда и/или ишемии миокарда, или наличие в анамнезе инфаркта миокарда. |
Таблица 2. Относительные противопоказания к УНКП
| Сохраняющаяся, устойчивая ишемия. Декомпенсированная застойная сердечная недостаточность. Тяжелая патология клапанного аппарата. Неконтролируемая артериальная гипертензия (> 180/110 мм рт. ст.). Злокачественные аритмии. Тяжелая патология периферических сосудов. Наличие в анамнезе флебита, глубокого венозного тромбоза, тяжелого варикозного расширения вен, или трофической язвы. Геморрагический диатез, включая продолжающееся применение варфарина с МНО >2.0. Повышенный риск кровотечения (в пределах 7 дней после ангиографии или другой инвазивной процедуры). Беременность или фертильные женщины, которые не используют надежный метод контрацепции, для того, чтобы избежать беременности. |
Эндоваскулярные методы диагностики
Медицину XXI века невозможно представить без эндоваскулярных методов диагностики и лечения. В настоящее время рентгенэндоваскулярная хирургия является высокоэффективным и малотравматичным методом лечения при коронарной болезни, сосудистой и клапанной патологии, врожденных пороках сердца. Эндоваскулярная хирургия занимает свою нишу практически во всех областях современной медицины (онкология, урология, гинекология и т.д.). Развитие эндоваскулярных методов лечения способствует тесному сотрудничеству эндоваскулярных хирургов, кардиологов, кардиохирургов и других смежных специальностей. Такое сотрудничество привело к развитию нового направления — так называемой гибридной хирургии.
За последние десятилетия в нашей стране значительно увеличилось число клиник, занимающихся эндоваскулярной хирургией. Девяностые годы XX столетия стали эпохой расцвета эндоваскулярной хирургии. Катетерная техника достигла высокого уровня развития и постоянно продолжает совершенствоваться. Практически ежегодно возникают высокотехнологические новшества. Части из них суждено остаться в истории интервенционной кардиологии, а части — стать совершенным орудием оператора. И только большой экспериментальный и клинический опыт сможет определить место каждого метода в эндоваскулярной хирургии.
На сегодняшний день рентгенэндоваскулярные вмешательства представляют альтернативу практически любой открытой операции по поводу патологии сердца и сосудов. Спектр выполняемых эндоваскулярных вмешательств огромен.
ФГБУ НМИЦ ССХ им. А.Н. МЗ РФ является одним из пионеров отечественной эндоваскулярной хирургии. Именно здесь в 1982 году был заложен краеугольный камень многих школ по рентгенэндоваскулярным диагностике и лечению. Сегодня отделения ФГБУ НМИЦ ССХ им. А.Н. МЗ РФ, занимающиеся оказанием рентгенэндоваскулярной медицинской помощи оснащены современнейшим оборудованием, не уступающим ведущим клиникам Европы и США, включая все доступные методики внутрисосудистой визуализации и инвазивной оценки внутрикоронарной физиологии. Ежегодно в центре выполняется более 15000 диагностических эндоваскулярных вмешательств и более 3000 тысяч эндоваскулярных операций у пациентов с ишемической болезнью сердца, сосудистой патологией, врожденными и приобретенными пороками сердца. Состав отделений представлен первоклассными специалистами международного уровня, обладающими большим опытом выполнения данных операций при сложных клинических случаях.
Ишемическая болезнь сердца
Ишемическая болезнь сердца — острое или хроническое поражение миокарда, возникающее вследствие уменьшения или прекращения снабжения сердечной мышцы артериальной кровью, в основе которого лежат патологические процессы в системе коронарных артерий. ИБС широко распространенное заболевание. Одна из основных причин смертности, временной и стойкой утраты трудоспособности во всем мире. В структуре смертности сердечно-сосудистые заболевания стоят на первом месте, из них на долю ИБС приходится около 40%.
Этиология ИБС
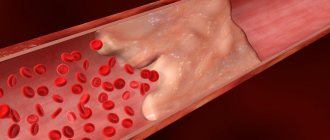
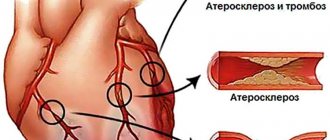
Ведущий этиологический фактор развития ишемической болезни сердца — атеросклероз коронарных артерий. Атеросклероз развивается последовательно, волнообразно и неуклонно. В результате накопления холестерина в стенке артерии формируется атеросклеротическая бляшка. Избыток холестерина приводит к увеличению бляшки в размере, возникают препятствия току крови. Симптомы усугубляются с ростом атеросклеротической бляшки, постепенно суживающей просвет артерии. Уменьшение площади просвета артерии более чем на 90-95% является критическим, вызывает снижение коронарного кровотока и ухудшение самочувствия даже в покое.
Клиническая картина ИБС
Первое описание стенокардии предложил английский врач Уильям Геберден в 1772 году: «…боль в грудной клетке, возникающая во время ходьбы и заставляющая больного остановиться, в особенности во время ходьбы вскоре после еды. Кажется, что эта боль в случае ее продолжения или усиления способна лишить человека жизни…» Обычно симптомы болезни впервые появляются после 50 лет. В начале возникают только при физической нагрузке.
Классическими проявлениями ишемической болезни сердца являются:
- Боль за грудиной, часто иррадиирует в нижнюю челюсть, шею, левое плечо, предплечье, кисть, спину. Часто возникает на морозе.
- Боль давящая, сжимающая, жгучая, душащая. Интенсивность различная.
- Провоцируется физическими или эмоциональными факторами. В покое прекращается самостоятельно.
- Длится от 30 секунд до 5-15 минут.
- Быстрый эффект от приема нитроглицерина.
Диагностика ИБС
«Золотым стандартом» в диагностике обструктивных поражений коронарных артерий сердца считается селективная коронарография.
Это рентгеноконтрастное исследование применяется для того, чтобы узнать является ли существенным сужение сосуда, какие артерии и сколько их поражено, в каком месте и на каком протяжении.
Лечение ИБС
Лечение данной патологии в первую очередь направлено на восстановление нормального кровоснабжения миокарда и улучшение качества жизни больных. К сожалению, чисто терапевтические (консервативные) методы лечения не всегда эффективны. На сегодняшний день общепринятыми методами лечения ИБС с доказанной и неоспоримой эффективностью является хирургическая реваскуляризация миокарда – коронарное шунтирование (КШ) и чрескожное коронарное вмешательство (ЧКВ) или «стентирование».
Первое стентирование коронарной артерии у человека выполнили J. Puel и соавт. в марте 1986 г. в Тулузе (Франция) и практически одновременно с ними U. Sigwart и соавт. в Лозанне (Швейцария).
Сегодня в эпоху высоких технологий в области фармацевтики и медицинской инженерии современные внутрикоронарные стенты позволяют достичь хороших результатов как в раннем, так и в отдаленном периодах после ЧКВ.
Данная операция выполняется под местной анестезией. В области запястья или бедра проводится пункция артерии (лучевой или бедренной), устанавливается интродьюсер (катетер), через него по проводнику под контролем ангиографической установки заводится проводниковый катетер.
Катетер устанавливается в левую или правую коронарную артерию, далее производится серия снимков. Через установленный катетер проводится микропроводник в артерию через пораженный участок. По микропроводнику к пораженному участку заводится и устанавливается коронарный стент.
На сегодняшний день спектр чрескожных коронарных вмешательств значительно расширился от лечения простых локальных сужений до многососудистой реваскуляризации миокарда (в т.ч. ствола левой коронарной артерии) и реканализации хронически окклюзий (полностью закрытых сосудов) коронарных артерий. Сегодня в клиническую практику внедрены стенты со специальным биорассасывающимся покрытием,
позвовляющим снизить частоту рестеноза (зарастания) и тромбоза стента, тем самым минимизируя риск повторных инфарктов у пациента после стентирования. Также в широко введены методы внутрисосудистой визуализации, позволяющие получить изображения коронарных артерий в режиме реального времени у пациента во время операции, сопоставимые с данными, полученными при использовании светового микроскопа. Все вышесказанное позволяет получить внутрипросветное изображение коронарных артерий в режиме реального времени. Это позволяет хирургу получить «ювелирный» результат при установке стента в коронарные сосуды.
Интраоперационная шунторафия
В ФГБУ НМИЦ ССХ им. А.Н. Бакулева в рутинную практическую деятельность введена интраоперационная шунтография
. Интраоперационная шунтография представляет с собой ангиографическое исследована на завершающем этапе операции аорто-коронарного шунтирования. С помощью анигографии проверяется проходимость всех наложенных шунтов прямо в кардиохирургической операционной. В случае выявления поражения или нарушения функционирования шунта, оперирующий хирург получает возможность устранить её непосредственно в операционной, тем самым достигается «идеальный» результат большой кардиохирургической операции.
ФГБУ НМИЦ ССХ им. А. Н. Бакулева МЗ РФ является единственным центром в Российской Федерации и одним из не многих центров мира, где интраоперационная шунтография выполняется одновременно с коронарным шунтированием.
Врожденные пороки сердца (ВПС)
Вторая половина ХХ века ознаменовалась головокружительными успехами фактически во всех аспектах детской сердечно-сосудистой хирургии.
В настоящее время с помощью рентгенэндоваскулярных методов лечения можно устранить такие врожденные пороки сердца как дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП) или Боталлов проток, открытое овальное окно ( ООО), дефект межжелудочковой перегородки (ДМЖП), коарктация аорты. За последнее десятилетие данные вмешательства стали «стандартной» процедурой практически с нулевой летальностью. Рентгенэдоваскулярные методы лечения являются методом выбора при таких критических состояниях новорожденных, как критический клапанный стеноз аорты и легочной артерии. Выполнение баллонной атриосептостомии, предложенной в 1966 году Рашкиндом и Миллером, у новорожденных со сложными ВПС несовместимыми с жизнью привело резкому снижению летальности среди этой тяжелой категории больных.
На сегодняшний день в ФГБУ НМИЦ ССХ им. А.Н. Бакулева МЗ РФ выполняется полный спектр эндоваскулярных вмешательств при врожденных пороках сердца у пациентов всех возрастных групп,
в том числе у новорожденных с критическими пороками развития сердца и сосудов.
Многие операции выполнены впервые в мировой практике, а разработанные методики имеют уникальный характер.
Наиболее часто встречаются открытый артериальный проток, дефект межпредсердной перегородки, коарктация аорты, клапанный стеноз аорты и легочной артерии.
Коарктации аорты
Коарктация аорты — это врожденное сужение аорты в области перехода дуги в нисходящую часть аорты, а иногда в грудном или брюшном ее отделе. Частота данного порока колеблется от 6,3% до 15% среди всех врожденных пороков сердца (ВПС). Порок редко носит изолированный характер, чаще он сочетается с другими ВПС.
Клиника
Пациенты жалуются на головокружение, тяжесть и головную боль, повышенную утомляемость, носовые кровотечения, возможны боли в сердце, а также на слабость и боли в нижних конечностях, судороги в мышцах ног, зябкость стоп. У женщин возможны нарушения менструального цикла, бесплодие. При осмотре отмечается хорошее физическое развитие с диспропорцией мышечной системы: мышцы верхней половины туловища гипертрофированы при относительной гипотрофии мышц таза и нижних конечностей, ноги на ощупь холодные. При пальпации межреберных артерий отмечается их повышенная пульсация.
Решающее значение в диагностике коарктации аорты имеет определение характера пульса на руках и ногах. На бедренных артериях отсутствует или резко ослаблена пульсация и при этом напряженный пульс на верхних конечностях. Систолическое артериальное давление на руках у больных с изолированной резко выраженной коарктацией аорты достигает высоких цифр до 190-200/90-100 мм рт.ст.
Диагностика
Диагноз предполагают по данным клинического обследования (в том числе измерения артериального давления на всех 4 конечностях), подтверждают рентгенографией грудной клетки и ЭКГ и устанавливают на основании результатов двухмерной эхокардиографии с цветным потоком и допплеровского исследования. У старших пациентов – с помощью КТ- или МР-ангиографии.
Наиболее информативным методом выявления коарктации аорты является
двухмерная эхокардиография(ЭхоКГ).
Эндоваскулярное лечение В нашей стране первую ТЛБАП коарктации аорты произвели Ю.С. Петросян и соавт. в 1985 году в Институте сердечно-сосудистой хирургии АМН СССР. Операция выполняется под седацией через небольшой прокол бедренной артерии. Через прокол проводится катетер и баллон к месту сужения аорты. Далее выполняется расширение суженного участка аорты баллоном соответствующего размера с восстановлением просвета и кровотока по аорте. ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» обладает большим опытом лечения коарктации аорты.
Ангиограмма пациента с коарктацией аорты, выполненной артериальным доступом:
а- аорторафия до баллонной ангиопластики, стрелками указана мембрана в области перешейка аорты;
б — ракрытие баллона (стрелкой указана перетяжка, соответсвующая области коарктации арты);
в- аортография после баллонной ангиопластики — сужение перешейка аорты устранено.
Стентирование коарктации аорты у детей весом более 15кг
Стентирование коарктации/рекоарктации показано у детей весом более 15-20 кг. Необходимо помнить, что стентирование коарктации аорты выполняется специальными стентами, которые в дальнейшем, с ростом ребенка, можно дорасширить.
Рисунок. Стентирование коарктации аорты
А – при аортографии визуализировано сужение перешейка
Б — после стентирования коарктации аорты.
КЛАПАННЫЙ СТЕНОЗ АОРТЫ У НОВОРОЖДЕННЫХ
Клапанный стеноз аорты — врожденный порок сердца, при котором отмечается срастание створок аортального клапана. Без хирургического вмешательства смертность среди новорожденных с врожденным клапанным стенозом аорты крайне высока – погибает почти 85-90% больных в течение первого месяца жизни.
Симптоматика
Новорожденные с тяжелым стенозом аорты становятся раздражительными, плохо едят, потеют во время кормления, у них затруднено дыхание, кожа приобретает неестественно бледную или сероватую окраску, мерзнут ладони рук и ступни ног, снижается объем мочи и учащается сердцебиение.
Лечение
Баллонная дилатация (расширение) клапана аорты является одним из методов лечения
Опыт ФГБУ «НМИЦССХ им. А.Н. Бакулева»
Большим опытом выполнения баллонной вальвулопластики в стране как у новорожденных и грудных детей, так и у детей старшего возраста обладает НМИЦ ССХ им. А. Н. Бакулева.
Рисунок. Этапы выполнения транслюминальной баллонной вальвулопластики клапанного стеноза аорты.
а — ангиография восходящего отдела аорты: видна струя (стрелка) некотрастированной крови, свидетельствующей о стенозе клапана аорты;
б — левая вентрикулография (стрелкой указан поток неконтрастированной крови из ЛЖ, также указывающий на стеноз клапана аорты);
в – позиционирование баллона в проекции клапана аорты. Рентгенконтрастные метки баллона (стрелки) располагаются выше и ниже фиброзного кольца клапана аорты;
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) – врожденный порок сердца (ВПС), характеризующийся наличием сообщения (отверстия) между правым и левым предсердием, которое обуславливает существование артериовенозного сброса между ними. Риск развития ДМПП у будущего ребенка существенно выше в тех семьях, где есть родственники с ВПС. Кроме наследственной обусловленности, к возникновению ДМПП, могут приводить вирусные заболевания беременной (краснуха, ветряная оспа и др.), эндокринопатии, прием некоторых медикаментов и алкоголя во время беременности, производственные вредности, гестационные осложнения (токсикозы, угроза выкидыша и др.)
Жалобы
Одышка и сердцебиение являются наиболее частыми ранними симптомами заболевания при больших ДМПП у детей, но обычно в течение первых месяцев жизни происходят компенсация гемодинамики и регресс клинической картины. В дальнейшем у большей части детей ДМПП протекают асимптомно, пациенты жалоб не имеют. Дети нередко имеют астеническое телосложение с заметной бледностью кожных покровов.
Диагноз
ДМПП рекомендуется ставить при помощи трансторакальной эхокардиографии (ЭхоКГ) с применением режима цветного допплеровского картирования, что является основным диагностическим инструментом в постановке диагноза ДМПП, определении его размера, локализации, объема и направления шунтирования крови.
На сегодняшний день эндоваскулярные методы лечения при соответствующий анатомии являются методом выбора при лечении ДМПП. Закрытие дефектов происходит с помощью специальных устройств-окклюдеров. Окклюдер представляет с собой двухдисковое устройство — левый диск открывается в левом предсердии, правый диск — в правом. Дефект остается между двумя дисками. Операция выполняется под местной анестезией доступом через бедренную вену. Продолжительность операции 40-60 минут. После операции пациент переводится в палату и может быть выписан на следующий день.
Рисунок. Различные модификации окклюдеров для закрытия дефекта межпредсердной перегородки.
Открытый артериальный проток
Открытый артериальный проток (ОАП) – сосуд, через который после рождения сохраняется патологическое сообщение между аортой и лёгочной артерией (ЛА). Комментарии: в норме ОАП обязательно присутствует у плода, но закрывается вскоре после рождения, превращаясь в артериальную связку.
Факторами риска открытого артериального протока являются преждевременные роды и недоношенность, семейный анамнез, наличие других ВПС, инфекционные и соматические заболевания беременной.
ОАП обычно встречается у недоношенных детей и крайне редко у детей, рожденных в срок.
Жалобы больных при ОАП неспецифичны. Клинические проявления зависят от величины протока и стадии гемодинамических нарушений. Течение порока варьируется от бессимптомного до крайне тяжелого. При больших размерах протока, последний проявляет себя уже с первых недель жизни признаками сердечной недостаточности, отставанием в физическом развитии. У детей раннего возраста при крике (либо натуживании) может появиться цианоз, который отчетливее выражен на нижней половине туловища, особенно на нижних конечностях. Характерно, что цианоз исчезает после прекращения нагрузки.
Диагностика
Основным методом диагностики является ультразвуковое исследование и аускультация. Аускультация выявляет характерный для порока «машинный» шум во втором-третьем межреберье слева от грудины, иррадиирующий в межлопаточное пространство и сосуды шеи.
Лечение
Основным методом лечения ОАП является рентгенэндоваскулярное вмешательство. Маленькие протоки закрываются с помощью спиралей, большие (более 3-х мм) — посредством окклюдеров. P. Cambier в 1992 г. впервые в мире применил спираль для эмболизации открытого артериального протока. Операции выполняется доступом через бедренную артерию или вену без вскрытия грудной клетки. Длительность операции 30-40 минут. Пациент переводится в палату под наблюдением и через день может быть выписан. Имплантируемые устройства являются МРТ- совместимыми, т.е возможно выполнение МРТ — исследования через 6 месяцев.
А Б
Рисунок. А — Открытый артериальный проток. Б — после закрытию протока спиралью.
Большие протоки закрываются с помощью специальных устройств — окклюдеров.
Рисунок. Окклюдер для закрытия открытого артериального протока.
Открытое овальное окно
Открытое овальное окно (ООО) представляет собой короткий межпредсердный канал (средняя длина 5 мм), расположенный точно на оси кровотока, поступающего из нижней полой вены. У 25-30% отсутствует полная анатомическая окклюзия, и овальное окно остаётся открытым или, точнее говоря, открываемым. Это называется ООО и, как правило, не считается отклонением, а скорее вариантом нормы. В большинстве случаев ООО остаётся бессимптомным и не проявляет себя. Наиболее очевидными проявлениями ООО являются парадоксальные артериальные эмболии, самыми серьёзными из которых являются вызванные ими инсульты.
Показания для закрытия ООО:
Мигрень (с аурой), апноэ во сне, инсульт, занятия дайвингом, высокогорный отёк лёгких ООО закрывается с помощью специальных окклюдеров. Операция проходит под местным обезболиванием, доступом через бедренную вену. По установленному катетеру проводится окклюдер, который закрывает ООО с помощью двух дисков («сэндвич»).
Рисунок. Различные устройства для закрытия открытого овального окна
Сосудистая патология
Эндоваскулярные методы лечения сосудов и вен является одной из самых интересных и быстро развивающихся специальностей медицины с неуклонным ростом количества операций. Эндоваскулярные методы лечения применяются при поражении всех магистральных сосудов и вен (сонны, почечных, подключичных артерий, сосудов нижних конечностей).
Сосудистая патология
Рентгенэндоваскулярные методы диагностики и лечения занимают лидирующие позиции при лечении сосудистой патологии, и их доля с каждым годом неуклонно растет. Наиболее активно данные методы используются при патологии сонных, брахиоцефальных, почечных артерий, сосудов нижних конечностей.
Стентирование внутренней сонной артерии
Согласно данным американской кардиологической ассоциации (AHA/ASA) ежегодно в США регистрируется приблизительно 6,5 миллионов случаев инсультов. Около 20% всех ишемических инсультов возникает вследствие атеросклеротического стеноза сонных артерий, обычно расположенных в области их деления на наружную и внутреннюю артерии. Атеросклероз ВСА является одной из основных патологий ВСА, которая представляет угрозу развития инсульта головного мозга вследствие закупорки сосудов головного мозга, с последующей инвалидизацией или приводящая к летальному исходу.
Клиника:
При нарушении
проходимости возникают следующие проявления:
- инсульт
- головокружение
- шум в ушах
- потемнение в глазах
- слабость
Часто стеноз артерий предшествует острому нарушению мозгового кровоснабжения. Распознать патологию можно по следующим симптомам:
- тошнота и рвота
- головная боль
- онемение конечностей или одной из сторон лица
- сложности с координацией
- проблемы с речью
Диагностика:
- УЗДГ
- КТ – ангиография
- Ангиография
Оперативное вмешательство:
Одним из методов лечения стенозов внутренней сонной артерии (ВСА) является стентирование ВСА. Метод заключается в установке высокотехнологичного, биосовместимого, металлического (хромокобальтовый сплав) каркаса в зону сужения с полным восстановлением просвета артерии, что предотвращает развитие острых нарушений мозгового кровоснабжения (ТИА и инсульта).
Данная операция выполняется под местным обезболиванием доступом через бедренную или лучевую артерии (через бедро или руку). Через установленный катетер в пораженный участок сонной артерии проводится и имплантируется специальный самораскрывающийся стент различного дизайна. С целью уменьшения количества осложнений, при всех операциях используются специальные ловушки-фильтры. Пациент после операции переводится в палату и на следующий день выписывается.
Клинические примеры:
- Стеноз левой ВСА 85%
- Стеноз правой ВСА 95%
Стентирование почечной артерии
Кровоснабжения почек обеспечивается почечными артериями, отходящими от самого крупного сосуда в организме (аорта). При стенозе почечных артерий у пациента развивается так называемая вазоренальная гипертензия. Прогрессирование стеноза со временем может привести к развитию почечной недостаточности.
Диагностика:
- УЗДГ
- КТ – ангиография
- Ангиография
Оперативное вмешательство:
Стентирование почечной артерии является эффективной и безопасной процедурой. Метод заключается в установке высокотехнологичного, биосовместимого, металлического (хромокобальтовый сплав) каркаса в зону сужения, под местной анестезией, с полным восстановлением просвета артерии, что предотвращает дальнейший прогресс ишемии органа (снижение функции), а также приводит к стабилизации артериального давления.
Стентирование артерий нижних конечностей
Патология:
Атеросклероз артерии нижних конечностей является одной из основных патологий, которая представляет угрозу развития ишемии нижних конечностей, приводящие к снижению функции нижних конечностей, а также к трофическим поражения тканей.
Клиника:
При нарушении проходимости возникают следующие проявления:
- Боли в ногах при ходьбе — «перемежающаяся хромота»
- Онемение, похолодание стоп
- Уменьшение волосяного покрова
- Дистрофия ногтевых пластинок
- Трофические язвы
- Сухая гангрена
- Влажная гангрена
- Нарушение функций органов малого таза
Диагностика:
- УЗДГ
- КТ – ангиография
- Ангиография
Оперативное вмешательство:
Стентирование артерий нижних конечностей является эффективной и безопасной процедурой. Метод заключается в установке высокотехнологичного, биосовместимого, металлического (хромокобальтовый сплав) каркаса в зону сужения, под местной анестезией, с полным восстановлением просвета артерии, что предотвращает развитие хронических и острых нарушений кровоснабжения нижней конечности, а также убирает клинику заболевания.
Стентирование подключичной артерии
Атеросклероз подключичной артерии развивается чаще всего в начальном отделе этой артерии и может сопровождаться развитием симптомов нарушения кровообращения в руке или к недостаточности мозгового кровообращения из-за феномена позвоночно-подключичного обкрадывания, когда кровь оттекает по позвоночной артерии в подключичную, вследствие чего возможно развитие ишемии головного мозга.
Клиника:
При нарушении ее проходимости возникают следующие проявления:
- Боль, усталость, похолодание, парастезии, онемение верхней конечности
- Головокружения
- Неустойчивость
- Атаксия
- Нистагм, диплопия, гемианопсия
- Потеря слуха
Диагностика:
- УЗДГ
- КТ – ангиография
- Ангиография
Оперативное вмешательство:
Стентирование подключичной артерии является эффективной и безопасной процедурой. Процедура безболезненна и проходит под местной анестезией.
Стентирование выполняется через небольшой прокол в бедренной или радиальной артерии (через руку). Через установленный катетер в пораженный участок подключичной артерии проводится и имплантируется специальный стент соответствующего размера. Дальше происходит раскрытие стента и армирование суженного участка с полным восстановлением просвета.
Эндопротезирование брюшной аотры
Анатомия:
Аорта является самым крупным сосудом в организме человека. Она отходит непосредственно от сердца, отдавая магистральные ветви ко всем органам и тканям в организме. Анатомически аорту делят на восходящий отдел (дугу аорты) и нисходящий отдел (грудной отдел и брюшной отдел).
Патология:
Аневризмой аорты принято называть образовавшийся в ней просвет, который превышает нормальный диаметр сосудов в два раза (и больше). Проявляется дефект в результате разрушения эластических волокон (филаментов) центральной оболочки, вследствие чего оставшаяся волокнистая ткань удлиняется, тем самым расширяя диаметр сосудов и приводя к истончению и напряжению их стенок. По мере развития заболевания и последующего увеличения размера просвета существует вероятность разрыва аневризмы аорты с внутренним массивным кровотечением, приводящая в 2-х случаях из 5-ти к летальному исходу.
Клиника:
Аневризма брюшной аорты проявляется в виде тупых, ноющих и постепенно нарастающих болей в животе. Неприятные ощущения, как правило, возникают слева от пупка и отдают в спину, крестец и поясницу. При выявлении таких симптомов следует обратиться к доктору, иначе возможен разрыв аневризмы брюшной аорты.
Чаще всего при аневризме брюшной аорты первым сигналом являются приступы боли. Они возникают неожиданно, часто отдают в поясницу, паховую область или ноги. Боль продолжается несколько часов и плохо поддается воздействию лекарств. При воспалении аневризмы может подняться температура. Иногда наблюдается посинение и похолодание пальцев.
Диагностика:
- УЗДГ
- МРТ
- КТ – ангиография
- Ангиография
Оперативное вмешательство:
Эндопротезирование брюшной аорты является эффективной и безопасной процедурой. Метод заключается в установке высокотехнологичного, биосовместимого, металлического (хромокобальтовый сплав) каркаса с покрытием в зону расширения, под местной анестезией, с полным выключением аневризматического расширения из кровотока, что предотвращает дальнейшее увеличение размеров аневризмы, образование тромбов, а также предотвращает разрыв аорты.
Рисунок
Аневризма брюшной аорты до и после стентирования
Транскатетерная имплантация аортального клапана
Транскатетерная имплантация аортального клапана (ТИАК) открыла новые возможности для лечения пациентов с тяжелым поражением (сужением) аортального клапана. Транскатетерная имплантация аортального клапана (TAVI) – современный малоинвазивный транскатетерный способ замены фортального клапана искусственным биологическим.
Стеноз клапана аорты
— тяжёлая патология, она занимает второе место среди всех приобретённых структурных заболеваний сердца, и в значительной мере повышает риск внезапной сердечной смерти. Такие пациенты испытывают выраженную сердечную недостаточность и одышку даже при минимальных нагрузках, приступы стенокардии в виде загрудинных болей, внезапную слабость, периферические отёки и обморочные состояния. Ещё 15 лет назад основным методом лечения данной патологии являлась открытая хирургическая операция на остановленном сердце. Однако в современной медицинской практике всё чаще используется альтернативный малоинвазивный транскатетерный подход имплантации аортального клапана (ТАИК), когда через отверстие в общей бедренной артерии проводится биологический протез и имплантируется в позицию аортального клапана. В 80% случаев в ходе операции не требуется применение общего наркоза, пациент находится в сознании и в контакте с врачом. Время операции варьируется от 30 до 70 минут, а пребывание больного в блоке интенсивной терапии сокращается до 24 часов. Современные эндоваскулярные клапанные протезы доказали свою эффективность во многих многоцентровых исследованиях, проводимых ведущими клиниками Европы и США, а конструкция используемых моделей позволяет минимизировать риски развития неблагоприятных последствий в послеоперационном периоде при достижении максимального клинического эффекта.
Рисунок. Транскатетерная имплантация аортального клапана
Лечение и период после проведения курса УНКП
Терапия УНКП начиналась не случайно. В начале лечения, пациентке требовалась помощь, для того чтобы добраться на сеанс лечения, из-за стенокардии. Во время лечения она отметила уменьшение приступов стенокардии, сопровождающееся повышением физической активности (таблица 3). В конце 7-недельного курса лечения она не испытывала ограничений при физических нагрузках, включая 60-минутные тренировки на велосипеде или тредмиле. Она продолжала принимать те же лекарства от стенокардии, что и до УНКП.
Рис. 1. Механизм диастолического усиления и снижения постнагрузки, во время применения УНКП. Отмечена ЭКГ зависимая последовательная диастоличекая активация «молочной» венозной крови нижних конечностей и артериальной крови от периферии к магистральным сосудам системе (этап 1-3). Их всех манжет одновременно выпускается воздух непосредственно перед систолой (этап 4).
В последующем наблюдалось улучшение перфузии миокарда, что было показано данными сцинтиграфии во время пробы с аденозином, не выявлено признаков ишемии миокарда или инфаркта миокарда (рис. 2). Через 9 месяцев после окончания курса лечения, пациентка оставалась активной, приступы стенокардии были реже, чем 1 раз в месяц, и сразу прекращались в покое или после применения нитроглицерина под язык.
Таблица 3. Клиническая картина во время лечения.
| 1-я неделя 1 приступ стенокардии покоя Физическая активность ограничена пребыванием в комнате отеля 3-я неделя 1 приступ стенокардия покоя Ходьба по комнате в отеле 5-я неделя 2 коротких приступа стенокардии малых напряжений Пациентка начинает небольшие программы упражнений 7-я неделя Отсутствие стенокардии Прогулка/поездка на велосипеде в течение 60 минут в день |
Рис.2 Сравнение изображений перфузии в покое и при нагрузке, полученные до (слева) и после (справа) курса УНКП. Отмечается уменьшение ишемии миокарда, вызванной аденозином в нижней стенке (стрелочка), нижнеперегородочном сегменте (звездочка), и верхушечном сегменте ЛЖ (знак плюса) после лечения. Отметки стоят на изображении, полученном до лечения. Redist ― перераспределение.
Обсуждение
Представленный случай ― впечатляющий пример возможностей УНКП, применяемой для уменьшения симптомов ишемии миокарда. В начале терапии, пациентка была прикована к постели из-за тяжелой стенокардии. После 7-недельного курса лечения ЕЕСР, она стала способной ежедневно заниматься физической нагрузкой без стенокардии, у нее не было признаков ишемии миокарда во время повторной сцинтиграфии миокарда. Этот положительный клинический результат сохранялся на протяжении 9 месяцев после лечения.
Увеличивается количество информации, подтверждающей эффективность УНКП, используемой при стенокардии в течение 2 десятилетий. Данная процедура, впервые предложенная Kantrowitz and Kantrowitz, является неинвазивной и нетравматичной, она увеличивает диастолическое АД и перфузионное давление в коронарных артериях, также способствует разгрузке левого желудочка, аналогично внутри-аортальной контрпульсации. Первые гидравлические аппараты контрпульсации были обременительными и модифицировались на протяжении нескольких лет, и в настоящий момент включают в себя компьютеризированные, ЭКГ-контролируемые пневматические компрессионные манжеты, которые обворачивают вокруг нижних конечностей, что улучшает диастолическую аугментацию и воспроизводимость данного воздействия. В результате использования новых аппаратов УНКП показано продолжительное снижение симптомов ишемии миокарда и улучшение качества жизни в разнородной группе пациентов с ИБС.
УНКП при лечении стенокардии
Опубликованы результаты нескольких исследований, в которых сообщается об опыте применения УНКП у пациентов со стенокардией рефрактерной к медикаментозной терапии. Эти пациенты не подходили для чрескожной или хирургической реваскуляризации. Исследования показали существенное уменьшение класса стенокардии, определенного по классификации Канадского Общества кардиологов; количества ежедневно используемого таблеток нитроглицерина; повышение толерантности к физическим нагрузкам; и уменьшение ишемии миокарда по объективным данным (таблица 4). Недостатки этих исследований состоят в том, что в них принимало участие небольшое количество пациентов, отсутствовал контроль, исключающий эффект плацебо. В последнем многоцентровом, рандомизированном, плацебо-контролируемом исследовании УНКП рандомизировано 139 пациентов со стенокардией и документированной ИБС для активной и гемодинамически неактивной контрпульсации. В группе активной контрпульсации показано значительное увеличение времени до развития депрессии сегмента ST при нагрузке, а также ее продолжительность. Количество приступов стенокардии также существенно снизилось в основной группе (таблица 5). Не наблюдалось серьезных осложнений, а влияние на качество жизни, сохранялось в течение 1 года. Радионуклидная перфузионная сцинтиграфия показала снижение или исчезновение дефектов перфузии после курса УНКП. Также УНКП могла увеличивать перфузию с исходного уровня, что доказано данными позитронно — эмиссионной томографии.
Таблица 4. Результаты первых нерандомизированных исследований УНКП
| Автор | Количество пациентов | Количество сеансов лечения (час) | Снижение симптомов стенокардии (%) | Улучшение перфузии (%) |
| Зенг и др., 1983 | 200 | 12 | 97 | NA |
| Лосон и др., 1992, 1995 | 18 | 36 | 100 | 78 |
| Карим и др., 1995 | 38 | 36 | 86 | 78 |
| УНКП=усиленная внешняя контрпульсация; NA=не доступны. | ||||
Таблица 5. Изменение толерантности к физической нагрузке в MUST-ЕЕСР*
| Контрольная группа | Группа УНКП | ||||
| Параметры | № | Средние (SE) изменения (сек) | № | Средние (SE) изменения (сек) | Р |
| Продолжительность нагрузки | 58 | 26(12) | 57 | 42(11) | .30 |
| Время до развития депрессии ST сегмента | 56 | — 4 (12) | 56 | 37 (11) | .01 |
| *MUST-ЕЕСР= Многоцентровое исследование УНКП | |||||
Альтернативные методики хирургической реваскуляризации
Современная медицина располагает различными средствами минимально-инвазивной реваскуляризации. Они альтернативны по отношению к классическим хирургическим способам иссечения артерий (артериэктомия) – но отнюдь не являются методиками альтернативной медицины. Эти средства взяты на вооружение официальной медициной, которая сегодня уже практически не отдает предпочтений классическим средствам сосудистой хирургии.
Современные минимально-инвазивные средства принято называть эндоваскулярной хирургией. Ей и отданы предпочтения. Эндоваскулярная хирургия отвечает интересам пациентов: лечение менее болезненное, менее травматизирующее, послеоперационная реабилитация проходит быстрей. Вопрос лишь в том, располагает ли та или иная хирургическая клиника оборудованием для минимально-инвазивных эндоваскулярных операций и терапевтических действий, имеет ли ее персонал необходимый опыт.
Эндоваскулярные процедуры подразумевают применение сосудистых катетеров, подводимых по внутреннему просвету артерии не через внешний разрез, а через небольшие «проколы», выполняемые в местах наиболее мелкого залегания артерии (например, в паху). Насадки на катетерах позволяют не только цеплять тромб для его выведения наружу, но и расширять сосуд изнутри (баллонная дилятация), вживлять стент (сосудистый каркас, препятствующий его сужению).
Современная методика интервенционного тромболиза (химического разложения тромба) основана на катетерном введении разлагающих веществ, которыми обрабатывают тело тромба. При достаточно «удобном» положении места закупорки можно подавать вещества для тромболиза (стрептокиназа, урокиназа, препарат rt-PA) напрямую, в месте пунктирования артерии.
Тромбэктомия сразу же освобождает внутренний просвет артерии. Значит, сразу же восстанавливается и кровоток. Для химического разложения тромба требуется время. Поэтому тромболиз можно выполнять при неполной закупорке артерии. Или с одновременным шунтированием закупоренного участка (установлением временного обводного кровотока).
Механизм действия
Точный механизм, с помощью которого УНКП уменьшает симптомы у пациентов с хронической стенокардией и другими синдромами, все еще не определен. Острый гемодинамический эффект схож с тем, что наблюдается при внутриаортальной баллонной контрпульсации, происходит уменьшение постнагрузки и увеличение диастолического давления в аорте. Кроме того, может быть увеличена преднагрузка. Последние достижения в изучении физиологии коронарного кровообращения дали возможность предположить механизмы, объясняющие благоприятное влияние УНКП. При ишемии, увеличенный коронарный кровоток и напряжение сдвига, вызванные увеличением диастолического давления, могут быть достаточны для стимулирования ангиогенеза и формирования коллатералей. In vitro, повышенное напряжение сдвига активизирует тирозиновую киназу в эндотелии. Тирозиновый рецептор вызывает фосфорилирование в группе субмембранных протеинов, что, в свою очередь, приводит к изменениям актиновом цитоскелете. Эта модификация актинового цитосклета является ключевым фактором в миграции эндотелиальных и гладкомышечных клеток, потенциально приводящей к формированию новых сосудов в ишемизированном миокарде.
Кроме ангиогенеза и формирования коллатералей, повышенное напряжение сдвига вызванное центральным или периферическим путем во время УНКП, может способствовать улучшению вазомоторной функции. Было продемонстрировано, что напряжение сдвига увеличивает продукцию эндотелийрасслабляющего фактора- NO. Недавно продемонстрирована down – регуляция уровня эндотелина-1 при пневматической внешней пульсации. Down – регуляция уровня эндотелина-1 может увеличить дилатацию коронарных артерий и улучшить перфузию миокарда. Также это может способствовать анти-ишемическому воздействию УНКП. Таким образом, эти факторы играют основную роль в в реакции гладкомышечных клеток артерий и дилатации сосудов. Также здесь наблюдается участие различных факторов роста, особенно, сосудистых эндотелиальных факторов роста. Эти изменения считаются важными в поддержании ангиогенеза и формировании коллатералей и могут объяснить благоприятное воздействие даже после того, как был завершен курс УНКП.
Результаты
Эндартерэктомия из бассейна ПКА выполнена у 4 (56,2%) больных. Из этих больных гипокинез нижней стенки ЛЖ до операции наблюдался в 25 (34,2%) случаях. Регресс гипокинеза задней стенки ЛЖ отмечен у 8 (32%) больных. Эндартерэктомия из ПМЖВ выполнена у 21 (28,8%) больного (рис. 5).
Рис. 5. Эндартерэктомия из ПНА из двух септальных ветвей. Из этих больных нарушения кинетики межжелудочковой перегородки до операции наблюдались у 3 (4,1%) пациентов. У 2 (2,7%) пациентов гипокинез передней стенки ЛЖ регрессировал. У 4 пациентов, которым была выполнена эндартерэктомия из ОВ, гипокинезов не наблюдалось.
Общая госпитальная летальность составила 4,1% (3 пациента). Причинами летальных исходов явились периоперационный инфаркт миокарда (n
=1), полиорганная недостаточность на фоне сепсиса и респираторного дистресс-синдрома (
n
=2).
В раннем послеоперационном периоде 44 (60,3%) пациента нуждались в продленной кардиотонической поддержке (допамин 5 мг/кг/мин, адреналин 0,01 мкг/кг/мин более 12 ч). Внутриаортальная баллонная контрпульсация (ВАБК) использована у 2 (2,7%) пациентов. Острое нарушение мозгового кровообращения зафиксировано у 1 (1,4%) пациента. У 11 (15,1%) больных зафиксирована постгипоксическая энцефалопатия с полным регрессом симптоматики в период стационарного лечения. Семь (9,6%) больных находились на продленной искусственной вентиляции легких (более 48 ч). У 1 (1,4%) больного развилось кровотечение, потребовавшее рестернотомии и дополнительного гемостаза. Характеристика больных в послеоперационном периоде представлена в табл. 4.
Таблица 4. Характеристика послеоперационного периода
Список литературы
1. Schub C. Stable angina pectoris, 3: medical treatment. Mayo din Proc. 1990:65:256-273. 2. Stone PH, Gibson RS. Glasser SP, et al. ASIS Study Group. Comparison ot’propranolol, diltiazem, and nifedipine in the treatment of ambulatory ischemia in patients with stable angina: differential effects on ambulatory ischemia, exercise performance, and anginal symptoms. Circulation. 1990:82:1962-1972. 3. RITA-2 Trial Participants. Coronary angioplasty versus medical therapy for angina: the Second Randomised Intervention Treatment of Angina (RITA-2) trial. Lancet. 1997:350:461-468. 4. Chaitman BR. Rosen AD. Williams DO. et al. Myocardial in-farction and cardiac mortality in the Bypass Angioplasty Revas-cularization Investigation (BARI) randomized trial. Circulation. 1997:96:2162-2170″ 5. Alien KB, Dowling RD, Fudge TL, et al. Comparison of transmyocardial revascularization with medical therapy in patients with refractory angina. N En^l .1 Mcd. 1999:341:1029-1036. 6. Frazier OH. March RJ. Horvath KA. Transmyocardial revascularization with carbon dioxide laser in patients with end-stage coronary artery disease. N Enyl J Med. 1999:341:1021-1028. 7. Whitlow PL, Knopf WD. O’Neill WW. Kaul U. Londero H, Shawl F. Six month follow-up of percutaneous transmyocardial revascularization in patients with refractory angina [abstract]. J Am Coil Cardiol. 1999;33(suppl):29A. 8. Benetti F, Mariani MA. Sani G. et al. Video-assisted minimally invasive coronary operations without cardiopulmonary bypass: a multicenter study../ Thorac Surg. 1996:112:1478-1484. 9. Boonstra PW, Grandjean JG, Mariani MA. Improved method for direct coronary grafting without CPB via anterolateral small thoracotomy. Ann Thorac Surg. 1997:63:567-569. 10. Holubkov R, Zenali M, Akin JJ. Erb L, Courcoulas A. MIDCAB characteristics and results: the CardioThoracic Systems (CTS) registry. EiirJCardiothoracSurs. 1998:14(suppl 1):S25-S30. 11. Mariani MA. Boonstra PW, Grandjean JG, et al. Minimally invasive coronary artery bypass grafting versus coronary angioplasty for isolated type C stenosis of the left anterior descending artery. J Thorac Cardiovasc Surf;.1997:114:434-439. 12. Alderman EL. Levy JH. Rich JB, et al. Analyses of coronary graft patency after aprotinin use: results from the International Multi-center Aprotinin Graft Patency Experience (IMAGE) trial. J Thorac Cardiovasc Surf;. 1998; 116:716-730. 13. Chauhan A. Mullins PA. Thuraisingham SI, Taylor G, Fetch MC, Schofield PM. Effect of transcutaneous electrical nerve stimulation on coronary blood flow. Circulation. 1994;89:694-702. 14. DeJongste MJ, Hautvast RW, Hillege HL, Lie KI. Working Group on Neurocardiology. Efficacy of spinal cord stimulation as adjuvant therapy for intractable angina pectoris: a prospective, randomized clinical study. J Am Colt Cardiol. 1994;23:1592-1597. 15. Yeung AC, Hayase M, Fitzgerald P, et al. Percutaneous in-situ coronary artery bypass (PICAB): current development status and preliminary results of a novel myocardial revascularization technique [abstract]., I Am Coil Cardiol. 1999:33(suppl):47A. 16. Carter AJ. Kornowski R. Lamson T, et al. Percutaneous in-situ coronary venous arterial bypass: initial results of retrograde myocardial perfusion in a porcine model [abstract]. J Am Coil Cardiol. 1999;33(suppl):49A. 17. Symes JF. Losordo DW, Vale PR, et al. Gene therapy with vascular endothelial growth factor for inoperable coronary artery disease. Ann Thorac Sui-s. 1999:68:830-836. 18. Arora RR, Chou TM. Jain D. et al. The Multicenter Study of Enhanced External Counterpulsation (MUST-EECP):effect of EECP on exercise-induced myocardial ischemia and anginal epi.sodes.7Aw Coil Cardiol. 1999:33:1833-1840. 19. Lawson WE. Hui JC. Soroff HS, et al. Efficacy of enhanced external counterpulsation in the treatment of angina pectoris. Am J Cardiol. 1992:70:859-862. 20. Lawson WE, Hui JCK, Zheng ZS, et al. Three-year sustained benefit from enhanced external counterpulsation in chronic angina pectoris. Am J Cardiol. 1995:75:840-841. 21. Zheng ZS. Li TM, Kambic H, et al. Sequential external counterpulsation (SECP) in China. Trans Am Soc Artif Intern Organs. 1983:29:599-603. 22. Karim S, Sani A, Karo-Karo S. et al. Enhanced external counterpulsation in the treatment and rehabilitation of coronary patients in Indonesia. Asian Cardiovasc Thorac Ann. 1995;3: 26-28. 23. Kantrowitz A, Kantrowitz A. Experimental augmentation of coronary flow by retardation of the arterial pressure pulse. Surgery. 1953:34:678-687. 24. Moulopoulos SD, Topaz S, Kolff WJ. Diastolic balloon pumping (with carbon dioxide) in the aorta—a mechanical assistance to the failing circulation. Am Heart.I. 1962:63:669-675. 25. Jacobey JA. Taylor WJ, Smith GT. Gorlin R. Harken DE. A new therapeutic approach to acute coronary occlusion. II: opening dormant coronary collateral channels by counterpulsation. Am J Cardiol. 1963:11:218-227. 26. Masuda D. Nohara R. Hirai T, et al. The new therapeutic approach with the enhanced external counterpulsation in patients with chronic stable angina: evaluation of myocardial flow and flow reserve by N-13 ammonia PET [abstract]. Circulation. 1999; 100(suppl):l-732. 27. Sessa WC. Pritchard K, Seyedi N, Wang J, Hintze TH. Chronic exercise in dogs increases coronary vascular nitric oxide production and endothelial cell nitric oxide synthase gene expression. Circ Res. 1994:74:349-353. 28. Garlichs CD. Zhang H. Werner D, John A, Tragner P. Daniel WG. Reduction of serum endothelin-1 levels by pneumatic external counterpulsation [abstract]. Can J Cardiol. 1998; 14(suppl): 87F. 29. Zarins CK. Zatina MA. Giddens DP. Ku DN. Glagov S. Shear stress regulation of artery lumen diameter in experimental athero-genesis. J Vase Surg. 1987:5:413-420. 30. Tseng H, Peterson TE, Berk BC. Fluid shear stress stimulates mitogen-activated protein kinase in endothelial cells. Circ Res. 1995;77:869-878.