Введение
Ведущей причиной развития атеросклероза в настоящее время считается нарушение липидного обмена и холестерина (ХС) липопротеинов низкой плотности (ЛНП) как главного показателя для оценки сердечно-сосудистого риска (ССР). Близок к ЛНП липопротеин (а) (Лп(а)), функциональное и патофизиологическое значение которого до сих пор окончательно не определено, несмотря на большое количество оригинальных и обзорных статей, посвященных этой проблематике начиная с 1963 г., когда частица Лп(а) была впервые описана норвежским профессором в области медицинской генетики Kare Berg.
Структура Лп(а)
Лп(а) представляет собой частицу ЛНП, содержащую молекулу аполипопротеина А (апоА), ковалентно связанную с аполипопротеином В-100 (апоВ) дисульфидной связью (рис. 1) [1].
Уникальность белка апоА заключается в том, что он не обнаруживается более ни в одном из классов липопротеинов и имеет высокую степень гомологии (до 90%) крингл-домену плазминогена. Ген, ответственный за синтез белка апоА, локализован в длинном плече 6-й хромосомы, рядом с геном плазминогена. Однако связи между высоким содержанием Лп(а) и риском венозных тромбозов и тромбоэмболий продемонстрировано не было [2]. Крингл-домены — это автономные белковые участки, которые складываются в петли, стабилизируемые дисульфидными связями, и играют большую роль в межбелковых взаимодействиях коагуляционного каскада, а также при связывании различных медиаторов (взаимодействие протеинов и фосфолипидов, биологических мембран). Существует десять типов крингл-доменов. Среди них только тип домена 2 варьирует по числу копий от 2 до 40, что обусловливает наличие множества изоформ белка и гетерогенность структуры Лп(а) в популяции [3]. АпоА гидрофилен и может связываться с поврежденным эндотелием сосудов, как и плазминоген [4]. Частицы Лп(а) имеют диаметр менее 70 нм, легко проникают через эндотелиальный барьер, где, подобно ЛНП, накапливаются и повышают риск сердечно-сосудистых заболеваний (ССЗ) [5].
Нужен ли тест на Липопротеин (а)?
Почему необходимо определять уровень Липопротеина (а)?
Липопротеин (a) состоит из одной молекулы apo (a), apoB и липопротеинов низкой плотности (LDL). Ряд медицинских сообществ рекомендовали определять высокий уровень Lp (a) для профилактики сердечно-сосудистых заболеваний (ССЗ), а в июне 2021 года Центры по контролю и профилактике заболеваний утвердили первые коды МКБ-10 для диагностики повышенных уровней Lp (a).
В настоящее время нет лекарственных средств, предназначенных для снижения уровня Lp (a), одобренных FDA. Тем не менее, при тестировании Lp (a) выявляются люди с повышенным риском сердечно-сосудистых заболеваний, которые не диагностировались с помощью других тестов, что позволяет им получать своевременное лечение других факторов риска сердечно-сосудистых заболеваний.
Ограничения различных методов определения Lp (A)
Наиболее распространенными методами измерения Lp (a) являются иммунологические тесты, большинство из которых используют различные поликлональные антитела против apo (а), вступают в реакцию с высокополиморфным криглингом IV типа 2 домена. Учитывая высокую степень гетерогенности по размеру в apo (a), поликлональный иммуноанализ Lp (a) может завышать или занижать уровень Lp (a) в образцах крови человека в зависимости от уровня apo (a) в калибраторах тест-системы.
Другой уровень неточности связан с выражением концентраций Lp (a) в мг/дл. Поскольку частицы Lp (a) чрезвычайно изменчивы не только в размерах apo (a), но также в их липидном содержимом и степени гликозилирования, то невероятно трудно определить точную массу Lp (a) в эталонном стандарте и невозможно применить это значение к вторичным референсным материалам, калибраторам и, в конечном счете, образцам человека.
В 2004 году Всемирная Организации Здравоохранения/Международная федерация клинической химии и лабораторной медицины (WHO / IFCC) утвердила референсный реагент для иммунологических анализов Lp (a) с точностью, установленной в молярной концентрации (нмоль/л). Метод моноклинального фермент-связанного иммуносорбентного анализа (ELISA), независимого от вариаций размера apo (а), был определен как эталонный метод, и исследования продемонстрировали сопоставимость результатов Lp (a) с использованием эталонного материала (Clin Chem 2000; 46: 1956-67).
Однако, в большинстве имеющихся в продаже иммунологических тестов, отсутствует оптимизация для минимизации влияния вариабельности размеров apo (a), за исключением одного латексного улучшенного турбидиметрического метода, который использует смесь apo (а) изоформ в своих калибраторах.
Существуют другие аналитические подходы к измерению Lp (a), которые в меньшей степени подвержены гетерогенности apo (a), такие как ELISA-методы, которые используют антитело захвата, распознающее apo (a) и антитело обнаружения против apoB, а также методы, основанные на электрофоретическом разделение липопротеиновых частиц с последующим окрашиванием apoB или холестерина, с последующим количественным определением.
Что должно быть учтено лабораториями для осуществления анализа Lp (A)?
Прежде чем начать выполнять исследования Lp (a), лаборатория должна сначала оценить ожидания медицинских работников относительно целевой группы пациентов и правил принятия решения, определяющих референсные уровни Lp (a). И врачи, и лаборанты должны знать о расовых/этнических различиях в уровнях Lp (a). В частности, афроамериканцы обычно имеют более высокие уровни этой частицы, чем другие расовые/этнические группы.
Лаборатории также должны обозначить следующие вопросы об аналитических особенностях теста Lp (a) перед тем, как сделать выбор: 1) сертифицирована ли система для определения уровня Lp (a) по WHO/IFCC? 2) Выполняется ли измерение Lp (a) в нмоль/л вместо мг/дл? Расчет через коэффициент пересчета не рекомендуется. 3) Являются ли реагенты нечувствительными к вариабельности размера apo (a)? Даже если это учтено, существует вероятность погрешности определения у пациентов с экстремальными размерами apo (а). 4) И будут ли пациенты определять уровень Lp (a) различными методами в нескольких лабораториях?
Мнение специалиста:
Благодаря успехам в стандартизации методов определения Lp(a) и более корректной статистической обработке данных, положение о том, что повышенные уровни Lp(a) – фактор риска сердечно-сосудистых заболеваний, а также заболеваний периферических сосудов, считается чётко установленным и общепринятым. Диагностика повышенного уровня Lp(a) позволит своевременно начать лечение там, где это действительно требуется.
Метаболизм и биологическая роль Лп(а)
Лп(а) синтезируется в печени, там же происходит и его катаболизм. На поверхности гепатоцитов находится множество рецепторов, участвующих в процессе эндоцитоза молекул Лп(а), включая скавенджер-рецепторы В1 и рецепторы фибриногена [3]. Наряду с печеночным путем деградации, существует и почечный. В проспективном исследовании было обнаружено, что уровень апоА и апоВ у пациентов на гемодиализе значительно ниже, нежели у здоровых наблюдаемых, в то время как разницы в скорости их синтеза обнаружено не было [6]. Период полураспада Лп(а) длиннее, чем у ЛНП, и составляет 3,3 сут.
Индивидуальный уровень Лп(а) приблизительно на 90% обусловлен генетически [7]. Единой точки зрения на физиологическую роль Лп(а) не существует, несмотря на большое количество фундаментальных и клинических работ по этой теме. Африканцы отличаются повышенной концентрацией Лп(а), которая в среднем в 7 раз превышает этот показатель у представителей европейской и азиатской популяций [8]. Учитывая высокую гетерогенность структуры данной молекулы, можно предполагать, что значимость Лп(а) различна не только у лиц разных рас, но и в разных популяциях одной и той же расы. А.В. Тихоновым в 1980–1992 гг. проводилось сравнительное исследование уровня Лп(а) в рамках скрининговой программы неорганизованного населения одного из районов г. Новосибирска, коренных жителей Чукотки и Горного Алтая. Было обнаружено, что высокое содержание этого липопротеина более характерно для коренного населения Чукотки, проживающего в экстремальных климатических условиях азиатской части континента. Возможно, это связано с преобладанием в их питании таких пищевых компонентов, как мясо животных и морского зверя, животных жиров [8].
Существует гипотеза, которая предполагает участие Лп(а) в репарации тканей. Предполагается, что доставка ХС к тканям, в которых идет активный процесс репарации, может проходить через связь Лп(а) и фибрина. Из-за структурной гомологии доменов апоА также может обладать качествами различных факторов роста, включая фактор роста гепатоцитов [9].
Структура липопротеина (a)
Исторически, деление липопротеинов на разные категории основано на различной плотности липопротеиновых частиц, определяемой ультрацентрифугированием:
- хиломикроны (chilomicrons)
- липопротеины очень низкой плотности (VLDL, ЛОНП)
- липопротеины промежуточной плотности (IDL, ЛПП)
- липопротеины низкой плотности (LDL, ЛПНП)
- липопротеины высокой плотности (HDL, ЛПВП)
- липопротеины (a) (Lp (a))
По плотности липопротеина (a) (Lp(a)) близки к HDL. По электрофоретической подвижности — к VLDL. Структурно же частицы Lp(a) сходны с LDL.
Частица ЛП(a) состоит из холестерина, триглицеридов, Апо В, фосфолипидов и аполипопротеина Апо(а). Они имеют сходный с LDL состав липидов и, также как и LDL, содержат 1 молекулу белка apo-B в каждой частице. Но белковая часть Lp(a) содержит еще и особый, присущий только этим липопротеинам, белок – аполипопротеин Апо(a).
Аполипопротеин Апо(а) — это большой гидрофильный и высокогликозилированный белок, который по составу похож на плазминоген. Аполипопротеин Апо(а) состоит из доменов, называемых «kringle», (крендель, англ.), которые, собственно, и сходны с аналогичными доменами плазминогена. Аполипопротеин Апо(а) состоит из неактивного протеазного домена, одного домена kringle V и разного количества доменов kringle IV.
У разных индивидов в гене, кодирующем аполипопротеин Апо(а), может быть разное (от 12 до 51) количество фрагментов ДНК, кодирующих домен аполипопротеина Апо(а).
Количество доменов «kringle» в Апо(а), таким образом, предопределяется генетически и может варьировать от 12 до 51. В результате в популяции наблюдается значительный полиморфизм и по размеру белка, и по размеру частиц ЛП(а). И поэтому молекулярная масса белка аполипопротеина Апо(а) у разных лиц может составлять от ~280 до 800 кДа; сейчас известны 34 изоформы ЛП(а).
Предполагается, что ген аполипопротеина Апо(а) произошёл в результате повторов некоторых частей гена плазминогена, причем оба гена тесно связаны друг с другом.
Аполипопротеин Апо(а) синтезируется в печени и связывается за счёт дисульфидной связи с вновь синтезированным апоВ-100. Так как оба белка взаимодействуют своими С-концевыми участками, апо В теряет аффинность к своему рецептору (ЛПНП-рецептор). Катаболизм ЛП(а), в отличие от других липопротеинов, происходит в почках, а не в печени.
В аполипопротеине Апо(а) домены kringle организованы в особый белковый «мотив», состоящий из трех петлевидных структур, стабилизированных тремя дисульфидными связями. Такой «мотив» содержится также в большом количестве белков, кодируемых генами семейства протромбинов, включающих протромбин, плазминоген, фактор роста гепатоцитов, урокиназу, фактор XII, тканевой активатор плазминогена.
Плазминоген — это предшественник (профермент) плазмина, основного фермента, расщепляющего фибриновые сгустки. Выяснилось что размер аполипопротеина (а) определяет концентрацию ЛП(а) в плазме. Чем меньше размер аполипопротеина Апо(а), т.е. чем меньше в нем доменов «kringle IV», тем выше уровень ЛП(а) в плазме и наоборот, чем длиннее молекула аполипопротеина Апо(а) – тем меньше концентрация ЛП(а).
В целом, уровень синтеза аполипопротеина Апо(а) определяется тем, как быстро секретируются его изоформы. Меньшие изоформы аполипопротеина Апо(а) секретируется быстрее и поэтому уровень ЛП(a) в плазме обратно пропорционален размеру аполипопротеина Апо(а).
Механизмы атерогенеза с участием Лп(а)
Вероятно, атерогенность Лп(а) имеет многоступенчатый характер. Большая масса белков Лп(а) (35% пула) представлена комплексом апоВ/апоА с соотношением по молекулярной массе 2:1. Благодаря наличию такой специфической структуры Лп(а), наряду с ХС ЛНП, может связывать ХС и переносить его в сосудистую стенку [3]. Кроме того, под влиянием апоА высокогидрофобный апоВ приобретает способность растворяться в воде. Комплекс апоА с апоВ задерживает деградацию апоB через классический рецепторный путь, создавая тем самым предпосылки для его более длительной циркуляции в плазме крови, модификационных изменений и поступления в клетки путем нерегулируемого эндоцитоза.
В свою очередь, Лп(а), легко проникая через эндотелиальный барьер [7], стимулирует экспрессию эндотелиоцитами молекул адгезии, а после окисления внутри атеросклеротической бляшки фагоцитируется макрофагами с трансформацией последних в пенистые клетки и высвобождением провоспалительных цитокинов. Окисленные фосфолипиды мембран, которые в основном переносятся Лп(а), ковалентно связаны с белком апоА и обеспечивают дополнительный провоспалительный потенциал плазмы [10]. Дополнительно Лп(а) может стимулировать пролиферацию гладкомышечных клеток сосудов и способствовать возникновению дисфункции эндотелия. Оба механизма признаны ключевыми в развитии атеросклеротического процесса. Присутствие Лп(а) и его специфических компонентов апоА в атеросклеротических бляшках коронарных артерий еще раз подтверждает его атерогенные качества [3].
Сердечно-сосудистый риск
Высокая концентрация Лп(а) в плазме крови связана с повышенным риском развития атеросклероз-ассоциированных заболеваний, однако для большинства пациентов этот показатель является значительно более слабым фактором риска, чем уровень ХС ЛНП. По мнению европейских кардиологов и липидологов, отраженному в последних рекомендациях по диагностике и лечению дислипидемии (2019 г.), учитывая генетическую детерминированность уровня Лп(а), его крайне высокий уровень (>180 мг/дл, или >430 нмоль/л) может представлять собой новое наследственное нарушение обмена липидов, распространенность которого в 2 раза выше, чем гетерозиготной семейной гиперхолестеринемии, а ССР у таких пациентов тождественны. В этой связи рекомендуется проводить определение уровня Лп(а) хотя бы один раз в жизни у каждого взрослого человека. Измерение Лп(а) также оправданно (класс рекомендаций IIa, уровень доказательности C) у отдельных пациентов с семейным анамнезом преждевременного развития ССЗ, а также в целях реклассификации лиц с пограничным (между умеренным и высоким) уровнем риска, наряду с такими реклассификаторами, как каротидный атеросклероз более 25% и/или коронарный кальциноз более 100 ед. Агатстона [7].
Повышением уровня Лп(а) можно частично объяснить остаточный риск у пациентов, находящихся на адекватной липидснижающей терапии, когда достигаются целевые значения ХС ЛНП [11]. Метаанализ, включающий данные о сердечно-сосудистых исходах 29 069 пациентов, 14 536 из которых получали статины (исследования AFCAPS, CARDS, 4D, JUPITER, LIPID, MIRACL и 4S), показал, что даже на фоне терапии статинами при повышении уровня Лп(а) имелась положительная корреляция с комбинированной конечной точкой (острый коронарный синдром, инсульт или реваскуляризация) в течение трех лет наблюдения. Пациенты, принимавшие симва-, аторва- или розувастатин и имеющие значение Лп(а) ≥50 мг/дл, характеризовались повышением ССР на 43% в сравнении с теми, у кого показатели Лп(а) были <15 мг/дл, учитывая поправку на иные факторы риска (возраст, пол, наличие ССЗ, сахарный диабет, курение, артериальная гипертония (АГ), ХС ЛНП, ХС липопротеинов высокой плотности (ЛВП)) [12]. В исследовании случай-контроль было выявлено, что Лп(а) в концентрации ≥50 мг/дл повышал риск ССЗ в 2 раза у молодых людей (менее 45 лет), в 3 раза у людей средней возрастной группы (45–60 лет), однако не играл значимой роли у пациентов старше 60 лет, что создает теоретические предпосылки для включения этого показателя в модели многофакторного прогнозирования сердечно-сосудистых исходов у пациентов с атеросклероз-ассоциированными заболеваниями, которые сейчас активно разрабатываются [13, 14].
Автор-составитель канд. биол. наук В.В.Вельков
Измерение концентраций Апо В и А1 – ключевых белков Х-ЛПНП и Х-ЛПВП – это наиболее точное и однозначное определение баланса проатерогенных и антиатерогенных холестеринов, которое оценивает риск фатальных и нефатальных инфарктов миокарда в течение последующих пяти лет. Эти крайне важные положения основаны на результатах проекта AMORIS, который проводился в Швеции в течение 8 лет и 3 месяцев. Наблюдались 98722 мужчины и 76831 женщина (возраст от 20 до 80 лет). В течение указанного периода от ОИМ умерли 3915 мужчин и 2461 женщина, именно у них были значительно повышенные уровни Апо В и значительно сниженные концентрации Апо А1 в плазме. Таким образом, высокие уровни Aпo В строго коррелируют с повышенным риском ССЗ, а высокие уровни Aпo А1 – кардиопротективный фактор, независимый от пола. Более того, Aпo В – более сильный индикатор риска ССЗ, чем Х-ЛПНП, особенно когда Х-ЛПНП в норме или понижен.
Соотношение Апо В/Апо А указывает на риск ССЗ независимо от уровня липидов,связанных с холестерином, и даже в том случае, когда уровень этих липидов в норме.
При этом оценка риска ССЗ может быть выражена одним числом (см. рис. 3). Существенно, что соотношение Апо В/Апо А1 имеет более строгую связь с риском ССЗ, чем соотношения ОХ/Х-ЛПНП или Х-ЛПНП/Х-ЛПВП.
Рис. 3. Риск развития ИМ в зависимости от соотношения концентраций Апо В и Апо А1
В целом, результаты этого и других аналогичных проспективных исследований четко свидетельствуют о том, что:
- риск атеросклероза ассоциирован не столько с концентрацией холестерина, сколько с количеством циркулирующих атерогенных частиц, которые легко связываются со стенками сосудов и быстро проникают в артериальные стенки,
- Апо В – самый точный индикатор риска ССЗ,
- Апо В – самый адекватный показатель эффективности терапии, направленной на снижение липидов,
- необходимо заменить определение общего холестерина и Х-ЛПНП на измерение концентрации Апо В,
- cоотношения Апо В/Апо А1 – по своей точности в оценке коронарных рисков у пациентов с бессимптомными ССЗ и у лиц, страдающих диабетом, превосходят индикаторые свойства всех других соотношений холестеринов.
Разумеется, определение общего холестерина, Х-ЛПНП и Х-ЛПВП ни в коем случае не утратило своей диагностической ценности. Но следует иметь в виду, что согласно общепризнанным исследованиям, патологические уровни этих маркеров действительно свидетельствуют о наличии атеросклероза, однако их нормальные уровни не обязательно свидетельствуют о том, что атеросклероза нет.
ЛИПОПРОТЕИН (а) – ПРЕДИКТОР ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ССЗ ЛП(а) [Lp(a)], или «липопротеин а малое» – это Х-ЛПНП с «довеском» – Апо (а), большим гликопротеином, который с помощью дисульфидной связи ковалентно связан с аполипопротеином Апо В, входящим в состав Х-ЛПНП. Синтез ЛП(a) происходит в печени, однако катаболизм ЛП(а), в отличие от катаболизма других липопротеинов, происходит в почках, а не в печени. Апо(а) имеет гомологию с плазминогеном человека и состоит из доменов, называемых «kringle» (крендель, англ.), которые сходны с аналогичными доменами плазминогена. У разных индивидов в гене, кодирующем Апо(а), может быть разное (от 12 до 51) количество фрагментов ДНК, кодирующих домены «kringle». В результате, по размеру белка и по размеру частиц ЛП(а) в популяции наблюдается значительный полиморфизм.
Как установлено, чем меньше размер Апо(а), т.е. чем меньше в нем доменов «kringle«, тем выше уровень ЛП(а) в плазме, и наоборот, чем длиннее молекула Апо(а), тем меньше концентрация ЛП(а).
Уровень ЛП(а) в плазме более чем на 90% определяется генетически и зависит в основном от скорости биосинтеза Апо(а), обратно пропорционально зависящей от размера Апо(а). Начиная с раннего детства, концентрация ЛП(a) возрастает, достигает плато к зрелости и остается потом практически неизменной. Дальнейшее повышение уровня ЛП(а) наблюдается только у женщин в постменопаузе. В отличие от большинства липидных факторов риска, риск, связанный с повышенными уровнями ЛП(а), не зависит ни от возраста, ни от пола, ни от диеты и ни от условий жизни. Однако, так как катаболизм ЛП(а) происходит в почках, ренальные патологии повышают уровень ЛП(а) из-за сниженного катаболизма его частиц. Нормальная физиологическая роль ЛП(а) не выяснена. Полагается, что ЛП(a) или как-то участвует в метаболизме холестеринов и триглицеридов (ибо похож на Х-ЛПНП), или принимает какое-то участие в процессах коагуляции, ибо Апо(а) похож на плазминоген. Повышенные уровни ЛП(а) вызывают ССЗ заболевания за счет проатерогенного характера, присущего Х-ЛПНП, и стимулируют тромбообразование за счет протромботических свойств аполипопротеина Апо(а).
Повышенный уровень ЛП (a) – наиболее частое генетически опосредованное нарушение метаболизма липидов у лиц с ранними ССЗ. В целом, повышенные концентрации ЛП(а) увеличивают коронарный риск, в особенности у мужчин с высокими уровнями Х-ЛПНП и низкими уровнями Х-ЛПВП. Более того, измерение уровней ЛП(a) позволяет определять риск ишемических инсультов независимо от других факторов риска. Измерение уровней ЛП(а) при ренальных патологиях, а также до и после гемодиализа позволяет оценить риск последующих сосудистых событий. При СД 1 уровни ЛП(а) выше 30 мг/дл связаны с удвоенным риском сосудистых осложнений, включающих заболевания коронарных и периферических артерий, а также цереброваскулярные заболевания. При СД 2 повышенные уровни ЛП(а) также предиктор ССЗ.
ЛП(а) – это фактор риска и предиктор генетической предрасположенности к сердечно-сосудистым и микрососудистым заболеваниям, к генетически опосредованным ишемическим инсультам. Измерять уровни ЛП(а) следует у пациентов:
- с ранними случаями ССЗ,
- у тех, у кого в семейной истории часты случаи ССЗ (подозрение на генетическую предрасположенность),
- с диагнозом ССЗ, но без традиционных факторов риска,
- у кого гиперхолестеринемия не снижается при терапии статинами,
- с ренальными заболеваниями,
- при СД 1 и 2 типа.
Важная информация При прямом определении Х-ЛПНП и иммунотурбидиметрическом измерении Aпo B в результаты измерений всегда входят концентрации ЛП(а) и Апо(а). При расчетном определении Х-ЛПНП в результат также входят и концентрации ЛП(а). Поэтому при высоких уровнях Х-ЛПНП и Aпo B целесообразно определять, какой вклад в них вносит генетически опосредованное повышение концентрации высокоатерогенного и протромботического ЛП(а) и Апо(а).
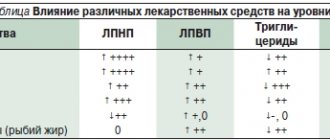
Липидснижающая терапия и Лп(а)
Уровень Лп(а) находится под строгим генетическим контролем, мало изменяется в течение жизни и значимо не снижается при соблюдении диеты и приеме обычных гиполипидемических препаратов. Несмотря на то, что обнаружена ассоциация между уровнем Лп(а) и повышенным ССР, до сих пор не хватает данных, говорящих о том, что снижение содержания Лп(а) улучшает прогноз [3]. Рандомизированные исследования ниацина и ингибиторов транспортного белка холестериновых эфиров (cholesteryl ester transfer protein, CETP), уменьшающих концентрацию Лп(а) на 20–30%, не предоставили доказательств того, что его снижение обеспечивает уменьшение риска развития атеросклероз-ассоциированных заболеваний сверх того, что ожидается при отмеченном снижении уровня липопротеинов, содержащих апоB [15].
В то же время последние данные, касающиеся ингибиторов PCSK9, указывают на снижение уровня Лп(а) на 20–30% на фоне терапии этими препаратами, что, возможно, играет определенную роль в интегральном уменьшении ССР, ассоциированного с кумабами [16]. Необходимо отметить, что пациенты с мутациями, обусловливающими снижение количества рецепторов ЛНП, могут не ответить на терапию кумабами [17].
Другой препарат — мипомерсен, антисмысловой олигонуклеотид, чье действие направлено на снижение синтеза апоВ-100-содержащих липидов — ЛНП, Лп(а) — через мРНК. Несмотря на то, что мипомерсен был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2013 г. в качестве дополнительной терапии при семейной гиперхолестеринемии у пациентов старше 12 лет, Европейское медицинское агентство в том же году отказало в регистрации этого препарата из соображений безопасности, т. к. он вызывал побочные реакции (местные реакции при инъекциях, стеатоз печени, повышение уровня трансаминаз, гриппоподобные реакции). Мипомерсен снижает уровень ЛНП на 26,4%, Лп(а) — на 22,7% [18].
Еще одно направление, обеспечивающее плазменную редукцию Лп(а), — IONIS-APO(a)Rx, антисмысловая олигонуклеотидная молекула, которая избирательно взаимодействует с мРНК апоА. РНКаза H1, распознает дуплекс РНК-ДНК, образующийся, когда ISIS-APO(a)Rx связывается с комплементарной последовательностью мРНК апоА и расщепляет мишень, тем самым уменьшая синтез апоА и предотвращая образование Лп(а) (рис. 2) [19]. В первой фазе исследований на здоровых добровольцах, имеющих уровень Лп(а) ≥25 нмоль/л, IONIS-APO(a)Rx дозозависимо снижал содержание Лп(а), а при использовании максимальной дозировки препарата в 300 мг достигалось снижение до 77,8% [15].
В настоящее время аферез липидов — единственный метод значительного снижения уровня Лп(а) плазмы (>60% за одну процедуру), показавший эффективность в обсервационных исследованиях, однако данный вид терапии является инвазивным и дорогостоящим, что ограничивает его применение в клинической практике [3]. Данные немецкого реестра липидного афереза показывают, что регулярное проведение процедуры у пациентов с высоким уровнем Лп(а) и ХС ЛНП на фоне липидкорригирующей терапии снижает риск сердечно-сосудистых событий [15].
Далее представлено клиническое наблюдение, демонстрирующее редкость определения содержания Лп(а) даже в условиях «неклассического», прогрессирующего течения ССЗ и актуализирует необходимость включения его в стандарт липидного обследования хотя бы раз в течение жизни у любого взрослого согласно европейским и последним российским рекомендациям «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза» [20].
Клиническое наблюдение
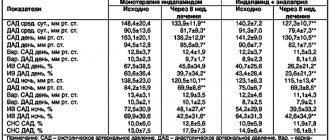
Пациентка Б., 62 года. В 2003 г. в возрасте 45 лет перенесла транзиторную ишемическую атаку, тогда же впервые была выявлена АГ II степени. В липидограмме: общий ХС 6,1 ммоль/л, ХС ЛНП 4,2 ммоль/л, ХС-ЛВП 1,0 ммоль/л, триглицериды 2,2 ммоль/л. Уровень глюкозы в крови 5,1 ммоль/л, скорость клубочковой фильтрации (расчет по формуле CKD-EPI) 98 мл/мин/1,73 м2, содержание Лп(а) не определяли.
Семейный анамнез не отягощен, не курит, менструальный цикл регулярный. При осмотре клинически значимой патологии не выявлено, индекс массы тела 28 кг/м2. Наряду с ацетилсалициловой кислотой пациентке назначена трехкомпонентная гипотензивная терапия, включающая амлодипин, лозартан и гидрохлортиазид, достигнуты целевые значения артериального давления. Прием розувастатина 10 мг/сут позволил достичь желаемых значений липидного спектра — ХС ЛНП 2,4 ммоль/л (целевое значение ХС ЛНП на тот момент, согласно актуальным клиническим рекомендациям, <2,5 ммоль/л). С 49 лет регистрируется предиабет, принимает пролонгированную форму метформина в дозе 1500 мг/сут.
Несмотря на высокую приверженность медикаментозной терапии, у пациентки в возрасте 54 лет манифестировала ишемическая болезнь сердца (ИБС) в виде стабильной стенокардии напряжения II функционального класса (ФК), снижение толерантности к физической нагрузке. В 56 лет в связи с частыми цервикалгиями, которые беспокоили без связи с повышением артериального давления, проведена магнитно-резонансная томография головного мозга и выявлены множественные мелкие сосудистые очаги размером 1,5–2,5 мм, признаки перенесенного правополушарного инфаркта мозга: очаги размером 15×20 мм в бассейне пограничного кровоснабжения средней мозговой артерии и передней мозговой артерии. Липидный профиль: ХС ЛНП 2,2 ммоль/л, триглицериды 1,47 ммоль/л.
В ноябре 2021 г. в возрасте 61 года находилась на плановом обследовании с диагнозом: ИБС. Стенокардия напряжения II ФК. Гипертоническая болезнь III стадии, АГ III степени, риск 4. Хроническая сердечная недостаточность I степени (ФК II по NYHA). Хроническая церебральная ишемия, резидуальные явления острого нарушения мозгового кровообращения в правой гемисфере в бассейне пограничного кровоснабжения средней мозговой артерии, передней мозговой артерии. Выраженное повышение содержания Лп(а). Абдоминальное ожирение II степени. Нарушенная толерантность к глюкозе.
Пациентке проведено дуплексное сканирование брахиоцефальных артерий: стеноз правой подключичной артерии 20–25%; стеноз на границе средней и дистальной трети левой общей сонной артерии 20–25% за счет гетерогенной атеросклеротической бляшки; пролонгированный стеноз 25% в средней трети левой общей сонной артерии за счет неоднородной атеросклеротической бляшки. Проведено холтеровское мониторирование электрокардиографии: на фоне синусового ритма с частотой сердечных сокращений 135 в минуту зафиксирован единичный эпизод нисходящей депрессии сегмента ST в отведении V3–V5 с амплитудой 0,1 мВ. По данным эхокардиографии: признаки гипертрофии миокарда левого желудочка, диастолической дисфункции, уплотнение стенок аорты, фракция выброса левого желудочка — 62%.
Общий анализ крови и общий анализ мочи без клинически значимых изменений; скорость клубочковой фильтрации 92 мл/мин/1,73 м2, гликированный гемоглобин 5,6%, тиреотропный гормон 3,5 мМе/л. На фоне терапии розувастатином 20 мг/сут в сочетании с эзетемибом 10 мг/сут: ХС ЛНП 1,4 ммоль/л, ХС ЛВП 1,1 ммоль/л, триглицериды 1,7 ммоль/л. Впервые проведенное измерение уровня Лп(а) показало значение 440,25 нмоль/л (при референсных значениях до 50 нмоль/л), что свидетельствует о наследственно обусловленном риске ССЗ, сопоставимом с риском гетерозиготной семейной гиперхолестеринемии. Однако если в последнем случае сроки инициации липидкорригирующей терапии четко определены — у взрослых с момента постановки диагноза, а у детей с 8 лет [10], то при значительном повышении содержания Лп(а) время начала, тактика медикаментозного вмешательства, целевые значения липидов в рамках первичной и вторичной профилактики неизвестны. В настоящее время пациентка продолжает принимать подобранную ей ранее терапию, в т. ч. комбинированную гиполипидемическую (розувастатин 20 мг/сут в сочетании с эзетемибом в стандартной дозе), от предложенной ей замены эзетемиба на ингибитор PCSK9 отказалась по финансовым соображениям.
Исследование холестерина-ЛПВП (альфа-холестерин, HDL)
Альфа-холестерин играет большую роль в утилизации избытка холестериновых молекул. Липопротеины высокой плотности циркулируют в кровеносном русле и там, где отмечается повышенная концентрация неизрасходованного клетками холестерина, связывают его и транспортируют в печень. В гепатоцитах ЛПВП под действием печеночных ферментов освобождаются от ХС, последний выводится из организма с желчью.
Чем выше уровень холестерина-ЛПВП в крови, тем активнее выводится из тканей лишний холестерин, тем меньше вероятность образования атеросклеротических бляшек на сосудистых стенках, тем меньше шансов к развитию сердечнососудистой патологии. Таким образом, холестерин-ЛПВП является «хорошим» или антиатерогенным.
Исследование HDL является обязательным при изучении липидного обмена. Данный анализ назначается также в качестве маркера эффективности немедикаментозной и фармакологической коррекции метаболизма. Норма – не менее 1,5 ммоль/л. Крайнее нижнее значение 1,0.
Контролировать этот показатель обязаны все пациенты, к которым относится любой из ниже перечисленных факторов:
- Возраст старше 40 лет;
- Сидячий или малоподвижный образ жизни;
- Преобладание в рационе питания животных жиров, рафинированных и простых углеводов;
- Курение;
- Частые стрессы;
- Злоупотребление алкоголем;
- Наличие избыточной массы тела;
- Сердечнососудистые болезни у близких родственников;
- Скачки артериального давления, особенно частое его повышение;
- Пограничные значения глюкозы и показателей липидного обмена в биохимической пробе крови.
К патологическому снижению приводит также:
- Почечная недостаточность;
- Генетические дефекты синтеза липопротеиновых компонентов;
- Печеночная патология с хроническим застоем желчи (желчнокаменная болезнь, дискинезия желчно-выводящих протоков, гепатит, цирроз, токсическое поражение печени).
Длительный дефицит ЛПВП приводит к накоплению ХС в кровеносных сосудах и тканях внутренних органов, существенно увеличивая риск возникновения:
- Атеросклероза аорты и артерий;
- Атеросклеротического кардиосклероза;
- Стенокардии;
- Нарушений сердечного ритма;
- Инфаркта миокарда;
- Инсульта;
- Почечной дисфункции;
- Нарушений кровообращения в кишечнике, конечностях.
Для профилактики этих заболеваний необходимо регулярно контролировать уровень холестерина-ЛПВП, особенно если имеются факторы риска.