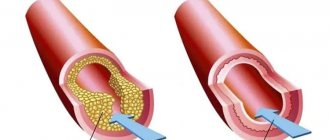
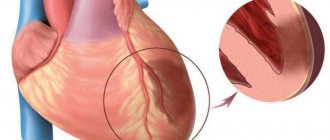
Первым, кто описал картину инфаркта миокарда в 1892 году, был В. М. Кернинг. В связи с нарушением коронарного кровообращения возникает некроз миокарда, сопровождающийся тромбозом коронарной артерии, и нарушением кровоснабжения участка сердечной мышцы, которые и получили название «инфаркт». Заболевание забирает жизни как молодых, так и пожилых людей. Отмечается также учащение случаев возникновения инфаркта у людей до 30 лет. Статистика также свидетельствует, что инфаркт по-разному поражает мужчин и женщин. Чаще всего от него страдают дамы в период менопаузы, когда уменьшается количество женского гормона в организме и атеросклеротическая бляшка разрушается, вместо нее возникает тромб, закупоривающий сосуд. Если тот процесс происходит быстро, то возникает острый инфаркт, требующий немедленной госпитализации. Представители сильного пола традиционно реже подвержены инфаркту, но после 40 лет мужчины получают инфаркт примерно в 4 раза, чем женщины, а начиная с 55 лет количество заболевших в обоих полах сравнивается. К непоправимым последствиям инфаркт приводит в 35% случаев.
Какой бывает инфаркт
Разновидности инфаркта различают по тому, где именно произошел некроз, какова глубина и площадь поражения миокарда. В соответствии с этими критериями, во врачебной практике принято выделять такие классы инфаркта:
- Крупноочаговый или обширный – при этой форме болезни тромб отличается значительными размерами;
- Мелкоочаговый возникает в результате незначительных повреждений мышцы, протекает, как правило, бессимптомно;
- Нижний – локализуется в нижней стенке артерии левого желудочка;
- Передний инфаркт наблюдается на передней стенке левого желудочка сердца;
- Задний – поражает, соответственно, заднюю стенку левого желудочка;
- Трансмуральный – самая опасная форма инфаркта, поражает всю стенку желудочка. Чаще всего приводит к летальному исходу;
- Интрамуральный – проявляется по всей толщине миокарда;
- Абдоминальный – локализован на задней стенке левого желудочка, возникает как результат других сердечных недугов;
- Рецидивирующий время от времени повторяется.
Различают также различные атипичные формы протекания инфаркта, при которых нет выраженных симптомов. Примерно 10% недуга идет именно в этой форме.
Где находится очаг поражения
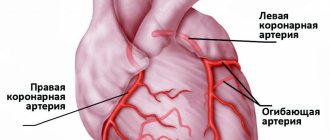
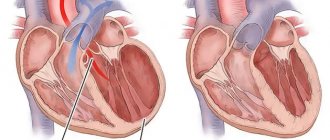
«Мишенью» нижнего инфаркта миокарда является левый желудочек — главный и самый массивный компонент мышечного «насоса». Его размеры больше, чем у других отделов сердца, в 2-3 раза. Толщина колеблется от 11 до 14 см, индекс массы миокарда 109-124 г/м² для женщин и мужчин соответственно. Кровоснабжение осуществляется по двум важным сосудам — правой венечной и огибающей артерии. Из этого отдела сердца выходит самый главный артериальный сосуд — аорта.
Таким образом, я могу сделать вывод, что левый желудочек нуждается в обильном кровообращении и гораздо большем количестве кислорода, чем другие области миокарда. В связи с этим именно он поражается в результате сердечно-сосудистой катастрофы практически в 100% случаев. А задняя стенка, разделенная на диафрагмальную и базальную области, затрагивается лишь в 10 — 15 %. Но хочу отметить, что при её вовлечении в патологический процесс возникают большие трудности в диагностике. Стандартные 12 электрокардиографических отведений не регистрируют повреждение данного анатомического сегмента («немая» зона).
Нижний инфаркт миокарда в большинстве случаев сопровождается поражением смежных областей — заднеперегородочной, задненижней и заднебоковой.
Это сочетание спасает жизни многих пациентов, так как изменения четко регистрируются на кривой ЭКГ.
Симптомы инфаркта
Следует помнить, что кардиологи рассматривают предынфарктное состояние и собственно, сам инфаркт миокарда. Внезапное возникновение болезни зафиксировано у 43% больных. Примерно за месяц до обострения человек начинает чувствовать себя нехорошо. Причем у женщин симптомы проявляются менее выражено и похожи на грипп или простуду. У мужчин же симптомы классические. Многие отмечают наличие следующих симптомов задолго до возникновения приступа:
- Усталость, которая не проходит и после сна;
- Постоянная слабость;
- Расстройства сна;
- Одышка;
- Онемение или покалывание конечностей;
- Нарушения зрения;
- Беспокойство;
- Бледность кожи;
- Повышенное потоотделение.
Для типичного инфаркта характерны следующие симптомы:
- Боли крайней интенсивности различного характера с локализацией в грудной клетке и иррадиированием в руку шею, левое плечо, ухо, область между лопатками. Замечена пропорция: боль тем сильнее, чем большая площадь сердечной мышцы поражена некрозом;
- Волнообразные болевые приступы;
- Тахикардия;
- Аритмия;
- Артериальное давление повышается, затем падает;
- Повышение температуры тела;
- Симптомы сердечной недостаточности.
Лечение
При острейшей стадии инфаркта, в первую очередь, медики купируют боль. Для этого внутривенно могут применяться различные анальгетики и наркотические средства (морфин). Для наступления более быстрого эффекта обезболивающие препараты вводятся внутривенно.
После снятия электрокардиограммы для восстановления коронарного кровотока вводятся тромболитики. Для устранения болевого приступа проводится нейролептаналгезия.
Далее больному назначается комплекс препаратов для уменьшения потребности миокарда в кислороде, бета-блокаторы для снижения нагрузки на сердце, медикаменты для разжижения крови и уменьшения уровня ее свертываемости. При необходимости назначают ингибиторы, седативные и снотворные препараты. Комбинация препаратов зависит от наличия у пациента сопутствующих заболеваний и степени тяжести перенесенного инфаркта.
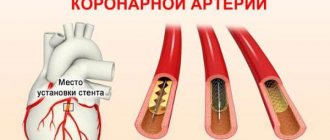
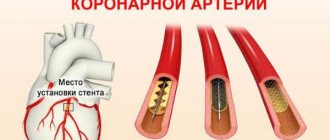
Для лечения инфаркта используются хирургические методы восстановления кровотока (аортокоронарное шунтирование, баллонная ангиопластика).
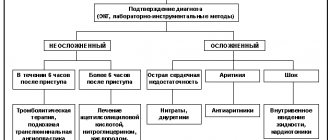
Первые дни лечения пациенту показан постельный режим, а, начиная с 3-4 дня, пациент может сидеть на стуле около часа два раза в день. При неосложненном инфаркте пациенту разрешают ходить через 5-7 дней после инфаркта. При неосложненной форме инфаркта миокарда пациента выписывают из стационара на 10-12 день, при осложнениях госпитализация может длиться до 4 недель.
Клинические рекомендации
Клинические рекомендации «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы» были разработаны Российским кардиологическим обществом при участии Ассоциации сердечно-сосудистых хирургов России, одобрены Научно-практическим Советом Минздрава РФ и утверждены Минздравом в 2021 году. Документ содержит информацию о заболевании, формах его диагностики, симптомах, методах лечения, возможных осложнениях, уходе и реабилитации.
Приложение В документа – рекомендации пациентам, перенесшим инфаркт, связанные со вторичной профилактикой заболевания. В рекомендациях сказано, что пациентам следует отказаться от курения, обеспечить регулярную физическую активность, соблюдать диету, разработанную для таких случаев, избавиться от лишнего веса, следуя рекомендациям врача поддерживать низкие значения холестерина в крови с помощью лекарств, обеспечить стойкую нормализацию артериального давления (при наличии артериальной гипертонии), поддерживать нормальный уровень сахара в крови (при наличии сахарного диабета). Кроме того, при обширном поражении сердечной мышцы и/или осложнениях инфаркта миокарда требуется дополнительное лечение, которое назначается врачом. Известно, что преждевременное прекращение приема необходимых лекарств существенно увеличивает риск возникновения повторного инфаркта миокарда и смерти, появления сердечной недостаточности, которая может существенно ограничить вашу ежедневную активность. Отменять лекарства, не посоветовавшись с врачом, нельзя. Для снижения риска повторных событий (инфаркта миокарда, его осложнений) для вас крайне желательно участие в специальной программе реабилитации, включающей регулярные дозированные физические нагрузки, психологическую поддержку, организацию контроля за факторами риска.
Стадии инфаркта миокарда
Если человек не заметил проявлений предынфарктного состояния, развивается непосредственно сам инфаркт. Врачебное сообщество создало такой перечень стадий протекания недуга, которые последовательно сменяют друг друга:
- Острейшая. Длится около 6 часов. Часто больного не успевают довезти на лечение;
- Острая. Считается самой опасной. Длится около двух недель, что позволяет возникнуть рубцу на сердечной мышце;
- Подострая – характеризуется постепенным исчезновением некроза;
- Постинфарктная – начинается со второго месяца от начала заболевания. Длительность ее напрямую связана с очагом поражения;
- Стадия рубцевания – завершает течение болезни, но не означает, что человек окончательно и бесповоротно излечился.
Реабилитация и восстановление после инфаркта
Главные задачи реабилитации после инфаркта – это восстановление работы системы кровообращения, трудоспособности и нормального образа жизни. Реабилитация включает в себя комплекс мер, последовательно и непрерывно осуществляется под наблюдением врачей.
Меры реабилитации индивидуальны и зависят от состояния пациента, тяжести инфаркта, хронических заболеваний. При этом этапы реабилитации связаны с нахождением в стационаре, в санатории и дома.
В стационаре производится диагностика заболевания, лечение после восстановления проходимости коронарных сосудов, оцениваются риски и формируется прогноз на восстановительный период и рецидив.
Стационарный реабилитационный период – это время острого периода инфаркта, которое пациент проводит в специализированном реабилитационном отделение больницы и затем – в кардиологическом санатории.
Амбулаторный период реабилитации предусмотрен для домашних условий под контролем кардиолога врача ЛФК.
Реабилитация – это медикаментозные и немедикаментозные методы восстановления. В них входят:
- гимнастика для профилактики образования повторных тромбов и усиления кровоснабжения и кислородообеспечения,
- физиотерапия,
- психологическая помощь.
При этом индивидуальный комплекс мер включает постепенное наращивание физических нагрузок. Обычно через две недели после инфаркта пациентам разрешаются прогулки до 2 км в день с оценкой способностей сердца к работе на ЭхоКГ (ультразвуковое исследование сердца), проводят пробы с физической нагрузкой.
В комплекс ЛФК постепенно включают плавание, ходьбу в темпе, занятия на тренажерах. В зависимости от функционального класса ишемии занятия проходят в тренирующем или щадящем режиме.
При реабилитации важны меры психологического восстановления. Возвращение к нормальной жизни, преодоления страха, в том числе и перед физическими нагрузками – важный этап излечения после инфаркта. Формирование депрессивных и тревожных состояний способно надолго оттянуть результаты реабилитации и ухудшить ее качество.
К немедикаментозным методам, кроме физической реабилитации, относят коррекцию образа жизни:
- отказ от курения и алкоголя,
- диета,
- полноценный сон.
Лекарственные средства используются для:
- предупреждения приступов стенокардии,
- контроля артериального давления,
- свертываемости крови,
- липидного обмена,
- лечения аритмии и хронической сердечной недостаточности.
Комплексная программа реабилитации помогает пациентам восстановиться в более короткие сроки, предупредить повторный инфаркт и другие осложнения.
Как протекает атипичный инфаркт
Помимо обычного течения болезни, которое встречается в большинстве случаев, медицине известны и атипичные варианты патогенеза. Например, такие, как:
- Астматический. Характерен для людей старшего возраста, болевой синдром выражен слабо, а вот сердцебиение учащено, наблюдается одышка, пульс учащен;
- Гастралгический. При этом варианте болит вверху живота, наблюдается отрыжка, икота, рвота, живот вздут. ;
- Аритмический. Сердцебиение нарушено, но боли незначительные. Процент пациентов с аритмическим инфарктом – до 5%;
- Цереброваскулярный характеризуется дезориентацией человека в пространстве, случаются потери сознания, рвота;
- Малосимптомный – практически не дает о себе знать. Как правило, обнаруживается, когда пациенту в профилактических целях назначают ЭКГ.
Однако врачи предупреждают, что только первый – острейший период проходит нетипично. Дальше болезнь берет свое и картина будет та же, как и при обычном течении инфаркта.
ПОМОЩЬ ДЫХАТЕЛЬНОГО ТРЕНАЖЕРА «САМОЗДРАВ» В РЕАБИЛИТАЦИИ
Чтобы побыстрее вернуться к нормальному образу жизни, можно использовать дыхательный тренажер «Самоздрав». Регулярные занятия на этом аппарате улучшат кровоснабжение сердца. Особенно он может быть полезен для той группы больных, которые проходят реабилитацию в домашних условиях.
Приступить к занятиям на тренажере можно уже через 3 месяца после инфаркта. Тренажер «Самоздрав» пригодится как для реабилитации больного, так и для профилактики повторного инфаркта. Ведь с помощью гиперкапнической смеси снимается спазм сосудов и улучшается работа всей сердечно-сосудистой системы.
За счет постоянных тренировок образуется система коллатералей – небольших кровеносных сосудов вокруг сердца. Они обеспечивают альтернативное кровоснабжение и более полноценное питание сердечной мышцы.
Занимаясь на тренажере «Самоздрав», больной быстрее восстановится после инфаркта, потому что нормализуется кровоток и уйдет нагрузка с коронарных сосудов. Занятия на тренажере «Самоздрав» дадут свои ощутимые результаты уже через 3-4 месяца, а для такого серьезного недуга как инфаркт это срок достаточно небольшой.
Инвалидность после инфаркта
Инфаркт требует длительного периода лечения и реабилитации. При этом полная трудоспособность человека восстанавливается не всегда. По этим причинам постоянная или временная инвалидность пациентам с инфарктом ставится достаточно часто.
Все пациенты, перенесшие обширный инфаркт, имеют право на четырёхмесячную оплачиваемую реабилитацию на основании полиса ОМС. Обычно этого срока реабилитации достаточно, чтобы понять, понадобиться ли человеку инвалидность, или он способен в полном объеме приступить к привычной работе. Если есть основание думать о частичной утрате трудоспособности, пациент по рекомендации лечащего врача может пройти освидетельствование в медико-социальной экспертной комиссии.
Для оценки уровня утраты трудоспособности комиссия оценит:
- возможности самообслуживания пациента,
- его образование,
- возможности возвращения к привычной работе,
- общее состояние здоровья.
В итоге инвалидность могут присвоить тем, чья работа связана с частыми стрессами, повышенным вниманием, физической активностью; пенсионерам и пациентам, перенесшим операции на сосудах; людям, имеющим сердечную недостаточность или нестабильную стенокардию, а также утратившим трудоспособность на 50 и более процентов.
Комиссия каждый случай оценивает индивидуально и принимает решение, исходя из совокупности факторов и о факте установления инвалидности, и о ее группе.
Диета
В первую неделю после инфаркта миокарда рекомендуется низкокалорийная диета с ограничением жидкости, соли, жиров, чрезмерно грубой клетчаткой и холестерином. В рацион должны включаться продукты, которые богаты калием и витамином С.
В первую неделю пищу подают в протертом виде, маленькими порциями по 6-7 раз в день. Это могут быть:
- манная,
- овсяная,
- гречневая,
- рисовая каши,
- нежирная телятина,
- курица,
- рыба,
- белковый омлет на пару,
- творог и кефир,
- салат из моркови и яблок,
- свекла и капуста,
- фруктовые пюре,
- мед.
Нельзя есть:
- сдобу и сладости,
- копченые,
- жареные,
- жирные,
- острые,
- соленые и маринованные блюда;
- макароны,
- бобы,
- кофе,
- вареные и жареные яйца.
После острейшего периода в рацион вводится цельная пища, но ограничения в питании должны стать для человека нормой жизни.
Основу рациона должны составлять:
- овощи,
- фрукты,
- орехи,
- нежирные сорта мяса и рыбы,
- крупы.
Не рекомендуются к употреблению копчености, консервы, жареное, соленое. Контролировать вес удобно с помощью индекса массы тела (результат от деления массы в кг и роста в метрах в квадрате).
Он должен быть в пределах 25-27 кг/м. Кроме того, оценивается окружность талии: для мужчин этот показатель не должен превышать 94 см, у женщин – 80 см.
Диета, направленная на снижение веса
Первый завтрак.
Сто граммов нежирного творога, чашка кофе с молоком и без сахара.
Второй завтрак.
Салат из свежей капусты (170 г) со сметаной без соли.
Обед.
Вегетарианские щи (200 мл), 90 г нежирного отварного мяса, 50 г зеленого горошка, 100 г яблок.
Полдник.
Сто граммов творога и 180 мл отвара шиповника.
Ужин.
Отварная рыба (100 г) и овощное рагу (125 г).
Перед сном, на ночь.
Кефир (180 мл) и 150 г ржаного хлеба.
Повторим, это приблизительный рацион на один день. Такая диета содержит 1800 ккал.
Для больных без проблемы лишнего веса рацион значительно расширяется. Им назначается диета с калорийностью
2500 – 3000 ккал
. Ограничивается употребление жиров животного происхождения и углеводов. Так же 4-5 разовое питание. Полезно проводить разгрузочные дни на яблоках (1, 5 кг) или свежих огурцах (2 кг). Для «заядлых мясоедов» даже разрешается 600 г нежирного мяса плюс гарнир из овощей (свежая капуста, зеленый горошек).
Категорически не рекомендуют
врачи употреблять таким больным
алкоголь
– даже самого высокого качества. Он вызывает тахикардию и нежелательное повышение аппетита. Абсолютно неприемлемо употребление копченостей, жареного, жирных колбасных изделий и сладостей.
Дыхательная гимнастика после инфаркта
Инфаркт – это острое состояние, связанное с предельным напряжением работы сосудов и экстремальным нарушением кровообращения. Нехватка кислорода в сердечной мышце приводит к ее отмиранию. К сожалению, некроз сердечной мышцы необратим, но тем не менее, создавать условия достаточности кислорода в организме необходимо и при первичной, и при вторичной профилактике заболевания.
Острыми болями при приступах стенокардии, являющихся предшественниками инфаркта, миокард сигнализирует о проблемах с кислородом.
Верный способ обеспечить сердечную мышцу достаточным количеством кислорода – снижать факторы риска и правильно дышать. Кислород мы получаем через органы дыхания, и они должны быть тренированными и настроенными на поддержку полноценного дыхательного цикла.
Дыхательный тренажер «Самоздрав» может стать уверенной и мощной поддержкой в профилактике инфаркта. Одно из базовых положительных влияний дыхательных тренировок на организм – достаточное поступление в организм кислорода и поддержка нормального уровня СО2. Благодаря тренировкам с «Самоздравом», можно постоянно поддерживать уровень кислорода на уровне, исключающим его дефицит. Это означает высокую вероятность сохранности миокарда и существенно снижает риск инфаркта.
Помимо «прямой поставки» кислорода в организм, дыхательные тренировки укрепляют работу нервной системы и корректируют реакции на стресс, обеспечивают покой и ровный эмоциональный фон даже при высоких нагрузках.
Тренировки с «Самоздравом» корректируют обмен веществ и эффективны при лечении ожирения. Они активизируют метаболизм за счет нормализации уровня кислорода в клетках и тканях, нормализуют выведение продуктов обмена, позволяют лучше усваиваться питательным веществам.
Незаменим «Самоздрав» для больных гипертонией. Именно лечение этого заболевания стало первоочередной задачей создателей дыхательного тренажера, и сегодня его эффективность при лечении гипертонии без медикаментов полностью доказана исследованиями и многолетней практикой применения миллионами людей.
Дыхательные тренировки способны справиться с любым модифицированным фактором риска инфаркта. Регулярные занятия дадут миокарду достаточный уровень кислорода и сохранят сердце здоровым.
Диагностика инфаркта
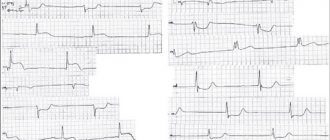
Чтобы поставить соответствующий диагноз, необходимо расспросить пациента и при жалобах на боли в загрудинной области – обязательно отправить на ЭКГ. При инфаркте кардиограмма покажет Т- или Q-зубец, патологию QRS. Разобраться в этом может только профильный специалист. Понадобится сдать и анализ крови. При инфаркте он очень показателен. Часов через 6 после приступа обнаружится увеличенный миоглобин, через 10 – креатинфосфокиназа, через сутки-двое – повышенный уровень лактатдегидрогеназы. Также будут увеличен СОЭ, АлАт, количество лейкоцитов, АсАт. Одним из новшеств в диагностике инфаркта является тропониновый тест. Это экспресс-метод помогает обнаружить инфаркт за час. У здорового человека тропонинов в крови нет, а вот при инфаркте они будут. Кстати, это один из «народных» способов отличить стенокардию от инфаркта. Скорее всего, не получится обойтись и без коронографии, которая покажет, как сокращаются желудочки, есть ли тромбы, определит возможность и необходимость шунтирования.
Острое повреждение миокарда при коронавирусной болезни 2021 (COVID-19) (разбор клинического случая)
- Бабаев Максим Александрович
- Петрушин М.А.
- Дубровин И.А.
- Кострица Н.С.
- Еременко Александр Анатольевич
Резюме
COronaVIrus Disease 2021 в 20% случаев характеризуется тяжелым и очень тяжелым течением, что сопровождается пневмонией, острым респираторным дистресс-синдромом, множественными органными дисфункциями. Осложнения со стороны сердечно-сосудистой системы встречаются в 20-25% случаев и самостоятельно или совместно с дыхательной недостаточностью являются причиной летальных исходов у 40% пациентов с неблагоприятным течением болезни. Острое миокардиальное повреждение (5-38%), причиной которого чаще всего является комбинация факторов: инфаркт на фоне острого вирусного миокардита и «цитокинового шторма»; тромбоз коронарных сосудов вследствие ковид-ассоциированой коагулопатии; вазоконстрик-ция по причине блокировки SARS-COV-2 рецепторов ангиотензин-превращающего фермента II (АПФ II) и увеличение концентрации ангиотензина II; гипоксия вследствие дыхательной недостаточности, — проявляется сердечной недостаточностью, нарушениями ритма сердца (~20%) и/или случаями внезапной смерти (5-7%).
Данный клинический случай демонстрирует, как у пациентки, входящей в группу особого риска (гипертоническая болезнь), несмотря на положительную динамику, после терапии человеческими моноклональными антителами к рецептору интерлейкина-6 (сарилумаб), на 8-е сутки нахождения в отделении реанимации и интенсивной терапии произошла внезапная смерть с остановкой кровообращения, причиной которой стало острое повреждение миокарда.
Ключевые слова:коронавирус, COVID-19, острое повреждение миокарда, множественные органные дисфункции
Финансирование
. Исследование не имело спонсорской поддержки.
Конфликт интересов
. Авторы заявляют об отсутствии конфликта интересов.
Для цитирования
: Бабаев М.А., Петрушин М.А., Дубровин И.А., Кострица Н.С., Еременко А.А. Острое повреждение миокарда при коронавирусной болезни 2021 (COVID-19) (разбор клинического случая) // Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2021. Т. 8, № 3. С. 87-94. DOI: https://doi.org/10.33029/2308-1198-2020-8-3-87-94
COVID 19 (COronaVIrus Disease 2019) — это вирусное инфекционное заболевание, вызываемое коронавирусом тяжелого острого респираторного синдрома 2 (severe acute respiratory syndrome coronavirus 2 — SARS-CoV-2) с уровнем смертности 3-7% [1]. Заболевания имеет 7-14-дневный период инкубации, чаще проявляется у лиц мужского пола со сниженными резервами организма (возраст, коморбидность). Болезнь обладает неоднородным клиническим течением, зависит от степени выраженности системного процесса, эндотипа и/или комбинации эндотипов генерализованного ответа на внедрение вируса (гипервоспаление, нарушение коагуляции, иммуносупрессия) и от объема повреждения эндотелия сосудов и эпителиальных тканей [2, 3]. При адаптивном ответе возможно появление отдельных симптомов или вообще бессимптомное носительство. В 20% случаев отмечается тяжелое и очень тяжелое течение, что сопровождается пневмонией, острым респираторным дистресс-синдромом (ОРДС), множественными органными дисфункциями, присоединением бактериальной инфекции и завершается полиорганной недостаточностью [2].
Кроме легочных осложнений, наиболее часто встречаются осложнения со стороны сердечно-сосудистой системы (ССС), которые самостоятельно или совместно с дыхательной недостаточностью являются причиной летальных исходов у 40% больных с неблагоприятным течением заболевания. При COVID-19 пациенты, имеющие в анамнезе сердечно-сосудистые заболевания (ССЗ) и гипертензию, чаще нуждаются в интенсивной терапии [отношение шансов (OШ) 2,1; доверительный интервал (ДИ) 1,5-3,0; OK: 1,9, ДИ 1,5-2,5)] и имеют повышенный риск смертности (OШ 4,7; ДИ 2,9-7,б) [4]. Осложнения со стороны ССС проявляются в виде острой сердечной недостаточности (ОСН) и венозной тромбоэмболии. Поражение сердца выявляется у 20-25% тяжелых пациентов c COVID-19 [2]. Острое миокардиальное повреждение является следствием ишемических (острый коронарный синдром, ОКС)/неишемических (миокардит)/смешанных причин (аритмии), проявляется увеличением уровней тропонина и натрийуретических пептидов В типа, связано с увеличением риска развития ОРДС, злокачественных желудочковых тахиаритмий, острого повреждения почек и коагулопатии, риска смерти, и этот риск больше у пациентов с уже имеющимися заболеваниями ССС [5, б].
В настоящей статье представлен анализ факторов риска, причин возникновения и течения COVID-19, осложненного острым повреждения миокарда.
Клинический случай
Больная З.,
1958 г.р., поступила 30.05.2020 в пульмонологическое отделение (для лечения больных с выявленным COVID-19) ГБУЗ «Областная клиническая больница» г. Твери с диагнозом «двусторонняя внебольничная пневмония (ковид-пневмония?)».
Считает себя больной с 23.05.2020, когда появилась общая слабость, через 2 сут обратилась за помощью к участковому терапевту, после чего ей был назначен левофлоксацин, а с 26.05.2020 к лечению добавлен цефтриаксон. 29.05.2020 проведена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки, при которой выявлена двусторонняя среднетяжелая пневмония с поражением 25-50% паренхимы легких, зонами уплотнения по типу «матового стекла» (КТ2 — классификация по степени выявленных изменений). За стационарной помощью не обращалась. 30.05.2020 на фоне ухудшения состояния (рефрактерная к терапии гипертермия до 38,6 °С, слабость) вызвала скорую медицинскую помощь. В анамнезе — гипертоническая болезнь II стадии, артериальная гипертензия II степени, риск 2.
При поступлении в ПЦР-анализе обнаружена РНК ковид-19; на электрокардиограмме (ЭКГ) атриовентрикулярная (АВ) блокада I степени, корригированный интервал QT
— 413 мс; в биохимическом анализе крови: увеличение уровня аспартатаминотрансферазы (АСТ) — до 111 ед./л при уровне аланинаминотрансферазы (АЛТ) — 31 ед./л, γ-глютамилтранспептидазы (ГГТ) — до 988 ед./л, креатинина сыворотки крови — 134 мкмоль/л.
После проведения дополнительных исследований пациентке поставлен диагноз: коронавирусная инфекция, вызванная вирусом COVID-19, вирус идентифицирован (U07.1); внебольничная двусторонняя полисегментарная пневмония (J18.8); множественные органные дисфункции (острый респираторный дистресс-синдром средней степени тяжести, ОРДС); острое миокардиальное повреждение; острое почечное повреждение, ОПП) и сопутствующие болезни в виде гипертонической болезни II стадии, артериальной гипертензии II степени, риск 2.
К 3-м суткам пребывания в стационаре (11-й день от начала болезни) состояние пациентки ухудшилось (рис. 1):
• сохранялась стойкая к проводимой терапии гипертермия до 38,7 °С; выявлено увеличение уровня С-реактивного белка до 85 мг/л, ферритина, содержание пресепсина соответствовало умеренному риску развития системного воспаления (487 пг/мл); отмечалась высокая склонность к микротромбообразованию (D-димер, лактатдегидрогеназа, ЛДГ);
• зафиксированы лабораторные признаки повреждения миокарда (тропонина I) и перегрузки полостей сердца (NT-proBNP); по данным эхокардиографии (ЭхоКГ) диастолическая дисфункция левого желудочка (ЛЖ) I степени (замедление расслабления), тенденция к дилатации левого предсердия, признаки легочной гипертензии (среднее давление в легочной артерии — 25 мм рт.ст.);
• гипоперфузия с появлением в анализах кислотно-основного состояния (КОС) — метаболического (4 ммоль/л) лактат-ацидоза (рН — 7,20, ВЕ — 16 ммоль/л);
• прогрессирование дыхательной недостаточности — снижение уровня SatO2 до 86% (по пульсоксиметру) при дыхании атмосферным воздухом, появление тахипоэ до 26/мин, на контрольной компьютерной томографии (КТ) диффузное уплотнение легочной ткани по типу «матового стекла», консолидация в сочетании с ретикулярными изменениями, значительное распространение объема поражения легких 96 % (КТ4).
Рис. 1.
Клинико-лабораторная характеристика течения заболевания у пациентки З.
SOFA — шкала органной дисфункции, ассоциированной с сепсисом; TnI — тропонин I; PEEP — положительное давление конца вдоха; CPAP — постоянное положительное давление в дыхательных путях; NT-proBNP — N-терминальный пропептид натрийуретического гормона; КТ — компьютерная томография; ЧД — частота дыхания; FIO2 — фракция кислорода во вдыхаемом воздухе; prone position -прон-позиция; АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза.
Fig. 1.
Clinical and laboratory characteristics of the course of the disease in patient Z.
SOFA — scale of organ dysfunction associated with sepsis; TnI — troponin I; PEEP is the positive pressure of the end of the dose; CPAP — continuous positive airway pressure; NT-proBNP — N-terminal propeptide of natriuretic hormone; CT — computed tomography; RR — respiratory rate; FIO2 — fraction of oxygen in the inhaled air; prone position — prone position; AST — aspartate aminotransferase; ALT — alanine aminotransferase.
Больная была переведена в отделение реанимации и интенсивной терапии (ОРИТ), где ей была начата неинвазивная вентиляция легких (НИВЛ) в режиме CPAP c PEEP 8 см вод.ст. и фракции вдыхаемого кислорода (FiO2) 50% с периодическими сеансами прон-позиции по 6-10 ч, коррекция КОС и водно-электролитного баланса, проведена смена антибиотикотерапии, начата целенаправленная терапия «цитокинового шторма» антагонистом ИЛ-6 препаратом сарулумаб.
К 7-м суткам пребывания в ОРИТ (18-й день от начала болезни) удалось купировать гипертермию, пациентка стала отмечать субъективное улучшение самочувствия, что сопровождалось уменьшением объема поражения до 86% по данным КТ, со стабилизацией показателя SatO2 на уровне 96% при ингаляции 40% кислородом.
Однако в анализах крови прогрессировали признаки воспаления (лейкоцитоз — 25,5х109/л, сегментоядерные нейтрофилы — 80,5%), тромботической микроангиопатии (рост ЛДГ практически в 2 раза), острой печеночно-почечной дисфункции (холестаз, цитолиз, прирост креатинина) и повреждения миокарда (увеличения уровней высокочувствительного тропонина I и NT-proBNP), что сопровождалось увеличением корригированного интервала QT
до 420 мс, диффузной гипокинезией миокарда ЛЖ без локальных нарушений сократимости; снижением фракции выброса до 46%; диастолической дисфункцией ЛЖ I степени. Также при ЭхоКГ визуализировались гипертрофия ЛЖ, признаки хронического легочного сердца (дисфункция и перегрузка правых отделов на фоне артериальной легочной гипертензии, гипертрофия правого желудочка); вторичная трикуспидальная недостаточность II степени; дилатация левого предсердия; атеросклероз аорты, кальциноз I-II степени створок аортального клапана, аортальная регургитация I степени.
11.06.2020 состояние больной резко ухудшилось. Пациентка потеряла сознание, на болевые раздражители не реагировала (шкала комы Глазго — 6 баллов), на ЭКГ зафиксирована асистолия. Больная была интубирована, переведена на ИВЛ, проведены реанимационные мероприятия в полном объеме, которые оказались неэффективны.
Результаты патологоанатомического исследования
Макропрепарат представлен на рис. 2.
Рис. 2.
Макропрепарат сердца больной З.
Сердце массой 340 г, размером 11x9x7 см. Толщина стенки ЛЖ 1,5 см, справа 0,3 см, толщина межжелудочковой перегородки 1,3 см; коронарные артерии проходимы. Заметное расширение правых отделов сердца. Мышца сердца на разрезах бледно-красная, под эндокардом передней стенки левого желудочка и межжелудочковой перегородки кровоизлияние 5×4 см. Легочные артерии проходимы свободно, интима гладкая, блестящая
Fig. 2.
Macrodrug of the heart of a patient Z.
Heart weighing 340 grams, size 11x9x7 cm. LV wait thickness 1.5 cm, right 0.3 cm, interventricular septum thickness 1.3 cm; coronary arteries are passable. Marked expansion of the right heart. The muscle of the heart on the incisions is pale red, under the endocardium of the anterior wall of the left ventricle and interventricular septum there is a 5×4 cm hemorrhage. The pulmonary arteries are freely passable, the intima is smooth, shiny
Обсуждение
На данном клиническом примере подтверждаются данные многочисленных исследований о том, что COVID-19 усугубляет течение существующих и приводит к развитию новых ССЗ; присоединение острого повреждения миокарда приводит к выраженному утяжелению течения болезни, способствует возникновению множественных органных дисфункций и является значимым фактором риска неблагоприятного исхода, несмотря на проводимую терапию; наличие острого повреждения миокарда может стать причиной внезапных остановок кровообращения.
Частота осложнений COVID-19 со стороны ССС, по данным разных авторов, колеблется от 5 до 38% среди госпитализированных пациентов [4, 7, 8].
Осложнения проявляются в виде острой сердечной недостаточности (ОКС, миокардит, аритмии) и венозной тромбоэмболии. Осложнения ССС при COVID-19 тесно связаны с уже имеющимися заболеваниями сердца и сосудов, особенно с гипертонической болезнью (23,3%) [4]. Причины этой взаимосвязи еще предстоит выяснить. История болезни пациентки З. наглядно показывает, что этот фактор риска (гипертоническая болезнь II стадии, артериальная гипертензия II степени, риск 2), даже без ишемической болезни сердца и выраженного атеросклероза у женщины не старше 65 лет может стать значимой причиной развития повреждения сердечной мышцы и прогрессирования сердечных дисфункций при COVID-19.
В литературе отмечается, что диагностируемые при поступлении в стационар осложнения со стороны ССС в 41,3% приводят к тяжелому течению болезни и скорому переводу в ОРИТ [4]. В нашем случае это произошло на 3-и сутки от момента поступления.
Причины возникновения ОСН и венозных эмболических осложнений достаточно хорошо ясны, так как они являются прямым следствием развивающихся при COVID-19 основных осложнений со стороны ССС (ОКС, миокардит, аритмии, гиперкоагуляция, вазоспазм). При этом патогенез острого повреждения миокарда достаточно сложно дифференцировать, так как механизмы, лежащие в его основе, носят смешанный ишемический и неишемический характер.
Патогенез повреждения сердца включает вазоконстрикцию [по причине увеличения концентрации ангиотензина II после блокировки SARS-COV-2 рецепторов ангиотензин-превращающего фермента II (АПФ II)]; нарушение доставки и потребления кислорода вследствие дыхательной недостаточности; инфаркт миокарда (1-го и 2-го типов) на фоне острого вирусного миокардита и «цитокинового шторма»; тромбоз вследствие ковид-ассоциированой коагулопатии [9] (см. рис. 2).
Патогенез и микроскопическая картина при COVID-19 у пациентки З. с острым повреждением миокарда представлены на рис. 3.
Рис. 3.
Патогенез и микроскопическая картина при COVID-19 остром повреждении миокарда: 1. Фрагментация, дисковидное и блочное разложение миокардиоцитов; 2. Некроз групп миокардиоцитов (отсутствие ядер в кардиомиоцитах). Зона некроза отграничена от сохраненного миокарда зоной полнокровия и лейкоцитарной инфильтрации (демаркационное воспаление); 3. Волнообразная деформация кардиомиоцитов (причина фибрилляции); 4. Тромб артериол; 5. Полнокровие, кровоизлияния, застой лейкоцитов в капиллярах с выходом в интерстициальные пространства (некроз длится около 1 дня); 6. Блочное разложение кардиомиоцитов
Fig. 3.
Pathogenesis and microscopic picture in acute covoid myocardial damage
(hematoxylin and eosin, X100).
1. Fragmentation, discoid and blocky decomposition of myocardiocytes; 2. Necrosis of myocardiocyte groups (lack of nuclei in cardio-myocytes). The area of necrosis is delimited from the preserved myocardium by the zone of plethora and leukocyte infiltration (demarcation inflammation); 3. Wave-like deformation of cardiomyocytes (the cause of fibrillation); 4. Arterioles thrombus; 5. Plethora, hemorrhages, stasis of leukocytes in the capillaries with access to interstitial spaces (necrosis lasts about 1 day); 6. Blocky decomposition of cardiomyocytes
Важная роль в патогенезе повреждения миокарда отводится воздействию SARS-CoV-2 на рецепторы АПФ II [10]. Вирус непосредственно связывается с АПФ II и приводит к уменьшению его экспрессии. Таким образом, под действием вируса увеличивается концентрация ангиотензина II и уменьшается концентрация ангиотензина 1-7, обладающего кардиопротективными свойствами [10]. Ангиотензин II, в свою очередь, оказывает вазоконстрикторное и проатеросклеротическое действие [11]. Кроме того, повышается экспрессия TNF-α, усиливая локальную и системную воспалительную реакцию и способствуя дальнейшему повреждению миокарда [12]. Данные эффекты могут носить как локальный, так и системный характер. Непосредственное проникновение вируса в клетки также может привести к некрозу кардиомиоцитов и в конечном итоге к повреждению миокарда [13].
При COVID-19 «цитокиновый шторм», вызванный неконтролируемым и дисфункциональным иммунным ответом Т-хелперами 1-го и 2-го типа, приводит к непрерывной активации и пролиферации различных цитокинов, которые вызывают апоптоз и некроз клеток миокарда, а также предрасполагают к разрыву бляшки [10].
Дыхательная недостаточность и генерализованное воспаление приводят к несоответствию между потреблением и доставкой кислорода к тканям, вызывая гипоксию, которая способствует чрезмерному внутриклеточному отложению кальция, приводящему к апоптозу клеток миокарда и его повреждению [11].
При COVID-19 регистрируется увеличение частоты артериальных тромбозов, провоцирующее возникновение инсультов, ОКС и эпизодов внезапной смерти. Патогенез этих тромботических осложнений является многофакторным и повторяет элементы известных нарушений коагуляции (сепсис-индуцированная коагулопатия, диссеминированное внутрисосудистое свертывание, гемафагоцитарный синдром и гемафагоцитарный лимфогистиоцитоз, антифосфолипидный синдром, тромботическая микроангиопатия, тромботическая тромбоцитопеническая пупрпура, гемолитический уремический синдром, гепарин-индуцированная тромбоцитопения) [14].
Острое повреждение миокарда характеризуется повышением и/или понижением концентрации маркеров повреждения миокарда: сердечный тропонин (cTnI/cTnT) выше/ниже 99-го процентиля при отсутствии клинических признаков ишемии миокарда может сопровождаться повышением уровня натрийуретического пептида типа В (BNP) или N-терминального фрагмента мозгового натрийуретического пептида (NT-proBNP) [15].
При COVID-19 можно заподозрить 2 типа повреждения миокарда: первичное или вторичное. При первичном повреждении пациенты преимущественно предъявляют сердечные, а не респираторные жалобы. Причиной первичного повреждения может быть острый инфаркт миокарда (тип 1), вирусный миокардит или вызванная стрессом кардиомиопатия. Больные жалуются на боль в груди, в анализах определяются повышенные сердечные ферменты, при ЭхоКГ наблюдают дисфункцию ЛЖ и изменения, связанные с сегментом ST-T
на ЭКГ, но с нормальной проходимостью коронарных сосудов на ангиограмме [10].
Вторичное повреждение связано с непосредственным повреждением вирусом кардиомиоцитов, генерализованным воспалением, выражается тенденцией к росту cTnI параллельно с увеличением воспалительных биомаркеров (интерлейкин-б, D-димер, ферритин и ЛДГ). F. Zhou и соавт. [16] показали, что частота повышения cTnI была значительно выше среди невыживших больных, и это стало предиктором внутрибольничной смерти (отношение шансов 80,07; 95% ДИ 10,34-620,36; р
<0,0001) [3]. В результатах [17, 18] отмечалось динамическое увеличение cTnI в группе невыживших с наиболее резким увеличением его концентрации после 16-го дня от начала заболевания и максимальным значением на 22-й день. Примечательно, что среднее время до смерти от появления симптомов составляло 18,5 дня (межквартильный период, диапазон 15-20 дней). Аналогично уровень NT-proBNP >88,64 пк/мл у пациентов с тяжелым течением COVID-19 является независимым фактором, повышающим внутригоспитальную летальность [19].
У пациентки З. с момента поступления в стационар уже отмечались признаки повреждения миокарда: увеличение уровней cTnI и NT-proBNP, сывороточных трансаминаз, полостей сердца, признаки легочной гипертензии. Изменение лабораторных показателей не сопровождалось характерными жалобами, не было анамнестических сведений о наличии ишемической болезни, на ЭКГ не зафиксировано изменений ишемического генеза. За сутки до наступления неблагоприятного исхода (8-е сутки в ОРИТ и 19-е от начала заболевания; этот временной промежуток совпадает с данными, представленными в работе G. Lippi и соавт. [17]) был отмечен прирост уровней cTnI и NT-proBNP — практически в 1,5 раза от исходных значений и незначительное снижение фракции изгнания ЛЖ на ЭхоКГ, увеличение характерных показателей микротромбообразования и прогрессирование на этом фоне тяжести органных дисфункций. Клинико-лабораторные характеристики подтверждаются результатами аутопсии, при которой были выявлены характерные патологические изменения макроанатомии сердца (масса, размеры, толщина стенок, наличие кровоизлияния в межжелудочковой перегородке) и структуры кардиомиоцитов (фрагментации, отек, распад кардиомиоцитов). В протоколе отмечено появление свежего участка некроза миокарда (за сутки до наступления летального исхода) с зоной перифокального воспаления и тромба в просвете артериолы, что совпадало с полученными лабораторными показателями. Удалось зафиксировать участок миокарда с волнообразными деформациями кардиомиоцитов, которые могли быть морфологической причиной развития нарушений ритма и внезапной смерти [20].
Сердечные аритмии в 7-17% случаев встречаются у пациентов с COVID-19 и определяются значительно чаще у тех, кто нуждается в интенсивной терапии (44,4 против 6,9%, р
<0,001) [5, 6]. В патогенезе аритмий лежат ишемия и повреждение миокарда, вызванные вирусной инфекцией, гипоксией, лихорадкой, нарушением обмена веществ, нейрогормональной дизрегуляцией и воспалительным стрессом, использованием лекарств, вызывающих пролонгацию периода
QT
(хлорохин, гидроксихлорохин, азитромицин) [21]. Характерно, что риск аритмий больше у пациентов с ранее диагностированными ССЗ. По данным литературы, подъем уровня тропо-нина вместе с появлением аритмии может указывать на присоединение молниеносного миокардита [13].
Описаны также случаи внезапной сердечной смерти у пациентов с COVID-19 [22], причиной которой могут быть любые из вышеописанных сердечно-сосудистых осложнений.
Таким образом, в представленном клиническом случае фактором риска развития осложнений со стороны ССС стала гипертоническая болезнь, причиной острого повреждение миокарда были ишемические и неишемические воздействия, характерные для патогенеза COVID-19 (генерализованное воспаление, миокардит, ишемия миокарда, микротромбозы). Острое повреждение миокарда характеризовалось повышенным уровнем сердечных ферментов, эхокардиографическими нарушениями и клинически выражалось в прогрессировании органных нарушений (острой почечной и печеночной дисфункции), ОСН и внезапном прекращении гемодинамики на фоне нарушений ритма сердца. Получено морфологическое и гистологическое подтверждение нарушений структуры органов и предполагаемых причин смерти у пациентки с COVID-19.
Заключение
В условиях существующей угрозы пандемии новой коронавирусной болезни пациенты с исходной сердечно-сосудистой патологией представляют особую группу риска с высокими показателями неблагоприятных исходов. Осложнения со стороны ССС значительно ухудшают тяжесть течения COVID-19, тесно связаны с развитием полиорганных дисфункций и являются основной причиной неблагоприятных исходов. Даже незначительное, но стойкое повышение уровня высокочувствительного тропонина I и фермента NT-proBNP может служить сигналом оповещения о повреждении миокарда, связанным с прямым вирусным воздействием на кардиомиоциты либо с кардиомиопатией или инфарктом, возникшими в процессе генерализованного ответа организма и течения COVID-19-ассоциированных патологических процессов. Наибольшую опасность представляют возникающие при повреждении сердца нарушения ритма и проводимости, которые могут быть предвестниками случаев внезапной смерти.
Литература
1. World Health Organization, Coronavirus disease 2019 (COVID-19): situation report, 121. 2021. P. 19.
2. Madjid M. et al. Potential effects of coronaviruses on the cardiovascular system: a review // JAMA Cardiol. 2021 Mar 27.
3. Российское Кардиологическое общество. Руководство по диагностике и лечению болезней системы кровообращения в контексте пандемии CO-VID-19 // Российский кардиологический журнал. 2021. Т. 25. № 3. С. 1-20.
4. Zadori N. et al. The negative impact of comorbidities on the disease course of COVID-19 // Intensive Care Med. 2021. P. 1-3.
5. Gopinathannair R. et al. COVID-19 and cardiac arrhythmias: a global perspective on arrhythmia characteristics and management strategies // J. Interv. Card. Electrophysiol. 2021. P. 1-8.
6. Liu K. et al. Clinical characteristics of novel coronavirus cases in tertiary hospitals in Hubei Province // Chin. Med. J. (Engl.). 2021. Vol. 133, N 9. P. 1025-1031.
7. Guo T. et al. Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2021 (COVID-19) // JAMA Cardiol. 2021 Mar.
8. Shi S. et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China // JAMA Cardiol. 2021. Vol. 5, N 7. P. 802-810.
9. Al Jaroudi W.A., Hage F.G. Cardiovascular disease in the literature: a selection of recent original research papers // J. Nucl. Cardiol. 2021. Vol. 27, N 3. P. 712-714.
10. Tersalvi G. et al. Elevated troponin in patients with coronavirus disease 2021: possible mechanism // J. Card. Fail. 2020. Vol. 26, N 6. P. 470-475.
11. Mahajan K., Chandra K.S. Cardiovascular comorbidities and complications associated with coronavirus disease 2021 // Med. J. Armed Forces India. 2021 May.
12. Babapoor-Farrokhran S. et al. Myocardial injury and COVID-19: possible mechanisms // Life Sci. 2021. Vol. 253. Article ID 117723.
13. Driggin E. et al. Cardiovascular considerations for patients, health care workers, and health systems during the COVID-19 pandemic // J. Am. Coll. Cardiol. 2021. Vol. 75, N 18. P. 2352-2371.
14. Iba T. et al. The unique characteristics of COVID-19 coagulopathy // Crit. Care. 2021. Vol. 24, N 1. P. 360.
15. Huang C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China // Lancet. 2021. Vol. 395, N 10 223. P. 497-506.
16. Zhou F. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study // Lancet. 2021. Vol. 395, N 10 229. P. 1054-1062.
17. Lippi G., Lavie C.J., Sanchis-Gomar F. Cardiac troponin I in patients with coronavirus disease 2021 (CO-VID-19): evidence from a meta-analysis // Prog. Cardio-vasc. Dis. 2021 Mar.
18. Krittanawong C. et al. Coronavirus disease 2021 (COVID-19) and cardiovascular risk: a meta-analysis // Prog. Cardiovasc. Dis. 2020. Vol. 63, N 3. P. 390391.
19. Gao L. et al. Prognostic value of NT-proBNP in patients with severe COVID-19 // Respir. Res. 2021. Vol. 21, N 1. P. 83.
20. Смирнов В.П., Панышева И.А. Патоморфология кардиомиоцитов при внезапной кардиальной смерти // Медицина: вызовы сегодняшнего дня : материалы III Международной научной конференции. Москва : Буки-Веди, 2021. С. 43-46.
21. Kochi A.N. et al. Cardiac and arrhythmic complications in patients with COVID-19 // J. Cardiovasc. Electrophysiol. 2021. Vol. 31, N 5. P. 1003-1008.
22. Marijon E. et al. Out-of-hospital cardiac arrest during the COVID-19 pandemic in Paris, France: a population-based, observational study // Lancet Public Health. 2021. Vol. 5, N 8. P. e437-e443.