Д.А. Кужель, Г.В. Матюшин, Т.Д. Федорова Е.А., Савченко, Т.М. Задоенко
КГУЗ «Красноярская краевая больница № 2»ГОУВПО «Красноярская государственная медицинская академия»
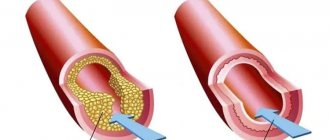
Электрокардиограмма в 12 стандартных отведениях является методом выбора в диагностике острого инфаркта миокарда (ОИМ). Быстрая и точная диагностика ОИМ жизненно необходима, поскольку дает возможность немедленно начать реперфузионную терапию, что позволяет сократить зону некроза и улучшить прогноз пациента. Одним из общепринятых критериев инфаркта миокарда является подъем сегмента ST в двух или более анатомически смежных отведениях [10]. Важность своевременной идентификации связанного с ОИМ подъема сегмента ST подчеркивает то обстоятельство, что ни депрессия сегмента ST, ни повышение биохимических маркеров кардиального некроза (МКН) в сыворотке крови не являются показаниями для тромболитической терапии [4, 9].
На ранних стадиях ОИМ диагностика может быть существенно затруднена, так как ЭКГ часто является нормальной или несет минимальные отклонения. Более того, только у половины пациентов с ОИМ на первой ЭКГ присутствуют явные диагностические изменения. В то же время примерно у 10% пациентов с доказанным ОИМ (на основании клинических данных и положительных МКН) на ЭКГ вообще не будут развиваться типичные изменения, такие, как подъем или депрессия сегмента ST [4]. Тем не менее в большинстве случаев на серии ЭКГ у лиц с ОИМ наблюдается характерная эволюция, которая обычно соответствует типичным изменениям, наблюдаемым при инфаркте миокарда. В отечественной школе кардиологии принято выделять четыре стадии течения ОИМ [1].
I.
Острейшая стадия
. В этой стадии, которая продолжается от нескольких часов до нескольких дней, изменения на ЭКГ затрагивают только сегмент ST и зубец Т. Самые ранние признаки острого инфаркта миокарда являются трудно различимыми и включают обычно увеличение амплитуды зубца Т в пораженной области, которые становятся симметричными и направленными (гиперострыми). Как правило гиперострые зубцы T наиболее очевидны в передних прекардиальных отведениях и наиболее заметны, когда доступна для сравнения старая ЭКГ. Изменения амплитуды зубцов T могут наблюдаться в течение нескольких минут от начала инфаркта и сопровождаются соответствующими изменениями сегмента ST. Оптимальным сроком доставки пациента до лечебного учреждения считается интервал до четырех часов от начала ОИМ. К сожалению, изменения на ЭКГ в острейшей стадии инфаркта миокарда нередко не получают должной оценки, что существенно увеличивает сроки доставки пациента до специализированного учреждения и продлевает начало реперфузионной терапии.
II. Острая стадия.
В острую стадию, которая длится обычно до одной недели, регистрируется подъем сегмента ST и начинают формироваться зубцы Q. В практике подъем сегмента ST является часто самым ранним признаком ОИМ и становится заметным обычно в пределах нескольких часов от начала симптоматики. На начальных этапах утрачивается характерный для нормальной ЭКГ угол между зубцом Т и сегментом ST. Зубец Т становится широким, а сегмент ST повышается, теряя свою нормальную вогнутость. В течение дальнейшего подъема сегмент ST становится выпуклым вверх. Степень подъема сегмента ST варьирует между небольшими изменениями менее 1 мм до выраженного подъема более 10 мм. Иногда комплекс QRS, сегмент ST и зубец Т сливаются, формируя так называемую монофазную кривую.
III. Подострая стадия.
Подострая стадия инфаркта миокарда продолжается до нескольких недель. В течение этой стадии сегмент ST начинает приближаться к изолинии, и формируются отрицательные зубцы Т. В случае трансмурального инфаркта миокарда процесс некроза сопровождается изменениями комплекса QRS, которые включают уменьшение амплитуды зубцов R и развитие патологических зубцов Q. Подобные изменения развиваются в результате утраты жизнеспособного миокарда под регистрирующим электродом, поэтому зубцы Q являются единственным ЭКГ критерием, верифицирующим миокардиальный некроз. Зубцы Q могут развиваться в течение 1-2 часов от начала симптоматики ОИМ, хотя для этого часто требуется от 12 до 24 часов. Наличие патологических зубцов Q, тем не менее, не обязательно указывает на завершенный инфаркт. Если подъем сегмента ST и зубцы Q выявляются на ЭКГ, а боль в груди имеет недавнее начало, пациент может все еще извлечь выгоду от тромболизиса или интервенционного вмешательства.
IV. Рубцовая стадия.
Консолидация рубцовой ткани заканчивается в среднем через 8 недель от инфаркта миокарда. В эту стадию происходит реверсия сегмента ST к изолинии и уменьшение амплитуды отрицательных зубцов Т. В случае обширного инфаркта миокарда патологические зубцы Q являются стабильным маркером кардиального некроза. При небольших инфарктах рубцовая ткань может включать жизнеспособный миокард, что может сокращать размер электрически инертной области и даже вызывать исчезновение зубцов Q в перспективе.
Одной из любопытных особенностей ЭКГ при ОИМ является так называемый феномен псевдонормализации. Теория формирования зубцов Q по Вильсону подразумевает формирование так называемого электрического окна в случае некроза, через которое регистрирующий электрод фиксирует электрические потенциалы противоположной стенки. Тем не менее, несмотря на некроз, часть волокон миокарда в зоне инфаркта остается жизнеспособной, что объясняет характерную сглаженность зубцов Q при инфаркте миокарда. Однако потенциалы этих волокон остаются скрытыми за мощным электрическим вектором противоположной стенки. При повторном же инфаркте, который вовлекает противоположную стенку, этот вектор существенно уменьшается, что, в свою очередь, дает возможность регистрировать потенциалы волокон миокарда в области старого рубца. В результате этого в области старого рубца с патологическими зубцами Q (например, в передней стенке) в случае повторного инфаркта противоположной стенки (например, задней) начинают регистрироваться зубцы R. Таким образом, регистрация зубцов R в области, где ранее наблюдались патологические зубцы Q, настоятельно предполагает образование инфаркта в противоположной стенке.
Динамика изменений сегмента ST и зубца Т при ОИМ
ЭКГ картина при инфаркте миокарда имеет свое характерное развитие. Во-первых, подъем сегмента ST, как правило, приводит к формированию зубцов Q. Во-вторых, формирование отрицательных зубцов Т происходит на фоне характерного дугообразного подъема сегмента ST.
Подъем сегмента ST, связанный с инфарктом миокарда в области передней стенки, может сохраняться продолжительное время, если развивается дискинезия или аневризма левого желудочка (ЛЖ). Отрицательные зубцы Т также могут сохраняться в течение длительного периода и иногда оставаться постоянным признаком перенесенного инфаркта миокарда. Нужно отметить, что отсутствие формирования или «восстановление» предварительно инвертированных зубцов T в острую стадию инфаркта миокарда жестко предполагает развитие постинфарктного перикардита [11].
Прогноз и нюансы реабилитации
Здоровье и жизнь пациента зависят от умения врача распознать симптоматику и патологические изменения на электрокардиограмме, поставить диагноз и назначить правильное лечение.
Важно знать, что при инфаркте правого желудочка строго запрещено самостоятельно принимать нитраты (нитроглицерин). При их назначении требуется тщательное наблюдение пациента в условиях стационара. Морфин также не подходит для обезболивания и применяется только при острой необходимости, поскольку он расширяет сосуды и приводит к понижению артериального давления и нарушению гемодинамики.
Основное задание терапии – умеренное снижение нагрузки на правый желудочек, контроль частоты и ритмичности сердечных сокращений, регуляция низкого артериального давления путем внутривенного капельного введения физраствора и других восстанавливающих недостающий объем крови препаратов (Реополиглюкин, Реосорбилакт, Стирофундин).
Процесс лечения контролируется с помощью ЭхоКГ и ЭКГ. Для пациента важно сохранять покой, поскольку лишние движения, даже такие, как переход из горизонтального положения в вертикальное при вставании с постели, нагружают сердце и могут привести к усугублению состояния.
Еще одним нюансом восстановления после перенесенного инфаркта является предпочтение медикаментозному лечению, поскольку инвазивные вмешательства и исследования могут дестабилизировать работу сердечно-сосудистой системы. При своевременном назначении тромболитиков операция может не понадобиться.
Последствием трансмурального инфаркта правого желудочка часто является аритмия, которую нужно контролировать во время восстановительного периода, регулярно проводить электрокардиографии и использовать антиаритмические препараты.
Реципрокная депрессия сегмента ST
Депрессия сегмента ST в отведениях, противоположных пораженной области, иначе называемая реципрокной, является высоко чувствительным индикатором ОИМ. Патогенез реципрокных изменений остается неизвестным. Реципрокные изменения обладают высокой чувствительностью и положительной прогностической ценностью до 90% и наблюдаются примерно в 70% нижних и до 30% инфарктов с поражение передней стенки ЛЖ, хотя, конечно, их отсутствие не исключает диагноз ОИМ [4, 5]. Как правило, депрессия сегмента ST носит горизонтальный или косонисходящий характер. Наличие реципрокных изменений особенно важно, когда имеются сомнения относительно клинического значения регистрируемого подъема сегмента ST. Особо отметим, что реципрокные изменения могут быть единственным признаком ОИМ на фоне еще неочевидного подъема сегмента ST. Подобные ситуации нередко встречаются в случаях инфарктов миокарда с поражением нижней стенки. Присутствие выраженной депрессии сегмента ST в прекардиальных отведениях на фоне нормальной ЧСС или брадикардии у пациента с ишемическим болевым приступом настоятельно требует исключения ОИМ.
Инфаркт миокарда передней стенки
Передне-перегородочный инфаркт с подъемом сегмента ST в отведениях V1-V3 является высокоточным индикатором поражения левой передней нисходящей коронарной артерии (ЛПНК). Подъем сегмента ST в этих трех отведениях и в отведении aVL в совокупности с депрессией сегмента ST более одного мм в отведении aVF указывает на окклюзию проксимального сегмента ЛПНКА. Подъем сегмента ST в отведениях V1, V2 и V3 без существенной депрессии сегмента ST в нижних отведениях предполагает окклюзию ЛПНКА после отхождения первой диагональной ветви.
В ряде случаев ЛПНКА оборачивается вокруг верхушки ЛЖ и кровоснабжает верхушечные отделы нижней стенки в дистальной части задней межжелудочковой борозды. Редко ЛПНКА простирается вдоль всей длины задней борозды, замещая заднюю нисходящую артерию. В случае подъема сегмента ST в отведении V1, V2 и V3 с подъемом ST в нижних отведениях можно предположить окклюзию ЛПНКА дистального отхождения первой диагональной ветви, в области, которая орошает нижнеапикальные отделы ЛЖ [7].
Отличия в клинике и диагностике от других форм
Инфаркт правого желудочка случается примерно у 30% пациентов с нижнезадним (диафрагмальным) инфарктом левого. Изолированный некроз правого встречается значительно реже, всего в 10% случаев.
Из-за омертвения тканей снижается сократимость ПЖ и нарастают симптомы острой сердечной недостаточности. Главная черта инфаркта правого желудочка – отсутствие застоя крови, накопления жидкости в малом круге кровообращения (легких), а также низкое давление.
Инфаркт правого желудочка на ЭКГ выглядит как подъем сегмента ST в нижних грудных отведениях (V3R и V4R) выше изолинии. Его оценивают у всех пациентов с острым ИМ и стенокардией.
Также в диагностике золотым стандартом остается измерение содержания сердечных ферментов и факторов некроза миокарда в сыворотке крови.
Основные клинические признаки инфаркта правого желудочка:
- Набухание яремных (шейных) вен на вдохе.
- Низкое артериальное давление, которое проявляется слабостью, головокружением, тошнотой.
- Увеличение печени. Она растягивается из-за повышенного объема проходящей через нее крови. Возникает боль как, например, при беге или интенсивной нагрузке.
- Накопление жидкости в брюшной полости.
- Отечность нижних конечностей, которая поднимается вверх от лодыжек к животу. При прогрессировании ИМ переходит в отек всего тела.
- Перебои в работе сердца при поражении проводящей системы. Симптоматика бывает разной: от снижения пульса и головокружения до потери сознания вследствие фибрилляции предсердий.
- Боли в области сердца с иррадиацией, характерные для инфаркта в целом, также возникают при поражении правого желудочка. Однако у пожилых, у диабетиков симптомов может не быть вовсе. В этих случаях часто обнаруживают рубцовые изменения на контрольной кардиографии.
Нижний ИМ
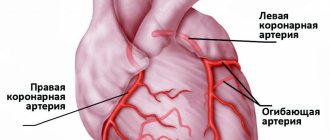
ОИМ с изолированным подъемом сегмента ST в отведении II, III, и aVF обычно связан с поражением правой коронарной артерии (ПКА) или дистальной части огибающей артерии (ОА). Достаточно неприятной особенностью ОИМ с поражением нижней стенки является то, что связанный с инфарктом подъем сегмента ST может формироваться в течение длительного периода, вплоть до двух недель, чтобы стать явным на ЭКГ [4]. Нижняя стенка может кровоснабжаться от правой коронарной артерии (в 80% случаев) или от ОА, являющейся ветвью левой коронарной артерии.
Подъем сегмента ST в отведении III больший, чем в отведении II, а депрессия сегмента ST более одного мм в отведении I и aVL предполагает поражение ПКА, кровоснабжающей нижнюю стенку. В случае кровоснабжения нижней стенки от ОА подъем сегмента ST в отведении III не превышает подъема в отведении II. При этом наблюдается либо подъем сегмента ST в aVL, либо он располагается на изолинии [6, 7].
Журнал «Медицина неотложных состояний» 1(20) 2009
Изолированный инфаркт миокарда правого желудочка (ИМПЖ) встречается исключительно редко, однако в группе больных с острым задним инфарктом сопутствующее поражение правого желудочка выявляется по данным ЭКГ с частотой 30–50 % [1, 2]. Сочетание заднего инфаркта с ИМПЖ чаще наблюдается у лиц пожилого возраста и связано с увеличением внутрибольничной летальности и количества осложнений. Приблизительно у 5 % больных с инфарктом правого желудочка развивается кардиогенный шок с высоким риском летального исхода [3]. Ведение больных с гемодинамически значимым ИМПЖ отличается от принятого при изолированном поражении левого желудочка и включает ограничение применения вазодилататоров и диуретиков, нагрузку объемом, инотропную поддержку, контроль ритма и частоты сердечных сокращений [4]. Для выбора оптимальной тактики ведения больного чрезвычайно важно раннее распознавание ИМПЖ.
В этом сообщении представлено клиническое наблюдение гемодинамически значимого инфаркта правого желудочка у больного с острым задним инфарктом миокарда. В данном случае своевременное выявление ИМПЖ существенно повлияло на лечебную тактику и внесло определенный вклад в благоприятный исход заболевания.
Больной Г., 66 лет, доставлен в клинику в порядке неотложной помощи 17 июля 2005 г. в 12:10, через 2 часа после появления интенсивной пекущей боли за грудиной. Боль такого характера появилась впервые, без видимой причины, сопровождалась общей слабостью и не уменьшилась после приема 2 таблеток нитроглицерина, что заставило больного обратиться за медицинской помощью. В анамнезе — повышение АД до 160/100 мм рт.ст. в течение 3 лет, стаж курения более 20 лет.
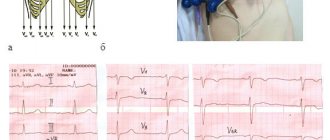
На ЭКГ, зарегистрированной бригадой скорой помощи через 50 минут от начала болевого синдрома (рис. 1), видны признаки острого заднедиафрагмального инфаркта миокарда, субэндокардиальной ишемии верхушечно-боковых отделов левого желудочка; замещающий ритм атриовентрикулярного (АВ) соединения с ЧСС 46/мин, полная блокада правой ножки пучка Гиса (ПНПГ).
На догоспитальном этапе были введены нитроглицерин, но-шпа, анальгетики (анальгин, омнопон), дексаметазон и мезатон, после чего больной доставлен в ОРИТ ГКБ № 8 г. Харькова с диагнозом: ИБС, острый инфаркт миокарда задней стенки левого желудочка. Кардиосклероз. ГБ III ст.
При поступлении в ОРИТ состояние больного тяжелое. Отмечались заторможенность, акроцианоз, похолодание конечностей. Над легкими везикулярное дыхание, единичные сухие хрипы. Частота дыхания 16/мин. Тоны сердца глухие, АД 80/60 мм рт.ст., выраженная брадикардия (ЧСС 42/мин). Печень не увеличена. Периферических отеков нет. По лабораторным данным — лейкоцитоз 11,7 х 109/л, анэозинофилия, гипергликемия (глюкоза крови 9,0 ммоль/л), небольшое повышение уровня креатинина (166 мкмоль/л).
С целью стабилизации гемодинамики внутривенно введен атропин 1 мг, затем преднизолон 60 мг, начата инфузия дофамина и ингаляция увлажненного кислорода. Назначен аспирин в дозе 325 мг, эноксапарин 80 мг подкожно 2 раза в сутки. В 12:20, через 2 часа 20 минут от момента появления ангинозной боли, проведен тромболизис стрептокиназой — 1,5 млн ЕД в виде внутривенной инфузии на протяжении 50 минут.
В результате проводимой терапии удалось полностью купировать болевой синдром. Динамика ЭКГ подтверждала эффективность проведенного тромболизиса.
На ЭКГ, снятой в 15:35, видно значительное уменьшение смещения сегмента ST во всех отведениях, начало формирования отрицательного Т в отведениях III и aVF. Патологических зубцов Q нет. Сохраняется брадикардия, замещающий ритм АВ-соединения с ЧСС 42/мин, полная блокада ПНПГ. В отведениях II, III и V6 определяются отдельные зубцы Р, не связанные с комплексами QRS, частота синусовых импульсов составляет 40/мин (рис. 2).
Однако, несмотря на наличие признаков реперфузии, продолжающуюся инфузию дофамина и повторное введение атропина, общее состояние больного оставалось тяжелым, сохранялась клиника кардиогенного шока (артериальная гипотензия с уровнем АД 70–90/40–60 мм рт.ст., признаки периферической гипоперфузии, анурия). На основании клинических данных заподозрен гемодинамически значимый инфаркт миокарда правого желудочка. Для проверки этого предположения зарегистрирована ЭКГ с дополнительными правыми грудными отведениями.
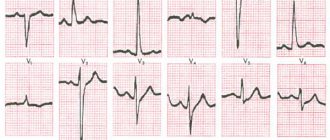
На ЭКГ, снятой в 16:00, сохраняется ритм АВ-соединения с ЧСС 43/мин. Исчезновение блокады ПНПГ меняет графику реполяризации в отведении V1, где исходная косонисходящая депрессия сегмента ST сменяется его значительной элевацией. Регистрация дополнительных отведений с правой стороны грудной клетки выявляет патологическую форму желудочкового комплекса в виде QS с V3R до V6R и значительную, до 3 мм, элевацию сегмента ST во всех правых грудных отведениях (рис. 3).Выявление ИМПЖ потребовало изменения тактики ведения больного: 1) предпринята нагрузка объемом под контролем показателей гемодинамики (АД, центрального венозного давления) в виде внутривенного введения 1100 мл жидкости — 900 мл физиологического раствора хлорида натрия и 200 мл реополиглюкина); 2) параллельно с введением жидкости продолжена инфузия дофамина; 3) начата электрокардиостимуляция (ЭКС) с целью устранения патологической брадикардии. В результате через 2 часа АД повысилось до 100/60 мм рт.ст., к утру — до 130/80 мм рт.ст.
На ЭКГ 18.07.2005 в 09:00 — ритм ЭКС, асинхронная стимуляция желудочков с частотой 60/мин. Отсутствие признаков электрической активности предсердий. Элевация ST в нижних и правых грудных отведениях (рис. 4).
В связи с увеличением собственной ЧСС больного до 50–60/мин и стабилизацией гемодинамики электрическая стимуляция сердца прекращена.
На протяжении последующих 3–4 дней тяжесть состояния больного была обусловлена острой почечной недостаточностью (ОПН), осложнившей течение заболевания. Больной жаловался на тошноту, общую слабость. В объективном статусе: небольшой общий цианоз, сухость кожных покровов, расширение яремных вен. Функция внешнего дыхания компенсирована, без признаков легочного застоя. Повышение АД до 160–170/80 мм рт.ст., ЧСС 60–80/мин, увеличение центрального венозного давления до 240–270 мм вод.ст. Печень увеличена — нижний край на 4 см ниже реберной дуги, болезненна при пальпации. Периферических отеков не было. Олигоанурия (с 18.07 по 21.07 объем выделенной за сутки мочи составлял соответственно 0–250–300–1000 мл).
В этот период по лабораторным данным наблюдалась гиперазотемия (уровень креатинина плазмы с 19.07 до 22.07 повысился от 475 до 896 мкмоль/л), повышение уровня печеночных ферментов (на 19.07 АлАТ — 2,64 ммоль/ч·л, АсАТ — 2,01 ммоль/ч·л, без снижения к 22.07); лейкоцитоз 16,0 х 109/л, анэозинофилия, нейтрофилез со сдвигом формулы влево 19.07, с положительной динамикой к 22.07 по количеству лейкоцитов и формуле, но с повышенной СОЭ. В клиническом анализе мочи: удельный вес 1010, протеинурия 0,6 г/л, лейкоциты — густо, эритроциты — на все поле зрения. Больной осмотрен урологом: выявлена аденома простаты, не требующая катетеризации мочевого пузыря. Рентгенография органов грудной клетки 20.07: эмфизема легких, диффузный пневмосклероз. Гипертрофия левого желудочка. Значительное расширение аорты с атеросклерозом и выраженным кальцинозом стенок.
Терапия была дополнена внутривенным болюсным, а затем капельным введением фуросемида до 160 мг/сутки на фоне инфузии раствора дофамина в диуретических дозах. Проводилась дезинтоксикационная терапия (реосорбилакт, раствор глюкозы с инсулином, содовые клизмы).
На ЭКГ, зарегистрированных в этот период, обращала на себя внимание необычная форма и продолжительность зубцов Р, однако низкий вольтаж предсердных зубцов при стандартной записи ЭКГ затруднял анализ их конфигурации.
ЭКГ 20.07.05 снята с дополнительным усилением (1 mV = 2 см): синусовый ритм с ЧСС 60/мин, АВ-блокада 1-й степени. Признаки инфаркта предсердий в виде элевации сегмента PQ, особенно отчетливой в отведениях II, III и aVF (рис. 5).
Следующий этап течения заболевания (с 22.07 по 26.07.2005) связан с разрешением ОПН. В эти дни на фоне полиурии (2500–3000 мл мочи за сутки) отмечалось снижение ЦВД до нормального и пониженного уровня (50–100 мм вод.ст.) с развитием тахикардии до 100–120/мин, сохранялась умеренная артериальная гипертензия. Наблюдалась положительная динамика лабораторных показателей, а именно снижение азотемии (25.07.2005 — креатинин 412 мкмоль/л, мочевина 24,4 ммоль/л), нормализация печеночных ферментов, уменьшение протеинурии и числа элементов мочевого осадка.
На ЭКГ, зарегистрированной 25.07.05 перед переводом больного из ОРИТ: синусовый ритм с ЧСС 86/мин, продолжительность интервала РQ = 0,20 с. Подострая стадия Q-позитивного заднедиафрагмального ИМ. Полная блокада ПНПГ.
Инфаркт правого желудочка и предсердия верифицирован эхокардиографией 04.08.2005: обнаружена значительная дилатация правого предсердия — 5,2 см, зоны гипо- и акинезии свободной стенки правого желудочка с тенденцией к увеличению его полости, гипокинезия базальных заднесептальных сегментов левого желудочка при нормальных размерах левых камер сердца (левое предсердие — 3,4 см, конечно-диастолический размер левого желудочка — 4,6 см, конечно-систолический размер левого желудочка — 3,4 см, толщина миокарда задней стенки и межжелудочковой перегородки — 1 см) и относительно сохранной систолической функции левого желудочка (фракция выброса — 51 %).
В инфарктном отделении больной получал бета-адреноблокаторы, статины, антитромбоцитарные препараты. Жалоб не было, состояние расценивалось как удовлетворительное, расширение двигательного режима переносил хорошо.
При плановом снятии ЭКГ 05.08.2005 зарегистрирована неправильная форма трепетания предсердий с меняющейся степенью АВ-блокады 2 : 1–4 : 1. Полная блокада ПНПГ. Подострая стадия обширного заднедиафрагмального инфаркта миокарда с вовлечением правого желудочка (рис. 6).
На 19-й день болезни, 05.08.2005, больной в удовлетворительном состоянии переведен в реабилитационное отделение.
В заключение хотелось бы отметить некоторые особенности представленного случая. Во-первых, у больного острый задний инфаркт миокарда сопровождался ИМПЖ, дисфункцией синусового узла, инфарктом предсердия и атриовентрикулярной блокадой. Этот комплекс нарушений характерен для проксимальной окклюзии доминантной правой коронарной артерии и связан с высоким риском развития кардиогенного шока и летального исхода. Своевременное распознавание инфаркта правого желудочка и коррекция проводимой терапии позволили больному пережить критический период кардиогенного шока, а отдаленный прогноз таких пациентов такой же относительно благоприятный, как при заднем инфаркте без вовлечения правого желудочка [5]. Это связано с тем, что острое ишемическое повреждение правого желудочка в действительности не всегда завершается некрозом и его функция со временем обычно полностью восстанавливается [6, 7].
Другая особенность пациента состояла в развитии острой почечной недостаточности, тяжесть которой не соответствовала продолжительности артериальной гипотензии. Можно предположить, что повреждение почек в период кардиогенного шока усугубилось сопутствующим атеросклеротическим поражением почечных артерий (с учетом пожилого возраста больного, признаков атеросклероза аорты и коронарного атеротромбоза, недавнего возникновения артериальной гипертензии и отсутствия данных о заболеваниях почек в анамнезе).
Инфаркт миокарда правого желудочка
ИМ правого желудочка обычно связан с окклюзией на уровне проксимальных отделов ПКА. Наиболее чувствительным ЭКГ признаком ИМ правого желудочка является подъем сегмента ST более одного мм в отведении V4R с положительным зубцом T в этом отведении [5]. Этот признак редко наблюдается более 12 часов от ОИМ, поэтому правые отведения должны быть зарегистрированы как можно скорее у всех пациентов с инфарктом нижней стенки. На стандартной ЭКГ в 12 отведениях признаками ОИМ с поражением правого желудочка являются подъем сегмента ST в отведении V1 в совокупности с подъемом сегмента ST в отведении II, III и aVF (STIII больше STII).
Инфаркт правого желудочка часто пропускается, так как ЭКГ в 12 стандартных отведениях не обладает высокой чувствительностью при его поражении. В то же время диагноз инфаркт правого желудочка важен, так как может быть связан с состоянием гипотензии, вызванным лечением нитратами или диуретиками. При этом, в отличие от кардиогенного шока, с которым приходится проводить дифференциальную диагностику, пациент хорошо отвечает на введение жидкости.
Примерно в 40% случаев ОИМ нижней стенки осложняется инфарктом правого желудочка [2, 6]. Менее часто правожелудочковый инфаркт связан с окклюзией огибающей артерии и, если эта ветвь доминирующая, может быть связан нижнебоковым инфарктом. Инфаркт правого желудочка может осложнять ОИМ передней стенки и редко может встречаться как изолированное явление [15].
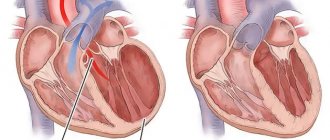
Особенности инфаркта правого желудочка: анатомия и физиология процесса
Правый желудочек (ПЖ) – это камера сердца с тонкой стенкой, которая через легочные артерии выталкивает кровь, обедненную кислородом, в легкие. Вследствие этого ПЖ работает в условиях низкого давления и гипоксии. Он снабжается кровью и в систолу, и в диастолу – и при напряжении, и при расслаблении сердечной мышцы. Эти факторы делают правый желудочек более устойчивым к развитию инфаркта миокарда (ИМ) по сравнению с левым. Тем не менее, он не защищен от негативного влияния атеросклероза.
Изолированный некроз клеток сердечной мышцы возникает, когда перекрываются тромбами или критически сужаются терминальные (конечные) веточки правой венечной артерии.
Крупноочаговый инфаркт миокарда левого желудочка может переходить на правый, при этом поражается вся задняя стенка сердца. Это частая причина возникновения гастралгической клиники ИМ с характерной болью в животе, рвотой и тошнотой.
При нарушении питания миокарда изменяются условия работы проводящей системы (она посылает электрические импульсы, которые заставляют сердце сокращаться). Это неизбежно приводит к развитию аритмии с особенно опасными формами – фибрилляцией предсердий, синусовой брадикардией и атриовентрикулярной блокадой.
Инфаркт миокарда задней стенки
Задняя нисходящая коронарная артерии (ЗНКА), кровоснабжающая задне-базальные отделы, может быть ветвью ПКА (в 85-90% случаев) либо ветвью ОА (12), что определяет правый или левый тип коронарного кровообращения. Диагноз ОИМ с поражением задне-базальных отделов часто затруднен при использовании ЭКГ в 12 стандартных отведениях, тогда как раннее выявление коронарного тромбоза очень важно с точки зрения назначения тромболитической терапии.
Изменения на ЭКГ при ОИМ задне-базальных отделов косвенным образом проявляются в передних прекардиальных отведениях. Отведения V1-V3 регистрируют потенциалы не только передней, но и противоположной (задней) стенки, и изменения кровоснабжения в этой области находят отражения в этих отведениях. Как правило, наблюдается увеличение зубцов R, которые становятся более широкими и доминирующими, а также депрессия сегмента ST и высоко амплитудные зубцы T, указывающие на заднюю стенку [3]. Использование отведений V7-V9, регистрирующих потенциалы задне-базальных отделов, покажет подъем сегмента ST у пациентов с ОИМ.
Эти дополнительные отведения обеспечивают ценную информацию и помогают в идентификации пациентов, которые могут извлечь пользу от срочной инвазивной терапии. В любом случае регистрация депрессии сегмента ST в отведениях V1-V2 должна служить поводом к исключению ОИМ задне-базальных отделов ЛЖ. В рубцовую стадию на перенесенный инфаркт миокарда задне-базальных отделов будут указывать отношения R/S > 1 в отведении V2 и RV2 > RV6, регистрируемые на фоне горизонтального положении электрической оси сердца [2].
Инфаркт боковой стенки.
Поражение в проксимальной области огибающей артерии часто связано с боковым инфарктом и изменениями в отведениях I, aVL, V5-V6. Нередко ОИМ может проявлять себя изменениями, возникающими изолированно в отведении aVL. В таких случаях принято диагностировать ОИМ с поражением высоких боковых отделов ЛЖ [3].
Лечение острой сердечной недостаточности при инфаркте миокарда правого желудочка
11 декабря 2010 0
Для определения оптимальных критериев инфузионной терапии в исследование были включены 42 пациента с ИМ нижней локализации и ИМПЖ, осложненного ОПЖН. Всем больным назначали добутамин и проводили внутривенное введение реополиглюкина (300 мл/час) под контролем давления в легочной артерии (ДЛА), давления заклинивания легочной артерии (ДЗЛА), центрального венозного давления (ЦВД). Для оценки перфузии определяли сердечный индекс (СИ) методом термоделюции.
Эхокардиографическое исследование выполняли до лечения и при оптимальных значениях ДЗЛА. Установлено, что у больных с ОПЖН при исходно низких цифрах ДЛА и ДЗЛА (16,2 ± 0,21 и7,0 ± 0,18 мм рт. ст.) повышено ЦВД (11,2 ± 0,25 мм рт. ст.). На фоне введения реополиглюкина СИ возрастал с 1,82 ± 0,03 до 2,51 ± 0,04 л/мин/м2 (p <� 0,001) при ДЗЛА 18 мм рт. ст. Выраженного подъема ЦВД при этом не происходило. Дальнейшее введение жидкости с повышением ДЗЛА до 20 мм рт. ст. не приводило к дальнейшему увеличению СИ и сопровождалось значительным повышением ЦВД (c 13,7 ± 0,23 до 16,2 ± 0,24 мм рт. ст.; p <� 0,001).
На фоне лечения увеличивался размер ЛЖ (c 52,3 ± 0,57 до 54,4 ± 0,60 мм; p <� 0,05) и возрастала его фракция выброса (с 37,5 ± 0,87 до 41,9 ± 0,99%; p <� 0,05) при отсутствии существенной динамики со стороны правых камер сердца. Полученные данные свидетельствуют о целесообразности повышения преднагрузки на правый желудочек для лечения ОПЖН. Жидкость следует вводить параллельно с лечением препаратами инотропной поддержки.
Целевым ДЗЛА в лечении ОПЖН является 18 мм рт. ст., при котором повышается объем и ФВ ЛЖ, что свидетельствует об улучшении его наполнения. Инфузия жидкости не целесообразна при приросте ЦВД больше, чем прирост ДЗЛА. В этом случае повышение конечного диастоличесого давления ЛЖ нивелируется более высокими темпами увеличения давления наполнения ПЖ, и увеличения наполнения ЛЖ не происходит. Инфаркт миокарда правого желудочка (ИМПЖ) осложняет течение нижних инфарктов миокарда (ИМ) в 30–50% случаев. При обширном поражении правого желудочка (ПЖ) снижается его сократимость и развивается острая правожелудочковая недостаточность (ОПЖН), характерной чертой которой является гиповолемия малого круга кровообращения [1–4]. Лечение ОПЖН направлено на увеличение возврата крови к левым камерам сердца. С одной стороны – это повышение сократимости ПЖ, с другой – увеличение преднагрузки на правый желудочек.
Повышение сократимости достигается применением инотропных препаратов, повышение преднагрузки – инфузией плазмоэкспандеров для повышения возврата крови к ПЖ и, как следствие, увеличения выброса крови в легочную артерию [3, 5]. Если режимы дозирования инотропных препаратов хорошо известны, то четких рекомендаций по объему вливаемой жидкости при ОПЖ в литературе нет.
Цель исследования. Выработать оптимальные значения давления заклинивания легочной артерии, к которым необходимо стремиться при проведении инфузионной терапии под контролем параметров центральной гемодинамики, а также сопоставить объем инфузии с оптимальными значениями ДЗЛА.
Читать публикацию полностью
ЭКГ предикторы реперфузии
Патогенетическая терапия ОИМ преследует цель – восстановление кровотока в пораженной артерии. Отсутствие восстановления кровотока (реперфузии) является наиболее мощным предиктором развития систолической дисфункции ЛЖ и риска смерти после ОИМ. В случае отсутствия реперфузии 30-дневная смертность может достигать 15% [14]. В свою очередь, разрешение подъема сегмента ST является индикатором улучшения краткосрочного (30 дневного) и долгосрочного (однолетнего) прогноза [5]. Оценка разрешения сегмента ST также полезна для решения вопроса о дальнейшей тактике ведения пациента.
Отсутствие разрешения сегмента ST в течение первых 90-120 минут после введения тромболитика должно служить причиной к рассмотрению вопроса о проведении ангиопластики. Специфичным маркером произошедшей реперфузии считается сокращение подъема сегмента ST более 50-70% в отведении с максимальным подъемом, что связано с наиболее благоприятным дальнейшим прогнозом. В то же время рядом авторов предлагается критерий 50% снижения подъема сегмента ST через 60 минут от реперфузионной терапии как предиктор хорошего прогноза у лиц с ОИМ [13]. Учитывая то, что максимальный эффект от последующей после тромболизиса ангиопластики достигается не позднее 6-8 часов от начала клиники ОИМ [14], сокращение срока оценки реперфузии имеет под собой веские основания.
Другие ЭКГ маркеры реперфузии включают инверсию зубца Т в течение четырех часов от начала ОИМ. Инверсия зубца Т, которая происходит в течение первых часов от реперфузионной терапии, является высоко специфичным признаком восстановления кровотока. Инверсия зубца Т, которая развивается более чем через четыре часа, связана с закономерной ЭКГ динамикой при ОИМ и не указывает на восстановление кровотока. Ускоренный идиовентрикулярный ритм 60-120 уд/мин, поздние, парные, желудочковые экстрасистолы также являются высоко специфичным маркером реперфузии. Эти ритмы считаются не опасными и, как правило, не требуют назначения антиаритмической терапии. Полиморфная желудочковая тахикардия и фибрилляция желудочков также может быть связана с реперфузией, однако является редкой и чаще следствие сохраняющейся коронарной окклюзии.