Симптомы сердечного приступа
Поскольку кардиогенный шок, как правило, развивается у людей с тяжелым сердечным приступом, важно знать признаки и симптомы сердечного приступа. К ним относятся:
- Давящие, распирающие или сжимающие боли в груди продолжительностью более 15 минут;
- Боли, отдающие в плечо, руку, спину или зубы и нижнюю челюсть;
- Увеличение частоты приступов боли в груди;
- Длительная боль в верхней части живота;
- Одышка;
- Потливость;
- Надвигающееся чувство страха;
- Обморок;
- Тошнота и рвота.
Если вы обратитесь к врачу сразу при появлении этих признаков или симптомов, вы предотвратите вероятность развития кардиогенного шока. Своевременное лечение сердечного приступа повышает шансы на выживание и уменьшает повреждение сердца. Не игнорируйте эти симптомы, если они продолжаются более пяти минут. Сразу вызывайте бригаду скорой медицинской помощи. Если нет возможности вызвать скорую помощь, попросите кого-нибудь отвезти вас в ближайшую больницу.
Симптомы
Симптомы кардиогенного шока
- частое дыхание;
- одышка;
- внезапно учащенное сердцебиение (тахикардия);
- затуманенное сознание;
- потеря сознания или обморок;
- слабый пульс;
- бледность и повышенная влажность кожных покровов;
- холодные руки и ноги;
- уменьшения количества выделяемой мочи (олигурия).
Симптомы инфаркта миокарда
Чаще всего кардиогенный шок развивается у людей перенесших острый инфаркт миокарда и поэтому важно знать признаки и симптомы инфаркта миокарда.
Они включают в себя:
- давящую или сжимающую боль в центре груди, которая продолжается несколько минут;
- боль может отдавать (иррадиировать) в плечо, руку, спину или даже в зубы и челюсть;
- продолжительные боли в верхней части живота;
- одышку;
- холодный пот;
- чувство беспокойства, подавленности;
- обморок;
- тошноту и рвоту.
Если при появлении этих признаков и симптомов Вы немедленно обратитесь к врачу, то тем самым уменьшите вероятность развития кардиогенного шока.
Причины
Кардиогенный шок развивается, когда сердце теряет возможность перекачивать достаточное крови к остальной части вашего тела. Чаще причиной развития кардиогенного шока является повреждение левого желудочка, основной насосной камеры сердца, связанного с недостатком кислорода из-за сердечного приступа.
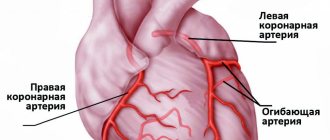
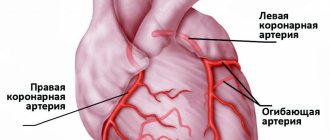
Сердечный приступ развивается при закупорке одной или нескольких артерий, по которым обогащенная кислородом кровь поступает к вашему сердцу (коронарных артерий). Иногда со временем происходит сужение коронарных артерий в связи с отложением на их стенках холестерина. Образование этих отложений, называемых бляшками, в артериях всего организма называется атеросклерозом.
Во время сердечного приступа одна из этих бляшек может разорваться, и на месте разрыва формируется тромб, который блокирует ток крови через артерии. Без поступления обогащенной кислородом крови в сердце происходит ослабление сердечной мышцы и развивается кардиогенный шок.
В редких случаях кардиогенный шок развивается при повреждении правого желудочка сердца. Из правого желудочка сердца кровь попадает в легкие, где обогащается кислородом перед поступлением в остальные части вашего тела. Повреждение правого желудочка приводит к тому, что сердце теряет способность эффективно перекачивать кровь в легкие, в связи с чем организм не получает достаточное количество кислорода.
Несмотря на то, что сердечный приступ — самая распространенная причина, кардиогенный шок возникает и при других состояниях: воспаление сердечной мышцы (миокардит) или инфекции сердечных клапанов (эндокардит). К причинам относятся передозировка наркотиков или отравление веществами, которые влияют на насосную функцию вашего сердца.
Публикации в СМИ
Кардиогенный шок — шок, развивающийся в результате внезапного снижения сердечного выброса.
Этиология • Как правило, он возникает при обширном ИМ на фоне многососудистого поражения венечных артерий. Шок развивается при вовлечении более 40% массы миокарда, и наблюдается у 5–20% больных с инфарктом • Другие причины •• Острый миокардит •• Выраженный, остро возникший аортальный или митральный стеноз •• Выраженная, остро возникшая аортальная или митральная недостаточность •• Разрыв межжелудочковой перегородки •• Аритмии.
Факторы риска • Пожилой возраст • Снижение фракции выброса левого желудочка ниже нормы (по данным ЭхоКГ) • Обширный ИМ (по данным ЭКГ инфарктные изменения в 8–9 отведениях; большая зона акинезии по данным ЭхоКГ), • Предшествующий ИМ • СД.
Патогенез. Тяжёлое нарушение сократительной функции миокарда с дополнительным присоединением усугубляющих ишемию миокарда факторов.
• Активация симпатической нервной системы вследствие падения сердечного выброса и снижения АД приводит к учащению ритма сердца и усилению сократительной деятельности миокарда, что увеличивает потребность сердца в кислороде.
• Задержка жидкости из-за снижения почечного кровотока и увеличение ОЦК, что усиливает преднагрузку на сердце, способствует отёку лёгких и гипоксемии.
• Увеличение ОПСС из-за вазоконстрикции, приводящее к увеличению постнагрузки на сердце и увеличению потребности миокарда в кислороде.
• Нарушение диастолического расслабления левого желудочка миокарда из-за нарушения его наполнения и снижения податливости, что вызывает увеличение давления в левом предсердии и способствует усилению застоя крови в лёгких.
• Метаболический ацидоз вследствие длительной гипоперфузии органов и тканей.
Клинические проявления
• Артериальная гипотензия — систолическое АД менее 90 мм рт.ст. или на 30 мм рт.ст. ниже обычного уровня в течение 30 мин и более. Сердечный индекс менее 1,8–2 л/мин/м2.
• Нарушение периферической перфузии •• почек — олигурия •• кожи — бледность, повышенная влажность •• ЦНС — загруженность, сопор.
• Отёк лёгких, как проявление левожелудочковой недостаточности.
При обследовании больного обнаруживают холодные конечности, нарушение сознания, артериальную гипотензию (среднее АД ниже 50–60 мм рт.ст.), тахикардию, глухие тоны сердца, олигурию (менее 20 мл/мин). При аускультации лёгких могут быть выявлены влажные хрипы.
Специальные методы исследования
• Установка катетера Суона–Ганца с целью контроля центральной гемодинамики, измерение сердечного выброса — по ЭхоКГ или инвазивно.
• Артериовенозная разница по кислороду более 5,5 мл%.
Диагностика. Необходимо исключить другие причины артериальной гипотензии: гиповолемию, вазовагальные реакции, электролитные нарушения (например, гипонатриемию), побочные эффекты лекарств, аритмии (например, пароксизмальные наджелудочковые и желудочковые тахикардии).
ЛЕЧЕНИЕ
Неотложное состояние, необходимо экстренное проведение лечебных мероприятий. Основная цель терапии — повышение АД.
Лекарственная терапия. Используют следующие ЛС (предпочтительно введение через специальные дозаторы). С их помощью АД следует повышать до 90 мм рт.ст. и выше • Добутамин (селективный b1-адреномиметик с положительным инотропным эффектом и минимальным положительным хронотропным эффектом, т.е. эффект увеличения ЧСС выражен незначительно) в дозе 2,5–10 мкг/кг/мин • Допамин (обладает более выраженным положительным хронотропным эффектом, т.е. может увеличить ЧСС и соответственно потребность миокарда в кислороде, несколько усугубив тем самым ишемию миокарда) в дозе 2–10 мкг/кг/мин с постепенным увеличением дозы каждые 2–5 мин до 20–50 мкг/кг/мин • Норэпинефрин в дозе 2–4 мкг/мин (до 15 мкг/мин), хотя он, наряду с усилением сократимости миокарда, в значительной степени увеличивает ОПСС, что также может усугубить ишемию миокарда.
Внутриаортальная баллонная контрпульсация (механическое нагнетание крови в аорту с помощью насоса во время диастолы, что способствует увеличению кровотока в венечных артериях). Проводят при наличии соответствующего оборудования и неэффективности лекарственного лечения кардиогенного шока.
Чрескожная транслюминальная коронарная ангиопластика — восстановление проходимости венечных артерий с её помощью в первые 4–8 ч от начала инфаркта не только сохраняет миокард, но и прерывает порочный круг патогенетических механизмов кардиогенного шока.
Наблюдение. При кардиогенном шоке рекомендуется постоянный контроль АД, ЧСС, диуреза (постоянный мочевой катетер), давления заклинивания лёгочных капилляров (баллонный катетер в лёгочной артерии), а также контроль сердечного выброса с помощью ЭхоКГ или методом радионуклидной ангиографии.
Прогноз. Смертность при кардиогенном шоке составляет 50–90%.
МКБ-10 • R57.0 Кардиогенный шок
Осложнения
При отсутствии своевременного лечения, кардиогенный шок становится смертельным состоянием. Другим серьезным осложнением кардиогенного шока является повреждение органов.
Если сердце не может перекачивать достаточное количество обогащенной кислородом крови к остальной части вашего тела, развиваются повреждения печени, почек и других органов. При повреждении печени и почек кардиогенный шок усугубляется, так как почки выделяют в кровь химические вещества, поддерживающие функцию мышц, а печень вырабатывает белки, способствующие свертыванию крови. При большой продолжительности кардиогенного шока могут развиваться стойкие повреждения органов.
Кардиогенный шок у инфарктных больных: что нового?
Кардиогенный шок – это острое нарушение перфузии тканей организма, вызванное значительным повреждением миокарда и нарушением его сократительной функции. К основным причинам кардиогенного шока относятся инфаркт миокарда (ИМ), миокардиты, кардиомиопатии, токсические поражения миокарда, опухоли сердца, тяжелые пороки сердца, травма, тампонада перикарда, тромбоэмболия легочной артерии, тяжелое нарушение сердечного ритма.
Наиболее часто практическому врачу приходится сталкиваться с кардиогенным шоком у больных с острым коронарным синдромом (ОКС), прежде всего при ИМ с подъемом сегмента ST. Кардиогенный шок – ведущая причина смерти больных ИМ.
Обычно кардиогенный шок развивается в первые часы после появления первых симптомов ИМ и значительно реже – в более поздний период. Риск развития этого грозного осложнения и его тяжесть во многом определяются обширностью инфаркта – размерами пострадавшего от ишемии и некроза миокарда. Поэтому чаще всего кардиогенный шок развивается при ИМ передней стенки левого желудочка, верхушки сердца и передней части межжелудочковой перегородки, то есть при окклюзии левой коронарной артерии, которая обеспечивает кровью большую часть массы миокарда, а также при поражении всех трех основных венечных артерий (что обусловливает вовлечение в зону инфаркта более 40% массы миокарда левого желудочка). Кардиогенный шок при ИМ правого желудочка бывает значительно реже.
Самой большой проблемой при кардиогенном шоке является следующий порочный круг: выраженное угнетение систолической функции и снижение артериального давления (АД) обусловливают неэффективность коронарной перфузии, в результате коронарный кровоток еще больше ухудшается, а ишемия и некроз миокарда прогрессивно усугубляются, что дополнительно ухудшает насосную функцию левого желудочка. Если масса некротизированного миокарда составляет 40-50% и более, то, как правило, кардиогенный шок становится ареактивным (торпидным), то есть таким, при котором введение инотропов и вазопрессоров не дает эффекта. Летальность в этой группе больных приближается к 100%.
Есть ли какие-то положительные тенденции в решении проблемы кардиогенного шока в последние годы? Какие возможности современная медицина может предложить для рутинной практики ведения больных с этим осложнением? Мы подобрали основные доказательные данные и практические рекомендации, посвященные этому актуальному вопросу, и представляем их краткий обзор в этой статье.
Кардиогенный шок вчера и сегодня
Частоту развития кардиогенного шока у больных ОКС точно определить сложно, поскольку разные авторы используют разные определения и критерии диагностики шока. По приблизительным оценкам десятилетней давности (GUSTO-I, 1996; GUSTO-III, 1999; R.J. Goldberg et al., 1999), кардиогенный шок развивался у 7-10% пациентов с ОКС. Позже различные популяционные исследования показывали уже чуть более низкую встречаемость кардиогенного шока при ОКС – от 3,2 до 8,6% (TRACE, 2003; NRMI, 2005; J. Fang et al., 2006; GRACE, 2007). В некоторых из этих исследований положительная динамика риска кардиогенного шока, отмеченная за последние несколько лет, четко ассоциировалась с внедрением современных научно-обоснованных рекомендаций по ведению больных ОКС [2, 3], прежде всего – с более широким использованием методов реваскуляризации коронарных сосудов, особенно хирургических, а также поддержки гемодинамики с помощью внутриаортальной баллонной контрпульсации.
Наиболее ценно в достижениях современной кардиологии то, что они выражаются не только в более низком риске кардиогенного шока, но и в снижении летальности при этом осложнении. Совсем недавно кардиогенный шок фактически был приговором. До внедрения в практику современных методов лечения ИМ (ургентной реваскуляризации, внутриаортальной баллонной контрпульсации) развитие кардиогенного шока обрекало на летальный исход почти всех пациентов – порядка 85-95% (E. Braunwald, 1988). Как показал ряд исследований последних лет (NRMI, 2005; J. Fang et al., 2006; AMIS Plus, 2008), летальность при кардиогенном шоке возможно снизить до 30-40%, хотя на практике реальные цифры летальности даже в развитых странах мира пока остаются на уровне 50-60%. В последнем руководстве Европейского общества кардиологов (European Society of Cardiology, ESC) по ведению больных с сердечной недостаточностью (СН) (2008) [4] указано, что внутрибольничная летальность лиц с кардиогенным шоком составляет 40-60%.
Так, результаты американского национального регистра по ИМ (National Registry of Myocardial Infarction, NRMI) показали, что внутрибольничная летальность среди больных с кардиогенным шоком, развившемся в связи с ИМ с подъемом ST, снизилась с 60,3% в 1995 г. до 47,9% в 2004 г. (p<0,001). Это увеличение выживаемости пациентов было ассоциировано с удвоением количества чрескожных коронарных вмешательств (ЧКВ), используемых для ургентной реваскуляризации коронарных артерий (27,4% в 1995 г. и 54,4% в 2004 г., p<0,001). В швейцарском регистре AMIS Plus были получены похожие данные – отмечено снижение летальности при кардиогенном шоке за последние 10 лет с 62,8 до 47,7% (p=0,01), которое связывается со значительным ростом количества ЧКВ при ОКС (с 7,6 до 65,9%, p=0,01) [5].
В 1999 г. исследование SHOCK [6] показало, что ургентная реваскуляризация (ангиопластика или аортокоронарное шунтирование) при ОКС, осложненном кардиогенным шоком, хотя и не приводит к достоверному снижению ранней (1-месячной) летальности по сравнению с группой медикаментозного лечения, но статистически значимо улучшает прогноз в отдаленные сроки. Летальность таких больных в течение первого полугодия после ИМ уменьшилась с 63,1 до 50,3% (p=0,027), в течение 1 года – с 66,4 до 53,3% (р<0,03). Наибольшие преимущества реваскуляризации были отмечены для подгруппы больных моложе 75 лет. По результатам этого исследования было настоятельно рекомендовано шире использовать хирургические методы ранней реваскуляризации коронарных артерий у больных с кардиогенным шоком на фоне ОКС [2].
Тромболизис менее эффективен для реваскуляризации в случае кардиогенного шока, поскольку низкое перфузионное давление препятствует адекватной доставке фибринолитика в коронарные артерии. Однако и тромболитическая терапия, по данным исследования GUSTO-I, дает снижение частоты встречаемости кардиогенного шока до 7,2%, а летальности при этом осложнении – до 55%. Другие исследования также подтвердили достоверное улучшение выживаемости больных с кардиогенным шоком на фоне применения тромболизиса по сравнению с консервативной терапией (без реваскуляризации). Поэтому тромболизис в условиях недоступности ЧКВ и ургентного аортокоронарного шунтирования является оптимальным методом лечения, особенно учитывая то, что тромболизис можно провести в гораздо более короткие сроки, в том числе и на догоспитальном этапе, что для больных с кардиогенным шоком может иметь жизнеспасающее значение. Для реалий отечественной медицины в настоящее время это более приемлемая стратегия лечения, хотя и не оптимальная, разумеется, по сравнению с ЧКВ и аортокоронарным шунтированием.
Наряду с этим было подтверждено, что у пациентов с ИМ, перенесших кардиогенный шок и выживших в ранние сроки, отдаленные клинические исходы существенно не отличаются от таковых у больных без кардиогенного шока в анамнезе (SHOCK, 2006; M. Singh et al., 2007). Поэтому мероприятия, обеспечивающие улучшение ранней (внутрибольничной) выживаемости больных с кардиогенным шоком, фактически уравнивают дальнейшие риски пациентов независимо от наличия шока в анамнезе.
Регистр AMIS Plus: 10 лет, отмеченные прогрессом в лечении и профилактике кардиогенного шока
Для иллюстрации приведенных выше данных хотелось бы подробнее рассказать о результатах, которые были получены в рамках швейцарского регистра по ИМ (Acute Myocardial Infarction in Switzerland, AMIS Plus) [5].
В регистр было включено более 23,6 тыс. больных ОКС (с и без подъема сегмента ST) из 70 клиник Швейцарии. Анализировались данные с 1 января 1997 по 31 декабря 2006 года. Авторы оценили изменение частоты развития кардиогенного шока и летальности при этом осложнении в течение исследуемого периода времени и определили зависимость этих изменений от характера лечения пациентов.
Оказалось, что в течение последних 10 лет частота развития кардиогенного шока у больных ОКС уменьшилась с 12,9 до 5,5% (p=0,001). Произошло это за счет уменьшения риска развития кардиогенного шока во время лечения в стационаре (с 10,6 до 2,7%, p<0,001), в то время как частота регистрации уже развившегося кардиогенного шока в момент поступления в стационар существенно не изменилась – около 2-2,3%
Хотя кардиогенный шок в 2 раза чаще встречался у больных ОКС с подъемом ST, чем без подъема ST, снижение риска его развития за истекшее десятилетие было примерно одинаковым в обеих когортах больных.
Значительно уменьшилась также внутрибольничная летальность больных с кардиогенным шоком – с 62,8 до 47,7% (p=0,01), причем это касалось как больных, поступивших с кардиогенным шоком (с 73,8 до 46,6%, p=0,009), так и тех, у кого кардиогенный шок развился уже после госпитализации (с 60,9 до 48,9%, p=0,094), хотя, как видно, у последней подгруппы больных различия не достигли статистической значимости.
Анализ данных AMIS Plus [5] указывает на то, что положительные тенденции в динамике риска кардиогенного шока и связанной с ним летальности у больных ОКС коррелируют с совершенствованием стационарной помощи таким пациентам, в частности с широким внедрением хирургических методов реваскуляризации. Следует отметить, что в изучаемых клиниках за время исследования значительно увеличилось количество проведенных ЧКВ (с 7,6 до 65,9%, p=0,01) и использование внутриаортальной баллонной контрпульсации, в то время как количество тромболизисов снизилось, а количество операций аортокоронарного шунтирования практически не изменилось.
Анализ показал, что на снижении как внутрибольничной летальности больных ОКС в целом, так и внутрибольничной летальности в подгруппе пациентов с кардиогенным шоком достоверно отразилось именно более широкое использование ЧКВ.
Кроме того, существенно улучшилось терапевтическое лечение пациентов с кардиогенным шоком: в течение изучаемого периода времени в этой когорте больных возросло использование ацетилсалициловой кислоты (с 80,4 до 89,2%), клопидогреля (с 11,7 до 65,5%), ингибиторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов (с 11,8% в 1999 г. до 35,6% в 2006 г.), липидоснижающих препаратов (с 14,3% в 1999 г. до 77,8% в 2006 г.), β-блокаторов (с 32,7 до 40%).
В рамках регистра AMIS Plus [5] были изучены также факторы риска развития кардиогенного шока. Оказалось, что независимыми предикторами этого осложнения были пожилой возраст, подъем сегмента ST, тахикардия, низкое систолическое АД. Напротив, использование липидоснижающих препаратов и проведение ЧКВ достоверно ассоциировались с более низким риском кардиогенного шока.
- Практические рекомендации по ведению больных с кардиогенным шоком
Диагностика
Быстрая диагностика кардиогенного шока позволяет своевременно принять необходимые меры и предотвратить гибель пациента. Поэтому очень важно знать те признаки, которые с наибольшей вероятностью указывают на развитие этого осложнения.
Для оценки выраженности острой СН у больных ИМ используются классификации T. Killip (1967) и J.S. Forrester (1977) [4]. Обе классификации подразумевают деление пациентов на 4 группы (стадии, классы) в зависимости от выраженности нарушений системной гемодинамики и застоя в легких. Отличия между ними состоят в том, что в классификации J.S. Forrester учитываются не только клинические признаки, как в классификации T. Killip, но и некоторые показатели центральной гемодинамики (давление «заклинивания» в легочной артерии, сердечный индекс). По классификации T. Killip, состоянию кардиогенного шока соответствует снижение АД <90 мм рт. ст. и наличие признаков периферической вазоконстрикции (олигурия, цианоз, потливость); по классификации J.S. Forrester – признаки сниженной перфузии тканей организма в сочетании с высоким давлением «заклинивания» в легочной артерии.
В обновленном в конце 2008 г. руководстве ESC по ведению больных ИМ с подъемом ST [1], кардиогенный шок определяется снижением систолического АД <90 мм рт. ст., повышением давления наполнения желудочков сердца (и, соответственно, давления «заклинивания» легочной артерии) >20 мм рт. ст., уменьшением сердечного индекса <1,8 л/мин/м2. Диагноз кардиогенного шока устанавливается в том случае, если исключены другие возможные причины гипотензии (гиповолемия, вазовагальный рефлекс, электролитный дисбаланс, побочный эффект фармпрепаратов, тампонада миокарда). Но при этом следует помнить, что кардиогенный шок составляет около 80% всех шоковых состояний, осложняющих течение ИМ, то есть именно эта патология является наиболее вероятной, если речь идет о значительной гипотензии и гипоперфузии у инфарктных больных.
Согласно новому руководству ESC по ведению больных с СН (2008) [4] кардиогенный шок не имеет четких критериев диагностики, хотя в типичных случаях о нем можно говорить, когда АД уменьшается ниже 90 мм рт. ст. (или среднее АД падает более чем на 30 мм рт. ст.), а диурез отсутствует или резко снижен (<0,5 мл/кг/ч). За короткое время появляются клинические признаки гипоперфузии органов и застоя в легких. Часто развиваются нарушения сердечного ритма.
Таким образом, для первичной диагностики кардиогенного шока (у постели больного) достаточно обнаружить угрожающие клинические признаки, измерить АД и исключить другие вероятные причины гипотензии. Снижение объема выводимой мочи, которое можно оценить после катетеризации мочевого пузыря, достаточно быстро подтверждает, в правильном ли направлении движется диагностический поиск. Кроме того, как для диагностики шока, так и для контроля эффективности лечения крайне важно инвазивное исследование параметров центральной гемодинамики. С этой целью рекомендована катетеризация правых отделов сердца и легочной артерии (баллонный «плавающий» катетер Swan-Ganz). При этом измеряется давление в правом предсердии и желудочке, легочной артерии, давление «заклинивания» легочной артерии, сердечный выброс. Эти данные позволяют наиболее точно оценить состояние функции сердца и дают возможность заметить ее минимальное ухудшение или улучшение, а также исключить многие другие возможные причины гипотензии.
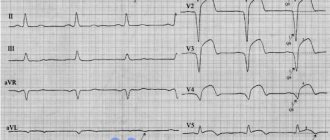
Важно напомнить, что ИМ правого желудочка иногда манифестирует как кардиогенный шок, но подходы к лечению обоих состояний существенно отличаются. Поэтому при подозрении на кардиогенный шок необходима также дифференциальная диагностика с инфарктом стенки правого желудочка. С этой целью могут помочь выявление набухания шейных вен (особенно на вдохе), подтверждение отсутствия влажных хрипов в легких, ЭКГ-признаки ИМ правого желудочка (например, подъем сегмента ST в отведении V4, характерные изменения при записи грудных отведений ЭКГ справа), ультрасонографические доказательства правостороннего инфаркта.
Профилактика и лечение
На сегодняшний день единственным подходом, четко подтвердившим возможность снижения риска кардиогенного шока у больных с ОКС, является как можно более раннее проведение реваскуляризации коронарных сосудов. Как показывают клинические исследования и крупные регистры, рекомендуемая в настоящее время стратегия ургентной реперфузии – наилучший способ уменьшить количество пациентов с кардиогенным шоком.
Лечение кардиогенного шока представляет собой задачу сложную, но не безнадежную. Как было показано выше, некоторые лечебные мероприятия при ОКС уже доказали свои значительные преимущества не только в профилактике кардиогенного шока, но и в улучшении выживаемости в случае развития этого осложнения. Это касается прежде всего стратегии ранней реваскуляризации, использование которой ассоциировано с лучшими исходами для больных с манифестировавшим кардиогенным шоком. Снижение внутригоспитальной летальности у больных с кардиогенным шоком на фоне использования ЧКВ было убедительно показано в регистре AMIS Plus (2008) [5], положительное влияние на более отдаленные исходы (6 месяцев) – в исследовании SHOCK (1999) [6]. На основании полученных в исследовании SHOCK данных разработчики американских рекомендаций по лечению ИМ (American College of Cardiology, ACC; American Heart Association, AHA) отнесли экстренную реваскуляризацию при кардиогенном шоке к рекомендациям I класса [2].
В руководстве ESC по ведению больных с ИМ с подъемом сегмента ST (2008) [1] ранняя реваскуляризация с помощью ЧКВ является рекомендуемой стратегией в случае развития кардиогенного шока (класс рекомендаций I, уровень доказательности В). Если ЧКВ не может быть проведено или доступно только после некоторой задержки, пациентам с кардиогенным шоком может быть показано немедленное проведение аортокоронарного шунтирования, особенно если есть и другие показания к операции на сердце (митральная регургитация, разрыв стенки левого желудочка и т.д.). Если же и ЧКВ, и аортокоронарное шунтирование невозможны в ближайшее время, необходима ранняя реваскуляризация с помощью тромболизиса.
Раннее и эффективное устранение ишемии миокарда и предотвращение формирования некроза или значительное ограничение его размеров обеспечивают быстрое восстановление систолической функции сердца и тем самым разрывают замкнутый круг «угнетение сердечного выброса → снижение перфузии → дополнительное ухудшение состояния миокарда».
Кроме того, для прерывания этого же порочного круга очень важны мероприятия по гемодинамической поддержке для удержания АД на уровне, который обеспечивает адекватную перфузию жизненно важных органов, прежде всего самого миокарда (90-100 мм рт. ст.). Для этого используются инотропные препараты, вазопрессоры, внутриаортальная баллонная контрпульсация.
Руководства ESC по ведению больных ИМ с подъемом ST (2008) [1] и по ведению больных СН (2008) [4] для лечения кардиогенного шока, кроме ранней реваскуляризации, рекомендуют использование оксигенотерапии, искусственной вентиляции легких в зависимости от уровня газов крови, оценку состояния гемодинамики с помощью катетеризации сердца, введение инотропов (допамина, добутамина), применение внутриаортальной баллонной контрпульсации и механических устройств для обеспечения функции левого желудочка.
На сегодняшний день нет доказательств того, что инотропные препараты улучшают выживаемость больных с кардиогенным шоком. Но инотропы могут либо улучшить клиническое состояние пациента и вывести его из шока, либо, по крайней мере, стабилизировать его гемодинамику до того момента, как будет возможным использовать более эффективные методы (внутриаортальная баллонная контрпульсация, хирургическое вмешательство, специальные механические устройства). Наиболее популярным инотропом является допамин, особенно учитывая то, что в низких дозах он эффективно улучшает почечную перфузию, не влияя существенно на системную гемодинамику. У добутамина есть свои преимущества – хотя он является несколько более слабым инотропом, чем допамин, он снижает давление в легочной артерии. Но следует помнить, что назначение инотропов, особенно допамина в высоких дозах, увеличивает риск развития тахикардии и аритмии, поэтому они должны с осторожностью использоваться у больных с ускоренной частотой сердечных сокращений и требуют мониторинга ЭКГ. Часто применяется комбинация низких доз допамина с более высокими дозами добутамина – это позволяет с минимальным риском побочных эффектов улучшить системную гемодинамику и особенно перфузию почек.
Основными критериями эффективности инотропной терапии являются повышение систолического АД выше 90 мм рт. ст., увеличение сердечного индекса >2 л/мин/м2, снижение давления «заклинивания» легочной артерии до 20 мм рт. ст., увеличение диуреза. При этом важно, чтобы частота сердечных сокращений не превышала 100 уд/мин. Если развивается тахикардия или нарушения сердечного ритма, дозы инотропов необходимо по возможности снизить.
Если инотропы в стандартных дозах оказались недостаточно эффективными, возможны следующие варианты изменения тактики: повышение дозы используемого инотропа, комбинация двух инотропов, добавление вазопрессоров, использование внутриаортальной баллонной контрпульсации, специальных механических устройств для поддержки функции левого желудочка.
Вазопрессоры (норадреналин) не рекомендованы в качестве терапии первой линии острой СН, но в случае кардиогенного шока могут быть показаны, если инотропы в комбинации с адекватной инфузионной терапией оказались недостаточно эффективными в стабилизации гемодинамики. При этом использовать вазопрессоры необходимо с большой осторожностью, поскольку кардиогенный шок, как правило, сопровождается периферической вазоконстрикцией и высоким периферическим сосудистым сопротивлением. К тому же норадреналин способствует лактатному ацидозу, повышает давление в легочной артерии (может спровоцировать отек легких) и отличается тем, что к нему быстро развивается толерантность. Поэтому, даже если пришлось прибегнуть к норадреналину, важно отменить его по возможности как можно раньше. Применение адреналина для лечения кардиогенного шока не рекомендовано; показания к его введению должны быть ограничены только случаями остановки сердца.
Методом временной поддержки гемодинамики, достоверно улучшающим выживаемость больных с кардиогенным шоком, является внутриаортальная баллонная контрпульсация. Однако следует отметить, что доказательные данные, свидетельствующие о клинических преимуществах метода, несколько противоречивы. Тем не менее исследование SHOCK показало снижение летальности больных с кардиогенным шоком при использовании контрпульсации, в том числе и в комбинации с тромболитической терапией [6].
В случае если пациент не отвечает на стандартную терапию, показано применение механических устройств для обеспечения функции левого желудочка, хотя доказательная база по этой стратегии нуждается в дополнительных исследованиях. Как и внутриаортальная баллонная контрпульсация, использование этих устройств, частично или полностью замещающих насосную функцию левого желудочка, позволяет выиграть время, поддержать гемодинамику пациента до ее стабилизации либо до того, как появится возможность решить проблему более радикальным путем.
Если кардиогенный шок обусловлен разрывом стенки миокарда, отрывом сосочковой мышцы, митральной регургитацией или другими серьезными изменениями структуры сердца, то единственным шансом на спасение пациента является безотлагательное оперативное вмешательство.
Из медикаментозных средств также может быть полезным назначение ингибиторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов. Эти препараты продемонстрировали определенные преимущества в профилактике феномена «no-reflow» после реваскуляризации и потому в наибольшей степени показаны больным, для которых адекватная реперфузия имеет жизнеспасающее значение, то есть в первую очередь для пациентов с кардиогенным шоком. Например, в исследовании CAPTURE (1996) применение абсиксимаба в комбинации с ургентной коронарной ангиопластикой комбинированная конечная точка (смерть + повторный ИМ + повторная ургентная ангиопластика) составила 8,5% по сравнению с 20,4% в группе сравнения (р=0,05). Исследования EPIC, EPILOG, EPISTENT подтвердили схожие преимущества комбинирования абсиксимаба с ЧКВ.
Изучаются также некоторые инновационные подходы, например использование никорандила, ингибиторов NO-синтазы, ингибиторов Na+/K+-насоса, глюкозо-инсулин-калиевой смеси и др. Но целесообразность их использования у больных с кардиогенным шоком еще должна быть подтверждена в достаточно крупных рандомизированных исследованиях.
До выведения больного из состояния кардиогенного шока не следует применять без особых показаний β-адреноблокаторы, антагонисты кальция, ингибиторы ангиотензинпревращающего фермента, сердечные гликозиды, глюкокортикостероиды. Инфузионная терапия при кардиогенном шоке должна быть очень осторожной, проводиться в небольших объемах (в отличие от стратегии лечения ИМ правого желудочка, когда пациенту показана быстрая объемвосполняющая терапия).
Литература
1. Van de Werf F., Bax J., Betriu A. et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology. Eur Heart J 2008; 29: 2909-2945.
2. Antman E.M., Anbe D.T., Armstrong P.W. et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction – executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). Circulation 2004; 110: 588-636.
3. Van de Werf F., Ardissino D., Betriu A. Et al. Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J 2003; 24: 28-66.
4. Task Force for Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of European Society of Cardiology, Dickstein K., Cohen-Solal A., Filippatos G. et al.; ESC Committee for Practice Guidelines, Vahanian A., Camm J., De Caterina R. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J 2008; 29 (19): 2388-442; Eur J Heart Fail 2008; 10 (10): 933-89.
5. Jeger R.V., Radovanovic D., Hunziker P.R. et al.; for the AMIS Plus Registry Investigators. Ten-Year Trends in the Incidence and Treatment of Cardiogenic Shock. Ann Intern Med 2008; 149 (9): 618-26.
6. Hochman J.S., Sleeper L.A., Webb J.G. et al.; for The SHOCK Investigators. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341 (9): 625-34.
7. Davies C.H. Revascularization for cardiogenic shock. Q J Med 2001; 94: 57-67.
8. Topalian S., Ginsberg F., Parrillo J.E. Cardiogenic shock. Crit Care Med 2008; 36 (1 Suppl): S66-74.
9. Sanborn T.A., Feldman T. Management strategies for cardiogenic shock. Curr Opin Cardiol 2004; 19 (6): 608-12.
10. Lee K.W., Norell M.S. Cardiogenic shock complicating myocardial infarction and outcome following percutaneous coronary intervention. Acute Card Care 2008; 10 (3): 131-43.
11. Mann H.J., Nolan P.E. Jr. Update on the management of cardiogenic shock. Curr Opin Crit Care 2006; 12 (5): 431-6.
12. Duvernoy C.S., Bates E.R. Management of cardiogenic shock attributable to acute myocardial infarction in the reperfusion era. J Intensive Care Med 2005; 20 (4): 188-98.
По материалам Madicine Review
Методы диагностики
Диагностика кардиогенного шока требует незамедлительных действий. Врачи проверят наличие признаков и симптомов шока, а затем назначат дополнительные обследования, чтобы выяснить причину вашего состояния. К методам диагностики кардиогенного шока относятся:
- Измерение артериального давления. У людей с шоком часто снижается артериальное давление. Если человека в состоянии шока доставляют в больницу бригада скорой помощи, артериальное давление измеряют до поступления в больницу.
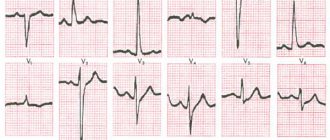
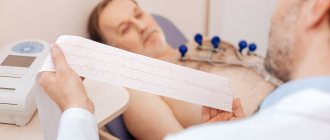
- Электрокардиограмма (ЭКГ). Это первое обследование для диагностики сердечного приступа. Часто его проводят одновременно с опросом о симптомах. Обследование заключается в записи электрической активности сердца с помощью электродов, прикрепленных к коже. Импульсы выглядят как «волны», отображаемые на мониторе или напечатанные на бумаге. Поскольку при повреждении сердечная мышца не может нормально проводить электрические импульсы, ЭКГ позволяет определить, произошел ли у вас сердечный приступ, или он в настоящий момент развивается.
- Рентгенография органов грудной клетки. Рентгеновское изображение органов грудной клетки поможет врачу оценить размеры и форму вашего сердца и его сосудов.
- Анализы крови. Анализы крови позволят определить наличие у вас повреждений почек и печени, обнаружить признаки инфекции сердца, а также выявить наличие у вас сердечного приступа. Другой тип анализа крови (анализ содержания газов в артериальной крови) также назначают для определения содержания кислорода в крови.
- Эхокардиограмма. При этом обследовании звуковые волны используют для получения изображения сердца. Во время эхокардиографии звуковые волны направляют на сердце от палочкообразного устройства (датчика), расположенного на груди. Звуковые волны отражаются от сердца и возвращаются обратно через грудную клетку, они обрабатываются в электронном виде для получения видеоизображения сердца. Эхокардиография поможет выявить область повреждения вашего сердца и нарушение насосной функции сердца.
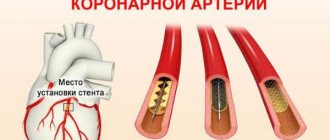
- Катетеризация коронарных артерий (ангиография, коронарография). Это обследование выявит сужение и закупорку коронарных артерий. Жидкое контрастное вещество вводят в артерии сердца через длинную тонкую трубку (катетер), который проводят через артерию в ноге или руке до артерий сердца. Когда контрастное вещество заполняет артерии, они становятся видимыми на рентгеновских снимках, что позволяет выявить зоны их закупорки.
Кроме того, во время катетеризации ваш врач может удалить закупорку артерии путем коронарной ангиопластики и стентирования. Для ангиопластики используют крошечные баллоны, которые вводят через кровеносный сосуд в коронарную артерию для расширения заблокированной зоны. После ангиопластики устанавливают сетчатую трубку (стент) внутри артерии для сохранения достаточного ее просвета и предотвращения повторного сужения в будущем.
Как лечить кардиогенный шок при инфаркте миокарда?
Н
есмотря на значительные успехи в лечении больных острым инфарктом миокарда (ИМ), что позволило значительно снизить летальность при этом заболевании,
кардиогенный шок
(КШ)
по-прежнему остается основной причиной смерти больных ИМ даже в так называемую «тромболитическую эру»
. Встречается КШ в среднем у 5-10% больных ИМ. По данным Golbert (1991 г.) летальность у больных с ИМ, осложненным КШ, в период с 1975 г. по 1988 г. составила 78%. А результаты Национального регистра инфаркта миокарда (NRMI 2), в котором прослежены исходы ИМ у 23 тыс. больных с КШ в 1400 госпиталях США за период с 1994 г. по 2001 г., показали, что летальность в последние годы снизилась незначительно и составляла около 70%.
КШ — это осложнение ИМ, связанное со снижением сердечного выброса при адекватном внутрисосудистом объеме, приводящее к гипоксии органов и тканей. Как правило, шок развивается у больных в результате серьезного нарушения функции левого желудочка в связи с существенным повреждением миокарда. На аутопсии у больных, погибших от КШ, размеры ИМ составляют от 40 до 70% массы миокарда левого желудочка. В этой статье будут обсуждены принципы лечения больных с истинным КШ. Другие клинические варианты КШ, например, связанные с развитием ари шок, или гиповолемии, а также с внутренними или наружными разрывами миокарда и острой митральной регургитацией, требуют других патогенетических подходов к лечению.
Критерии диагностики кардиогенного шока:
- систолическое АД составляет менее 90 мм рт.ст. на протяжении 1 часа и более;
- признаки гипоперфузии — цианоз, холодные влажные кожные покровы, выраженная олигурия (мочеотделение менее 20 мл в час), застойная сердечная недостаточность, ментальные расстройства;
- частота сердечных сокращений выше 60 уд. в мин;
- гемодинамические признаки — давление заклинивания в легочной артерии более 18 мм рт.ст., сердечный индекс менее 2,2 л/мин/кв.м.
Стандартное лечение кардиогенного шока
Больные ИМ, осложненным КШ, должны находиться в палате интенсивного наблюдения и требуют тщательного постоянного контроля за целым рядом параметров: общим клиническим состоянием; уровнем кровяного АД — предпочтительно прямым методом, используя, например, катетеризацию лучевой артерии; водным балансом — с обязательным измерением почасового диуреза; мониторированием ЭКГ. При возможности целесообразно контролировать параметры центральной гемодинамики с использованием катетера Swan-Ganz или хотя бы центрального венозного давления.
Общепринятая терапия КШ включает в себя оксигенотерапию
. Кислород больные должны получать через интраназальные катетеры или маску, а в случаях грубых нарушений функции дыхания переводиться на искусственную вентиляцию легких. Как правило, больные нуждаются в терапии инотропными препаратами:
в/в инфузия допамина
со скоростью, необходимой для контроля уровня АД (в среднем она составляет 10-20 мкг/кг в мин); при недостаточной эффективности и высоком периферическом сопротивлении подключается
инфузия добутамина
5-20 мкг/кг в мин. В последующем возможна замена одного из этих препаратов на норадреналин в возрастающих дозах от 0,5 до 30 мкг/кг в мин или адреналин. В ряде случаев эти препараты позволяют поддерживать кровяное давление на уровне не менее 100 мм рт. ст. При высоком давлении заполнения левого желудочка, как правило, назначаются
диуретики
. Применения нитропрепаратов и других периферических дилататоров следует избегать из-за их гипотензивного действия. КШ является абсолютным противопоказанием для применения b-блокаторов.
Надо сказать, что стандартная медикаментозная терапия, как правило, оказывается либо неэффективной, либо дает кратковременный эффект, поэтому не будем подробно останавливаться на детальной характеристике общеизвестных препаратов – обсудим те способы лечения, которые по современным представлениям могут изменить прогноз у больных с КШ.
Тромболитическая терапия
Чаще всего КШ развивается при тромботической окклюзии крупной субэпикардиальной коронарной артерии, приводящей к повреждению миокарда и ишемическому некрозу. Тромболитическая терапия (ТЛТ) — один из современных способов лечения
, позволяющий восстановить перфузию в очаге ишемии и спасти жизнеспособный (гибернированный) миокард. Первые обнадеживающие результаты были получены в крупномасштабном исследовании
GUSTO-I
(1997 г.), где обследовалось более 40 тыс. больных ИМ. Оказалось, что у пациентов, получавших терапию тканевым активатором плазминогена (t-PA), шок в стационаре развился в 5,5% случаев, а в группе леченных стрептокиназой — в 6,9% случаев (p<0,01). 30-ти дневная летальность составила 57% и 58%, соответственно. То есть терапия t-PA способна предупреждать развитие КШ у больных ИМ в стационаре. Следующие генерации тканевого активатора плазминогена — альтеплаза и ретиплаза, обладающие рядом преимуществ перед t-PA (быстрота разрушения тромба и удобство введения), были изучены в исследовании
GUSTO-III
(1999 г.). При введении альтеплазы и ретиплазы шок в условиях стационара развивался в 5,3 и 5,5% случаев, а 30-дневная летальность составила 65% и 63%, соответственно. Таким образом, тромболитики следующего поколения оказались не столь эффективными, как ожидалось, в плане предупреждения развития КШ у больных в стационаре. Среди пациентов, включенных в GUSTO-I и в GUSTO-III, при поступлении в стационар признаки КШ зарегистрированы в 0,8% и в 11%, соответственно. Летальность у них составила: в группе t-PA — 59%, стрептокиназы — 54%, ретиплазы — 58%. Тромболитическая терапия несколько снижает летальность больных с ИМ, осложненным КШ, а t-PA, по-видимому, уменьшает частоту его развития. Исследования в этом направлении продолжаются. Возможно, что не только использование новых тромболитиков (молекул-мутантов и др.), но и другие способы оптимизации лечения больных могут улучшить исход заболевания. Известно, что сочетанная терапия тромболитиками и низкомолекулярными гепаринами, например, эноксапарином (АSSENT-3, AMI-SK, HART II), существенно улучшала прогноз ИМ, уменьшая смертность, количество повторных ИМ и необходимость проведения реваскуляризации. Не исключено, что лечение КШ с использованием тромболитических препаратов и низкомолекулярных гепаринов окажется более эффективным, хотя на сегодня это пока только гипотетическое соображение.
Применение тромболитиков при кардиогенном шоке может улучшить выживаемость у больных ИМ, а в некоторых случаях предупредить развитие этого осложнения. Однако использование только этого метода лечения вряд ли сможет существенно изменить существующую ситуацию. Связано это с тем, что низкое системное давление приводит к низкому перфузионному давлению в коронарных артериях и значительному снижению эффективности тромболизиса.
Внутриаортальная баллонная контрапульсация
Внутриаортальная баллонная контрапульсация (ВАБК) применяется для того, чтобы стабилизировать состояние больных с КШ и повысить эффективность тромболитической терапии. Связано это с тем, что ВАБК улучшает перфузию миокарда в диастолу, уменьшает систолическую постнагрузку и при этом не изменяет потребность миокарда в кислороде. В исследовании GUSTO-I было показано уменьшение смертности к 30-му дню ИМ и через 1 год заболевания в тех случаях, когда использовали ВАБК у больных с КШ. Анализируя результаты NRМI-2
, сравнили эффективность лечения больных с КШ с использованием ВАБК и без нее. Следует отметить, что эти данные получены в результате лечения КШ у более чем 20 тыс. больных не в специально спланированном исследовании, а в практике здравоохранения США за последние 6 лет. Данные о проценте больных, получавших тромболитики, первичную ангиопластику (ТБКА) или не получавших «реперфузионной» терапии, представлены на рисунке 1. Оказалось, что в группе получавших тромболитическую терапию применение ВАБК позволило достоверно снизить госпитальную смертность с 70% до 49%. Использование ВАБК при проведении первичной ангиопластики существенно не изменило летальность в стационаре. Смертность при КШ (рис. 2) у больных после первичной коронарной ангиопластики составила 42% и была ниже, чем при использовании любых других методов лечения.
Рис. 1. Процент больных, леченных с использованием ТЛТ либо первичной ТБКА, либо без этих вмешательств, в зависимости от проведения ВАБК NRMI 2
Рис. 2. Госпитальная смертность в группе больных с ТЛТ или первичной ТБКА в зависимости от проведения ВАБК NRMI 2
Таким образом, применение ВАБК при КШ позволяет не только стабилизировать состояние больных в период ее проведения, но и существенно улучшить эффективность тромболитической терапии и выживаемость больных.
Немедикаментозное восстановление коронарного кровотока
Возможности немедикаментозного восстановления кровотока при ИМ, осложненным КШ, в первую очередь с помощью первичной коронарной ангиопластики и экстренного проведения АКШ активно изучаются в последнее десятилетие. Известно, что при удачной первичной ангиопластике удается добиться более полного восстановления коронарного кровотока, меньшего диаметра резидуального стеноза и улучшения выживаемости больных с КШ (S-MASH, GUSTO-1).
Наиболее убедительные результаты были получены в многоцентровом исследовании SHOCK
, проведенном в 30 центрах США и Канады с 1993 г. по 1998 г. 302 больных с истинным КШ были рандомизированы в группы — интенсивного медикаметозного лечения (n=150) и ранней реваскуляризации (n=152). Больные 1 и 2 групп получали терапию иноторопными препаратами в 99%, ВАБК в 86% и тромболитиками в 63% и 49% случаях, соответственно. Во второй группе у 97% была проведена экстренная коронарная ангиография и в 87% случаев достигнута ранняя реваскуляризация (внутрикоронарное вмешательство — 64%, хирургическое — 36%).
Смертность у больных в группе медикаментозного лечения к 30 дню ИМ составила 56%, а в группе ранней реваскуляризации 46,7%. К 6 месяцу болезни смертность во 2 группе оказалась существенно ниже (63% и 50%, соответственно), и различия эти сохранялись до 12 месяца болезни (рис. 3). Анализ эффективности агрессивного ведения больных ИМ с КШ показал, что результаты выживаемости больных оказались лучше в случаях реваскуляризации
почти во всех подгруппах (рис. 4). Исключение составили больные пожилого возраста (старше 75 лет) и женщины, у которых медикаментозное лечение оказалось предпочтительным. Исследование SHOCK было блестяще организовано. Например, среднее время от принятия решения до начала ангиопластики составило 0,9 часа, а до проведения операции на коронарных сосудах — 2,7 часа.
Рис. 3. Смертность больных в группах медикаментозного лечения (группа 1) и ранней реваскуляризации (группа 2) Исследование SHOCK
Рис. 4. Сравнительный риск 30-дневной смерти в подгруппах Исследование SHOCK
Таким образом, ранняя реваскуляризация у больных ИМ, осложненным КШ, приводит, по-видимому, к восстановлению функции гибернированного миокарда и позволяет добиться значительного снижения летальности у этих пациентов. Следует отметить, что 55% больных с КШ в исследовании SHOCK переводились в специализированные центры, где им и были проведены соответствующие инвазивные вмешательства. Такая тактика ведения больных с КШ может оказаться наиболее перспективной и в нашей стране.
Метаболическая терапия
При окклюзии коронарной артерии происходят серьезные нарушения структуры и функций миокарда. Нарушения метаболизма миокарда, развивающиеся при продолжительной ишемии и системной гипотонии даже при восстановлении коронарного кровотока, могут препятствовать нормализации восстановления функции сердца. В связи с этим предпринимались многочисленные попытки восстановить метаболизм миокарда у больных с КШ с помощью целого ряда препаратов — глюкозо-инсулин-калиевая смесь, аденозин, блокаторы Na+H+-каналов, L-карнитин. Предполагалось, что они помогут увеличить жизнеспособность ишемизированного миокарда. Несмотря на теоретические предпосылки сегодня с позиций доказательной медицины не получено данных, которые позволили бы рекомендовать использование в клинической практике метаболических препаратов для лечения больных с КШ.
Новые подходы к лечению
Обнадеживающие результаты получены при использовании антиагрегантных препаратов последнего поколения — блокаторов IIb-IIIa гликопротеиновых рецепторов тромбоцитов. Применение эптифибатида
в подгруппе больных с КШ в исследовании
PURSUIT
(2001 г.) у больных с острыми коронарными синдромами без элевации ST привело к существенному, по сравнению с контрольной группой, увеличению выживаемости. Возможно, эффект этот частично связан со способностью данной группы препаратов улучшать кровообращение в микроциркуляторном русле за счет устранения тромбоцитарных агрегатов.
Лечение после выписки из стационара
Значительные нарушения сократительной способности миокарда у большинства выживших больных ИМ, осложненным КШ, сохраняются. Поэтому они нуждаются в тщательном медикаментозном контроле и активной терапии после выписки из стационара. Минимально возможная терапия, целью которой является уменьшение процессов ремоделирования миокарда и проявлений сердечной недостаточности (ингибиторы АПФ, диуретики, b-блокаторы и сердечные гликозиды), снижение риска тромбозов и тромбоэмболий (ацетилсалициловая кислота, производные кумарина — варфарин и др.), должна использоваться лечащим врачом в отношении каждого пациента с учетом складывающейся клинической ситуации.
Лекарственные препараты
Лекарства для лечения кардиогенного шока назначают с целью улучшения кровотока через сердце и улучшения насосной функции вашего сердца.
- Аспирин. Аспирин снижает свертываемость крови и поддерживает кровоток через суженную артерию. Принимайте аспирин самостоятельно в ожидании приезда бригады скорой помощи, только если врач рекомендовал вам это сделать при появлении симптомов сердечного приступа.
- Тромболитики. Эти препараты помогают растворить тромб, который блокирует приток крови к сердцу. Чем раньше вам назначат тромболитический препарат при сердечном приступе, тем выше вероятность выживания и уменьшения повреждения сердца. Тромболитики назначают, если не удается провести экстренную катетеризацию артерий сердца и выполнить стентирование.
- Антиагреганты. Врачи в отделении неотложной помощи могут назначит вам другие препараты, которые похожи на аспирин, для предотвращения образования новых тромбов. К ним относятся такие препараты, как клопидогрель (Плавикс) и другие блокаторы рецепторов гликопротеинов IIb/IIIa тромбоцитов.
- Другие разжижающие кровь препараты. Вам, вероятно, назначат и другие препараты. К ним относится гепарин, для снижения вероятности образования опасных тромбов. Гепарин вводят внутривенно или подкожно в течение первых нескольких дней после сердечного приступа.
- Инотропные препараты. Допамин или адреналин назначают для улучшения и поддержания функции сердца.
Лечение
Лечение кардиогенного шока направленно на восстановление поврежденной мышце сердца и других органов, возникших из-за нехватки кислорода.
Экстренная медицинская помощь
Экстренная медицинская помощь необходима для лечения большинства пациентов в кардиогенном шоке. Лечение кардиогенного шока проводится в условиях реанимации. Вам дадут дышать кислородом при помощи маски, это проводится для того чтобы уменьшить повреждение органов и тканей. Медикаменты и жидкости будут вводится через внутривенные катетеры.
Медикаментозное лечение
Медикаментозное лечение кардиогенного шока направленно на улучшения кровотока по артериям кровоснабжающих сердце и увеличение сократительной способности сердца.
Аспирин.
Аспирин снижает свертываемость крови и помогает крови протекать через суженный участок в артерии. Пациенты, которые до развития кардиогенного шока уже принимали аспирин, его назначение в острой стадии заболевания сопровождается более благоприятным течение.
Тромболитики.
Эти препараты названы так, потому что помогают растворить кровяной сгусток, который блокирует приток крови к сердцу. Чем раньше эти препараты будут введены от начала острого инфаркта миокарда, тем выше выживаемость и меньше повреждения сердца. Тромболитики обычно назначают, если экстренная катетеризация сердца не возможна.
«Супераспирин».
Врачи скорой помощи могут дать Вам другой препарат, который по механизму действия похож на аспирин и так же предотвращает образование новых сгустков в кровеносных сосудах. К этим препаратам относятся: клопидогрель (плависк) и другие препараты блокирующие рецепторы гликопротеина IIb/IIIa тромбоцитов.
Другие «разжижающие» кровь препараты. Вам может быть введен другой препарат, такой как гепарин, который не позволит образовываться тромбам в кровеносных сосудах. Гепарин вводят внутривенно или с помощью инъекций в подкожно жировую клетчатку и его назначают в течение нескольких дней после инфаркта миокарда.
Инотропные препараты.
Вам могу назначить такие препараты как допмин, адреналин, для улучшения и поддержки сократительной способности сердца, пока другие методы лечения не будут выполнены.
Лечебные манипуляции
Лечебные манипуляции при кардиогенном шоке направлены на восстановление кровотока по коронарным артериям, снабжающим зону инфаркта. Они включают в себя:
Ангиопластика
Ангиопластика и стентирование.
Эти методы лечения направлены на воздействие на участки стенозирования коронарных артерий, восстановление кровотока по этим артериям и в результате улучшение течения кардиогенного шок. Экстренная ангиопластика устраняет сужение или окклюзию коронарной артерии, в результате кровь течь более свободно к сердцу. Доктор устанавливает специальный катетер, через прокол (пункцию) бедренной артерии, в суженный сегмент коронарной артерии. Этот катетер оснащен специальным баллоном. При проведении катетера в нужный отдел коронарной артерии он расширяется и открывает закрытую артерию. В это же время может быть имплантирован стент в артерию, для снижения частоты повторного сужения коронарной артерии. Доктор Вам может имплантировать стент с лекарственным покрытием, эти стенты длительное время сохраняют артерию открытой.
Внутриаортальная баллонная контрпульсация.
В зависимости от вашего состояние врач может выбрать этот метод лечения. В аорту вводится специальный баллон, который надувается и сдувается, имитируя сократительную функцию сердца, помогая крови течь к другим органам и тканям.
Хирургическое лечение
Если лекарственные препараты и медицинские манипуляции не эффективны при лечении кардиогенного шока, то Вам может быть рекомендована операция.
Аортокоронарное шунтирование.
Суть этого оперативного лечения – в создании обходных сосудов, шунтов, в качестве которых используются вены и артерии между аортой и суженной частью коронарной артерии. В результате восстанавливается приток крови к сердцу. Врач Вам может рекомендовать аортокоронарное шунтирование через некоторое время после перенесенного острого инфаркта миокарда, для того чтоб ваше сердце восстановилось.
Хирургическое лечение
, направленное на восстановление повреждений сердца. Иногда повреждения сердца, такие как разрыв одной из камер сердца или повреждение клапанов сердца, может вызывать кардиогенный шок. Если кардиогенный шок вызван травмой сердца, то врач Вам рекомендует оперативное лечение, направленное на устранение дефекта сердца.
Искусственное сердце.
Это механическое устройство, которое имплантируется в брюшную полость и помогает в работе ослабленного сердца. Искусственное сердце помогает продлить и улучшить жизнь больных с терминальной стадией сердечной недостаточности, больных ожидающих пересадки сердца.
Пересадка сердца.
Если сердце сильно повреждено и никакие методы лечения не помогают, последним средством в лечении кардиогенного шока, является пересадка сердца.
Хирургические вмешательства
Хирургические вмешательства для лечения кардиогенного шока направлены на восстановление кровотока через сердце. Их выполняют в специализированных кардиоцентрах. К таким вмешательствам относятся:
- Ангиопластика и стентирование. Обычно при восстановлении кровотока через закупоренную артерию отмечают улучшение признаков и симптомов кардиогенного шока. При неотложной ангиопластике восстанавливают просвет закупоренных артерий, что обеспечивает свободный ток крови к вашему сердцу. Врачи вставляют длинную тонкую трубку (катетер), который продвигают через артерию в ноге или руке к закупоренной артерии вашего сердца. Этот катетер снабжен специальным баллоном. При установке стента в зоне сужения баллон раздувают, чтобы восстановить просвет артерии. Кроме того, в артерию могут вставить металлический сетчатый стент для сохранения ее просвета в течение длительного времени и восстановления притока крови к сердцу. Врачи устанавливают стенты, которые медленно выделяют в кровь лекарственные вещества, обеспечивающие сохранение достаточного просвета артерии.
- Баллонный насос. В зависимости от вашего состояния, врачи могут установить баллонный насос в главную артерию вашего сердца (аорту). Баллонный насос надувается и сдувается, имитируя работу вашего сердца и обеспечивая ток крови.
Шок
К каким врачам обращаться
При первых же признаках развития шока нужно немедленно вызвать бригаду скорой помощи.
Лечение шока
Больной с шоком любого типа должен быть доставлен в отделение реанимации и интенсивной терапии по предполагаемому профилю заболевания. В случае травмы, при наличии признаков внутреннего кровотечения, а также в ситуациях, когда причину шока на догоспитальном этапе установить не удалось, показана госпитализация в противошоковую операционную (или иную операционную, предназначенную для лечения пострадавших с шоком).
Основные задачи терапии:
- прервать болевую импульсацию;
- нормализовать объем циркулирующей крови и реологические свойства крови;
- провести коррекцию метаболизма;
- устранить причины органных нарушений.
1. Обеспечение проходимости дыхательных путей. Кислородотерапия проводится через маску. В случае тяжелого шока или недостаточной вентиляции легких необходима интубация дыхательных путей с механической вентиляцией.
2. Установка внутрисосудистых катетеров для быстрой инфузии растворов и компонентов крови, при необходимости введение большого количества лекарственных средств (в т.ч, катехоламинов).
3. Этиологическое лечение.
4. Поддержка работы системы кровообращения и транспорта кислорода:
- отмена гипотензивных лекарственных средств, если таковые применялись;
- при большинстве видов шока основное значение имеет восполнение внутрисосудистого объема путем инфузии плазмозаменителей и плазмоэкспандеров, растворов кристаллоидов и коллоидов;
- инфузия вазопрессорных препаратов для устранения гипотензии;
- пациентам с низким сердечным выбросом при отсутствии нарушений сердечного ритма назначают постоянную в/в инфузию добутамина, при сопутствующей гипотензии одновременно применяют сосудосуживающий препараты;
- оксигенотерапия при снижении насыщения гемоглобина кислородом.
5. Основным методом коррекции лактатного ацидоза является этиотропное и поддерживающее функции системы кровообращения лечение.
6. Мониторирование жизненно важных показателей.
7. Предупреждение кровотечения из желудочно-кишечного тракта и тромбоэмболических осложнений.
8. Коррекция гипергликемии.
После реанимационных действий назначают специфическое лечение основного заболевания. Дополнительная поддерживающая терапия зависит от типа шока.
Осложнения
Опасность шока заключается в уменьшении кровоснабжения жизненно важных тканей. Прогноз зависит от причины шока и своевременности оказания терапии.
При отсутствии лечения шок заканчивается смертельным исходом.
Развитие гиповолемического шока сопровождается летальностью до 70% в зависимости от его тяжести. При своевременной помощи, оказанной в полном объеме, летальность не превышает 25%. Дистрибутивный шок характеризуется различным уровнем летальности, зависящем от этиологического фактора, и может достигать 70% в случае септического шока. Обструктивный шок, связанный с достаточно эффективно устранимыми причинами, сопровождается летальностью, не превышающей 15%. При тромбоэмболии легочной артерии летальность превышает 30%. Даже при лечении летальность от кардиогенного шока после инфаркта миокарда остается очень высокой и достигает 70%.
Профилактика шока
Шок – это состояние, процесс, который нельзя рассматривать отдельно от известных нозологических форм. Поэтому шок не может быть причиной смерти, причиной смерти становится фактор, вызвавший состояние шока. Профилактика шока заключается в своевременном лечении заболеваний, которые могут привести к его развитию.
Источники:
- Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание, том 27.
- Клинические рекомендации (протокол) по оказанию скорой медицинской помощи при шоке у детей. Российское общество скорой медицинской помощи Союз педиатров России, 2015, с. 21.
- Мороз В.В., Бобринская И.Г., Васильев В.Ю. с соавт. Шок. Учебно-методическое пособие для студентов, ординаторов, аспирантов и врачей. — Москва, 2011.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Операции
При неэффективности медикаментозного лечения и перечисленных хирургических вмешательств, врач порекомендует вам операцию:
- Аорто-коронарное шунтирование. Шунтирование заключается в пришивании вен или артерий в обход зоны закупорки или сужения коронарной артерии. Это восстанавливает приток крови к сердцу. Врач предложит эту операцию после восстановления сердца от сердечного приступа.
- Операции по восстановлению повреждения сердца. Иногда причина развития кардиогенного шока — разрыв одной из камер сердца или повреждение клапана сердца. Для исправления этих проблем врач предложит оперативное лечение.
| Интенсивная терапия | Главная страница сайта | ||
Амниотическая эмболия
Амниотическая эмболия – акушерская катастрофа, которая, к счастью, встречается довольно редко. Частота этого осложнения по данным различных авторов составляет от 1 случая на 8000 до 1 на 80000 родов. Амниотическая эмболия – самая непредсказуемая и, во многих случаях, почти непредотвратимая причина материнской смертности, уровень которой достигает 86%. В структуре материнской смертности эта патология занимает от 1,2 до 16,5%. Столь широкий диапазон данных о частоте и летальности обусловлен тем, что, к сожалению (или скорее – к счастью), ни один врач не может “похвастаться” большим личным опытом ведения больных с амниотической эмболией. Несмотря на то, что интерес к этому осложнению родов в последние годы растёт, представления врачей о клинической физиологии амниотической эмболии и об интенсивной терапии этого осложнения ещё очень далеки от желаемого совершенства. Пусть амниотическая эмболия редка, но для роженицы и её врачей, встретившихся с этим грозным осложнением, не имеет значения, что среди прочих осложнений родов процент амниотической эмболии невелик: погибшая больная составляет для себя и своей семьи 100%. Поэтому нам представляется очень важным, чтобы акушеры и анестезиологи хорошо знали современное состояние проблемы амниотической эмболии.
Краткая история проблемы
Повидимому, первым целенаправленным описанием эмболии околоплодными водами была диссертация нашего соотечественника Н.Е.Касьянова “К вопросу об эмболии лёгких плацентарными гигантами”, защищённая в Санкт-Петербурге в 1896 г. Правда, в 1893г. Ch.G.Schmorl обнаружил в лёгких женщины, погибшей в родах, клетки трофобласта и предположил, что эти клетки попадают из маточного кровотока в сердце, а затем в лёгкие, где осаждаются, создавая препятствие кровотоку в малом круге кровообращения. Однако эта довольно аргументированная гипотеза так и осталась незамеченной. О следующем случае амниотической эмболии сообщил лишь через 33 года бразильский врач L.R.Meyer. Спустя ещё год в экспериментальной работе R.M.Warden были показаны значительные изменения сердечно-сосудистой системы у животных, возникающие после внутривенного введения амниотической жидкости. Клинического значения эти прекрасно выполненные эксперименты не имели: они были получены как “побочный” продукт при изучении патогенеза эклампсии, а не амниотической эмболии. Затем последовал очередной перерыв в полтора десятка лет, пока в 1941 г. двое исследователей из Чикагской университетской клиники P.E.Steiner и C.C.Lushbaugh не положили начало систематическому изучению амниотической эмболии. Авторы описали этот синдром у 8 женщин, внезапно умерших в родах, и лишь после этого амниотическая эмболия была признана медициной как нозологическая форма болезни. Может показаться, что в своих последующих работах эти авторы грешат гипердиагностикой амниотической эмболии, приводя очень высокую частоту эмболии – 1 на 3000 родов. Однако, если вспомнить случаи неожиданных коагулопатических кровотечений и отёков лёгких в родах, часть которых, как мы теперь знаем, обусловлена недиагностированной амниотической эмболией, то и статистика, приведённая авторами, не покажется такой уж неправдоподобной. Тем не менее, “открытие” амниотической эмболии в 1941 г. наводнило медицинскую литературу этим диагнозом, поскольку к нему относили большинство случаев, когда беременная или роженица умирали внезапно. В 1958 г. эпителиальные клетки плода обнаруживали в маточных венах без клинической симптоматики амниотической эмболии. Поэтому обнаружение слущенных эпителиальных клеток в пробах крови, полученных из центральной вены или лёгочной артерии, при отсутствии клинических проявлений не должно считаться патогномоничным признаком амниотической эмболии, т.к. небольшое их количество может обнаруживаться и при отсутствии этого осложнения. По современным представлениям о клинической физиологии амниотической эмболии, причина катастрофы кроется не в чешуйках плода, а значит и их обнаружение в кровотоке не всегда может подтвердить или отвергнуть этот диагноз. Ещё очень долго публикующиеся материалы об амниотической эмболии напоминали крайне пессимистическую научную, а подчас и ненаучную, фантастику. И лишь в последние два десятилетия экспериментальные и клинические работы по амниотической эмболии стали посвящаться механизмам развития этого грозного осложнения и его интенсивной терапии и профилактике. Бесспорным является одно – при амниотической эмболии околоплодные воды попадают в материнский кровоток. Когда и как это происходит, то есть каковы физиологические механизмы амниотической эмболии?
Клиническая физиология
Условия для эмболии
С помощью радиоизотопных методов показано, что при схватках во время нормальных родов амниотическая жидкость в материнский кровоток не попадает. Для того, чтобы это произошло, необходимы два условия:
1) существенное превышение амниотического давления над венозным;
2) зияние венозных сосудов матки.
Что касается первого условия – превышения амниотического давления над венозным
, – то при отсутствии родовой деятельности амниотическое давление составляет около 8
мм вод.ст
., а венозное – около 10
мм вод.ст
. На высоте схваток эти показатели равны соответственно 20 и 40
мм вод.ст.,
то есть первого условия для возникновения амниотической эмболии нет ни в покое, ни на высоте схваток. Однако существует целый ряд ситуаций, вызывающих дисбаланс этих параметров, что и позволяет выявить группу риска амниотической эмболии. Снижение венозного давления может иногда быть следствием гиповолемии, связанной с увлечением акушеров диуретиками при лечении отеков беременных без должного клинико-физиологического осмысливания причин их возникновения. Гиповолемия с низким венозным давлением может часто сопровождать течение беременности у больных сахарным диабетом, пороками сердца и тяжёлыми формами преэклампсии. Амниотическая эмболия чаще случается у многорожавших. Ранее считалось, что изменения сердечно-сосудистой системы, возникающие при беременности, подвергаются полному обратному развитию после родов. Однако в 1991 г. E.L.Capeless и I.F.Clapp показали, что снижение периферического сосудистого сопротивления, наступающее после беременности, является достаточно стойким. Поэтому при последующих беременностях и родах у многорожавших женщин может наблюдаться растущее несоответствие между увеличивающейся ёмкостью периферического сосудистого русла и объёмом циркулирующей крови. В итоге может иногда возникнуть относительная гиповолемия и снижение венозного давления, и тогда вероятность возникновения амниотической эмболии растет. К аналогичному результату приводит и необоснованное назначение беременным сосудорасширяющих и антигипертензивных средств без соответствующей своевременной коррекции волемических нарушений. Амниотическое давление может превысить венозное при стремительных родах, тазовом предлежанииплода, крупном плоде или многоплодной беременности, при ригидной шейке матки и несвоевременно вскрытом плодном пузыре. Среди предрасполагающих к амниотической змболии факторов выделяют стимуляцию родовой деятельности окситоцином. Следует иметь в виду, что при операции кесарева сечения инфузия окситоцина со скоростью 10 капель/мин уже сама по себе может приводить к развитию артериальной гипотонии. Появилось даже сообщение о связи касторового масла, применяемого для стимуляции родовой деятельности, с возникновением амниотической эмболии. Приём внутрь касторового масла увеличивает концентрацию простагландина Е и, таким образом, может вызывать схватки и потенцировать действие различных сокращающих средств. Следовательно, и касторовое масло, и другие факторы, вызывающие чрезмерно сильные схватки и рост внутриматочного давления, могут способствовать возникновению амниотической эмболии.
Зияние сосудов матки – второе непременное условие амниотической эмболии – наблюдается при преждевременной отслойке плаценты и при её предлежании, при любом оперативном вмешательстве на матке – кесаревом сечении, ручном обследовании матки и отделении последа, а так же при послеродовой атонии матки. Некоторые авторы связывают амниотическую эмболию с травматическими непроникающими разрывами матки, попаданием амниотической жидкости в кровоток через повреждённые эндоцервикальные вены или децидуальные синусы. Вывод из этих клинико-физиологических рассуждений конкретен: различная патология беременности и родов, а также сопутствующая гиповолемия любой этиологии, в том числе и ятрогенная, чреваты опасностью амниотической эмболии.
Надо обратить внимание на удивительный парадокс: околоплодные воды – это хитроумное изобретение природы, предназначенное для сохранения жизни и роста плода, то есть для нормального развития беременности. Но поражает несовершенство этого важного устройства, таящего в себе смертельную угрозу для матери и плода, если амниотическая жидкость проникает в материнский кровоток, что, как мы видим, может встречаться не столь уж редко.
Пато- и танатогенез
Рассмотрим состав околоплодных вод. Амниотическая жидкость – это коллоидный раствор, в котором имеются мукопротеиды с высоким содержанием углеводов, большое количество липидов и белок в концентрации 210-390 мг%
. В довольно высоких концентрациях представлены различные биологически активные вещества – адреналин (76
мкмоль/л
), норадреналин (59
мкмоль/л
), тироксин и эстрадиол [Barnes]. Амниотическая жидкость богата гистамином, уровень которого повышается при преэклампсии. Содержатся также профибринолизин и тромбокиназоподобные вещества. Добавление одной капли околоплодных вод в пробирку с кровью ускоряет время свертывания вдвое. Амниотическая жидкость содержит многие продукты белкового и жирового метаболизма, биологически активные вещества, в том числе цитокины и эйкосаноиды, а также различные механические примеси – чешуйки эпидермиса, лануго, сыровидную смазку. При внутриутробной инфекции плода амниотическая жидкость может быть инфицирована, и попадание в материнский кровоток инфицированных околоплодных вод вызывает ещё более тяжёлую коагулопатию. Клиническая физиология амниотической эмболии укладывается в две главные формы –
кардио-пульмональный шок
и
коагулопатию
, но нередко эти формы различаются лишь по времени и степени их проявления.
Кардио-пульмональный шок
Долгое время существовало мнение, что лёгочная артериальная гипертензия вызвана обструкцией лёгочных капилляров механическими примесями (чешуйки, пушковые волосы, муцин и т.д.), но поскольку в 1 мл
околоплодных вод содержится в среднем около 500-600 клеток, то для того, чтобы они создали преграду лёгочному кровотоку необходимо было бы, чтобы лёгкие профильтровали около семи литров амниотической жидкости, для чего требуются околоплодные воды, по крайней мере, шести беременных женщин. Более правдоподобной кажется гипотеза о повышении лёгочного сосудистого сопротивления с возникновением кардио-пульмонального шока под воздействием, главным образом, простагландина F2a. В экспериментах на животных неоднократно отмечалось развитие лёгочной гипертензии и кардио-пульмонального шока при внутривенном введении амниотической жидкости, взятой во время родов, но не в середине беременности. Основное различие в составе околоплодных вод в эти моменты – высокая концентрация простагландинов к моменту родов. Правда, описаны эмболии околоплодными водами в ранние сроки беременности при высоком надрыве плодного пузыря, но в ранних сроках амниотическая эмболия больше проявляется коагулопатией и в меньшей степени – кардио-пульмональным шоком. В 1985 г. специальные исследования S.L.Clark e.a. выявили при амниотической эмболии острую левожелудочковую недостаточность и резкое уменьшение сердечного выброса при относительно нормальных показателях сопротивления лёгочных сосудов. Возникла гипотеза о прямом токсическом влиянии амниотической жидкости на сократительную способность миокарда, и для её проверки проводили перфузию изолированного сердца животных отфильтрованными околоплодными водами. Это вызывало выраженный спазм коронарных сосудов и снижение сердечного выброса, то есть сердечную недостаточность вследствие прямой ишемии миокарда. Уместно вспомнить, что простагландины F2a и Е, а также тромбоксан вызывают спазм коронарных сосудов, в то время как простациклин их расширяет и улучшает насосную функцию сердца. К редким симптомам амниотической эмболии относится появление неприятного вкуса во рту роженицы сразу же после отделения последа, кратковременно развивающийся озноб и гипертермия, хотя скорее всего на эти “пустяки” просто редко обращают внимание специалисты, упоённые могуществом своей науки. Анестезиологам, работающим в родильных залах, знакома тяжело купируемая послеродовая дрожь, которую вряд ли можно рассматривать только с позиций гипоэргоза, тем более когда вслед за ней наступает гипотоническое или коагулопатическое кровотечение. Во время операции кесарева сечения эти симптомы маскируются наркозом. Цепь описанных изменений заканчивается либо фибрилляцией желудочков, либо кардио-пульмональным шоком с развитием компонентов некардиогенного отёка лёгких. Мрачное описание танатогенеза кардио-пульмонального шока при амниотической эмболии имеет один маленький просвет: мы упоминали, что непреодолимых механических препятствий лёгочному и коронарному кровотоку нет, а смерть наступает от реакций, запущенных биологически активными веществами. Справиться с ними и есть главная задача анестезиолога-реаниматолога в ранних стадиях амниотической эмболии.
Коагулопатия
Если фазу кардио-пульмонального шока удается благополучно преодолеть, то у большей части больных развивается та или иная степень коагулопатии, обусловленной тромбопластическими свойствами амниотической жидкости. Синдром рассеянного внутрисосудистого свертывания может быть и единственным клиническим проявлением эмболии околоплодными водами, а также предшествовать кардио-пульмональному шоку или его завершать. Необходимо лишь помнить, что амниотическая эмболия является клинико-физиологической основой многих “необъяснимых” коагулопатических кровотечений в акушерской практике. Кровотечение может начаться и без РВС-синдрома, вследствие того, что амниотическая жидкость вызывает и атонию матки. Клинические проявления и функциональная диагностика коагулопатической формы амниотической эмболии не имеют специфики.
Интенсивная терапия
К сожалению, интенсивная терапия кардио-пульмонального шока при амниотической эмболии чаще всего превращается в реанимацию. Именно поэтому необходимо, чтобы возле роженицы, подозрительной на возможность возникновения этого осложнения, всегда находился человек, владеющий приёмами реанимации. И не имеет значения, как он называется в штатном расписании больницы – акушер, анестезиолог, реаниматолог или терапевт: сочтёмся славою после благополучной выписки больной. Но только командовать должен кто-то один, потому что, как справедливо заметил Х.В Гуфеланд, “… один врач лучше двух, двое лучше трёх и т.д., с возрастанием количества врачей всегда уменьшается вероятность выздоровления”
. При остановке сердца на фоне синдрома сдавления нижней полой вены венозный возврат практически прекращается, как бы усердно при этом не проводился массаж сердца. Поэтому проведение лёгочно-сердечной реанимации в положении беременной на спине сокращает её эффективность из-за резкого уменьшения кровоснабжения миокарда, вследствие снижения венозного возврата. При реанимации в поздних сроках берменности стол должен быть слегка наклонён влево, чтобы сократить аорто-кавальную компрессию. Полагаем, что амниотическая эмболия – слишком грозное осложнение повседневной практики акушеров и анестезиологов, работающих рядом с ними, чтобы вспоминать о ней лишь при её возникновении. Основанное на знании клинической физиологии выявление факторов риска амниотической эмболии, своевременная ликвидация физиологических механизмов, способствующих развитию этого осложнения, готовность и оснащённость для проведения реанимации и интенсивной терапии как при кардио-пульмональном шоке, так и при коагулопатии – вот простая основа успеха в сохранении жизни больных с амниотической эмболией. После успешной реанимации или при амниотической эмболии, которая не требовала её, интенсивная терапия может быть условно разделена на три группы действий:
I. Подавление реакций, вызвавших кардио-пульмональный шок.
II. Лечение коагулопатии.
III. Профилактика и лечение полиорганной недостаточности.
Мы придерживаемся следующего порядка действий при интенсивной терапии амниотической эмболии. Катетеризация подключичной вены с обязательным контролем ЦВД после устранения аорто-кавальной компрессии наклоном операционного стола влево;
последующие действия:
* при ЦВД < 8 см вод.ст.
корекция гиповолемии проводится инфузией коллоидов и кристаллоидов в соотношении 2:1 со скоростью от 5 до 20
мл/мин
в зависимости от изменений ЦВД; при кровотечении в состав инфузионной терапии включается трансфузия свежезамороженной плазмы или свежей крови;
* при ЦВД > 8 см вод.ст
. применить средства с положительным инотропным действием (добутрекс и др.), начиная с минимальных доз; одновременно можно вводить глюкокортикоиды, которые стабилизируют адренорецепторы;
* при нарастающих признаках дыхательной недостаточности и РаО2 < 70 мм рт.ст
. произвести интубацию трахеи и перевести больную на ИВЛ;
* как можно раньше, проконтролировав свёртывающие свойства крови, ввести гепарин из расчета 50-100 ЕД/кг
одномоментно внутривенно в сочетании с большими дозами ингибиторов протеолитических ферментов: это может в значительной мере уменьшить вероятность коагулопатии.
Дальнейшая интенсивная терапия коагулопатической формы амниотической эмболии не имеет специфики и требует лишь скрупулёзного клинико-физиологического подхода. А что в медицине критических состояний не требует этого? Надо взять кровь из центральной вены, мокроту или смывы трахеи, чтобы потом исследовать их на наличие элементов околоплодных вод, хотя, как уже отмечалось, их наличие не является абсолютным доводом для подтверждения диагноза. Амниотическая эмболия может маскироваться под другую крайне тяжёлую патологию, и чем бы ни закончилась наша интенсивная терапия, кто знает, сколько усилий ещё придется приложить на утренней конференции, доказывая, что это была именно амниотическая эмболия, а не что-то совсем другое.
| Интенсивная терапия | Главная страница сайта | ||
Профилактика
Лучший способ профилактики кардиогенного шока — предотвращение развития сердечных приступов. Изменения образа жизни, которые используют при лечении заболеваний сердца, помогут предотвратить развитие сердечного приступа. К таким изменениям образа жизни относятся:
- Контроль за высоким артериальным давлением (лечение гипертонической болезни). Одним из самых важных шагов для снижения риска развития сердечного приступа и кардиогенного шока — это контроль за уровнем артериального давления. Регулярные физические упражнения, управление стрессом, поддержание нормального веса тела, ограничение употребления соли и алкоголя помогут контролировать повышение артериального давления. В дополнение к рекомендациям по изменению образа жизни, врач может назначить лекарства для лечения гипертонической болезни, например, диуретики, ингибиторы ангиотензин-превращающего фермента (АПФ) или блокаторы рецепторов ангиотензина.
- Отказ от курения. Отказ от курения снижает риск развития сердечного приступа. Через несколько лет после отказ от курения, риск развития инсульта у курильщика такой же, как у некурящего человека.
- Сохранение нормального веса тела. Избыточный вес содействует влиянию факторов риска развития сердечного приступа и кардиогенного шока: высокое артериальное давление, сердечно-сосудистые заболевания и сахарный диабет. Снижение веса всего на 4,5 кг приведет к снижению уровня артериального давления и снижению содержания холестерина.
- Снижение содержания холестерина и насыщенных жиров в вашем рационе питания. Употребление меньшего количества холестерина и жиров, особенно насыщенных жиров, снизит риск развития сердечных заболеваний.
- Регулярное выполнение физических упражнений. Физические упражнения понижают риск развития сердечного приступа. Упражнения снижают артериальное давление, повышают содержание липопротеинов высокой плотности (ЛПВП), и улучшают общее состояние ваших кровеносных сосудов и сердца. Они помогут вам похудеть, контролировать сахарный диабет и снизить уровень стресса. Регулярно выполняйте дозированные физические упражнения: ходьба, бег трусцой, плавание или езда на велосипеде в течение 30 минут каждый день.
Интенсивная терапия аритмогенного шока
Аритмогенный шок представляет собой разновидность нарушений кровообращения, при которой адекватное кровоснабжение органов и тканей нарушено вследствие дисбаланса ритма сердечных сокращений. Аритмия может быть первичной и вторичной. К первичной относят нарушения ритма и проводимости, обусловленные аномалиями развития проводящей системы. Вторичная аритмия связана с кардиомиопатией, фиброзластозом, органическими поражениями и расстройствами метаболизма миокарда, электролитными нарушениями. По локализации патологического водителя ритма выделяют наджелудочковые (предсердные и узловые) и желудочковые аритмии. Различают также тахи- и брадиаритмию. Основным патогенетическим механизмом тахиаритмического шока являются укорочение времени диастолического наполнения сердца и снижение ударного выброса на фоне сокращения диастолического периода венечного кровотока.
При брадиаритмическом шоке уменьшение минутного объема крови не может быть компенсировано повышением ударного выброса, так как объем диастолического заполнения желудочков ограничен способностью стенки миокарда к механическому растяжению.
Предварительный диагноз нарушения ритма устанавливают на основании данных пальпации пульса на бедренной или сонной артериях, аускультации сердца и наличия гииотензии. Заподозрить аритмию позволяют такие проявления, как внезапное изменение состояния ребенка, беспокойство или вялость (блокада атривентрикулярного соединения), потеря сознания (синдром Эдемса — Стокса), акроцианоз, бледность кожных покровов, «мраморный» рисунок кожи. Точный диагноз устанавливают на основании данных ЭКГ-исследования.
Аритмогенный шок может развиваться на фоне чрезмерной синусовой, предсердной и желудочковой тахикардии, фибрилляции желудочков, брадиаритмии (идиовентрикулярного ритма, атриовентрикулярной блокады II — III степени), желудочковой экстрасистол.
Лечение аритмогенного шока предусматривает экстренное восстановление сердечного ритма с частотой, обеспечивающей адекватный сердечный выброс. Обязательным условием при лечении тахи- и брадиаритмического шока является устранение аритмогенных факторов: негативного влияния блуждающего нерва, гипоксии, ацидоза, алкалоза, электролитных нарушений. Использованию антиаритмических средств должна предшествовать коррекция гипо- и гиперволемии, анемии, гипогликемии и обязательная атропинизация из расчета 0,01-0,03 мг/кг массы тела. Приоритетным средством неотложной терапии тахиаритмического шока является электродеполяризация (2 Вт /с на 1 кг массы тела), позволяющая выиграть время и подобрать оптимальное антиаритмическое фармакологическое средство. При наджелудочковой тахиаритмии предпочтительнее ввести изоптин — по 0,1 мг/кг в течение 1 мин. Эту же дозу можно назначить с 15-минутным интервалом повторно. Лидокаин назначают в дозе 1 мг/кг и вводят в течение 10 мин. При желудочковой тахиаритмии и экстрасистолии эффективен мекситил. Препарат вводят в дозе 5 мг/кг в течение 15 мин, поддерживающая доза — 5 — 20 мкг/кг в 1 мин.
При брадиаритмическом шоке и отсутствии эффекта от введения атропина сульфата средством выбора является изупрел (изопротеренол, изадрин, новодрин). При отсутствии эффекта от медикаментозной терапии показана электрокардиостимуляция.
Всех детей в состоянии аритмогенного шока госпитализируют в отделение интенсивной терапии.