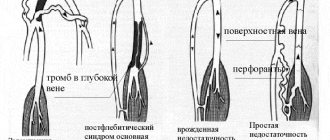
Показания к примененинию препарата Актовегин раствор для инъекций
Метаболические и циркуляторные нарушения ЦНС — ишемический инсульт, остаточные явления геморрагического инсульта, черепно-мозговые травмы, энцефалопатия различного генеза. Нарушения периферического артериального или венозного кровообращения, ангиопатия, в том числе диабетического генеза. Ожоги I–III степени (химические, термические, солнечные, лучевые). Для заживления ран (язвы различной этиологии, трофические нарушения, пролежни, нарушение процессов заживления ран); радиационные повреждения кожи, слизистых оболочек, радиационная нейропатия.
Применение препарата Актовегин раствор для инъекций
Применяется в/в (струйно, капельно), в/а по 5–20 мл в сутки. В/м вводят медленно, не более 5 мл в сутки. Для в/в введения препарат разводят в 0,9% р-ре натрия хлорида или 5% р-ре глюкозы. Допустимая конечная концентрация Актовегина составляет до 2000 мг сухого вещества на 250 мл р-ра. Обычная рекомендуемая схема: вначале 5–10 мл в/в или в/а, в дальнейшем — по 5 мл в/в, или медленно в/м ежедневно или несколько раз в неделю. При тяжелых состояниях показано в/в капельное введение Актовегина в дозе 20–50 мл/сут на протяжении нескольких дней до достижения выраженного клинического эффекта. При состояниях средней тяжести или обострении хронических заболеваний вводят в/в или в/м в дозе 5–20 мл в сутки на протяжении 14–17 дней. При проведении планового курса лечения назначают по 2–5 мл в сутки в/в или в/м на протяжении 4–6 нед. Кратность введения — от 1 до 3 раз в зависимости от степени тяжести заболевания. Препарат применяют для лечения детей. Новорожденным назначают в дозе 0,4–0,5 мл/кг 1 раз в сутки в/м или в/в, детям в возрасте 1–3 лет — в дозе 0,4–0,5 мл/кг 1 раз в сутки в/м или в/в, 3–6 лет — 0,25–0,4 мл/кг 1 раз на сутки в/м или в/в.
Список использованной литературы
- Карпов Андрей Владимирович «Комплексное лечение больных с критиче-ской ишемией нижних конечностей». Автореферат на соискание ученой степени доктора медицинских наук. Санкт Петербург, 2007 г.;
- Морозов Михаил Юрьевич «Оценка эффективности мидокалма,эмоксипина и актовегина в комплексном лечении больных облитерирующим атеросклерозом нижних конечностей». Автореферат на соискание ученой степени кандидата медицинских наук. Саранск, 2007 г.;
- Майнугин С. В., Фомин А. А., Красавин В. А., Красавин В. Г., Аверин С. В., Каменский С. Ю., Худояров Т. А.. «Первый опыт использования технологии лазерной допплеровской визуализации при выборе уровня ампутации нижней конечности у больных с критической ишемией // Тромбоз, гемостаз и реология». – 2012 г., №3;
- Фомин А. А., Майнугин С. В., Красавин В. А., Казмирук Н. А., Каменский С. Ю., Худояров Т. А. «Лазерная допплеровская визуализация в практике отделения гнойной хирургии // Тромбоз, гемостаз и реология» – 2012 г. , №4;
- Brecht M., de Grool H. «Protection from hypoxic injury in cultured hepatocytes hy glycine, alanine and serine. Amino Acids». 1994. Vol.6. P. 25-35.
диабет ишемия ишемия нижних конечностей хирургия
Особые указания по применению препарата Актовегин раствор для инъекций
В/м желательно вводить не более 5 мл р-ра, поскольку он является гипертоническим. В связи с возможностью возникновения анафилактических реакций рекомендуется проводить пробную инъекцию (2 мл р-ра вводят в/м с оценкой местной и общей реакции). Р-р для инъекций имеет желтоватый оттенок, интенсивность которого зависит от номера партии и исходного материала, однако цвет р-ра не влияет на эффективность и чувствительность к нему. Применение препарата Актовегин в период беременности допускается только по жизненным показаниям.
Последние десятилетия характеризуются значительными успехами в профилактике и лечении сердечно-сосудистых заболеваний (ССЗ): артериальной гипертензии (АГ); различных форм ишемической болезни сердца (ИБС) – острого коронарного синдрома (ОКС), инфаркта миокарда (ИМ); хронической сердечной недостаточности (ХСН). Эти достижения обусловлены внедрением в клиническую практику современных высокотехнологичных методов диагностики и лечения левожелудочковой недостаточности, в основу которых заложено четкое представление о механизмах развития ишемии и гибели кардиомиоцитов (структурных и функциональных единиц миокарда), адаптационных изменений центральной гемодинамики.
ИБС широко распространена во всем мире, особенно в экономически развитых странах, занимает ведущее место в структуре инвалидизации и летальности от ССЗ среди социально значимой возрастной группы населения. В большинстве европейских стран распространенность ИБС составляет 20–40 тыс. на 1 млн населения. Смертность от болезней системы кровообращения в Российской Федерации, по данным медицинской статистики за 2010 г., составила 56,5 % от общей летальности; из них более половины приходится на ИБС как на причину летального исхода.
ИБС как “самостоятельное заболевание” была выделена Всемирной организацией здравоохранения (ВОЗ) лишь в 1965 г. в связи с ростом частоты этой патологии, доминирующим участием в прогрессировании нарушений насосной деятельности сердца при ХСН и включена в Международную статистическую классификацию болезней, травм и причин смерти.
При ИБС наблюдается несоответствие уровня потребления миокардом кислорода объему его доставки коронарным кровотоком. Адекватное энергетическое обеспечение насосной деятельности сердца в широком диапазоне его деятельности – от состояния покоя до уровня максимальной нагрузки (соответственно уровню основного обмена целостного организма) зависит от состояния коронарного резерва. Коронарный резерв – это способность коронарного сосудистого русла во много раз увеличивать коронарный кровоток за счет дилатации коронарных сосудов адекватно потребностям миокарда в кислороде.
Кислород является ключевым компонентом окислительного фосфорилирования в синтезе АТФ – “топлива”, обеспечивающего функционирование кардиомиоцитов и в целом насосную деятельность сердца. Энергетический метаболизм в миокарде представляет собой взаимосвязанные механизмы доставки О2 и его утилизации субклеточными структурами кардиомиоцита – митохондриями [1 ,2, 4].
Сердце для энергообеспечения своей деятельности “утилизируeт” различные биологические субстраты: углеводы (глюкозу, гликоген, лактат), свободные жирные кислоты (СЖК), в меньшей степени – аминокислоты (белки). Независимо от энергетического субстрата в заключительной стадии распада биологических субстратов образуется ацетилкоэнзим-А , который вступает в цикл трикарбоновых кислот (цикл Кребса), и с участием О2 в митохондриях образуется энергетический субстрат АТФ.
В физиологических условиях 10 % АТФ образуется при окислительном фосфорилировании в митохондриях за счет аэробного гликолиза (расщепления глюкозы до пирувата). Количества АТФ, образующегося в результате аэробного гликолиза, не хватает для обеспечения работы ионных каналов сарколеммы, в частности для кальциевого насоса саркоплазматического ретикулума (СР), который для обеспечения диастолического расслабления потребляет до 50 % синтезированной энергии. Восполнение остального количества фосфатной энергии для функционирования кардиомиоцита в целом при нормальном кислородном обеспечении происходит за счет окисления СЖК. Метаболизм ЖК при окислительном фосфорилировании обеспечивает до 80 % синтеза АТФ. Однако окисление СЖК по сравнению с гликолизом – менее эффективный источник АТФ: “топлива” для сердца-насоса. При окислении СЖК на выработку одного и того же количества АТФ требуется примерно на 10 % больше кислорода, чем при гликолизе.[1, 4].
СЖК проникают в митохондрии посредством активного транспорта, за который отвечает карнитинпальмитиновый ферментный комплекс, затем в митохондриях происходит β-окисление СЖК. Этот процесс строго контролируется и зависит главным образом от интенсивности транслокации СЖК в митохондрии. В случае умеренной ишемии аэробное окисление СЖК и глюкозы снижается и анаэробный гликолиз становится основным источником АТФ. В этих условиях мобилизуются запасы гликогена на поддержку гликолиза.
При развитии различной степени ишемии (частичная или полная окклюзия коронарной артерии) анаэробный гликолиз остается единственным источником ограниченного образования АТФ. По мере уменьшения доставки О2 снижается активность окислительного метаболизма с образованием ограниченного количества АТФ. Выраженный дисбаланс между потребностью кислорода при окислении глюкозы и СЖК в сторону последних приводит к тому, что при ишемии в митохондриях кардиомиоцитов синтез АТФ переходит на β-окисление ЖК с накоплением множества недоокисленных активных форм ЖК ацилкоэнзима-А (Ацил-КоА) и ацилкарнитина (АцКар), что еще больше усугубляет разобщение окислительного фосфорилирования (рис. 1). Недоокисленные активные формы ЖК, в частности АцКар и Ацил-КоА как метаболиты, блокируют транспорт АТФ от места синтеза в митохондриях к месту их внутриклеточного потребления, оказывают разрушительное действие на мембрану – сарколемму, увеличивая дефицит энергии, необходимой для жизнедеятельности кардиомиоцитов [2, 4, 6, 10].
Параллельно в условиях тяжелой ишемии (отсутствия кровотока) лактат и Н+ накапливаются в кардиомиоцитах, т. е. на фоне анаэробного обмена происходит накопление протонов (Н+, Na+) и происходит “закисление” цитоплазмы. Ионы H+ и Na+ обмениваются на другие катионы (преимущественно на Ca2+), вследствие чего происходит “перегрузка” кардиомиоцитов Ca-ем с формированием незавершенной диастолы – контрактуры миокарда (рис. 2).
Современные достижения в изучении функции клеток (в частности, эндотелия) различных органов указывают на ключевую роль оксидативного стресса – избыточное образование активных форм кислорода (АФК – О2), в формировании ССЗ через перекисное окисление липидов (ПОЛ) клеточной мембраны. Главным источником АФК в клетках являются митохондрии, при нормальном функционировании которых 98 % поступившего кислорода используют для окисления субстратов с образованием АТФ (главного энергетического субстрата клеток) и 2 % – для синтеза АФК, который может значительно возрастать при различных патологических состояниях (рис. 3).
Уменьшение или прекращение доставки О2 к сердечной мышце может быть вызвано различными механизмами: от спазма до тотальной закупорки коронарной артерии. После восстановления коронарного кровотока поврежденные митохондрии не способны полностью утилизировать “нахлынувшее” поступление кислорода, часть которого используется другими окислительными системами клеток и сопровождается образованием повышенного количества АФК. Активность одного из мощных окислительных ферментов – ксантиноксидазы – находится на низком уровне в условиях аэробного обмена, но резко возрастает при гипоксии, кроме того – с переводом Fe3+ в Fe2+. Сочетание этих двух факторов способствует избыточному формированию АФК [8]. Избыточное образование и высвобождение свободных радикалов (АФК) активизируют перекисное окисления липидов (ПОЛ) с повреждением мембран клеток, которые состоят из фосфолипидов, холестерина и белковых включений, выполняющих роль ионных каналов или рецепторов.
Все вышеперечисленное является побудительным моментом для клиницистов при лечении и профилактике возможных осложнений в условиях ишемических эпизодов различных регионов (сердце, ЦНС): применение препаратов с антиоксидантной и антигипоксантной фармакологической направленностью, обладающих плейотропными эффектами (кардио-, нейроцитопротекция), восстановление аэробного внутриклеточного метаболизма. Типичным представителем лекарственных препаратов с подобными фармакокинетическими и фармакодинамическими качествами является Актовегина.
Актовегин – высокоочищенный гемодиализат из крови телят, полученный методом ультрафильтрации, не содержащий эндотоксинов и антигенов и состоящий из биологически активных физиологических компонентов, обладающих высокой биологической активностью: аминокислоты, олигопептиды, нуклеозиды, продукты углеводного и жирового обмена. Фармакологический состав Актовегина формируется 2-этапной ультрафильтрацией с использованием фильтров для выделения молекул разного размера. Молекулярный вес конечного отфильтрованного продукта не превышает 5000 Дальтон. Состав Актовегина был проверен современными аналитическими методиками, включая газовую жидкостную хроматографию в сочетании с масс-спектрометрией. Данные количественных методов анализа возможных метаболитов показали – Актовегин является комбинацией более чем 200 биоактивных молекул.[6, 7, 10].
Метод атомной эмиссионной спектрометрии показал наличие в Актовегине макро-электролитов (Mg, Na, Ca, P, K) и микроэлементов (Si,Cu), которые входят в простатические группы антиоксидантных ферментов (супероксиддисмутазы, глутатионпероксидазы, каталазы). Антиоксидантный эффект Актовегина обусловлен супероксиддисмутазной активностью [8]. Магний, входящий в Актовегин, – компонент кардиопептидных фрагментов и ферментов, выполняет функции каталитического центра, обеспечивающего контроль и запуск энзимобиохимических внутриклеточных процессов.
Антиишемическое действие Актовегина на клеточном уровне осуществляется за счет перевода энергообмена клеток в сторону аэробного гликолиза с торможением β-окисления жирных кислот. Актовегин®, селективно ингибируя 3-кетаоцетил-КоА-каталазы, замедляет ß-окисление жирных кислот, одновременно конкурентно восстанавливая сопряжения между гликолизом и окислительным декарбоксилированием, суммарно ведет к увеличению количества АТФ, что лежит в основе антиишемической защиты кардиомиоцитов Актовегином (рис. 4).
В экспериментальных исследованиях на клеточном уровне показано, что Актовегин® поддерживает энергетический метаболизм сердца. Кардиопротективный эффект Актовегина обусловлен его способностью поддерживать физиологический уровень креатинфосфата (основного переносчика энергии внутри клетки) и АТФ в условиях ишемии, стабилизировать pH внутри клетки (препятствует развитию внутриклеточного метаболического ацидоза), уменьшать повреждение мембраны – сарколеммы – перекисным окислением липидов, вызываемое свободными радикалами. Нормализация метаболического баланса приводит к ограничению накопления неорганического фосфата, Na и Са внутри клетки с сохранением нормальной концентрации К. Одновременно Актовегин® понижает уровень миграции и инфильтрации полинуклеарных нейтрофилов (ингибиция хемотаксиса) в ишемизированных и реперфузируемых тканях сердца, что уменьшает аутоиммунное повреждение миокарда, не оказывая влияния на центральную гемодинамику [4, 5, 9].
Оксидантный стресс вызывает поломку 1 нити ДНК, что приводит к активации ядерного фермента полимеразы поли-АДФ-рибозы (ПАРП). Избыточная активация ПАРП имеет негативные последствия в виде запуска последовательных клеточных процессов, которые в конечном итоге останавливают гликолиз и процесс митохондриального дыхания (окислительное фосфорилирование – цикл Кребса), что приводит к гибели клетки вследствие энергетического истощения и активации оксидативного стресса [8].
Дальнейшие исследования подтвердили роль метаболизма ПАРП как важного механизма в развитии дисфункции эндотелия при кардио-васкулярных патологиях, вызванных нарушением углеводного обмена, – СД, и недавно было подтверждено, что ПАРП может участвовать в развитии диабетической полинейропатии. Обобщая эти данные, можно сделать предположение о важной роли ПАРП при ИБС, цереброваскулярных заболеваниях и диабете [3, 5, 7, 8].
M.W. Elmlinger и соавт., используя клеточные культуры головного мозга (первичные нейроны гиппокампа), в своем исследовании показали ингибирующее влияние Актовегина на процессы оксидантного стресса. В нейронах, обработанных возрастающими концентрациями третбутилгидропероксида (> 0,2 мМ), было обнаружено повышение уровней внутриклеточных АФК (p < 0,001), но в случае использования Актовегина в культуре нейронов отмечено дозозависимое снижение выраженности оксидантного стресса через 10 дней (p < 0,001 при концентрациях > 0,3 мкг/мл) [8]. В исследованиях in vivo влияние Актовегина на анализируемые параметры при экспериментальной диабетической полинейропатии соответствовало результатам, полученным в данном исследовании in vitro [6, 7].
Актовегин® оказывает многоплановое действие через нормализацию потребления и использование кислорода, усиление поступления в клетки глюкозы, благодаря чему восстанавливается клеточный метаболизм [6, 9, 10]. Актовегин® усиливает окислительные процессы, сдвигая баланс окислительно- восстановительных реакций в сторону окисления, что способствует повышению содержания высокоэнергетических фосфатов, таких как АТФ и креатинфосфат. K. Schwabe показал, что Актовегин® активирует внутриклеточные окислительные процессы и ускоряет не только энергетический, но и резервный метаболизм, что в случае заболевания сердца сопровождается усиленным накоплением гликогена и калия. Эти данные стали одним из первых наблюдений, показавших прямое позитивное влияние препарата Актовегин® на метаболизм головного мозга и миокарда [5, 8].
Ранее проведенные исследования документируют – Актовегин® оказывает инсулиноподобное действие через активацию ГЛЮТ 1–4, стимулируя клеточный метаболизм, повышает потребление кислорода и выработку энергии. Одной из составных частей фракций Актовегина является Инозитол-ФосфатОлигосахарид (ИФО-фракция), который через активацию цАМФ и аденилатциклазы способствует внутриклеточной утилизации глюкозы, стимулирует эффективность потребления О2 и снижает образование лактатов.
Действие Актовегина на транспорт глюкозы в кардиомиоцит – инсулиннезависимое (не оказывает влияния на инсулиновые рецепторы), т. к. реализуется через непосредственную активацию ГЛЮТ 1–4, поэтому его эффект сохраняется даже на фоне инсулинорезистентности у больных СД 2 типа. Одновременно ИФО-фракция в синергизме с супероксиддисмутазой и магнием способствует ингибированию ПОЛ клеточных мембран (мембранстабилизирующий эффект) [4, 6–8, 10].
В ряде клинических исследований показано, что применение препарата Актовегин® положительно влияет на когнитивные функции при кардиоваскулярных энцефалопатиях, улучшает психологические и поведенческие реакции, наиболее эффективен при легких и умеренных когнитивных нарушениях [3, 6].
Благодаря разработкам и внедрению в клиническую практику новых медицинских технологий, в частности позитронной эмиссионной томографии (ПЭТ), в настоящее время существует реальная возможность количественной оценки перфузии миокарда in vivo, поглощения кислорода, утилизации глюкозы, ЖК, сократительной способности. ПЭТ позволяет неинвазивным способом изучать поглощение кислорода, метаболизм глюкозы и ЖК с расчетом количественных параметров в абсолютных значениях. В качестве естественного маркера захвата и метаболизма глюкозы при ПЭТ используется [18F]-2-флюоро-2-деоксиD-глюкоза ([18F]ФДГ) – аналог глюкозы, меченный 18-фтором, который не метаболизируется и остается в клеточном цитозоле в неизменном виде. Для количественной оценки метаболизма СЖК в миокарде человека в настоящее время в качестве естественного маркера применяется [18F]-тиа-гепта-деканоевая кислота ([18F]ТДК) – длинноцепочечная ложная ЖК, меченная 18-фтором, накопление которой свидетельствует о β-окислении СЖК в миокарде как основном источнике энергии в миокарде. Для оценки окислительного метаболизма при ПЭТ разработана модель с использованием [1-11C]-ацетат как маркера поглощения миокардом кислорода [1, 4].
На рис. 5 представлены примеры количественной оценки утилизации О2 метаболизма глюкозы (рис. 5А) и свободных жирных кислот (рис. 5Б) до и после внутривенной инфузии 1000 мг Актовегина. Актовегин способствует 3-кратному увеличению утилизации О2 с одновременным 6–7-кратным увеличением захвата глюкозы и аналогичным снижением метаболизма СЖК. Подобная динамика окислительного метаболизма свидетельствует о стимуляции Актовегином аэробного окисления – наиболее выгодного источника макроэнергофосфатов [4].
Имеются данные, что действие Актовегина на пациентов с ИБС, осложненной острой коронарной недостаточностью, многокомпонентно, помимо улучшения метаболизма миокарда позитивно влияет на реологические свойства крови: снижает агрегационную активность тромбоцитов, увеличивает подвижность эритроцитов, снижает вязкость крови (через гипогликемический эффект). Одновременно Актовегин способствует ангиогенезу – развитию коллатерального кровообращения [9].
По данным ряда авторов, применение Актовегина больными в первые сутки развития способствует восстановлению сократительной функции миокарда левого желудочка ИМ через улучшение метаболизма кардиомиоцитов, устраняет электрическую гетерогенность, что суммарно проявляется в снижении частоты осложнений и ранней госпитальной летальности [4, 5].
В наших исследованиях применение Актовегина (от 800 до 1200 мг внутривенно) в острейшей фазе ИМ 49 больными на фоне тромболизиса и стандартной терапии способствовало более эффективному предупреждению развития синдрома “реперфузии” (прогрессирование болевого синдрома, увеличение эпизодов желудочковых аритмий, распространение зоны ИМ, нарастание СН). Группа сравнения – 67 больных ОИМ, которым артифициальный тромболизис проводился без профилактического внутривенного введения Актовегина. Анализы клинического статуса и исследования насосной деятельности сердца до и после лечения по группам представлены в таблице.
Как видно из таблицы, купирование частоты реперфузионного синдрома до 18,4 % в исследуемой группе больных ОИМ по сравнению с контрольной группой больных ОИМ (67 больных ОИМ) – 34 %, было опосредовано за счет улучшения эффективной диастолы (устранение “контрактуры” ишемизированного миокарда). Все параметры потоков крови через митральный клапан, характеризующие диастолическое расслабление миокарда левого желудочка, улучшились статистически достоверно, что способствовало эффективному увеличению фракции выброса левого желудочка – интегрального показателя насосной деятельности сердца. ФВ в исследуемой группе на фоне введения Актовегина увеличилась статистически достоверно (p < 0,05) на 8,4 % (от 39,2 ± 5,5 % до 46,6 ± 2,1%) по сравнению с контрольной группой больных ОИМ (от 39,1 ± 2,9 % до 42,7 ± 3,1 %).
Более эффективное восстановление метаболизма ишемизированного миокарда на фоне введения Актовегина способствует минимизации электрической гетерогенности, что клинически манифестируется уменьшением частоты развития желудочковых нарушений ритма сердечной деятельности: в группе исследования после лечения они имели место в 22,4 % наблюдений, в группе сравнения – в 32,8 %.
Аналогичные результаты были получены и в других клинических наблюдениях [5].
Актовегин как антигипоксант и вторичный антиоксидант при его использовании в клинической практике активирует аэробное дыхание клеток, находящихся в состоянии ишемии и метаболической недостаточности, оказывает системное действие на организм (рис. 6). Основными фармакологическими действиями Актовегина являются повышение эффективности поглощения кислорода и активация транспорта глюкозы, в частности в кардиомиоците. Активация процессов аэробного окисления увеличивает энергетический потенциал миокардиальной клетки. Перечисленные эффекты Актовегина наиболее выраженно проявляются при гипоксическом статусе сердечной мышцы.
Таким образом, развитие кардиососудистых нарушений при ишемических эпизодах сопровождается совокупностью патофизиологических событий, для устранения которых необходим интегрированный фармакологический подход, а не упрощенное однонаправленное воздействие. Множественные кардио- и нейротропный эффекты предполагают одновременное модулирующее влияние на разные повреждающие патологические механизмы (воспаление, апоптоз, оксидантный стресс и многие др.).
В качестве биологического агента, обладающего плейотропными эффектами, Актовегин по своим механизмам действия (антиоксидантному, антигипоксантному) соответствует концепции об интегративном терапевтическом подходе.
В представленном обзоре и анализе собственного опыта показано – Актовегин принимает активное участие в восстановлении баланса клеточного метаболизма путем коррекции ряда патофизиологических процессов, имеющих место при развитии ИБС. Актовегин оказывает кардиопротективное действие на кардиоваскулярный функциональный блок за счет своего антиапоптотического и антиоксидантного действий, активизирует механизмы утилизации глюкозы и кислорода с нормализацией внутриклеточного энергетического баланса, способствующие улучшению насосной деятельности сердца.