Изменения биохимических показателей
При беременности снижение общей концентрации белка в плазме крови (альбумина) обусловлено частичным разведением крови из-за увеличения ее общего объема. Но может происходить в результате задержки жидкости в организме, нарушения гемодинамики, повышения проницаемости сосудов во время беременности.
Изменение концентрации белков крови обнаруживаются на протеинограмме. В первый и во второй триместр беременности уменьшается альбумин. В третьем триместре выявляется увеличение альфа-1-глобулиновой фракции, альфо-фетопротеина.
Альфа-2-глобулиновая фракция может повышаться за счет белков, связанных с беременностью (начинают повышаться с 8-12 недели беременности и достигают максимума в III триместре). Бетта и гаммаглобулины также увеличиваются. Незначительные изменения С-реактивного белка, наблюдаемые чаще в ранние сроки беременности, могут быть реакцией организма на процессы усиленного деления клеток при росте и развитии малыша.
Изменение объема циркулирующей крови (ОЦК) и кровоснабжения почек приводит к изменениям выделительной функции почек. Происходит задержка и накопление азотистых веществ, при этом количество мочевины снижается, особенно в поздние сроки беременности. Показатели креатинина снижаются максимально в I-II триместре (его концентрация может снижаться почти в 1,5 раза), что связано с ростом мышц массы матки и ребенка. Уровень мочевой кислоты чаще снижен за счет усиления кровоснабжения почек. Но даже небольшие нарушения в работе почек могут привести к повышению данного показателя, и это расценивается как возможный симптом интоксикации.
Существенно изменяется во время беременности жировой обмен. Так как усиливаются обменные процессы в организме, увеличиваются показатели холестерина (холестерола, липопротеинов высокой плотности ЛПВП).
Повышение уровня гормонов эстрогенов во время беременности приводит к отложению жира в молочных железах, на талии и ягодицах. Поэтому худеть и сидеть на диетах беременным бесполезно. Это гормональное и уйдет только после того, как ребенку исполнится год, причем практически независимо от того кормит мама грудью или нет.
Во время беременности увеличивается уровень инсулина. Показатель, отражающий уровень инсулина это С-пептид. При этом уровень глюкозы может меняться незначительно или совсем не меняться.
Однако в моче глюкоза имеет право обнаруживаться при нормальной беременности. Это происходит потому, что во время беременности повышается скорость фильтрации мочи через почки. Чаще глюкоза в моче появляется на сроке беременности 27-36 недели.
Особенностями минерального обмена у здоровых беременных по сравнению с небеременными женщинами является задержка в организме солей натрия, калия, хлора, фосфора. И именно изменения показателей фосфора в организме беременной связано с повышением щелочной фосфатазы. Это обусловлено изменениями во время беременности со стороны костной ткани и изменениями со стороны печени.
Как известно, во время беременности повышается потребность в солях кальция, которые необходимы для формирования скелета малыша. Поэтому у мамы может наблюдаться дефицит кальция, который иногда проявляется в судорогах мышц.
Повышение потребления железа организмом беременной может приводить к анемии. Характеризуется данное состояние снижением железа, ферритина, витаминов: В12, фолиевой кислоты.
Осложнения после гестоза
Последняя стадия патологии может привести к ряду серьезных последствий:
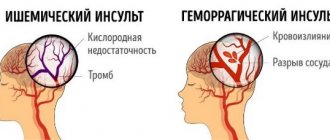
- Внутримозговое кровоизлияние.
- Геморрагический шок.
- Преждевременная отслойка плаценты.
- Отслойка сетчатки и потеря зрения.
- Острая почечная недостаточность.
- Кома после судорог.
Осложнения со стороны плода:
- Синдром задержки развития.
- Внутриутробная недостаточность кислорода (гипоксия).
- Антенатальная гибель.
Подобных состояний можно избежать, проходя регулярный осмотр и наблюдаясь у опытного гинеколога.
Причины патологии
Существует несколько теорий, которые объясняют развитие преэклампсии и эклампсии у беременных. Рассмотрим основные:
- Кортико-висцеральная теория. Согласно ей гестоз является невротическим состоянием, которое возникает из-за нарушения физиологической связи между корой и подкоркой головного мозга.
- Иммунологическая. Патология возникает из-за неправильной реакции иммунной системы беременной на антигены плода.
- Генетическая. Существует предположение о возможном «гене эклампсии», который передается по наследству. Согласно теории, гестоз в 8 раз чаще встречается у женщин, чьи матери перенесли подобное заболевание.
- Эндокринная. По этой теории патология развивается из-за неправильной работы эндокринной системы организма.
- Плацентарная. К болезни приводит нарушение развития плаценты, в результате чего нарушается кровоток и возникает гипоксия.
Стоит отметить, что единой теории, объясняющей развитие гестоза, пока не выявлено. По мнению ученых, к патологии приводит совокупность нескольких факторов.
В группе повышенного риска находятся женщины, имеющие один из следующих факторов:
- Возраст младше 18 и старше 35 лет.
- Многоплодная беременность.
- Перенесенный раннее гестоз.
- Экстрагенитальные заболевания.
- Наличие ожирения.
Симптомы заболевания
Наиболее очевидными признаками патологии является следующее:
- Постоянные головные боли, плохое самочувствие.
- «Мушки» перед глазами.
- Тошнота и рвота, повышение температуры.
- Сухой кашель, осиплость голоса.
- Озноб, лихорадка.
- Отеки ног, рук и лица.
- Артериальная гипертензия.
При появлении подобных симптомов в 3 триместре женщине назначают ряд дополнительных обследований, позволяющих диагностировать гестоз. Чаще всего у пациентки дополнительно обнаруживается нарушение маточно-плацентарного кровотока, наличие белка в моче, снижение числа тромбоцитов и уменьшение концентрации антикоагулянтов.
Лечение и профилактика
Для диагностики ранних стадий гестоза используют тест Маклюра-Олдрича, который позволяет выявить скрытые отеки. Также проводится анализ крови, позволяющий определить содержание тромбоцитов, а также наличие белка. Выполняется допплерографическое исследование плода и УЗИ почек. В нашей клинике профессор С.М. Воеводин и профессор А.Д. Липман проводят экспертное исследование – ЭКГ + кровотоки в маточных и плодовых сосудах (УЗИ-ЭКИПФС ). Это исследование делается на специализированном оборудовании и позволяет на доклиническом уровне выявить риски гестоза или оценить динамику развития плода, а также эффективность терапии на фоне гестоза. Кроме того, научной группой врачей клиники разработан алгоритм ведения пациентки с риском возникновения гестоза и невынашивания, который позволяет минимизировать риски.
По результатам диагностики определяется состояние здоровья пациентки. При обнаружении признаков развития гестоза назначается ряд препаратов, включая седативные и антигипертензивные средства, антикоагулянты и антиоксиданты. Могут проводиться внутривенные влияния, направленные на восполнение объемов циркулирующей крови. Дело в том, что у большинства пациенток с гестозом нарушается система гемостаза. Поэтому важна консультация или наблюдение у специалиста-гемостазиолога. Если лечение не приносит должных результатов, то необходимо родоразрешение – чаще всего выполняется кесарево сечение.
Но стоит отметить, что это – крайние меры, при грамотном подходе специалиста удается обнаружить и вылечить гестоз при беременности еще на ранних стадиях. Поэтому обязательно сообщайте своему врачу даже о незначительном ухудшении самочувствия.
Если у вас возникли вопросы о подобной патологии, вы можете задать их специалистам нашей Международной клиники Гемостаза в Москве. Записывайтесь на прием при помощи онлайн-формы или по телефону.
Свертываемость крови во время беременности
Свертывающая системы крови является одной из наиболее сложно регулируемых систем нашего организма. Процессы тромбообразования находятся в определенном равновесии с процессами фибринолиза. При нарушении данного баланса могут наблюдаться патологические явления — гиперсвертываемость или же, напротив, склонность к кровотечениям. Конечно, этому всегда способствуют те или иные факторы, одним из которых является период беременности.
Во время беременности под действием различных влияний, меняется большинство нормальных процессов в организме. Наиболее известным является факт снижения иммунитета, что рассматривается как защитная реакция организма. Ведь плод на ранних сроках может восприниматься как чужеродный белок, в таком случае недостаточная работа иммунной системы только во благо, так как не происходит борьбы организма против малыша. Но далеко не все знают об этой особенности и в ряде случаев стараются любыми способами повлиять на состояние иммунитета, чтобы избежать частых вирусных заболеваний, обострения имеющихся хронических инфекций.
Подобные изменения происходят и со свертывающей системой крови. Во время беременности в норме происходит усиленное тромбообразование. Это можно объяснить подготовкой организма к последующей возможной кровопотере в родах. Также свойства крови во время беременности меняются из-за возрастающей нагрузки — требуется ток крови и достаточное питание по направлению к плаценте, которая обильно кровоснабжается. Формирующиеся системы и органы плода также влияют на характеристики свертываемости крови. Если подобные изменения незначительные и укладываются в нормы для беременных, то патология гемостаза исключена. Но в случаях, когда имеются выраженные нарушения, особенно сопровождающиеся клинической картиной, важно вовремя диагностировать данное состояние и решить вопрос о необходимости медикаментозной коррекции.
Одним из показателей, на которые обращают особое внимание во время беременности является Д-димер
. Д-димер представляет собой продукт распада сформированного кровяного сгустка, тромба. Чем выраженнее тромбообразование, тем больше образуется Д-димеров из тромбов. По их уровню в крови можно предположить гиперкоагуляцию, то есть повышенную свертываемость, тромбообразование.
Во время беременности Д-димер в норме несколько повышен
. Обращаем Ваше внимание, лаборатории всегда приводят референсные значения по триместрам, но лишь лечащий врач может точно диагностировать патологическую свертываемость, приняв во внимание жалобы, клиническую картину. В первую очередь, учитывают акушерско-гинекологический анамнез. Так, при неудачных ранее беременностях, закончившихся прерыванием, потерей плода, при обнаружении повышенного Д-димера показана консультация гематолога для решения вопроса о назначении антикоагулянтов. Но если повышение Д-димера отмечается однократно, при этом нет признаков тромбообразования, анамнез пациентки без особенностей, врачи обычно выбирают наблюдательную тактику, хотя несколько лет назад даже незначительные повышения Д-димера заставляли специалистов включать в терапию гепарины. Сейчас клинические рекомендации составлены таким образом, что подход к изучению свойств крови является исключительно комплексным и не ограничивается лишь оценкой Д-димера. Обязательно учитывают общую коагулограмму, наличие варикозно расширенных сосудов, тромобозов в анамнезе, наличие синдрома привычного невынашивания беременности.
У женщин с наличием 2 и более потерь беременностей углубленное исследование свойств крови показано уже на этапе планирования. Следует отметить, что на фоне имеющихся патологических состояний крови вполне возможно зачатие, но дальнейшее прогрессирование беременности без должной коррекции может быть значительно затруднено и даже невозможно.
Самые распространённые проблемы 1 триместра беременности
Кровотечения: из-за недостатка прогестерона происходит спазм и расслабление мышц матки и соответственно отслойка плодного яйца и кровотечение (в тяжёлых случаях – выкидыш). Также при гипотиреозе происходит нарушение имплантации плодного яйца, что тоже приводит к кровотечениям.
Тромбозы. При беременности повышается свёртываемость крови (это нормальное явление – организм готовится к потерям крови). Для профилактики тромбозов вен нижних конечностей необходимо отказаться от приема оральных контрацептивов за 6 месяцев до начала планирования беременности, а во время наступившей беременности сохранять по возможности достаточную физическую активность (длительные пешие прогулки, плавание) и наблюдаться у врача. При возникновении боли, отечности, «синюшности» в нижних конечностях необходимо немедленно обратиться ко врачу.
Аномалии развития и генетические патологии. В 1 триместре наиболее часто развиваются и проявляются отклонения в развитии плода, которые могут наступить вследствие ионизирующего излучения, перенесённых при беременности инфекционных заболеваний (краснуха, грипп, и т.д), приёма препаратов, запрещённых при беременности (фторхинолоны, макролиды, тетрациклины, транквилизаторы, и т.п.), генетических патологий и наследственных болезней.
Анемии. Чаще бывает вследствие дефицита железа, т.к. плод потребляет огромное его количество, отнимая запасы железа у матери, реже – вследствие кровотечений. Так же встречается В12 и фолиево-дефицитные анемии, связанные так же с повышенным расходом и недостаточным потреблением матерью. Анемия опасна хроническим недостатком кислорода, вызывающим синдром задержки роста плода. В тяжёлых случаях может приводить к внутриутробной гибели плода.
Во время беременности могут обостряться хронические заболевания. Это связано с тем, что оплодотворённая яйцеклетка несёт в себе уже часть чужеродной для матери ДНК. Чтобы не произошло отторжения яйцеклетки, организм матери подавляет свой иммунитет на протяжении всей беременности, что отражается на организме в целом. Поэтому все болезни, не выявленные на стадии подготовки к беременности следует обнаружить и вылечить. Это касается в основном инфекционных болезней. Например, обострение хронического пиелонефрита, или герпесвирусной инфекции.
Также при беременности происходит резкая перестройка гормонального фона, что, в свою очередь, сказывается на соматических (не инфекционных) болезнях. Например вследствие сгущения желчи и сдавления желчного пузыря маткой может обостряться хронический холецистит. При развитии плода, островки Лангерганса (клетки, вырабатывающие инсулин в поджелудочной железе), иногда развиваются недостаточно быстро и ребёнок начинает потреблять инсулин матери. При наличии у матери диабета или нарушений толерантности к глюкозе (в т.ч. скрытых), и ребёнку, и матери не хватает инсулина, что приводит к повреждению тканей как ребёнка так и матери (раннее старение плаценты, задержка развития плода, преждевременные роды, многоводие, повышение артериального давления у беременной, формирование крупного плода, риск травм женщины и ребенка в родах и самое грозное осложнение – внутриутробная гибель плода).
Кроме того печень плода ещё не функционирует как детоксикационный орган, и все продукты распада, вырабатываемые ребёнком, вынуждена перерабатывать печень матери. У 2% беременных женщин развивается доброкачественный холестатический гепатоз беременных – нарушение образования и оттока желчи, что вызывает:
- Кожный зуд особенно в ночное время
- Нарушение пищеварения (тк желчь участвует в эмульгировании жиров)
- Воспаление печеночной ткани вследствие токсического воздействия на клетки и желчные протоки
Классификация патологии
Подобное заболевание нередко еще называют поздним токсикозом, но это название некорректно. В отличие от токсикоза, гестоз требует лечения, так как не является вариантом нормы. В зависимости от тяжести симптомов выделяют 4 стадии болезни:
- Водянка. Она нередко остается незамеченной, так как характеризуется только отечностью.
- Нефропатия. Помимо отечности у беременной обнаруживается белок в моче. На этом этапе происходит поражение почек, при отсутствии лечения могут возникнуть осложнения.
- Преэклампсия. Характеризуется повышением артериального давления и сопутствующими симптомами: головной болью, тошнотой и т.д. Возможно нарушение мозгового кровоснабжения.
- Эклампсия. Эта стадия является самой опасной. У беременной нередко наблюдаются судороги, может произойти отслойка плаценты, инфаркт и другие серьезные последствия.
Открытие новых форм тромбофилии, роль гиперкоагуляционных нарушений в дебюте и прогрессировании различных осложнений беременности определяют важность изучения данной проблемы. В настоящее время показателей простой коагулограммы не хватает для объективной оценки функции системы гемостаза. Лабораторные исследования, выявляющие маркеры тромбофилии, делают возможными своевременную диагностику гиперкоагуляционных состояний и определение вариантов лечения таких больных. Тромбофилия — тенденция организма к формированию гиперкоагуляционных состояний, вызванная нарушением регуляторных механизмов системы гемостаза или изменением свойств отдельных звеньев данной системы. З.С. Баркаган и А.П. Момот [1] определяют тромбофилию как «нарушения гемостаза и гемореологии, которые характеризуются повышенной наклонностью к развитию тромбозов кровеносных сосудов и ишемии органов, в основе которых лежат нарушения в различных звеньях системы гемостаза». В последние 20 лет изучению тромбофилий уделяется большое внимание. Это связано с крупными достижениями в области гемостазиологии (диагностика гиперкоагуляционных нарушений и их коррекция) и широкой распространенностью тромбофилических состояний. В 1965 г. исследователь O. Egeberg [2] впервые описал патологию, которая заключалась в склонности к возникновению тромбозов в молодом возрасте, связанной со снижением уровня антитромбина ІІІ (АТ III). В дальнейшем доказаны иные возможности развития тромбофилии: изменение структуры молекулы АТ III, дефицит протеина С (J. Griffin и соавт. [3]), дефект протеина S [4]. В 1993 г. B. Dahlback и соавт. [5] описали резистентность к активированному протеину С — АРС-резистентность (activated protein С-резистентность), или болезнь фактора V Лейден.
Выявление мутированного протромбина 20210 А, приводящего к увеличению его содержания в крови почти на 25%, позволило обсуждать вопрос о новом классе тромбофилий, возникающих за счет избытка содержания в крови прокоагулянтов [6, 7]. Существенным прогрессом в понимании развития повышенной склонности организма человека к тромбообразованию стало обнаружение связи между частотой тромбозов и уровнем гомоцистеина в крови [8]. С развитием диагностики причин тромбофилии, установлением новых этиологических факторов, росла и частота выявления патологии. Для генетического дефекта при тромбофилии в хронологическом порядке у лиц с венозными тромбозами этот показатель являлся следующим: до 1965 г. — 0, 1965 г. (открыто значение антитромбина) — менее 5%, 1981 г. (открыто значение протеина С) — менее 10%, 1984 г. (открыто значение протеина S) — около 10—12%, 1994 г. (открыто значение АРС-резистентности) — около 60%, 1996 г. (значение протромбина 20210А) — около 80% [6, 7]. В настоящее время наибольшее клиническое значение имеют следующие факторы: 1) фактор V Лейден; 2) мутация протромбина 20210А; 3) АТ ІІІ; 4) дефект протеина S; 5) дефект протеина C; 6) гипергомоцистеинемия. В отсутствие генетических аномалий звенья системы гемостаза поддерживают кровь в нормальном состоянии. Коагуляция крови происходит при взаимодействии сосудисто-клеточного и плазменного звеньев данной системы. Коагуляция крови контролируется действием белков-антикоагулянтов. АТ ІІІ — плазменный протеин, снижающий активность сериновых протеаз внутреннего и общего путей свертывания. При наличии эндогенного гепарансульфата скорость их инактивации увеличивается. Плазменные кофакторы — VІІІ и V факторы — инактивируются при расщеплении их протеином С, который активируется тромбином при наличии тромбомодулина, связанного с эндотелиальными клетками. При наличии протеина S, который действует как кофактор, скорость активации значительно увеличивается. Ингибитор внешнего пути свертывания — липопротеинассоциированный плазменный протеин. Он участвует в формировании комплекса с тканевым фактором и активированными факторами VІІ и Х, что приводит к их инактивации. На сформированный тромб действует плазминсериновая протеаза, образующаяся в результате ферментативных реакций из плазминогена.
АРС-резистентность — наиболее частая причина развития тромбофилии. Определяется в популяции у 20% пациентов с дебютом тромбозов, у 50% — с наследственными нарушениями системы гемостаза и у 60% — с тромбозами при нормальных уровнях протеинов С, S, АТ ІІІ. У пациентов, у которых выявляется АРС-резистентность, имеется точковая мутация гена V фактора свертываемости (лейденская мутация). При данной мутации фактор свертываемости приобретает резистентность к расщепляющему действию активированного протеина С. Гетерозиготная лейденская мутация определяется у 5% пациентов и приводит к 3—7-кратному увеличению риска образования тромбов. Гомозиготная форма данной мутации повышает риск тромбообразования примерно в 80 раз [9—11]. Вероятность тромбообразования возрастает при сочетании лейденской мутации с другими нарушениями системы гемостаза — дефицитом протеина S, гипергомоцистеинемией и беременностью. Лейденскую мутацию определяют при помощи ДНК-диагностики (полимеразная цепная реакция — ПЦР). Диагностика АРС-резистентности осуществляется с помощью коагулологических проб в динамике.
Дефицит протеина С выявляется не более чем у 0,5% в общей популяции. У пациентов с дебютом тромбоза его обнаруживают не более чем в 3% наблюдений [12, 13]. При гетерозиготной форме данной мутации риск развития тромбозов увеличивается в 7 раз [14]. В семьях, у членов которых наблюдается данная мутация, частота тромбозов составляет примерно 50%. Уровень протеина С в крови при такой форме определяется в диапазоне от 35 до 65% от нормативных значений. Дебют тромбоза у людей с данной мутацией происходит в возрасте от 10 до 50 лет. У новорожденных с гомозиготным типом дефицита протеина С возможно развитие фульминантной пурпуры или диссеминированного внутрисосудистого свертывания крови. Данные состояния были несовместимы с жизнью до того момента, пока не стали применять свежезамороженную плазму — источник протеина С. Причинами дефицита протеина С могут быть более 160 мутаций [15]. Дефицит протеина С встречается двух типов: количественный (1-й тип) и качественный (2-й тип). Для 1-го типа характерно наличие сниженного количества нормального протеина С. При втором типе в крови содержится большое количество протеина С с низкой активностью. Функциональную активность протеина С определяют с помощью коагулологических методов исследования, а его уровень — иммуноферментным методом.
Протеин S — кофактор в реакции инактивации факторов свертываемости Vа и VІІІа — состоит из свободного протеина S (40%) и связанного белка (60%) с С4B-связывающим протеином. Наследственная недостаточность протеина S определяется у 0,7% людей в общей популяции и 3% пациентов с венозным тромбозом. В семьях с данной патологией частота возникновения тромбозов составляет 19—47% в молодом возрасте (10—50 лет). Риск тромбообразования повышается при ассоциации с другими наследственными тромбофилиями. Дефицит протеина S, передаваемый по наследству, могут вызывать более 70 мутаций гена, кодирующего синтез этого белка [13, 16]. Типы дефицита такие же, как и в случае с дефицитом протеина С.
АТ ІІІ — мощнейший естественный антикоагулянт, ингибирующий наряду с тромбином еще несколько факторов свертывания, — активированные факторы ІХ, Х, ХІ и ХІІ. Дефицит А.Т. ІІІ в общей популяции выявляют в 0,17% наблюдений, среди больных с тромбозами и тромбоэмболией легочной артерии — в 1,1%. В семьях с наследственным дефицитом АТ ІІІ тромботические осложнения возникают у 50% родственников. У лиц, гетерозиготных по дефициту АТ ІІІ, его уровень составляет 45—75%. Наибольшая частота формирования тромбозов при этой форме тромбофилии приходится на возраст от 15 до 35 лет. В целом риск тромбозов, обусловленных дефицитом АТ ІІІ, превышает таковой при дефиците протеинов С, S и АРС-резистентности. Гомозиготный дефицит АТ ІІІ не совместим с жизнью, за исключением дефицита, связанного с дефектом гепаринсвязывающего домена молекулы АТ ІІІ в результате соответствующей мутации. Больные с таким типом дефицита имеют высокий риск не только венозных, но и артериальных тромбозов [17].
Мутация гена протромбина 20210А определяется по постоянно высокому уровню протромбина в плазме крови (у 87% носителей превышает 115%). Мутация наследуется по аутосомно-доминантному типу, гетерозиготная ее форма встречается у 2—3% людей в общей популяции и 6,2% больных с венозными тромбозами [13]. Мутация G20210А сопряжена с высоким риском тромбозов не только в периферических венах и венах головного мозга, но и в артериях с развитием ишемических инсультов и ишемической болезни сердца у молодых пациентов.
Гипергомоцистеинемия встречается в популяции с частотой 5—10% и определяется как слабая при уровне гомоцистеина в плазме крови 15—30 мкмоль/л, умеренная — при уровне 30—100 мкмоль/л и выраженная — при уровне более 100 мкмоль/л. Частота выраженной гипергомоцистеинемии в популяции составляет 0,4%. Гипергомоцистеинемию выявляют у 10—25% пациентов с венозными тромбозами [18, 19]. Она также является независимым фактором риска развития атеросклероза.
Гомозиготная форма дефицита цистатион-β-синтазы (наследственная гомоцистеинурия) встречается редко — у 1 на 200 000 новорожденных [13]. Характеризуется крайне высоким уровнем гомоцистеина в крови, нередко превышающим 400 мкмоль/л, клинически проявляется ранним развитием венозных и артериальных тромбозов, а также атеросклероза у лиц с патологией скелета и задержкой умственного развития. Гетерозиготный дефицит цистатион-β-синтазы характеризуется умеренной гипергомоцистеинемией, как правило, не превышающей 20—40 ммоль/л, и не проявляется до первого эпизода венозного или артериального тромбоза в молодом возрасте. Частота этой формы гипергомоцистеинемии в популяции составляет 0,3—1,4% [20, 21].
Существенно чаще встречается дефицит 5,10-метилентетрагидрофолатредуктазы — у 5% людей в общей популяции (у 15% — в США и Канаде). У пациентов с атеросклерозом эта форма гипергомоцистеинемии встречается в 19% наблюдений [22, 23].
Механизмы протромбогенного и антиатеросклеротического действия гомоцистеина включают повреждение эндотелиальных клеток с последующей активацией тромбоцитов и экспрессией тканевого фактора, активирующего каскад коагуляции, перекисное окисление липидов, окислительную модификацию липопротеидов низкой плотности, усиливающие повреждение сосудистой стенки [24]. Сочетание гипергомоцистеинемии с другими формами тромбофилии повышает риск развития тромбозов.
Повышение уровня гомоцистеина легко устраняется приемом витаминов В12, В6 и фолиевой кислоты. Однако до настоящего времени неясно, приводит ли его нормализация к уменьшению риска развития венозных и артериальных тромбозов, хотя работы, демонстрирующие такую связь, появились [25].
Беременность всегда сопровождается состоянием гиперкоагуляции, что связано с повышением уровня фибриногена и протромбина; также значительно на 50—80% — возрастает уровень VIII, IX, X факторов свертывания крови. Одновременно снижается активность системы фибринолиза и физиологических антикоагулянтов: повышается активность ингибитора активатора плазминогена с одновременным повышением уровня активаторов плазминогена — t-PА, u-PА, FXII. С увеличением срока беременности происходит снижение скорости кровотока в венах нижних конечностей, обусловленное сдавлением нижней полой вены беременной маткой, что дополнительно создает условия для образования тромбов в просвете вен. Частота развития венозных тромбозов, тромбоэмболических осложнений на фоне беременности составляет 0,7—1,3 на 1000, что почти в 10 раз выше, чем среди небеременных женщин фертильного возраста [9]. Кроме того, на фоне тромбофилии происходят и изменения в плаценте: нестойкость баланса гемостаза в системе мать—плацента возникает в течение осложненной беременности, когда под влиянием ряда факторов появляются многочисленные повреждения эпителиального покрова ворсин плаценты, приводящие к нарушению щеточной каймы, оголению базального слоя и даже стромы ворсин и высвобождению дополнительных плацентарных коагулирующих факторов [27]. Последнее сопровождается активацией внешней системы свертывания, а в дальнейшем запускает внутренний путь коагуляции материнской крови в межворсинчатом пространстве.
Важным открытием XX века явилось признание роли тромбофилии в развитии таких осложнений, как привычное невынашивание беременности, синдром задержки роста плода, преждевременная отслойка плаценты, неразвивающаяся беременность, антенатальная гибель плода [28, 29]. Если ранее в качестве причин антенатальных потерь рассматривались в основном хромосомные, анатомические, эндокринные, инфекционные и иммунные факторы, то в настоящее время в отдельную группу причин репродуктивных потерь выделены нарушения в системе свертывания крови — наследственные и приобретенные дефекты гемостаза [30]. Частота самопроизвольных выкидышей в России составляет около 15—20% среди всех желанных беременностей, достигая показателя 40—50% [31] в I триместре, и остается стабильной в первую очередь вследствие многофакторности данной проблемы [32, 33].
Синдром потери плода (СПП) является широким понятием и включает: наличие одного или более самопроизвольных выкидышей в сроке беременности 10 нед и более; мертворождение; смерть недоношенного плода как осложнение преждевременных родов, тяжелого гестоза или плацентарной недостаточности; 3 или более самопроизвольных выкидыша на преэмбриональной или ранней эмбриональной стадии, в том числе неудачные попытки экстракорпорального оплодотворения [40].
Одна из прочих значимых причин данной патологии — антифосфолипидный синдром (АФС). Он может иметь как спорадический, так и наследственный характер. Развитие АФС связывают с носительством локусов DR 4, DR 7, DRw 53, DRB 1 системы HLА [35, 36]. Активное участие в процессе имплантации принимают фосфолипиды клеточных мембран. В норме отрицательно заряженные фосфолипиды на поверхности клеток являются сигналом для разрушения клеток макрофагами и локальной активации свертывания крови. Трофобласт — единственная ткань, клетки которой длительно экспонируют на своей поверхности отрицательно заряженные фосфолипиды. Отрицательно заряженный фосфатидилсерин трофобласта покрыт естественным антикоагулянтом — аннексином V. Аннексин V, известный также как плацентарный антикоагулянтный протеин (PАP I), принадлежит семейству кальцийзависимых белков, связывающих фосфолипиды. Сродство аннексина V к фосфолипидам в 1000 раз выше, чем протромбина. В основе патогенеза АФС лежит процесс тромбообразования, индуцируемый взаимодействием антифосфолипидных антител (АФА) с фосфолипидами мембран тромбоцитов, эндотелия и фосфолипидсвязанными белками плазмы. Основной фракцией АФА являются антикардиолипиновые антитела (АКА). Эти антитела обнаруживаются при различных аутоиммунных заболеваниях. Число случаев обнаружения АКА у женщин с привычным невынашиванием беременности в России составляет 28—31%. Антитела к b2-ГП 1 могут относиться к классам G, M и, А [37]. АФА напрямую взаимодействуют с синцитиотрофобластом и цитотрофобластом и ингибируют межклеточное слияние клеток трофобласта. Среди АФА клинически наиболее значимыми являются волчаночный антикоагулянт (ВА), антитела к кофактору b2-ГП 1, антитромбиновые антитела и антитела к аннексину V. Повреждающее действие АФА могут осуществлять несколькими путями: изменяются адгезивные характеристики предымплантационного эмбриона; нарушается слияние синцития; снижается глубина инвазии трофобласта; подавляется продукция хорионического гонадотропина; усиливаются тромботические тенденции за счет предоставления матриц для реакций свертывания. Последний фактор объясняет положительный эффект от антикоагулянтной терапии с самых ранних сроков беременности. Эти механизмы также позволяют объяснить неудачные попытки искусственного оплодотворения и пересадки эмбриона у женщин с АФА. Циркуляция АФА чаще обнаруживается у пациенток с ранними выкидышами — у 43,1% [38], при поздних выкидышах — у 22,4% и при ранних преэмбрионических потерях — у 35,7% [39]. Риск потери плода у женщин с ВА и/или АФА может достигать 28% в отличие от 7% в общей популяции [40].
Частота преждевременной отслойки нормально расположенной плаценты (ПОНРП) имеет тенденцию к повышению и в настоящее время составляет 0,3—0,4% от всех родов.
Отслойка плаценты служит проявлением системной, иногда скрыто протекающей патологии у беременных. Изменения гемостаза — причина и следствие ПОНРП. В развитии ПОНРП большое значение придают АФС, генетическим дефектам гемостаза, описанным ранее, предрасполагающим к тромбозам. Тромбофилия, развивающаяся вследствие этих нарушений, препятствует полноценной инвазии трофобласта, способствуя дефектам плацентации [41].
Нарушения гемостаза могут возникать вследствие ПОНРП, например острая форма ДВС-синдрома [42], приводящая к массивному кровотечению и развитию ПОНРП. Ситуация характерна для центральной отслойки, когда в области скопления крови повышается давление, возникают условия для проникновения клеток плацентарной ткани, обладающих тромбопластическими свойствами, в материнский кровоток.
Фетоплацентарная недостаточность — симптомокомплекс, при котором возникают различные нарушения как в плаценте, так и у плода. Данная патология имеет широкий спектр нарушений, которые зависят от срока беременности, силы, длительности и характера воздействия повреждающего фактора, а также от компенсаторных возможностей системы мать—плацента—плод. Данная проблема является мультифакторной, и один из этих факторов — гиперкоагуляционные нарушения, проявлением которых служит нарушение функции питания и, как следствие, развитие синдрома задержки роста плода [43].
Роль гиперкоагуляционных нарушений в течении и прогрессировании многих заболеваний определяет важность изучения данной проблемы, особенно в области акушерства и гинекологии. Многие аспекты данной проблемы описаны и изучены, ежегодно множество научных статей и разборы клинических случаев приближают к полному пониманию данной проблемы, однако риски неблагоприятного исхода беременности при недостаточном внимании к данной патологии очень велики, поэтому проведение своевременной диагностики и правильно назначенное лечение способны спасти множество жизней и семей.
Авторы заявляют об отсутствии конфликта интересов.
Authors declare lack of the conflicts of interests.
*e-mail; https://orcid.org/0000-0001-8117-9054