Общий артериальный ствол (ОАС) относится к сложным врожденным порокам развития сердца и сосудов, при котором от сердца отходит только единственный, не разделившийся на легочную артерию и аорту, общий кровеносный сосуд, разносящий кровь по малому и по большому кругу кровообращения, и приводящий к глубоким гемодинамическим нарушениям. Этот аномальный для уже родившегося ребенка сосуд во время внутриутробного развития и называют общим артериальным стволом.
Такой сложный порок сердца и сосудов встречается у 2-3% пациентов с врожденными пороками, и он всегда сочетается с такой аномалией как дефект межжелудочковой перегородки. Нередко ОАС сочетается с другими пороками развития сосудов и сердца: открытый атриовентрикулярный канал, аномальный дренаж легочных вен, коарктация аорты, один желудочек, атрезия митрального клапана и пр. Кроме этого, такой аномалии могут сопутствовать и внекардиальные пороки формирования скелета, мочеполовой или пищеварительной системы.
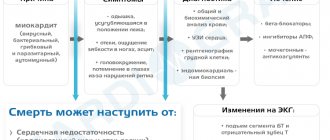
Клинические проявления ОАС выражаются в двух синдромах: сердечная недостаточность застойного характера и артериальная гипоксемия. При этом пороке развития сердца симптомы глубоких нарушений гемодинамики начинают проявляться сразу после рождения, и если сужение устья легочной артерии отсутствует, то состояние новорожденного оценивается как критическое уже с первых минут его жизни. Около 75% детей с ОАС погибают до достижения первого года жизни, и у 65% из них смерть наступает до 6 месяцев. Летальный исход при общем артериальном стволе вызывается переполненностью легочных сосудов кровью и тяжелой сердечной недостаточностью.
Лечение при ОАС может быть только хирургическим и должно проводиться в первые же месяцы жизни ребенка. Нередко больных, которым исполнилось 2-3 года, оперировать уже поздно и они, как правило, могут дожить только до 10-15 лет. При отсутствии своевременно выполненного кардиохирургического вмешательства менее 10% больных доживают до 20-30 лет.
В этой статье мы ознакомим вас с предположительными причинами, разновидностями, симптомами, механизмами нарушения гемодинамики, способами выявления и лечения общего артериального ствола. Эта информация поможет вам понять суть заболевания, и вы сможете задать своему лечащему врачу возникшие вопросы.
Причины
Вредные привычки будущей матери существенно повышают риск развития пороков сердца у плода
Как и все врожденные пороки сердца, возникновение ОАС способны провоцировать негативные факторы, влияющие на организм беременной и плода. Особенно опасно их воздействие на 3-9 неделе вынашивания плода, так как именно в этот период происходит эбрионогенез сердца будущего ребенка.
К таким неблагоприятным факторам относят:
- генетические нарушения;
- инфекционные агенты (вирусы Коксаки В, герпеса, краснухи, гриппа, энтеровирус и др.);
- вредные привычки будущей матери (курение, прием наркотиков и алкоголя);
- неблагоприятная экология (электромагнитное излучение, радиация, токсические выбросы и пр.);
- профессиональные вредности;
- прием некоторых лекарственных препаратов;
- заболевания беременной (особенно сахарный диабет, аутоиммунные реакции).
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
УЗИ сканер RS80
Эталон новых стандартов!
Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
В многочисленных исследованиях зарубежных и отечественных коллег неоднократно формулировались и изучались различные группы риска по возникновению ВПС. Это делалось для того, чтобы потенциально сузить группу беременных женщин, которым показана эхокардиография в специализированном центре. Среди этих групп риска выделяли:
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): «Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга».
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира — это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки — в I триместре беременности [5-8]. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или «белого» журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат «перу» специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды — в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
Рис. 1.
Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Рис. 2.
Беременность 12 недель. Срез через три сосуда. Визуализируются аорта, легочной ствол. Сосуды расположены в одну линию и имеют нормальные размеры.
Рис. 3.
Беременность 8 недель. Эктопия сердца. Сердце расположено снаружи грудной полости.
Случай опубликован на сайте www.thefetus.net.
Рис. 4.
Беременность 13 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца. Положение атриовентрикулярных клапанов.
Расширенная эхокардиография предполагает применение дополнительных режимов и срезов — среза через дугу аорты (рис. 5), среза через выносящий тракт левого желудочка (рис. 6), режима ЦДК (рис. 7), импульсной допплерометрии, технологии STIC (рис. 8-11). Это обследование проводится при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА [расширение толщины воротникового пространства — ТВП, гипоплазия/отсутствие носовой кости (рис. 12, 13), регургитации в венозном протоке (рис. 14), трикуспидальной регургитации (рис. 15)] и/или врожденных пороков развития плода.
Рис. 5.
Беременность 13 недель. Срез через дугу аорты. Отчетливо видны три плечеголовных сосуда, отходящих от дуги.
Рис. 6.
Беременность 12 недель. Тетрада Фалло. Режим ЦДК. Срез через выносящий тракт левого желудочка. Видна «аорта-наездница», сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.
Рис. 7.
Беременность 13 недель. Двойной выход сосудов из правого желудочка. Режим ЦДК. Параллельный выход сосудов из правого желудочка.
Рис. 8.
Беременность 12 недель. Атриовентрикулярная коммуникация (АВК) при синдроме Дауна. Режим STIC.
Рис. 9.
Беременность 12 недель. Тетрада Фалло. Режим STIC. Аорта «наездница», сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.
Рис. 10.
Беременность 13 недель. Транспозиция магистральных сосудов. Режим STIC. Виден параллельный ход выносящих сосудов, верхний из которых выходит из левого желудочка и делится на бифуркацию (легочная артерия).
Рис. 11.
Беременность 12 недель. Общий артериальный ствол. Режим STIC. Виден единый выносящий сосуд из двух желудочков.
Рис. 12.
Беременность 11,4 недель. Множественные маркеры ХА. Синдром Патау (трисомия 13). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости, протуберансом на верхней челюсти (признак расщелины лица), полидактилия. У плода выявлена гипоплазия левых отделов сердца.
Рис. 13.
Беременность 12 недель. Множественные маркеры ХА. Синдром Дауна (трисомия 21). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости. У плода выявлена АВК.
Рис. 14.
Беременность 12 недель. Реверсный кровоток в венозном протоке у плода с гетеротаксией.
Рис. 15.
Беременность 12 недель. Трикуспидальная регургитация у плода с общим артериальным стволом.
Нозология выявленных нами ВПС была следующей:
- синдром гипоплазии левых отделов сердца (СГЛОС) — 29 случаев (рис. 16);
- атриовентрикулярная коммуникация (АВК) — 23 (рис. 17, 18);
- дефект межжелудочковой перегородки (ДМЖП) — 19 (рис. 19);
- патология магистральных сосудов — 19 (из них транспозиция — 3, двойное отхождение сосудов из правого желудочка — 2, тетрада Фалло — 5, общий артериальный ствол — 9);
- патология правых отделов сердца (патология трикуспидального клапана) — 3;
- синдром гетеротаксии — 6;
- единственный желудочек — 4;
- эктопия сердца — 7;
- сочетанные формы ВПС встретились в 15 случаях.
Рис. 16.
Беременность 13 недель. Синдром гипоплазии левых отделов сердца у плода с синдромом Тернера (45Х). Единый поток через трикуспидальный клапан. Сброс крови в гипоплазированный левый желудочек через ДМЖП.
Рис. 17.
Беременность 11,4 недель. Четырехкамерный срез сердца. Единый атриовентрикулярный клапан. Отсутствует «крест» нормального взаимоотношения атриовентрикулярных клапанов и сердечных перегородок.
Рис. 18.
Беременность 11,4 недель. Четырехкамерный срез сердца. Режим ЦДК. Единый атриовентрикулярный клапан.
Рис. 19.
Беременность 12 недель. Режим ЦДК. Обширный ДМЖП у плода с синдромом Эдвардса (трисомия 18).
При кариотипировании плодов с пренатально установленным диагнозом ВПС в 11-14 недель было диагностировано 68 хромосомных аномалий:
- трисомия 21 (синдром Дауна) выявлена в 23 (34%) случаях,
- трисомия 18 (синдром Эдвардса) — в 19 (28%);
- трисомия 13 (синдром Патау) — в 7 (10%);
- моносомия Х (синдром Тернера) — в 6 (9%);
- триплоидия — в 8 (12%);
- другие хромосомные дисбалансы — в 5 (7%).
Особо следует отметить, что в 8 случаях обнаруженных ХА показанием к кариотипированию было выявление ВПС. У этих плодов было нормальное значение как ТВП, так и длины носовой кости.
При ХА выявленные ВПС по нозологии имели следующие особенности: у большинства плодов с синдромом Дауна диагностировались АВК и ДМЖП; с синдромом Патау — СГЛОС и ДМЖП; с синдромом Эдвардса — ДМЖП, тетрада Фалло и ОАС; при синдроме Тернера — СГЛОС и патология аорты — коарктация аорты в типичном месте (рис. 20).
Рис. 20.
Беременность 12 недель. Срез через дугу аорты. Режим ЦДК. Сужение аорты в «типичном» месте у плода с синдромом Тернера (45Х).
Необходимо отдельно рассмотреть вопрос верификации ультразвукового диагноза. Все беременности с изолированными ВПС в I триместре пролонгировались до срока II триместра, когда возможна 100% морфологическая верификация диагноза. В современных условиях верификация диагнозов после прерывания беременности в I триместре представляет довольно значимую проблему. Однако при специализированном обучении специалистов-морфологов верификация ВПС возможна и при прерывании беременности в I триместре (рис. 21, 22). Это, несомненно, зависит от качества полученного материала, квалификации морфолога и специального оборудования, необходимого в некоторых случаях, а также от общих методологических подходов к анатомо-морфологической диагностике независимо от срока гестации.
Рис. 21.
Беременность 13 недель. Увеличенная ТВП у плода с гипоплазией левых отделов сердца.
Рис. 22.
Тот же плод. Морфологическое обследование — гипоплазия восходящей аорты и кистозные полости (отмечены стрелками).
Заключение
Из сказанного выше можно сделать следующие выводы.
Сердце плода необходимо оценивать у всех беременных при скрининговом осмотре в I триместре (11-14 нед). Так как современная концепция развития пренатальной диагностики в рамках «пилотного» проекта МЗ РФ подразумевает скрининговое обследование в I триместре врачом-экспертом, именно он и должен оценить сердце плода и заподозрить ВПС уже в конце I триместра беременности.
Для исключения летальной и клинически значимой сердечной патологии в I триместре обязательна оценка четырехкамерной проекции сердца плода и среза через три сосуда.
Расширенная эхокардиография должна проводиться при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА и/или ВПР плода.
При выявлении ВПС в I триместре показано кариотипирование плода.
Литература
- Office for National Statistics. Mortality Statistics. Childhood, Infancy and Perinatal. Series DH3. Stationary Office: London, 2007; 40.
- Новикова И.В., Прибушеня О.В., Румянцева Н.В. Формирование групп риска по дородовой диагностике врожденных пороков сердца. Инструкция по применению. Минск, 2004.
- Carvalho J.S., Moscoso G., Tekay A. et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart. 2004; 90: 921-926.
- Becker R., Wegner R.-D. Detailed screening for fetal anomalies and cardiac defects at the 11-13 week scan. Ultrasound Obstet Gynecol 2006; 27; 613-618.
- Allan L.D., Sharland G.K., Milburn A. et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol 1994; 23: 1452-1458.
- Huggon I.C., Ghi T., Cook A.C. et al. Fetal cardiac abnor-malities identified prior to 14 weeks’ gestation. Ultrasound. Obstet. Gynecol. 2011; 20: 22-29.
- Persico N., Moratalla J., Lombardi C.M. et al. Fetal echocardiography at 11-13 weeks by transabdominal high-frequency ultrasound Ultrasound Obstet. Gynecol. 2011; 37: 296-301
- Allan L.D. Echocardiographic detection of congenitalheart disease in the fetus: present and future. Br. Heart. J. 1995; 74: 103-106.
УЗИ сканер RS80
Эталон новых стандартов!
Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Разновидности
В зависимости от места расположения ОАС относительно желудочков сердца выделяется три варианта:
- в основном над правым желудочком – почти у 42% больных;
- в равной мере и над правым, и над левым желудочком – почти у 42% больных;
- в основном над левым желудочком – примерно у 16% больных.
В зависимости от места отхождения легочных артерий кардиологи выделяют четыре основных типа ОАС:
- I – от единого артериального ствола ответвляется ствол легочной артерии и разделяется на левую и правую легочную артерию;
- II – обе легочные артерии ответвляются от поверхности задней стенки единого артериального ствола;
- III – обе легочные артерии ответвляются от поверхности боковых стенок единого артериального ствола;
- IV – легочных артерий нет, а доставка крови в легкие осуществляется ответвляющимися от аорты бронхиальными артериями.
IV тип ОАС сейчас рассматривается кардиологами как одна из тяжелых форм тетрады Фалло.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Нарушения гемодинамики
ОАС формируется у плода на 5-6 неделе беременности. Под воздействием неблагоприятных факторов на этом сроке не происходит разделение единого ствола на основные сосуды – легочную артерию и аорту. Между ними не появляется нормальная перегородка, и они продолжают сообщаться друг с другом.
Общий ствол доставляет кровь в оба желудочка сердца, и этот процесс приводит к смешиванию венозной крови с артериальной. При этом давление остается одинаковым в артериальном стволе, сердечных камерах и легочных артериях.
При ОАС всегда присутствует дефект в перегородке между желудочками. Кроме этого, при задержке развития других перегородок сердечных камер сердце может иметь только 2 или 3 отдела. Клапан, находящийся в артериальном стволе, может иметь 1, 2, 3 или 4 створки.
Равное давление в сердечных камерах, легочной артерии и аорте вызывает перенаполнение сосудов в легких и быстрое нарастание сердечной недостаточности, которая в определенный момент провоцирует наступление смерти. У выживших детей такие глубокие гемодинамические нарушения вызывают развитие выраженной легочной гипертензии.
При присутствии сужения легочной артерии перегрузка легочных сосудов не происходит, но создается градиент давления в варианте «аорта – ствол легочной артерии». Такое изменение гемодинамики приводит к развитию право- и левожелудочковой недостаточности.
В зависимости от формы ОАС гемодинамические нарушения могут происходить в трех вариантах:
- нормальный или несколько усиленный кровоток в легких с нерезко выраженным сбросом крови – проявляется возникновением цианоза при нагрузках и не сопровождается сердечной недостаточностью;
- снижение легочного кровотока из-за стеноза устья легочной артерии – проявляется постоянным цианозом из-за нарушения обогащения крови кислородом;
- усиленный легочный кровоток и повышение давления в легочных сосудах – выражается в легочной гипертензии и недостаточности сердечной деятельности, которые не корректируются проводимой терапией.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
- Уменьшение диаметра аорты при расширении лёгочного ствола можно говорить об гипоплазии (недоразвитости) левых отделов сердца малыша, отвечающих за начало кровообращения;
- Уменьшение ствола лёгочной артерии в размерах при сохранении в норме диаметров аорты и верхней полой вены указывает на стеноз (сужение) лёгочной артерии. У плода выявляются только выраженные формы;
- Маленький диаметр аорты при нормальном 4-камерном строении сердца является следствием коарктации аорты (сужение аорты сердца в определённом сегменте);
- Визуализация 2 сосудов вместо 3 может быть следствием соединения сосудов в общий артериальный ствол;
- Смещение аорты вперёд или правее лёгочной артерии наблюдается при транспозиции магистральных сосудов;
- Диаметр аорты расширен, но при этом сужен диаметр лёгочной артерии, а аорта смещена вперёд. Это может является тетрадой Фалло (очень тяжёлая сочетанная аномалия сердца). Проблема включает в себя стеноз или гипертрофию выходного отдела правого желудочка, дефект межжелудочковой перегородки, декстропозицию аорты (отхождение в правую сторону). Диагностика плода крайне затруднительна, поэтому на помощь приходит допплеровский режим, помогающий визуализировать поток крови в аорту из обоих желудочков;
- Гипоплазия (недоразвитость) правых камер сердца определяется по уменьшению их размеров относительно левых камер. Эта патология сопровождается обычно дисплазией (провисанием или выбуханием) митрального клапана;
- Общий предсердно-желудочковый канал виден как дефект перегородки сердца с расщеплением атриовентрикулярного клапана;
- Гипопластический синдром левых отделов сердца проявляется в виде недоразвития желудочка и митрального и аортального клапанов;
- Единственный желудочек также не является нормой, потому что их должно быть два и они хорошо просматриваются в четырёхкамерном срезе;
- При недоразвитости трёхстворчатого клапана кровь из правого предсердия не попадает в левое, что хорошо видно при допплеровском исследовании;
- Со 2 триместра фиброэластоз эндокарда визуализируется как утолщение миокарда и ухудшении его сокращения;
- Недоразвитие миокарда одного из желудочков (аномалия Уля) заметна на 2 триместре.
Симптомы
Клинические симптомы этого врожденного порока сердца и сосудов выражаются в артериальной гипоксемии, проявляющейся цианозом, и сердечной недостаточности. Выраженность этих явлений зависит от типа ОАС.
При таком врожденном пороке сердца могут присутствовать следующие симптомы:
- возникающая в покое одышка;
- чрезмерная потливость;
- снижение выносливости;
- цианоз (от минимального до значительного);
- учащенный пульс;
- увеличение печени и селезенки;
- отставание в физическом развитии;
- «сердечный горб» (присутствует не всегда);
- деформация пальцев рук в виде «барабанных палочек» и ногтей по типу «часовых стекол».
При I типе ОАС синюшность выражена в легкой форме, а при II-III типах она проявляется в большей мере, но признаки сердечной недостаточности выявляются не всегда.
При осмотре пациента врач может обнаружить следующие симптомы ОАС:
- увеличение пульсового давления;
- усиление сердечного толчка;
- одиночный и громкий II тон и щелчок изгнания;
- голосистолический шум по левому краю грудины с интенсивностью 2-4/6;
- убывающий диастолический шум в III межреберье слева от грудины (при клапанной недостаточности артериального ствола);
- выслушиваемый на верхушке шум на митральном клапане в середине диастолы (не всегда).
Диагностика
Подозрение на данную патологию возникнет еще в период беременности, а точнее, на позднем ее сроке при прохождении женщиной УЗИ
Подозрение на присутствие ОАС у плода может возникать при проведении УЗИ на 24-25 неделе беременности. Нередко женщинам при обнаружении такой патологии у будущего ребенка рекомендуется прервать беременность, так как даже своевременно выполненные операции по коррекции ОАС не всегда успешны. Кроме этой аномалии развития, примерно у половины плодов выявляются экстракардиальные пороки (аномалии костного скелета, пищеварительной или мочеполовой системы, синдром Ди Джорджи).
Заподозрить наличие ОАС у новорожденного помогает выявление вышеописанных симптомов и данные физикального осмотра ребенка. Для уточнения диагноза назначаются следующие методы обследования:
- рентгенография грудной клетки – определяется шаровидная форма сердца, расширенные тени ветвей легочной артерии и магистральных сосудов, гипертрофия и увеличение объема желудочков;
- ЭКГ – выявляется отклонение ЭОС вправо и перегрузка желудочков сердца;
- фонокардиография – определяются отклонения в тонах и шумы в сердце (громкий II тон, систолический, а иногда и диастолический, шум);
- Эхо-КГ – выявляется соединение легочных артерий с ОАС;
- катетеризация сердца – при таком врожденном пороке катетер легко проникает в ОАС, в желудочках, аорте и легочной артерии определяется одинаковое давление, а при сужении легочной артерии присутствует градиент давления;
- ангиокардиография – рентгенография с контрастом выявляет специфические аномалии развития сосудов, увеличение объемов желудочков и правого предсердия, нечеткость и необычность структуры корней легких и усиление или объединение рисунка легких;
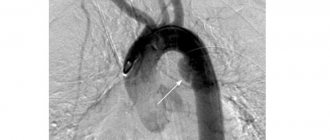
- аортография – это рентгенологическое исследование с контрастированием определяет уровень отхождения легочной артерии и оценивает состояние клапанных створок.
Наиболее информативной процедурой в обследовании новорожденных является ангиокардиография, позволяющая оценить тип ОАС. Данные всех исследований дают врачу возможность составить правильный план лечения и определить объем необходимой хирургической коррекции.
Аномалии положения сердца плода
Содержание статьи
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла – сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Лечение
ОАС может устраняться только хирургическим путем. Консервативное лечение при таком пороке развития сердца неэффективно и назначается для поддержания состояния больного до проведения кардиохирургического вмешательства.
Консервативная терапия
Цель такого лечения направлена на следующие аспекты:
- снижение физической активности;
- обеспечение температурного комфорта;
- снижение объема циркулирующей крови;
- устранение симптомов сердечной недостаточности.
Больному могут назначаться такие лекарственные препараты:
- диуретики;
- Дигоксин;
- ингибиторы АПФ.
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
- дефект межпредсердной перегородки;
- дефект межжелудочковой перегородки;
- транспозиция главных артерий.
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter