Термин кардиомиопатия (КМП) — собирательное название для множества заболеваний миокарда, связанных с нарушением его структуры и функции, не связанных с артериальной гипертонией, нарушением кровоснабжения и заболеваниями клапанов.
Чаще всего кардиомиопатия проявляется патологическим утолщением сердечной мышцы (гипертрофическая кардиомиопатия) или расширением сердечных камер (дилатационная кардиомиопатия) из-за генетических мутаций или других причин.
1
Узи сердца при кардиомиопатии
2 Холтер при кардиомиопатии
3 Диагностика при кардиомиопатии
Классификации кардиомиопатий
Классификация кардиомиопатий по происхождению
По происхождению различают первичную (заболевания миокарда неясного генеза) и вторичную кардиомиопатию (причина поражения миокарда известна или связана с заболеваниями других органов).
Причины первичной кардиомиопатии:
- Генетические нарушения;
- вирусные инфекции (Коксаки и др.);
- замещение сердечной мышцы соединительной или жировой тканью.
Причины вторичной кардиомиопатии:
- эндокринные нарушения (тиреотоксикоз, сахарный диабет);
- интоксикации (токсическая, алкогольная и др.);
- стресс (кардиомиопатия такоцубо).
Классификация кардиомиопатии по клиническим признакам (основные формы):
Дилатационная кардиомиопатия — наиболее тяжелая и распространенная. При этом заболевании имеет место кардиомегалия — значительное увеличение полостей миокарда. В результате сердце теряет способность полноценно перекачивать кровь. Дилатационная КМП неизбежно приводит к развитию сердечной недостаточности.
Перипартальная (послеродовая) кардиомиопатия — одна из разновидностей дилатационной кардиомиопатии. Как ни парадоксально, развитие у женщины сердечной недостаточности и характерных для нее симптомов — практически основной признак перипартальной формы. Среди других распространенных вариантов — алкогольная.
Гипертрофическая кардиомиопатия (ГКМП) — одна из главных причин внезапной смерти у молодых, физически активных людей (спортсменов, военнослужащих). Эта кардиомиопатия связана с утолщением миокарда (гипертрофия сердечной мышцы). Рост толщины стенки опережает развитие сосудов и как следствие-нарушается кровоснабжение мышцы сердца, также страдает наполнение желудочков кровью.
ГКМП чаще встречается у мужчин.
Обструктивная кардиомиопатия (субаортальный подклапанный стеноз) -разновидность гипертрофической кардиомиопатии, при которой ограничен кровоток, проходящий в аорту из левого желудочка, локально утолщенной межжелудочковой перегородкой.
Рестриктивная кардимиопатия — редкая патология, при которой ухудшаются эластичные свойства сердечных стенок. Миокард теряет способность к растяжению и расслаблению, что нарушает его способность наполняться кровью. Итогом становится застой крови в венах и нехватка ее в артериях. Вероятная причина этого — аномальное разрастание соединительной ткани.
Аритмогенная правожелудочковая кардиомиопатия (болезнь Фонтана) — сопровождающаяся жизнеугрожающими аритмиями.
Аритмогенная КМП может стать причиной желудочковой аритмии у детей и молодых людей с внешне неизмененным сердцем, а также у более взрослых пациентов. Исходом этого заболевания часто является внезапная смерть, особенно в молодом возрасте.
Кардиомиопатия такоцубо (синдром разбитого сердца) — весьма редкое заболевание, при котором развивается внезапное преходящее снижение сократимости миокарда. Форма левого желудочка из-за патологического расширения внешне уподобляется такоцубо — ловушке для осьминогов в Японии (именно в этой стране данный синдром был обнаружен и описан).
КМП такоцубо является причиной острой сердечной недостаточности. Чаще выявляется у женщин в постменопаузе, развивается на фоне тяжелого психоэмоционального потрясения. На ЭКГ может маскироваться под инфаркт миокарда.
1 Анализы при кардиомиопатиях
2 Диагностика кардиомиопатии
3 ЭКГ при кардиомиопатиях
Перипартальная кардиомиопатия (Кардиомиопатия Мидоуса, Перипартальная болезнь)
Консервативная терапия
После подтверждения диагноза больных обязательно госпитализируют в кардиологический стационар. При тяжелой недостаточности кровообращения показан перевод в отделение реанимации и интенсивной терапии для проведения внутриаортальной балонной контрпульсации. Несмотря на быстропрогрессирующее течение, почти у половины пациенток наблюдается спонтанное выздоровление.
Немедикаментозное лечение включает ограничение приема жидкости до 2 литров в сутки и поваренной соли до 3-4 граммов в сутки. При назначении лекарственной терапии беременным необходимо учитывать потенциальный нежелательный эффект некоторых медикаментов на плод. Рекомендованы:
- Агонисты дофаминовых рецепторов.
Препараты действуют на главное патогенетическое звено ПКМП. Подавляя выработку пролактина, они снижают образование его кардиотоксического фрагмента (16кДа). У беременных применяется бромокриптин, после родов возможен перевод на каберголин или хинаголид. - Ингибиторы АПФ.
Основные лекарственные средства, замедляющие прогрессирование сердечной недостаточности. - Бета-адреноблокаторы.
Назначаются как альтернатива ингибиторам АПФ беременным женщинам, а также при наличии тахиаритмий. - Вазодилататоры.
Сосудорасширяющие медикаменты используются для снятия вазоспазма при систолическом давлении более 110 мм рт. ст. - Диуретики.
С целью уменьшения застойных явлений в легких и выведения жидкости применяются тиазидные и петлевые мочегонные препараты. - Сердечные гликозиды.
Для поддержания адекватного сердечного выброса при артериальной гипотензии показаны дигоксин, левосимендан. - Антикоагулянты.
Так как дилатация сердечных полостей сопровождается высоким риском тромбообразования, пациенткам рекомендован прием антикоагулянтов (варфарина, ривароксабана). Беременным разрешен только гепарин.
Хирургическое лечение
При выраженной ХСН (фракция выброса левого желудочка достигает менее 40%), развившейся у беременных, требуется прерывание беременности путем кесарева сечения. Крайне тяжелая, резистентная к консервативной терапии перипартальная кардиомиопатия служит показанием к трансплантации сердца. При устойчивых тахиаритмиях, сопровождающихся грубыми гемодинамическими нарушениями (критическое падение артериального давления), прибегают к имплантации кардиовертера-дефибриллятора.
Симптомы кардиомиопатии
К сожалению, кардиомиопатия может длительно протекать без всяких признаков, чтобы затем проявиться симптомами, общими для многих кардиологических заболеваний:
- одышка при незначительных физических усилиях, ходьбе;
- аритмии;
- боли в области сердца;
- постоянный упадок сил;
- головокружения;
- обморочные состояния.
Зачастую заподозрить именно кардиомиопатию можно лишь тогда, когда болезнь уже находится в стадии декомпенсации и налицо все симптомы сердечной недостаточности:
- одышка даже в покое;
- наличие отеков на ногах;
- асцит (накопление жидкости в брюшной полости живота), увеличение печени и др.;
- мерцательная аритмия и другие виды аритмий;
- кашель, усиливающийся в лежачем положении;
- приступы удушья;
- отек легких.
1 УЗИ сердца при кардиопатии
2 ЭКГ при кардиомиопатиях
3 Анализы крови при карддиомиопатии
Перипартальная (связанная с беременностью и родами) кардиомиопатия (ППКМП) является редким заболеванием, развивающимся у женщин в последний месяц беременности или через 5 мес после родов. Описаны случаи ее развития ранее чем за 1 мес до родов [26].
Ряд авторов [2, 3, 17] считают ППКМП одной из форм дилатационной кардиомиопатии (ДКМП), протекающей с левожелудочковой сердечной недостаточностью (СН).
Критериями диагностики данной патологии являются:
1) развитие СН в последний месяц беременности или через 5 мес после родов;
2) отсутствие или неясность причин СН;
3) отсутствие диагностированного заболевания сердца более чем за 1 мес до родов;
4) признаки нарушения функции левого желудочка по данным эхокардиографии (ЭхоКГ), выражающиеся в снижении фракции выброса (ФВ) [22].
Крайне редким видом поражения миокарда является формирование так называемого некомпактного миокарда, рассматриваемого рядом авторов как самостоятельная нозологическая форма — некомпактная кардиомиопатия (НКМП). В современной литературе описано лишь 7 случаев данной патологии у беременных [18, 19].
Цель данной публикации — знакомство практикующих врачей с вопросами диагностики и дифференциальной диагностики тяжелых заболеваний миокарда у беременных.
Больная П.,
26 лет, первобеременная. Ранее занималась спортом (волейбол, плавание). Отец умер в возрасте 36 лет от ДКМП. С 34-й недели беременности стала отмечать нарастающую одышку при нагрузке, затем — удушье в ночные часы, резкое снижение аппетита, отеки голеней. К врачам не обращалась. Поступила в Московский областной НИИ акушерства и гинекологии в сроке 36 нед беременности. Объективно: состояние тяжелое. Перкуторно определяется кардиомегалия, выслушиваются систолический шум митральной недостаточности, ритм галопа (тахикардия до 120 уд в 1 мин, дополнительный III тон в диастолу), акцент II тона на легочной артерии. АД 90/60 мм рт.ст. Печень отчетливо не пальпируется. Отеки голеней. Клинический, биохимический анализы крови, анализы мочи без патологии.
На ЭКГ (рис. 1):
Рисунок 1. ЭКГ больной П., 26 лет. ритм синусовый, низковольтовая ЭКГ от конечностей, нормальное направление электрической оси сердца. Признаки гипертрофии и дилатации левого предсердия, обоих желудочков. При суточном мониторировании ЭКГ по Холтеру выявлено 2 «пробежки» пароксизмальной желудочковой тахикардии от 3 до 5 комплексов QRS.
При ЭхоКГ (рис. 2 и 3):
Рисунок 2. ЭхоКГ больной П., 26 лет (четырехкамерная позиция). Определяется дилатация левого желудочка. Обозначения слоев: К — компактный миокард; НК -некомпактный миокард (указано стрелкой).
Рисунок 3. Допплерометрическая ЭхоКГ больной П., 26 лет (четырехкамерная позиция). Определяются участки кровотока из полости желудочка в межтрабекулярные углубления в области верхушки и боковой стенки левого желудочка (указано стрелками). дилатация всех камер сердца. Конечный систолический размер (КСР) левого желудочка (ЛЖ) — 7,1 см (норма до 4,3 см), конечный диастолический размер (КДР) ЛЖ — 7,8 см (норма до 5,5 см); размер левого предсердия 4,8 × 8 см (норма 1,85 × 3,3 см). Миокард гипертрофирован, пронизан множественными лакунами, определяются выраженная трабекулярность, гипоплазия сосочковых мышц. Глобальная сократимость миокарда снижена (ФР ЛЖ при динамическом наблюдении колебалась от 18 до 22%). Рестриктивный тип диастолического кровотока. Митральная недостаточность II-III степени. Расчетное давление в правом желудочке 55-60 мм рт.ст. (норма — 25-30 мм рт. ст.).
Результаты компьютерной томографии грудной клетки (рис. 4):
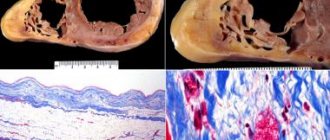
Рисунок 4. Рентгеновская компьютерная томограмма (с введением омнимака) сердца больной П., 26 лет. Общая толщина миокарда 25,3 мм, толщина компактного слоя — 6,1 мм, RA — правое предсердие. правые отделы расширены. Состояние их без особенностей. Полость ЛЖ расширена, стенки резко утолщены, представлены компактным и некомпактным слоями, последний занимает более 2/3 заднелатеральной стенки.
Диагноз: дилатационная кардиомиопатия. Некомпактный миокард. Относительная митральная недостаточность II-III степени. Легочная гипертензия II степени. СН, IV функциональный класс.
Родоразрешена в условиях операционной кардиохирургического стационара Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского с помощью кесарева сечения под регионарной анестезией в сроке 38 нед беременности. Извлечена живая доношенная девочка, массой 3000 г, ростом 49 см, с оценкой по шкале Апгар 7-8 баллов. Лактация прекращена с помощью использования бромокриптина. После родоразрешения соматическое состояние родильницы стабилизировалось, отмечалось исчезновение отеков и одышки. Переведена для долечивания в кардиологическое отделение. Получала терапию сердечными гликозидами, рибоксином, амиодароном, ингибиторами ангиотензинпревращающего фермента (АПФ), салуретиками. Через 1 год внезапно погибла от основного заболевания.
Обсуждение
Развитие выраженной СН у беременных в отсутствие других причин чаще всего связывают с ППКМП. Реальная ее частота неизвестна и зависит от географического региона. Так, она составляет 1:3000-1:4000 родов в США [16], 1:1000 — в Южной Африке, 1:6000 — в Японии, 1:400 — на Гаити, а в Нигерии — 1 на 100 родов [12].
Патогенез ППКМП до конца не изучен. В ее развитии имеет значение комплексное воздействие инфекции, гемодинамической нагрузки во время беременности и генетических факторов. В ряде исследований в генезе развития ППКМП придается значение перенесенному миокардиту. Считается, что вирусная инфекция, перенесенная в детском возрасте, ведет к персистенции вируса, не имеющего патогенетического значения. Однако во время беременности, сопровождающейся снижением иммунитета, возможна реактивация вируса с поражением миокарда [8]. Другая теория рассматривает в качестве причины ППКМП попадание фетальных антигенов в материнский кровоток (фетальный микрохимеризм) на фоне сниженного иммунитета беременной. При данной патологии часто выявляются высокие титры аутоантител против основных белков миокарда [24]. A. Ansari и соавт. [4] в сыворотке крови больных с ППКМП обнаружили высокие титры аутоантител, которые не выявляли у больных с идиопатической ДКМП [4].
В качестве дифференциального диагноза всегда рассматривается ДКМП, которая является одной из наиболее распространенных и необратимых форм кардиомиопатий, встречается с частотой 1:2500 здоровых людей, может носить наследственный характер и в 1/3 случаев служит причиной трансплантации сердца [28]. Однако в представленном клиническом наблюдении развитие СН отчетливо было связано с беременностью, что позволило остановиться на диагнозе ППКМП.
Крайне редким наблюдением является так называемый некомпактный миокард, причем ряд авторов такое состояние сердечной мышцы относят к развитию НКМП, которая является редкой врожденной формой кардиомиопатии ЛЖ, описанной в 1984 г. R. Engberding и F. Bender и характеризуется аутосомно-доминантным типом наследования (в 44%), а также встречается как в качестве самостоятельной формы, так и при других заболеваниях сердца. Например, некомпактный миокард может определяться при миокардите в 12%, при ДКМП — в 52%, а также при других заболеваниях сердца [14]. В качестве механизма НКМП рассматривают нарушение формирования нормального миокарда из эмбрионального губчатого, который в отсутствие коронарного кровотока кровоснабжается из полостей сердца [1]. Хотя процесс чаще всего затрагивает верхушку и нижнюю стенку ЛЖ, он может определяться в любой стенке левого и правого желудочков [10].
Дифференциальные отличия НКМП и ДКМП относятся в большей степени к количественным характеристикам, определяемым при ЭхоКГ, а также к более благоприятной клинической картине и возможности выздоровления после родов при НКМП (см. таблицу).
Критерием плохого прогноза заболевания является соотношение толщины некомпактного и компактного слоев миокарда, превышающее 3:1, вовлечение в процесс более 3 сегментов миокарда, выраженные признаки СН.
Ввиду отсутствия типичных клинических проявлений НКМП основным методом диагноза является ЭхоКГ. Диагностика базируется на следующих основных критериях: наличии, по крайней мере, в 4 местах выраженной трабекулярности и глубоких межтрабекулярных углублений, наличии кровотока из полости желудочка в межтрабекулярные углубления и типичной двухслойной структуры в пораженной части ЛЖ. В диагностике НКМП может быть использована ядерно-магнитная рентгенотомография [15].
Лечение.
Наблюдение и лечение беременных с ППКМП осуществляется кардиологом и акушером-гинекологом специализированного роддома. В лечении используют диуретики (гидрохлоротиазид, фуросемид), уменьшающие выраженность отечного синдрома, застойные явления в легких, а также сердечные гликозиды (дигоксин). Необходимо учитывать, что длительное использование диуретиков может снижать маточно-плацентарный кровоток и способствовать развитию ацидоза у матери, что требует мониторирования кислотно-основного состояния [5]. Из вазодилататоров возможно использование нитропруссида натрия.
Внутривенно вводимые препараты положительного инотропного действия (усиливающие сократимость миокарда) занимают важное место в краткосрочном лечении острой СН, в том числе у беременных. Наиболее часто используемыми препаратами являются агонисты β-адренорецепторов (дофамин, добутамин). Кроме применения перечисленных препаратов, обсуждается вопрос использования у беременных представителя нового класса негликозидных кардиотонических средств, называемых кальциевыми сенситайзерами — левосимендана, основным механизмом действия которого является увеличение чувствительности сократительных белков кардиомиоцитов к кальцию, что приводит к стабилизации конформации тропонина С, запускающего сокращения миофибрилл. Ряд авторов [5, 6] считают, что использование левосимендана позволяет уменьшить степень легочной гипертензии и увеличить сердечный выброс при ППКМП. Однако в рандомизированном исследовании M. Biteker и соавт. [7] не выявлено положительного действия препарата при 24-часовом его применении у данного контингента больных. Кроме того, в экспериментальных исследованиях отмечено его токсическое действие на плод, в связи с чем левосимендан следует назначать беременным женщинам только в случае, если польза для матери превосходит потенциальный риск для плода.
Применение других препаратов положительного инотропного действия (допамина, добутамина) допускается в случаях существенного снижения сердечного выброса, а их отмена осуществляется при стабилизации состояния больной [25]. Использование кардиоселективных β-адреноблокаторов (карведилол) позволяет уменьшить потребление кислорода миокардом, снизить преднагрузку, является безопасным у беременных с ППКМП [22].
Лечение аритмий, осложняющих течение ППКМП, осуществляется по общим показаниям. Возможна имплантация кардиовертера-дефибриллятора (класс рекомендаций IIb, уровень С) [20].
У женщин с ФВ ЛЖ менее 20% или с признаками внутриполостного тромбоза рекомендуется использование нефракционированного гепарина (НГ), низкомолекулярного гепарина (НМГ) или варфарина (C. Nelson-Piercy и соавт., 1997).
Иммуносупрессивная терапия при ППКМП не показана. Существуют единичные работы успешного применения иммуноглобулина при данном заболевании (A. Keogh и соавт., 1994).
Случаи тяжелой ППКМП требуют проведения баллонной контрпульсации или использования искусственного ЛЖ [13]. Положительный результат применения последнего в течение 3-6 мес после родов у женщин с ППКМП позволяет существенно снизить частоту трансплантаций сердца с 33 до 4-7% [9].
Подготовка к родам и родоразрешение
Подготовка к родам беременных с ППКМП включает использование кардиотонических препаратов и препаратов положительного инотропного действия (по показаниям). Родоразрешение осуществляется в условиях кардиохирургического стационара под наблюдением опытного кардиолога и анестезиолога-реаниматолога при постоянном контроле ЭКГ и измерения артериального давления с возможностью проведения баллонной контрпульсации или «включения» искусственного ЛЖ.
Родоразрешение чаще всего осуществляется с помощью кесарева сечения с применением эпидуральной анестезии с медленным подбором дозы анестетика или общей анестезии, которая используется в случаях экстренного родоразрешения [21, 23]. Возможно также использование спинально-эпидуральной анестезии [27].
Послеродовой период.
Восстановление сократительной функции ЛЖ происходит у 23-54% больных с ППКМП и зависит от исходного значения ФВ ЛЖ [9, 14]. Процесс нормализации обычно занимает от 3 до 24 мес. Смертность при ППКМП в США колеблется от 6 до 10%, а 6-месячная и 2-летняя смертность в Южной Африке составляет 10 и 28% соответственно [11, 25]. У женщин, перенесших ППКМП с дальнейшим улучшением ФВ ЛЖ, в послеродовом периоде сохраняется риск развития тяжелой СН и внезапной смерти [17].
Наблюдение и лечение женщин, перенесших ППКМП, осуществляют кардиолог и кардиохирург. Наряду с общепринятыми препаратами, использующимися в лечении СН, в послеродовом периоде возможно применение ингибиторов АПФ. ЭхоКГ-обследование осуществляется через 6 нед и 6 мес после родов, а при показаниях — чаще [25].
В послеродовом периоде у женщин с ФВ ЛЖ менее 30% рекомендуется использование НГ или НМГ (C. Nelson-Piercy и соавт., 1997).
Таким образом, в представленном клиническом наблюдении у беременной выявлено редкое сочетание ППКМП и некомпактного миокарда, возможно, представляющего собой отдельную нозологическую форму, а наследственный характер патологии, тяжелые желудочковые аритмии и отсутствие положительной ЭхоКГ-динамики после родоразрешения обусловили, несмотря на активную медикаментозную терапию, фатальный исход заболевания.
Диагностика кардиомиопатии
Диагностику КМП следует доверять только опытному специалисту, поскольку клиническая картина при различной патологии имеет схожие признаки.
Сначала врач собирает анамнез и осматривает пациента (обращает внимание на цвет кожи, уточняет наличие отеков, измеряет ЧСС и АД, выслушивает сердце и легкие стетоскопом).
Далее назначаются лабораторные и инструментальные исследования:
- анализы крови (клинический, биохимический, гормональный статус, липидограмма и т.д.);
- электрокардиография (ЭКГ);
- холтер-мониторинг ЭКГ;
- эхокардиография (УЗИ сердца);
- рентгенография;
- коронарография;
- МРТ, КТ сердца.
Беременность у пациентов с кардиомиопатией/СН: согласительный документ HFA, ESC
Беременность – состояние, сопровождающееся повышенной нагрузкой на организм женщины. В связи с чем очевидно, что ее наступление может способствовать декомпенсации каких-либо хронических заболеваний, в том числе заболеваний сердца. Кроме этого, и сама по себе беременность может быть фактором одной из форм дилатационной кардиомиопатии – перипортальной кардиомиопатии. В связи с чем эксперты Ассоциации сердечной недостаточности Европейского общества кардиологов приняли решение о необходимости создания консенсусного документа, посвященного стратификации риска и ведению женщин с кардиомиопатиями/заболеваниями сердца, планирующих беременность или беременных. Прежде всего, в документе освещаются общие подходы ведения беременных и кормящих пациенток с сердечной недостаточностью. Подчеркивается, что по-возможности следует пролонгировать беременность до 32 недель. Предпочтительным методом родоразрешения, как и у здоровых беременных женщин, являются вагинальные роды, сопровождающиеся адекватным обезболиванием. В то же время отмечено, что в большинстве случаев при наличии сердечной недостаточности родоразрешение возможно лишь путем операции кесарева сечения. Далее рассматриваются общие вопросы ведения беременных пациенток как с врожденными формами кардиомиопатий (гипертрофическая, аритмогенная дисплазия правого желудочка), так и с приобретенными (перипортальная, дилатационная, синдром такоцубо). Особо актуальным представляется раздел, в котором обсуждаются некоторые аспекты ведения беременных, перенесших ранее лечение по поводу онкологического заболевания, у которых в процессе беременности развилась сердечная недостаточность. Определены факторы риска развития сердечной недостаточности у таких пациенток. Ими являются: снижение фракции выброса левого желудочка <50%, химиотерапия и лучевая терапия онкологического заболевания, диагноз онкологического заболевания в очень молодом возрасте <10 лет, время от момента онкологического заболевания до беременности >15 лет. В целом же очевидно, что какие-либо исследования в этой области практически полностью отсутствуют. В связи с чем решение об оптимальном методе лечения должно приниматься командой специалистов, включающих акушеров-гинекологов и кардиологов. Кроме этого, важным является подробное консультирование таких пациенток при планировании беременности.
Источник:
Sliwa K, et al. Eur J Heart Fail. 2021. doi: 10.1002/ejhf.2133.