Статистический метод. Статистические методы использовались для идентифицирования и оценки факторов риска для следующих прогнозов: ежегодный средний рост аневризмы, частота осложнений (острое расслоение и/или разрыв), смертность и выживаемость в отдаленные сроки.
Анализ выживания. Пятилетние оценки выживания были рассчитаны анализом таблицы жизни (Kaplan-Meier). Различия в выживании были проверены посредством LIFEREG процедуры в версии 6.07 SAS, 1994 (SAS Institute, Inc, Кари Н. С.).
График выживаемости Kaplan-Meier. Пятилетние оценки выживания иллюстрированы для пациентов с грудными аортальными аневризмами (ГАА) против общего (согласованного с возрастом и полом) населения (ОН).
Результаты и обсуждение. Joyce J.W. et al. [21] сообщили о пятилетней выживаемости при аневризмах восходящей грудной аорты с диаметром 6 см или меньше в 61% случаев; аневризмы больше чем 6 см имели пятилетнюю выживаемость в 38% случаях. Полное пятилетнее выживание в нашем ряде наблюдалось в 64% случаев. Смертность, как полагают, будет связана с аневризмой в огромном большинстве случаев, хотя адекватные детали для этого различия были часто недоступны. Выживание значительно ниже при аневризмах нисходящей аорты (39% за 5 лет) (p=0.031). Пациенты с расслоением имели более низкую выживаемость (46% за 5 лет).
Параметры роста. Определенный ежегодный рост для грудных аортальных аневризм составил 0,29 см/год. Это находится в близком соотношении с результатами, о которых сообщает Dapunt O.E. et al. [26] (0,32 см/год). Masuda Y. et al. [27] информировали о норме роста для грудных аортальных аневризм – 0,13 см/год. Hirose Y. et al. [28] приводят высокую ежегодную норму роста – 0,42 см/год для грудных аортальных аневризм. В последующем изучении, однако, Hirose Y. et al. [28] привели существенно более низкую норму.
Несоответствие в двух изучениях [28] может вполне объяснить различные использованные стратегии для оценки роста. В последних исследованиях Hirose Y. [28] применяемые регрессы приближаются к используемым Dapunt O.E. et al. [26] и в текущем изучении, при оценке роста грудной аортальный аневризмы. Более ранними изучениями группой Hirose Y. [28] вычислено, что рост равен различию между последним и первым измеренным размером, разделенным на продолжительность между исследованиями.
Размер традиционно рассматривался как важный фактор риска для осложнений (то есть острого расслоения и/или разрыва) у пациентов с грудными аневризмами, и это считалось самым важным независимым фактором в решении планового хирургического вмешательства. Влияние размера на величину роста аневризм – предмет дискуссий. Dapunt O.E. et al. [26] отмечают, что более интенсивные расширения были найдены у тех пациентов, у которых аортальный диаметр при диагнозе был >5 см. С другой стороны. Hirose Y. et al. [28] не нашли никакого существенного влияния размера на интенсивность ростa.
Dapunt O.E. et al. [26] сообщили, что наличие гипертонии, коррелирует с большим аортальным диаметром, но значительно не затрагивает норму роста аортального расширения. Masuda Y. et al. [27] сообщили о прямой связи между величиной диастолического давления и степенью аортального расширения.
Вероятность осложнений. Важно рассмотреть естественное течение болезни у пациентов с грудными аневризмами, т.е. случаи острого расслоения и/или разрыва у этого контингента. Pressler V., McNamara J.J. [22] сообщили, что у восьми из девяти случаев разрывов нисходящих грудных аортальных аневризм размеры аорты были больше 10 см. В последующих изучениях сообщается об осложнениях при намного меньших размерах. В исследованиях Gott V.L. et al [11], при аневризмах восходящей аорты у пациентов с синдромом Марфана, указывается средний размер – 7,8 см во время расслоения.
Однако у семи из 26 пациентов (26,9%) расслоения наблюдались при размерах аневризм 6,5 см или меньше. Кроме того, Crawford E.S. et al. [9] сообщили о среднем размере во время разрыва – 8,0см среди 117 пациентов с нисходящими грудными и торакоабдоминальными аневризмами. Dapunt O.B. et al. [26] информируют о разрывах грудных аневризм, встречающихся в еще меньших размерах, со средним размером 6,1см.
Эти наблюдения свидетельствуют о расслоениях или разрывах при расширяющихся размерах аневризм. Средним размером во время разрыва или расслоения было 6,0 см для восходящих аневризм и 7,2см для нисходящих. Производился многовариантный ретроспективный анализ с намерением изолировать факторы риска для острого расслоения или разрыва, который показал, что размер больше 6,0 см увеличивает вероятность расслоения или разрыва на 32,1 % для восходящих аневризм (p=0.005). Для нисходящих аневризм, эта вероятность увеличилась на 43 % при размере больше 7,0 см (p=0.006). Frist W.H. et al. [33] выдают следующие данные для восходящих и нисходящих аневризм: 6см для восходящей аорты и 7см для нисходящей.
Критерии для хирургического вмешательства.
Ниже мы попытались продемонстрировать важность грудного размера аневризмы при грозных осложнениях, таких как разрыв и расслоение аорты. Нашими наблюдениями мы пытаемся продемонстрировать четко увеличивающуюся частоту осложнений с увеличением аортального размера. Эти наблюдения показывают, что средний размер при разрыве и расслоении составляет 6,0 см для восходящих аневризм и 7,2 см для нисходящих. Многовариантный анализ факторов риска, влияющих на острое расслоение и/или разрыв, показывает, что размер больше 6,0 см является существенным фактором риска (p=0.005). Логистический анализ указывает 32,1% увеличение вероятности расслоения или разрыва для восходящих аневризм при среднем размере больше 6,0см (p=0.005) и 43,0% увеличение для нисходящих аневризм больше 7,0см (p=0.006).
Эти данные настоятельно требуют применения критерия размера для хирургической замены аневризматической аорты, чтобы предотвратить осложнения разрыва и расслоения. Кроме того, эти данные говорят о том, что следует применять более низкий критерий размера, чем предварительно зарекомендованные.
Если средний размер во время осложнения (в этом случае: 6,0см для восходящей и 7,2см для нисходящей аорты) будет применен как интервенционный критерий, то у половины пациентов во время вмешательства с большой вероятностью будут наблюдаться грозные осложнения. Соответственно, авторы предлагают вмешательство при критериях несколько ниже среднего размера во время осложнения. Предлагается, чтобы хирургическое вмешательство было применено при размере 5,5см для восходящей и 6,5см для нисходящей аортальных аневризм. Эти вышепредложенные критерии позволяют произвести вмешательство перед катастрофически увеличенной вероятностью разрыва и/или расслоения.
Эти рекомендации указывают, что плановая операция намного более безопасна, чем экстренное вмешательство. Для восходящих аневризм и аневризм дуги аорты, плановая операция была весьма безопасна (смертность 4,3%). Эти результаты смертности широко совместимы с теми, о которых сообщают и другие центры. Хотя операция на нисходящей аорте имеет более высокий риск (19%), но количество пациентов в этой категории является относительно меньшим, чтобы влиять на конечный результат.
Множество вышеприведенных данных показали, что операция на восходящей аорте более безопасна. ИК через левопредсердно-бедренную канюляцию с использованием центробежного насоса показал, что он является безопасным и надежным методом для предотвращения п/о осложнений: ишемизированные осложнения типа почечной недостаточности и повреждения спинного мозга. Кроме того, появление ингибитора протеазы (апротинин) п ривело к существенному сокращению потери крови в результате защиты рецепторов стенки тромбоцита в начале ИК. Выпуск пропитанного коллагеном дакронового протеза привел (Hemashield Meadox Medicals Inc, Окленд, N.J.) к улучшению хирургического гемостаза, фактически устраняя кровотечение через стенку протеза. Эти факты говорят в пользу приоритетного избирательного вмешательства для избежания разрыва и расслоения аневризм.
Для нисходящих аортальных аневризм нужно рассмотреть риск параплегии как существенное интраоперационное осложнение. Риск параплегии (спинномозгового генеза) в литературе остается между 2 и 20%, в этом случае составляет 4.0%. Очевидно, что пожилой возраст и сопутствующие болезни могут привести к частым осложнениям, при которых не показано хирургическое вмешательство. Таким образом, каждый пациент должен быть оценен индивидуально, и ожидаемый риск осложнений (особенно параплегия при нисходящих аортальных аневризмах) должен быть взвешен во избежание таких осложнений, как разрыв и расслоение. Кроме того, должен быть принят во внимание уровень врачей в рассматриваемом медицинском центре. Критерии размера, представленные здесь, предложены для менее тяжелых пациентов, вылеченных в более опытных центрах.
Исследования пациентов с синдромом Марфана.
Больше чем 90% смертельных случаев при синдроме Марфана связаны с осложнениями аневризм восходящей аорты. Поскольку большинство пациентов с синдромом Марфана имеет некоторую степень аортальной недостаточности (корень аорты – 6,0см), Готт, Лима и соавторы рекомендуют профилактическое лечение при аневризмах, достигающих 5,5–6,0см. Мы рекомендуем интервенционный критерий 5,0см для пациентов с синдромом Марфана, другими наследственными коллагеновыми заболеваниями сосудов или семейными случаями аортальной недостаточности.
Этот критерий размера несколько ниже, чем рекомендации для вмешательства при атеросклеротических аневризмах восходящей аорты. Опыт показывает, что у нескольких пациентов с синдромом Марфана расслоение или разрыв произошли при размерах меньше 5,0см. Эти молодые больные часто находились в тяжелом клиническом состоянии. Таким образом, профилактическое хирургическое лечение может существенно улучшить их клиническое состояние и прогноз.
Разработка интервенционных критериев – это комплекс исследовательских усилий. Исследование этой проблемы является важным для повышения выживаемости пациентов. Чтобы определить соответствующие критерии размера для вмешательства, мы прибегли к помощи статистического анализа. В этих интервенционных критериях должны учитываться возраст пациента, физическое состояние, ожидаемая продолжительность жизни, то есть приблизиться к критериям вмешательства, используя статистические методы с точки зрения предотвращения осложнений (расслоение и разрыв). Давление органа аневризмой, сопутствующая аортальная недостаточность и острое расслоение аорты являются широко принятыми общими признаками для хирургического вмешательства независимо от аортального размера.
Некоторые точки зрения все еще обсуждаются в хирургии хронической болезни восходящей аорты: какую методику использовать при лечении (открытый или методику обертки, прямая или опосредованная реимплантация коронарных артерий), как предохранять мозг во время восстановления дуги аорты. Когда корень аорты был включен в план операции, обычно исполнялась имплантация клапаносодержащего кондуита, используя методику обертки с реимплантацией коронарных артерий и дакроновый трансплантат (8мм). Только клапанное протезирование не предохраняет от рецидивов аневризмы восходящей аорты, ведя к повторной операции. При этом повторные операции имеют высокую смертность.
Некоторые авторы использовали методику обертки. По поводу кровотечения вероятность ранней повторной операции низка – 4,5% в этом ряде и может быть сравнена с данными Kouchoukos N. (2% — открытая методика). У исследуемых больных не было необходимости повторных операций при псевдоаневризмах восходящей аорты.
Реимплантация коронарных магистралей с использованием дакронового трансплантата (8мм) кажется более надежной и технически легко осуществимой, чем прямая реимплантация или реимплантация с аортальными пуговками. Kouchoukos N. [7] Taniguchi K. et al. [12] сообщается о появлении псевдоаневризм в коронарном устье после этих операций [12,13].
Поэтому есть мнение, что использование дакронового трансплантата предотвращает появление этих осложнений (как показано стандартной коронарографией). Образовавшиеся правопредсердные фистулы закрылись, за исключением одного случая, когда потребовалась повторная операция. В девяти случаях, когда был имплантирован трубчатый графт, была зафиксирована внезапная смерть от неизвестной причины (вскрытие трупов не было выполнено). Возможность ложных аневризм или фистул, приводящих к смерти, не исключалась.
Восстановление дуги аорты всегда показано, когда аневризма переходит на дугу аорты, когда участок расслоения простирается на дугу или когда разрыв интимы локализован на дуге (2 случая в этом ряде). Авторам кажется, что остановка гипотермического ИК приводит к неврологическим осложнениям. Griepp R.B. et al. сообщили о коэффициенте (5,6%) неврологических осложнений у 87 больных [15]. Авторы предпочитают остановку гипотермического ИК при выборочной катетеризации магистральных сосудов головного мозга.
30-дневная смертность отмечалась у 7,6 % больных и 6% — с протезированием (использовались клапаносодержащие кондуиты). Galloway A.C. et al. [6] было сообщено о похожих цифрах летальности, соответственно 5,3 и 5%.
Многие анализы также указывают, что сопутствующая трансплантация коронарных артерий и пожилой возраст являются главными факторами риска, что показано и другими авторами. Выживаемость оставляет желать лучшего у больных, которые подвергаются хирургическому вмешательству при хронической болезни восходящей аорты: 48% за 12 лет у Kouchoukos N.T. et al. [13] и 57% за 7 лет у Culliford A.T. [34]. В этом ряде полное выживание – 59,6%±3,7% за 9 лет для всех больных и 66,3%±4,5% за 9 лет для больных с протезированием клапаносодержащим кондуитом (включена также интраоперационная смертность).
Преобладающая причина поздней смертности не была обнаружена в этом ряде. Факторами, увеличивающими риск, что показано одномерным анализом, являются: время ИК, восстановление дуги аорты, хроническое расслоение аорты и пожилой возраст.
Заключение
Медицинские интернет-конференции
Введение
Атеросклероз и аортальные аневризмы имеют общие факторы риска, но развитие аневризмы связано с прочностными и эластическими свойствами сосудистой стенки аорты. Аневризма аорты – это постоянное локальное или диффузное расширение ее просвета в 2 раза и более по сравнению с неизмененным участком или нормальным диаметром аорты. Первые описания аневризмы брюшной аорты относятся к XVI в. (Везалий), а симптомы разрыва аневризмы брюшной аорты первым описал Laennek. В 1955 г. Etheredge впервые выполнил успешную операцию по поводу торакоабдоминальной аневризмы.
Среди аневризм всех локализаций аневризмы брюшной аорты составляют 29-37,8%. Соотношение частоты встречаемости этого заболевания у мужчин и женщин составляет 5:1. У 95-96% больных аневризмы расположены ниже места отхождения почечных артерий. Основным этиологическим фактором развития аневризм абдоминального отдела аорты является атеросклероз (42-73%) [1, 3].
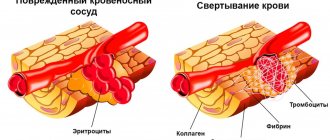
Атеросклероз и аортальные аневризмы имеют общие факторы риска, но развитие аневризмы связано с прочностными и эластическими свойствами сосудистой стенки аорты. При аневризме в стенке аорты наблюдается уменьшение содержания эластина и увеличение коллагена, что приводит к потере прочности стенки аорты, а последующее ее расширение ускоряет развитие атеросклеротического процесса. Согласно закону Лапласа, рост диаметра сосуда увеличивает напряжение стенки, и формирование аневризмы ускоряется, а у лиц с диаметром аорты больше 50 мм рост размера аневризмы составляет на 4,3 мм в год.
Развитие современных методов исследования сопровождается широким внедрением компьютерного моделирования в хирургию различных областей, в частности сердечно-сосудистой хирургию. Знание деформационных и прочностных свойств тканей артериальной сосудистой стенки, а также изменчивость этих свойств с возрастом необходимы для компьютерного моделирования с целью прогнозирования развития возможных осложнений при хирургических реконструктивных вмешательствах [2, 4].
Материалы и методы
Материалом для исследования послужили: 5 нефиксированных аорт с расслаивающей аневризмой брюшного отдела и 10 аорт без макроскопических признаков патологии, изъятых у трупов людей мужского пола (n 15) в возрасте 35-60 лет не позднее первых суток после смерти. Изучали наружный, внутренний диаметры, толщину стенки, протяженность и локализацию аневризматического расширения. Измерения наружного и внутреннего диаметра брюшного отдела аорты проводили по методу Иоффе цифровым штангенциркулем, с шагом 0,5 мм.
Результаты
Средний возраст исследуемых субъектов составил 53±5 лет. В ходе проведенного исследования выявлено, что наружный диаметр аорт при наличии аневризм составил 61,4±0,7 мм, внутренний – 45,5±0,6 мм, при этом толщина стенок достигала 15,5±0,5 мм. При исследовании 10 аорт без макроскопических признаков наличия патологии получены следующие средние значения: на уровне отхождения чревного ствола (№ 1) толщина стенок аорт в среднем составила 2,9±0,3 мм, наружный диаметр – 19,6±0,5 мм, внутренний диаметр – 16,7±0,5 мм. На уровне отхождения почечных артерий (№ 2): толщина стенок аорт составила 3,1±0,4 мм, наружный диаметр – 17,5±0,7 мм, внутренний диаметр – 14,4±0,6 мм. В 3-х см ниже уровня места отхождения почечных артерий (№ 4) при толщине стенок аорты в среднем 3,2±0,4 мм, наружный диаметр составил – 15,5±0,6 мм, внутренний диаметр – 11,4±0,4 мм.
При сравнительном анализе выявлено: толщина стенок пораженной аневризмой аорты превышала значения непораженных аневризмой аорт: на уровне отхождения чревного ствола (№ 1), на уровне отхождения почечных артерий (№ 2), в зоне аневризмы (№ 3) и на 3 см ниже уровня отхождения почечных артерий (№ 4) в 1,7: 1,8: 4,1 и 1,6 раза, соответственно. Наблюдалось также увеличение показателей наружного диаметра на вышеуказанных уровнях: в 1,1: 1,3: 3,3 раза, соответственно, однако уровне № 4 отмечалось его резкое уменьшение – в 2,5 раза. Внутренний диаметр пораженной аневризмой аорты превышал внутренний диаметр непораженных аорт, так его увеличение на уровнях № 2 и № 3 составило 1,2 и 3,2 раза, соответственно. На уровнях № 1 и № 4 наблюдалось сужение внутреннего просвета, уменьшение внутреннего диаметра составило 1,4 и 14 раз.
При проведении натурного эксперимента было выявлено, что модуль Юнга тканей аорты без патологии составил 12 МПа, при наличии аневризмы (в зоне максимальной дилатации аневризмы) – 3,2 МПа, а при поражении стенки аорты атеросклерозом – от 20 до 31 МПа.
Обсуждения
Развитие аневризм брюшной аорты характеризуется изменением морфологических, прочностных и упруго-деформативных свойств ее стенки. Характер снижения данных свойств имеет прямую зависимость с интенсивностью и локализацией атеросклеротического поражения аневризматически измененной стенки брюшной аорты, а последующее её расширение ускоряет развитие атеросклероза, что усугубляет течение обоих патологических процессов.
Выводы
Аневризматические и атеросклеротические поражения являются одними из самых распространённых патологических процессов сосудистой стенки, в частности стенки брюшной части аорты. Понимание их сочетанного развития позволяет определять изменения биомеханических характеристик аорты, а так же дает возможность прогнозировать тактику оперативного лечения и риски вероятных осложнений.
УЗИ сердца: норма и расшифровка результатов
В различных областях медицины ультразвуковое исследование внутренних органов является основным методом диагностики.
УЗИ сердца в кардиологии называется эхокардиография. Исследование позволяет выявить изменения, аномалии, нарушения и пороки развития в работе сердца. Процедура безболезненная, неинвазивная, может быть назначена людям всех возрастов и даже беременным женщинам. Исследование сердца ультразвуком проводится уже на стадии внутриутробного развития плода.
Для обследования используется специальное оборудование – УЗИ аппарат или сканер. На кожу пациента наносится особый гель, который способствует лучшему проникновению ультразвука в мышцы сердца и другие структуры, прикрепляется датчик. Данные отображаются на мониторе и автоматически фиксируются.
Процедура длится от 30 до 60 минут. Эхокардиография проводится кардиологом, а также по направлению пульмонолога, невролога, эндокринолога, гинеколога.
Врач назначает обследование в случаях, если пациент имеет жалобы на головокружение, отдышку, боли в груди, слабость, аритмию, тахикардию, повышенное артериальное давление, признаки сердечной недостаточности, обмороки. Людям, перенесшим кардиологические операции, инфаркт необходимо проходить процедуру один раз в год.
Эхокардиография применяется для:
— определения шумов, — диагностики состояния клапанов, — обнаружения изменений в структурах, — оценки работы отделов сердца у людей с хроническими заболеваниями, — обнаружения скопления жидкости, — оценки и мониторинга врожденных дефектов, кровотока, состояния кровеносных сосудов, — обнаружения тромбов в камерах
УЗИ сердца показывает состояние перикарда, миокарда, сосудов, митральный клапан, стенки желудочков.
Во время процедуры кардиолог фиксирует полученные показания. Расшифровка данных дает возможность выявить заболевания, отклонения, патологии, аномалии в работе сердца. На основе полученной информации врач ставит диагноз, назначает лечение. Зачастую дополнительно к эхокардиографии назначают допплерографию. Данная процедура позволяет увидеть направление движения, определить скорость, турбулентность потока крови в камерах сердца.
Врач делает заключение в протоколе результатов диагностики, где отображаются данные, полученные с УЗИ аппарата.
С помощью эхокардиографии диагностируют:
— предынфарктное состояние; — сердечную недостаточность; — ишемическую болезнь; — инфаркт миокарда; — гипертонию, гипотонию; — пороки сердца; — нарушения ритма; — кардиомиопатию; — миокардит, перикардит; — вегето-сосудистую дистонию; — ревматизм.
В целях получения данных о работе сердца с физической нагрузкой проводят Стресс- эхокардиографию. Пациенту дают определенную физическую нагрузку или вызывают усиленную работу сердечной мышцы с помощью препаратов, снимают показания.
Довольно редко в практике встречаются случаи, когда провести стандартную процедуру УЗИ сердца не возможно: деформация грудной клетки, наличие клапанов-протезов, слой подкожно-жировой клетчатки, обильное оволосенение. В таком случае, проводится чреспищеводная (трансэзофагеальная) эхокардиография.
Типы эхокардиографии:
- Одномерная в М-режиме. Датчик подает волны вдоль одной выбранной оси. На монитор выводится изображение – вид сверху. Дает возможность увидеть аорту, предсердие, желудочки.
- Двухмерная. Дает возможность получить изображение в двух плоскостях, сделать анализ движения структур.
Провести полный и точный анализ расшифровки кардиограммы и составить заключение может только врач-кардиолог.
Нормы УЗИ сердца:
Левый желудочек
— масса миокарда (мужчины: 135-182 г; женщины: 95-141 г)
— индекс массы миокарда (мужчины: 71-94 г/м2; женщины: 71-80 г/м2)
— объем в состоянии покоя (мужчины: 65-193 мл; женщины: 59-136 мл)
— размер в состоянии покоя (мужчины: 5,7 см; женщины: 4,6 см)
— размер во время сокращения (мужчины: 4,3 см; женщины: 3,1см)
— толщина стенки вне сокращений сердца при работе: 1,1 см. Показатель 1,6 см свидетельствует о гипертрофии
— фракция выброса не менее 55-60%. Показатель указывает на объем крови, который при каждом сокращении выбрасывает сердце. Меньшее значение говорит о сердечной недостаточности
— ударный объем: 60-100 мл (количество крови, выбрасываемой за одно сокращение)
Правый желудочек
— толщина стенки 5 мм
— индекс размера 0,75 — 1,25 см/м2
— размер в состоянии покоя 0,75 — 1,1 см
Клапаны
— Уменьшение диаметра отверстия клапана, затруднение прокачивания крови свидетельствует о стенозе
— Сердечную недостаточность диагностируют в случае, если створки клапана препятствуют обратному движению крови, не выполняют возложенную функцию
Перикард
— Норма жидкости 10-30 мл. При показателе свыше 500 нормальная работа сердца затруднена. Возможно начало воспалительного процесса – перекардита, скопление жидкости, образование спайки сердца и околосердечной сумки.
Проведение процедуры УЗИ сердца помогает обнаружить заболевания сердечнососудистой системы на ранней стадии и вовремя принять необходимые меры.