Кардиомиопатия может быть различных форм, среди которых самой редко встречающейся считается гипертрабекулярность левого желудочка. Заболевание в основном определяется у детей, хотя иногда встречается среди взрослых. В тяжелых случаях может потребоваться даже пересадка сердца.
Гипертрабекулярность левого желудочка (ГТЛЖ, некомпактный миокард, губчатая кардиомиопатия) — это состояние, при котором мышечная стенка левого желудочка сердца становится как бы “губчатой”. Это может повлиять на способность сердца эффективно работать и на электрическую проводимость миокарда.
Гипертрабекулярность левого желудочка (ЛЖ) не может быть полностью вылечена, но медикаментозное воздействие помогает больным уменьшить выраженность симптомов.
Заболевание возникает редко и считается врожденной патологией. Во время эмбриологического развития сердца формируется два слоя: нормальный и патологический (губчатый). Развитие клиники и дальнейшее обследование больного позволяет поставить диагноз и назначить симптоматическое лечение.
Видео: Noncompaction myocardium (NCM) — Некомпактный («губчатый») миокард (НКМ)или Губчатая кардиомиопатия
Введение
Одной из редко встречающихся и трудно диагностируемых, преимущественно врожденных, первичных кардиомиопатий является некомпактный, или губчатый, миокард левого желудочка, который проявляется гипертрофией миокарда левого желудочка, его чрезмерной трабекуляцией и образованием широких межтрабекулярных пространств вследствие нарушения внутриутробного процесса уплотнения миокарда. Диагностика некомпактного миокарда левого желудочка затруднена по причине отсутствия типичных клинических признаков заболевания и недостаточности знаний.
История выявления заболевания
Первые сведения о некомпактном миокарде левого желудочка относятся к 1932 году, когда S. Bellet при проведении аутопсии новорожденного с атрезией аорты и коронарно-желудочковой фистулой выявил губчатую структуру миокарда. В 60–70-х годах прошлого столетия в зарубежной литературе стали появляться публикации, где описывались изменения миокарда в виде повышенной трабекулярности в сочетании с различной патологией сердца: обструкцией выносящего тракта левого и правого желудочков, комбинированным цианотическим врожденным пороком сердца, дефектом межпредсердной перегородки, дефектом межжелудочковой перегородки, стенозом легочной артерии, аномалией коронарных артерий. Однако данная патология определяется как неизолированный некомпактный миокард желудочков.
Позднее было показано, что некомпактный миокард левого желудочка может также встречаться в сочетании с нейромышечными заболеваниями, такими как метаболическая миопатия, синдромы Barth, Ohtahara и другие. В литературе описаны случаи некомпактного миокарда при наследственных дефектах лицевого черепа — выступающий лоб, двустороннее косоглазие, микрогнатия, расщепление неба и др.
В 1984 году была описана изолированная патология в виде синусоиды в левом желудочке. Годом позднее авторами был описан случай диагностированной атипичной дилатационной кардиомиопатии у 21-летней пациентки, у которой в возрасте 15 лет была выявлена острая левожелудочковая недостаточность. Эхокардиографическое обследование выявило каналоподобные структуры в утолщенном и гипокинетическом миокарде левого желудочка; ангиография выявила «сотовую» структуру стенки левого желудочка. Через год те же авторы описали подобный клинический случай у 21-летнего студента при проведении аутопсии с выявленными выраженными синусоидами в гипертрофированном миокарде. В 1990 году были представлены результаты наблюдения 8 случаев некомпактного миокарда у детей. Несмотря на то, что количество публикаций о случаях некомпактного миокарда левого желудочка в доступных литературных источниках увеличивается, сведений об изолированном некомпактном миокарде у детей недостаточно [1, 5, 6, 8, 10].
Описание
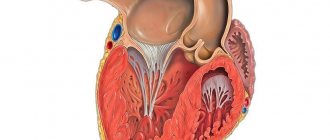
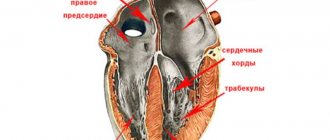
Гипертрабекулярность левого желудочка — это состояние сердца, при котором стенки левого желудочка (нижняя камера левой стороны сердца) не настолько уплотнена, как это должно быть в норме. Это приводит к образованию в сердечной мышце каналов, называемых трабекулами. Левый желудочек принимает характерный “губчатый” вид, немного похожий на соты. Хотя в основном поражается левый желудочек, в некоторых случаях также определяется гипертрабекулярность правого желудочка.
Первое описание болезни датируется 1926 г. после обследования больного ребенка.
ГТЛЖ описывается Американской кардиологической ассоциацией как тип генетической кардиомиопатии (болезнь сердечной мышцы, вызванная изменением генетического состава человека). Однако Всемирная организация здравоохранения (ВОЗ) описывает ее как “неклассифицированный” тип кардиомиопатии. Патология может также быть связана с расширенной или гипертрофической кардиомиопатией. В настоящее время нет универсально согласованных диагностических критериев для состояния.
Развиваться патология может в любом возрасте. В одних случаях определяется сочетание ГТЛЖ с другими врожденными заболеваниями, в других развивается изолированная форма болезни.
Эпидемиология
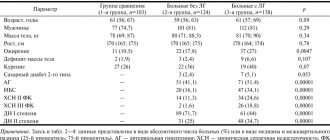
Распространенность некомпактного миокарда левого желудочка составляет, по данным некоторых авторов, 0,05–0,24 %, других — 0,014–0,14 % в общей популяции. Можно предположить, что в связи с появлением новейших современных методов диагностики выявляемость, а следовательно, и распространенность данной патологии может увеличиться. Известно, что некомпактный миокард у пациентов мужского пола встречается чаще, чем у лиц женского пола, и составляет от 56 до 82 % [8, 9].
Авторы приводят ссылку на данные 2003 года об эпидемиологическом исследовании первичных кардиомиопатий у детей Австралии, где некомпактный миокард был выявлен в 9,2 % случаев от общего числа первичных кардиомиопатий и находился на третьем месте после дилатационной и гипертрофической кардиомиопатий [1].
Причины и распространенность
ГТЛЖ в основном является генетическим заболевание, вызванным измененным или “мутированным” геном. Если болезнь генетическая, она может быть унаследована (передана от родителя к ребенку) и поэтому нередко бывает распространена в определенных семьях. По этой причине рекомендуется провести скрининг членов семьи первой линии (родителей, братьев и сестер), если у кого-то из близких ранее определилась ГТЛЖ.
Распространенность ГТЛЖ на самом деле не известна, хотя, по некоторым предположениям, болезнь чаще затрагивает мужчин, чем женщин. В настоящее время у большого количества людей диагностируется ГТЛЖ, потому что кардиография сейчас более развита, так что неуплотненные области можно довольно точно увидеть и диагностировать.
ГТЛЖ иногда диагностируется у больных с расширенной или гипертрофической кардиомиопатией.
Немного статистики:
- ГТЛЖ в 80% случаев регистрируется у мужчин.
- У детей ГТЛЖ встречается чаще всего, поскольку занимает третье место после гипертрофической и дилатационной форм кардиомиопатии.
- Среди диагностируемых кардиомиопатий ГТЛЖ определяется в 9,2% случаев.
- На общую долю патологии приходится 0,014% случаев (по данным E. Oechslin).
Патогенез
Нарушения в эмбриогенезе происходят на ранних стадиях. В норме к 26-му дню внутриутробного развития миокард представлен сложной губчатоподобной структурой из мышечных трабекул с множественными межтрабекулярными карманами — лакунами. Такое строение является необходимым условием нормального развития, поскольку в этом периоде еще не сформированы коронарные сосуды и юные кардиомиоциты вынуждены потреблять кислород непосредственно из камер сердца. К 31-му дню стенки сердца уплотняются, лакуны закрываются и частично участвуют в формировании коронарных сосудов. Если уплотнения миокардиальных волокон по какой-либо причине не происходит, в таком случае ребенок рождается с редкой аномалией — некомпактным (губчатым) миокардом. Основной признак этого заболевания — глубокие трабекулы в миокарде левого желудочка и межжелудочковой перегородке, что влечет за собой снижение систолической функции левого желудочка. Полное неуплотнение миокарда встречается у детей и обычно сочетается с другими врожденными аномалиями, чаще всего стенозами выносящего тракта правого и левого желудочков. Смертность среди детей с сочетанной патологией полного некомпактного миокарда очень высокая. Взрослые с изолированным губчатым миокардом обычно жалоб не предъявляют, данная патология может выявляться случайно при обследовании по причине иных состояний.
Установлено, что у здорового ребенка левый желудочек имеет до трех видимых трабекул и является менее трабекулярным по сравнению с правым желудочком. В случае внутриутробного нарушения эндомиокардиального морфогенеза происходят процессы дезорганизации уплотнения миокарда. В период эмбриогенеза углубления взаимодействуют с эндокардом желудочка и при дальнейшем уплотнении миокарда преобразуются в капилляры. Некомпактный миокард представлен наличием более трех глубоких межтрабекулярных углублений в гипертрофированных сегментах миокарда левого желудочка. Кроме того, желудочки часто бывают при этом гипокинетическими. Установлено, что глубокие межтрабекулярные выемки покрыты эпителием, что указывает на родство с эндокардом желудочка. В отличие от установленных нарушений в левом желудочке дифференцировать повышенную трабекулярность правого желудочка не представляется возможным, поскольку правый желудочек в норме имеет повышенную трабекулярность. Однако полностью этиопатогенетические механизмы развития заболевания до настоящего времени не изучены [1, 2, 9].
Генетические аспекты
В литературе имеются данные как о спорадических формах заболевания, так и о семейных случаях изолированного некомпактного миокарда левого желудочка. Изолированный некомпактный миокард левого желудочка — генетически гетерогенное заболевание. Авторами выделяются несколько типов синдрома некомпактного миокарда левого желудочка: тип 1 — наблюдается утолщение стенки левого желудочка и межжелудочковой перегородки без дилатации левого желудочка, тип 2 — наблюдается сочетание признаков некомпактного миокарда левого желудочка и дилатационной кардиомиопатии и Х-сцепленный тип.
1-й тип синдрома некомпактного миокарда левого желудочка наследуется по аутосомно-доминантному типу, в некоторых случаях является результатом новых мутаций. При этом типе наблюдается как изолированный синдром некомпактного миокарда левого желудочка, так и его сочетание с пороками сердца. Чаще всего встречаются дефекты межпредсердной перегородки, изолированный или множественные дефекты межжелудочковой перегородки, стеноз легочных артерий и другие пороки. Причиной этого заболевания являются мутации в гене дистробревина, который расположен в локусе 18q12.1-q12.2.
2-й тип наследуется по аутосомно-доминантному типу. Сочетания синдрома некомпактного миокарда левого желудочка с пороками сердца не отмечается. Ген, ответственный за это заболевание, до сих пор еще не известен, однако картирован локус 11р15, сцепленный с этим заболеванием. Поэтому прямая диагностика этого заболевания пока невозможна.
Х-сцепленный тип наследуется по Х-сцепленному рецессивному типу. Это редкое наследственное заболевание развивается в результате мутаций в гене G 4.5 (TAZ), который расположен на Х-хромосоме в области Xq28. Указанный ген кодирует белок таффазин, являющийся необходимым структурным компонентом мембран скелетной и сердечной мышц, а также принимает участие в морфогенезе миокарда. С этим геном связывают синдром Барта, другие Х-сцепленные инфантильные кардиомиопатии и Х-сцепленный фиброэластоз эндокарда. Хотя у взрослых пациентов данной мутации не выявлено, что может свидетельствовать о других причинах заболевания. Прямая ДНК-диагностика данного типа заболевания может подтвердить наличие заболевания. Женщины могут быть носительницами мутантного гена, они имеют 50% вероятность передать ген, несущий мутацию, сыновьям. Все дочери женщин-носительниц будут здоровы, но половина из них — также носительницами мутантного гена. Однако не у каждой матери, родившей мальчика с синдромом некомпактного миокарда левого желудочка, выявляется мутантный ген. Данный факт можно объяснить тем, что мутация у больного произошла впервые. Для выяснения носительства мутантного гена необходимо проведение молекулярно-генетических методов обследования [7].
Механизм развития
ГТЛЖ — эта патология обычно образовывается, когда ребенок еще является эмбрионом, развивающимся в утробе матери. Это означает, что человек рождается с этим заболеванием. Однако у некоторых людей патологическое состояние может формироваться после рождения, при этом его называют “приобретенной” ГТЛЖ.
Сердце состоит из толстого слоя мышечных клеток (называемого миокардом). В нормальном состоянии мышечные клетки в миокарде плотно связаны друг с другом, поэтому считаются “уплотненными”.
Во время развития сердца эмбриона волокна сердечной мышцы поначалу являются “не уплотненными”, не способными нормально сжиматься. Это нужно для формирования толстой мышечной стенки. ГТЛЖ возникает тогда, когда эта часть нормального развития сердца (называемая “фазой ремоделирования”) прерывается, в результате чего часть миокарда не формируется компактной, а остается не уплотненной.
Классификация
С 1995 года по предложению ВОЗ согласно классификации кардиомиопатий некомпактный миокард был отнесен в группу неклассифицируемых кардиомиопатий. В соответствии с классификацией кардиомиопатий, предложенной Американской ассоциацией сердца (АНА, 2006), некомпактный миокард левого желудочка относится к первичным генетическим кардиомиопатиям (неклассифицируемым кардиомиопатиям). С 2008 года Европейское общество кардиологов предложило классификацию известных и редких кардиомиопатий. В соответствии с указанной классификацией выделены две больших группы кардиомиопатий: семейная и несемейная. Семейная форма диагностируется при наличии заболевания более чем у одного члена семьи или если имеет место одинаковая генетическая мутация в случаях заболеваний в семье. Семейная форма кардиомиопатии чаще является моногенным заболеванием. Из врожденных несемейных кардиомиопатий в классификацию вошли только идиопатические. Приобретенные несемейные формы кардиомиопатий не вошли в указанную классификацию, поскольку приобретенные кардиомиопатии имеют существенные отличия в диагностике и лечении в связи с тем, что они являются осложнением заболевания, а не его клиническим признаком [3, 7–9].
Клинические признаки
Основными симптомами некомпактного миокарда являются проявления сердечной недостаточности, аритмии (желудочковая тахикардия, фибрилляция предсердий, синдром Вольфа — Паркинсона — Уайта), тромбоэмболии (эмболия легочной артерии, тромбы в желудочках сердца), особенно выраженные у пациентов со сниженной функцией левого желудочка. Кроме кардиологических симптомов, у детей часто наблюдался лицевой дисморфизм. У взрослых чаще всего отмечена полная блокада ножек пучка Гиса. Также у детей чаще, чем у взрослых, отмечался семейный тип заболевания. Постоянным признаком заболевания у детей и взрослых было наличие некомпактных сегментов миокарда. Тяжесть состояния пациентов обеих возрастных групп определялась степенью некомпактности миокарда [1–3, 8, 9].
Диагностика
Для диагностики некомпактного миокарда левого желудочка используют различные методы инструментального обследования: эхокардиографию, магнитно-резонансную томографию, реже — компьютерную томографию, позитронную эмиссионную томографию.
Для визуализации полости левого желудочка используется эхокардиография, чаще двухмерная, а также трехмерная. Особенно важным является использование эхокардиографии при проведении семейного скрининга с целью выявления пациентов при отсутствии жалоб и симптомов заболевания.
Главным эхокардиографическим признаком некомпактного миокарда является наличие повышенной трабекулярности левого желудочка. Однако повышенная трабекулярность может быть вариантом нормы, но при некомпактном миокарде наиболее часто ее можно определять между переднебоковой стенкой и межжелудочковой перегородкой. Для более точной диагностики некомпактного миокарда рекомендуется проведение нескольких эхокардиографических исследований, поскольку имеющаяся патологическая трабекулярность при получении плоских срезов может визуально сглаживаться. Также для дифференциальной диагностики рекомендовано использовать изображение с парастернальной короткой оси в конце систолы.
Существуют несколько вариантов критериев диагностики изолированного некомпактного миокарда левого желудочка.
Критерии диагностики изолированного некомпактного миокарда левого желудочка по T.K. Chin (1990): отсутствие каких-либо других сопутствующих структурных аномалий сердца; парастернальная проекция по длинной оси, субкостальная и верхушечная проекция; определение глубины выемок; измеренное в конце диастолы соотношение между расстояниями от поверхности эпикарда до начала выемок и от эпикарда до конца трабекул ≤ 0,5; повышенная трабекулярность и глубокие межтрабекулярные углубления.
Критерии диагностики изолированного некомпактного миокарда левого желудочка по R. Jenni (1999): отсутствие сопутствующих аномалий сердца, при визуализации на уровне парастернальной проекции по короткой оси и верхушечной проекции выявляется типичная двухслойная структура миокарда с тонким компактным внешним (эпикардиальным) слоем и более толстым некомпактным внутренним (эндокардиальным) слоем, который состоит из трабекулярной сетчатой структуры с глубокими до эндокарда углублениями (характерным является максимальное конечно-систолическое соотношение некомпактного эндокардиального слоя и компактного миокарда, составляющее 2); преобладает сегментарная локализация аномального миокарда (то есть некомпактный миокард доминирует на верхушке (около 80 %) и в средних отделах нижней и латеральной стенок желудочка); с помощью цветного допплера можно выявить глубокую перфузию межтрабекулярных углублений (в отличие от синусоидов миокарда межтрабекулярные углубления не сообщаются с коронарным кровотоком).
В 2006 году С. Lilje и соавторы предложили метод количественной оценки степени некомпактности миокарда в зависимости от значений указанного выше соотношения: величина соотношения 0,33–0,26 соответствует «мягкой» некомпактности, 0,25–0,2 — умеренной, меньше 0,2 — тяжелой. Данная величина признана прогностическим признаком дальнейшего развития заболевания и возникновения осложнений, поскольку она тесно коррелирует со степенью и скоростью развития сердечной недостаточности.
Авторы C. Stollbeger и J. Finsterer считают, что для постановки диагноза некомпактного миокарда левого желудочка необходимы следующие условия: наличие более трех трабекул, простирающихся от стенки левого желудочка в области верхушки до папиллярной мышцы и визуализирующихся хотя бы в одной позиции; перфузия межтрабекулярных пространств их желудочковой полости, зафиксированная при допплер-эхокардиографии.
Приведенные выше критерии диагностики изолированного некомпактного миокарда левого желудочка являются подтверждающими диагноз эхокардиографическими признаками.
Установлено, что чаще всего (около 80 %) поражены апикальный и средний сегменты нижней и боковой стенки левого желудочка.
Метод магнитно-резонансной томографии при диагностике изолированного некомпактного миокарда левого желудочка является наиболее информативным, особенно при использовании трехмерной визуализации. Реже используется метод компьютерной томографии. Оба указанных метода обладают высокой разрешающей способностью и признаны весьма перспективными в диагностике некомпактного миокарда левого желудочка, хотя в литературе результаты их применения описываются недостаточно [4–6, 8, 10].
Видео
Еще фото Автор (ы):
Л.В. Крашенинников, ветеринарный врач-кардиолог, Инновационный ветеринарный центр Московской ветеринарной академии им. К.И.Скрябина [email protected]
Журнал:
№6-2017
Ключевые слова
: некомпактный миокард левого желудочка (НМЛЖ), гипертрабекулярность, сердечная недостаточность
Kew words
: noncompaction cardiomyopathy (NCCMP), hypertrabecularity, heartfailure
Аннотация
Некомпактный миокард левого желудочка – очень редкая форма врожденной кардиомиопатии, характеризующаяся гипертрабекулярностью миокарда левого желудочка. В процессе эмбриогенеза при некомпактном (гипертрабекулярный) миокарде левого желудочка (НМЛЖ) формируются два слоя сердечной мышцы – нормальный компактный и патологический некомпактный. Клинически данный вид кардиомиопатии проявляется желудочковыми аритмиями, сердечной недостаточностью, тромбоэмболией, внезапной смертью, а также может протекать бессимптомно. Основные методы диагностики – эхокардиография, компьютерная томография и магнитно-резонансная томография.
Summary
Left ventricular noncompaction is a very rare form of genetic cardiomyopathy, that is characterized by hypertrabecularity of left ventricle myocardium. During embryogenesis in case of Noncompaction cardiomyopathy (NCCMP) two layers of cardiac myocardium are formed – normal compact and pathological non compact. Clinicaly this type of cardiomyopathy presents with ventricular arrhythmias, heart failure, thromboembolic events, sudden death and also can be asymptomatic. Echocardiography, CT and MRI can be helpful in providing diagnosis of NCCMP.
Описание болезни
Некомпактный (гипертрабекулярный) миокард левого желудочка (НМЛЖ), также ранее известный как губчатый миокард, – одна из редких первичных кардиомиопатий, характеризующаяся выраженными трабекулами левого желудочка и глубокими межтрабекулярными углублениями. При этом формируются два слоя – некомпактный со сниженной сократительной функцией и компактный. У людей НМЛЖ встречается в любом возрасте и может быть изолированным или сочетаться с другими врожденными заболеваниями сердца.
Впервые болезнь была описана у ребенка в 1926 г. и долгое время считалась разновидностью апикальной гипертрофической кардиомиопатии (ГКМП). В настоящее время НМЛЖ отнесена к категории неклассифицируемых кардиомиопатий (Европейская классификация).
Этиология, генетика и эмбриогенез
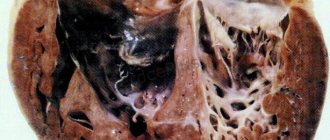
Сердечная мышца развивается из миоэпикардиальной пластинки мезодермы в I триместре беременности, при этом изначально миокард представлен группой раздельных волокон, разделенных между собой широкими синусоидами. Во время эмбриогенеза постепенно происходит уплотнение волокон между собой и сужение межтрабекулярных пространств. Процесс протекает от основания сердца к его верхушке и от эпикарда к эндокарду. Нарушение течения этого процесса приводит к тому, что остаются зоны неуплотненных, «некомпактных» трабекул, разделенных глубокими межтрабекулярными рецессусами (рис. 1).
На сегодняшний день этиология заболевания остается малоизученной. Есть данные о ненаследуемом и наследуемом характере заболевания, преимущественно аутосомно-доминантном и сцепленном с Х-хромосомой. В развитии НМЛЖ у людей могут участвовать различные мутации генов, в том числе кодирующих синтез саркомеров, – MYH7, ACTC, TNNT2, ответственных за развитие ГКМП – MYBPC3, белков, участвующих в организации цитоскелета, – LDB3, Lamin A/C, кардиоспецифических – CSX, альфа-дистробревина – Cypher/ZASP, дистропина и некоторых других.
В частности, выявлена интересная общая R820W мутация MYBPC3 гена, вызывающая ГКМП у кошек породы рэг-долл, у гомозиготных людей – НМЛЖ и ГКМП, а у гетерозиготных людей экспрессия минимальна. Распространенность и классификация
В настоящее время в человеческой популяции распространенность заболевания сильно недооценена в связи со сложностями диагностики. Часто данную патологию описывают, как другие формы кардиомиопатий, тромбы, опухоли и т.д.
Заболевание чаще регистрируется у мужчин – до 80% случаев по данным разных авторов. В педиатрической практике НМЛЖ занимает третье место после ГКМП и ДКМП, составляя, по некоторым данным, около 9,2% всех диагностируемых кардиомиопатий. Общая доля заболевания составляет около 0,014% (E. Oechslin). На сегодняшний день описан и гистологически подтвержден один случай бивентрикулярного НМЛЖ без гипертрофии у мейн-куна с A31P мутацией протеина С, ответственного за ГКМП у данной породы кошек, при этом животное наблюдалось каждые 6 мес в течение 6 лет до смерти.
НМЛЖ может быть как изолированным, так и комбинированным с другими кардиомиопатиями, нейропатиями и врожденными пороками сердца. У людей наиболее часто встречается вместе с дефектами межжелудочковой или межпредсердной перегородок, но может сочетаться и с другими врожденными пороками сердца (ВПС).
Патогенез и клиническая картина
Нарушение нормальной архитектуры сердечной мышцы, проявляющееся в виде двух слоев, компактного с нормальной сократительной способностью и некомпактного со сниженной, приводит к снижению общей сократительной способности миокарда желудочка, а нарушение микроциркуляции – к хронической ишемии. Эти два фактора, а также величина некомпактной части сердечной мышцы по отношению к компактной, определяют тяжесть и скорость развития хронической сердечной недостаточности у пациента, при этом страдает как систола, так и диастола, которая в некоторых случаях может быть рестриктивного типа.
Клинически НМЛЖ проявляется хронической сердечной недостаточностью, реже – желудочковыми и наджелудочковыми аритмиями, повышенной вероятностью тромбообразования или протекает бессимптомно.
Развитие хронической сердечной недостаточности связано с систолической и диастолической дисфункциями и возникающей на их фоне кардиомегалией и ретроградным застоем в соответствующих кругах кровообращения.
Ввиду выраженных структурных изменений миокарда, аритмии являются патогномоничным синдромом для НМЛЖ и могут быть единственным проявлением патологии. Наиболее часто встречаются желудочковые нарушения ритма, такие как желудочковая тахикардия и экстрасистолия, при этом механизмы, отвечающие за их развитие, предположительно, схожи с таковыми при аритмогенной кардиомиопатии правого желудочка. Другими часто встречаемыми нарушениями являются фибрилляция предсердий, АВ-блокады и блокады на уровне ножек Гиса, причиной чему служит прогрессирующий эндомиокардиальный фиброз. Синдром WPW встречается реже, при этом дополнительный путь чаще локализуется в переднеперегородочном сегменте в области фиброзного кольца трикуспидального клапана. Дополнительные пути проведения – основная причина внезапной смерти при НМЛЖ.
Повышенная вероятность тромбообразования зависит от нескольких причин. С одной стороны, это увеличенные размеры камер сердца, что особенно важно для кошек, с другой – глубокие межтрабекулярные рецессусы в полости желудочка в совокупности со сниженной насосной функцией сердца.
Диагностика
Первичным методом диагностики НМЛЖ является эхокардиография. В дальнейшем для уточнения диагноза может быть использована магнитно-резонансная и компьютерная томография, в гуманной медицине также используется контрастная вентрикулография.
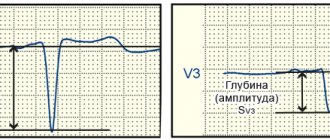
Эхокардиографически НМЛЖ представлен двухслойной структурой миокарда желудочка – тонкий эпикардиальный компактный слой и трабекулярный, с глубокими рецессусами, некомпактный слой, чаще всего локализованный в апикальной области и на свободной стенке левого желудочка. Существует несколько вариантов комбинаций критериев оценки изображения для постановки диагноза НМЛЖ. Одной из наиболее распространенных является соотношение некомпактного слоя к компактному более 2 у взрослых и 1,4 у детей, измеренных в конце систолы, наличие нескольких трабекул в одном срезе и глубоких рецессусов, сообщающихся с полостью левого желудочка, что визуализируется при цветном допплеровском картировании (рис. 2).
Магнитно-резонансная томография является высокочувствительным и специфичным методом диагностики при подозрении на НМЛЖ, особенно при недостаточно четкой визуализации верхушки сердца во время эхокардиографии. Согласно рекомендациям AHA, должны использоваться томографы с мощностью более 1,5 Тесла для получения максимально четкого изображения. Критерием НМЛЖ будет являться наличие двух слоев миокарда, а также выбирается один из нескольких диастолических срезов по длинной или короткой осям с наиболее выраженной трабекулярностью, при этом, в отличие от эхокардиографии, соотношение некомпактного слоя к компактному должно быть более 2,3. Для определения локализации используется 17-сегментарная модель сердца.
Дифференциальная диагностика
НМЛЖ может быть ошибочно принят за различные формы ГКМП, так как при обеих патологиях может иметь место гипертрофия свободной стенки левого желудочка и, что особенно важно, апикальной области. Ошибка описания НМЛЖ как ДКМП связана с тем, что систолическая функция может быть умеренно или значительно снижена, а полость желудочка расширена. Ошибки определения как фиброэластоз и эндомиокардиальный фиброз связаны с тем, что изменения при данных патологиях затрагивают прежде всего апикальную область, которая наиболее трудна для визуальной оценки, и межтрабекулярные рецессусы могут плохо визуализироваться при эхокардиографическом исследовании. При миокардите стенки желудочка могут быть утолщены (у кошек), а систолическая функция может быть снижена (у собак), аналогичные изменения можно встретить при НМЛЖ.
Согласно данным Stöllberger и J. Finsterer, наиболее частым ошибочным диагнозом в порядке убывания будут ГКМП, ДКМП, фиброэластоз, миокардит, РКМП и другие причины.
Лечение и прогноз
Бессимптомные пациенты при отсутствии нарушений ритма и проводимости не требуют специфической терапии. В остальных случаях она ничем не отличается от обычной патогенетической и симптоматической терапии хронической сердечной недостаточности.
Предикторами неблагоприятного прогноза будут являться дилатация камер сердца и тяжелые нарушения ритма и проводимости.
Динамическое наблюдение во всех случаях рекомендуется минимум 2 раза в год.
Клинический случай
На прием по направлению терапевта поступил бенгальский котенок в возрасте 3 мес с выявленной рентгенологически кардиомегалией. Единственной жалобой было затрудненное, «хрюкающее» дыхание. Аппетит и переносимость физических нагрузок сохранены полностью. При аускультации выявлен систолический шум слева 2–3-й степени из 6.
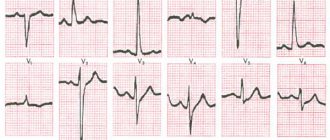
ЭКГ – ритм синусовый, ЧСС 208 в 1 мин, нарушений проводимости не выявлено.
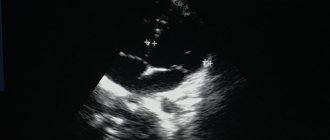
Эхокардиография – выявлена повышенная трабекулярность верхушки левого желудочка с характерным «мозаичным» кровотоком (соотношение некомпактного и компактного слоев в диапазоне 1,5–2,2) и апикальной мезовентрикулярной обструкцией с градиентом 55 мм рт. ст. (рис. 3 и 4), умеренная дилатация левого предсердия (13,7 мм, аорта 7 мм, измерения в короткой оси), 3–4-й класс диастолической дисфункции левого желудочка, фракция выброса 66% по Симпсону, выраженный застой по малому кругу кровообращения (ЛВ/ПВЛА 1,5), умеренная регургитация на митральном клапане, признаки легочной гипертензии отсутствуют. Предварительный диагноз на основании данных исследования – неклассифицируемая кардиомиопатия, мезовентрикулярная обструкция на фоне некомпактного развития левого желудочка. Дифференциальный диагноз – апикальная форма гипертрофии левого желудочка. Безусловно, в данном случае диагноз НМЛЖ является строго предварительным и, учитывая крайне редкую частоту встречаемости заболевания, должен быть подтвержден гистологически.
К сожалению, хозяйка животного на повторный прием не явилась и о дальнейшей судьбе пациента ничего не известно. Интересным является тот факт, что этот котёнок – единственный выживший из второго помета. Первый помет, всего пять котят, был полностью мертворожденным. Во втором помете тоже было пять котят: два из них были мертворожденными, двух кошка задавила сразу же после рождения, а единственный выживший котенок спустя 3 мес попал на кардиологический прием с редким заболеванием миокарда.
Литература
1. Angelini P. Can Left Ventricular Noncompaction Be Acquired, and Can It Disappear? Texas Heart Institute Journal. 2017; 44 (4) : 264–265. PMC. Web. 27 Oct. 2021.
2. Shemisa K. et al. Left Ventricular Noncompaction Cardiomyopathy. Cardiovascular Diagnosis and Therapy. 2013; 3 (3): 170–175. PMC. Web. 27 Oct. 2021.
3. Ali Sulafa K.M. Ventricular Noncompaction: Over or under Diagnosis? Journal of the Saudi Heart Association. 2009; 21 (3): 191–194. PMC. Web. 27 Oct. 2021.
4. Lin Ying-Nan et al. Left Ventricular Noncompaction Cardiomyopathy: A Case Report and Literature Review. International Journal of Clinical and Experimental Medicine. 2014; 7 (12): 5130–5133. Print.
5. Fazlinezhad A. et al. Echocardiographic Characteristics of Isolated Left Ventricular Noncompaction. ARYA Atherosclerosis. 2016; 12 (5): 243–247. Print.
6. Kittleson M.D. et al. Naturally Occurring Biventricular Noncompaction in an Adult Domestic Cat. Journal of Veterinary Internal Medicine. 2017; 31 (2): 527–531. PMC. Web. 27 Oct. 2017.
7. Zhang W. et al. Molecular Mechanism of Ventricular Trabeculation/compaction and the Pathogenesis of the Left Ventricular Noncompaction Cardiomyopathy (LVNC). American journal of medical genetics. Part C, Seminars in medical genetics. 2013; 163 (3): 144–156. PMC. Web. 27 Oct. 2021.
8. Weir-McCall, Jonathan R. et al. Left Ventricular Noncompaction: Anatomical Phenotype or Distinct Cardiomyopathy? Journal of the American College of Cardiology. 2016; 68 (20): 2157–2165. PMC. Web. 27 Oct. 2021.
9. Jenni R., Oechslin E., Schneider J. et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. 2001; 86: 666–671.
10. Голухова Е.З., Шомахов Р.А. Некомпактный миокард левого желудочка. Креативная кардиология. 2013.
Назад в раздел
Лечение
Основа терапевтической тактики у больных с губчатым миокардом — профилактика и лечение сердечной недостаточности, нарушений сердечного ритма и тромбоэмболических осложнений (прием антикоагулянтов при нарушении функции левого желудочка). Асимптоматическим пациентам и пациентам, не имеющим аритмий и признаков дисфункции левого желудочка, лечение не назначается. Некоторым больным показана трансплантация сердца. Больным со злокачественными нарушениями ритма показана имплантация кардиовертера-дефибриллятора [1, 2, 7, 9].
Прогноз у больных с некомпактным миокардом левого желудочка зависит от объема пораженных сегментов, общей сократительной способности миокарда, времени возникновения и скорости нарастания симптомов сердечной недостаточности. По данным I. Jedlinsky и соавторов, смертность в течение 6 лет составила 50 %. Из 34 пациентов, наблюдавшихся в исследовании E. Oechslin и соавторов, на протяжении 44 месяцев умерли 12 больных, у 6 из которых была диагностирована внезапная сердечная смерть, у 4 — терминальная сердечная недостаточность, четырем пациентам проведена пересадка сердца, еще четырем установлен кардиовертер-дефибриллятор. Особенно неблагоприятный прогноз у пациентов с фракцией выброса менее 35 %. К факторам, указывающим на неблагоприятный прогноз заболевания, относят: большой конечно-диастолический размер левого желудочка, постоянную фибрилляцию предсердий, блокаду ножек пучка Гиса на электрокардиограмме.
При проведении патологоанатомических исследований установлено, что изолированный некомпактный миокард характеризуется наличием гипертрофированных сегментов стенки левого желудочка, которая состоит из некомпактного эндокардиального слоя, в котором отмечается повышенная трабекулярность, и тонкого эпикардиального компактного слоя. Глубокие межтрабекулярные выемки сообщаются с полостью левого желудочка, но не с коронарным кровотоком, в отличие от некомпактного миокарда, связанного с другими врожденными пороками сердца, когда межтрабекулярные углубления сообщаются с полостью левого желудочка и сосудами коронарного кровообращения (неизолированный миокард) [1, 2, 8, 10].
Симптомы
Хотя болезнь может быть диагностирована в любом возрасте, в основном первые симптомы начинают появляться в младенчестве. У части больных может быть недиагностированная форма ГТЛЖ, в таких случаях симптомы практически отсутствуют.
Проявления ГТЛЖ варьируются от одного человека к другому в зависимости от величины и расположения миокарда без уплотнения. Симптомы не являются строго специфическими для ГТЛЖ, поскольку они нередко определяются при других типах кардиомиопатии и заболеваниях сердечно-сосудистой системы, что нередко затрудняет диагностику.
Клинические проявления обычно возникают потому, что:
- некомпактный миокард не позволяет сердцу хорошо перекачивать кровь по всему телу (что может вызвать симптомы сердечной недостаточности, так как сердце не отвечает потребностям организма);
- трабекулярность миокарда влияет на нормальную электрическую активность сердца (что может вызвать аритмию — нарушение сердечного ритма).
Симптомы ГТЛЖ включают:
- одышку;
- усталость (иногда крайне выраженную);
- чувство головокружения;
- обморочное состояние;
- чувство аномальных сердечных сокращений (сердцебиение);
- опухание ног, лодыжек и стоп (отеки).
Клинический случай некомпактного миокарда левого желудочка у девочки 6 лет
Ребенок Меланья Б. родилась от первой беременности, протекавшей на фоне хронического пиелонефрита матери и хронической внутриутробной гипоксии плода, от первых срочных родов в сроке гестации 39 недель с массой тела 3700 г. В родах отмечена короткая пуповина. На 1-е сутки после рождения диагностирована родовая травма — ротационный подвывих первого шейного позвонка С1, клинически проявлялся признаками синдромов двигательных нарушений и вегетовисцеральных расстройств. При проведении нейросонографии выявлены УЗ-признаки перивентрикулярной ишемии I–II степени. В связи с наличием признаков постгипоксического синдрома дезадаптации сердечно-сосудистой системы девочке была проведена эхокардиография, при этом были выявлены эхо-признаки малой аномалии развития сердца — аномальная хорда левого желудочка, гипертрабекулярность левого и правого желудочков, разрастание папиллярных мышц, кардит.
Из роддома девочка была переведена в отделение патологии новорожденных. Дополнительно к перечисленным обследованиям предусмотрена эхокардиография на 12-е сутки жизни: камеры сердца не расширены, патологических шунтов не выявлено, хордальные особенности левого желудочка, систолодиастолическая функция левого желудочка не изменена. На электрокардиограмме — замедление атриовентрикулярной проводимости, диффузные изменения миокарда желудочков. После проведенного лечения девочка была выписана домой в возрасте 1 месяца с рекомендациями наблюдения у кардиолога, невропатолога, педиатра.
В дальнейшем состояние ребенка постепенно ухудшалось, нарастали явления сердечной недостаточности, в связи с чем девочка в возрасте 5 месяцев была госпитализирована в кардиоревматологическое отделение Луганской городской многопрофильной детской больницы № 1 с диагнозом: врожденный неревматический кардит тяжелой степени, декомпенсированный, нарушение кровообращения IIА степени, тимомегалия II степени, малая сердечная аномалия, синдром двигательных нарушений, перинатально обусловленный. При обследовании на электрокардиограмме — дилатация левого желудочка с систолической перегрузкой, диффузные изменения миокарда. На повторной электрокардиограмме через 4 дня — дилатация левого желудочка и левого предсердия с митральной вторичной недостаточностью IIБ степени, возможно, на фоне перенесенного миокардита, снижение систолодиастолической функции левого желудочка. На эхокардиограмме через 9 дней — умеренное расширение левых камер сердца, снижение сократимости миокарда левого желудочка, умеренная индивидуальная повышенная трабекулярность левого желудочка. Консультация кардиохирурга: порока сердца нет. В отделении ребенку впервые был назначен дигоксин. Из отделения девочка была выписана по настоянию родителей в возрасте 5 месяцев 13 дней.
В возрасте 8 месяцев состояние девочки ухудшилось, она снова была госпитализирована в кардиоревматологическое отделение с диагнозом: врожденный неревматический кардит, тяжелое течение. Стадия декомпенсации, нарушение кровообращения IIБ степени, относительная недостаточность митрального и трикуспидального клапанов, замедление статокинетической функции, рахит II степени, подострое течение, гипотрофия I степени, иммунодефицитное состояние. Через две недели девочка выписана домой с улучшением состояния.
В дальнейшем ребенок неоднократно был консультирован кардиологом, обследован, получал лечение. На электрокардиограмме в возрасте ребенка 9 месяцев выявлены признаки неполной блокады правой ножки пучка Гиса.
В возрасте 1 года 3 месяцев девочка была обследована и консультирована в условиях научно-практического медицинского центра детской кардиологии и кардиохирургии г. Киева, где был выставлен диагноз: кардиомиопатия, некомпактный миокард левого желудочка, выраженная митральная недостаточность, высокая легочная гипертензия. Были даны рекомендации по дальнейшей тактике обследования и лечения больной. В дальнейшем девочка регулярно обследовалась и получала лечение в указанном центре.
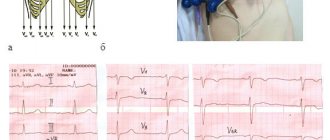
Магнитно-резонансная томография сердца без внутривенного контрастирования была проведена в возрасте 3 лет и 2 месяцев. На серии томограмм отмечается расширение полостей обоих желудочков (размер левого желудочка 5,6 x 3,6 x 3,6 см, правого — 4,4 x 2,25 см), значительно увеличено левое предсердие, наблюдается умеренная недостаточность атриовентрикулярных клапанов. Эндокард левого желудочка имеет открытую трабекулярную структуру с относительным истончением компактной субэпикардиальной части до 0,25 см. Диастолическое соотношение некомпактной и компактной части левого желудочка равно 1,25/0,25 см. Аналогичные структурные изменения миокарда определяются в правом желудочке. Фракция выброса левого желудочка — 27 %. Небольшое количество жидкости в полости перикарда. Генетически девочка не обследована.
В связи с ухудшением состояния девочка снова была направлена на лечение в возрасте 5 лет и 3 месяцев. Диагноз: некомпактный миокард левого желудочка. Выраженная недостаточность трикуспидального и митрального клапанов, дилатация левых отделов сердца, выраженная легочная гипертензия. На эхокардиограмме — левые отделы сердца расширены, сократимость миокарда удовлетворительная. Выраженная трабекулярность задней стенки левого желудочка, толщина компактной части 2,5 мм, некомпактной — 12 мм. Заключение: некомпактный миокард левого желудочка, недостаточность трикуспидального и митрального клапанов, дилатация левых отделов сердца, выраженная легочная гипертензия. Повторная эхокардиография через 10 дней лечения выявила: расширены левые отделы сердца, сократимость миокарда хорошая (положительная динамика на фоне лечения). Диастолические расстройства левого желудочка III типа (рестриктивный). Выраженная трабекулярность левого желудочка (некомпактный миокард). Жидкости в полости перикарда и плевральных полостях нет. В период лечения девочка получала добутамин, лазикс, аспаркам, дигоксин, берлиприл, панангин, верошпирон. Учитывая положительную динамику клинического состояния больной, консилиум врачей принял решение, что хирургическое лечение не показано, рекомендовано продолжать лечение амбулаторно. В настоящее время состояние девочки компенсированное.