Показания и подготовка к анализу
Показатель гематокрит всегда указывается в результатах общего анализа крови. Это значит, что его можно оценить:
- При проведении любого медицинского осмотра или обязательной диспансеризации.
- При подготовке к операции.
- При госпитализации и перед выпиской.
Но кроме этого существуют определенные показания, когда требуется определить гематокрит. В этом случае выполняют прямое измерение: способом центрифугирования материала отделяют плазму и получают точный показатель. Показания для этого:
- Кровотечение.
- Проблемы со свертываемостью крови
- Обезвоживание организма.
- Анемия.
- Полицитемия.
Для того чтобы получить достоверный результат следует отказаться от пищи за 6-10 часов до забора крови из вены или из пальца. Как правило, анализ сдают в утреннее время. Также необходимо исключить употребление алкоголя за 2-3 дня и воздержаться от курения за 2-3 часа до процедуры.
Где сдавать анализ крови на гематокрит
Исследование уровня hct является частью эритроцитарных индексов, которые в свою очередь входят в ОАК – анализ крови, который прежде назывался клиническим, а в рамках современных лабораторных стандартов – общим. В рамках этого анализа проводится изучение лейкоцитов, тромбоцитов и эритроцитов. Отдельно кровь на hct не сдаётся, а общее исследование (ОАК) можно заказать в любой медицинской клинике.
Также для забора крови в удобном для вас месте, дома или по указанной локации, последующего проведения исследования с расшифровкой и подробными рекомендациями о плане введения программы приёма микронутриентов можно обратиться к специалистам bioniq:
- Проводим исследования до 50 параметров крови и различных индексов;
- Бесплатно при подписке bioniq BALANCE
- Стерильно;
- Медицинский персонал высшей категории.
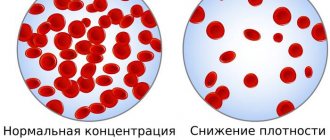
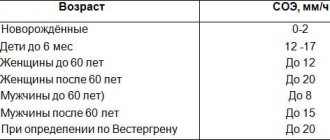
Норма
Норма гематокрита отличается в зависимости от возраста и половой принадлежности. У новорожденных показатель высокий нормой считается показатель 42% — 65%. В процессе взросления он уменьшается, у пожилых людей отмечаются минимальный уровень гематокрита. Для взрослых людей в возрасте 18- 65 лет норма составляет:
- Для мужчин — 41% — 53%.
- Для женщин — 36% — 46%.
Отклонения от нормы могут наблюдаться в период беременности. Приблизительно с 20 недели показатель снижается в связи с увеличением количества жидкой части крови по физиологическим причинам. После родов гематокрит быстро возвращается к нормальным значениям при отсутствии патологий.
Отклонения в сторону увеличения гематокрита фиксируются:
- У курильщиков, в связи кислородным голоданием тканей, что приводит к увеличению выработки эритроцитов.
- При подъеме на большую высоту, выработка эритроцитов увеличивается вследствие адаптации организма к пониженной концентрации кислорода в воздухе.
- При стрессах и травматическом шоке, который характеризуется интенсивной болью.
- При приеме кортикостероидных препаратов и диуретиков,
Отклонения в сторону уменьшения гематокрита фиксируются:
- При длительной неподвижности.
- При приеме антиагрегантов и антикоагулянтов, разжижающих кровь.
- На фоне большого потребления жидкости.
- При хроническом алкоголизме.
Микронутриенты для системы кроветворения
Гемопоэз – то есть кроветворение – это множество этапов превращения стволовой клетки в один из элементов, составляющих кровь. Повторим, что роль витаминов В6, В9 и В12 и железа в этих процессах приоритетна, и скачки уровня hct всегда так или иначе приводят к выводу о нехватке этих веществ.
Кроме этой четвёрки внимание стоит уделить и другим питательным соединениям.
- Витамин Е – жирорастворимая форма, может накапливаться в любых тканях, но в основном в жировых. Защищает мембраны эритроцитов от повреждений в результате окислительного стресса;
- Витамин С – добавляет железо в процесс синтеза гемоглобина, начиная с образования эритроцитов в красном костном мозге;
- Витамин А (ретинол) – помогает переносу железа из «запасов»;
- Витамин В2 (рибофлавин) – помогает не выводить необходимое железо прежде времени через мочеполовую систему;
- Витамин D2 (эргокальциферол) – помогает транспортировать железо из клеток-депо в красный костный мозг, где продуцируется гемоглобин в клетке эритроцита;
- Медь – помогает железу окисляться до уровня усваиваемого (двухвалентного);
- Жирные кислоты Омега 3 и Омега 6 – стимулируют и регулируют образование новых клеток в процессе эритропоэза (образование эритроцитов).
Нередко при сомнительных анализах hct можно обратиться к дополнительному исследованию крови на витамины и микроэлементы, которые участвуют в кроветворении. На основании подробных данных можно говорить о разработке персонального комплекса микронутриентов, который закроет потребности именно в рамках индивидуальных особенностей работы организма.
Повышение показателя гематокрита
Многих интересует вопрос, когда гематокрит повышен, что это значит. Прежде всего, показатель увеличивается при ускоренном продуцировании эритроцитов костным мозгом. Также к отклонениям выше нормы может привести увеличение размеров красных кровяных телец. Это происходит при различных патологических состояниях, а именно:
- Первичный эритроцитоз, возникающий на фоне сверхактивной выработки эритроцитов, чаще всего, это свидетельствует об опухолевых процессах в костном мозге.
- Вторичный эритроцитоз связан с патологиями дыхательной и сердечно-сосудистой системы, в частности, он развивается при дыхательной недостаточности или пороке сердца.
Уменьшение объема плазмы, а, следовательно, и повышение показателя гематокрита может указывать о развитии перитонита, лейкозе или патологиях почек. Происходит это также при обширных ожогах. Причиной дегидратации часто становится некомпенсированный сахарный диабет.
Эритроцитоз на начальной стадии, когда гематокрит незначительно повышен, протекает бессимптомно. В большинстве случаев отклонения обнаруживают случайно в процессе проведения планового медосмотра. Но при значительном увеличении обнаруживается случайно, при сдаче анализа крови по другим причинам. Только при значительном увеличении гематокрита возникают настораживающие признаки:
- Боли в суставах и мышцах.
- Одышка, слабость и повышенное потоотделение.
- Головокружение.
- Повышение давления.
Поскольку симптомы не являются специфичными, при их появлении следует пройти полное обследование с целью постановки правильного диагноза. Лечение может быть успешным только в случае, если будет установлена причина увеличение количества эритроцитов в общем объеме крови.
Снижение гематокрита
Пониженный показатель гематокрита бывает при уменьшении количества красных кровяных телец или их размера – эритроцитопении. Причиной может быть и накопление воды в организме, когда кровь становится более жидкой – гипергидратация, а также гиперпротеинемия или накопление белков в плазме, способствующее задержке жидкости.
Причины
Понижению гематокрита способствуют длительная неподвижность, голодание или строгая диета, прием антикоагулянтов и дезагрегантов, внутривенные инфузии в больших объемах; обильное питье, хронический алкоголизм, чрезмерное употребление соли, менструация у женщин.
Также изменение показателя в сторону снижения может указывать на следующие патологии:
- железо-, B12- либо фолиево-дефицитная анемия;
- выраженное кровотечение;
- нарушение продукции гемоглобина при серповидно-клеточной анемии;
- фиброзное перерождение печени – цирроз;
- нарушение работы органов мочевыделительной системы;
- гемолиз эритроцитов – разрушение красных кровяных телец вследствие наследственной мутации, аутоиммунных процессов или токсического воздействия на клетки крови;
- малярия, брюшной тиф;
- онкологические заболевания костного мозга либо его метастатическое поражение из других органов;
- увеличение количества белка в плазме на фоне рвоты, диареи, онкологических заболеваний крови и иных состояний.
Во время беременности снижение гематокрита может наблюдаться в случае токсикоза, совсем юного возраста матери, многоплодия, малого промежутка времени между беременностями, а также после 20-й недели вынашивания плода из-за физиологического увеличения жидкости в организме.
Симптомы
Снижение гематокрита в крови сопровождается гипоксией различных органов, так как именно красные кровяные тельца в норме разносят кислород по организму. Такое состояние проявляется следующими симптомами:
- быстрая утомляемость;
- общая слабость;
- сонливость;
- учащенное сердцебиение и дыхание;
- чувство нехватки воздуха;
- головная боль, головокружение;
- снижение памяти и концентрации внимания;
- выпадение волос;
- мраморность или бледность кожи.
Лечение
Снижение гематокрита у взрослого до 35-30% требует амбулаторного наблюдения врача, исключения возможных серьезных заболеваний, коррекции рациона с увеличением потребления продуктов животного происхождения, в частности, красного мяса и печени, листовой зелени. Показатель ниже 13% характерен для угрожающих жизни патологий и выявляется обычно у пациентов в тяжелом состоянии в больнице. Тактика ведения пациента определяется основным заболеванием, которое привело к изменению уровня гематокрита.
Автор:
Бактышев Алексей Ильич, Врач общей практики (семейный врач), врач ультразвуковой диагностики, главный врач
Железодефицитная анемия у детей грудного и младшего возраста
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания и патологические состояния, характеризующиеся уменьшением содержания гемоглобина и/или эритроцитов в единице объема крови, приводящие к нарушению снабжения тканей кислородом. Применяются следующие лабораторные критерии анемии (Н. П. Шабалов, 2003). В зависимости от возраста детей уровень гемоглобина составляет:
- 0–1 сутки жизни — < 145 г/л;
- 1–14 дней жизни — < 130 г/л;
- 14–28 дней жизни — < 120 г/л;
- 1 мес — 6 лет — < 110 г/л.
Из всех анемий самой распространенной является железодефицитная (ЖДА), которая составляет примерно 80% от всех анемий. По данным Всемирной организации здравоохранения (ВОЗ), в мире более 500 тыс. человек страдает ЖДА. Распространенность ЖДА у детей в России и развитых европейских странах составляет: около 50% — у детей младшего возраста; более 20% — у детей старшего возраста.
ЖДА — это клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
Железо — один из основных микроэлементов в организме человека. В норме в организме взрослого человека содержится 3–5 г железа в связанной форме. 70% общего количества железа входит в состав гемопротеинов. Железо в этих соединениях связано с порфирином. Основной представитель этой группы — гемоглобин (58% железа); также железо содержится в миоглобине (8%), цитохромах, пероксидазах, каталазах — до 4%. Железо входит и в состав негемовых ферментов (ксантиноксидаза, никотинамидадениндинуклеотид (НАДН)-дегидрогеназа, аконитаза, локализующиеся в митохондриях); транспортной формы железа (трансферрин, лактоферрин). Запасы железа в организме существуют в двух формах: в виде ферритина (до 70%) и гемосидерина (до 30%). Особенность распределения железа у детей младшего возраста заключается в том, что у них выше содержание железа в эритроидных клетках и меньше железа приходится на мышечную ткань.
Всасывание железа происходит преимущественно в двенадцатиперстной кишке и проксимальных отделах тощей кишки. В суточном рационе обычно содержится около 5–20 мг железа, а усваивается только около 1–2 мг в сутки. Степень абсорбции железа зависит как от его количества в потребляемой пище и биодоступности, так и от состояния желудочно-кишечного тракта (ЖКТ).
Легче абсорбируется железо в составе гема (мясные продукты) — 9–22%. Всасывание негемового железа определяется диетой и особенностями желудочно-кишечной секреции.
Особенно активно всасывание железа происходит из грудного молока, хотя его содержание в нем невелико — всего 1,5 мг в литре; биодоступность железа грудного молока составляет до 60%. Этому способствует особая форма, в которой оно представлено, — в виде железосодержащего белка лактоферрина. В молекуле лактоферрина определены два активных центра связывания ионов Fe3+. Лактоферрин в грудном молоке содержится в виде насыщенной и ненасыщенной форм. Соотношение форм лактоферрина меняется в зависимости от периода лактации. В течение первых 1–3 мес жизни превалирует насыщенная железотранспортная форма лактоферрина. Наличие специфических рецепторов к лактоферрину на эпителиальных клетках слизистой оболочки кишечника способствует адгезии с ними лактоферрина и более полной его утилизации. Кроме того, лактоферрин, связывая лишнее, не всосавшееся в кишечнике железо, лишает условно-патогенную микрофлору необходимого для ее жизнедеятельности микроэлемента и запускает неспецифические бактерицидные механизмы. Установлено, что бактерицидная функция иммуноглобулина A реализуется только в присутствии лактоферрина.
Физиологические потери железа с мочой, потом, калом, через кожу, волосы и ногти не зависят от пола и составляют 1–2 мг в сутки, у женщин во время менструации — 2–3 мг в сутки. У детей потеря железа составляет 0,1–0,3 мг в сутки, возрастая до 0,5–1,0 мг в сутки у подростков.
Ежедневная потребность детского организма в железе составляет 0,5–1,2 мг в сутки. У детей раннего возраста в связи с быстрыми темпами роста и развития наблюдается повышенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из депо: у недоношенных детей к 3-му месяцу, у доношенных — к 5–6-му мес жизни. Для обеспечения нормального развития ребенка в суточном рационе новорожденного должно содержаться 1,5 мг железа, а у ребенка 1–3 лет — не менее 10 мг.
Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и ЖКТ. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка. Установлено, что у детей, имевших в младенчестве железодефицитную анемию, в возрасте 3–4 лет определяются нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения из-за нарушения миелинизации и, как следствие этого, нарушение проводимости нервов.
Причины железодефицитных состояний у детей очень разнообразны. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. К антенатальным причинам относят также и осложненное течение беременности, нарушение маточно-плацентарного кровообращения, фетоматеринские и фетоплацентарные кровотечения, синдром фетальной трансфузии при многоплодной беременности. Интранатальными причинами дефицита железа являются: фетоплацентарная трансфузия, преждевременная или поздняя перевязка пуповины, интранатальные кровотечения из-за травматических акушерских пособий или аномалий развития плаценты или пуповины. Среди постнатальных причин сидеропенических состояний на первое место выступает недостаточное поступление железа с пищей. При этом более всего страдают новорожденные, находящиеся на искусственном вскармливании неадаптированными молочными смесями, коровьим и козьим молоком. Другими постнатальными причинами ЖДА являются: повышенная потребность организма в железе; потери железа, превышающие физиологические; заболевания ЖКТ, синдром нарушенного кишечного всасывания; дефицит запасов железа при рождении; анатомические врожденные аномалии (дивертикул Меккеля, полипозы кишечника); употребление продуктов, тормозящих абсорбцию железа.
В группе риска всегда находятся недоношенные дети и дети, родившиеся с очень большой массой, дети с лимфатико-гипопластическим типом конституции.
У детей первого года жизни к дефициту железа чаще всего приводит несбалансированная диета, в частности вскармливание исключительно молоком, вегетарианство, недостаточное употребление мясных продуктов.
К сидеропении способны приводить кровотечения различной этиологии. Источником этого могут быть: грыжа пищеводного отверстия диафрагмы, варикозное расширение вен пищевода, желудочно-кишечные язвы, опухоли, дивертикулы, язвенный колит, геморроидальные узлы, а также кровотечения из мочеполового тракта и дыхательных путей. Прием некоторых медикаментов, таких как нестероидные противовоспалительные препараты, салицилаты, кумарины, глюкокортикостероиды, также может привести к потере железа. Дефицит железа всегда сопутствует заболеваниям, сопровождающимся нарушениями кишечного всасывания (энтериты, болезнь Крона, паразитарные инвазии и др.). Дисбактериоз кишечника также препятствует нормальному перевариванию пищи и тем самым снижает способность организма усваивать железо. Кроме того, может иметь место нарушение транспорта железа из-за недостаточной активности и снижения содержания трансферрина в организме.
Распознать причину развития ЖДА в каждом конкретном случае чрезвычайно важно. Ориентация на нозологическую диагностику необходима, так как в большинстве случаев при лечении анемии можно воздействовать и на основной патологический процесс.
ЖДА проявляется общими симптомами. Один из главных и видимых признаков — бледность кожных покровов, слизистых оболочек, конъюнктив глаз. Обращают на себя внимание общая вялость, капризность, плаксивость, легкая возбудимость детей, снижение общего тонуса организма, потливость, отсутствие или снижение аппетита, поверхностный сон, срыгивание, рвота после кормления, понижение остроты зрения. Выявляются изменения со стороны мышечной системы: ребенок с трудом преодолевает физические нагрузки, отмечается слабость, утомляемость. У детей первого года жизни может наблюдаться регресс моторных навыков.
Во втором полугодии жизни и у детей старше года наблюдаются признаки поражения эпителиальной ткани — шершавость, сухость кожи, ангулярный стоматит, болезненные трещины в уголках рта, глоссит или атрофия слизистой оболочки ротовой полости, ломкость и тусклость волос, их выпадение, матовость и ломкость ногтей, разрушение зубов (кариес), отставание в физическом и психомоторном развитии.
В зависимости от степени тяжести заболевания выявляются симптомы поражения органов и систем: сердечно-сосудистой — в виде функционального шума в сердце, тахикардии; нервной системы — в виде головных болей, головокружений, обмороков, ортостатических коллапсов. Возможно увеличение размеров печени, селезенки. Со стороны ЖКТ наблюдается затрудненное глотание, вздутие кишечника, диарея, запоры, извращение вкуса — желание есть глину, землю.
Диагноз ЖДА ставится на основании клинической картины, лабораторных признаков анемии и дефицита железа в организме: гипохромная (цветовой показатель < 0,85) анемия различной степени тяжести, гипохромия эритроцитов, снижение средней концентрации гемоглобина в эритроците (менее 24 пг), микроцитоз и пойкилоцитоз эритроцитов (в мазке периферической крови); уменьшение количества сидеробластов в пунктате костного мозга; уменьшение содержания железа в сыворотке крови (< 12,5 мкмоль/л); повышение общей железосвязывающей способности сыворотки (ОЖСС) более 85 мкмоль/л (показатель «голодания»); повышение уровня трансферрина в сыворотке крови, при снижении его насыщения железом (менее 15%); снижение уровня ферритина в сыворотке (< 15 мкг/л).
Лечение ЖДА
Лечение ЖДА у детей раннего возраста должно быть комплексным и базироваться на четырех принципах: нормализация режима и питания ребенка; возможная коррекция причины железодефицита; назначение препаратов железа; сопутствующая терапия.
Важнейшим фактором коррекции железодефицита является сбалансированное питание, и в первую очередь грудное вскармливание. Грудное молоко не только содержит железо в высокобиодоступной форме, но и повышает абсорбцию железа из других продуктов, употребляемых одновременно с ним. Однако интенсивные обменные процессы у грудных детей приводят к тому, что к 5–6-му мес жизни антенатальные запасы железа истощаются даже у детей с благополучным перинатальным анамнезом и малышей, вскармливаемых грудным молоком.
Из других продуктов питания наибольшее количество железа содержится в свиной печени, говяжьем языке, телячьих почках, яичном желтке, устрицах, бобах, кунжуте, морской капусте, пшеничных отрубях, гречке, фисташках, турецком горохе, персиках, овсяных хлопьях, шпинате, лесных орехах и др. (табл.).
Абсорбцию железа тормозят танины, содержащиеся в чае, карбонаты, оксалаты, фосфаты, этилендиаминтетрауксусная кислота, используемая в качестве консерванта, антацидные препараты, тетрациклины. Аскорбиновая, лимонная, янтарная и яблочная кислоты, фруктоза, цистеин, сорбит, никотинамид усиливают всасывание железа.
Необходимы длительные прогулки на свежем воздухе, нормализация сна, благоприятный психологический климат, профилактика острых респираторных вирусных инфекций (ОРВИ), ограничение физической нагрузки. Питание ребенка должно быть сбалансированным и включать продукты, богатые железом, и вещества, усиливающие его всасывание в кишечнике. Детям, страдающим ЖДА, необходимо вводить прикорм на 2–4 нед раньше, чем здоровым. Введение мясного прикорма целесообразно начинать в 6 мес. Следует отказаться от введения в рацион ребенка таких каш, как манная, рисовая, толокняная, отдавая предпочтение гречневой, ячменной, просяной.
Однако эти меры недостаточны и не приводят к излечению ЖДА, поэтому основой терапии являются препараты железа. К основным из них, применяемым перорально, относятся: соединения трехвалентного железа — гидроксид-полимальтозный комплекс (полимальтозат железа), мальтофер, мальтофер фол, феррум лек и железо-протеиновый комплекс (железа протеин сукцинилат) — ферлатум; соединения двухвалентного железа — актиферрин, ферроплекс, тардиферон, гемофер, тотема, фумарат железа, ферронат.
Начинать терапию следует препаратами для приема внутрь и только при плохой их переносимости (тошнота, рвота, диарея), синдроме нарушенного всасывания, резекции тонкого кишечника и т. д. — препараты железа назначают парентерально. При назначении пероральных форм следует отдавать предпочтение неионным соединениям железа — протеиновый (ферлатум) и гидроксид-полимальтозный комплексы Fe3+ (мальтофер, мальтофер фол, феррум лек). Эти соединения имеют большую молекулярную массу, что затрудняет их диффузию через мембрану слизистой кишечника. Они поступают из кишечника в кровь в результате активного всасывания. Это объясняет невозможность передозировки препаратов в отличие от солевых соединений железа, всасывание которых происходит по градиенту концентрации. Взаимодействия их с компонентами пищи и лекарственными препаратами не происходит, что позволяет использовать неионные соединения железа, не нарушая режим питания и терапии сопутствующей патологии. Их применение существенно снижает частоту развития побочных эффектов, обычно наблюдаемых при назначении пероральных препаратов железа (тошнота, рвота, диарея, запоры и др.). Кроме того, у детей раннего возраста большое значение имеет лекарственная форма препарата. В этом возрасте удобно использовать капли и сиропы, что обеспечивает в том числе возможность точного дозирования препаратов и не вызывает негативного отношения ребенка.
При назначении любых препаратов железа необходимо рассчитывать индивидуальную потребность в нем для каждого пациента, исходя из того, что оптимальная суточная доза элементарного железа составляет 4–6 мг/кг. Среднесуточная доза железа при лечении ЖДА составляет 5 мг/кг. Применение более высоких доз не имеет смысла, поскольку объем всасывания железа не увеличивается.
Применение парентеральных препаратов железа показано для быстрого достижения эффекта при анемии тяжелой степени; патологии ЖКТ, сочетающейся с нарушением всасывания; неспецифическом язвенном колите; хроническом энтероколите; при тяжелой непереносимости оральных форм препаратов. На сегодняшний день в Российской Федерации для внутривенного введения разрешен только один препарат — венофер (сахарат железа), для внутримышечного может использоваться феррум лек.
Необходимо помнить, что у детей раннего возраста дефицит железа никогда не бывает изолированным и часто сочетается с недостаточностью витаминов С, В12, В6, РР, А, Е, фолиевой кислоты, цинка, меди и др. Это связано с тем, что алиментарная недостаточность и нарушенное кишечное всасывание, приводящие к дефициту железа, влияют и на насыщаемость данными микронутриентами. Поэтому в комплексную терапию ЖДА необходимо включать поливитаминные препараты.
Об эффективности терапии ЖДА можно судить уже через 7–10 дней по увеличению ретикулоцитов в 2 раза по сравнению с исходным количеством (так называемый ретикулоцитарный криз). Также оценивается прирост гемоглобина, который должен составлять 10 г/л и более в неделю. Соответственно, достижение целевого уровня гемоглобина наблюдается в среднем через 3–5 нед от начала терапии в зависимости от тяжести анемии. Однако лечение препаратами железа должно проводиться в достаточных дозах и длительно (не менее 3 мес) даже после нормализации уровня гемоглобина, с тем чтобы пополнить запасы железа в депо.
Если же в течение 3–4 нед не наблюдается значимого улучшения показателей гемоглобина, то необходимо выяснить, почему лечение оказалось неэффективным. Наиболее часто речь идет: о неадекватной дозе препарата железа; продолжающейся или неустановленной кровопотере; наличии хронических воспалительных заболеваний или новообразований; сопутствующем дефиците витамина В12; неверном диагнозе; глистной инвазии и других паразитарных инфекциях.
Противопоказаниями к назначению препаратов железа являются:
- отсутствие лабораторного подтверждения дефицита железа;
- сидероахрестические анемии;
- гемолитические анемии;
- гемосидероз и гемохроматоз;
- инфекция, вызванная грамотрицательной флорой (энтеробактерии, синегнойная палочка, клебсиелла).
При развитии тяжелых анемий, сопровождаемых угнетением эритропоэза и снижением продукции эритропоэтина, показано назначение препаратов рекомбинантного человеческого эритропоэтина (рчЭПО). Особое значение имеет применение рчЭПО при развитии ранней анемии недоношенных, которая развивается на втором месяце жизни и встречается, по данным различных авторов, в 20–90% случаев. Назначение препаратов рчЭПО (рекормон, эпрекс, эпокрин) приводит к резкой активизации эритропоэза и, как следствие, к значительному возрастанию потребностей в железе.
Поэтому применение рчЭПО является показанием к назначению препаратов железа, как правило, парентеральных. В настоящее время в Российской Федерации разрешены к применению a- и b-эпоэтины, которые вошли в список дополнительного лекарственного обеспечения. Назначeние рчЭПО позволяет в большинстве случаев избежать гемотрансфузий, при которых велика вероятность осложнений (трансфузионные реакции, сенсибилизация и пр.). Предпочтительным способом введения препаратов рчЭПО, особенно в раннем детском возрасте, является подкожный. Подкожный способ введения более безопасный и экономичный, так как для достижения эффекта необходимы меньшие дозы, чем при внутривенном введении. До недавнего времени в странах Евросоюза и в Российской Федерации для лечения гипорегенераторных анемий у детей использовались в основном β-эритропоэтины, которые при подкожном введении не вызывали значимых побочных реакций в отличие от a-эритропоэтинов, при подкожном введении которых был велик риск развития красноклеточной аплазии. Наиболее широкое распространение среди β-эритропоэтинов получил препарат рекормон (Ф. Хоффманн-Ля Рош), который удобен в применении и приводит к быстрому повышению уровня эритроцитов и ретикулоцитов, не влияя на лейкопоэз, повышает уровень гемоглобина, а также скорость включения железа в клетки.
С 2004 г. в европейских странах разрешено подкожное введение a-эритропоэтинов, среди которых в нашей стране наиболее часто используются эпрекс (Янсен-Силаг) и эпокрин (Сотекс-ГосНИИ ОЧБ).
Целью лечения рчЭПО является достижение показателей гематокрита 30–35% и устранение необходимости переливаний крови. Значения целевой концентрации гемоглобина могут варьировать в зависимости от дней и месяцев жизни ребенка, однако не могут быть ниже 100–110 г/л. В зависимости от дозы целевые значения концентрации гемоглобина и гематокрита достигаются примерно через 8–16 нед лечения рчЭПО.
С целью профилактики ЖДА рчЭПО назначается недоношенным новорожденным, родившимся с массой тела 750–1500 г до 34-й недели беременности.
Лечение эритропоэтином должно начинаться как можно раньше и продолжаться 6 нед. Препарат рекормон вводят подкожно в дозе 250 МЕ/кг 3 раза в неделю. Однако необходимо учитывать, что чем меньше возраст ребенка, тем более высокие дозы эритропоэтина ему требуются, поэтому доза может быть увеличена.
Как было сказано выше, терапия рчЭПО приводит к резкому возрастанию потребления железа, поэтому в большинстве случаев, особенно у недоношенных детей, одновременно с повышением гематокрита снижается содержание ферритина в сыворотке. Быстрое расходование запасов железа в организме может привести к ЖДА. Поэтому всем больным, получающим терапию рчЭПО, показано назначение препаратов железа. Терапия препаратами железа должна продолжаться до нормализации уровня сывороточного ферритина (не менее 100 мкг/мл) и насыщения трансферрина (не менее 20%). Если концентрация ферритина в сыворотке сохраняется стойко ниже 100 мкг/мл или есть другие признаки дефицита железа, дозу железа следует увеличить, в том числе с использованием парентеральных препаратов.
Профилактика ЖДА у детей раннего возраста включает в себя: антенатальную (правильный режим и питание беременной, своевременное выявление и лечение анемии беременной, превентивное назначение препаратов железа женщинам из групп риска по развитию ЖДА); постнатальную (соблюдение гигиенических условий жизни ребенка, длительное грудное вскармливание и своевременное введение прикормов, адекватный выбор смеси для детей, находящихся на смешанном и искусственном вскармливании, профилактика развития у ребенка рахита, гипотрофии и ОРВИ). В профилактическом назначении препаратов железа нуждаются:
- женщины репродуктивного возраста, страдающие обильными и длительными менструальными кровотечениями;
- постоянные доноры;
- беременные, особенно повторные беременности, следующие с коротким интервалом;
- женщины с дефицитом железа в период лактации.
Профилактическое назначение препаратов железа показано детям из групп риска по развитию ЖДА:
- недоношенные дети (с 2-месячного возраста);
- дети от многоплодной беременности, осложненных беременностей и родов;
- крупные дети с высокими темпами прибавки массы и роста;
- дети с аномалиями конституции;
- страдающие атопическими заболеваниями;
- находящиеся на искусственном вскармливании неадаптированными смесями;
- с хроническими заболеваниями;
- после кровопотерь и хирургических вмешательств;
- с синдромом мальабсорбции.
Доза железа, назначаемого с профилактической целью, зависит от степени недоношенности ребенка:
- для детей с массой тела при рождении менее 1000 г — 4 мг Fe /кг/день;
- для детей с массой тела при рождении от 1000 до 1500 г — 3 мг Fe/кг/день;
- для детей с массой тела при рождении от 1500 до 3000 г — 2 мг Fe/кг/день.
Значимость проблемы ЖДА у детей раннего возраста обусловлена ее большой распространенностью в популяции и частым развитием при различных заболеваниях, что требует постоянной настороженности врачей любых специальностей. Тем не менее на современном этапе в арсенале врача имеется достаточно диагностических и лечебных возможностей для раннего выявления и своевременной коррекции сидеропенических состояний.
Литература
- Анемии у детей/под ред. В. И. Калиничевой. Л.: Медицина, 1983. 360 с.
- Анемии у детей: диагностика и лечение/под ред. А. Г. Румянцева, Ю. Н. Токарева. М., 2000. 128 с.
- Аркадьева Г. В. Диагностика и лечение железодефицитных анемий. М., 1999. 59 с.
- Белошевский В. А. Железодефицит у взрослых, детей и беременных. Воронеж, 2000. 121 с.
- Борисова И. П., Скобин В. Б., Павлов А. Д. Раннее назначение рекомбинантного эритропоэтина у недоношенных детей/7-й Национальный конгресс «Человек и лекарство». М., 2000. С. 125.
- Вахрамеева С. Н., Денисова С. Н. Латентная форма железодефицитной анемии беременных женщин и состояние здоровья их детей//Российский вестник перинатологии и педиатрии. 1996. № 3. С. 26–29.
- Дворецкий Л. И., Воробьев П. А. Дифференциальный диагноз и лечение при анемическом синдроме. М.: Ньюдиамед, 1994. 24 с.
- Дворецкий Л. И. Железодефицитные анемии//Русский медицинский журнал. 1997. № 19. С. 1234–1242.
- Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 190 с.
- Казакова Л. М., Макрушин И. М. Иммунитет при дефиците железа// Педиатрия. 1992. № 10–12. С. 54–59.
- Казюкова Т. В., Самсыгина Г. А., Левина А. А. Дефицит железа у детей: проблемы и решения//Consilium medicum. 2002. С. 17–19.
- Малаховский Ю. Е., Манеров Ф. К., Сарычева Е. Г. Легкая форма железодефицитной анемии и латентный дефицит железа — пограничные состояния у детей первых двух лет жизни//Педиатрия. 1988. № 3. С. 27–34.
- Папаян А. В., Жукова Л. Ю. Анемии у детей: руководство для врачей. СПб.: Питер, 2001. 382 с.
- Пригожина Т. А. Эффективность рекомбинантного эритропоэтина в комплексной профилактике и лечении ранней анемии недоношенных: автореф. дис. … канд. мед. наук. М., 2001. 19 с.
- Румянцев А. Г., Морщакова Е. Ф. Павлов А. Д. Эритропоэтин. Биологические свойства. Возрастная регуляция эритропоэза. Клиническое применение. М., 2002. С. 137–144; 266–270.
- Румянцев А. Г., Морщакова Е. Ф., Павлов А. Д. Эритропоэтин в диагностике, профилактике и лечении анемий. М., 2003. 568 с.
- Сергеева А. И., Султанова К. Ф., Левина А. А. и др. Показатели метаболизма железа у беременных женщин и детей раннего возраста//Гематология и трансфузиология. 1993. № 9–10. С. 30–33.
- Тетюхина Л. Н., Казакова Л. М. Профилактика дефицита железа как мера по снижению заболеваемости детей//Педиатрия. 1987. № 4. С. 72–73.
- Dallman P. R., Looker A. C., Johnson C. L. et al. Iron Nutrition in Health and Disease. Eds. Hallberg L., Asp N. G. Libbey; London. 1996; 65–74.
- Messer Y., Escande B. Erytropoietin and iron in the anemia of prematurity. TATM 1999; 15–17.
- Ohls R. K. The use of erythropoetin in neonatoles//Clin Perinatol. 2000; 20 (3): 681–696.
- Ulman J. The role of erythropoietin in erythropoiesis regulation in fetuses and newborn infants//Ginekol. Pol. 1996; 67:205–209.
Л. А. Анастасевич, кандидат медицинских наук А. В. Малкоч, кандидат медицинских наук РГМУ, Москва