Клиническое применение фиксированных комбинаций антигипертензивных лекарственных средств
В настоящее время вопросы рациональной фармакотерапии, оптимального выбора лекарственных средств при различных заболеваниях имеют особую актуальность, в том числе при сердечно-сосудистых заболеваниях (ССЗ), которые остаются лидирующей причиной смертности во всем мире. Число людей с заболеваниями сердечно-сосудистой системы (ССС) по данным современных зарубежных источников превышает 100 млн. Ежегодно от ССЗ умирает 16,7 млн человек во всем мире, причем почти в 50% случаев причиной смерти является ишемическая болезнь сердца (ИБС) и почти в 30% случаев — мозговой инсульт (МИ) [1]. Среди ССЗ наиболее распространенным является артериальная гипертония (АГ). Именно с ней чаще всего приходится сталкиваться практическим врачам, и именно она является серьезным прогностическим фактором риска (ФР) развития инфаркта миокарда (ИМ), МИ, хронической сердечной недостаточности (ХСН), общей и сердечно-сосудистой смертности [2].
В связи с этим вопросы рациональной фармакотерапии и оптимального выбора лекарственных средств при ССЗ приобретают особую актуальность. На основе доказательной медицины активно разрабатываются алгоритмы лечения различных ССЗ. Они находят отражение в международных и национальных клинических рекомендациях. Использование клинических рекомендаций в практической работе врача, несомненно, способствует улучшению результатов лечения и прогноза при ССЗ [3, 4].
Вместе с тем зачастую назначение оптимальной терапии представляет собой непростую задачу, особенно в условиях расширения фармацевтического рынка и появления большого количества все новых и новых лекарственных средств (ЛС), а также в связи с ростом распространенности коморбидных состояний, которые во многом затрудняют проведение лекарственной терапии и требуют особого пристального внимания к контролю эффективности и безопасности лекарственных средств. Как показывает практика, степень соответствия проводимой фармакотерапии принятым рекомендациям в реальной клинической практике остается достаточно низкой как в нашей стране, так и за рубежом [5, 6].
В 2013 г. вышли новые рекомендации Европейского общества гипертонии (European Society of Hypertension, ESH) и Европейского кардиологического общества (European Society of Cardiology, ESC) по лечению АГ [7], а также Российские рекомендации «Диагностика и лечение артериальной гипертонии» [8], которые являются основой для выбора рациональной фармакотерапии АГ врачами всех специальностей. Основная цель лечения больных АГ состоит в максимальном снижении риска развития сердечно-сосудистых осложнений (ССО) и смерти от них. Для достижения этой цели требуется:
- снижение артериального давления (АД) до целевого уровня;
- коррекция всех модифицируемых ФР (курение, дислипидемии, гипергликемия, ожирение);
- предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней;
- лечение ассоциированных и сопутствующих заболеваний (ИБС, сахарного диабета и др.).
Выбор фармакотерапии
В настоящее время для лечения больных АГ рекомендуются пять классов антигипертензивных ЛС с доказанным влиянием на степень сердечно-сосудистого риска и не имеющих существенных различий по выраженности антигипертензивного эффекта:
- ингибиторы ангиотензин-превращающего фермента (иАПФ);
- блокаторы рецепторов ангиотензина II (БРА);
- бета-адреноблокаторы (БАБ);
- антагонисты кальция (АК);
- тиазидные диуретики.
Каждый класс имеет свои особенности применения, преимущества и ограничения, связанные с возможностью развития нежелательных реакций.
Большой арсенал имеющихся лекарственных средств делает чрезвычайно важной и одновременно сложной задачу выбора конкретных препаратов, а дифференцированный выбор лекарственных средств остается актуальной проблемой для практикующих врачей в настоящее время. Особенно это касается больных, имеющих дополнительные факторы риска и сопутствующие заболевания, которые, с одной стороны, ухудшают прогноз при АГ, с другой, ограничивают применение ряда антигипертензивных лекарственных средств. Фармакотерапевтические подходы к лечению больных АГ с сопутствующими ФР и ассоцированными заболеваниями предполагают комплексный подход, позволяющий воздействовать не на каждое заболевание в отдельности, а на больного в целом.
Безусловно, каждый пациент требует серьезного осмысления, анализа особенностей его клинической ситуации, и с учетом этого следует выбирать тот или иной класс препаратов. Большую помощь практическому врачу на этом этапе могут оказать рекомендации, обобщающие доказательную базу по всем классам антигипертензивных ЛС. Некоторые препараты целесообразно считать предпочтительными для конкретных ситуаций, так как они использовались в этих ситуациях в клинических исследованиях или продемонстрировали более высокую эффективность при конкретных типах поражения органов-мишеней.
Приверженность к лечению
Обсуждая проблему рациональной фармакотерапии АГ, нельзя не остановиться на очень важном ее аспекте — низкой эффективности лечения АГ и недостижении целевых значений артериального давления (АД). Это объясняется различными факторами, не последнее место среди которых занимает низкая приверженность больных АГ лечению. Об этом свидетельствуют результаты клинико-эпидемиологических исследований, проводимых как за рубежом, так и в нашей стране. Так, по данным разных исследователей до 50% больных АГ самостоятельно прекращают лечение, назначенное врачом [9, 10]. О низкой приверженности к лечению свидетельствуют и результаты Российского многоцентрового исследования РЕЛИФ (Регулярное Лечение И проФилактика), проведенного в Центральном и Северо-Западном федеральных округах, которое показало, что 58,2% больных АГ принимают препараты только при повышении АД. Из них 63,6% принимают ЛС не каждый день, 39,7% прекращают лечение после нормализации АД, 32,9% пропускают прием по забывчивости, и только 3,3% не допускают пропусков приема лекарств [11].
Основные понятия приверженности к лечению
Под приверженностью к лечению понимают соответствие поведения пациента рекомендациям врача, включая прием препаратов, диету и/или изменение образа жизни. Приверженность к лечению предполагает такие понятия, как удержание на терапии (упорство) и комплаентность.
Удержание на терапии определяется длительностью периода получения медикаментозной терапии и оценивается количеством дней, в течение которых пациент получал терапию, или процентом больных, продолжающих лечение на протяжении определенного периода.
Комплаентность — показатель приверженности к медикаментозной терапии (соблюдение дозы, кратности и режима приема). Комплаентность оценивается индексом использования препарата, представляющим собой частное от деления количества дней приема полной дозы препарата (или его количества, выданного больному) на длительность (в днях) всего периода исследования (наблюдения). Идеальной целью представляется достижение стопроцентной приверженности, однако при любом хроническом заболевании получение подобного результата затруднительно. Если индекс использования препарата достигает 80% и более, комплаентность считается приемлемой.
Для того чтобы повысить информативность опроса больных в отношении приверженности к лечению, создаются специализированные вопросники и шкалы оценки приверженности. Они, как правило, включают в себя не только вопросы, имеющие непосредственное отношение к соблюдению рекомендаций по приему препаратов и немедикаментозных методов лечения, но и вопросы общепсихологического характера, касающиеся готовности больного к взаимодействию, ответственности, следованию советам и т. д. Некоторые из таких шкал сегодня уже валидизированы и рекомендованы к широкому применению.
Самый простой тест оценки комплаентности — тест Мориски–Грина, состоящий из четырех вопросов:
- Вы когда-нибудь забывали принять препараты?
- Не относитесь ли Вы иногда невнимательно к часам приема ЛС?
- Не пропускаете ли Вы прием препаратов, если чувствуете себя хорошо?
- Если Вы чувствуете себя плохо после приема ЛС, не пропускаете ли Вы следующий прием?
Комплаентными считают больных, набравших 4 балла, некомплаентными — менее 3 [12]. Использование этого простого и доступного метода поможет практическому врачу обратить внимание на тех пациентов, которым необходимо уделить дополнительное внимание с целью повысить их комплаентность.
Каковы же пути повышения приверженности больных к лечению?
На сегодня нет единой эффективной стратегии повышения комплаентности, однако, говоря о воздействии на приверженность к лечению, следует иметь в виду два основных аспекта.
Первый, касающийся собственно следования больным рекомендациям врача, в первую очередь зависит от мотивации к лечению. В данном аспекте основные усилия должны быть направлены на создание этой мотивации, что, прежде всего, требует установления контакта с пациентом и его обучения. Ряд авторов и групп экспертов на основании больших аналитических обзоров литературы делают акцент на принципиальном изменении самого подхода к участию пациента в лечебном процессе и более активном привлечении к принятию медицинского решения. По их мнению, без активного участия и желания пациента лечиться трудно добиться решения кратко- и среднесрочных, а тем более долгосрочных задач.
Доказано также, что пациенты не стремятся выполнять рекомендации врача, если они не информированы о своем заболевании и его осложнениях. Поэтому в данном аспекте основные усилия должны быть направлены на создание устойчивых и качественных отношений врач–пациент, на предоставление пациенту полной информации о заболевании и его осложнениях с целью создания мотивации к строгому и регулярному выполнению профилактических мероприятий и приему препаратов.
Одним из путей формирования партнерства «врач—пациент» является обучение пациентов, в частности в школах здоровья для пациентов с АГ, которые по сути представляют собой медицинскую профилактическую технологию, основанную на совокупности индивидуального и группового воздействия на пациентов и направленную на повышение уровня их знаний, информированности и практических навыков по рациональному лечению АГ, повышению приверженности пациентов к лечению и для профилактики осложнений заболевания, улучшению прогноза и повышению качества жизни.
Вторым аспектом приверженности к терапии является реальный ежедневный прием препаратов без существенных отклонений от дозы и режима приема. Этот аспект может быть существенно улучшен за счет упрощения самой схемы лечения и введения специальных приемов, помогающих больному не пропускать прием очередной дозы.
Необходимость использования комбинированной терапии АГ
Ключевым моментом современной антигипертензивной терапии является комбинированная терапия с использованием рациональных сочетаний лекарственных средств, позволяющая не только достигать целевого уровня АД, не снижая качества жизни больных АГ, но и снижать риск развития сердечно-сосудистых осложнений.
Результаты метаанализа крупномасштабных клинических исследований последних лет убедительно свидетельствуют о том, что для достижения целевого уровня АД и снижения сердечно-сосудистого риска (ССР) большинству пациентов необходимо назначать несколько антигипертензивных препаратов [13]. Комбинированная терапия, по сути, на сегодняшний день является приоритетным направлением в лечении больных АГ, что нашло отражение в новых Европейских и Российских рекомендациях по гипертонии [7, 8]. Комбинации из двух и более гипотензивных препаратов рекомендуется назначать пациентам уже на этапе стартовой терапии, в первую очередь больным с высоком ССР, т. е. больным с наличием трех и более факторов риска, с субклиническим поражением органов-мишеней, а также тем, у кого уже имеются ассоциированные клинические состояния.
Проведение комбинированной терапии больным АГ представляется оправданным и обоснованным также и в силу того, что по механизмам развития и становления АГ является многофакторным заболеванием, и сочетание ЛС с различным механизмом действия, взаимодополняющих друг друга, позволяет оптимально воздействовать на различные патогенетические механизмы АГ. Рациональная комбинация ЛС подразумевает использование препаратов из различных классов с разным механизмом действия с целью получения дополнительного гипотензивного эффекта и снижения риска развития нежелательных явлений. Сочетание препаратов с различным механизмом действия также может уменьшить изменения в тканях, по-разному влияя на механизмы повреждения органов-мишеней: сердца, сосудов и почек.
Фиксированные комбинации лекарственных средств — путь к улучшению приверженности пациентов
Повышение приверженности к антигипертензивной терапии — один из наиболее реальных способов повышения ее эффективности. Очевидно, что добиться соблюдения рекомендаций можно только при сотрудничестве врача с пациентом, во многом достигающемся за счет подробного и вместе с тем доступного информирования последнего о цели лечения АГ.
Способствовать улучшению приверженности может и использование фиксированных комбинаций антигипертензивных ЛС, получающих все более широкое распространение в последние годы [14]. Клинические исследования показали, что назначение фиксированных комбинаций небольших доз антигипертензивных препаратов, принадлежащих разным классам, более эффективно, чем применение тех же препаратов при монотерапии. Большое значение для рациональной фармакотерапии имеют фиксированные комбинированные препараты, для создания которых применяют усовершенствованные лекарственные формы. Преимуществами фиксированных лекарственных комбинаций являются простота назначения и титрования дозы, повышение эффективности лечения и более частое достижение целевого АД, удобство для пациента, улучшение приверженности больного к лечению, а также фармакоэкономические преимущества — улучшение соотношения стоимость/эффективность. Широкое применение фиксированных комбинаций ЛС уже на начальном этапе лечения является приоритетной тенденцией рациональной фармакотерапии АГ на сегодняшний день.
Преимущества фиксированных комбинаций заключаются в том, что они позволяют воздействовать одновременно на разные звенья патогенеза АГ. В результате данный подход к лечению позволяет добиться более выраженного гипотензивного эффекта по сравнению с применением монотерапии ЛС, входящими в состав комбинированного препарата, особенно в тех случаях, когда одно из них достаточно полно блокирует активацию контррегулирующих механизмов, обусловленную действием другого компонента. При этом нередко исчезает необходимость в использовании высоких доз отдельных препаратов.
Важным преимуществом применения комбинированных гипотензивных препаратов с фиксированными дозами является улучшение соблюдения больными предписанного режима терапии.
Большинство пациентов не принимают препараты регулярно и часто прерывают лечение на несколько дней. Даже в случаях, когда больные принимают назначенные антигипертензивные препараты, далеко не всегда они делают это в положенное время. В специальном исследовании с использованием электронных устройств было показано, что у 25% пациентов время приема препарата на 6 ч отличается от предписанного врачом. Наибольшие отклонения от предписанного режима терапии отмечаются в случаях, когда режим дозирования препарата слишком сложен или возникают значимые нежелательные лекарственные реакции. Уменьшение числа ежедневно принимаемых таблеток, необходимых для снижения АД, считается важным преимуществом комбинированных препаратов с фиксированными дозами. При этом если комбинированный препарат приходится принимать 2 раза в сутки, степень соблюдения предписанного режима терапии снижается, поэтому предпочтение отдают препаратам, эффективным при однократном приеме в сутки.
К настоящему времени в мире накоплена большая доказательная база по изучению эффективности, переносимости, преимуществ в отношении влияния на состояние органов-мишеней и показатели ССР различных двухкомпонентных комбинаций антигипертензивных ЛС.
Одним из сравнительно новых комбинированных ЛС является препарат Конкор АМ, представляющий собой фиксированную комбинацию БАБ (бисопролола) и дигидропиридинового АК (амлодипина). Каждый из этих препаратов давно используется в клинической практике и имеет большую доказательную базу.
БАБ за последние 50 лет заняли прочные позиции в фармакотерапии наиболее распространенных ССЗ и без них уже невозможно представить современную кардиологию. Большая доказательная база позволила включить этот класс препаратов практически во все современные рекомендации — и по лечению АГ, и ИБС, и ХСН. Они снижают риск и частоту ССО, положительно влияют на клинические проявления заболевания и улучшают качество жизни больных с различными ССЗ, а также при сочетанной патологии [7, 8].
Основанием для широкого использования БАБ послужило выявление роли хронической гиперактивации симпатоадреналовой системы (САС) в развитии эндотелиальной дисфункции, гипертрофии левого желудочка, злокачественных нарушений сердечного ритма и прогрессировании хронической сердечной недостаточности. БАБ представляют собой весьма неоднородную по своим фармакологическим эффектам группу лекарственных препаратов, внутри которой имеются значимые различия в фармакокинетике и фармакодинамике, касающиеся двух основных показателей — кардиоселективности и липофильности. Общим свойством всех БАБ является конкурентный антагонизм в отношении β1-адренергических рецепторов. Наряду с блокадой β1-адренергических рецепторов БАБ могут блокировать и β2-адренорецепторы.
Опыт клинического применения БАБ при лечении АГ свидетельствует о том, что они, в особенности β1-селективные препараты, обладают достаточно высокой антигипертензивной эффективностью и хорошей переносимостью при длительном применении в средних терапевтических дозах у самых разных категорий больных [15–21].
Широкое распространение в клинической практике имеет бисопролол, который обладает высокой кардиоселективностью. Если принять способность блокировать β1-рецепторы у карведилола за единицу, то для метопролола этот показатель составит 6, для бисопролола — 21 [22]. Также, будучи амфофильным, то есть растворяющимся как в жирах, так и в воде, бисопролол имеет два пути элиминации — почечную экскрецию и печеночный метаболизм. Это обеспечивает большую безопасность применения у больных с сопутствующими поражениями печени и почек, пожилых больных, а также низкую вероятность лекарственного взаимодействия.
По антигипертензивному эффекту бисопролол не только не уступает другим БАБ, но по ряду показателей превосходит их. Так, в исследовании BISOMET было показано, что бисопролол сопоставим с метопрололом по степени снижения АД в покое, но значительно превосходит его по влиянию на уровень систолического АД и частоту сердечных сокращений при физической нагрузке [23]. Эффективность бисопролола по снижению ССР в сочетании с отсутствием негативного воздействия на показатели углеводного обмена доказана в крупных рандомизированных клинических исследованиях, в числе которых и такие известные, как CIBIS-II (Cardiac Insufficiency Bisoprolol Study II) [24], TIBBS (Total Ischemic Burden Bisoprolol Study) [25] и др.
Амлодипин, входящий в состав Конкор АМ, является АК III поколения, с периодом полувыведения более 35 часов, имеет большую селективность в отношении коронарных и мозговых сосудов. Препарат практически лишен инотропного эффекта и влияния на функцию синусового узла, атриовентрикулярную проводимость, что определяет его преимущество перед другими АК (группы верапамила и дилтиазема).
С точки зрения клинической фармакологии комбинация высокоселективного БАБ и дигидропиридинового АК является обоснованной и оправданной. Эффекты бисопролола и амлодипина являются взаимодополняющими в отношении снижения АД, поскольку они влияют на разные звенья патогенеза, позволяющие усилить антигипертензивную эффективность: вазоселективное действие амлодипина (уменьшение общего периферического сосудистого сопротивления (ОПСС)) и кардиопротективное действие бисопролола (уменьшение сердечного выброса, урежение частоты сердечных сокращений), что в свою очередь способствует снижению риска развития патологических состояний при АГ, таких как стенокардия, ИМ, ремоделирование миокарда, МИ [27].
В соответствии с российскими рекомендациями по лечению АГ, преимущественными показаниями к назначению Конкора АМ являются сочетание АГ с ИБС, атеросклеротическим поражением сонных и коронарных артерий, тахиаритмиями, а также изолированная систолическая АГ, АГ у пожилых пациентов, АГ у беременных.
Клинический опыт использования Конкора АМ свидетельствует о хорошей антигипертензивной эффективности препарата с высокой частотой достижения целевых значений АД [26, 28, 29].
Важно отметить, что проведенные исследования продемонстрировали хороший профиль переносимости препарата. Нежелательные явления были легкими и не потребовали отмены препарата. Также ни в одном из проводимых клинических исследованиях не отмечено отрицательных влияний на углеводный и липидный обмены [28, 29].
Важным с практической точки зрения является тот факт, что препарат выпускается в широком диапазоне доз бисопролола и амлодипина: 5 мг + 5 мг, 5 мг + 10 мг, 10 мг + 5 мг, 10 мг + 10 мг. Это позволяет выбирать оптимальный режим дозирования для каждого пациента с учетом индивидуальных особенностей гемодинамики.
Заключение
В настоящее время вопросы рациональной фармакотерапии, оптимального выбора лекарственных средств при различных заболеваниях имеют особую актуальность.
Качество фармакотерапии напрямую зависит от степени приверженности пациента к лечению. Приверженность — ключевая позиция, связывающая процесс и результат медицинского вмешательства. Использование в клинической практике фиксированных комбинаций антигипертензивных ЛС упрощает схему лечения больных АГ и способствует улучшению приверженности к лечению.
Препарат Конкор АМ — фиксированная комбинация разных доз бисопролола и амлодипина, обладает доказанной антигипертензивной эффективностью в сочетании с хорошим профилем безопасности. Компоненты препарата являются взаимодополняющими в отношении снижения АД, поскольку они влияют на разные звенья патогенеза, позволяющие усилить антигипертензивную эффективность: вазоселективное действие амлодипина (уменьшение ОПСС) и кардиопротективное действие бисопролола (уменьшение сердечного выброса, урежение ЧСС), что в свою очередь способствует снижению риска развития патологических состояний при АГ, таких как стенокардия, инфаркт миокарда, ремоделирование миокарда, мозговой инсульт.
Литература
- https://who.int/gho/mortality_burden_disease/en/
- Шальнова С. А., Баланова Ю. А., Константинов В. В. и др. Артериальная гипертония: распространенность, осведомленность, прием антигипертензивных препаратов и эффективность лечения среди населения Российской Федерации // РКЖ. 2006; 4: 45–50.
- Wolf-Maier K., Cooper R. S., Banegas J. R., Giampaoli S., Hense H. W., Joffres M. et al. Hypertension prevalence and blood pressure levels in 6 European countries, Canada and the United States // JAMA. 2003; 289: 2363–2369.
- Redon J., Olsen M. H., Cooper R. S., Zurriaga O., Martinez-Beneito M. A., Laurent S. et al. Stroke mortality trends from 1990 to 2006 in 39 countries from Europe and Central Asia: implications for control of high blood pressure // Eur Heart J. 2011; 32: 1424–1431.
- HYPERLINK «https://www.cardiotimes.com/2011/10/10/dramatic-underutilizationofproven-medications-for-cv-prevention/» Dramatic underutilization of provenmedications for CV prevention // /Lancet. 2011 (Published Online).
- Погосова Г. В., Колтунов И. Е., Соколова О. Ю. Вторичная профилактика артериальной гипертонии и ишемической болезни сердца в реальной клинической практике Российской Федерации. М.: Викас-принт, 2009; 154 с.
- ESH/ESC Guidelines for the management of arterial hypertension // Journal of Hypertension. 2013, № 31. С. 1281–1357.
- Клинические рекомендации «Диагностика и лечение артериальной гипертонии», 2013. https://www.cardioweb.ru/klinicheskie-rekomendatsi.
- Конради А. О. Значение приверженности к терапии в лечении кардиологических заболеваний // Consilium medicum. Справочник поликлинического врача. 2007; 6.
- Pruijm M. T., Maillard M. P., Burnier M. Приверженность пациентов лечению и выбор антигипертензивной терапии: фокус на лерканидипин. Service of Nephrology and Hypertension, Department of Medicine, University Hospital, Lausanne, Switzerland // Vasc Heal Risk Management. 2008; 4 (6): 1159–1166.
- Погосова Г. В., Колтунов И. Е., Мелик-Оганджанян Г. Ю., Соколова О. Ю. Приверженность к лечению сердечно-сосудистых заболеваний: проблема врачей и пациентов // Кардиоваскулярная терапия и профилактика, 2009; № 4.
- Morisky D. E., Green L. W., Levine D. M. Concurrent and predictive validity of selfreported measure of medical adherence // Med Care. 1986; 24: 67–73.
- Wald D. S. et al. Combination Therapy Versus Monotherapy in Reducing Blood Pressure: Meta-analysis on 11,000 Participants from 42 Trials // Am. J. Med. 2009; V. 122. № 3. P. 290.
- Морозова Т. Е., Юдина И. Ю. Современная стратегия улучшения приверженности лечению больных артериальной гипертонией: фиксированные комбинации лекарственных средств // Consillium medicum. 2010, т. 22, № 1, с. 22–28.
- Гуревич М. А. Современные подходы к применению b-адреноблокаторов // Экономический вестник фармации. 2003. № 3 (61). С. 63–64.
- Metra M., Giubbini R., Nodari S. Differential effects of beta-blocers in patients with failure: a prospective, randomized, double-blind comparision of the longterm of metoprolol versus carvedilol // Circulation. 2000; 102 (5): 546–551.
- Wikstrand J., Hjalmarson A., Waagstein F. Dose of metoprolol CR/XL and clinical outcomes in patients with heart failure: analysis of the experience in metoprolol CR/XL randomized intervention trial in chronic heart failure // J Am Coll Cardiol. 2002; 40 (3): 491-49-84.
- Danhlof B. et al. Cardiovascular morbidity and mortality in the Losartan intervention for endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. 2002; 359: 995-10-03.
- Efficacy of atenolol and captopril in reducing risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 39. UK Prospective Diabetes Study Group // BMJ. 1998; 317 (7160): 713–720.
- Nuttall S. L., Toescu V., Kendall M. J. Вeta-blocade after myocardial infarction // BMJ. 2003; 320 (7234): 581–588.
- Law M. R., Morris J. K., Wald N. J. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies // BMJ. May 23, 2009; 338: b1665.
- Brixius K. et al. Nebivolol, bucindolol, metoprolol and carvedilol are devoid of intrinsic sympathomimetic activity in human myocardium // British Journal of Pharmacology. 2001; 133: 1330–1338.
- Haasis R., Bethge H. Exercise blood pressure and heart rate reduction 24 and 3 hours after drug intake in hypertensive patients following 4 weeks of treatment with bisoprolol and metoprolol: a randomized multicentre double-blind study (BISOMET) // Eyr Heart Jour. 1987; 8; 103–113.
- CIBIS-II Investigators and Committees. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomized trial // Lancet. 1999; 353: 9–13.
- Von Arnim T. Medical treatment to reduce total ischemic burden: Total Ischemic Burden Bisoprolol Study (TIBBS), a multicenter trial comparing bisoprolol and nifedipine // J Am Coll Cardiol. 1995; 25: 231–238.
- Чесникова А. И., Сафроненко В. А., Коломацкая О. Е. Оценка эффективности фиксированной комбинации бисопролола и амлодипна в амбулаторном лечении больных артериальной гипертензией и ишемической болезнью сердца. Кардиология. 2014; 9: 30–36.
- Стрюк Р. И. Клиническое обоснование применения фиксированной комбинации бисопролола с амлодипином при АГ // Consilium medicum. 2013; 1: 23–25.
- Rana R., Patil A. Efficacy and safety of bisoprolol plus amlodipine fixed dose combination in essential hypertension // Indian Pract. 2008; 61: 225–234.
- Mehta S., Shah A. et fl. Efficacy and tolerability of a fixed dose combination of amlodipine and bisoprolol in essential hypertension // Indian Pract. 2005; 58: 751–759.
И. Ю. Юдина Т. Е. Морозова1, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
1 Контактная информация
Современная рациональная комбинированная терапия в лечении пациентов с артериальной гипертензией
По данным эпидемиологических исследований, распространенность артериальной гипертензии (АГ) среди взрослого населения в развитых странах мира колеблется от 20 до 40% и увеличивается с возрастом [1]. Повышенное АД обнаруживается более чем у 50% мужчин и женщин старше 60 лет [2]. Актуальность проблемы поддерживается возрастающими процессами урбанизации общества, создающими предпосылки для возникновения факторов риска (ФР), таких как стресс, гиподинамия, ожирение, вредные привычки и нарушенная экология. Повышенное АД является одним из главных ФР развития мозгового инсульта, ишемической болезни сердца (ИБС) и других сердечно-сосудистых заболеваний атеросклеротического происхождения, с которыми связано более 50% всех случаев смерти [3].
Клиническая практика и результаты многих мультицентровых исследований показали [4–6], что применение монотерапии в лечении АГ редко приводит к целевым уровням АД, увеличивает риск развития нежелательных явлений и снижает приверженность пациента к лечению. Применение препаратов в рациональном комбинированном режиме требует соответствия целому ряду обязательных условий: безопасность и эффективность компонентов; вклад каждого из компонентов в ожидаемый результат; разный, но взаимодополняющий механизм действия компонентов; лучший результат по сравнению с каждым из компонентов; сбалансированность компонентов по биодоступности и продолжительности действия; усиление органопротективных свойств; воздействие на универсальные (наиболее частые) механизмы повышения АД; уменьшение количества нежелательных явлений и улучшение переносимости [7–9].
Согласно современным национальным рекомендациям [10], рекомендациям Европейского общества по артериальной гипертонии (ЕОГ) и Европейского общества кардиологов (ЕОК) [11], тактика лечения эссенциальной АГ зависит от уровня АД и степени риска кардиоваскулярных осложнений. Основной целью лечения является максимальное снижение риска развития сердечно-сосудистых осложнений (ССО) и смерти от них. Основными задачами являются нормализация уровня АД, с целью предупреждения осложнений, при отсутствии или минимальном уровне нежелательных лекарственных реакций (НЛР), коррекция всех модифицируемых ФР (курение, дислипидемия, гипергликемия, ожирение), предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней, а также лечение ассоциированных и сопутствующих заболеваний – ИБС, сахарный диабет (СД) и т. д. [10, 11].
При лечении больных АГ величина АД должна быть менее 140/90 мм рт. ст., что является его целевым уровнем. При хорошей переносимости назначенной терапии целесообразно снижение АД до более низких значений. У пациентов с высоким и очень высоким риском ССО необходимо снизить АД до 140/90 мм рт. ст. и менее в течение 4 нед. В дальнейшем, при условии хорошей переносимости, рекомендуется снижение АД до 130/80 мм рт. ст. и менее. У больных ИБС уровень АД необходимо снижать до целевого значения 130/85 мм рт. ст. У больных СД и/или с заболеванием почек целевой уровень АД должен составлять менее 130/85 мм рт. ст. [10].
Разумеется, лечение АГ следует начинать с изменения образа жизни: снижение избыточной массы тела, ограничение потребления поваренной соли и спиртных напитков, увеличение физической активности и др. Ограничение потребления поваренной соли является достаточно эффективным способом снизить АД. Было отмечено, что ограничение потребления поваренной соли усиливает антигипертензивное действие многих антигипертензивных препаратов, в т. ч. блокаторов АТ1–ангиотензиновых рецепторов и β-адреноблокаторов.
Одним из важнейших условий обеспечения адекватного контроля АД и повышения приверженности пациентов к лечению является оптимальный выбор антигипертензивного средства в составе моно- или комбинированной фармакотерапии.
В настоящее время для лечения АГ рекомендованы пять основных классов антигипертензивных препаратов [10]:
1. ингибиторы ангиотензинпревращающего фермента (иАПФ) (каптоприл, эналаприл, периндоприл, лизиноприл, фозиноприл, квинаприл, трандолаприл и др.);
2. блокаторы рецепторов AT1 (БРА) (валсартан, лозартан, телмисартан, кандесартан, ирбесартан и др.);
3. блокаторы медленных кальциевых каналов (БМКК) (нифедипин, амлодипин и др.);
4. бета-адреноблокаторы (БАБ) (карведилол, бисопролол, небиволол, метопролола тартрат, метопролола сукцинат, атенолол и др.);
5. тиазидные и тиазидоподобные диуретики (гидрохлоротиазид (ГХТЗ), индапамид).
В качестве дополнительных классов антигипертензивных препаратов для комбинированной терапии могут использоваться α-адреноблокаторы (празозин, доксазозин), агонисты имидазолиновых рецепторов (моксонидин), прямой ингибитор ренина (алискирен).
Согласно настоящим национальным рекомендациям [10], выбор антигипертензивного препарата должен быть связан с особенностями его действия, принадлежностью к определенному классу, т. к. в настоящее время результаты клинических исследований, проведенных по правилам доказательной медицины, позволили установить ситуации преимущественного классового выбора препаратов. При выборе антигипертензивного препарата необходимо в первую очередь оценить эффективность, вероятность развития побочных эффектов и преимущества ЛС в определенной клинической ситуации (табл. 1).
На выбор препарата оказывают влияние многие факторы, наиболее важными из которых являются:
- наличие у больного ФР;
- поражение органов-мишеней;
- сопутствующие клинические состояния, поражения почек, МС, СД;
- сопутствующие заболевания, при которых необходимы назначение или ограничение применения антигипертензивных препаратов различных классов;
- предыдущие индивидуальные реакции больного на препараты различных классов;
- вероятность взаимодействия с лекарствами, которые пациенту назначены по другим поводам;
- социально-экономические факторы, включая стоимость лечения.
Начинать лечение необходимо с применения одного ЛС в минимальной суточной дозе (эта рекомендация не касается больных с тяжелой АГ или лиц, у которых предшествующая терапия была неэффективной). Применение новых препаратов следует начинать с использования низких доз, целью каждого очередного этапа лечения должно быть снижение уровня АД на 10–15% [10]. Если АД не снижается до желаемого уровня, дальнейшее лечение осуществляется путем постепенного – шаг за шагом – увеличения доз или присоединения новых ЛС. Неэффективные ЛС (не вызывающие снижения АД на 10–15 мм рт. ст.) и препараты, вызывающие НЛР, следует заменить [12].
Единых рекомендаций относительно того, с каких именно средств следует начинать лечение больного, не существует. Выбор ЛС зависит от возраста, пола и наличия сопутствующих заболеваний.
В настоящее время в лечении большинства пациентов с АГ применяются препараты, изменяющие активность РААС. Это иАПФ, БАБ и блокаторы рецепторов ангиотензина II (БРА). БРА – один из современных и наиболее динамично развивающихся классов антигипертензивных препаратов. БРА подавляют реализацию эффекта ангиотензина II через АТ1-рецепторы. Установлено, что гиперсекреция ангиотензина II ведет не только к развитию АГ, но и повреждению органов-мишеней, являясь одним из основных факторов прогрессирования АГ и ее осложнений, ремоделирования сердца и сосудов. Блокаторы АТ1-ангиотензиновых рецепторов совсем не случайно отнесены к категории основных антигипертензивных средств. Многочисленные контролируемые исследования, такие как LIFE, VALUE, MARVAL, PRIME, IDNT, DETAIL [13] показали, что АТ1-блокаторы являются эффективными и безопасными антигипертензивными препаратами. Особенно эффективными блокаторы АТ1-ангиотензиновых рецепторов оказались в плане предупреждения развития мозгового инсульта. Для профилактики инсульта у больных АГ АТ1-блокаторы могут использоваться как вместо диуретиков или антагонистов кальция, так и вместе с ними. БРА, как и иАПФ, способны также предотвращать развитие СД 2-го типа, снижая риск его возникновения на 20–25% [14]. Поэтому можно предполагать, что блокаторы АТ1-ангиотензиновых рецепторов следует использовать для лечения АГ в первую очередь у больных с высоким риском развития инсульта или СД. Превосходная переносимость – несомненное достоинство АТ1-блокаторов при длительной антигипертензивной терапии. Применение блокаторов АТ1-ангиотензиновых рецепторов позволяет улучшить приверженность больных к длительной терапии, поскольку БРА значительно реже, чем другие антигипертензивные препараты, приходится отменять из-за развития побочных эффектов. В отличие от тиазидных диуретиков, БАБ и иАПФ антигипертензивная эффективность блокаторов АТ1-ангиотензиновых рецепторов не зависит от возраста, пола или расы больных [15].
Ренин-ангиотензин-альдостероновая система (РААС) играет центральную роль как в возникновении АГ, так и в реализации патофизиологических процессов, которые в конечном итоге приводят к серьезным сердечно-сосудистым осложнениям, таким как мозговой инсульт, инфаркт миокарда, сосудистое ремоделирование, нефропатия, застойная сердечная недостаточность и развитие атеросклеротических процессов. иАПФ были первой группой препаратов, действующих непосредственно на РААС, которые широко внедрены в клиническую практику. Длительный период их применения, многочисленные клинические исследования, большой опыт практических врачей по их использованию привели к тому, что в настоящее время в России данные препараты используются чаще других антигипертензивных средств. иАПФ в средних дозах снижают САД несколько в меньшей степени, чем диуретики и антагонисты кальция. Выбор конкретного иАПФ для длительной терапии больных с АГ имеет важное клиническое значение, поскольку эти препараты назначают, по существу, пожизненно. Из иАПФ с доказанной эффективностью наиболее перспективными представляются периндоприл и рамиприл [16, 17].
Клиническая практика и результаты многих мультицентровых исследований показали, что применение монотерапии в лечении АГ редко приводит к целевым уровням АД, увеличивает риск развития нежелательных явлений и снижает приверженность пациента к лечению. Важнейшими условиями повышения приверженности пациентов к лечению являются понимание ими целей, задач, современных методов и принципов лечения, а также правильный выбор варианта антигипертензивного лечения врачом. Тактика использования комбинированной терапии с подбором препаратов разного механизма действия уже в начале лечения дает значительно больше шансов на успешный контроль АД. Низкодозовая комбинированная рациональная гипотензивная терапия может быть мерой первого выбора, особенно у пациентов с высоким риском развития сердечно-сосудистых осложнений, к достоинствам которой можно отнести: простой и удобный режим приема для пациента; облегчение титрации; простота прописывания препарата; повышение приверженности пациентов; уменьшение нежелательных явлений за счет снижения доз применяемых компонентов; уменьшение риска использования нерациональных комбинаций; уверенность в оптимальном и безопасном дозовом режиме; уменьшение цены [17–21].
Следует отметить, что в последних и американских, и европейских рекомендациях подчеркивается необходимость избегать по возможности тактики частой смены лекарств и их дозировок у пациентов. В настоящее время становится очевидным, что эффективность монотерапии препаратами всех основных групп невысокая и сопоставимая: через год лечения даже при почти идеальной приверженности лечению эффект монотерапии не превышает 50% против почти 30% при плацебо. Тактика «последовательной монотерапии» в реальности может потребовать 4–5 смен терапии, каждая из которых может осложниться развитием побочных эффектов. Такая тактика занимает много времени, лишает врача и пациента уверенности в успехе, что в конечном итоге оказывает негативное психологическое воздействие на пациента и ведет к низкой приверженности лечению АГ. Именно недооценка роли комбинированной терапии является одной из частых причин неудовлетворительного контроля АД [17–21].
Комбинированная антигипертензивная терапия имеет много преимуществ:
- усиление антигипертензивного эффекта за счет разнонаправленного действия препаратов на патогенетические механизмы развития АГ, что увеличивает число пациентов со стабильным снижением АД;
- уменьшение частоты возникновения побочных эффектов как за счет меньших доз комбинируемых антигипертензивных препаратов, так и за счет взаимной нейтрализации этих эффектов;
- обеспечение наиболее эффективной органопротекции и уменьшение риска развития и числа сердечно-сосудистых осложнений.
Многочисленные рандомизированные клинические исследования и опыт реальной клинической практики показали все плюсы комбинированной терапии, которые могут быть суммированы следующим образом [22, 23]:
- одновременное использование препаратов двух различных фармакологических групп более активно снижает АД за счет того, что происходит воздействие на различные патогенетические механизмы гипертензии;
- совместное применение более низких доз двух препаратов, действующих на различные регуляторные системы, позволит лучше контролировать АД, учитывая неоднородность реакции больных гипертонической болезнью на антигипертензивные средства;
- назначение второго препарата может ослаблять или уравновешивать запуск механизмов противодействия понижению АД, возникающих при назначении одного препарата;
- устойчивое понижение АД может быть достигнуто меньшими дозами двух препаратов (чем при проведении монотерапии);
- меньшие дозы позволяют избежать дозозависимых побочных эффектов, вероятность которых более высока при большей дозе того или иного препарата (при проведении монотерапии);
- применение двух препаратов может в большей степени предотвращать поражение органов-мишеней (сердце, почки), обусловленное АГ;
- назначение второго препарата может в определенной мере уменьшать (и даже полностью ликвидировать) нежелательные эффекты, обусловленные первым (пусть даже и вполне эффективным) препаратом;
- назначение второго препарата (в частности, мочегонного) позволяет получить быстрый антигипертензивный эффект комбинации лекарств, т. к. большинство антигипертензивных препаратов (иАПФ, БКК, БРА, а отчасти и БАБ) проявляют в полной мере свое действие лишь на 2–3-й нед. приема (и даже позже).
Комбинации двух антигипертензивных препаратов делят на рациональные (эффективные), возможные и нерациональные. Все преимущества комбинированной терапии присущи только рациональным комбинациям антигипертензивных препаратов [24].
К ним относятся [10]:
- иАПФ + диуретик;
- БРА + диуретик;
- иАПФ + дигидропиридиновый БМКК;
- БРА + дигидропиридиновый БМКК;
- дигидропиридиновый БМКК + БАБ;
- дигидропиридиновый БМКК + диуретик;
- БАБ + диуретик;
- БАБ + α-адреноблокатор.
Вопрос комбинирования трех и более препаратов еще недостаточно изучен, поскольку нет результатов рандомизированных контролируемых клинических исследований, изучавших тройную комбинацию антигипертензивных препаратов. Таким образом, антигипертензивные препараты в данных комбинациях объединены вместе на теоретической основе. Однако у многих пациентов, в т. ч. у больных с рефрактерной АГ, только с помощью трех и более компонентной антигипертензивной терапии можно достичь целевого уровня АД [25]. К рекомендуемым комбинациям трех антигипертензивных препаратов относятся:
- иАПФ + дигидропиридиновый БМКК + БАБ;
- БРА + дигидропиридиновый БМКК + БАБ;
- иАПФ + БМКК + диуретик;
- БРА + БМКК + диуретик;
- иАПФ + диуретик + БАБ;
- БРА + диуретик + БАБ;
- дигидропиридиновый БМКК + диуретик + БАБ.
Поскольку комбинированная терапия стала одним из основных направлений в лечении больных с АГ, широкое распространение получили фиксированные комбинации антигипертензивных препаратов, содержащие в одной таблетке два лекарственных средства, что улучшает психологический настрой больного на лечение и дает возможность снизить риск осложнений и побочных эффектов. Оптимальное сочетание компонентов подразумевает отсутствие нежелательной гипотонии, которая может привести, особенно у пожилых пациентов, к повышению сердечно-сосудистого риска. Рациональный подбор компонентов по фармакокинетическому профилю создает предпосылки для однократного использования препаратов, которые в режиме монотерапии требуют двух- или трехкратного применения.
К преимуществам фиксированных (официнальных) комбинаций можно отнести:
- потенциирование антигипертензивного эффекта препаратов;
- простоту назначения и процесса титрования дозы;
- уменьшение частоты побочных эффектов (низкая доза, взаимная нейтрализация НЛР);
- увеличение приверженности пациентов к лечению;
- уменьшение стоимости лечения.
В настоящее время существует достаточно много официнальных комбинированных препаратов: Капозид (каптоприл + ГХТЗ), Ко-ренитек (эналаприл + ГХТЗ), Нолипрел (периндоприл + индапамид), Аккузид (квинаприл + ГХТЗ), Ко-диован (валсартан + ГХТЗ), Гизаар (лозартан + ГХТЗ), Эксфорж (валсартан + амлодипин), Экватор (лизиноприл + амлодипин), Логимакс (метопролол + фелодипин), Тарка (верапамил + трандолаприл) и др. Наиболее часто назначаемой из всех нефиксированных и фиксированных комбинаций ЛС является комбинация иАПФ с тиазидным диуретиком или БРА с тиазидным диуретиком. Высокая эффективность и безопасность данной комбинации при лечении АГ отмечена в рекомендациях ВОЗ, ВНОК, ЕОГ – ЕОК и JNS 7. Действие блокаторов АТ-рецепторов типа 1 специфично, поскольку они в отличие от иАПФ не влияют на активность других нейрогуморальных систем, в частности брадикинина, с которыми связывают характерные побочные эффекты (сухой кашель и ангионевротический отек). Эффект «ускользания» фармакологической блокады РААС от действия иАПФ объясняется синтезом ангиотензина II в некоторых органах и тканях с помощью других ферментов без участия АПФ.
В настоящее время считается, что хроническая стимуляция РААС ведет к активации факторов роста и фиброза на тканевом уровне, что определяет развитие патологических процессов в органах-мишенях, поэтому возможность блокады тканевого звена РААС представляется перспективной для достижения органопротективного эффекта антигипертензивной терапии. В ряде исследований не было выявлено прямой зависимости рено- и кардиопротективного эффекта антигипертензивной терапии от степени снижения АД, что свидетельствует о важности негемодинамических эффектов блокады РААС. При совместном применении тиазидные диуретики не только усиливают, но и удлиняют антигипертензивное действие БРА. Доказано, что совместное применение БРА и мочегонных препаратов приводит к заметному снижению АД у пациентов как с высокой, так и с низкой активностью ренина, и ответ на данную комбинированную терапию составляет около 80% и выше.
Также примером благоприятной комбинации является сочетание БМКК с иАПФ, что приводит к уменьшению выраженности отеков, ассоциированных с применением дигидропиридинов. Кроме того, комбинация недигидропиридинового БМКК с иАПФ может потенциально усиливать положительный эффект последнего в отношении эластических свойств сосудов.
К комбинациям нерациональным, при которых не происходит потенцирования антигипертензивного эффекта препаратов и/или усиливаются побочные эффекты при их совместном применении, относятся сочетания БАБ и препаратов центрального действия, БАБ и БМКК недигидропиридинового ряда и БАБ с иАПФ, БРА, агонистами имидазолиновых рецепторов. Комбинация иАПФ и БРА в настоящее время считается запрещенной.
Заключение
Важнейшими условиями повышения приверженности пациентов к лечению являются понимание ими целей, задач, современных методов и принципов лечения, а также правильный выбор варианта антигипертензивного лечения врачом. Тактика использования комбинированной терапии с подбором препаратов разного механизма действия уже в начале лечения дает значительно больше шансов на успешный контроль АД и риска развития сердечно-сосудистых осложнений. Преимущества комбинированной терапии заключаются в потенцировании антигипертензивного эффекта и уменьшении числа побочных эффектов и присущи лишь так называемым рациональным комбинациям гипотензивных препаратов. Для адекватного лечения АГ целесообразно использовать комбинированную терапию, начиная с низких доз препаратов.
Литература
- Оганов Р.Г., Тимофеева Т.Н., Колтунов И.Е. и др. Эпидемиология артериальной гипертонии в России. Результаты федерального мониторинга 2003-2010 гг // Кардиоваскулярная терапия и профилактика. 2011. № 1. С. 9–13.
- ABC Of Hypertension / edited by D. Gareth Beevers, Gregory H. Lip and Eoin O’Brien. 5th ed. Malden, Mass.: BMJ Books, 2007. p. 88.
- Ezzati M., Lopez A.D., Rodgers A. et al. Selected major risk factors and global and regional burden of disease // Lancet. 2002. Vol. 360(9343). P. 1347–1360.
- Hansson L., Zanchetti A., Carruthers S.G. et al. Effects of intensive blood–pressure lowering and low–dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial // Lancet. 1998. Vol. 351. P. 1755–1762.
- Dahlof B. Sweedish trial in old patients with hypertension (STOP-Hypertension). // Clm. Exp. Hypertens. 1993. Vol. 15. P. 925–939.
- Чазова И.Е., Беленков Ю.Н. РОСА – Российское исследование по оптимальному снижению артериального давления. https://www. cardiosite.ru/ research/article.asp? id=2559.
- Карпов Ю.А.Комбинированная терапия артериальной гипертонии – эффект контроля и успех лечения // РМЖ. 2006. № 20. С. 1458–1461.
- 1999 World Health Organization – International Society of Hypertension Guidelines for the Management of Hypertension // J. Hypertens. 1999. Vol. 17. P. 151–183.
- Кобалава Ж.Д. Эволюция комбинированной антигипертензивной терапии: от многокомпонентных высокодозовых свободных комбинаций до низкодозовых фиксированных комбинаций как средств первого выбора // РМЖ. 2001. № 18. С. 789–794.
- Диагностика и лечение артериальной гипертензии. Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов. Четвертый пересмотр // Системные гипертензии. 2010. № 3. С. 5–26.
- ESH-ESC Guidelines Committee. 2013 guidelines for the management of arterial hypertension // J. Hypertension. 2013. Vol. 31. P. 1281–1357.
- Карпов Ю.А. Новые рекомендации по артериальной гипертензии РМОАГ/ВНОК 2010 г.: вопросы комбинированной терапии // РМЖ. 2010. № 22. С. 1290.
- Полосьянц О.Б. Сартаны в кардиологической практике // РМЖ. 2008. № 11. С. 1593–1597.
- Преображенский Д.В., Пересыпко М.К., Носенко Н.С. и др. Блокаторы АТ1-ангиотензиновых рецепторов: диапазон органопротективных эффектов // Справочник поликлинического врача. 2004. № 1. С. 8–14.
- Matcar D.B., McCrory D.C., Orlando L.A. et al. Comparative Effectiveness of Angiotensin-Converting Enzyme Inhibitors (ACEIs) and Angiotensin II Receptor Antagonists (ARBs) for Treating Essential Hypertension. Comparative Effectiveness Review No. 10. (Prepared by Duke Evidence-based Practice Center under Contract No. 290-02-0025.) Rockville, MD: Agency for Healthcare Research and Quality. November 2007. Available at: www.effectivehealthcare.ahrq.gov/ reports/final.cfm
- Моисеев С.В. Валсартан: от реалий клинической практики к новым возможностям // Клиническая фармакология и фармакотерапия. 2009. № 3. С. 32–43.
- Кириченко А.А., Эбзеева Е.Ю. Дифференцированный подход к лечению артериальной гипертензии // Consilium Medicum. 2006. Т. 4. № 3.
- Преображенский Д.В., Стеценко Т.М. и др. Терапия гипертонической болезни: комбинации ингибитора АПФ и диуретика // Consilium Medicum. 2006. Т. 4. № 7.
- 1999 World Health Organization – International Society of Hypertension Guidelines for the Management of Hypertension // J. Hypertens. 1999. Vol. 17. P. 151–183.
- Gosse P., Sheridan D.J., Zannad F. et al. Regression of LVH in hypertensive patients treated with indapamide SR 1,5 mg versus enalapril 20 mg: the LIVE study // J. Hypertens. 2000. Vol. 18. P. 1465–1475.
- Chalmers J., Castaigne A., Morgan T. et al. Long-term efficacy of a new, fixed, very-low-dose angiotesin-converting enzyme-inhibitor/diuretic combination as first-line therapy in elderly hypertensive patients // J. Hypertens. 2000. Vol. 18. P.1–11.
- Бубнова М.Г. Современные принципы профилактики и лечения артериальной гипертонии. Анализ основных положений международных рекомендаций // Справочник поликлинического врача. 2005. № 4. С. 8–14.
- Преображенский Д.В., Стеценко Т.М. и др. Выбор оптимального препарата для длительной терапии артериальной гипертензии // Consilium Рrovisorum. 2005. № 2. С. 21–23.
- Арутюнов Г.П., Розанов А.В. Фармакотерапия артериальной гипертензии: место фиксированных комбинаций лекарственных препаратов // Артериальная гипертензия. 2003. № 6. С. 218–221.
- Чазова И.Е., Беленков Ю.Н., Ратова Л.Г. и др. От идеи к клинической практике. Первые результаты российского национального исследования оптимального снижения артериального давления (РОСА) // Сист. гиперт. 2004. № 2. С. 18–23.
- Chalmers J., Castaigne A., Morgan T. et al. Long-term efficacy of a new, fixed, very-low-dose angiotesin-converting enzyme-inhibitor/diuretic combination as first-line therapy in elderly hypertensive patients // J. Hypertens. 2000. Vol. 18. P. 1–11.
Выбор антигипертензивного препарата для лечения артериальной гипертонии
О.Д. ОСТРОУМОВА
, д.м.н. профессор,
И.И. КОПЧЕНОВ
, к.м.н.,
кафедра факультетской терапии и профболезней МГСМУ им. А.И. ЕвдокимоваВ статье представлены современные подходы к дифференцированному выбору антигипертензивных препаратов. Описаны преимущества и ограничения основных 5 классов антигипертензивных медикаментов. Приводятся данные о выборе препарата внутри класса с учетом конкретных клинических ситуаций.
Основная цель лечения больных артериальной гипертонии (АГ) заключается в максимальном снижении риска развития сердечно-сосудистых осложнений (ССО) и смерти от них [1]. Для реализации этой задачи требуется не только снижение артериального давления (АД) до целевого уровня, но и коррекция всех модифицируемых факторов риска (курение, дислипидемия, гипергликемия, ожирение), профилактика, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней (ПОМ), а также лечение ассоциированных и сопутствующих заболеваний (ИБС, сахарный диабет и др.).
Целевым уровнем АД считается показатель, не превышающий 140/90 мм рт. ст. При хорошей переносимости назначенной терапии рекомендуется снижение АД до более низких значений. У пациентов с высоким и очень высоким риском ССО необходимо поддерживать АД на уровне 140/90 мм рт. ст. и ниже в течение 4 недель [1]. В дальнейшем при условии хорошей переносимости рекомендуется снижение АД до 130–139/80–89 мм рт. ст.
В настоящее время для лечения АГ используют 5 основных классов антигипертензивных препаратов (АГП): ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы АТ1-рецепторов к ангиотензину II (БРА), антагонисты кальция (АК), бета-адреноблокаторы (БАБ) и диуретики [1]. В качестве дополнительных препаратов в комбинированной терапии могут использоваться альфа-адреноблокаторы (ААБ), агонисты имидазолиновых рецепторов и прямые ингибиторы ренина [1].
На выбор препарата оказывает влияние целый ряд факторов, наиболее важными из которых являются [1]:
• наличие у больного других факторов риска; • ПОМ; • ассоциированные клинические состояния (АКС), поражения почек, метаболический синдром (МС), сахарный диабет; • сопутствующие заболевания, при которых необходимо назначение или ограничение применения АГП различных классов; • индивидуальная непереносимость ЛС в анамнезе; • вероятность лекарственного взаимодействия с препаратами, назначенными пациенту по поводам других заболеваний; • социально-экономические факторы, в т. ч. стоимость лечения.
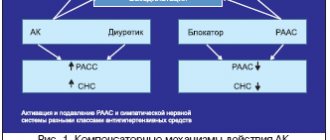
При выборе АГП необходимо в первую очередь оценить его эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации (рис. 1 и 2). Согласно результатам многоцентровых рандомизированных исследований, ни один из основных классов АГП не имеет существенного преимущества как в снижении АД, так и в уменьшении риска ССО и смерти от них. Более значимым фактором снижения риска ССО на фоне антигипертензивной терапии имеет величина, на которую снижается АД, поэтому невозможно точно предсказать, какой из АГП окажется максимально эффективным у данного пациента. У любого из представителей основных классов АГП существуют свои плюсы и минусы (рис. 1 и 2), поэтому универсальное ранжирование АГП не представляется необходимым. В каждой конкретной клинической ситуации необходимо учитывать особенности действия АГП различных классов, выявленные в ходе рандомизированных исследований [1]. Таким образом, выбор того или иного АГП, особенно на старте лечения, должен основываться на результатах крупных клинических исследований, в которых доказана высокая эффективность и безопасность применения именно этого препарата у пациентов в подобной клинической ситуации [1].
Ингибиторы АПФ
Согласно данным российских фармакоэпидемиологических исследований, ИАПФ являются самым назначаемым классом препаратов для лечения сердечно-сосудистых заболеваний, в т. ч. АГ, что обусловлено важной ролью активации ренин-ангиотензин-альдостероновой системы (РААС) в патогенезе этих состояний [1].
В зависимости от химической структуры активной части молекулы, связывающейся с АПФ, препараты этого класса разделяют на 3 группы [2]:
• ингибиторы АПФ, содержащие сульфгидрильную группу (каптоприл); • ингибиторы АПФ, содержащие карбоксильную группу или карбоксилкилдипептиды (эналаприл, лизиноприл, рамиприл, периндоприл, цилазаприл, беназеприл, квинаприл, трандолаприл, спираприл); • ингибиторы АПФ, содержащие фосфорильную группу (фозиноприл).
На эффективность терапии оказывают значительное влияние такие параметры фармакокинетики ингибиторов АПФ, как биодоступность, биотрансформация (является ли препарат активным веществом или пролекарством, которое превращается в организме в активные метаболиты), пути элиминации и продолжительность торможения активности АПФ. Исходя из этого, ингибиторы АПФ разделяют на 2 группы соответственно их фармакокинетическим свойствам:
• активные вещества (каптоприл, лизиноприл); • пролекарства: предшественники ингибиторов АПФ (фозиноприл, все карбоксилкилдипептиды за исключением лизиноприла). Пролекарства превращаются в активную форму путем гидролиза эфирной связи при прохождении через слизистую оболочку желудочно-кишечного тракта и в печени (например, эналаприл превращается в эналаприлат). Действие препаратов этой группы реализуется медленнее, а эффект длится дольше. При нарушении функции печени (циррозы печени, тяжелые гепатиты и т. п.) эффективность их снижается, что требует коррекции дозы [2].
Среди ЛС этой группы особое место занимает фозиноприл. Особенностью препарата является двойной сбалансированный путь выведения – через печень и через почки (в соотношении примерно 50:50). Это означает, что у пациентов с нарушением функции печени данный фозиноприл будет выводиться через почки, а у больных с нарушением функции почек – через печень (ЖКТ) [2]. В клинической практике это обеспечивает преимущество препарата, которое выражается в отсутствии необходимости коррекции дозы у пациентов с сопутствующей почечной или печеночной недостаточностью [2].
Ингибиторы АПФ доказали свою эффективность в снижении скорости прогрессирования ПОМ и уменьшении степени патологических изменений. Терапия ИАПФ приводит к уменьшению выраженности гипертрофии миокарда левого желудочка (ГМЛЖ), в т. ч. фиброзного компонента, значимому снижению уровня микроальбуминурии (МАУ) и протеинурии и предотвращает ухудшение функции почек [1]. Наиболее выраженное антигипертензивное действие ИАПФ отмечено у пациентов с повышенной активностью РААС [1,2]. Помимо этого, ИАПФ замедляют деградацию брадикинина, что, с одной стороны, усиливает их антигипертензивную эффективность, а с другой – способствует развитию таких характерных побочных эффектов, как сухой кашель и ангионевротический отек.
Как известно, у пациентов с сахарным диабетом АГ многократно повышает риск развития как макрососудистых (инфаркт миокарда, инсульт), так и микрососудистых (ангиопатия, ретинопатия, нефропатия) осложнений. Было обнаружено, что ингибиторы АПФ обладают дополнительными преимуществами для этой группы больных по сравнению с другими классами антигипертензивных препаратов: они в большей степени снижают риск всех осложнений и тормозят развитие хронической почечной недостаточности (ХПН), т. е. оказывают нефропротективное действие [1]. Применение ингибиторов АПФ достоверно замедляет наступление «почечной смерти» (диализ или трансплантация почек) как при диабетической нефропатии, так и при АГ с протеинурией без СД [3]. Именно поэтому они показаны всем больным с сочетанием СД и АГ, а также пациентам с АГ и микроальбуминурией без СД [1].
Надежным клиническим маркером повышенного риска осложнений, как сердечнососудистых, так и почечных, у больных АГ, особенно в сочетании с СД, является микроальбуминурия [1]. По степени уменьшения микроальбуминурии в процессе лечения можно судить о снижении риска развития осложнений. Эффективность ингибиторов АПФ у пациентов с микроальбуминурией обусловлена тем, что ангиотензин II играет ключевую роль в развитии органных поражений при АГ, особенно нефропатии и хронической почечной недостаточности. Ангиотензин II стимулирует активность симпатической нервной системы, что влечет за собой увеличение продукции ангиотензина II почками, активацию РААС, запуск каскада нейрогуморальных и структурно-функциональных изменений, которые приводят к развитию протеинурии, клеточной пролиферации, аккумуляции матрикса и в конечном итоге – формированию гломерулосклероза [3].
Установлено, что ингибитор АПФ лизиноприл снижает уровень микроальбуминурии на 48% [4]. Кроме того, у больных с АГ и СД лизиноприл оказывает ряд дополнительных положительных эффектов на углеводный обмен, в частности, снижает уровень гликозилированного гемоглобина, повышает чувствительность тканей к инсулину [5].
Интересны результаты исследования, изучавшего влияние другого ингибитора АПФ – фозиноприла – на риск микро- и макрососудистых осложнений.
В исследовании PREVEND-IT (n = 864) было доказано, что терапия другим ИАПФ фозиноприлом предотвращает прогрессирование микроальбуминурии, а также развитие ССО у пациентов с АГ [6, 7]. На фоне терапии фозиноприлом в дозе 20 мг/сут в течение 46 месяцев у больных с АГ и микроальбуминурией уровень экскреции альбумина с мочой снизился на 26% по сравнению с плацебо, а основной комбинированный показатель сердечно-сосудистой смертности и частоты госпитализации по поводу заболеваний сердца – на 40%. Применение правастатина у этой категории больных не влияло на уровень микроальбуминурии, а показатель сердечно-сосудистой смертности и частоты госпитализации уменьшился на 13% [6, 7].
Одной из актуальных проблем является лечение АГ у пациентов с МС. Как известно, абдоминальное ожирение – независимый фактор риска развития осложнений у пациентов с АГ [1, 8]. Установлено, что у пациентов среднего возраста с избыточной массой тела риск развития АГ увеличивается в 3 раза, а у молодых людей – в 6 раз. По данным Фрамингемского исследования каждые 4,5 кг лишнего веса увеличивают систолическое АД у мужчин на 4,4 мм рт. ст., а у женщин на 4,2 мм рт. ст. Лечение таких больных вызывает определенные сложности [8].
По данным исследования TROPHY, количество пациентов, у которых удалось добиться нормализации АД, было достоверно больше в группе лизиноприла по сравнению с группой гидрохлоротиазида (при использовании препарата в дозах до 50 мг/сут) [9]. При этом уровень глюкозы в сыворотке крови в группе лизиноприла снижался, а в группе гидрохлоротиазида – повышался. Уровень калия в группе лизиноприла практически не изменился, тогда как в группе гидрохлоротиазида он достоверно снизился. Указанные свойства убедительно демонстрируют целесообразность применения лизиноприла у тучных пациентов с АГ.
Еще одним важным свойством ИПФ является антиатеросклеротический эффект. Так, результаты исследования PHYLLIS [10] показали замедление прогрессирования атеросклероза сонных артерий у больных с АГ на фоне терапии фозиноприлом. В исследовании участвовало 508 больных с АГ с бессимптомным атеросклеротическим поражением сонных артерий. Пациенты были разделены на группы в зависимости от проводимой терапии: 127 больных получали гидрохлоротиазид в дозе 25 мг/сут, 127 – фозиноприл в дозе 20 мг/сут, 126 – 25 мг гидрохлоротиазида и дополнительно 40 мг правастатина, 128 – 20 мг фозиноприла и 40 мг правастатина. Средний срок наблюдения составил 2,6 года [12, 13]. Достигнутый на фоне лечения уровень АД при измерении в клинике и амбулаторно у пациентов между группами не различался. Толщина комплекса интима-медиа (КИМ) достоверно увеличивалась в группе пациентов, получавших только гидрохлоротиазид. В группах больных, принимавших фозиноприл, наблюдалось достоверное уменьшение толщины КИМ [10]. Таким образом, показано, что фозиноприл оказывает антиатерогенный эффект у больных с АГ.
Блокаторы рецепторов ангиотензина II
В действии ангиотензина II (АII) на сосуды различают два механизма – прессорный и депрессорный. Первый опосредуется влиянием АII на рецепторы 1-го типа и приводит к вазоконстрикции, задержке натрия и жидкости, увеличению симпатической активности, снижению тонуса блуждающего нерва, клеточной пролиферации и положительному инотропному эффекту. Депрессорное действие АII реализуется через стимуляцию рецепторов 2-го типа, что приводит к вазодилатации, особенно выраженной в сосудах головного мозга и почек, натрийуретическому действию, антипролиферативному эффекту, активации кининогена, высвобождению оксида азота и простагландина I2 [1, 2]. В основе антигипертензивного действия и других фармакологических эффектов блокаторов рецепторов АТ1 (БРА, сартаны) лежат два механизма – прямой и косвенный. Первый связан с ослаблением эффектов АII в условиях селективной блокады АТ1-рецепторов. Второй обусловлен реактивной гиперактивацией РААС в условиях блокады АТ1-рецепторов и дополнительной стимуляцией АТ2-рецепторов [1, 2]. На антигипертензивную эффективность БРА не оказывают влияние активность РААС, пол и возраст пациента.
Для БРА доказано положительное влияние на состояние органов-мишеней и снижение риска развития всех ССО [1, 2]. Кроме того, для препаратов этой группы характерна наиболее высокая приверженность пациентов лечению за счет высокой эффективности и наилучшей среди всех классов АГП переносимости лечения [1, 2]. За последние годы область применения БРА существенно расширилась. К списку показаний (диабетическая нефропатия, протеинурия/МАУ, хроническая сердечная недостаточность, ГМЛЖ, мерцательная аритмия пароксизмальная, кашель при приеме ИАПФ и т. д.) были добавлены ИБС, недиабетическая нефропатия, дисфункция левого желудочка; помимо этого, БРА теперь могут назначаться пожилым пациентам [1].
Первым и исключительно важным исследованием, подтверждающим огромные возможности cартанов в лечении АГ, стало исследование LIFE (Losartan Intervention For Endpoint reduction in hypertension study) [11]. В нем приняли участие более 9 000 пациентов с АГ и ГМЛЖ. Больные получали либо лозартан 50 мг, либо атенолол 50 мг с возможностью добавления 12,5 мг гидрохлоротиазида и последующим увеличением дозы препаратов до достижения целевого уровня АД. В течение последующего 5-летнего наблюдения у больных, получавших лозартан, по сравнению с группой атенолола, наблюдалось 13%-ное снижение частоты основных сердечно-сосудистых событий (первичная конечная точка), в т. ч. с 25%-ным различием в частоте инсультов. Безусловно, основным механизмом такой эффективности лозартана является его способность уменьшать выраженность ГМЛЖ (р < 0,0001 для индекса Соколова – Лайона и для Корнельского произведения) [11]. Известно, что гипертрофия ЛЖ является независимым серьезным фактором риска ССО [1]. В этом же исследовании было продемонстрировано уменьшение частоты возникновения новых случаев СД 2 типа (на 25%) и снижение выраженности инсулинорезистентности при лечении лозартаном [11].
Стоит отметить, что среди всех БРА только лозартан с доказанной эффективностью значительно увеличивает экскрецию мочевой кислоты (до 300%), что делает привлекательным его применение у пациентов с подагрой [13]. Как известно, гиперурикемия является одним из компонентов метаболического синдрома и независимым фактором риска CCЗ. В эксперименте показано, что лозартан обладает способностью блокировать транспорт уратов через мембраны в проксимальном отделе почечных канальцев [2]. Таким образом, БРА уменьшают риск развития сахарного диабета, благодаря чему их применение особенно актуально у пациентов с АГ и МС [1].
Для БРА характерен также выраженный нефропротективный эффект, что было доказано результатами крупного исследования RENAAL (n = 1 513), в котором оценивалась эффективность лозартана у пациентов с АГ, сахарным диабетом 2 типа и диабетической нефропатией. В результате приема лозартана (50–100 мг/сут) риск двойного увеличения плазменной концентрации креатинина снижался на 25%, а риск развития терминальной стадии хронической почечной недостаточности – на 28%. Кроме того, по сравнению с группой плацебо у пациентов из группы лозартана статистически достоверно снижался уровень протеинурии и частота первичной госпитализации [12].
Таким образом, БРА зарекомендовали себя как незаменимые препараты при лечении такого социально значимого заболевания, как АГ. Действие их многогранно и определяется не только влиянием на АД, но и нормализацией функционирования РААС, органопротективным эффектом; препараты отличаются благоприятным метаболическим профилем и крайне низкой частотой побочных эффектов.
Антагонисты кальция
Эффективность АК в качестве антигипертензивных средств обусловлена замедлением тока Са через α1- и α2-адренергические пути и кальциевые каналы периферических сосудов, уменьшением чувствительности артериальных сосудов к эндогенным влияниям норадреналина, вазопрессина, гистамина, серотонина, ацетилхолина, что приводит к снижению общего периферического сосудистого сопротивления и АД [1, 2, 14]. АК делят на 3 подгруппы в зависимости от химической структуры [1, 2, 14]:
1) дигидропиридины (нифедипин, амлодипин, фелодипин и др.); 2) фенилалкиламины (верапамил); 3) бензодипины (дилтиазем).
Существуют значительные различия в способности АК влиять на миокард, сосудистую стенку и проводящую систему сердца. Дигидропиридины оказывают выраженное селективное действие на мускулатуру сосудов, приводя к расширению периферических артерий, не влияют на проводящую систему сердца и практически не вызывают снижения сократительной функции миокарда [1, 2, 14]. Для недигидропиридиновых АК (верапамил и дилтиазем) характерно отрицательное ино- и дромотропное действие. Все АК метаболически нейтральны и не оказывают отрицательного действия на углеводный, липидный и пуриновый обмен. Помимо антигипертензивного эффекта, АК обладают органопротективными и антиангинальными свойствами, тормозят агрегацию тромбоцитов, достоверно уменьшают риск развития инсульта и являются препаратами первого выбора у пожилых пациентов и больных с изолированной систолической АГ [1, 2, 14].
Важнейшей характеристикой АК является их способность тормозить прогрессирование атеросклероза [14]. Механизмы антиатеросклеротического эффекта заключаются в замедлении пролиферации гладкомышечных клеток путем подавления высвобождения соответствующего фактора роста, ингибировании гиперплазии интимы сосудов, уменьшении адгезии моноцитов и захвата макрофагами эфиров холестерина, ингибировании экспрессии гена ГМГ-КоА-редуктазы, благоприятном влиянии на соотношение ЛВП/ЛНП, стабилизации плазматической мембраны, что препятствует проникновению свободного холестерина в стенку сосуда, и антиоксидантном действии АК [14]. В проспективном рандомизированном двойном слепом исследовании сосудистых эффектов амлодипина (PREVENT) оценивалось влияние препарата на прогрессирование начального атеросклероза [15]. Результаты терапии Амлодипина бесилатом в дозе 10 мг один раз в сутки сравнивались с эффектом от обычной терапии (врачам разрешалось использовать любые препараты или вмешательства, которые они считали нужными). В исследовании участвовали 825 больных, длительность наблюдения составила 3 года. Первичной конечной точкой являлась динамика состояния коронарных артерий с начальными атеросклеротическими изменениями (исходный стеноз 30%), которую оценивали с помощью количественной коронарной ангиографии (ККА). В качестве других конечных точек были выбраны динамика изменения диаметра пораженных атеросклерозом сегментов коронарных артерий по данным ККА, частота прогрессирования каротидного атеросклероза, которую определяли с помощью двухмерной эхографии, и клинические исходы. Амлодипин назначали в дозе 5 мг/сут, затем увеличивали ее до 10 мг/сут в течение 4 недель. В исследование включали больных в возрасте 30–80 лет с фракцией выброса левого желудочка 40% и более.
При ультразвуковом исследовании сонных артерий было показано, что у больных коронарным атеросклерозом длительная терапия амлодипином достоверно замедляет прогрессирование каротидного атеросклероза [15]. Измерения в 12 сегментах сонных артерий проводили перед началом лечения, в конце 4-недельного периода титрования дозы и через 6, 12, 24, 30 и 36 месяцев (последний визит). У больных, получавших амлодипин, толщина комплекса интима-медиа в течение 3 лет уменьшилась на 0,013 мм, а в группе плацебо увеличилась на 0,033 мм (р = 0,007).
В исследовании PREVENT 3-летняя терапия амлодипином привела к значительному снижению частоты неблагоприятных клинических исходов у больных коронарным атеросклерозом. При длительном лечении амлодипином частота госпитализаций по поводу нестабильной стенокардии и застойной сердечной недостаточности снизилась на 35% по сравнению с таковой в группе плацебо (р = 0,01). Частота операций на коронарных артериях в группе амлодипина снизилась на 43% по сравнению с таковой группе плацебо (р = 0,001) [15]. Через 36 месяцев терапия амлодипином привела к снижению суммарной частоты любых ССО или вмешательств на коронарных артериях на 31% (р = 0,01), в основном за счет значительного снижения (на 33%) частоты госпитализаций по поводу нестабильной стенокардии и оперативных вмешательств на коронарных артериях (на 43%) [15].
АК показаны при сочетании АГ и ИБС [1]. У этих больных дигидропиридиновые АК III поколения (прежде всего амлодипин) показаны в следующих ситуациях [1, 14]:
• в качестве препаратов первой линии при вариантной стенокардии; • у больных со стенокардией в случае сохраняющихся приступов стенокардии на фоне терапии бета-блокаторами показана их комбинация с пролонгированными дигидропиридинами.
Следует отметить, что ретроспективные исследования типа «случай – контроль» показали: относительный риск развития ССО или смерти у больных АГ при лечении нифедипином короткого действия значительно выше, чем при ле¬чении диуретиками или БАБ [14]. В то же время примене¬ние дигидропиридинов длительного действия не приводит к увеличению риска раз¬вития инфаркта миокарда по сравнению с таковым при использовании диуретиков, БАБ, ИАПФ и БРА [14]. Поэтому в клинической практике предпочтительным является использование пролонгированных дигидропиридиновых АК (IIb и особенно III поколения).
Тиазидные и тиазидоподобные диуретики
Тиазидные и тиазидоподобные диуретики (ТД) оказывают выраженное антигипертензивное действие. Эффективность лечения ТД в снижении АД и уменьшении сердечно-сосудистой смертности доказана в многочисленных контролируемых сравнительных рандомизированных исследованиях, а также результатами метаанализов [1].
ТД действуют на кортикальный сегмент петли Генле и в начальной области дистальных канальцев, где у здоровых людей реабсорбируется до 5–8% отфильтрованного натрия, они угнетают активность специального натриево-хлорного транспортера и способствуют повышенному выведению ионов натрия, хлора, а также воды, ионов калия и магния [2].
За счет прямого и косвенного вазодилатирующего действия диуретиков отмечается снижение АД, уменьшение общего периферического сосудистого сопротивления, венозного возврата к сердцу. Действие тиазидных и тиазидоподобных диуретиков начинается через 1–2 часа после приема внутрь и продолжается у большинства пациентов в течение 12–24 часов (24 часа – для тиазидоподобного диуретика индапамида).
Следует отметить, что большинство ТД характеризуются неблагоприятным метаболическим действием. Лечение высокими дозами ТД (гидрохлоротиазид 50–100 мг/сут) способно ухудшать показатели углеводного, липидного, пуринового обмена и снижать величину калия в плазме крови [1]. Это обстоятельство ограничивает применение ЛС данной группы у пациентов с МС и высоким риском сахарного диабета. Препаратом выбора в таких случаях становится тиазидоподобный диуретик индапамид: он метаболически нейтрален и не оказывает негативного влияния на углеводный и липидный обмен [2].
Индапамид занимает особое место в группе диуретиков. Терапевтическая эффективность препарата обусловлена двойным действием. Во-первых, он ингибирует реабсорбцию ионов натрия, хлора, в меньшей степени – калия и магния, в проксимальных и дистальных канальцах короткого сегмента нефрона; во-вторых – устраняет избыточное содержание ионов натрия в сосудистой стенке, повышает синтез простагландина E2 и J2, угнетает приток ионов кальция в гладкомышечные клетки сосудистой стенки, в результате чего происходит расширение сосудов и снижается их чувствительность к вазопрессорным агентам (катехоламинам, тромбоксану) [2, 16, 17]. Индапамид оказывает диуретический эффект при применении дозы 5 мг/сут, суточный диурез увеличивается на 20%. В дозах 1,25–2,5 мг/сут препарат действует главным образом как периферический артериальный вазодилататор. При этом антигипертензивная эффективность индапамида в дозе 2,5 мг/сут сравнима с действием 20 мг/сут эналаприла или 5 мг/сут амлодипина [3, 9].
Общее периферическое сосудистое сопротивление при лечении индапамидом 2,5 мг/сут снижается на 10–15%. По данным суточного холтеровского мониторирования АД, на фоне лечения индапамидом отмечается равномерное снижение АД в течение суток, без подъема в ранние утренние часы [1]. Препарат эффективен при нормальной и нарушенной функции почек.
Антигипертензивное действие индапамида отмечается при нетяжелой АГ примерно у 70% больных. Эффект проявляется через несколько дней лечения и постепенно нарастает. При длительной терапии у 60% пациентов сохраняется антигипертензивное действие этого препарата [2, 16].
Уникальным свойством индапамида как диуретика является его положительное воздействие на липидный обмен. Так, отмечено, что на фоне лечения индапамидом снижается уровень холестерина липопротеидов низкой плотности и триглицеридов и увеличивается показатель холестерина липопротеидов высокой плотности [16].
Помимо антигипертензивного действия, индапамид способствует уменьшению гипертрофии левого желудочка больных с АГ. Шестимесячная терапия индапамидом 2,5 мг/сут приводила к уменьшению индекса массы левого желудочка на 13,3% [16].
В отличие от тиазидных диуретиков индапамид обладает нефропротективным действием. Длительное (в течение 2 лет) лечение этим препаратом у пациентов с АГ и функциональной недостаточностью почек сопровождалось увеличением скорости клубочковой фильтрации на 28% [16]. Таким образом, среди тиазидных диуретиков индапамид является средством выбора для лечения больных с АГ и дислипопротеидемией, МС, сахарным диабетом и начальной почечной недостаточностью.
Бета-адреноблокаторы
Для БАБ доказана высокая эффективность в снижении риска ССО при лечении больных АГ [1]. В настоящее время показаниями для назначения БАБ у больных АГ является стабильная стенокардия, перенесенный инфаркт миокарда, хроническая сердечная недостаточность, тахиаритмия, глаукома и беременность.
БАБ конкурируют с катехоламинами за связывание с бета-адренорецепторами сердца. Основные эффекты БАБ – уменьшение частоты и силы сердечных сокращений, антиаритмическое и гипотензивное действие – обусловлены блокированием влияния медиаторов на бета1-адренорецепторы.
Проблема, возникающая при использовании БАБ, заключается в неблагоприятном метаболическом действии ряда представителей этого класса на углеводный и липидный обмен, что ограничивает их применение в качестве монотерапии у лиц с МС и высоким риском развития сахарного диабета. Стоит подчеркнуть, что данные о негативных метаболических эффектах БАБ были получены при анализе исследований, в которых главным образом применялся атенолол. Указанные ограничения не распространяются на высокоселективные БАБ (бисопролол, небиволол), а также препарат III поколения карведилол, который помимо выраженного вазодилатирующего действия оказывает еще и кардиопротективный эффект, обусловленный его антиоксидантными свойствами [1].
Таким образом, дифференцированный подход к выбору класса антигипертензивных препаратов и препарата внутри класса позволит индивидуализировать лечение конкретного пациента и повысить его эффективность.
Литература
1. Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр). Системные гипертензии 2010; 3: 5–26. 2. Клиническая фармакология. Под ред. В.Г. Кукеса, издание 4, М.: «ГЭОТАР-Медиа», 2008. С. 321–396, 458–479. 3. Rizzoni D., Muiesan M.L., Porteri E. Effects of long-term antihypertensive treatment with lisinopril on resistance arteries in hypertensive patients with left ventricular hypertrophy. J. Hypertens., 1997; 15 (2): 197-204. 4. Balázsi I., Takács J. The effect of lisinopril on hypertensive patients suffering in diabetic nephropathy Diabetologia Hungarica, 1999; 7.(N2.): 101-106. 5. Kawahara J., Hsieh ST., Tanaka S. et al. Effects of lisinopril on lipid peroxidation, cell membrane fatty acids, and insulin sensitivity in essential hypertension with impaired glucose tolerance. Am J Hypertens 1994; 7: 23A. 6. Asselbergs F.W., Diercks G.F.H., Hillege H.L. et al. for the Prevention of Renal and Vascular Endstage Disease InterventionalTrial (PREVEND IT) Investigators. Effect of fosinopril and pravastatin on cardiovascular events in subjects with microalbuminuria // Circulation. – 2004. – Vol. 110. – P. 2809-2816. 7. Diercks G.F., Janssen W.M., van Boven A.J. et al. Rationale, design, and baseline characteristics of a trial of prevention of cardiovascular and renal disease with fosinopril and pravastatin in nonhypertensive, nonhypercholesterolemic subjects with microalbuminuria (the Prevention of REnal and Vascular ENdstage Disease Intervention Trial ) // Amer. J. Cardiology. – 2000. – Vol. 86. – P. 635-638. 8. Чазова И.Е., Мычка В.Б. Метаболический синдром. М.: Меdia Меdica, 2004. – 163c. 9. Reisin E. TROPHY study. Hypertens. 1997; 30 : P.140-145. 10. Zancetti A., Crepaldi G., Bond G. et al. on behalf of PHYLLYS Investigators. Different effects of antihypertensive regimens based on fosinopril or hydrochlorthiazide with or without lipid lowering with pravastatin on progression of asymptomatic carotid atherosclerosis. Princioal results of PHYLLIS – a randomized double-blind trial // Stroke. – 2004. – Vol. 35. – P. 2807-2812. 11. Dahlof B., Devereux R.B., Kjeldsen S.E., et al. Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. //Lancet.– 2002– 359(9311) – P. 995–1003. 12. Brenner B.M., Cooper M.E., de Zeeuw D., Grunfeld J.–P., Keane W.F., Kurokawa K., McGill J.B., Mitch W.E., Parving H.H., Remuzzi G., Ribeiro A.B., Schluchter M.D., Snavely D., Zhang Z., Simpson R., Ramjit D., Shahinfar S: Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan (RENAAL). JRAAS 2000;1:328–35. 13. Dang A., Zhang Y., Liu G. et al: Effects of losartan and irbesartan on serum uric asid in hipertensiv patients with hyperuricaemia in Chinese population. J hum Hypertense 2006; 20:45–49. 14. Кукес В.Г., Остроумова О.Д., Стародубцев А.К. Антагонисты кальция: современные аспекты применения в кардиологии. Consilium medicum, 2006; Том 8 (№11): 113–117. 15. Pitt B., Byington R.P., Furberg C.D. et al. (for the PREVENT investigators). Effect of amlodipine on progression of atherosclerosis and the occurrence of clinical events. Circulation 2000; 102 (13): 1503–10. 16. Преображенский Д.В., Сидоренко Б.А. Дифференциальная медикаментозная терапия при артериальной гипертензии. Сonsilium Medicum. 2001; Том 3 (10): 83–87. 17. Passeron J., Panly N., Despart J. International multicentre study of indapamide in the treatment of essential arterial hypertension. Postgrad. Med. J., 1981; 57: 53–64.
Несмотря на усилия ученых, врачей и органов управления здравоохранения, артериальная гипертензия (АГ) в Российской Федерации остается одной из наиболее значимых медико-социальных проблем. Это обусловлено как широким распространением данного заболевания (около 40 % взрослого населения РФ имеет повышенный уровень артериального давления [АД]), так и тем, что АГ является важнейшим фактором риска основных сердечно-сосудистых заболеваний – инфаркта миокарда и мозгового инсульта, главным образом определяющих высокую смертность в нашей стране [1].
Согласно современным представлениям, основной целью антигипертензивной терапии (АГТ) является снижение смертности и частоты осложнений. Поэтому в задачи лечения входит не только достижение целевого уровня АД, но и защита органов-мишеней (сердца, мозга, почек) [1]. Как показали крупные клинические исследования, для решения данной задачи большинству пациентов с АГ требовалось применение комбинации из двух и более препаратов [2]. В настоящее время комбинированная АГТ становится одним из основных направлений в терапии АГ. Современные подходы к лечению АГ значительно расширили показания к комбинированной АГТ: согласно российским рекомендациям по диагностике и лечению АГ 4-го пересмотра (2010), с нее рекомендуется начинать лечение, минуя стадию монотерапии, у больных АГ не только II–III, но даже и I степени при наличии высокого и очень высокого риска развития сердечно-сосудистых осложнений. При этом приоритет отдается применению фиксированных комбинаций, содержащих в одной таблетке два антигипертензивных препарата (АГП) [1]. При этом исследования, изучающие антигипертензивную эффективность и безопасность разных фиксированных комбинаций, малочисленны. В последнее десятилетие активно изучаются органопротективные эффекты разных АГП. Представлено множество работ, доказывающих способность практически всех групп АГП вызывать регресс поражений органов-мишеней (сердца, почек, головного мозга), в т. ч. коррекцию дисфункции эндотелия. Однако изучение органопротективного действия именно фиксированных комбинаций АГП только начинается. В табл. 1 приведены рациональные комбинации АГП и некоторые существующие в настоящее время фиксированные комбинации.
. Некоторые рациональные комбинации АГП и фиксированные комбинации АГП, применяемые в России.
Во всех имеющихся в настоящее время рекомендациях по лечению АГ (американских, европейских, российских) разработаны подходы к выбору группы АГП в разных клинических ситуациях, тогда как подходы к выбору рациональных комбинаций для разных подгрупп пациентов с АГ не разработаны вовсе [1, 3, 4]. И это при том, что во всех рекомендациях по лечению АГ приоритет отдается именно комбинированной терапии. В связи с этим в готовящейся 4-й редакции российских рекомендаций по диагностике и лечению АГ (2010) впервые в мире предпринимается попытка разработать показания к выбору двухкомпонентных антигипертензивных комбинаций в конкретных клинических ситуациях. Основные показания к назначению рациональных комбинаций АГП представлены в табл. 2 и 3.
. Преимущественные показания к назначению рациональных комбинаций АГП.
Рекомендации по выбору рациональных и возможных комбинаций АГП препаратов для лечения больных АГ в зависимости от клинической ситуации
Поражение органов-мишеней:
- ГЛЖ – АРА-II/ИАПФ с ТД или АК;
- бессимптомный атеросклероз – АРА-II/ИАПФ с АК;
- микроальбуминурия – АРА-II/ ИАПФ с ТД;
- поражение почек – АРА-II/ИАПФ с ТД;
Ассоциированные клинические состояния:
- предшествующий мозговой инсульт – любые рациональные комбинации АГП;
- предшествующий ИМ – β-АБ/АК с АРА-II/ИАПФ, β-АБ с АК;
- ИБС – β-АБ или АК с АРА-II или ИАПФ;
- ХСН – АРА-II/ИАПФ с β-АБ и ТД;
- почечная недостаточность/протеинурия – АРА-II/ИАПФ с петлевым диуретиком;
- заболевания периферических артерий – АК с АРА-II/ИАПФ;
Особые клинические ситуации:
- пожилые – АРА-II/ИАПФ с АК/ТД;
- ИСАГ – АК с ТД, АК или ТД с АРАII/ИАПФ;
- метаболический синдром – АРА-II/ ИАПФ с АК/ТД;
- сахарный диабет – АРА-II/ИАПФ с АК/ТД;
- беременность – метилдопа с АК/β-АБ.
В данной статье мы cфокусируем внимание на возможности применения наиболее часто используемой в нашей стране комбинации АГП– ИАПФ с ТД (тиазидным диуретиком).
В настоящее время комбинация ИАПФ и ТД по-прежнему является наиболее часто назначаемой из всех нефиксированных и фиксированных комбинаций АГП не только в нашей стране. Высокая эффективность и безопасность данной комбинации при лечении АГ отмечена в рекомендациях ВНОК, ЕОК-ЕОГ и JNC VII [1, 3, 4]. Рациональность комбинации ИАПФ с диуретиком для лечения больных АГ полностью обоснована. Так, антигипертензивное действие ИАПФ основано в первую очередь на уменьшении продукции ангиотензина II, поэтому наиболее выраженное антигипертензивное действие они оказывают на пациентов с повышенной активностью ренин-ангиотензин-альдостероновой системы (РААС), что было показано в ряде исследований [5]. При этом антигипертензивный эффект всех диуретиков ограничен неизбежно возникающими на фоне их применения реактивной гиперренинемией и вторичной гиперальдостеронемией, связанными с активацией РААС, выраженность которых значительно снижается при одновременном назначении ИАПФ. Совместное применение ИАПФ и диуретиков позволяет значительно повысить эффективность обоих препаратов, что ведет к расширению круга пациентов, отвечающих на терапию, позволяя чаще достигать целевого уровня АД [5]. У больных с нормои низкорениновой АГ эффективность ИАПФ невысока, но добавление диуретика помогает повысить активность ренина, восстановив чувствительность к ИАПФ. В результате эта комбинация эффективно снижает АД практически у всех пациентов независимо от исходной активности РААС, что позволяет использовать ее при нормо- и даже гипорениновой формах АГ [5]. Это крайне важно для лечения пожилых больных, поскольку у них нормо- и гипорениновые формы встречаются весьма часто.
Дополнительное снижение АД при комбинированной терапии диуретиком и ИАПФ также обусловлено тем, что последние потенцируют натрийуретический эффект мочегонных препаратов, повышая их эффективность. Совместное применение ИАПФ и диуретиков приводит к аддитивному антигипертензивному эффекту при использовании меньших доз обоих АГП [5].
ИАПФ предотвращают развитие гипокалиемии, возникающей в результате стимуляции выработки альдостерона под действием диуретиков, за счет уменьшения активности ангиотензина II и снижения концентрации альдостерона, что способствует обратному всасыванию калия, теряемого при назначении мочегонных препаратов. Одновременно совместное применение ИАПФ и диуретиков способствует усиленному выведению натрия из организма, тем самым уменьшая нагрузку объемом [5]. При проведении комбинированной терапии очень важны метаболические эффекты ТД и ИАПФ, особенно влияние на инсулинорезистентность, т. к. ее наличие связано с увеличением сердечно-сосудистого риска у больных АГ [2]. Применение диуретиков сопряжено с отрицательным влиянием на углеводный, липидный и пуриновый обмены, способствуя повышению уровней мочевой кислоты, глюкозы и холестерина в крови, что значительно ограничивается при совместном применении с ИАПФ, противодействующими неблагоприятному влиянию мочегонных препаратов [5].
При наличии множества положительных моментов существует несколько проблем, связанных с использованием комбинации ИАПФ и диуретика. Применяя данную комбинацию в качестве средства первого выбора, можно опасаться развития гипотонии из-за эффекта первой дозы. Добавление ИАПФ к мочегонному средству может ухудшить функцию почек у больных сердечной недостаточностью, однако эти проблемы возможно решить посредством тщательного контроля за пациентом в первые дни лечения и постепенного титрования дозы ИАПФ [5].
Снижение доз диуретика и ИАПФ в рациональной комбинации происходит не только без потери, но даже и с увеличением антигипертензивного эффекта, а также снижением риска побочных явлений при лечении этой комбинацией препаратов. Применение комбинации ИАПФ + диуретик позволяет достигать целевого уровня АД более чем у 80 % больных АГ: имея высокую антигипертензивную эффективность, эта комбинация доказала разноплановый органопротективный эффект в виде уменьшения выраженности гипертрофии миокарда левого желудочка (ГМЛЖ), нефропротекции и способности восстанавливать нарушенную эндотелиальную функцию [5]. Данная комбинация АГП предназначена в первую очередь пациентам с хронической сердечной недостаточностью, ГМЛЖ, при диабетической и недиабетической нефропатии. Она также очень эффективна у пожилых пациентов, больных изолированной систолической АГ (ИСАГ), при неэффективности монотерапии ИАПФ или диуретиками (табл. 2, 3).
При комбинированной АГТ с помощью ИАПФ и диуретика принципиально важным остается вопрос о безопасной дозы ТД, т. к. еще в 1959 г. появилось первое сообщение о том, что ГХТ может вызывать нарушение толерантности к глюкозе. С того времени накопилось множество свидетельств о неблагоприятном влиянии ТД на показатели углеводного обмена у больных АГ независимо от наличия или отсутствия сахарного диабета [5]. Помимо неблагоприятного влияния на углеводный обмен ТД могут негативно воздействовать на липидный обмен. Результаты ряда клинических исследований показали, что применение ТД приводит к повышению уровня общего холестерина на 5–20 % и триглицеридов на 15–30 % от исходного уровня [6]. В настоящее время доказано, что только низкие дозы ТД (не более 12,5– 25,0 мг ГХТ в сутки) могут быть использованы для постоянного лечения больных АГ – даже в сочетании с ИАПФ. Безопасность низких доз ГХТ в сочетании с ИАПФ выявлена в ряде исследований. Так, например, в многоцентровом исследовании, включившем 505 пациентов, применение 12,5 мг ГХТ в комбинации с 10 мг лизиноприла уменьшало АД так же эффективно, как и 25 мг ГХТ [7]. Но более высокая доза ТД привела к снижению уровня калия и увеличению уровня глюкозы в плазме крови. Авторы этого исследования сделали вывод, что при неэффективности монотерапии предпочтительно перевести больного на комбинированную терапию вместо увеличения дозы ТД. Еще в одном многоцентровом исследовании с участием 402 пациентов к эналаприлу (20 мг/суг) добавляли ГХТ (6,25 или 12,50 мг/сут) [8]. Присоединение обеих доз ТД привело к практически двукратному нарастанию антигипертензивного эффекта по сравнению с мо нотерапией эналаприлом, однако более высокая доза ГХТ не имела явного преимущества. Обе дозы ГХТ показали одинаковую безопасность в отношении побочных эффектов и не привели к метаболическим нарушениям [8]. C учетом имеющихся на сегодняшний день данных оптимально начинать лечение с низких доз ИАПФ (например, лизиноприла 10 мг/сут) и ТД (6,25–12,5 мг/сут ГХТ) с возможным последующим увеличением доз одного или обоих препаратов вдвое (предпочтительнее вначале увеличить вдвое дозу ИАПФ, а затем в случае недостижения целевого АД увеличить вдвое и дозу ГХТ). Особое значение это свойство комбинации ИАПФ и ГХТ в дозах не более 12,5 мг имеет в гериатрической практике, поскольку практически все больные пожилого возраста имеют сопутствующий атеросклероз коронарных, сонных и бедренных артерий.
Антигипертензивная эффективность комбинаций различных ИАПФ с диуретиками подтверждена рядом исследований, в т. ч. российских [9–13]. Так, например, одним из представителей класса ИАПФ является лизиноприл. В многоцентровом исследовании были изучены антигипертензивная эффективность, влияние на функцию почек терапии лизиноприлом и его фиксированной комбинации с диуретиком ГХТ у больных АГ [13]. В исследовании участвовали 58 пациентов (27 мужчин и 31 женщина) 33–75 лет (55,0 ± 1,5 года) со средней длительностью АГ 12,3 ± 1,4 года. У 61 % больных имела место АГ I и у 39 % II степени тяжести по классификации ВНОК 2007 г. по уровню АД. Через 2 недели “чистого фона” все больные начинали лечение лизиноприлом в дозе 10 мг/сут однократно утром. Через 2 недели у больных, не достигших целевого уровня АД (≤ 140/90 мм рт. ст., а при наличии сахарного диабета ≤ 130/80 мм рт. ст.), доза лизиноприла удваивалась (20 мг/ сут). Если монотерапия лизиноприлом не позволяла достигать целевого уровня АД, к лечению добавляли диуретик ГХТ в виде фиксированной комбинации с лизиноприлом (20 мг лизиноприла/12,5 мг ГХТ) по одной таблетке однократно утром и назначали дополнительный визит через 2 недели для оценки эффективности препарата. При недостижении целевого уровня АД на фоне комбинированной терапии доза данной фиксированной комбинации удваивалась (40 мг лизиноприла/ 25 мг ГХТ). Состояние функции почек как органа-мишени при АГ и ее динамику оценивали при помощи пробы Реберга с расчетом скорости клубочковой фильтрации (СКФ) и определения микроальбуминурии (МАУ) в суточной моче [13].
Авторы отмечают, что на фоне монотерапии лизиноприлом в дозе 10–20 мг/сут в целом по группе через 4 недели терапии происходило достоверное снижение АД со 151,2 ± 1,2/92,2 ± 1,2 до 137,2 ± /85,8 ± 1,2 мм рт. ст. (Δ -14,0 ± 1,0/-6,4 ± 0,8; p < 0,001). Целевого уровня АД достигли 37 % больных, остальных пациентов перевели на фиксированную комбинацию с 12,5 мг ГХТ. За 16 недель лечения в среднем по группе АД снизилось со 151,2 ± 1,2/92,2 ± 1,2 до 127,4 ± 1,0/79,2 ± 0,9 мм рт. ст. (Δ -23,8 ± 1,5/-13,0 ± 1,1; p < 0,001). Достоверной динамики частоты сердечных сокращений не отмечено. Целевого АД достигли 98 % пациентов [13].
Поскольку больных с почечной недостаточностью не включали в исследование, уровень креатинина крови у всех пациентов оставался в пределах 63,7–140,0 (89,2 ± 2,4) мкмоль/л. СКФ колебалась от 69,8 до 187,1 (98,7 ± 4,5) мл/мин. У 28 % больных выявлена гиперфильтрация, которая является основным неиммунным механизмом прогрессирования гипертонической нефропатии, со временем ведущей к снижению СКФ и повышению уровня азотистых шлаков крови [14], что подтверждается наличием отрицательной корреляционной зависимости уровня креатинина от СКФ. МАУ была выявлена у 72 % больных. Суточная экскреция альбумина составила 5–290 (45,3 ± 6,0) мг/сут. Выраженность МАУ нарастала с увеличением тяжести АГ (r = 0,57, p = 0,003) от 37,1 ± 4,4 мг/сут при I до 58,8 ± 13,9 мг/сут при II степени тяжести АГ (p = 0,003) [13].
Авторы также отметили, что лечение лизиноприлом в виде монотерапии и его фиксированной комбинацией с ГХТ привело к снижению уровня МАУ более чем в 2 раза (ΔМАУ -28,6 ± 3,9 мг/сут; p < 0,001), а также увеличению СКФ с 80,8 ± 2,6 до 97,7 ± 3,0 мл/мин (ΔСКФ 20,7 ± 3,4 мл/мин, р < 0,001) у больных с исходно нормальной и сниженной СКФ и уменьшению СКФ со 145,7 ± 5,1 до 120,2 ± 7,3 мл/мин (ΔСКФ -26,9 ± 7,3 мл/мин; p = 0,005) при исходной гиперфильтрации. Разнонаправленное влияние терапии на СКФ у больных с исходно нормальным и повышенным этим показателем является положительным моментом, поскольку гиперфильтрация в настоящее время рассматривается как основной неиммунный механизм развития нефросклероза, что ведет к прогрессированию АГ и развитию почечной недостаточности [2, 5, 14]. Отсутствие снижения СКФ на фоне АГТ у больных без гиперфильтрации свидетельствует об отчетливом нефропротективном эффекте терапии. Снижение уровня МАУ за 16 недель терапии произошло у всех (100 %) больных, с нормализацией – у 88 % больных с исходно повышенной МАУ [13].
По сообщению исследователей, в группе больных, оказавшихся “нечувствительными” к монотерапии лизиноприлом, имевших исходно достоверно более высокий уровень креатинина крови и более низкую СКФ, комбинированная терапия лизиноприлом с ГХТ благоприятно воздействовала на функцию почек в виде статистически значимого снижения уровня МАУ с 53,1 ± 9,2 до 20,4 ± 5,4 мг/сут (ΔМАУ -32,7 ± 5,8 мг/сут, р < 0,001) и увеличения СКФ с 87,4 ± 4,2 до 113,3 ± 3,5 мл/мин (ΔСКФ 25,9 ± 3,1 мл/мин, р < 0,001) [13].
Следует обратить внимание на тот факт, что биохимические показатели крови (калий, натрий, глюкоза, аланинаминотрансфераза, аспартатаминотрансфераза) на фоне терапии обоими препаратами достоверно не изменялись. Переносимость лизиноприла и его фиксированной комбинации с ГХТ была хорошей, различий в переносимости выявлено не было. Нежелательные явления в виде сухого кашля отмечены у одного больного, имели легкую степень выраженности и прошли самостоятельно после отмены препарата [13].
Есть также данные об эффективность и безопасности комбинаций других ИАПФ, например эналаприла, периндоприла, моэксиприла, фозиноприла, с тиазидными и тиазидоподобными диуретиками [9–12]. Однако практически все исследования с использованием ИАПФ и диуретика за редким исключением [9, 12] не ставили перед собой цель оценивать эффективность и безопасность лечения комбинацией препаратов. Как правило, речь шла либо об ИАПФ, либо о диуретике, а второй препарат присоединялся только при неэффективности первого, что диктует необходимость дальнейших исследований.
Проблема АГ особенно актуальна для пожилых больных, поскольку распространенность АГ нарастает с возрастом и после 50 лет превышает 50 %, а у лиц старше 80 лет – 80 % [15]. Кроме того, наличие АГ оказывает существенное влияние на состояние здоровья, продолжительность и качество жизни пожилых пациентов, поскольку она является самостоятельным прогностически независимым фактором риска развития таких сердечно-сосудистых заболеваний, как инсульт, ИБС, а также преждевременной смерти. Так, возраст старше 55 лет для мужчин и старше 65 лет для женщин является одним из дополнительных факторов риска при стратификации риска сердечнососудистых осложнений [16]. Другими словами, при одинаковом уровне АД, как систолического, так и диастолического, риск развития ИБС (рис. 1) и инсульта всегда выше у больного пожилого возраста по сравнению с более молодыми пациентами. Поэтому при лечении пожилых больных особенно важно достижение целевых уровней АД. В связи с этим высокая антигипертензивная эффективность комбинации ИАПФ и диуретика, в частности лизиноприла и ГХТ, имеет весьма существенное значение.
Такое выраженное увеличение частоты АГ у пожилых лиц имеет свое объяснение с точки зрения патогенеза. С возрастом (после 60 лет) даже у практически здоровых людей количество функционирующих нефронов уменьшается в 2 раза [17]. Соответственно, уменьшается площадь фильтрации и возникают объем-зависимые подъемы АД. Это создает условия для повышения эффективности диуретиков при лечении АГ у лиц данной возрастной группы. С возрастом также снижается растяжимость аорты, что в настоящее время считают основным механизмом развития ИСАГ у пожилых [18, 19], возрастает чувствительность к поваренной соли [20] и развивается дисфункция эндотелия (снижается выработка сосудорасширяющих факторов, в частности оксида азота, и повышается сосудосуживающихся) [21].
C возрастом увеличивается частота ИСАГ, превышая 40 % у больных старше 60 лет [22]. Под ИСАГ понимают повышение уровня систолического АД (САД) до 140 мм рт. ст. и выше при диастолическом АД (ДАД) менее 90 мм рт. ст. [1]. С другой стороны, среди пациентов с ИСАГ преобладают лица старше 60 лет: в данной возрастной подгруппе ИСАГ составляет 65–75 % от всех случаев АГ [22]. Это, по-видимому, связано с тем, что повышение САД происходит по меньшей мере до 80-летнего возраста, в то время как диастолического – только до 50-летнего, а затем оно либо выравнивается, либо имеет тенденцию к снижению (рис. 2) [23].
Важность выделения проблемы ИСАГ связана с тем, что повышение САД, в т. ч. изолированное (при нормальном ДАД), является важным фактором риска развития сердечнососудистых, церебральных осложнений и хронической почечной недостаточности [24, 25]. Поэтому расценивать повышение САД как проявление возрастной нормы, как это было около 10 лет назад, является серьезной ошибкой, которая имеет для больного самые серьезные последствия. Повышение САД и ДАД как факторов риска развития всех осложнений АГ минимум равнозначны, и необходимо добиваться их полной нормализации. Более того, во многих случаях повышение САД играет даже большую роль в развитии сердечно-сосудистых осложнений: у лиц всех возрастных групп риск развития всех сердечнососудистых осложнений АГ (ИБС, в т. ч. инфаркт миокарда, инсульт, сердечная недостаточность, атеросклероз периферических артерий) сильнее коррелировал с уровнем САД, а не ДАД [24, 25]. Установлено, что ИСАГ увеличивает смертность от сердечнососудистой патологии в 2–5 раз и общую смертность на 51 % по сравнению с таковой у лиц, имеющих нормальные показатели АД [24].
Средством первого выбора для лечения ИСАГ являются в т. ч. тиазидные и тиазидоподобные диуретики [1]. Их применение у больных с ИСАГ приводит не только к нормализации АД, но и к снижению смертности, риска осложнений (инфаркта, инсульта, сердечной и почечной недостаточности, деменции). Так, если снизить САД хотя бы на 12–13 мм рт. ст., это приведет к уменьшению риска развития ИБС и инсульта (на 21 и 37 % соответственно) и смертности от этих причин (на 27 и 36 % соответственно) [25]. В связи с этим применение фиксированных комбинаций, в состав которых входят диуретики, особо актуально в реальной клинической практике. Различия среди множества фиксированных комбинаций, содержащих комбинацию ИАПФ и ГХТ, базируются, конечно, на различиях в свойствах ИАПФ.
Особое внимание для лечения АГ у пожилых привлекают препараты, метаболизм которых не зависит от ряда факторов, в т. ч. функции печени. Хорошо известно, что больные старше 60 лет имеют множество сопутствующих заболеваний и одно из наиболее частых – это различная патология печени. Поэтому особое внимание при выборе ИАПФ для этой категории больных заслуживает лизиноприл. Его отличительными фармакокинетическими чертами являются очень низкая липофильность, отсутствие метаболизма в организме [26]. Прием пищи не влияет на всасывание препарата. Он единственный(!) из ИАПФ не метаболизируется в печени. Пик концентрации в крови отмечается через 7 часов после приема препарата. Период полувыведения составляет 12 часов, назначают лизиноприл 1 раз в день. Выводится почками. Данный препарат в отличие от всех других длительно действующих ИАПФ является активным действующим веществом, а не пролекарством, требующим метаболических изменений. Это большое клиническое преимущество лизиноприла, поскольку он может в той же дозе назначаться пациентам с любой сопутствующей патологией печени без потери клинического эффекта в отличие от всех других ИАПФ.
Поэтому в России распространены фиксированные комбинации, содержащие лизиноприл и ГХТ. Хотелось бы обратить внимание на препарат Литэн H, который выпускается в двух вариантах: лизиноприл 10 мг + ГХТ 12,5 и лизиноприл 20 мг + ГХТ 12,5 мг. Наличие двух дозировок позволяет врачу более индивидуально подбирать лечение для каждого больного. Так, при АГ I степени (АД 140–159 и/или 90–99 мм рт. ст.) лечение следует начинать с лизиноприла 10 мг + ГХТ 12,5 мг, а при необходимости, особенно при высоком и очень высоком риске развития осложнений, в дальнейшем переходить на вариант лизиноприл 20 мг + ГХТ 12,5 мг. При АГ II степени (АД – 160–179 и/или 100–109 мм рт. ст.) сразу рекомендуется назначать лизиноприл 20 мг + ГХТ 12,5 мг.
Таким образом, комбинированная терапия, прежде всего фиксированные комбинации АГП, является на сегодняшний день терапией первой линии в лечении АГ. В настоящее время по-прежнему самой часто назначаемой комбинацией в очень большом количестве клинических ситуаций, в т. ч. при лечении АГ у пожилых и ИСАГ, является комбинация ИАПФ и ТД ГХТ. Ее отличительными особенностями являются высокая антигипертензивная эффективность, низкая частота побочных эффектов (в т. ч. за счет нейтрализации побочных эффектов друг друга), наличие органопротективных свойств, метаболическая нейтральность (при условии дозы ГХТ не более 12,5 мг). Большое значение для клинической практики имеют и дополнительные свойства ИАПФ, в частности лизиноприла. Более широкое и рациональное использование этих фиксированных комбинаций позволит повысить эффективность лечения АГ, снизить риск сердечно-сосудистых осложнений и смерти.