Сердце начинает биться задолго до нашего рождения. Удивительно и даже волшебно, правда? Однако это значит, что и работает этот орган дольше и больше остальных. И от того, насколько внимательно мы отнесемся к его состоянию, зависит не только качество нашей жизни, но и сама жизнь!
Ежегодно от заболеваний сердца и сосудов погибает больше 17 миллионов человек. При этом доказано, что 80 % преждевременных инфарктов и инсультов можно было предотвратить!
К счастью, большинство сердечно-сосудистых недугов успешно диагностируется благодаря современному инновационному оборудованию и профессионализму врачей. А как известно, установить точный диагноз — значит сделать важный шаг к исцелению.
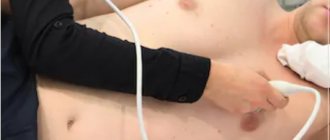
Одним из наиболее информативных и безопасных исследований является эхокардиография сердца (ЭхоКГ) или, иначе говоря, УЗИ сердца.
1 ЭХО-КГ в «МедикСити»
2 Эхокардиография в «МедикСити»
3 УЗИ сердца в «МедикСити»
Суть эхокардиографии
УЗИ сердца — процесс изучения всех основных параметров и структур этого органа с помощью ультразвука.
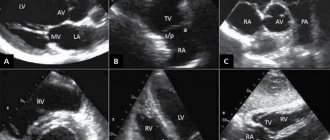
Под воздействием электрической энергии датчик эхокардиографа испускает высокочастотный звук, который проходит через структуры сердца, отражается от них, захватывается тем же датчиком и передается на компьютер. Тот, в свою очередь, анализирует полученные данные и выводит их на монитор в виде двух- или трехмерного изображения.
В последние годы эхокардиографию все чаще применяют в профилактических целях, что дает возможность выявить аномалии сердечной деятельности на ранних этапах.
Что показывает УЗИ сердца:
- размеры сердца;
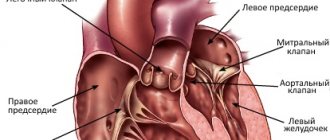
- целостность, структуру и толщину его стенок;
- размеры полостей предсердий и желудочков;
- сократимость сердечной мышцы;
- работу и строение клапанов;
- состояние легочной артерии и аорты;
- уровень давления в легочной артерии (для диагностики легочной гипертензии, которая может возникнуть при тромбоэмболии легочной артерии, например, при попадании тромбов из вен ног в легочную артерию);
- направление и скорость сердечного кровотока;
- состояние внешней оболочки, перикарда.
1 ЭХО-КГ в «МедикСити»
2 Эхокардиография в «МедикСити»
3 УЗИ сердца в «МедикСити»
Установление клинического класса и верификация диагноза
Легочные функциональные тесты позволяют выявить обструктивные или рестриктивные изменения с целью дифференциальной диагностики ЛГ и уточнения тяжести поражения легких. Для больных характерно уменьшение диффузионной способности легких в отношении монооксида углерода (40-80% от нормы), небольшое или умеренное снижение легочных объемов, нормальное или незначительно сниженное PaO2 и обычно сниженное из-за альвеолярной гипервентиляции PaСO2.
Вентиляционно-перфузионная сцинтиграфия легких является методом скрининга для исключения хронической тромбоэмболии как причины легочной гипертензии. У больных после тромбоэмболии обнаруживаются дефекты перфузии в долевых и сегментарных зонах при отсутствии нарушений вентиляции. Перфузионная сцинтиграфия исторически стала одним из первых методов обнаружения дефектов перфузии легочной паренхимы при ТЭЛА. Изображения, получаемые при острой ТЭЛА и ХТЭЛГ, существенно различаются. Дефекты перфузии при острой ТЭЛА более четко очерчены и резко контрастируют с нормально функционирующей тканью. При ХТЭЛГ дефекты перфузии очерчены не четко и часто не соответствуют зоне кровоснабжения крупной легочной артерии.
Компьютерная томография и КТ-ангиопульмонография
КТ- картина хронической тромбоэмболии может быть представлена окклюзиями и стенозами легочных артерий, эксцентрическими дефектами наполнения вследствие наличия тромбов, в том числе реканализованных.КТ-ангиопульмонография проводится на спиральных компьютерных томографах в фазу прохождения контрастного вещества через легочное артериальное русло. Из методологических особенностей следует отметить, что исследование должно быть проведено с использованием не менее чем 8- спирального томографа, с минимальным шагом (не более 3 мм) и толщиной среза (не более 1мм). Тщательное сканирование должно охватить оба легких полностью – от верхушек до диафрагмальных синусов. Контрастное усиление правых отделов сердца и легочных артерий должно соответствовать или превышать степень контрастирования левых камер сердца и аорты. Выполнение второй, артериальной фазы сканирования рекомендуется всем больным старше 40 лет, особенно при наличии данных за артериальные тромбозы и ИБС в анамнезе. Современное программное обеспечение позволяет провести реконструкции изображений легочных артерий в любых плоскостях, построить проекции максимальной интенсивности и трехмерные изображения. В большинстве случаев для уточнения характера поражения достаточно проанализировать поперечные срезы с использованием программы просмотра изображений, что позволяет определить наличие изменений не только в долевых и в сегментарных ветвях, но и в ряде субсегментарных артерий. Патологические изменения помимо наличия «старого» тромботического материала могут включать локальные утолщения стенки сосуда, сужения в устье сосудов и на их протяжении, окклюзии, внутрисосудистые структуры в виде мембран и перемычек. При выявлении изменений в нескольких ветвях легочных артерий можно сделать вывод о высокой вероятности тромбоэмболического характера ЛГ. Важно отметить, что разрешающая способность современных КТ-сканеров ограничена и не позволяет определять очень тонкие мембранные и тяжистые структуры в просвете ЛА, особенно если размеры объекта не превышают 2-3 мм. В ряде случаев развивается кальцификация «старого» тромботического материала, и КТ может оказать неоценимую помощь в определении локализации кальциноза. КТ позволяет выявить не только стенотические изменения сосудов легких, но и нарушения перфузии легочной ткани по характеру контрастирования паренхимы. В некоторых случаях контрастирование паренхимы настолько неравномерно, что на сканах определяется мозаичное контрастирование. Четко выраженная мозаичность сегментов обычно свидетельствует о хорошем прогнозе оперативного лечения. Контрастирование исключительно прикорневых зон не является истинной мозаичностью и нередко наблюдается при микрососудистых формах ЛГ. Обеспечивая детальное изображение легочной паренхимы, КТ позволяет диагностировать и другие заболевания легких. Помимо состояния артериального русла, КТ может дать исчерпывающую информацию обо всех внутригрудных структурах, что важно для подтверждения диагноза и построения плана оперативного лечения. Перед выполнением операции следует учитывать состояние легочной паренхимы, бронхиального дерева, легочных вен.
Ангиографическая диагностика
Основными задачами ангиографической диагностики являются определение степени тяжести легочной гипертензии, уточнение характера поражения легочного русла посредством ангиопульмонографии, выявление/исключение коронарной болезни. Проведение катетеризации в изолированном виде без качественной ангиопульмонографии у больного с четкими признаками ХТЭЛГ нецелесообразно. Это исследование должно дать четкую информацию врачам для решения вопроса об операбельности больного и тяжести его состояния. Гемодинамическими критериями постэмболической легочной гипертензии, выявляемыми при катетеризации правых отделов сердца, являются: среднее давление в легочной артерии (ДЛА) выше 25 мм рт. ст., давление заклинивания легочной артерии (ДЗЛА) ≤ 15 мм рт. ст., ЛСС > 2 ЕД. по Вуду (160 дин. сек см-5) при наличии множественных стенозирующих и/или окклюзирующих поражений ветвей легочной артерии различного калибра.
Кому назначают ЭхоКГ
Планово обследуются:
- младенцы — при подозрении на врожденные пороки;
- подростки — в пору интенсивного роста;
- беременные женщины с имеющимися хроническими заболеваниями — для решения вопроса о способе родов;
- профессиональные спортсмены — для контроля состояния сердечно-сосудистой системы.
Обязательно проводится ЭхоКГ при:
- аномалиях эндокарда и клапанного аппарата:
- опухолях сердца;
- аритмии;
- угрозе инфаркта или имевшем место инфаркте;
- ИБС;
- сбоях сердечной деятельности при различных интоксикациях;
- приступах стенокардии;
- перикардитах различного происхождения;
- гипертонии;
- сердечной недостаточности.
А также в процессе лечения заболеваний сердца, до и после кардиохирургического вмешательства.
Лечение
Стандарты лечения легочной гипертензии предполагают комбинацию адекватной терапии с применением препаратов, выполнения рекомендаций по снижению симптоматики, хирургических методов. Немедикаментозные методы лечения синдрома легочной гипертензии предполагают соблюдение водно-солевого баланса, умеренные физические нагрузки и кислородотерапию. Врачи Юсуповской больницы рекомендуют пациентам с диагнозом легочная гипертензия соблюдать следующие ограничения:
- Уменьшить употребление жидкости — не более 1,5 литров в сутки. Также уменьшить потребление соли;
- Исключить подъемы на высоту (не более 1000 метров);
- Избегать обмороков, появления одышки и болей в груди, что достигается с помощью дозированной физической нагрузки.
Для лечения легочной гипертензии применяют препараты, действие которых направлено на восстановление функции дыхательной и сердечно-сосудистой систем. Специалистам при использовании медикаментозного метода удается уменьшить нагрузку на сердце, расширить сосуды и снизить давление.
В Юсуповской больнице кардиологи назначают пациентам с легочной гипертензией следующие фармакологические препараты:
- Антагонисты кальция. Изменяют частоту сердечных сокращений, расслабляют мускулатуру бронхов, снижают спазм сосудов малого круга, уменьшают агрегацию тромбоцитов, повышают устойчивость сердечной мышцы;
- Диуретики. Выводят лишнюю воду из организма, снижают давление;
- Ингибиторы АПФ. Расширяют сосуды, уменьшают нагрузку на сердце, снижают давление;
- Нитраты;
- Антиагреганты. Уменьшают способность склеивания эритроцитов и тромбоцитов. Предотвращает их прилипание к внутренней оболочке кровеносных сосудов;
- Антикоагулянты прямого действия. Эти препараты препятствуют образованию фибрина (такое вещество в крови, которое образует основу кровяного сгустка), а также предупреждают появление сгустков крови (тромбов);
- Непрямые антикоагулянты. Препараты, относящиеся к этой группе, воздействуют на свертывание крови, а также снижают свертываемость крови;
- Антагонисты рецепторов эндотелина;
- Бронходилятаторы. Эти препараты улучшают вентиляцию легких;
- Оксид азота NO в виде ингаляций – для расширения сосудов;
- Антибиотики — если имеется бронхолегочная инфекция;
- Простагландины. Мощные расширители сосудов, которые имеют целый спектр дополнительных эффектов, таких как препятствие слипанию тромбоцитов и эритроцитов, замедление образования соединительной ткани, уменьшение повреждения эндотелиальных клеток.
Тяжёлая легочная гипертензия у взрослых требует применения хирургических методов лечения:
- Тромбоэндартерэктомии – удаления из сосудов сгустков крови;
- Предсердной саптостомии – создания отверстия между предсердиями для снижения давления;
- Трансплантации комплекса легкого и сердца или только легкого – применяется на поздних стадиях развития заболевания и при наличии других заболеваний.
Чтобы остановить прогрессирование и не допустить осложнений болезни, своевременно обращайтесь к специалистам Юсуповской больницы.
Когда проводится УЗИ сердца
Показаниями к УЗИ сердца являются:
- настораживающие изменения в здоровье (учащения или перебои в сердцебиении, одышка, отеки, слабость, длительно повышенная температура, боли в груди, случаи потери сознания);
- изменения, обнаруженные при последней ЭКГ;
- повышение АД;
- шумы в сердце;
- кардиомиопатия;
- проявления ишемической болезни сердца;
- пороки сердца (врожденные, приобретенные);
- болезни перикарда;
- болезни легких.
Виды
Врачи выделяют несколько основных видов легочной гипертензии:
- Первичную – заболевание с неизвестным происхождением, которое может быть как врожденным, так и приобретенным. Болезнь получила название «идиопатическая легочная гипертензия». Она характеризуется изменением легочной артерии и увеличением правого желудочка. Первичная легочная гипертензия является причиной инвалидизации больного, а при отсутствии лечения приводит к летальному исходу;
- Вторичную – развивается как осложнение других заболеваний: врожденных и приобретенных пороков сердца, ВИЧ-инфекции, болезней соединительной ткани, бронхиальной астмы, патологии дыхательной системы. Заболевание может развиться вследствие закупорки кровяными сгустками сосудов. В данном случае диагностируется хроническая легочная гипертензия.
Подготовка к эхокардиографии сердца
УЗИ сердца не подразумевает специальных приготовлений. Накануне процедуры пациент волен питаться, как привык, и совершать обычные действия. Единственное, чего от него попросят, — это отказаться от спиртного, кофеинсодержащих напитков, крепкого чая.
Если пациент постоянно принимает лекарства, об этом необходимо заранее предупредить, дабы результаты исследования не были искажены.
На каждое последующее УЗИ сердца следует брать расшифровку предыдущего. Это поможет врачу увидеть процесс в динамике и сделать верные выводы о вашем состоянии.
Само исследование занимает от 15 до 30 минут.
Пациент, раздетый до пояса, находится в положении лежа на спине или на боку. На его грудную клетку наносят специальный гель, обеспечивающий более легкое скольжение датчика по исследуемой области (пациент при этом не испытывает дискомфорта).
Специалисту, проводящему ЭхоКГ, доступны любые участки сердечной мышцы — это достигается за счет изменения угла наклона датчика.
Иногда стандартное УЗИ сердца не дает полного объема информации о работе сердца, поэтому применяются другие виды ЭхоКГ. Например, жировая прослойка на грудной клетке у человека с ожирением может мешать прохождению ультразвуковых волн. В таком случае показана чреспищеводная эхокардиография. Как следует из названия, ультразвуковой датчик вводят прямо в пищевод, максимально близко к левому предсердию.
А для скрининга сердечной работы в состоянии нагрузки пациенту может быть назначена стресс-ЭхоКГ. От обычного это исследование отличается тем, что выполняется с нагрузкой на сердце, достигаемой физическими упражнениями, спецпрепаратами или под воздействием электрических импульсов. Используется преимущественно для выявления ишемии миокарда и риска осложнений ИБС, а также при некоторых пороках сердца для подтверждения необходимости хирургической операции.
Симптомы
Легочная гипертензия не имеет ярко выраженных симптомов, поэтому лечение начинается на поздних этапах заболевания. В дебюте заболевания можно обнаружить следующие симптомы:
- Появление небольшой одышки в состоянии покоя или при малой физической активности;
- Охрипший голос или сухой кашель;
- Снижение массы тела без видимых причин;
- Учащенное сердцебиение, с течением заболевания на шее у пациента отчетливо отмечается пульсация яремной вены;
- Подавленное настроение и постоянное чувство усталости и слабости;
- Обмороки и головокружения, которые являются следствием гипоксии – нехватки кислорода.
- На более поздних этапах легочная гипертензия проявляется следующими признаками:
- Нарушением ритма сердца – аритмией;
- Симптомами ишемии миокарда и приступами стенокардии, при которых пациента охватывает чувство страха, выступает холодный пот и появляется боль за грудиной;
- Кровохарканьем и появлением прожилок крови в мокроте.
На терминальной стадии происходит отмирание тканей, возникающее из-за формирования тромбов в артериолах. Гипертонические кризы у больных проявляются в ночное время. Острая сердечная недостаточность или перекрытие легочной артерии тромбом могут стать основными причинами смерти.
Записаться на приём
Расшифровка ЭхоКГ
После исследования врач составляет заключение. Вначале описывается визуальная картинка с предполагаемым диагнозом. Во второй части протокола исследования указываются индивидуальные показатели пациента и их соответствие нормам.
Расшифровка полученных данных не является окончательным диагнозом, поскольку исследование может делать не кардиолог, а специалист УЗ-диагностики.
Именно врач-кардиолог, на основании собранного анамнеза, результатов осмотра, расшифровки анализов и данных всех назначенных исследований, может сделать точные выводы о вашем состоянии и назначить необходимое лечение!
ЭхоКГ норма: о чем говорят некоторые параметры
Существует диапазон нормальных значений того или иного показателя УЗИ сердца для взрослых людей (у детей нормы иные и напрямую зависят от возраста).
Так, наряду с другими важными параметрами, ЭхоКГ помогает получить информацию о фракции выброса сердца — по этому показателю определяется эффективность работы, выполняемой сердцем с каждым ударом.
Фракцией выброса (ФВ) именуется процент от объема крови, выбрасываемой в сосуды из желудочка сердца во время каждого сокращения. Если в желудочке было 100 мл крови, а после сокращения сердца в аорту попало 55 мл, считается, что фракция выброса составила 55%.
Когда звучит термин фракция выброса, как правило, речь идет о фракции выброса левого желудочка (ЛЖ), так как именно левый желудочек выбрасывает кровь в большой круг кровообращения.
Здоровое сердце даже в покое с каждым ударом выбрасывает в сосуды более половины крови из левого желудочка. При уменьшении фракции выброса развивается сердечная недостаточность.
Норма фракции выброса левого желудочка для взрослого человека составляет 55-70%. Значение 40-55% говорит о том, что ФВ ниже нормы. Показатель менее 40% и еще более низкие фракции выброса указывают на сердечную недостаточность у пациента.
- Архив журнала /
- 2012 /
- №17
Лекарственные препараты для лечения легочной гипертензии
Е.А. Ушкалова, Н.К. Рунихина, И.М. Новикова
ФГБУ “Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова” Минздравсоцразвития России
Представлен обзор, посвященный фармакотерапии легочной гипертензии (ЛГ), возникающей в результате прогрессивного повышения легочного сосудистого сопротивления, что ведет к правожелудочковой недостаточности и преждевременной смерти. На основании результатов многочисленных клинических исследований в статье анализируются эффективность применения и безопасность препаратов, которые используются в качестве основной и поддерживающей терапии ЛГ. Поддерживающая фармакотерапия включает использование антикоагулянтов, сердечных гликозидов и диуретиков. К препаратам специфической терапии ЛГ относят блокаторы кальциевых каналов, аналоги простациклина, ингибиторы эндотелиновых рецепторов и ингибиторы фосфодиэстеразы-5 (ФДЭ-5).
Ключевые слова: фармакотерапия легочной гипертензии, правожелудочковая сердечная недостаточность, легочная гипертензия
Легочная гипертензия (ЛГ) – синдром, возникающий из-за ограниченного кровотока через легочную артериальную циркуляцию, который приводит к увеличению легочного сосудистого сопротивления и в конечном счете – к правожелудочковой сердечной недостаточности [1]. ЛГ является достаточно редкой патологией, встречающейся с частотой 15 на 1 млн населения [2]. Прогноз при ЛГ неблагоприятный, смертность среди больных, получающих современную терапию, составляет 15 % в течение года [3], средняя выживаемость с момента диагностики – 2,8–5,0 лет [4–7].
Выбор терапии при ЛГ определяется формой и тяжестью заболевания, поэтому эффективность лечения в значительной мере зависит от тщательности обследования больного [8, 9]. Лечение следует начинать только после верификации диагноза при катетеризации правых отделов сердца и проведения острых проб с вазодилататорами [10].
Лекарственную терапию ЛГ подразделяют на основную и поддерживающую. Поддерживающая фармакотерапия включает использование антикоагулянтов, сердечных гликозидов и диуретиков. Следует отметить, что применение поддерживающей фармакотерапии основано на ограниченной доказательной базе (см. таблицу).
. Рекомендации по применению поддерживающей терапии у больных ЛГ [15].
Так, использование антикоагулянтов обусловлено преимущественно сведениями о нарушении коагуляции и фибринолиза у этих больных [11–13], а также данными аутопсии о высокой распространенности среди них тромботических поражений [14]. Кроме того, среди больных ЛГ имеются неспецифические факторы риска венозной тромбоэмболии, такие как сердечная недостаточность и ограничение двигательной активности.
Исследования пероральных антикоагулянтов, преимущественно одноцентровые и ретроспективные, проведены для больных идиопатической ЛГ, наследственной ЛГ и ЛГ, вызванной применением анорексигенных средств [15]. В некоторых из исследований показано улучшение показателя выживаемости пациентов с ЛГ [16]. В Международных руководствах по лечению ЛГ пероральные антикоагулянты рекомендуют больным идиопатической и хронической тромбоэмболической формами заболевания [1, 15]. Антикоагулянтную терапию в связи с повышенным риском катетерассоциированного тромбоза в отсутствие противопоказаний также проводят больным, длительно получающим аналоги простациклинов для внутривенного введения.
Рекомендация по применению варфарина больными идиопатической ЛГ основана на результатах одного проспективного и двух ретроспективных обсервационных неконтролируемых исследований [17].
При назначении антикоагулянтов рекомендуется тщательно взвешивать их потенциальную пользу и риск кровотечения, особенно для пациентов с портолегочной ЛГ и выраженным расширением вен пищевода. Полного консенсуса в отношении целевого международного нормализованного отношения (МНО) при применении антикоагулянтов больными ЛГ нет. В странах Северной Америки рекомендуют поддерживать МНО на уровне 1,5–2,5; в Европе – 2,0–3,0 [1, 15].
Рандомизированные клинические исследования диуретиков при ЛГ не проводились. Их рекомендуют для симптоматической терапии пациентам с правожелудочковой недостаточностью [15, 18]. Выбор конкретного
мочегонного препарата в международных рекомендациях оставляется на усмотрение лечащего врача [1, 15], в российских рекомендациях предпочтение отдается петлевым диуретикам: фуросемиду (20–120 мг/сут), этакриновой кислоте (50–100 мг/сут), торасемиду (5–10 мг/сут) [18]. К основному мочегонному препарату можно добавить антагонист альдостерона [1, 18]. Во избежание резкого снижения объема циркулирующей крови и артериального давления (АД) дозы диуретиков необходимо тщательно титровать. В период лечения следует контролировать уровень электролитов в сыворотке крови и функцию почек.
Применение кардиотоников, преимущественно дигоксина, рекомендуется при правожелудочковой недостаточности и для урежения частоты желудочковых сокращений у больных ЛГ с мерцанием или трепетанием предсердий [1]. В одном исследовании показано, что внутривенное введение дигоксина больным идиопатической ЛГ приводит к умеренному повышению сердечного выброса и снижению уровня циркулирующего в крови норадреналина [19], однако данные об эффекте хронического применения дигоксина для этих больных отсутствуют. Практический опыт показывает, что внутривенное введение добутамина часто приводит к улучшению различной продолжительности среди больных ЛГ конечной стадии, но клинических исследований добутамина у этой категории пациентов не проводилось.
К препаратам специфической терапии ЛГ относят блокаторы кальциевых каналов, аналоги простациклина, ингибиторы эндотелиновых рецепторов и ингибиторы фосфодиэстеразы-5 (ФДЭ-5). Блокаторы кальциевых каналов применяют в качестве лечения ЛГ с середины 1980-х гг. Основанием к их применению явились патогенетические изменения, происходящие при идиопатической ЛГ: гипертрофия и гиперплазия гладкомышечных клеток, вазоконстрикция. РКИ эффекта от препаратов этой группы для пациентов с ЛГ не проводили. В одноцентровых нерандомизированных неконтролируемых исследованиях применение блокаторов кальциевых каналов больными идиопатической ЛГ ассоции-ровалось с благоприятным влиянием на выживаемость [20, 21]. Однако в последние годы получено достаточно много данных, свидетельствующих о том, что пользу от применения препаратов этой группы может получить лишь небольшое число пациентов с идиопатической ЛГ (10–15 %), у которых наблюдался положительный ответ на острую пробу на вазореактивность [22].
При ЛГ, ассоциированной с заболеваниями соединительной ткани, роль блокаторов кальциевых каналов еще более ограничена малым числом респондеров на пробы на вазореактивность и плохой переносимостью высоких доз этих препаратов [23]. Кроме того, при большинстве ассоциированных форм ЛГ, включая ЛГ, ассоциированную с заболеваниями соединительной ткани, ВИЧ-инфекцией, портальной гипертензией и веноокклюзионной болезнью/легочным капиллярным гемангиоматозом, даже от пациентов с положительным ответом на острую пробу с вазодилататором редко наблюдается адекватный терапевтический ответ на длительную терапию блокаторами кальциевых каналов [23]. Исключение составляют лишь больные, у которых ЛГ ассоциирована с применением анорексигенных средств [24].
Пациентам, не прошедшим пробы с вазодилататором или с негативным ответом при проведении этих проб, назначать блокаторы кальциевых каналов не рекомендуется в связи с риском развития тяжелых побочных эффектов (гипотензии, синкопе, правожелудочковой недостаточности) и низкой вероятностью эффективности. Выбор конкретного блокатора кальциевых каналов зависит от исходной частоты сердечных сокращений. Пациентам с относительной брадикардией предпочтение рекомендуется отдавать нифедипину и амлодипину, тахикардией – дилтиазему. Применения верапамила в связи с потенциальным отрицательным инотропным эффектом рекомендуетсяизбегать. Блокаторы кальциевых каналов используют в высоких суточных дозах: нифедипин – 120–240 мг, дилтиазем – 240–720 мг и амлодипин – до 20 мг/сут. Однако лечение следует начинать с низкой дозы (например, по 30 мг нифедипина с медленным высвобождением действующего вещества 2 раза в сутки, 60 мг дилтиазема 3 раза в сутки или амлодипина 2,5 мг/сут), а затем постепенно и с осторожностью повышать ее до максимально переносимой. Факторами, ограничивающими повышение дозы, обычно являются системная гипотония и отек нижних конечностей.
В период лечения блокаторами кальциевых каналов необходимо тщательно мониторировать их эффективность и безопасность. Первую оценку эффективности терапии, в т. ч. с катетеризацией правых отделов сердца, рекомендуется проводить через 3–4 месяца после их назначения [15]. Если у больного с положительным ответом на пробу с вазодилататором при лечении блокаторами кальциевых каналов не удается достичь улучшения состояния (переход в функциональный класс I или II), рекомендуется добавить препараты других групп или перевести его на другую терапию.
Применение аналогов простациклина, антагонистов рецепторов эндотелина и ингибиторов ФДЭ-5 основы-вается на современных представлениях о патогенезе ЛГ (в соответствии с которыми выделяют 3 основные терапевтические мишени – повышение эффектов простациклина и оксида азота и снижение эффектов эндотелина [25]. Благоприятный эффект аналогов простациклина (простаноидов) при ЛГ обусловлен наличием у них сосудорасширяющих, антиагрегационных и антипролиферативных свойств [15]. Первым препаратом этой группы, зарегистрированным для лечения ЛГ, был эпопростенол. Он предназначен для внутривенного введения, оказывает быстрый эффект, достигая стабильных концентраций в крови менее чем через 30 минут после введения, но имеет очень короткий период полувыведения (менее 6 минут), в связи с чем его необходимо вводить непрерывно с помощью инфузионной помпы и центрального венозного катетера [26]. Препарат сохраняет стабильное состояние при комнатной температуре не более 8 часов, поэтому его надо поддерживать в охлажденном состоянии. Кроме того, недостатком эпопростенола является развитие к нему толерантности, требующей постоянного повышения дозы [27]. Эффективность эпопростенола для больных идиопатической ЛГ была продемонстрирована в нескольких РКИ и систематических обзорах [26–31]. Одно-, двух- и трехлетняя выживаемость при применении этого препарата составила 87,8 %, 76,3 и 62,8 %, что достоверно превышало ожидаемую выживаемость, рассчитанную на основании исторического контроля (58,9 %, 46,3 и 35,4 % соответственно) [32]. По результатам метаанализа, внедрение эпопростенола в медицинскую практику позволило повысить пятилетнюю выживаемость с 34 до 67 % [33].
Фактором, ограничивающим применение эпопростенола, является его переносимость. Побочные эффекты при длительном применении препарата встречаются часто. Наиболее распространенными среди них являются головная боль, покраснение кожи, боль в области нижней челюсти, диарея, тошнота, эритематозная сыпь, боль в спине, голенях и стопах [27]. Иногда развивается системная гипотония. Частота и выраженность побочных эффектов зависят от дозы. Максимально переносимая доза для большинства пациентов составляет 20–40 нг/кг/мин [29, 32]. Кроме того, при применении препарата существует риск развития серьезных нежелательных явлений, связанных со способом введения, – неправильного функционирования инфузионной помпы, обструкции катетера, инфекции в месте введения и сепсиса. В связи с этим введение эпопростенола рекомендуется производить только в центрах, имеющих опыт работы с данным препаратом [34].
Трициклическое бензидиновое производное эпопростенола трепростинил отличается более длительным периодом полувыведения (4,5 часа) и удовлетворительной стабильностью, позволяющей вводить его в физиологическом растворе при температуре окружающего воздуха как внутривенно, так и подкожно. При внутривенном введении трепростинил вызывает побочных эффектов меньше, чем эпопростенол, однако сравнительных исследований по эффективности этих препаратов не проводилось [35–38]. Подкожное введение, осуществляемое с помощью микроинфузионной помпы и подкожных катетеров, позволяет значительно снизить риск инфекционных осложнений по сравнению с внутривенным введением [27]. Недавно за рубежом была зарегистрирована лекарственная форма трепростинила для ингаляционного введения, в стадии предрегистрационных исследований находится пероральная форма препарата. По сравнению с илопростом (см. ниже) ингаляционная форма трепростинила имеет ряд преимуществ – более редкое введение, более короткое время ингаляции, более удобный в использовании небулайзер [39].
Эффективность и безопасность трепростинила при подкожном введении для больных со II–IV функциональными классами (ФК) ЛГ были показаны в двух плацебо-контролируемых РКИ, включая большое двойное слепое исследование с участием 470 пациентов [40]. В открытом исследовании с участием 860 больных ЛГ однолетняя выживаемость при подкожном применении трепростинила составила 91 %, четырехлетняя – 72 % [41]. Фактором, ограничивающим подкожное введение препарата, особенно в педиатрии, является болезненность инъекций.
Илопрост, предназначенный для ингаляционного введения с помощью небулайзера, вводится 6–9 раз в сутки в течение 10–15 минут. Его преимуществом перед препаратами для инъекционного введения является более редкая частота системных побочных эффектов, включая снижение системного АД. В целом илопрост хорошо переносится, в т. ч. при длительном применении [42], но может вызывать реактивный бронхоспазм, особенно у детей [43].
В многоцентровом рандомизированном исследовании лечение илопростом в течение 3 месяцев по эффективности (комбинированная конечная точка, включающая не менее 10 % улучшения по тесту 6-минутной ходьбы и улучшение ФК) значительно превосходило плацебо [44]. Согласно результатам мета-анализа, илопрост проявляет равную эффективность с антагонистом рецепторов эндотелина бозентаном и ингибитором ФДЭ-5 силденафилом, однако чаще вызывает серьезные побочные эффекты [45]. Двухлетняя выживаемость при его применении составила 87 % (по сравнению с ожидаемой 63 %), среднее повышение дозы в течение 2 лет – 16 % [42].
Препарат рекомендован в качестве лечения больных идиопатической ЛГ III и IV ФК. В ряде азиатских стран для лечения ЛГ разрешен пероральный аналог простациклина берапрост, однако в США и Европе от его дальнейших исследований отказались в связи с неблагоприятным соотношением польза/риск [34]. Улучшение симптоматики, наблюдавшееся в клинических исследованиях только в первые 3–6 месяцев лечения берапростом, сопровождалось частым развитием побочных эффектов [46]. В настоящее время в клинических исследованиях изучается аналог берапроста более длительного действия [47].
В целом простациклины рассматриваются в качестве препаратов выбора для больных тяжелой идиопатической формой ЛГ, однако их применение на ранних стадиях заболевания приносит существенную пользу и пациентам с легкими, а также среднетяжелыми формами [48]. Имеющиеся данные позволяют предположить, что аналоги простациклина также эффективны при ЛГ, ассоциированной с системными заболеваниями соединительной ткани, пороками сердца и ВИЧ-инфекцией [15]. Накапливаются сведения о том, что терапия простаноидами способствует нормализации уровня С-реактивного протеина – фактора, ассоциирующегося с улучшением отдаленных исходов [49].
Антагонисты рецепторов эндотелина устраняют сосудосуживающий и митогенные эффекты эндотелина-1 (ЕТ1), которому отводят важную роль в патогенезе ЛГ. В настоящее время в Европе и Северной Америке применяют два препарата этой группы – бозентан и амбрисентан. Третий антагонист рецепторов эндотелина, ситаксентан, был добровольно отозван производителем с рынка в декабре 2010 г. в связи с двумя случаями фатальной гепатотоксичности [50]. В РФ зарегистрирован только бозентан. Он является “двойным” антагонистом эндотелиновых рецепторов ЕТ1 – ЕТА и ЕТВ. Препарат предназначен для приема внутрь и имеет достаточно благоприятные фармакокинетические свойства, позволяющие применять его 2 раза в сутки.
Эффективность применения бозентана продемонстрирована в клинических исследования больных идиопатической ЛГ. Применение бозентана приводило к повышению по сравнению с плацебо переносимости физической нагрузки, улучшению ФК, сердечно-легочной гемодинамики и качества жизни пациентов, а также замедлению прогрессирования заболевания [51–54]. В ряде исследований показано существенное улучшение выживаемости пациентов по сравнению с историческим контролем [55–57]. В одном из них одно- и двухлетняя выживаемость при лечении бозентаном составила 97 и 91 % по сравнению с 91 и 84 % при применении эпопростенола [56]. Помимо влияния на выживаемость, по данным открытого исследования, бозентан увеличивал на 3,49 года по сравнению с историческим контролем продолжительность добавленной качественной жизни (quality-adjusted life years) больных ЛГ [58]. Однако в Кокрановском мета-анализе (11 РКИ, 1457 пациентов) удалось выявить лишь тенденцию к снижению смертности среди пациентов с ЛГ, получавших препараты группы антагонистов рецепторов эндотелина, включая бозентан [59]. В другом мета-анализе (10 РКИ, 1635 пациентов, в т. ч. 23,9 % с ЛГ, ассоциированной с заболеваниями соединительной ткани, и 18,2 % –с врожденными заболеваниями сердца) прогнозируемая выживаемость при применении бозентана составила 77,8 % в течение года, 67,7 % – 2 лет и 59,3 % – 3 лет, что было значительно хуже приведенных выше показателей [60]. Есть данные об эффективности бозентана для больных ЛГ, ассоциированной с ВИЧ-инфекций [56], врожденными заболеваниями сердца [61, 62] и заболеваниями соединительной ткани [63–66]. Бозентан представляется перспективным препаратом лечения хронической тромбоэмболической ЛГ [67, 68]. Согласно результатам метаанализа, его применение ассоциируется с улучшением гемодинамики и, возможно, переносимости физической нагрузки этими больными [69].
Основной проблемой при применении бозентана является его гепатотоксичность. Согласно данным производителя, повышение уровня печеночных аминотрансфераз более чем в 3 раза наблюдается среди 11 % пациентов, получающих препарат [70]. Гепатотоксичность носит дозозависимый характер: в исследовании BREATHE-1 частота повышения уровня печеночных ферментов составила 14 % при применении бозентана в дозе 250 мг 2 раза в сутки и 4 % – при его применении в дозе 125 мг 2 раза в сутки (в группе плацебо – 3 %) [63]. Анализ данных 4994 пациентов (период наблюдения – 30 месяцев), принимавших бозентан в реальной медицинской практике, показал, что частота повышения печеночных ферментов в 3 раза по сравнению с верхней границей нормы составила при его применении 7,6 %, частота отмены препарата по этой причине – 3,7 % [71].
В первые недели лечения бозентаном наблюдается снижение уровня гемоглобина, который стабилизируется примерно через 12 недель после начала терапии [72]. В исследовании BREATHE-5 среди пациентов с синдромом Эйзенменгера, получавших препарат, отмечено небольшое статистически недостоверное снижение сатурации смешанной венозной крови, не сопровождавшееся развитием нежелательных клинических явлений [61].
У 10–19 % больных ЛГ бозентан может вызывать периферические отеки [61, 64, 71, 73]. Механизм их развития не до конца ясен. У некоторых пациентов отеки возникают вследствие ухудшения правожелудочковой недостаточности, они также могут быть обусловлены вазодилатацией, вызываемой антагонистами рецепторов эндотелина, или влиянием на функцию почечных канальцев [74]. Амбрисентан в отличие от бозентана является селективным антагонистом рецепторов ЕТА и имеет более длительный период полувыведения (9–15 часов), позволяющий вводить его 1 раз в сутки. Его эффективность при пероральном приеме в дозах от 2,5 до 10 мг/сут больными ЛГ подтверждена результатами РКИ [75, 76]. Применение препарата приводило к улучшению состояния пациентов по результатам теста с 6-минутной ходьбой и оценке по шкале индивидуального восприятия нагрузки Борга, улучшению ФК ЛГ, гемодинамических показателей и качества жизни больных.
Амбрисентан реже бозентана вызывает гепатотоксические реакции [77]. В ряде клинических исследований их частота составила менее 1 %, однако в этих исследованиях частота повышения уровня печеночных ферментов у пациентов группы плацебо также была очень низкой [78]. Следует отметить, что частота гепатотоксических реакций ситаксентана, впоследствии отозванного с рынка вследствие фатальных поражений печени, в клинических исследованиях была также ниже (7 %), чем в исследованиях бозентана [78]. Амбрисентан реже бозентана вступает в клинически значимые лекарственные взаимодействия [79].
Мощным вазодилататором, селективно действующим на сосуды малого круга кровообращения, является оксид азота. За рубежом больным ЛГ проводят 2–3-недельные курсы ингаляционного оксида азота (20–40 пропроми́лле) в течение 5–6 часов в сутки. Результаты клинических исследований позволяют предполагать, что ингаляционный оксид азота может быть эффективной терапевтической опцией для лечения ЛГ разной степени тяжести [80, 81].
Механизм действия ингибиторов ФДЭ-5 опосредован через усиление ффектов оксида азота. Предотвращая деградацию цГМФ, они усиливают расслабляющее действие оксида азота на гладкую мускулатуру сосудов и его антиагрегационную активность, вызывают снижение легочного сосудистого сопротивления и перегрузки правого желудочка сердца. Возможно, что благоприятному эффекту препаратов этой группы при ЛГ могут способствовать их плейотропные эффекты. В частности, силденафил обладает антиоксидантными свойствами и оказывает антипролиферативный эффект [82–84]. Результаты одного исследования позволили предположить наличие у силденафила инотропного действия [85]. Помимо ФДЭ-5 силденафил ингибирует ФДЭ-1, уровень которой повышается при ЛГ [86]. Кроме того, при лечении силденафилом в бóльшей степени, чем при лечении другими препаратами, повышается уровень эндотелиальных прогениторных клеток, число которых снижено при идиопатической и наследственной ЛГ [87].
В клинических исследованиях силденафила участвовали преимущественно пациенты с II–III ФК, в т. ч. 71 % пациентов с идиопатической ЛГ и 25 % – с ЛГ, ассоциированной с заболеваниями соединительной ткани. При применении в дозах 25–100 мг 2–3 раза в сутки он вызывал улучшение гемодинамики, повышение толерантности к физическим нагрузкам и улучшение ФК ЛГ [88].
В ряде мета-анализов продемонстрирована равная эффективность силденафила с аналогами простациклина и антагонистами рецепторов эндотелина [45, 89]. По результатам P. Steele и соавт., однолетняя выживаемость при применении силденафила (75,2 %) была сопоставимой с таковой при применении эпопростенола (78,4 %), бозентана (77,8 %), трепростинила (76,1 %), ситаксентана (75,8 %) и берапроста (74,1 %) [60]. Силденафил показан для лечения больных ЛГ II–III ФК [1]. В настоящее время нет данных, поддерживающих его применение больными бессимптомной ЛГ. Его также не следует рассматривать в качестве препарата первого выбора для пациентов с тяжелой формой заболевания (IV ФК, показатель теста 6-минутной ходьбы < 100 м) [90]. Рекомендуемая доза силденафила, согласно инструкции по медицинскому применению, составляет 20 мг 3 раза в сутки, однако длительный стабильный эффект препарата продемонстрирован лишь при применении дозы 80 мг/сут. Ограничение дозы 60 мг/сут обусловлено проблемами безопасности, т. к. ряд наиболее распространенных побочных эффектов препарата (покраснение кожи, головная боль, нарушения зрения) носит дозозависимый характер [88].
Силденафил в целом хорошо переносится больными ЛГ, в т. ч. при длительном применении, однако при его назначении следует оценивать уровень системного АД, а также выяснять, не принимает ли пациент сопутствующие препараты, способные усиливать его гипотензивный эффект (нитраты, α-адреноблокаторы).
Другим ингибитором ФДЭ-5, зарегистрированным за рубежом для лечения ЛГ, является тадалафил (40 мг/сут). Основанием для его регистрации по данному показанию явились результаты 16-недельного РКИ, в котором тадалафил в дозах от 2,5 до 40 мг сравнивали с плацебо у больных ЛГ [91]. Полученные результаты были сходными с таковыми исследования SUPER-1, в котором изучали силденафил [88]. Применение тадалафила приводило к улучшению результатов теста 6-минутной ходьбы на 44 м, улучшению гемодинамических показателей и качества жизни пациентов. Переносимость тадалафила сходна с таковой силденафила.
Результаты недавно опубликованного 24-недельного двойного слепого плацебо-контролируемого исследования (n = 66) свидетельствуют, что варденафил в дозе 5 мг 2 раза в сутки также эффективен при ЛГ и хорошо переносится больными [92].
Пациентам, у которых наблюдается ухудшение (или отсутствует улучшение) состояния на фоне монотерапии, эксперты рекомендуют комбинированную фармакотерапию [1, 15]. В основу этой рекомендации положено преимущественно теоретическое предположение, будто терапевтический эффект может усиливаться при воздействии ЛС на разные патогенетические мишени [93]. Это предположение подтвердилось в ряде клинических исследований, однако имеющиеся в настоящее время данные не позволяют окончательно доказать наличие преимуществ комбинированной тера
пии по сравнению с монотерапией. По результатам мета-анализа 6 РКИ (858 пациентов) комбинированная терапия улучшает клинические и гемодинамические исходы, но не снижает смертность по сравнению с монотерапией [94]. Потенциально полезные комбинации включают сочетание простаноидов с антагонистами рецепторов эндотелина, простаноидов с ингибиторами ФДЭ-5 и ингибиторов ФДЭ-5 с антагонистами рецепторов эндотелина.
Таким образом, в настоящее время на международном фармацевтическом рынке имеется достаточно много ЛС разных фармакологических групп для лечения ЛГ, однако смертность этих больных остается на высоком уровне. Поиск эффективной и безопасной фармакотерапии ЛГ продолжается. В стадии разработки находятся препараты нескольких фармакологических классов – ингибиторы Rho-киназы, стимуляторы растворимой гуанилатциклазы (риоцигуат и др.), вазоакти́вные полипептиды, ингибиторы транспортера серотонина, ингибиторы протеинтирозинкиназы (иматиниб), фактор роста сосудистого эндотелия и др. [34].
Литература
1. McLaughlin VV, Archer SL, Badesch DB, et al. ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American. Heart Association Developed in Collaboration With the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association J Am Coll Cardiol. 2009 Apr 28;53(17):1573–619. 2. McLaughlin VV. Classification and epidemiology of pulmonary hypertension. J Am Coll Cardiol 2004;43(12):5S–12S. 3. Thenappan T, Shah SJ, Rich S, et al. A USA-based registry for pulmonary arterial hypertension: 1982– 2006 Eur Respir J 2007;30:1103–10. 4. D’Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension. Ann Intern Med 1991;115:343–49. 5. Appelbaum L, Yigla M, Bendayan D, et al. Primary pulmonary hypertension in Israel: a national survey. Chest 2001;119(6):1801–806. 6. Sandoval J, Bauerle O, Palomar A, et al. Survival in primary pulmonary hypertension. Validation of a prognostic equation. Circulation 1994;89(4):1733–44. 7. Shapiro S, Traiger GL, Turner M, et al. Sex differences in the diagnosis, treatment, and outcome of patients with pulmonary arterial hypertension enrolled in the registry to evaluate early and long-term pulmonary arterial hypertension disease management. Chest 2012; 141(2):363–73. 8. McLaughlin VV, Davis M, Cornwell W. Pulmonary arterial hypertension. Curr Probl Cardiol 2011;36(12):461–517. 9. Frumkin LR. The Pharmacological Treatment of Pulmonary Arterial Hypertension. Pharmacol Rev 2012;1 . 10. Сидоренко Б.А., Преображенский Д.В., Батыралиев Т.А., Беленков Ю.Н. Легочная артериальная гипертензия: изменяющиеся подходы к лечению // Кардиология 2011. № 51(1). С. 100–8. 11. Herve P, Humbert M, Sitbon O, et al. Pathobiology of pulmonary hypertension: the role of plateletsand thrombosis. Clin Chest Med 2001;22:451–58. 12. Hoeper MM, Sosada M, Fabel H. Plasma coagulation profiles in patients with severe primary pulmonary hypertension. Eur Respir J 1998;12:1446–49. 13. Beckmann R, Frank H, Kneussl M, et al. Fibrinogen,t-PA, and PAI-1 plasma levels in patients with pulmonary hypertension. Am J Respir Crit Care Med 1994;150:929–33. 14. Fuster V, Steele PM, Edwards WD, et al. Primary pulmonary hypertension: natural history and the importance of thrombosis. Circulation1984;70:580–87. 15. Gali N, Hoeper MM, Humbert M, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT) Eur Heart J 2009;30(20):2493–537. 16. Kawut SM, Horn EM, Berekashvili KK, et al. New predictors of outcome in idiopathic pulmonary arterial hypertension. Chest 2008;134:139–45. 17. Badesch DB, Abman SH, Simonneau G, et al. Medical therapy for pulmonary arterial hypertension. Updated ACCP evidence-based clinical practice guidelines. Chest 2007;131:1917–28. 18. Чазова И.Е., Мартынюк. Т.В., Адееев С.Н. и др. Российские рекомендации по диагностике и лечению легочной гипертензии //Кардиоваскулярная терапия и профилактика 2007. № 6(6). Приложение 2. 19. Rich S, Seidlitz M, Dodin E, et al. The short-term effects of digoxin in patients with right ventricular dysfunction from pulmonary hypertension. Chest 1998;114:787–92. 20. Rich S, Kaufmann E, Levy PS. The effect of high doses of calcium-channel blockers on survival in primary pulmonary hypertension N Engl J Med 1992;327:76–81. 21. Sitbon O, Humbert M, Jais X, et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005;111:3105–11. 22. Tonelli AR, Alnuaimat H, Mubarak K. Pulmonary vasodilator testing and use of calcium channel blockers in pulmonary arterial hypertension. Respir Med 2010;104(4):481–96. 23. Mukerjee D, St George D, Coleiro B, et al. Prevalence and outcome in systemic sclerosis associated pulmonary arterial hypertension: application of a registry approach. Ann Rheum Dis 2003;62:1088–93. 24. Montani D, Savale L, Natali D, et al. Long-term response to calcium-channel blockers in non-idiopathic pulmonary arterial hypertension. Eur Heart J 2010;31(15):1898–907. 25. Humbert M, Sitbon O, Simonneau G. Treatment of pulmonary arterial hypertension. N Engl J Med 2004;351:1425–36. 26. Badesch DB, McLaughlin VV, Delcroix M, et al. Prostanoid therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43(12):56S–61S. 27. Ivy DD. Prostacyclin in the intensive care setting. Pediatr Crit Care Med 2010; 11(2 Suppl.): S41–S5. 28. Barst RJ, Rubin LJ, Long WA, et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. The Primary Pulmonary Hypertension Study Group. N Engl J Med 1996;334:296–302. 29. Sitbon OHM, Nunes H, Parent F, et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: Prognostic factors and survival. J Am Coll Cardiol 2002;40:780–88. 30. Chen YF, Jowett S, Barton P, et al. Clinical and cost-effectiveness of epoprostenol, iloprost, bosentan, sitaxentan and sildenafil for pulmonary arterial hypertension within their licensed indications: a systematic review and economic evaluation. Health Technol Assess 2009;13(49):1–320.
Об авторах / Для корреспонденции
Ушкалова Е.А. – д.м.н., проф. кафедры общей и клинической фармакологии РУДН. ведущий научный сотрудник терапевтического отделения ФГБУ “Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова”, E-mail; Рунихина Н.К. – д.м.н., зав. терапевтическим отделением ФГБУ “Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова” Минздравсоцразвития РФ. E-mail:[email protected]; Новикова И.М. – к.м.н., старший научный сотрудник терапевтического отделения ФГБУ ”Научный центр акушерства, гинекологии и перинатологии им. им. В.И. Кулакова” Минздравсоцразвития РФ.
Похожие статьи
- Легочная гипертензия: актуальные вопросы диагностики и лечения
- Вторичная легочная гипертензия у ребенка с сочетанной кардиореспираторной патологией (клинический случай)
- Принципы рациональной периоперативной фармакотерапии у пациентов с врождеными пороками сердца, осложненными легочной гипертензией
- Риоцигуат – новый препарат для лечения легочной гипертензии
- Лекарственная терапия больных с легочной гипертензией: взгляд в будущее
Безопасна ли эхокардиография сердца?
При проведении этого исследования отсутствует лучевая и другая нагрузка на орган. Поэтому при необходимости его могут назначать даже несколько раз в неделю.
Данное исследование характеризуется отсутствием осложнений и побочных эффектов.
Не вредит ЭхоКГ и во время беременности — ни будущей матери, ни плоду.
Ограничением для проведения процедуры могут выступить воспалительные заболевания кожи груди, деформации грудной клетки и некоторые другие причины.
Как сделать УЗИ сердца в клинике «МедикСити»?
Сделать ЭхоКГ желательно каждому человеку хотя бы раз в жизни. Достаточно невысокая стоимость УЗИ сердца — еще одна причина отдать предпочтение именно этому методу диагностики.
В «МедикСити» вы можете пройти все виды кардиологической диагностики — ЭКГ, ЭхоКГ, велоэргометрию, ХОЛТЕР, СМАД и др.
Просто наберите в поисковике: «УЗИ сердца, метро «Савеловская», метро «Динамо». Или позвоните нам по телефону: +7 (495) 604-12-12.
Врачи нашей многопрофильной клиники сделают все возможное, чтобы унять вашу сердечную боль!