Болезнь Аддисона – что это такое
На фото болезни Аддисона Бирмера обычно изображены худые люди со страдальческим выражением лица. Вид больных напрямую зависит от степени недостаточности гормонов коры надпочечников.
Патология чаще встречается в среднем возрасте (между 20 и 40 годами). Характеризуется прогрессирующим тяжелым течением. В равной степени диагностируется и у мужчин, и у женщин.
Формы болезни Аддисона
По причинному фактору болезнь Аддисона классифицируют на:
- первичную недостаточность (разрушается более чем 95% клеток коркового вещества, вырабатывающего гормоны);
- вторичную и третичную недостаточность (из-за гипофиза/гипоталамуса возникает дефицит гормонов, которые стимулируют функцию надпочечников);
- ятрогенную недостаточность (развивается в результате прекращения приема глюкокортикоидов после продолжительного их использования).
По критерию времени болезнь Аддисона может протекать в двух формах:
- острой (кора надпочечников быстро разрушается из-за кровоизлияния, проведенного хирургического лечения, травмы);
- хронической (итог аутоиммунного поражения, туберкулеза).
Классификация
В зависимости от механизма развития Аддисоновой или по-другому бронзовой болезни выделяют:
- первичную недостаточность коры надпочечников – в основе патологии поражение непосредственно железистых структур;
- вторичную недостаточность – в результате нарушения гипоталомо-гипофизарной системы, которая в норме должна стимулировать кору надпочечников.
Острая недостаточность надпочечниковых желез называется гипоадреналовым или Аддисоновым кризом.
Особенности аддисонического криза
Развивается Аддисонический криз внезапно и может угрожать жизни человека. Низкие концентрации гормонов (кортизола, альдостерона) в кровотоке приводят к потере сознания или психозу, спутанности сознания, делирию, лихорадке, сильной рвоте и диареи, нарушениям минерального и водного баланса, болям в ногах, пояснице, животе, снижению АД и даже вызвать шок.
Болезнь Аддисона – причины
Врачи выделяют следующие причины болезни Аддисона:
- аутоиммунное повреждение надпочечников (организм начинает вырабатывать антитела против собственных тканей);
- врожденные генетические заболевания (например, аутоиммунный полигландулярный синдром первого типа);
- метастазирующие опухоли (рак молочных желез, легких);
- туберкулезное поражение надпочечников (инфекция может быть занесена из костей, легких, почек);
- удаление надпочечников по причине возникновения опухолевых новообразований;
- опухоли гипоталамо-гипофизарной области;
- облучение/удаление гипофиза при раке;
- продолжительный прием глюкокортикостероидов, из-за которого угнетаются функции коры надпочечников;
- некроз надпочечников на последней стадии ВИЧ, при скарлатине, осложненном гриппе;
- неконтролируемый прием цитостатиков, вызывающий токсическое поражение надпочечников.
Анализы и диагностика
Чтобы подтвердить Аддисонову болезнь нужно провести:
- ультразвуковое исследование надпочечников для выявления очагов поражения, например при туберкулезе;
- анализ крови для определения уровня гормонов надпочечников (кортизола), АКТГ, глюкозы, калия, натрия, ренина;
- КТ надпочечников, которое позволяет обнаружить инфаркт надпочечников, уменьшение размеров, опухолевые метастазы, амилоидоз;
- МРТ головного мозга для изучения гипоталамо-гипофизарной области и обнаружения деструктивных, опухолевых или гранулематозных процессов.
Основанием для диагностирования Аддисонического криза является:
- понижение концентрации натрия в кровотоке ниже 130 ммоль/л, выделение с мочой – меньше 10 г в сутки;
- повышение концентрации калия в кровяном русле свыше 5 ммоль/л;
- падение соотношения ионов натрия к калию до 20 единиц (в норме 32);
- низкий уровень глюкозы;
- развитие ацидоза;
- высокие концентрации мочевины, остаточного азота в анализах плазмы крови.
Болезнь Аддисона Бирмера – симптомы
Признаки болезни Аддисона Бирмера могут быть разными.
Кожа и слизистые
Со стороны слизистых оболочек и кожных покровов наблюдаются:
- снижение эластичности;
- истончение кожи;
- бледность;
- появление пигментации сначала на открытых участках, позже на складках кожи (наибольшее потемнение диагностируется на губах, в области промежности, возле сосков).
Изменение цвета кожи при болезни Аддисона объясняется выделением большого количества адренокортикотропного гормона, который в норме стимулирует работу надпочечников. Так как данный гормон по строению схож с меланостимулирующим (усиливает пигментацию в меланоцитах), то его избыток приводит к тому, что кожные покровы становятся коричневыми или темно-бурыми. Пятна необычного цвета нередко образуются и на деснах, внутренней поверхности щек.
Половая система и сексуальное влечение
Со стороны половой системы болезнь Аддисона проявляется следующими признаками:
- Прекращение ежемесячных менструальных выделений у женщин, сухость кожи, снижение ее эластичности. Выпадение волос в области лобковой кости и подмышечных впадин.
- Импотенция и снижение либидо у мужчин.
Объясняются эти симптомы тем, что в коре надпочечников синтезируются половые гормоны, влияющие на развитие и работу половых органов и отвечающие за половую функцию у представителей обоих полов.
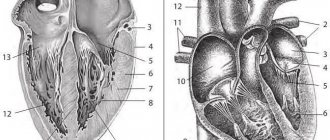
Сердечно-сосудистая система
Со стороны сердечно-сосудистой системы при болезни Аддисона Бирмера выявляются:
- Нарушение ритма сердечных сокращений, сбой передачи нервных импульсов, способствующих сокращению сердечной мышцы. Эти признаки связаны с тем, что в клетках миокарда и крови накапливаются ионы калия. Ионы натрия, напротив, усиленно выводятся с мочой. Из-за дисбаланса названных элементов нарушается и сердечный ритм, и нервная передача в других органах.
- Снижение частоты и силы сердечных сокращений. Если болезнь Аддисона диагностирована у детей, то рассчитывать на то, что сердце будет нормально развиваться, бессмысленно. В будущем у пациента могут даже проявиться признаки сердечно-сосудистой недостаточности, отек нижних конечностей, бледность и понижение температуры кожи.
- Гипотония. Артериальное давление у больных снижается из-за усиленного выведения ионов натрия с мочой. Данный процесс провоцирует обезвоживание организма. Наряду со слабыми сердечными сокращениями, тонус кровеносных сосудов существенно снижается. Развивается артериальная гипотония.
Желудочно-кишечный тракт
При болезни Аддисона Бирмера снижается скорость метаболизма. Как следствие, возникает недостаточность функции секреторных желез кишечника и желудка. Со временем ворсинки слизистых ЖКТ начинают отмирать, нормальное всасывание питательных веществ становится невозможным. Это чревато:
- рвотой, тошнотой, диареей (признаки недостаточности гормонов коры надпочечников);
- язвой желудка и двенадцатиперстной кишки;
- гипоацидным гастритом (слизистая оболочка желудка воспаляется, снижается выработка пепсина и соляной кислоты, нужных для качественного переваривания пищи).
Другие органы и системы
Заболевание Аддисона связано с обезвоживание. Дело в том, что регуляция водно-солевого обмена невозможна без альдостерона. Если возникает его нехватка, ионы хлора и натрия быстро выводятся из организма вместе с жидкостью. Артериальное давление падает, кожа становится очень сухой, щеки и область вокруг глаз впадают. Живот втягивается. Но больше всего обезвоживание влияет на центральную нервную систему и головной мозг:
- Возникают тяжелые неврологические нарушения. Больной становится очень вялым и пассивным. Он плохо реагирует на внешние раздражители. Несвоевременно начатое лечение может стать причиной коматозного состояния, судорог и смерти. Не исключены и психические расстройства при болезни Аддисона.
- Нарушается передача нервных импульсов. Чувствительность расстраивается, возникает онемение конечностей, выраженная мышечная слабость.
Из-за нехватки жидкости кровь становится густой, нарушается кровообращение. Ухудшается снабжение кровью периферических органов. Могут формироваться тромбы. Количество отделяемой мочи также уменьшается.
Страдает при болезни Аддисона и иммунитет. Пациент легко заражается инфекционными заболеваниями, часто болеет пневмонией, бронхитом.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Анемия – клинико-гематологический синдром, характеризующийся снижением концентрации гемоглобина в единице объема крови. Анемией страдает население как слаборазвитых, так и экономически развитых стран. Она развивается у людей любого возра-ста, но значительно чаще ею страдают дети и беременные женщины [1, 2]. У детей уровень гемоглобина необходимо оценивать в зависимости от возраста. Анемия диагностируется при снижении гемоглобина ниже 110 г/л у детей в возрасте до 5 лет, ниже 115 г/л – в возрасте от 5 до 12 лет, ниже 120 г/л – старше 12 лет [2, 3] (табл. 1).
На основании анализа эритроцитарных индексов все анемии разделяются на микроцитарные (гипохромные), нормоцитарные (нормохромные) и макроцитарные (гиперхромные) (табл. 2) [4].
Анемия является неспецифическим симптомом, она может быть проявлением многих патологических состояний, как связанных с первичным поражением системы кроветворения, так и не зависящих от нее.
Несмотря на разнообразие вариантов анемии, существует всего лишь три механизма ее развития:
- Нарушение эритропоэза (выработка эритроцитов красным костным мозгом).
- Укорочение жизни эритроцитов или их гемолиз (разрушение).
- Острое или хроническое кровотечение.
При некоторых видах анемии возможно сочетание этих механизмов. Анемии у детей с хронической патологией желудочно-кишечного тракта (ЖКТ) встречаются часто, иногда являются единственным первым признаком хронического заболевания. Частота анемии при патологии ЖКТ, по разным данным, составляет от 6 до 74 % [5] (табл. 3).
У детей с хронической патологией ЖКТ чаще всего наблюдаются анемии вследствие дефицита железа, витаминов (В12, фолиевой кислоты), постгеморрагические анемии (острые и хронические), анемии хронических заболеваний. Данные состояния могут быть спровоцированы как кровопотерей (чаще хронической на фоне эрозивно-язвенных процессов ЖКТ, полипоза, микродиапедезных кровотечений), так и недостатком поступления и всасывания микроэлементов и витаминов.
По данным ВОЗ, железодефицитная анемия (ЖДА) занимает первое место среди всех анемий. Она характеризуется нарушением эритропоэза из-за дефицита железа вследствие несоответствия между поступлением и расходом железа, снижением наполнения гемоглобина железом [4, 6].
Основные причины развития железодефицитных состояний:
- нарушения питания (нарушение поступления железа с продуктами питания);
- глистные инвазии (повышенный расход железа, микрокровопотери);
- патология ЖКТ (ограничение поступления железа с пищей на фоне диеты, хронические кровопотери – эрозии, язвы, микродиапедезные кровотечения; нарушение всасывания железа за счет атрофических изменений слизистой ЖКТ).
Наиболее частой причиной развития ЖДА у детей с хронической патологией служат кровопотери, которые могут возникать из верхних и нижних отделов ЖКТ. Причиной кровопотерь в 85 % случаев является патология верхних отделов ЖКТ (пищевод, желудок, 12-перстная кишка), в 14 % – толстая кишка и только в 1 % случаев – тонкая кишка. Патология со стороны верхних отделов ЖКТ (эрозивно-язвенные поражения, варикозно-расширенные вены пищевода) чаще приводит к развитию массивной острой кровопотери, что проявляется острой постгеморрагической анемией [7–9]. При острой постгеморрагической анемии одномоментно теряется большой объем (более 10 %) крови. Это ургентное состояние, требующее немедленного устранения источника кровотечения. Под хронической постгеморрагической анемией подразумевают длительно сохраняющуюся потерю небольших объемов крови, превышающую способность организма восстанавливать утраченную кровопотерю [10, 11]. Развитие хронической постгеморрагической и ЖДА при патологии верхних отделов ЖКТ встречается значительно реже, чем при хронической патологии тонкой и толстой кишки [11]. В 35–90 % случаев кровотечения из толстой кишки останавливаются самостоятельно, но часто вновь возобновляются, приводя к развитию стойкой анемии смешанного генеза (постгеморрагической и железодефицитной) [12]. Хронические ВЗК нередко протекают под маской функциональных нарушений кишечника, а анемию у этих детей рассматривают как отдельное заболевание.
Клинический пример 1. Мальчик 1 года 10 месяцев обратился к гастроэнтерологу в связи дефицитом массы, жалобами на стул со склонностью к запорам и избирательный аппетит. Беременность и роды протекали нормально. Грудное вскармливание до настоящего времени. Мама употребляла в пищу большое количество молочных продуктов. У ребенка с 2-месячного возраста отмечено снижение уровня гемоглобина до 105 г/л, цветового показателя – до 0,8. С 5-месячного возраста у ребенка появились высыпания на коже в виде проявлений атопического дерматита, в кале периодически выявлялись примесь крови в виде точек и темных прожилок. Мама отменила в своем питании все продукты на основе коровьего молока и говяжье мясо, но ввела в свой рацион питания до 1 литра цельного козьего молока. Через 2 недели у ребенка отмечено нарастание беспокойства, срыгиваний (сразу после еды и «отсроченных»), появление рвоты до 5 раз в сутки.
С того момента отмечено отставание в прибавке массы, постоянная примесь крови и слизи в кале в большем количестве. К году в анализе крови гемоглобин – 77 г/л, цветовой показатель – 0,7. Врач порекомендовал прием препарата железа. Через 10 дней терапии железом мама самостоятельно отменила лечение в связи с тем, что стул стал темным. В возрасте 1 года 10 месяцев у ребенка дефицит массы 23 %, уровень гемоглобина – 103 г/л, цветовой показатель – 0,79, уровень сывороточного железа снижен – 6,8 мкмоль/л (норма – 6,9–29), ферритин низкий – 7 нг/мл (норма – 30–130). На основании результатов проведенного обследования диагностирована ЖДА, которая стала следствием микродиапедезных кровотечений за счет гастроинтестинальной формы пищевой аллергии, что в дальнейшем привело к нарушению питания, избирательности аппетита (мальчик отказался от мяса), развитию функциональных запоров.
На фоне соблюдения диетических рекомендаций (полная элиминация молочных продуктов, назначение аминокислотной смеси Неокейт адванс) явления атопического дерматита купировались, самочувствие ребенка улучшилось, за месяц прибавка в массе составила 500 граммов, аппетит повысился, стул самостоятельный 1 раз в сутки. После проведения курса терапии препаратом железа на основе гидроксид-полимальтозного комплекса Мальтофером внутрь из расчета 5 мг на кг массы в сутки через 3 месяца полная нормализация гемоглобина, содержания сывороточного железа и ферритина крови.
Воспалительные заболевания кишечника часто сопровождаются развитием анемии. Анемия при ВЗК выявляется в 35–50 % случаев, несколько чаще развивается при язвенном колите (ЯК), чем при болезни Крона (БК) [11–13]. По нашим данным, у 37,6 % детей с хроническим колитом выявлена ЖДА, однако латентный дефицит железа – у 97 % [14, 15]. Механизм развития анемии при ВЗК связан не только с кровопотерей, нарушением поступления железа в организм (на фоне жесткой диеты, воспаления слизистой кишечника), но и вследствие длительного повышения уровня провоспалительных цитокинов (ФНО-α, интерлейкинов-1, -6, -10, γ-интерферона), что приводит к нарушению метаболизма железа и угнетению костномозгового кроветворения, т.е. к развитию анемии хронических заболеваний (АХЗ) [13].
В настоящее время исследуется роль гепсидина как недостающего связующего звена в сложном механизме эритропоэза. Гепсидин – это 20–22- или 25-аминокислотный мелкий пептид, синтезируемый в печени и определяемый в сыворотке крови и моче. Он обладает противомикробным действием, его уровень повышается при любых воспалительных заболеваниях. Гепсидин является прямым медиатором в патогенезе АХЗ, непосредственно снижая абсорбцию железа в тонкой кишке и блокируя выход его из макрофагов [16, 17]. Анемия хронических заболеваний встречается при хронических воспалительных процессах различных органов (легких, почек, печени, ЖКТ), в т.ч. вызванных инфекционными агентами, при системных заболеваниях соединительной ткани, эндокринной патологии и при новообразованиях различной локализации, аллергических и аутоиммунных заболеваниях ЖКТ. Чаще встречаются нормохромные анемии или умеренно гипохромные [18]. По распространенности АХЗ у пациентов с хронической патологией ЖКТ занимают второе место после ЖДА [19]. Анемия хронических заболеваний характеризуется снижением уровня сывороточного железа, ОЖСС, трансферрина и повышением содержания сывороточного ферритина. Ферритин относится к острофазным белкам воспаления, поэтому повышенный уровень сывороточного ферритина при АХЗ служит проявлением воспаления, что не позволяет его использовать в качестве показателя запасов железа [20].
Ошибочная диагностика ЖДА при АХЗ может повлечь назначение препаратов железа (парентерально) с последующим развитием вторичного гемосидероза. В настоящее время для дифференциальной диагностики ЖДА и АХЗ используется новый лабораторный параметр – растворимый рецептор трансферрина (sTfR) [21]. Результаты исследований свидетельствуют о высокой диагностической ценности данного теста [22].
Не все гипохромные анемии железодефицитные. Наличие гипохромной анемии не исключает гипохромную анемию другого происхождения. Необходимо проведение дифференциальной диагностики между ЖДА и сидероахрестическими анемиями, при которых содержание железа в организме находится в пределах нормы или даже имеется его избыток [3]. В силу различных причин железо не используется для построения гема в молекуле гемоглобина, что приводит к образованию гипохромных эритроцитов с низким содержанием гемоглобина. Неиспользованное железо запасается организмом, откладывается в органах и тканях, приводя к развитию гемосидероза. Дифференциальный диагноз гипохромных анемий нужно проводить между ЖДА, АХЗ, талассемией, анемией на фоне хронической интоксикации лекарственными препаратами или солями тяжелых металлов. В практике педиатра наиболее часто встречаются ЖДА и АХЗ, дифференциальный диагноз между ними приведен в табл. 4 [23].
Заболевания тонкой кишки, сопровождающиеся развитием синдрома мальабсорбции, приводят к дефициту белка, микроэлементов и витаминов, регулирующих эритропоэз (железа, меди, цианкобаламина, фолиевой кислоты и др.), вследствие чего дефицитная анемия – закономерный процесс при целиакии, экссудативной энтеропатии. При патологии стенки тонкой кишки (экссудативная энтеропатия) анемия носит железодефицитный характер за счет хронической потери с лимфой сывороточного железа и трансферрина через эктазированные лимфатические сосуды кишечника. Анемия при целиакии выявляется у 40–67 % детей [24, 25]. Вследствие атрофии тонкой кишки отмечается значительное нарушение всасывания железа, фолиевой кислоты, витамина В12, аминокислот и других нутриентов, необходимых для полноценного эритропоэза. Однако и сама анемия сопровождается развитием энтеропатии в виде дегенеративно-дистрофических процессов в пищеварительном канале, приводящих к ахлоргидрии, снижению активности пепсина, амилазы, трипсина, нарушению процессов пищеварения и абсорбции, создавая порочный круг для больных целиакией. Доказано, что в наибольшей степени страдает всасывание железа, что определяет преимущественно железодефицитный характер анемии при целиакии [26]. При латентнотекущей целиакии ЖДА выявляется у 2,8 % больных как первый признак заболевания [27].
Клинический пример 2. Девочка 4,8 года наблюдается в КДПО ТДГБ Москвы (главный врач – профессор И.М. Османов). Ребенок от физиологической беременности и родов, родилась с нормальными массо-ростовыми показателями. На грудном вскармливании до трех месяцев жизни, затем ребенок получал адаптированные молочные смеси и с 5–6 месяцев введены в питание глютенсодержащие каши. До 3,5 лет развитие ребенка соответствовало возрасту. В 3,5 года выявлен сахарный диабет 1 типа, ребенок наблюдался в эндокринологическом центре, инсулинотерапия подобрана со стабильной компенсацией по гликемии. Однако через 4 месяца от начала заболевания у ребенка выявляются увеличение в объеме живота, учащенный разжиженный стул, далее отставание в массе и росте (см. рисунок). Вес – 14,7 кг (10,8 perc, -1,24 SD), рост – 95 см (0,4 perc, -2,66 SD). Ультразвуковое исследование органов брюшной полости выявило диффузные изменения поджелудочной железы, расцененные педиатром как панкреатит, в связи с чем ребенку были назначены ферментные препараты на основе панкреатина, прием которых не привел к ожидаемому эффекту. В анализе крови через 7 месяцев обнаружена анемия гипохромная, микроцитарная средней степени (Hb 80 г/л), отмечен кариес временных зубов. К 4,5 годам стало отмечаться извращение вкуса.
С учетом нарастания клиники мальабсорбции, задержки физического развития, развития стойкой анемии проведено исследование крови для исключения целиакии. Выявлены антитела к тканевой трансглутаминазе IgA > 500 (при норме 0–10 ЕД/мл), антитела к эндомизию Ig G > 1 : 5, что послужило показанием к проведению эндоскопического обследования с биопсией из двенадцатиперстной кишки. По данным морфологического исследования была выявлена атрофическая энтропатия Marsh 3B–3C, что стало подтверждением диагноза целиакии у данного ребенка. Кроме того, нами проведено генотипирование по HLA-системе, обнаружен генотип DQ2о. В связи с подтвержденной целиакией и наличием ЖДА средней степени тяжести назначен Мальтофер внутримышечно.
Мегалобластные анемии встречаются при патологии ЖКТ и представляют собой группы заболеваний, характеризующихся нарушением синтеза ДНК, в результате чего нарушается деление всех быстропролиферирующих клеток (гемопоэтических, клеток кожи, ЖКТ, слизистых оболочек). Кроветворные клетки относятся к наиболее быстро размножающимся элементам, поэтому анемия, а также нередко нейтропения и тромбоцитопения выходят в клинике на первый план [10]. Основной причиной мегалобластной анемии служит дефицит цианкобаламина или фолиевой кислоты.
Пернициозная анемия (от лат. perniciosus – гибельный, опасный), или В12-дефицитная анемия, или мегалобластная анемия, или болезнь Аддисона–Бирмера, или (устаревшее название) «злокачественное малокровие» – заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина В12. Особенно чувствительны к дефициту этого витамина костный мозг и ткани нервной системы. Заболевание чаще встречается среди людей пожилого возраста с атрофическим гастритом в связи с недостаточным поступлением в организм витамина В12. Запасы витамина В12 составляют от 2000 до 5000 мкг, более половины из них хранятся в печени. Запасы печени прогрессивно увеличиваются с возрастом, но ежедневно через желчевыводящие пути теряется от 1 до 4 мкг витамина В12.
В соответствии с Международной статистической классификацией болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра [28] выделяют следующие формы анемий, связанных с дефицитом витамина В12:
- D 51.0. Витамин-В12-дефицитная анемия вследствие дефицита внутреннего фактора;
- D 51.1. Витамин-В12-дефицитная анемия вследствие избирательного нарушения всасывания витамина В12 с протеинурией;
- D 51.2. Дефицит транскобаламина II;
- D 51.3. Другие витамин-В12-дефицитные анемии, связанные с питанием;
- D 51.8. Другие витамин-В12-дефицитные анемии;
- D 51.9. Витамин-В12-дефицитная анемия неуточненная.
Основные причины развития В12 дефицитной анемии представлены в табл. 5.
Клинический пример 3. Девочка 15 лет обратилась к врачу с жалобами на привкус металла во рту, ощущение волоса на языке. Отмечает общую слабость, онемение кончиков пальцев, головокружения и при физической нагрузке онемение стоп. Девочка соблюдает вегетарианскую диету в течение последних 6 месяцев, в течение последнего месяца беспокоят запоры, чередующиеся с поносами. Из анамнеза известно, что в 12-летнем возрасте ребенок перенес травму живота, была проведена резекция части подвздошной кишки (15 см) и аппендэктомия. Через 3 года в анализе крови выявлено снижение гемоглобина до 72 г/л, снижение эритроцитов до 2,5 × 1012, цветовой показатель, норма – 0,86. В биохимическом анализе крови отмечено повышение общего билирубина до 48 мкмоль/л (норма – до 21), снижение уровня общего белка до 6,0 г/дл (норма – 6,6–9,0 г/дл), уровни ферритина и сывороточного железа в пределах нормы. При проведении эзофагогастродуоденоскопии выявлен поверхностный дуоденит. При УЗИ органов брюшной полости обнаружены признаки гипомоторной дисфункции желчного пузыря.
В копрограмме обнаружена слизь в большом количестве, немного непереваренной растительной клетчатки и мыл. В анализе крови выявлены антитела к аскаридам в диагностически значимом титре. Состояние расценено как течение нормохромной анемии средней степени тяжести, аскаридоз.
Девочка получила противоглистную терапию Немазолом 400 мг однократно. Педиатром назначен препарат железа Актиферрин в возрастной дозировке перорально на 2 месяца, лечение продолжалось в течение двух месяцев без эффекта. С учетом отсутствия эффекта от проводимой терапии проведено определение уровня витамина В12 в крови, что подтвердило наличие у ребенка В12-дефицитной анемии (резекция – 15 см подвздошной кишки в раннем детстве). Уровень В12 оказался сниженным в 1,5 раза от нормы. На фоне внутримышечного введения витамина В12 через 2 недели отмечено значительное улучшение состояния ребенка. Девочка стала более активной, снизилась утомляемость, купировались боли в животе. Через 4 недели от начала терапии парестезии сохранялись только при физических нагрузках, уровень гемоглобина поднялся до 114 г/л, цветовой показатель равен 1,0.
Данное клиническое наблюдение показывает ошибки ведения данного ребенка, поскольку не была учтена возможность В12-дефицитной анемии. При нормальных цифрах цветового показателя, уровня ферритина и сывороточного железа был поставлен диагноз ЖДА и начато лечение препаратами железа, которое оказалось неэффективным.
Фолиеводефицитная анемия – заболевание, характеризующееся мегалобластным типом кроветворения в результате нарушения синтеза ДНК (табл. 6). Чаще развивается у лиц молодого возраста, детей, у беременных женщин [30]. Фолаты всасываются в двенадцатиперстной кишке и верхнем отделе тощей кишки. В эпителиальных клетках полиглутаматы восстанавливаются до дигидро- и тетрагидрофолатов, которые связываются с белками и транспортируются в форме метилтетрагидрофолата, где с цианкобаламином участвуют в биосинтезе пуриновых и пиримидиновых нуклеотидов, в превращениях аминокислот (гистидина в глутаминовую кислоту), необходимых для образования ДНК. Общее количество фолиевой кислоты в организме человека – около 70 мг, третья часть представлена печеночными запасами. В условиях дефицита фолиевой кислоты нарушается процесс эритропоэза и развивается мегалобластный тип кроветворения [31].
В соответствии с Международной статистической классификацией болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра [28] выделяют следующие формы анемий, связанных с дефицитом фолиевой кислоты:
- Фолиеводефицитная анемия (D 52).
- D 52.0. Фолиеводефицитная анемия, связанная с питанием.
- Мегалобластная алиментарная анемия.
- D 52.1. Фолиеводефицитная анемия медикаментозная (при необходимости идентифицировать лекарственное средство используют дополнительный код внешних причин [класс XX]).
- D 52.8. Другие фолиеводефицитные анемии.
- D 52.9. Фолиеводефицитная анемия неуточненная.
Клинический пример 4. Мальчик 10 месяцев поступил в гастроэнтерологическое отделение ТДГБ (зав. отд. – Л.А. Катаева) в связи с задержкой моторного развития. Отмечены вялость, отказ от еды, периоды беспокойства. Ребенок от физиологически протекавшей беременности родился массой 3100 граммов ростом 50 см, до трех месяцев находился на грудном вскармливании. Летом мама с ребенком уехала в деревню к родственникам, где в связи с гипогалактией вскармливала малыша цельным козьим молоком. Прикормы не вводились. В возрасте 10 месяцев впервые обратились в поликлинику. Вес ребенка составил 7100 граммов (недостаток массы – 26,7 %), отмечена выраженная бледность кожных покровов, язык малинового цвета без наложений. Резко снижен тургор кожи, живот увеличен в объеме. В анализе крови гемоглобин – 78 г/л, эритроциты – 2,05 × 1012, цветовой показатель – 1,14. В биохимическом анализе отмечено снижение уровня белка до 6,0 г/дл (норма – 6,4–8,4 г/дл). Сывороточное железо в норме. С учетом неправильного вскармливания ребенка, данных анамнеза, свидетельствовавших о вскармливании цельным козьим молоком, что может приводить к развитию фолиеводефицитной анемии Якш–Гайема, ребенку проведено определение содержания витаминов В12 и фолиевой кислоты в крови. Уровень витамина В12 оказался в пределах нормы, содержание фолиевой кислоты в эритроцитах снижено до 58 нг/л (норма – 100–450 нг/л). Таким образом, у ребенка диагностирована фолиеводефицитная анемия, что послужило закономерным следствием вскармливания ребенка цельным козьим молоком в отсутствие введения прикорма. В козьем молоке содержание фолиевой кислоты крайне низкое – 6 нг/г, в коровьем и женском молоке существенно выше – 50 нг/г [33]. Ребенку назначена смесь на основе гидролиза сывороточных белков Нутрилон пепти аллергия, перорально фолиевая кислота в дозе 5 мг 1 раз в день в течение месяца, витамин D3 Аквадетрим. На фоне проведенной терапии через месяц ребенок прибавил в массе 900 граммов, стал активным, самостоятельно ходить без поддержки, уменьшились беспокойство и капризность. В анализе крови гемоглобин 105 г/л, эритроциты – 3 × 1012. В биохимическом анализе крови уровень общего белка поднялся до 6,8 г/дл.
Лечение анемии у детей с патологией ЖКТ невозможно без терапии основного заболевания, вследствие которого она возникла. Тяжесть анемии коррелирует со степенью активности заболевания (особенно это ярко проявляется у больных ВЗК). При этом необходимо учитывать всевозможные механизмы развития анемии: кровопотерю, перераспределение железа, диетические особенности рациона питания, нарушение всасывания микронутриентов в кишечнике. Чаще всего у детей с патологией ЖКТ анемии носят сочетанный характер. Например, у пациентов с ВЗК вначале заболевания анемия может носить нормохромный постгеморрагический характер.
С течением времени возникает дефицит железа, далее развивается АХЗ. У больных болезнью Крона в сочетании с целиакией возможно развитие не только железодефицитных состояний, но и В12-дефицитной анемии, особенно после резекции кишечника [13, 35, 36].
Лечение основного заболевания должно включать устранение (уменьшение) активности воспаления, нормализацию моторики ЖКТ, процессов переваривания и всасывания в просвете кишки. В случаях тяжелых постгеморрагических анемий возможно применение гемотрансфузий. В данном случае в первую очередь необходимо купировать кровотечение и далее проводить коррекцию анемии. В связи со временным эффектом, высоким риском осложнений и возможности перегрузки железом применение их ограничено.
Лечение анемических состояний при заболеваниях ЖКТ должно включать назначение препаратов железа в связи с преимущественным железодефицитным характером анемии (табл. 7). При развитии ЖДА возместить дефицит железа без лекарственных железосодержащих препаратов невозможно [37]. Эффективность лечения препаратами железа зависит от тяжести анемии, выбранного препарата железа и способа его введения. При атрофии тонкой кишки назначение пероральных препаратов железа неэффективно, т.к. из-за нарушения процессов всасывания железо не переносится из просвета кишки в кровь. Максимальная адсорбционная способность кишечника по всасыванию железа в среднем составляет 1–2 мг в сутки, что явно недостаточно для эффективной коррекции анемии [3]. Пероральные препараты могут самостоятельно вызывать или усугублять воспалительные изменения слизистой кишечника, т.к. их избыток в просвете кишки способствует развитию свободно радикальных реакций вплоть до оксидативного стресса. Более чем 20 % больных прекращают прием препаратов железа из-за возникновения осложнений от их приема, не добившись коррекции ЖДА [38]. В наибольшей степени эти осложнения наблюдаются при применении двухвалентных солей железа (сульфат железа и др.). Гидроксид-полимальтозные соединения трехвалентного железа не вызывают подобных осложнений и с точки зрения безопасности могут применяться, однако эффективность их ограничена при воспалении стенки кишки.
Таким образом, часто пациентам с патологией ЖКТ целесообразно применение парентеральных форм железа в остром периоде заболевания, с дальнейшим переходом на пероральные формы. Большим преимуществом обладают внутривенные препараты железа — сахарат железа (Венофер), которые не зависят от всасывания, способны быстро и эффективно восполнять дефицит железа и его запасы (возрастание уровня трансферрина). Энтеральные препараты железа показаны больным гастроэнтерологической патологией для коррекции дефицита железа и лечения легкой и среднетяжелой ЖДА в отсутствие кровотечений в верхних отделах ЖКТ и выраженных нарушений кишечного всасывания [39, 40].
Назначение пероральных препаратов детям с гастроэнтерологической патологией требует соблюдения определенных условий:
- Препараты железа должны быть безопасными, не вызывать токсических и оксидативных реакций, в т.ч. и за счет неконтролируемого всасывания.
- Препараты железа не должны оказывать раздражающего действия на слизистые оболочки ЖКТ.
- Препараты железа должны обладать высокой биодоступностью и хорошо всасываться.
- На данный момент на рынке существует множество препаратов железа, как двухвалентного, так и трехвалентного.
Для применения препаратов железа в педиатрии только несколько соответствует всем предъявляемым требованиям. Оптимально применение гидроксид-полимальтозных соединений трехвалентного железа (Мальтофер), которые имеют разные формы выпуска, что позволяет легко дозировать препарат для детей разного возраста. Однако применение только препаратов железа к детям с хронической патологией ЖКТ будет эффективным лишь при преобладающем железодефицитном характере анемии [41]. В других случаях, особенно при длительном рецидивирующем течении ВЗК и развитием не столько дефицита железа, сколько АХЗ, не приводит к значимой и стойкой коррекции анемии, но и чревато перегрузкой железом с развитием гемосидероза [41].
Пошаговая терапия АХЗ при ВЗК:
Шаг 1. Лечение основного заболевания. Успех терапии будет зависеть от степени компенсации ВЗК [42].
Шаг 2. Лечение препаратами железа парентерально, т.к. в связи с неполным усвоением пероральные формы будут оказывать токсический эффект и усугублять изменения слизистой кишки [36, 43, 44].
Шаг 3. Наиболее эффективным и обоснованным патогенетически для коррекции АХЗ является назначение эритропоэтина, что компенсирует его недостаточную эндогенную продукцию и способствует повышению чувствительности клеток красного костного мозга к эритропоэтину. Однако нужно помнить, что назначение эритропоэтина неизбежно приводит к высокому потреблению железа эритроидными предшественниками и быстрому истощению его запасов в организме [42]. Результатом служит железодефицитный эритропоэз, что возвращает нас к шагу 2. Параллельно с эритропоэтином обязательно назначение внутривенных препаратов железа, которое тем более показано больным со смешанным генезом анемии. Применение эритропоэтина в сочетании с препаратами железа приводит к более быстрому достижению нормальных показателей гемоглобина [18, 36].
Дозировка на курс введения препарата железа рассчитывается по формуле Ganzoni [45, 46, 48]. Дефицит железа (в мг) = масса тела (в кг) × 0,24 × (долженствующий гемоглобин – фактический гемоглобин в г/л) + 500 мг.
Показания к назначению препаратов железа парентерально [48, 49]:
- тяжелое течение анемии;
- высокая активность ВЗК;
- одновременная терапия эритропоэтином;
- непереносимость пероральных форм железа;
- недостаточный эффект от применения пероральных форм железа;
- предпочтения пациента (редко).
В данном случае в первую очередь необходимо купировать кровотечение и далее проводить коррекцию анемии.
Пациентам со смешанным генезом анемии при синдроме мальабсорбции показано применение витамина В12 и фолиевой кислоты [47]. При адекватном лечении уже в течение первых 3 суток наблюдается увеличение числа ретикулоцитов в крови, на 7–10-й день отмечается ретикулоцитарный криз (пик ретикулоцитоза). К 3–4-й неделям лечения имеет место увеличение уровня гемоглобина на 20 г/л. Прием препаратов железа необходимо продолжать еще в течение 3–6 месяцев после нормализации уровня гемоглобина — пока насыщение трансферрина железом не превысит 30 % и концентрация ферритина не достигнет 50 нг/мл (показатель восстановления тканевых запасов железа) [48, 49].
Диагностика болезни Аддисона
Диагностика болезни Аддисона базируется на проведении лабораторных исследований и специальных проб. Инструментальные методы используются, если необходимо определить степень изменения надпочечников при длительном течении патологического процесса.
Лабораторные анализы при болезни Аддисона Бирмера
Пациенту необходимо сдать:
- общий анализ крови (обычно повышен гематокрит);
- биохимию крови (концентрация натрия снижена, калия – повышена);
- общий анализ мочи (концентрация продуктов обмена тестостерона (17 кетостероиды) и глюкокортикоидов (17 оксикетостероиды) снижена).
Также лабораторные анализы показывают снижение уровня тестостерона, альдостерона, кортизола.
Диагностические пробы при заболевании Аддисона
Диагностические пробы при болезни Аддисона нацелены на выяснение того, какой эндокринный орган поражен первично. Если патология касается только надпочечников и не затрагивает гипофиз и гипоталамус, диагностируется снижение уровня гормонов коры надпочечников на фоне повышения концентрации гормонально активных веществ, вырабатываемых гипофизом и гипоталамусом.
Больному могут быть назначены пробы:
- С использованием адренокортикотропного гормона (АКТГ). АКТГ – это гормон гипофиза, отвечающий за выработку гормонов корой надпочечников. У здоровых людей концентрация альдостерона и кортизола увеличивается в два раза через полчаса после его введения. Если имеется болезнь Аддисона, цифры не изменяются.
- Проба с синактеном-депо. Синактен является синтетическим аналогом адренокортикотропного гормона. В норме он способствует усилению секреции кортизола, но у больных этого не происходит, поскольку пораженные надпочечники не способны реагировать на стимулирующее воздействие. Соответственно, гормоны кортизола и альдостерона остаются на одном уровне.
Инструментальная диагностика при болезни Аддисона Бирмера
Методы инструментальной диагностики при заболевании Аддисона включают:
- Компьютерную томографию, магнитно-резонансную томографию. Если проблема вызвана туберкулезом, обнаруживаются увеличенные в размерах надпочечники. При этом отчетливо видны отложения солей кальция в пораженных зонах. Если заболевание обусловлено аутоиммунными процессами, на снимках видны уменьшенные в размерах надпочечники.
- Электрокардиограмму (выявляются изменения в работе сердца из-за нарушений электролитного и водно-солевого обмена).
- Рентген костей черепа. Обследование проводится, если диагностированы нарушения в гипоталамусе или гипофизе. Рентген-лучи направляют непосредственно на область турецкого седла (там находится гипофиз). Если там имеется кровоизлияние или опухоль, на снимках отчетливо видные затемнения или просветления пораженных участков.
Учитывая клиническую картину заболевания, результаты проведенных лабораторных и инструментальных обследований, врач может поставить точный диагноз и подтвердить либо опровергнуть наличие у пациента болезни Аддисона Бирмера.
Дифференциальный диагноз
Чаще всего болезнь Аддисона дифференцируют (различают) со следующими заболеваниями:
- вторичной надпочечниковой недостаточностью, вызванной снижением выработки гипофизом адренокортикотропного гормона;
- врожденной гиперплазией надпочечников (группа наследственных патологий, возникающих из-за нарушения биосинтеза кортизола);
- адренолейкодистрофией (наследственное дегенеративное заболевание ЦНС, которое передается по X-сцепленному рецессивному типу и ассоциируется с надпочечниковой недостаточностью);
- аутоиммунным полиэндокринным синдромом 2 типа (синдром Шмидта, редкое аутоиммунное заболевание, при котором происходит резкое снижение функции нескольких эндокринных органов: надпочечников, щитовидной железы, паращитовидных желез, гонад, поджелудочной железы);
- аутоиммунным полиэндокринным синдромом 1 типа (редкий генетический синдром APECED, который характеризуется поражениями кожи и слизистых оболочек грибами рода Candida, снижением функции паращитовидных желез и аутоиммунной недостаточностью функции надпочечников).
Лечение болезни Аддисона
Так как минералокортикоиды (альдостерон), глюкокортикоиды (кортизол) и другие важные гормоны в организме человека вырабатываются только в надпочечниках, терапия направлена в основном на подбор эффективных заместительных препаратов, минералокортикоидов и глюкокортикоидов синтетического происхождения.
Наиболее часто при лечении болезни Аддисона Бирмера используется «Кортизон». Доза препарата подбирается в индивидуальном порядке. При этом учитывают следующие факторы:
- Прием важно начинать с минимальных доз и постепенно увеличивать количество, пока состояние систем и органов не нормализуется.
- Количество синтетического гормона должно быть равно физиологическому уровню гормонов, который способен вырабатывать здоровый организм.
- «Кортизон» рекомендуется принимать в убывающем порядке. Наибольшая доза – утром, средняя – днем, наименьшая – вечером. Объясняется это тем, что в утренние часы кора надпочечников наиболее активна, после она постепенно падает и ближе к ночи становится минимальной.
- При кризах болезни Аддисона гормон вводят внутримышечно или внутривенно. Если пациент пребывает в состоянии стресса, сильного эмоционального потрясения, вводимую дозу можно увеличить.
Устранение симптомов болезни Аддисона
- С целью нормализации нарушенного электролитного баланса и восполнения объема потерянной жидкости внутривенно вводится физиологический раствор хлорида натрия.
- Если уровень глюкозы понижен, осуществляется внутривенное введение пятипроцентного раствора глюкозы.
Также во время лечения патологии врач должен контролировать массу тела пациента, следить за его артериальным давлением, периодически назначать анализ мочи на концентрацию 17-КС и 17-ОКС.
В ситуации, когда болезнь Аддисона спровоцирована туберкулезом, рекомендован прием противотуберкулезных лекарственных препаратов, например, «Стрептомицина» или «Изониазида».
Аддисоновский кризис
Если болезнь Аддисона не лечить, уровень кортизола и альдостерона в организме будет постепенно снижаться. Это приведет к прогрессирующему ухудшению симптомов и в конечном итоге приведет к ситуации, известной как аддисонический криз.
Аддисоновский криз — это то, когда симптомы болезни Аддисона проявляются очень быстро и очень сильно. Состояние может развиться, когда вышеупомянутые симптомы станут хуже.
Аддисоновский криз является неотложной медицинской ситуацией. Если не лечить, она может быть смертельной. Если вы или кто-то из знакомых заболел болезнью Аддисона и возникли какие-либо из перечисленных ниже симптомов, вызовите скорую помощь (номера: 103, 112).
Симптомы аддисоновского криза:
- сильное обезвоживание;
- тяжелая гипотония;
- шок (когда органы и ткани не получают достаточно крови);
- сильная рвота и диарея;
- крайняя мышечная слабость;
- головная боль;
- крайняя сонливость или кома;
- смерть.
Диета при болезни Аддисона Бирмера
В комплексном лечении болезни Аддисона используется диета, богатая питательными веществами. Важно, чтобы ежедневный рацион пациента содержал повышенное количество белков, жиров и углеводов. Также необходимы витамин С (капуста, лук, яблоки), витамины группы В (яичный желток, фасоль, морковь, печень) и другие. При их нехватке у больных нарушается обмен веществ.
Так как недостаток альдостерона приводит к накоплению в организме ионов калия, врачи советуют ограничить пациентам продукты, в которых содержится много данного микроэлемента (картофель, горох, бананы, орехи).
Распространенность
Первичная надпочечниковая недостаточность встречается редко: по данным отечественных авторов, у 1 на 4000-6000 госпитализированных больных. Американские эндокринологи приводят данные о 39-60 случаев надпочечниковой недостаточности на 1 миллион населения. Хроническая надпочечниковая недостаточность (ХНН) чаще встречается у мужчин; соотношение мужчин и женщин, страдающих этим заболеванием, — 2:1. По данным немецких врачей — Oelkers и его коллег — средний возраст, в котором диагностируется заболевание, — 40 лет (от 17 до 72).
B12 анемия: лечение
Тактика лечения В12-дефицитной анемии разрабатывается специалистами ЦЭЛТ согласно результатам диагностики и индивидуальным показаниям пациента. Если диагноз подтвердился, лечение будет проводиться пожизненно, а каждые пять лет потребуется эндоскопическое исследование слизистой желудка, исключающее риск развития его злокачественных новообразований.
Для того чтобы восполнить недостаток витамина, пациенту назначают его внутримышечное введение. Проводится лечение заболеваний и нарушений, которые инициировали развитие анемии:
- устранение гельминтов;
- приём пищеварительных ферментов;
- операции при дивертикулах и злокачественных опухолях;
- питание с повышенным содержанием животного белка;
- приём глюкокортикоидов при нарушениях производства внутреннего фактора.
Если начать лечение анемии своевременно, показатели крови придут в норму через полтора-два месяца. До полугода сохраняется неврологическая симптоматика, если лечение было начато на запущенной стадии, она необратима и вылечить её уже не удастся.
В отделении гематологии ЦЭЛТ ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Записаться к ним на приём можно онлайн или обратившись к нашим операторам. Не менее опытные и квалифицированные специалисты проводят септопластику в отделении отоларингологии.
В ЦЭЛТ вы можете получить консультацию гематолога.
- Первичная консультация — 3 500
- Повторная консультация — 2 300
Записаться на прием
Записавшись на прием гематолога, вы сможете получить всестороннюю консультацию. В компетенции врача находится лечение различных заболеваний крови, большинство из которых можно выявить на ранних стадиях и назначить своевременное лечение, позволяющее справиться с болезнью быстро и легко.
Лабораторные находки
Наиболее частые нарушения в анализе крови — повышение уровня калия (выше 5 ммоль/л) и креатинина при снижении уровня натрия (до 110 ммоль/л) и хлора (ниже 98,4 ммоль/л). Содержание кальция в сыворотке изредка повышено. Гиперкальциемия в таких случаях сочетается с гиперкальциурией, жаждой, полиурией и гипостенурией. У больных может также развиваться нормоцитарная нормохромная анемия, в мазках периферической крови отмечают эозинофилию и относительный лимфоцитоз. Часто фиксируют незначительное повышение содержания ТТГ (как правило, < 15 мкЕд/мл). Остается неясным, обусловлено ли это повышение ТТГ сопутствующим аутоиммунным заболеванием щитовидной железы, отсутствием подавления ТТГ эндогенными стероидами или развитием эутиреоидного патологического синдрома.
Наблюдаются нарушения функции почек: снижается скорость клубочковой фильтрации и почечного кровотока.
Метаболические нарушения и расстройство электролитного обмена приводят к изменению ЭКГ. Обычно обнаруживается увеличенный и заостренный зубец Т, который в отдельных отведениях может даже превосходить по высоте комплекс QRS. Возможно замедление предсердно-желудочковой или внутрижелудочковой проводимости.
Диагноз основывается не только на данных клинической картины и лабораторного исследования, но и на прямом подтверждении снижения функциональной активности надпочечников. Если уровень кортикостероидов в крови, взятой в 8-10 ч утра, меньше 170 нмоль/л (6 мкг/100 мл), то диагноз недостаточности надпочечников не вызывает сомнения. Наличие или отсутствие пигментации указывает на первичный или вторичный характер заболевания. При первичной ХНН уровень АКТГ обычно повышен, а при вторичной — снижен. Также для уточнения диагноза проводится ряд фармакодинамических проб — фиксируются колебания кортизола при введении АКТГ или инсулина. Проба с инсулином позволяет дифференцировать туберкулезное поражение коры надпочечников от деструкции ее аутоиммунным процессом. Туберкулезное поражение сопровождается деструкцией мозгового слоя (в котором синтезируются катехоламины), тогда как при поражении аутоиммунным процессом изменения происходят только в кортикальном слое надпочечника. Поэтому, определяя в период проведения инсулинового теста наряду с глюкокортикоидами содержание адреналина в сыворотке крови, можно установить причину, вызвавшую хроническую недостаточность надпочечников.
Для диагностики гипоальдостеронизма определяют концентрацию альдостерона в плазме крови или его экскрецию с мочой. И здесь предпочтение следует отдавать фармакодинамическим тестам. Специфическим стимулятором секреции альдостерона является ангиотензин. Если концентрация альдостерона в конце инфузии ангиотензина не повышается, это указывает на гипоальдостеронизм.
Режим
Аддисонов синдром не позволяет больным заниматься тяжелым физическим трудом. Любое стрессовое состояние (инфекция, физическое или умственное перенапряжение и др.) требует увеличения приема глюкокортикоидов. Принцип диспансерного наблюдения в отношении этих больных должен соблюдаться неукоснительно. Все пациенты с синдромом Аддисона снабжаются специальной памяткой, в которой указан рациональный график приема кортикостероидов и оптимальные для данного больного разовая и суточная дозы различных кортикостероидных препаратов. На случай ургентной ситуации должны быть наготове глюкокортикоиды для парентерального введения. Также должна быть подготовлена предупреждающая информация для медиков на случай, если больной не сможет самостоятельно изложить сведения о своей болезни. Пациенты должны знать, что им необходимо немедленно обратиться к врачу при появлении слабости, недомогания, повышении температуры, болях в животе, диарее и других признаках ухудшения состояния. Запрещаются употребление алкоголя, прием барбитуровых снотворных, а также использование щелочных минеральных вод для запивания таблеток, содержащих кортикостероиды.
1. Балаболкин М. И. Эндокринология, 1998 2. МакДермотт М. Секреты эндокринологии, 2001 3. Wolfgang Oelkers M. Adrenal issuficiency. The New England Journal of Medicine, Vol. 335, № 16, p. 1206-1212 https://www.temple.edu/imreports/Reading/Endo%20%20-Adrenal%20insuff.pdf 4. May M., Vaughn E., Carey R. Adrenocortical insufficiency — clinical aspects. In: Adrenal disorders, 1989, p. 171-189 5. Oelkers W., Diederich S., Bähr V. Recent advances in diagnosis and therapy of Addison’s disease. Journal of Endocrinology Vol. 1. 1994, p. 69-80
B12 анемия: причины
Ежедневная потребность человеческого организма в витамине В12 составляет от одного до пяти микрограммов. Она удовлетворяется за счёт его потребления с пищей: после попадания в желудок витамин отделяется от белка под воздействием ферментов. Для того, чтобы организм полноценно его усвоил, должен произойти процесс соединения с гликопротеином и другими факторами. Всасывание витамина в кровь происходит в нижней части подвздошной кишки, откуда он и поступает к тканям. Факторы, способные инициировать развитие анемии делят на две группы:
- Алиментарные – несбалансированное питание, не способное обеспечить поступление требуемого количества В12 в организм. Нередко такое случается, если пациент практикует голодание, вегетарианство или диеты, сводящие к минимуму или исключающие потребление животного белка;
- Эндогенные – сбои в процессе усвоения витамина из-за дефицита белка, связывающего витамин и переводящий его в усвояемую форму. Подобное явление может быть инициировано: врождённым отсутствием внутреннего фактора Касла;
- воспалительными процессами слизистой желудка в хронической форме;
- состоянием после проведения операции по иссечению желудка;
- состоянием после частичного удаления подвздошной или 12-типерстной кишки;
- воспалением тонкого кишечника (энтерит), поджелудочной железы (панкреатит);
- глютеновой энтеропатией;
- гранулёматозным воспалением отделов пищеварительного тракта (заболевание Крона);
- выпячиваниями кишечной стенки – (дивертикулами);
- новообразованиями тощей кишки злокачественной природы;
- глистными инвазиями, вызываемые разными видами гельминтов.
Причины могут крыться в физической и психической зависимости от приёма алкоголя, в применении «Колхицина», «Неомицина», а также ряда пероральных контрацептивов.