- д.м.н., проф. Л.М. ВАСИЛЕЦ,
- д.м.н., проф. А.В. ТУЕВ,
- к.м.н. А.Ю. ВЫШЕНСКАЯ,
- к.м.н. Н.С. КАРПУНИНА,
- О.Н. САРАПУЛОВА,
- В.В. ВУСТИНА,
- К.В. ТРЕНОГИНА,
- А.А. КРИВАЯ
Синдром преждевременного возбуждения, или преэкзитации, желудочков (ПЭЖ) встречается в разных возрастных группах населения, от новорожденных до лиц пожилого возраста, в том числе в 0,04 — 0,31% случаев у детей и в 0,15% — у взрослых. Преэкзитацию, или предвозбуждение, определяют как возбуждение большей или меньшей части миокарда желудочка импульсом, проведенным из предсердий по дополнительным проводящим путям (ДПП) раньше, чем при проведении импульса к желудочкам через атриовентрикулярный узел и систему Гиса—Пуркинье. Наиболее частыми вариантами синдрома предвозбуждения желудочков являются синдром Вольфа—Паркинсона—Уайта и синдром укороченного интервала P—Q(R), известный также как синдром Клерка—Леви—Кристеско. Принято различать два понятия: феномен и синдром ПЭЖ. По предложению рабочей группы экспертов ВОЗ (1980), при наличии электрокардиографических признаков предвозбуждения по пучку Кента используют термин «феномен Вольфа—Паркинсона—Уайта», а в случае присоединения пароксизмальных тахиари. В последние 20 лет удалось выявить существенные взаимосвязи между вегетативной нервной системой (ВНС) и смертностью от сердечно-сосудистых причин, включая внезапную сердечную смерть. Важную роль в формировании аритмий при синдроме ПЭЖ играет нарушение вегетативного статуса, так как в случае наличия дополнительных путей проведения вегетативный дисбаланс может влиять на проводимость по нормальным и аномальным путям проведения. Доказано, что сдвиг вегетативного тонуса в сторону преобладания симпатического влияния может быть провоцирующим фактором нарушений ритма сердца. Т. Honda и соавт. пришли к выводу, что повышенная симпатическая активность у больных с синдромом ПЭЖ способствует развитию фибрилляции предсердий (ФП). Имеется много клинических и экспериментальных подтверждений того, что автономная (вегетативная) нервная система играет важную роль в генезе и поддержании злокачественных аритмий. Доступным и информативным методом оценки вегетативного статуса пациентов в клинике является анализ вариабельности ритма сердца (ВРС). Наличие вегетативных нарушений при патологии сердца служит патогенетической основой для использования в комплексной терапии препаратов, сочетающих анксиолитические, противотревожные свойства и нормализующих вегетативный дисбаланс. В настоящее время с этой целью широко применяется дневной анксиолитик-адаптоген адаптол («Олайнфарм», Латвия), который обладает выраженными анксиолитическими, вегетостабилизирующими, стресспротективными и антиоксидантными свойствами, а также высокой безопасностью (являясь производным бициклических биомочевин, адаптол близок к естественным метаболитам пуринового обмена). Важное преимущество адаптола заключается в отсутствии «поведенческой токсичности», т.е. сонливости в дневные часы, миорелаксации, нарушений внимания и координации движений, а также в отсутствии зависимости и ограничения физической и психической активности. Положительные эффекты препарата выявлены у больных нейроциркуляторной дистонией, гипертонической болезнью, у больных ИБС с постинфарктным кардиосклерозом, при кардиалгиях неорганической природы. Влияние препарата на вегетативный дисбаланс при нарушениях ритма сердца практически не изучено.
Цель настоящей работы — изучить ВРС и аритмогенную готовность миокарда у больных с синдромом и феноменом предвозбуждения желудочков и оценить влияние адаптола в комплексной антиаритмической терапии.
Архів
Скорочений виклад
L Eckardt, G Breithardt, P Kirchhof Heart 2006;92:704–711.
Діагностика тахікардій з широкими комплексами (ТШК), тобто тривалістю комплексу QRS більше 120 мс, залишається непростою проблемою, незважаючи на численні визнані критерії диференціації шлуночкових і суправентрикулярних тахікардій (СВТ) з аберацією провідності. Правильне встановлення діагнозу важливе як для надання невідкладної допомоги, так і для тривалого ведення хворих із ТШК.
Мета цього огляду — обговорити основні причини, а також клінічні та електрофізіологічні критерії ТШК (табл. 1) у пацієнтів без структурного захворювання серця.
Таблиця 1. Причини ТШК у пацієнтів без структурного захворювання серця
| Суправентрикулярна | Шлуночкова | |
| Мономорфна | • Блокада ніжки пучка Гіса (рис. 1, 2): а) функціональна (правої — частіше, ніж лівої); б) фонова в) частотно-залежна • Антидромна (з ретроградним проведенням через атріовентрикулярний вузол) (рис. 3, 4) • Неспецифічне порушення провідності: а) антиаритмічні препарати І або ІІІ класу; б) електролітні порушення | • Блокада лівої ніжки пучка Гіса (БЛНПГ), відхилення електричної осі серця вниз (рис. 7): ідіопатична правошлуночкова тахікардія • Блокада правої ніжки пучка Гіса (БПНПГ), відхилення електричної осі серця вверх (рис. 8): ідіопатична лівошлуночкова тахікардія • ШТ, медіатором якої є кардіостимулятор |
| Поліморфна | • Фібриляція передсердь з преекзитацією (рис. 3) | • Пірует-тахікардія (синдром подовженого інтервалу QT) (рис. 9) • Синдром Бругада • Катехоламінергічна поліморфна ШТ (рис. 10) • Синдром укороченого інтервалу QT |
Примітка. Усіх хворих з ТШК потрібно лікувати так, як при ШТ, якщо не доведено наявність іншого виду тахікардії.
До основних категорій ТШК зараховують шлуночкову тахікардію (ШТ), СВТ з порушеннями внутрішньошлуночкової провідності, а також ритми при кардіостимуляції шлуночків. Відсутність фонового структурного захворювання серця не дозволяє виключити наявність ШТ і не обов’язково свідчить про доброякісний прогноз захворювання. Утім, якщо у пацієнта виникали подібні епізоди протягом попередніх років, СВТ є більш імовірною, ніж ШТ. Припинення тахікардії з допомогою проби Вальсальви або ін’єкції аденозину також дозволяє припустити її суправентрикулярне походження, хоча деякі види ШТ також можуть бути припинені з допомогою вагусних проб (наприклад, фасцикулярна ШТ).
Походження ТШК у пацієнта, який перебуває у стані свідомості і гемодинамічно стабільний, не обов’язково є суправентрикулярним. Клінічні прояви залежать від гемодинамічних наслідків тахікардії. Вони залежать від частоти серцевих скорочень (ЧСС), ступеня вираженості дисфункції міокарда, обставин та ступеня раптовості початку, а також вегетативних розладів. Фізикальне дослідження в пацієнта з ТШК може вказувати на гемодинамічні порушення (гіпотензія, серцева недостатність або кардіогенний шок). При збереженні рівнів серцевого викиду і артеріального тиску і/або короткочасній тахікардії аритмія може проявлятися серцебиттям, задишкою або лише відчуттям дискомфорту.
СУПРАВЕНТРИКУЛЯРНІ ТАХІКАРДІЇ З ШИРОКИМИ КОМПЛЕКСАМИ QRS
Порушення внутрішньошлуночкової провідності може бути наслідком змін ЧСС, а також пошкоджень провідної системи серця. У пацієнтів з фоновою (наявною під час нормального вихідного ритму) блокадою ніжки пучка Гіса (БНПГ) будь-яка СВТ може призвести до тахікардії з широкими комплексами QRS. Водночас частотно-залежна і/або “функціональна” (наявна лише під час тахікардії) БНПГ також може призвести до ТШК. Функціональна аберація є наслідком раптового зменшення тривалості серцевого циклу, коли частини системи Гіса-Пуркіньє частково або повністю втрачають збудливість. Функціональна БПНПГ виникає частіше, ніж функціональна БЛНПГ, через більш тривалу рефрактерність останньої. Інколи дискретні коливання тривалості серцевого циклу зумовлюють перехід від тахікардії з широкими комплексами до тахікардії з вузькими комплексами QRS, що полегшує встановлення діагнозу (рис. 1). Раптові коливання тривалості циклу тахікардії “короткий-довгий” подовжують рефрактерність системи Гіса-Пуркіньє, “довгий-короткий” — вкорочують її рефрактерність. Функціональна БНПГ може зберігатись протягом кількох послідовних імпульсів, оскільки заблокована антероградно ніжка пучка Гіса може активуватись транссептально через її протилежний компонент (“феномен взаємозв’язку”). Оскільки тривалість рефрактерного періоду залежить від тривалості попереднього серцевого циклу (чим триваліший попередній цикл, тим коротший рефрактерний період), раптові коливання тривалості серцевого циклу (“довгий-короткий” або “короткий-довгий”) збільшують імовірність появи функціональної БНПГ — наприклад, при фібриляції передсердь (ФП) (феномен Ашмана) (рис. 2).
Рисунок 1.
Епізод тахікардії з широкими комплексами QRS з конфігурацією БПНПГ, яка спонтанно переходить у тахікардію з вузькими комплексами QRS при незначному збільшенні тривалості циклу тахікардії. Ретроградні зубці Р спостерігаються після комплексу QRS (псевдо-r’ у відведенні V1 і псевдо-s у відведеннях II, III і aVF (*), що дозволяє думати про типову АВ вузлову реципрокну тахікардію.
Рисунок 2(А).
Фібриляція передсердь із шлуночковою аберацією внаслідок феномену Ашмана і, можливо, прихованого транссептального проведення імпульсів. Після тривалої паузи (*) рефрактерний період лівої ніжки пучка Гіса подовжений, що зумовлює появу 10 комплексів типу RS з морфологією типу БЛНПГ. Збереженню аберації, імовірно, сприяє приховане транссептальне проведення імпульсів (феномен взаємозв’язку) з правої до лівої ніжки, з блокадою антероградного проведення послідовних імпульсів у лівій ніжці. (B) Суцільна лінія відображає пучок Гіса; переривчаста (крапки) — ліву (праву) ніжку. Суцільні горизонтальні смуги відображають рефрактерний період.
На тахікардії при синдромі Вольфа-Паркінсона-Уайта припадає менша частина ТШК. При цих тахікардіях активація шлуночків відбувається переважно або винятково через додатковий шлях. Зміни характеру передчасного збудження (рис. 3) разом із змінами тривалості серцевого циклу зумовлені проведенням ФП через додатковий шлях. Натомість мономорфна картина преекзитації майже завжди спричинена реципрокною (рі-ентрі) тахікардією (за винятком передсердної тахікардії або тріпотіння передсердь із проведенням через додатковий шлях). За наявності ФП надто частий ритм шлуночків, спричинений атріовентрикулярним (АВ) проведенням через додатковий шлях (рис. 3), може призвести до фібриляції шлуночків і раптової серцевої смерті. Якщо при реципрокній тахікардії імпульс проходить антероградно через додатковий шлях, тахікардію називають антидромною. Ретроградним компонентом кільця рі-ентрі звичайно є АВ вузол, інколи — інший додатковий шлях. Загалом антидромну АВ реципрокну тахікардію спостерігають рідше, ніж ортодромну тахікардію. Оскільки додатковий шлях з’єднує міокард передсердя і шлуночка на рівні АВ сполучення, ЕКГ при СВТ із преекзитацією інколи неможливо відрізнити від ШТ, яка походить з основи шлуночків.
Рисунок 3.
Антидромна тахікардія (A) через лівобічний додатковий шлях у пацієнта із синдромом Вольфа-Паркінсона-Уайта. (B) Фібриляція передсердь із швидким проведенням через додатковий шлях у того ж пацієнта (найкоротший інтервал RR 200 мс).
При ТШК з морфологією БЛНПГ і відхиленням електричної осі серця вліво і вверх (рис. 4) потрібно завжди розглядати можливість атріофасцикулярного додаткового шляху (Махайма). У пацієнтів із цими шляхами можуть з’являтися епізоди тахікардії з преекзитацією, тоді як під час синусового ритму ознак передчасного збудження шлуночків немає. При цьому майже ніколи не виникають тахікардії з вузькими комплексами QRS, оскільки імпульс через додатковий шлях не проводиться ретроградно. Типова морфологія QRS під час тахікардії характеризується маленьким, коротким початковим зубцем R, з подальшим різким зниженням у відведенні V1.
Рисунок 4.
ЕКГ у 12 відведеннях під час антидромної АВ реципрокної тахікардії з залученням правого атріофасцикулярного додаткового тракту (Махайма) для антероградного проведення імпульсів. Ці шляхи в типових випадках розміщені вздовж ендокардіальної поверхні вільної стінки ПШ із дистальним входженням в апікальну ділянку правої ніжки пучка Гіса. Диференціальна діагностика здійснюється з ритмом кардіостимулятора, оскільки більшість електродів кардіостимуляторів розміщують у ділянці верхівки ПШ.
Інші механізми аберації проведення у шлуночках — пригнічення скоротливості міокарда внаслідок ефектів препаратів або електролітного дисбалансу, наприклад, гіперкаліємії. Крім того, високі дози блокаторів натрієвих каналів (антиаритмічних препаратів класів ІА і ІС) можуть викликати неспецифічне збільшення тривалості комплексу QRS. Інколи препарати класу ІС провокують ТШК через сповільнення частоти збудження передсердь, що дозволяє реалізуватись проведенню 1 : 1 (рис. 5). Повідомляли також про випадки індукування стійкої мономорфної ШТ під час фізичного навантаження на фоні застосування антиаритмічних засобів у молодих здорових осіб без структурного захворювання серця.
Рисунок 5.
Приклад ТШК на фоні введення антиаритмічного засобу класу IC флекаїніду в пацієнта з тріпотінням передсердь. Флекаїнід викликає цю тахікардію через сповільнення ритму тріпотіння передсердь з появою АВ проведення 1 : 1.
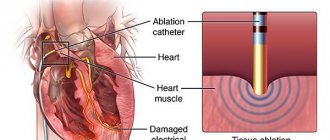
Залежно від ситуації ведення пацієнтів із СВТ з широкими комплексами може бути різним: при нечастих і нестійких епізодах — без терапії, в інших — медикаментозна терапія або радіочастотна катетерна абляція. Впровадження катетерних методів лікування драматично змінило підходи до ведення пацієнтів з СВТ. Діючий підхід полягає в тому, що у всіх пацієнтів, які вимагають тривалого лікування, слід оцінювати можливість радіочастотної катетерної абляції. Тривалу фармакотерапію (за умови, що немає преекзитації — засоби з метою блокади АВ сполучення) обирають у тих пацієнтів, які відмовляються від катетерної абляції, коли вона неефективна або пов’язана з високим ризиком ускладнень, таких як незворотна АВ блокада.
ЕЛЕКТРОКАРДІОГРАФІЧНІ КРИТЕРІЇ ДИФЕРЕНЦІАЛЬНОЇ ДІАГНОСТИКИ СВТ І ШТ
Загалом, якщо конфігурація комплексу QRS під час ТШК не нагадує аберації внутрішньошлуночкової провідності, найбільш імовірною є ШТ (рис. 6). Якщо наявний будь-який сумнів щодо походження ТШК, пацієнта слід лікувати так, як при ШТ. Відсутність комплексу типу RS у будь-якому прекордіальному відведенні або наявність інтервалу від початку зубця R до найнижчої точки зубця S більше 100 мс свідчать про високу ймовірність ШТ. Крім того, пропонують такі ЕКГ критерії диференціальної діагностики між ШТ і СВТ з аберацією:
- Тривалість комплексу QRS. ШТ є найбільш імовірною, якщо тривалість QRS у комплексі типу БПНПГ більше 140 мс, а при морфології БЛНПГ — більше 160 мс.
- Вісь комплексу QRS. Фронтальна вісь у межах від –90° до ±180° не може бути наявною при будь-якому виді БНПГ і тому дозволяє думати про ШТ. Отже, переважно негативні комплекси QRS у відведеннях I, II і III є корисним критерієм щодо виявлення ШТ.
- Конкордантні негативні комплекси ЕКГ у грудних відведеннях. Якщо у всіх грудних відведеннях комплекси QRS переважно негативні, імовірним діагнозом є ШТ. Якщо у всіх грудних відведеннях комплекси QRS позитивні, потрібно проводити диференціальну діагностику між антидромною тахікардією з залученням лівобічного додаткового шляху і ШТ.
- Морфологія QRS у відведеннях V1 і V6. При конфігурації QRS типу БПНПГ монофазний зубець R, широкий (> 30 мс) R, або qR у відведенні V1 свідчать про високу ймовірність ШТ. Монофазний R, або S амплітудою більшою, ніж R у відведенні V6, також дозволяють припускати ШТ. При QRS типу БЛНПГ широкий зубець R (звичайно тривалістю більше 30 мс) і/або повільне зниження до найнижчої точки S у відведенні V1 і Q у відведенні V6 свідчать на користь ШТ.
АТРІОВЕНТРИКУЛЯРНА ДИСОЦІАЦІЯ
Це один з найкорисніших критеріїв диференціальної діагностики ШТ і СВТ. Вона спостерігається у 20–50% випадків ШТ і майже ніколи — при СВТ. Для АВ дисоціації характерними є змінний пульсовий тиск, нерегулярні хвилі А на яремних венах і змінний за звучністю перший тон серця. Інколи для виявлення АВ дисоціації необхідними є тривалі записи ЕКГ у 12 відведеннях і ретельний аналіз ЕКГ. Крім того, приблизно 30% випадків ШТ поєднуються з ретроградним проведенням 1 : 1. При АВ дисоціації можна спостерігати зливні скорочення, які є наслідком одночасного проведення збудження від передсердь до шлуночків.
Реєстрація 12-канальної ЕКГ під час ШТ допомагає приблизно визначити розміщення її джерела. Морфологія ШТ за типом БЛНПГ у відведенні V1 характерна для походження тахікардії з правого шлуночка (ПШ) або міжшлуночкової перегородки. Спрямованість електричної осі серця вгору вказує на тахікардію із задньої стінки, тоді як спрямованість униз — з передньої (верхньої) стінки серця. Домінування зубців R у відведеннях V2–V4 свідчить про те, що джерело тахікардії розміщене поблизу основи шлуночків. При ідіопатичній тахікардії з вихідного тракту ПШ тривалість комплексу QRS під час ШТ звичайно >140 мс, якщо вона походить з вільної стінки вихідного тракту ПШ, і <140 мс, якщо аритмія походить з боку перегородки вихідного тракту ПШ. Перехідна зона зубця R при тахікардії з вихідного тракту ПШ звичайно спостерігається у відведеннях від V2 до V4, тим раніше, чим більше джерело тахікардії зміщено вверх уздовж перегородки. Перехідна зона зубця R у відведенні V2 дозволяє припускати розміщення її джерела безпосередньо під клапаном легеневої артерії або у вихідному тракті лівого шлуночка.
ШЛУНОЧКОВА ТАХІКАРДІЯ У ПАЦІЄНТІВ БЕЗ СТРУКТУРНОГО ЗАХВОРЮВАННЯ СЕРЦЯ: „ІДІОПАТИЧНА” ШТ
„Ідіопатична” ШТ — неспецифічний термін, яким позначають гетерогенну групу аритмій. Пацієнти можуть бути повністю безсимптомними або відчувати транзиторні симптоми, такі як серцебиття, запаморочення або передсинкопе; утім, ці аритмії, за винятком швидкої поліморфної ШТ, яка виникає при набутих аритмічних синдромах, рідко є життєво небезпечними. Механізми формування аритмій — рі-ентрі, тригерна активність, а також катехоламінергічний автоматизм. „Ідіопатичну” ШТ поділяють залежно від клінічних проявів (нестійка чи стійка), сприяючих факторів (наприклад, навантаження), місця походження (лівий чи правий шлуночок), відповіді на антиаритмічні препарати (наприклад, аденозин чи верапаміл) або за первинними електричними розладами.
ШТ У ПАЦІЄНТІВ БЕЗ СТРУКТУРНОГО ЗАХВОРЮВАННЯ СЕРЦЯ, ЯКА ПІДДАЄТЬСЯ РАДИКАЛЬНОМУ ЛІКУВАННЮ
Ідіопатична тахікардія з вихідного тракту правого шлуночка
Аритмія, джерело якої міститься у вихідному тракті ПШ, маніфестується як ШТ з комплексами QRS типу БЛНПГ і відхиленням осі серця вниз (рис. 7). Її частіше спостерігають у молодих пацієнтів (у жінок частіше, ніж у чоловіків) без структурного захворювання серця; на цю тахікардію припадає до 70% всіх випадків ідіопатичних ШТ. Хоча переважно ця тахікардія виникає спорадично, тобто без успадкування в сім’ї, стан розглядають як „первинне електричне захворювання”. Цей вид тахікардії може мати значення при диференціальній діагностиці м’яких або субклінічних форм аритмогенної кардіоміопатії ПШ. Дані більшості досліджень дозволяють думати, що основним механізмом є тригерна активність, викликана пізніми післядеполяризаціями, медіатором яких є аденілциклаза. Ідіопатичні тахікардії з вихідного тракту звичайно пов’язані з виснаженням або стресом. Вони можуть також проявлятися як зворотні екстрасистоли, або нестійкі аритмії з тенденцією до виникнення у спокої, або провокуватися лише при навантаженні (тахікардії Галавардена). Водночас ці форми тахікардій можуть лише бути проявом різного спектра подібних аритмій. Ідіопатичні тахікардії з вихідного тракту звичайно добре переносяться, імовірно, через збережену функцію шлуночків. З огляду на це вказана форма ШТ характеризується сприятливим довготривалим прогнозом порівняно з ШТ при структурному захворюванні серця. Цей вид аритмії може добре піддаватись лікуванню бета-блокаторами, соталолом або блокаторами кальцієвих каналів, а також катетерній абляції.
Рисунок 7.
Повторні епізоди ідіопатичної правошлуночкової тахікардії з комплексом QRS типу БЛНПГ і зміщенням осі серця вниз.
Iдіопатична лівошлуночкова тахікардія (фасцикулярна ШТ)
Iдіопатична лівошлуночкова тахікардія частіше виникає у молодих пацієнтів, переважно чоловіків, без структурного захворювання серця. Аритмія характеризується відносно вузькими (0,10–0,14 с) комплексами QRS з морфологією типу БПНПГ із швидким зниженням зубців S у грудних відведеннях і відхиленням осі серця вліво і вверх (рис. 8). Вважають, що вказана тахікардія виникає за механізмом рі-ентрі або внаслідок тригерної активності на фоні пізніх післядеполяризацій. Вона з’являється в ділянці перегородки або поряд з нею, біля задньої гілки лівої ніжки пучка Гіса. Рідко ШТ може виникати з передньої гілки лівої ніжки пучка Гіса і характеризуватися типом БПНПГ з відхиленням осі серця вправо. Ці ШТ часто не відповідають на лікування бета-блокаторами, але часто чутливі до верапамілу. Прогноз звичайно добрий, але в цих пацієнтів нерідко дуже виражені клінічні симптоми. При веденні симптомних пацієнтів у ранні терміни слід розглядати можливість виконання катетерної абляції (рис. 8).
Рисунок 8.
Неконтактне картування ідіопатичної лівошлуночкової тахікардії з конфігурацією БПНПГ, зміщення електричної осі серця вліво.
А — Множинний електрод у лівому шлуночку. Використано систему, яка забезпечує можливість картування окремого шлуночкового комплексу. Вираховуються електрограми одночасно з 3000 точок в ендокарді. Недеполяризований міокард показаний рожевим кольором на тривимірній карті ізопотенціалів.
В — Білим колом показане місце найбільш ранньої деполяризації. Проведення радіочастотної абляції в дистальній частині задньої гілки лівої ніжки пучка Гіса майже негайно припинило ШТ.
С — Тахікардія більше не індукується.
РЕЦИПРОКНА ТАХІКАРДІЯ З НІЖКИ ПУЧКА ГІСА
На рі-ентрі в системі Гіса-Пуркіньє припадає значна частка мономорфних ШТ у пацієнтів із серцевою недостатністю, але інколи ці тахікардії виникають у структурно незміненому серці. Хвиля рі-ентрі поширюється через одну ніжку (найчастіше — праву) і повертається через протилежну. З огляду на це формується комплекс QRS, який має конфігурацію БЛНПГ і нормальну або зміщену вліво електричну вісь серця у фронтальній площині. Отже, тахікардія відповідає ЕКГ критеріям СВТ з аберацією, але нерідко — з ознаками АВ дисоціації. Значення цієї тахікардії полягає в тому, що її можна легко усунути методом катетерної абляції правої ніжки пучка Гіса.
ШТ У ПАЦІЄНТІВ БЕЗ СТРУКТУРНОГО ЗАХВОРЮВАННЯ СЕРЦЯ, ЯКА ПОКИ ЩО НЕ ПІДДАЄТЬСЯ РАДИКАЛЬНОМУ ЛІКУВАННЮ
Механізм виникнення цих аритмій — зміни іонних трансмембранних каналів (каналопатії), або протеїнів, які зв’язують калій усередині клітини. Останнім часом виявили значну кількість мутацій.
Синдром подовженого інтервалу QT
Синдром подовженого інтервалу QT характеризується збільшенням тривалості інтервалу QT на поверхневій ЕКГ, зворотними нападами синкопе або виникненням раптової смерті на фоні поліморфної ТШК з характерним чергуванням комплексів RS навколо ізоелектричної лінії (torsade de pointes) (рис. 9). Частота виникнення цього синдрому становить 1 : 7000–1 : 10 000 народжених живих дітей. Описано більше 250 мутацій у семи генах (синдром подовженого інтервалу QT типу 1–7). У 30–40% пацієнтів не виявляють генетичних дефектів, що вказує на гетерогенність генетичних локусів. У частини пацієнтів подовження інтервалу QT зумовлене дією препаратів, які подовжують потенціал дії шлуночків, брадикардією або електролітним дисбалансом. При вродженому синдромі подовженого інтервалу QT профілактично призначають бета-блокатори. Доцільність профілактичної імплантації кардіовертерів-дефібриляторів розглядають у пацієнтів з нападами синкопе, які не припиняються при застосуванні бета-блокаторів, або при наявності в сім’ї випадків раптової смерті.
Рисунок 9.
Епізод пірует-тахікардії в пацієнта із синдромом подовженого інтервалу QT.
Синдром укороченого інтервалу QT
Нещодавно описано новий синдром, асоційований з раптовою серцевою смертю в пацієнтів без структурних змін у міокарді, — синдром укороченого інтервалу QT. Його поширеність невідома. У цих пацієнтів виявляють інтервал QT тривалістю <� 270 мс, випадки раптової смерті у сім’ї, серцебиття, синкопе або раптову зупинку серця внаслідок поліморфної ШТ з високою ЧСС. Сьогодні єдиним засобом терапії є імплантація внутрішнього кардіовертера-дефібрилятора.
Катехоламінергічна поліморфна шлуночкова тахікардія
Катехоламінергічна поліморфна шлуночкова тахікардія — клінічно та генетично гетерогенне захворювання. Воно характеризується епізодами синкопе або раптової смерті у відповідь на фізіологічний або емоційний стрес на фоні структурно незміненого серця. Документованими можуть бути двонаправлена ШТ (рис. 10), поліморфна ШТ, інколи — ідіопатична фібриляція шлуночків. Приблизно у третині випадків наявний сімейний анамнез ювенільної раптової смерті або стрес-індукованого синкопе. Смертність висока і становить 30–50% до досягнення віку 30 років. Приблизно в 40–60% пацієнтів виявляють мутації генів, які кодують зв’язування кальцію. Сучасне лікування включає бета-адреноблокатори, блокатори кальцієвих каналів, антиаритмічні засоби і/або імплантацію внутрішнього кардіовертера-дефібрилятора. Переважно воно є емпіричним і базується на результатах серійного навантажувально-медикаментозного тестування.
Рисунок 10.
Двонаправлена тахікардія після навантаження у пацієнта з катехоламінергічною поліморфною ШТ.
Синдром Бругада
У 1992 році брати Бругада описали новий клінічний синдром, який характеризується поєднанням БПНПГ та елевації сегмента ST у правих грудних відведеннях з високою частотою виникнення раптової серцевої смерті у пацієнтів із структурно не зміненим серцем. Він маніфестується епізодами поліморфної ШТ, синкопе і зупинки серця у дорослому віці (в середньому — у 40 років, але з вираженими коливаннями віку). На цей синдром припадає приблизно 4–12% випадків раптової смерті і 20–40% випадків раптової зупинки кровообігу у пацієнтів без структурного захворювання серця. Переважно синдром Бругада діагностується у чоловіків. Він є найбільш поширеним у країнах Південно-Східної Азії і в Японії, де цей синдром є провідною причиною природної смерті в молодих чоловіків (щорічна частота виникнення випадків смерті 26–38 на 100 000). Діагностичні критерії в основному базуються на електрокардіографічних змінах, за умови виключення структурного захворювання серця. Синдром Бругада розглядається як „каналопатія” і є одним з представників групи „первинних електричних захворювань серця”. У приблизно 20–30% пацієнтів із синдромом Бругада виявляють генетичні мутації натрієвих каналів. Електрокардіографічні прояви синдрому Бругада можуть бути транзиторними або прихованими, але можуть демаскуватись блокаторами натрієвих каналів (такими як аймалін і флекаїнід), ваготонічною стимуляцією або при гарячці. Діагностичне і прогностичне значення випадкового виявлення ЕКГ ознак синдрому Бругада у безсимптомних осіб без особливостей сімейного анамнезу до кінця не з’ясоване. Імплантація кардіовертера-дефібрилятора є основним методом вторинної та первинної профілактики раптової смерті у пацієнтів з високим рівнем ризику.
| Тахікардія з широкими комплексами (ТШК): ключові положення • Якщо комплекси QRS під час ТШК не мають форми аберантних, найбільш імовірною є шлуночкова тахікардія • Приблизно 80% всіх ТШК припадають на шлуночкові тахікардії • У пацієнтів із діагностованим структурним захворюванням серця майже всі ТШК є шлуночковими тахікардіями |
Підготував Олег Жарінов
Причины ишемической болезни. Предупреждаем сердце
Если рассматривать органические поражения сердечно-сосудистой системы, то аритмии чаще всего встречаются при ИБС, миокардитах, кардиомиопатиях, пороках сердца, патологиях крупных сосудов (тромбоэмболиях легочной артерии, аневризмах аорты), при гипертонической болезни, перикардитах и опухолях сердца. Аритмии также могут наблюдаться и при эндокринопатиях (феохромоцитома, тиреотоксикоз), интоксикациях медикаментами (гликозиды, катехоламины), острых инфекционных заболеваниях, анемиях, при нарушении электролитного баланса организма (особенно калиевого, кальциевого и магниевого) и других патологических состояниях.
Иногда нарушения сердечного ритма возникают и под влиянием экзогенных факторов: неумеренного употребления кофе, алкоголя, табака. Некоторые виды аритмий могут развиваться и у здоровых людей в ответ на физическую нагрузку или нервное напряжение.
Об аритмическом варианте ИБС говорят только в тех случаях, когда нарушения ритма сердца являются единственным симптомом этого заболевания. Диагноз ИБС остается предположительным до проведения ЭКГ, холтеровского мониторирования и коронароангиографии, которые и выявляют различные поражения сердца. Однако у большинства больных аритмии сочетаются с другими клиническими формами ИБС. Нарушения ритма – также частый симптом атеросклеротического кардиосклероза, особенно при стенокардии или сердечной недостаточности. Однако, несмотря на множество причин, которые могут вызвать нарушения ритма, все аритмии можно разделить на три основные группы: связанные с нарушением образования импульса, связанные с нарушением проведения импульса и комбинированные аритмии. В таблице 1 представлена классификация аритмий в зависимости от механизма их возникновения.
Таблица 1.
Классификация аритмий в зависимости от механизма возникновения
| Механизм возникновения | Нарушения образования импульса | Нарушения проведения импульса | Комбинированные нарушения |
| Виды нарушений ритма | Синусовые тахи- и брадиаритмии, синдром слабости синусового узла, эктопические ритмы (непароксизмальные тахикардии), экстрасистолии, желудочковые тахикардии, фибрилляция и трепетание предсердий и желудочков | Блокады: синоатриальные, внутрипредсердные, атриовентрикулярные; синдром преждевременного возбуждения желудочков | Атриовентрикулярные диссоциации, эктопические ритмы с блокадой, парасистолии* |
* Встречаются редко
Диагноз «аритмия сердца» всегда основывается на клинико-электрокардиографических данных, а лечение включает терапию основного заболевания и собственно противоаритмические мероприятия.