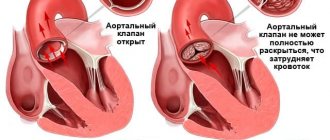
Синдром компрессии чревного ствола (СКЧС) — это редкое заболевание, являющееся одной из причин хронической абдоминальной ишемии [1]. Сдавление чревного ствола срединной дугообразной связкой диафрагмы возникает в процессе онтогенеза. В 1965 г. американский врач J. Dunbar впервые описал данный синдром, который в последующем стал называться его именем [2]. Диагностика и лечение СКЧС являются сложной задачей для хирурга, так как наличие экстравазальной компрессии, выявленной инструментальными методами исследования, зачастую не соответствует клинической картине и жалобам пациента. Причины, по которым у одних пациентов кровообращение в бассейне чревного ствола полностью компенсируется за счет коллатерального кровотока, а у других развивается ишемия, до конца не изучены [3]. Клиническое определение СКЧС можно сформулировать следующим образом: экстравазальная компрессия чревного ствола, подтвержденная инструментальными методами исследования, сопровождающаяся клинической симптоматикой абдоминальной ишемии, которую нельзя связать с каким-либо другим заболеванием. Симптоматика данного заболевания разнообразна: хроническая абдоминальная боль, возникающая или усиливающаяся после приема пищи, может сопровождаться диспептическими явлениями, нейровегетативными расстройствами, депрессивным астено-ипохондрическим синдромом.
Многие годы при СКЧС методом выбора было рассечение срединной дугообразной связки диафрагмы с использованием верхнесрединной лапаротомии или даже торакофренолюмботомии, что сопровождалось тяжелым течением послеоперационного периода с большим числом осложнений, связанных с травматичностью доступа [4]. С началом эры эндоскопической хирургии стали появляться первые сообщения о лапароскопической декомпрессии чревного ствола [5].
Однако с момента внедрения данного метода в хирургическую практику по сей день открытыми остаются вопросы о показаниях и противопоказаниях к данной операции, технике оперативного вмешательства, интраоперационной оценке эффективности декомпрессии, а также оценке результатов лечения в раннем и отдаленном послеоперационных периодах.
Цель нашего исследования — усовершенствование техники операции и оценка значения интраоперационного лапароскопического ультразвукового исследования (УЗИ), а также оценка и поиски путей улучшения ближайших и отдаленных результатов лапароскопической декомпрессии чревного ствола на основании собственного опыта.
Особенности строения
Чревный ствол – главный сосуд (артерия), питающий органы верхнего отдела брюшины. Отходит от аорты в зоне ее диафрагмального отверстия, которое сформировано сухожилиями левой, правой ножки диафрагмы. Их соединяют срединная дугообразная связка диафрагмы (СДСД), тела позвонков. В норме СДСД должна быть над устьем ствола, а если она под устьем, это ведет к стенозу и нарушению кровообращения. Чревный ствол имеет 3 основные ветви:
- Левая желудочная. Располагается в левой кривизне желудка, отдавая ветви к брюшной части пищевода. Кровоснабжает часть желудка и пищевода.
- Общая печеночная артерия. Питает 12-перстную кишку (с помощью ветки к ней), далее направляется к печени (собственная печеночная артерия). В этом органе разделяется на правую и левую. Правая дает ветвь к желчному пузырю.
- Селезеночная. Кровоснабжает селезенку и часть поджелудочной железы за счет мелких ответвлений.
Ствол очень короткий (до 2 см), и широкий (диаметр да 1 см), у некоторых людей его длина может быть даже 10 мм.
Материал и методы
Начиная с 2005 г. в Институте хирургии им. А.В. Вишневского нами выполнено 21 лапароскопическое вмешательство по поводу экстравазальной компрессии чревного ствола. Результаты лечения прослежены в отдаленном периоде. Среди пациентов было 8 женщин и 13 мужчин. Возраст пациентов варьировал от 28 до 72 лет и в среднем составил 44 года. Продолжительность заболевания до момента постановки диагноза и оперативного лечения варьировала от 3 до 20 лет и в среднем составила 6 лет. Результаты оперативного лечения в отдаленном послеоперационном периоде были исследованы у 17 из 21 пациента. Характерная клиническая картина заболевания в виде выраженных абдоминальных болей в эпигастральной области, нейровегетативных расстройств, таких как приступы тахикардии, панические атаки, в той или иной степени отмечалась у всех пациентов. Диспептические явления в виде тошноты, рвоты, метеоризма, потери веса отмечались у 9 пациентов. Астено-ипохондрический синдром присутствовал у 6 пациентов. Следует отметить, что длительное течение любого заболевания, сопровождающегося хроническим болевым синдромом, может приводить к психическим и поведенческим расстройствам. Предшествующая постановке верифицированного диагноза длительная история заболевания сопровождается диагностикой у пациентов синдрома раздраженного кишечника, функциональных абдоминальных болей, рефрактерного гастропареза, аггравации на фоне лекарственной зависимости, соматоформных расстройств вегетативной нервной системы. В основе появления психогенных факторов лежат длительные страдания больного, «беспомощность» врачей и современной «диагностической машины». Результатом этого является отказ больного от еды, дабы исключить развитие вероятных болей в животе, и снижение качества жизни. Таким образом, при решении вопроса о проведении оперативного пособия по декомпрессии чревного ствола необходимо привлекать врача-психиатра как на дооперационном этапе, так и после операции, чтобы исключить вероятность развития ложного рецидива заболевания.
Во всех наблюдениях диагноз был установлен по данным ультразвукового дуплексного сканирования с измерением скорости кровотока при респираторных пробах, а также подтвержден данными КТ-ангиографии (рис. 1, 2,
Рис. 1. Ультразвуковое дуплексное сканирование. Уменьшение пиковой систолической скорости кровотока на вдохе до 150 см/с.
Рис. 2. Ультразвуковое дуплексное сканирование. Увеличение пиковой систолической скорости кровотока до 350 см/с на выдохе. рис. 3, 4).
Рис. 4. Экстравазальная компрессия чревного ствола (КТ-ангиография, 3D-реконструкция).
Рис. 3. КТ-ангиография. Экстравазальная компрессия чревного ствола. а — в сагитальной плоскости; б — в аксиальной плоскости.
Ультразвуковыми критериями экстравазальной компрессии чревного ствола являются: углообразная деформация чревного ствола в краниальном направлении в В-режиме, ускорение пиковой систолической скорости кровотока в чревном стволе в фазе глубокого выдоха более чем на 80% по сравнению с фазой глубокого вдоха, а также снижение пиковой систолической скорости кровотока. Для артериальных стенозов принято считать, что стенозы, редуцирующие просвет сосуда более чем на 50% по диаметру, являются, как правило, гемодинамически значимыми [6]. По мнению некоторых авторов, компрессию чревного ствола можно считать гемодинамически значимой при степени сужения просвета сосуда более 50%, при пиковой систолической скорости кровотока более 2 м/с и градиенте артериального давления в чревном стволе более 15 мм рт.ст. на максимальном вдохе [7].
У всех пациентов, по данным инструментальных методов исследования, показатели кровотока по чревному стволу укладывались в диапазон гемодинамической значимости. По данным дуплексного сканирования, в предоперационном периоде средняя степень сужения чревного ствола составляла 72,5%. Пиковая систолическая скорость кровотока в чревном стволе (Vs) составляла 312 см/с, а ускорение пиковой систолической скорости кровотока в фазе глубокого выдоха по сравнению с фазой глубокого вдоха (Vs выд — Vs вдох) составляло 144,5 см/с. Также перед операцией все пациенты были комплексно обследованы в институте хирургии им. А.В. Вишневского в объеме УЗИ-органов брюшной полости, эзофагогастродуоденоскопии, консультации терапевта и психиатра. Таким образом, связь клинической симптоматики абдоминальной ишемии с другими заболеваниями была исключена.
Всем пациентам выполнена лапароскопическая декомпрессия чревного ствола.
Методика операции
Пациенты располагались на столе с разведенными ногами в положении Фовлера. Устанавливались 5 троакаров (5 и 10 мм): 10 мм (оптический) — на середине расстояния между мечевидным отростком и пупком по срединной линии, 10 мм — в правом и левом подреберьях по среднеключичным линиям для печеночного ретрактора и рабочего инструмента соответственно, 5 мм — под мечевидным отростком по срединной линии и 5 мм — по передней подмышечной линии слева для зажима и рабочего инструмента соответственно.
Первым этапом всем пациентам выполнялась топическая диагностика чревного ствола с использованием лапароскопического УЗИ, с помощью которого также определяли протяженность, степень сужения и деформацию чревного ствола, характерное постстенотическое расширение.
Интраоперационная ультразвуковая навигация позволяет быстрее найти и выделить чревный ствол, что особенно актуально в ситуации анатомической аномалии расположения сосудов целико-мезентериального бассейна, что встречается в 45% случаев, а также в условиях выраженного абдоминального ожирения.
Использовались два типа доступа к срединной дугообразной связке диафрагмы: антеградный или ретроградный, при этом решение о выборе доступа принималось интраоперационно в зависимости от конкретной анатомической ситуации и расположения анатомических структур относительно друг друга. Антеградная диссекция заключалась в рассечении печеночно-желудочной связки в аваскулярной зоне с целью создания доступа к правой ножке диафрагмы, от которой диссекция продолжалась в каудальном направлении. Для идентификации мышечных волокон перекреста ножек диафрагмы проводилась диссекция в ретроэзофагеальном пространстве. Мышечные волокна перекреста диафрагмальных ножек рассекались крючком с использованием монополярной коагуляции для обнажения передней поверхности аорты. Важным моментом при использовании как антеградного, так и ретроградного доступа являлось протяженное рассечение мышечного перекреста диафрагмальных ножек над аортой до 3—4 см с целью профилактики возникновения рестеноза в послеоперационном периоде вследствие рубцевания рассеченных структур.
С целью лучшей визуализации срединной дугообразной связки производилась тракция желудка книзу и влево атравматичным зажимом. Пересечение волокон связки выполнялось крючком с использованием монополярной коагуляции. Оттягивание волокон связки от сосудистой стенки с помощью крючка позволяло избежать электротравмы аорты и чревного ствола. Особое значение уделялось полноценной диссекции и рассечению всех лимфатических и нервных волокон, а также нервных ганглиев, окружающих устье чревного ствола для достижения максимального эффекта от выполненной декомпрессии. Процедура считалась оконченной, когда чревный ствол был освобожден от любых внешних стенозирующих структур вплоть до его устья, что обязательно подтверждалось данными интраоперационного лапароскопического УЗИ.
В большинстве случаев проводилась ретроградная диссекция, которая отличалась от предыдущего доступа тем, что доступ к дугообразной связке осуществлялся с помощью диссекции основных стволов ветвления чревного ствола в ретроградном направлении до устья чревного ствола, при этом чаще всего идентифицировали и выделяли левую желудочную или общую печеночную артерию. Деликатная тракция выделенных стволов с использованием сосудистых держалок позволяла получить адекватную экспозицию устья чревного ствола и последующую декомпрессию.
Причины синдрома компрессии чревного ствола
Главная причина КСЧС – врожденная аномалия, связанная с наличием перемычки из фиброзной ткани. Ее могут сжимать ножки диафрагмы, вследствие чего просвет сосуда уменьшается. Развитие приобретенного стеноза могут спровоцировать:
- заболевания поджелудочной железы, связанные с ее увеличением;
- разрастание нейрофиброзной ткани;
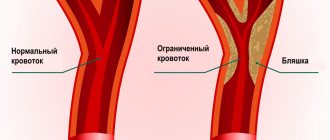
- атеросклеротические бляшки;
- тромбы;
- увеличение объема лимфатических узлов;
- опухоли;
- склеротические изменения в сосудах.
КСЧС может быть связан также со сдавлением ствола, воспаленными органами, находящимися рядом.
Важно! Врожденный КСЧС связан с изменениями в хромосомах или воздействием неблагоприятных факторов во время беременности.
Обсуждение
Несмотря на то что ряд авторов, как отечественных, так и зарубежных, рекомендуют выполнение открытой декомпрессии чревного ствола как «золотого стандарта», тем не менее, как и в других областях хирургии, минимально инвазивные технологии находят все больше сторонников.
Jimenez и соавт. (2012) в своей работе собрал 7 клинических серий из 121 пациента, которым выполнялась лапароскопическая декомпрессия чревного ствола, с клиническим улучшением у 116 пациентов. Лапароскопический доступ оказался предпочтительнее открытого в связи со значительно меньшей частотой послеоперационных осложнений и более быстрым восстановлением. Однако в ходе лапароскопической декомпрессии, как отмечает автор, при наличии серьезных технических сложностей, таких как кровотечение (7,4%) и развитие пневмоторакса (2,5%), высок риск конверсии (9,1%). Этот же автор отмечает, что повторные декомпрессии в лапароскопической группе понадобились в 5,7% случаев, а в открытой группе — в 6,8% [8].
В литературе встречаются малочисленные сообщения о применении эндоваскулярных методов лечения СКЧС — баллонной дилатации и стентирования чревного ствола при экстравазальной компрессии чревного ствола. Зачастую использование методов интервенционной радиологии в качестве монотерапии СКЧС приводит к появлению рестенозов выше места установки стента, а также между стентами в случаях выполнения эндоваскулярного рестентирования. В литературе описаны случаи смещения стентов из области стеноза, а также случаи перелома стента в просвете чревного ствола (рис. 9)
Рис. 9. К.Т. Фрагментированный стент в просвете чревного ствола. [9].
Таким образом, изолированное применение эндоваскулярных методик при синдроме Данбара зарекомендовало себя как неэффективный метод.
На данный момент интерес представляет возможность комплексного подхода к лечению данного заболевания, а именно дополнение при необходимости лапароскопической декомпрессии чревного ствола баллонной дилатацией либо стентированием [10].
Что касается техники операции, то следует помнить, что воспалительно-склеротические изменения паравазальной и периневральной соединительной ткани в области чревного ствола и чревного сплетения могут стать дополнительной причиной сдавления этого сосуда, а развитие ганглионеврита, описанного некоторыми авторами, может обусловить или усугубить абдоминальную боль [4]. В связи с этим следует помнить о необходимости иссечения нервных ганглиев чревного сплетения, которые, по мнению ряда авторов, способны приводить к экстравазальной компрессии чревного ствола. Thoolen и соавт. отмечают, что развитие клинических проявлений, свойственных для СКЧС, связано иногда не только с компрессией чревного ствола, но и с нейрогенным фактором. Авторы обращают внимание на то, что купирование проявлений СКЧС может быть достигнуто не только рассечением срединной дугообразной связки и восстановлением кровотока по чревному стволу, но и рассечением нервных ганглиев чревного ствола [11].
Что касается интраоперационной диагностики, то наиболее доступным на сегодняшний день является использование УЗИ чревного ствола. Впервые интраоперационное УЗИ стали использовать в 1992 г. хирурги Mayo Clinic при открытой декомпрессии чревного ствола. Интраоперационное УЗИ необходимо для определения анатомии сосудов целико-мезентериального бассейна и диагностики аномалии отхождения сосудов чревного ствола в непростой для ориентирования анатомической области в условиях ограниченного пространства, а также для оценки кровотока после декомпрессии [12].
Немаловажным аспектом лечения пациентов с СКЧС является психологическая составляющая.
По данным исследования, в котором проводилась оценка отдаленных результатов реконструкции чревного ствола у 44 пациентов, наилучший эффект был достигнут у пациентов с постпрандиальным характером возникновения боли, в возрасте от 40 до 60 лет и значительной потерей массы тела — более 9 кг. Клинически неблагоприятными прогностическими факторами при оценке отдаленных результатов являлись атипичный характер боли с периодами ремиссии (43%), психические заболевания в анамнезе или злоупотребление алкоголем (40%), возраст старше 60 лет (40%) и потеря массы тела, не превышающая 9 кг (52%). При сравнении групп пациентов с различным развитием коллатерального кровотока наихудшие результаты были получены у группы с хорошим его развитием, что может свидетельствовать об отсутствии только ишемического характера болей в этой группе пациентов.
Таким образом, при решении вопроса о проведении оперативного лечения необходимо привлекать врача-психоневролога как на дооперационном этапе, так и после операции, чтобы исключить вероятность развития «ложного рецидива» заболевания.
Патогенез синдрома Данбара
Механизмы развития связаны с нарушенной гемодинамикой в чревном стволе и его артериях. Они отвечают за кровоснабжение:
- 12-перстной кишки;
- поджелудочной железы;
- печени;
- желудка;
- селезенки;
- желчного пузыря;
- части кишечника.
Артерии имеют густую сеть сосудов и анастомозов, поэтому уменьшение тока крови в одном непарном сосуде приводит к нарушению питания всех органов ЖКТ.
Показания и противопоказания к методу лечения
Показания:
Стеноз чревного ствола более 60% с синдромом хронической абдоминальной ишемии
Стеноз верхней брыжеечной артерии более 60% (симптомы сосудистой недостаточности кишечника не являются обязательным показанием, достаточно факта стеноза)
Этап эндоваскулярного лечения острой мезентериальной непроходимости (мезентериальный тромбоз)
Противопоказания:
- Аллергия на йод
- Аневризма торакоабдоминальной аорты (без операции по поводу аневризмы)
- Стадия некроза кишки при мезентериальном тромбозе
Симптомы стеноза чревного ствола
Признаки – болевой синдром, диспепсические, нейровегетативные расстройства, но главное – боль. Согласно статистике на нее жалуются 98% больных, имеющих КСЧС. В большинстве случаев она ощущается в эпигастральной области, в зоне пупка, подвздошных костей, подреберье, в нижней части живота. Чаще боль постоянная, человек чувствует распирание, тяжесть, в более редких случаях возникает приступ.
Болевой синдром появляется или усиливается через 15 минут после принятия пищи. Интенсивность может зависеть от объема еды. Из-за страха появления боли люди часто перестают есть, теряют в весе. Кроме пищи, боль может спровоцировать физическая нагрузка – быстрый бег, поднятие тяжестей, длительное нахождение в согнутом положении. Также причиной боли могут стать стресс, одежда с тугим поясом.
Диспепсические расстройства – вторая по распространенности жалоба при КСЧС. К ним относят:
- отрыжку;
- горечь во рту;
- тошноту и рвоту;
- изжогу;
- вздутие живота.
Часто появляются симптомы нарушения работы кишечника в виде диареи, запоров. Нейровегетативные патологии сопровождают приступ боли или возникают самостоятельно. Проявляются:
- сердцебиением;
- затрудненным дыханием;
- головными болями;
- одышкой;
- усиленным потоотделением;
- пульсацией в животе;
- слабостью;
- чувствительностью к перепаду температур;
- снижением работоспособности.
Методы терапии
Лечение дефекта аорты осуществляется хирургическим путем. Показаниями к выполнению операции называют наличие у пациента болевого синдрома, потерю веса. Обязательно учитывается присутствие ангиографических признаков патологии. Без операции лечение стеноза чревного ствола, направленное на устранение беспокоящих симптомов, производится при наличии у человека серьезных сопутствующих заболеваний.
Хирургическое вмешательство осуществляется для освобождения чревного ствола от сдавливания. Оно может происходить традиционным открытым способом или при помощи эндоскопических методик. В последнем случае в теле больного делается несколько небольших надрезов, через которые вводятся хирургические инструменты. Ход операции контролируется при помощи видеокамеры. Она находится на эндоскопе, который также вводится в тело человека. Применение малоинвазивных методик позволяет предупредить распространенные осложнения операций – грыжи, спайки, воспалительные процессы.
Если в анамнезе пациента присутствуют сопутствующие патологии (камни в желчном пузыре), при возможности хирург устраняет и их. При выраженном стенозе пациенту производят искусственное расширение аорты с установкой сосудистого протеза.
Реабилитация после операции
После выполнения лапароскопического хирургического вмешательства больной наблюдается в стационаре на протяжении 3 дней, после чего выписывается домой. При проведении полостной операции пациент требует длительной терапии, применения антибиотиков, обезболивающих средств.
На протяжении месяца больному запрещено поднимать тяжести, рекомендуется ограничить физические нагрузки. Пациенту на короткий период могут назначить заместительную ферментную терапию, прием спазмолитических средств. При наличии высокой концентрации холестерина в крови больному рекомендована специальная диета и медикаментозное лечение.
Контроль состояния чревного ствола осуществляется через месяц после операции. При отсутствии отклонений от нормы больному рекомендуется посещать своего врача каждые полгода для мониторинга кровотока в аорте.
Диагностика заболевания
Диагноз КСЧС поставить трудно, поскольку заболевание не имеет специфических признаков, а «маскируется» под другие патологии ЖКТ. Иногда подозревают гастрит, панкреатит, энтероколит, дуоденит или ипохондрит и начинают лечить от них. Положительной динамики не добиваются, симптомы не исчезают. При первичном осмотре врач выявляет боль во время пальпации области живота, а при аускультации фиксирует систолический шум в зоне брюшной аорты. Пациенты с КСЧС, как правило, имеют астеническое телосложение и бледные кожные покровы.
Подготовка к стентированию чревного ствола и брыжеечной артерии
Врач может назначить пациенту комплекс исследований, в том числе:
- общий анализ и биохимические показатели мочи и крови, оценку показателей свертываемости;
- видеогастроскопию;
- рентген легких;
- электрокардиограмму;
- УЗИ сердца;
- УЗИ брюшной полости;
- мультиспиральную КТ аорты.
Непосредственно перед операцией нужно воздержаться от приема пищи (за 8 часов до вмешательства). За два часа до операции нельзя принимать даже жидкость.
Лечение при стенозе чревного ствола брюшной аорты
Основной метод КСЧС – хирурический. При незначительных симптомах, гемодинамических нарушениях допускается наблюдательная тактика. Пациент 2 раза в год должен обследоваться для своевременного выявления прогрессирования заболевания. На этот период назначают консервативное лечение сопутствующих заболеваний, связанных с жалобами.
Показаниями к операции являются: КСЧС, подтвержденный ангиографическими снимками, и наличие клинической симптоматики. Суть вмешательства – удаление связок, нейрофиброзной ткани, ножек диафрагмы, сдавливающих ствол. Операцию в основном выполняют методом лапароскопии. Ее плюсы:
- низкая степень травматичности;
- незначительный болевой синдром в послеоперационном периоде;
- низкий риск развития осложнений (спаечной болезни, грыж);
- отсутствие послеоперационных ран.
Лапароскопический метод имеет и минусы. Хирург ограничен в движении, ему трудно оценить рубцовые изменения в стенках артерий. Зона чревного ствола – опасная и анатомически сложная, в ней находятся крупные артерии и аорта. При случайном повреждении этих сосудов откроется сильное кровотечение, которое при лапароскопии трудно остановить.
Другой тип операции – верхнесрединная лапаротомия (открытый доступ). В ходе ее можно визуально, пальпаторно оценить состояние сосудов и внутренних органов брюшной полости. Минусы: травматичность, длительный послеоперационный период, риск развития послеоперационных грыж, спаечной болезни. Кроме того, операция сопровождается кровопотерей.
Возможные осложнения при лечении
Осложнения самой операции:
- Разрыв суженной артерии с кровотечением — требует экстренной открытой операции или установки специального покрытого стента (стент-графта). К счастью, встречается очень редко.
- Тромбоз реконструированной артерии — редкое осложнение, встречается при повышенной свертываемости крови. Если проводится предоперационная подготовка с использованием антитромбоцитарной подготовки, то риск минимальный. Если тромбоз наблюдается во время вмешательства, то выполняется тромбэктомия или тромболизис (введение препаратов рассасывающих тромб). Если признаки нарушения кишечного кровообращения наблюдаются после операции, то пациент повторно берется в операционную и проводится удаление тромбов с помощью ротарекса или специальных аспирационных катетеров.
Осложнения сосудистого доступа:
- Гематома в области пункции
- Тромбоз артерии в области пункции
- Повреждение нервов в области пункции
Эти осложнения встречаются крайне редко и легко устраняются при своевременном выявлении.
Реабилитация в послеоперационном периоде
После лапароскопии пациентам не требуется длительный восстановительный период. Их выписывают через 3-4 дня домой, на амбулаторное лечение. После полостной операции больные находятся в стационаре до 10 дней. Врачи рекомендуют ограничить физические нагрузки на месяц, придерживаться рекомендованной диеты. Для восстановления работоспособности органов, снятия болевого синдрома назначают ферментные препараты (Мезим форте, Панзинорм) и спазмолитики (Но-шпа). Через 1-2 месяца необходимо повторное исследование кровотока для определения эффективности лечения. В дальнейшем его повторяют раз в полгода.
Программа наблюдения после метода лечения
Наблюдение за результатами ангиопластики и стентирования висцеральных артерий осуществляется с помощью УЗИ контроля через 3 месяца, а затем ежегодно.
Через год после вмешательства желательно выполнить мультиспиральную компьютерную томографию с контрастированием брюшной аорты и ее ветвей.
После лечения пациенту назначаются антитромботические препараты. Чаще всего это аспирин и клопидогрель (плавикс). Прием этих препаратов нужно осуществлять постоянно, обязательно ставя в известность врачей перед выполнением каких-либо других вмешательств.
Питание при синдроме Данбара
Компрессионный стеноз вызывает нарушение пищеварительной функции, поэтому необходимо соблюдать диету до и после операции. Чтобы не перегружать ЖКТ, питание должно быть дробным, до 6 раз в сутки. Последний прием – за 2 часа до сна. При сильных болях перейти на блюда в виде пюре. Они должны быть отварены или приготовлены на пару.
В период обострений овощи и фрукты нельзя употреблять в сыром виде, а только в вареном, запеченном. Мясо, рыба разрешены только нежирных сортов. Молочные продукты – с низкой степенью жирности, кислые совсем исключить. Категорически под запретом алкогольные, энергетические напитки. Лучше пить чай с ромашкой, шиповником, мятой. Длительность диеты определяет врач.
Важно! До и после операции нужно отказаться от жирной, острой, соленой, жареной, маринованной пищи, ограничить употребление кофе, крепкого чая.
Результаты
Средняя продолжительность операции составила 102±20 мин. Интраоперационная кровопотеря в каждом случае не превышала 50 мл. Техническая выполнимость была достигнута во всех случаях независимо от варианта доступа к чревному стволу. Конверсий, интраоперационных осложнений, а также осложнений в раннем послеоперационном периоде не было ни в одном из 21 случая. Длительность пребывания в стационаре составила 5,8±0,6 дня.
Отдаленные результаты в сроки от 1 года до 12 лет после операции прослежены у 17 из 21 пациента. По данным ультразвукового дуплексного сканирования средняя степень сужения чревного ствола до операции составляла 72,5%, в раннем послеоперационном периоде уменьшилась до 42,5%, а в отдаленном периоде снизилась еще до 33% (рис. 5).
Рис. 5. Степень сужения чревного ствола по данным УЗИ до операции и в послеоперационном периоде.
Изменение гемодинамических показателей скорости кровотока в чревном стволе после операции также представляется значимым. Так, до операции средняя пиковая систолическая скорость кровотока в чревном стволе (Vs) составляла 312 см/с, а ускорение пиковой систолической скорости кровотока в фазе глубокого выдоха по сравнению с фазой глубокого вдоха (Vs выд — Vs вдох) составляло 144,5 см/с. В раннем послеоперационном периоде данные показатели снизились до 193,3 см/с и 54 см/с соответственно. В отдаленном послеоперационном периоде пиковая систолическая скорость кровотока в чревном стволе (Vs) составила 172 см/с, а ускорение пиковой систолической скорости кровотока (Vs выд — Vs вдох) снизилось еще до 43,5 см/с (рис. 6).
Рис. 6. Гемодинамические показатели кровотока до и после оперативного вмешательства.
В нашем исследовании интраоперационное лапароскопическое УЗИ выполнялось во всех случаях декомпрессии чревного ствола, что позволило, помимо определения анатомии чревного ствола, объективно оценить адекватность декомпрессии и соответственно получить хорошие клинические результаты (рис. 7).
Рис. 7. Интраоперационное ультразвуковое сканирование позволяет оценить эффективность декомпрессии.
Однако 2 пациентам из 21 понадобилось выполнение повторного оперативного вмешательства. В первом случае повторное оперативное вмешательство потребовалось вследствие неполного восстановления кровотока по чревному стволу после лапароскопической декомпрессии. Операция была проведена из открытого доступа через год после выполнения лапароскопической декомпрессии, с положительным эффектом. Этот случай был первым опытом выполнения лапароскопической декомпрессии чревного ствола в Институте хирургии им. А.В. Вишневского. Таким образом, необходимость повторной операции может быть связана с неполноценной декомпрессией в процессе становления методики.
Во втором наблюдении лапароскопическая декомпрессия чревного ствола была выполнена с выраженным положительным эффектом, что подтверждалось данными ультразвукового исследования в раннем и отдаленном послеоперационных периодах. В связи с сохранением у пациентки жалоб и наличием инструментально подтвержденного гемодинамически значимого сдавления чревного ствола было принято решение о повторной лапароскопической декомпрессии. Повторная лапароскопическая декомпрессия была выполнена успешно, кровоток был полностью восстановлен: по данным ультразвукового исследования в раннем послеоперационном периоде кровоток в чревном стволе носил ламинарный характер, линейная скорость кровотока составила 180 см/с. Однако жалобы на боли в животе у пациентки сохранялись. В данном случае речь, вероятно, идет о психосоматическом расстройстве.
Основными критериями эффективности оперативного вмешательства мы считаем послеоперационное улучшение гемодинамических показателей кровотока в чревном стволе (выход этих показателей из диапазона гемодинамической значимости) в сочетании с купированием симптоматики и улучшением качества жизни больного.
Эффективность выполненного вмешательства в отдаленном послеоперационном периоде оценивалась клинически, по данным послеоперационного инструментального обследования, а также с помощью анкетирования по системе оценки качества жизни SF-36. По опроснику SF-36 17 из 21 пациента были анкетированы дважды: в предоперационном периоде и через год после выполнения вмешательства. Перед операцией среднее значение физического компонента здоровья составило 38 баллов, психологического — 31 балл, интенсивность боли составила 28,7 балла. В послеоперационном периоде исследуемые критерии были оценены большим количеством баллов, что свидетельствовало о повышении качества жизни и снижении интенсивности боли: физический компонент здоровья составил 41,5 балла, психологический — 35,8 балла, критерий интенсивности боли составил 40,2 балла (рис. 8).
Рис. 8. Оценка качества жизни по данным опросника SF-36.
Последствия, профилактические меры
Результатом развития синдрома Данбара становится гипоксия органов ЖКТ. Дефицит питания и кислорода может проявиться гастритом, язвенной болезнью, дуоденитом, энтеритом и колитом. При нарушенном кровотоке в печени и поджелудочной железе могут развиться гепатит и панкреатит.
Профилактические меры предусматривают ежегодное обследование и грамотное лечении заболеваний, которые могут быть стать толчком к развитию приобретенного КСЧС. Профилактики врожденного синдрома Данбара нет. К нему могут привести атеросклеротические изменения, следовательно, необходимо придерживаться норм питания и ежегодно контролировать уровень холестерина.
Как проводится стентирование чревного ствола и брыжеечной артерии
Перед операцией внутривенно или внутримышечно может быть введен успокоительный препарат, после чего пациент сопровождается в операционную, где готовят к хирургическому доступу его бедро или локтевой сгиб: обрабатывают кожу септиком, закрывают стерильными простынями операционное поле.
Хирург обезболивает место прокола, пунктирует артерию и устанавливает специальную трубку. Через трубку (интродюссер) врач вводит в аорту проводник, а по нему – катетер для контрастного исследования артерий. Заполняя кровеносное русло, рентгеноконтрастное вещество обозначает места сужения. Прямо во время исследования врач может завести проводник ниже места сужения, доставить туда баллон со стентом и раскрыть его, чтобы увеличить просвет сосуда. Стент поддерживает сосудистую стенку, а артерия начинает пропускать кровоток в нужной мере.
После вмешательства обязательно проведение контрольной ангиографии для исключения осложнений. Из сосуда извлекают катетер, интродюссер, место доступа подвергается компрессии для остановки кровотечения. Для ликвидации разреза используют также специальные сшивающие устройства.