Тромбоз воротной вены (ТВВ),или пилетромбоз, является редко диагностируемым заболеванием сосудов печени и можетбыть результатом большого количестваразличных заболеваний как хирургического, так и терапевтического профиля,оставаясь бессимптомным длительныйпериод времени, что затрудняет его своевременную диагностику. В то же время прогноз при ТВВ всегда серьезен и неблагоприятен, в половине случаев наблюдаются смертельные исходывследствие желудочно-кишечных кровотечений и прогрессирования портальной гипертензии (ПГ) [6, 9].ТВВ называют процесс образованиятромба вплоть до полной окклюзиипросвета основного ствола и ветвей ВВ с прогрессирующим нарушением кровотока в печени и желудочно-кишечном тракте.
Впервые прижизненный диагноз тромбоза основного ствола ВВ поставил Боткин С.П. в 1862 г. [ 1, 7]. Первоеописание ТВВ принадлежит Вalfur иStewart (1868) на примере пациента соспленомегалией, асцитом и варикознорасширенными венами (ВРВ) [1, 3].В 1934 г. Стражеско Н.Д. на основании собственных исследований и данных литературы разработал и описал главные симптомы прижизненно распознанного ТВВ [3].
Достоверных сведений о частоте ТВВ нет. В зависимости от методов диагностики и критериев выборки пациентов статистические данные сильноварьируются. По данным аутопсий, в США частота портальных тромбозовколеблется от 0,05 до 0,50 % [9, 15]; данные японских патологов эти цифры подтверждают. В европейской популяции ТВВ обусловлено до 10 % всех случаев ПГ, в то же время в развивающихся странах эта цифра достигает 40 %[5, 12]. Частота ТВВ у больных циррозомпечени (ЦП), по разным литературнымданным, колеблется от 1 до 43 % [5, 9].При пересадке печени частота развитияТВВ варьируется от 2 до 26 % [5].
Таким образом, проблема ТВВ имеетважное медицинское значение, темболее что тщательно разработанныхалгоритмов диагностики и леченияданной патологии до сих пор нет.
Система ВВ
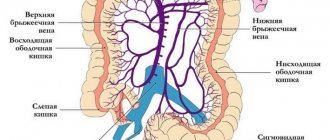
Система ВВ включает все вены, покоторым осуществляется отток венозной крови от внутрибрюшной части желудочно-кишечного тракта, селезенки, поджелудочной железы и желчногопузыря (см. рисунок).
. Анатомическое строение системы воротной вены. Ш. Шерлок, Дж. Дули.
ВВ образуется из слияния верхнейбрыжеечной и селезеночной вен позади головки поджелудочной железы приблизительно на уровне II поясничного позвонка; протяженность ВВ доворот печени составляет 5,5–8,0 см.В воротах печени ВВ разделяется направую и левую долевые ветви соответственно долям печени; далее в печениВВ делится на сегментарные ветви,сопровождающие ветви печеночнойартерии.
ВВ не содержит клапанов в основных ветвях. Распределение портального кровотока в печени непостоянно:может преобладать кровоток в левуюлибо в правую долю печени. У человека возможен переток крови из системы одной долевой ветви в систему другой. Давление в ВВ человека в норме составляет около 7 мм рт. ст. Объемнаяскорость кровотока через ВВ достигает1000–1200 мл/мин [3].
Этиология и патогенез ТВВ
Согласно современным представлениям, венозный тромбоз является суммирующим результатом врожденныхили приобретенных прокоагулянтныхнарушений и действия местных факторов [10, 22].
Состояние, при котором нарушается равновесие между процессами коагуляции и фибринолиза в пользу процессов коагуляции, может быть определено как тромбофилия. У человекас врожденными или приобретеннымив течение жизни тромбофилическими нарушениями чаще, чем в обычной популяции, развиваются артериальные или венозные тромбозы различной локализации (табл. 1) [5, 11,12, 14, 23].
Мутация Лейдена в гене фактора Vвстречается в 2–4 % европейской популяции и ведет к изменению аминокислотной последовательности самого фактора свертываемости V (заменеаргинина глутамином в позиции 506). Мутированный фактор V устойчив кразрушению протеином С; постояннаяциркуляция активированного фактораV приводит к неконтролируемому синтезу тромбина и формированию тромбов [11, 13, 16, 23].
Мутация гена фактора свертываемости II впервые описана в 1996 г., встречается в общей популяции у 2 %населения и приводит к избыточнойгенерации протромбина, т. е. сдвигугемостаза в прокоагулянтную сторону[17, 22].
Протеин С синтезируется в печеничерез витамин К – зависимый механизм, и является естественным антикоагулянтом. Протеин S – кофакторпротеина С, участвующий в нейтрализации активных форм факторов свертывания V и VIII. В настоящее время описано около 160 мутаций гена протеина С и множество мутаций генапротеина S, что ведет к дефициту этихбелков и развитию тромбофилии [11].
Приобретенные расстройства свертывания крови могут возникать примиелоприлиферативных заболеваниях,антифосфолипидном синдроме; онитакже сопровождают воспалительныеи онкологические заболевания, отмечаются на фоне применения пероральных контрацептивов [16, 22, 23], беременности и гипергомоцистеинемии.У 60 % больных при тромбозе вен внутренних органов отмечается гиперкоагуляция, у 25 % первостепенное значение имеет влияние локальных факторов [16, 20]. Для ТВВ характерна комбинация причинных факторов [18, 20].Приблизительно в 20 % случаев развитие тромбоза не находит исчерпывающего объяснения [21]. Возникновению тромбозов способствуют все заболевания, протекающие с замедлением кровотока через печень.
Патогенез ТВВ при ЦП до конца невыяснен. Значение здесь могут иметьПГ, уменьшение скорости кровотокапо ВВ, периферический лимфангиити фиброз [20].
. Причины тромбофилии.
Причины тромбоза
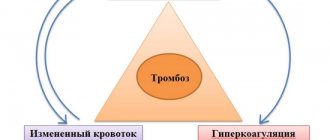
Для того, чтобы в вене образовался тромб, необходим ряд условий или факторов. В классическом варианте различают три фактора, способствующие тромбообразованию (триада Вирхова).
— состояние гиперкоагуляции (повышенная свертываемость). Причин для повышения свертываемости крови много – операция на любой части тела, беременность, роды, сахарный диабет, избыток жиров с пищей, оральные контрацептивы, обезвоживание, генетические факторы (редко) и др.
— травма внутренней стенки сосуда (эндотелия). Сосудистая стенка может быть травмирована при установки венозного катетера, инъекции в вену (в связи с эти очень часты тромбозы у наркоманов, делающих инъекции в вены голеней, в паху), травмах, при лучевой терапии, химиотерапии и др.
— замедление тока крови. Может наблюдаться при разных состояниях – варикозная болезнь, беременность, ожирение, обездвиживание конечности (например, при ношении гипса после переломов), сердечная недостаточность, вынужденное малоподвижное положение тела (например, при длительных авиаперелетах), сдавлении вен опухолями и др.
Тромбоз может возникнуть как при действии одного фактора, так и при их сочетании. Например, при переломе костей голени могут быть задействованы все три фактора – повышенная свертываемость в случае обширных кровоизлияний в области травмы, повреждение сосудистой стенки как следствие механического удара, замедление тока крови как следствие ношения гипса.
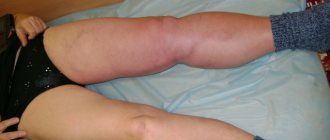
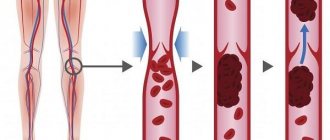
Чаще всего тромбоз возникает в венах нижних конечностей. Это связано с тем, что в этих венах чаще всего возникает застой (ожирение, варикозная болезнь, отеки и мн. др.).
Клиника ТВВ
Клиническая картина зависит от локализации и протяженности ТВВ, быстроты его развития и природы предрасполагающего заболевания печени. ТВВ можно разделить на острый и хронический, исходя из темпов развития венозной обструкции. О тромбозе ВВ или ее ветвей следует думать во всех случаях внезапного появления болей в эпигастральной области, сочетающихся с резким вздутием живота, быстрым накоплением жидкости в полости брюшины, повторной рвотой. ТВВ может проявлять себя в любом возрасте: начиная с 6-недельного до глубокой старости; различия по частоте его встречаемости между детьми и взрослыми не наблюдается [5]. Клинические проявления могут варьироваться от полностью бессимптомного течения болезни до острого начала с кровавой рвотой. Кровотечение из ВРВ пищевода и прямой кишки – наиболее частое проявление ТВВ. При наличии спленомегалии и гиперспленизма наблюдаются тромбоцитопения, боли в животе, транзиторный или постоянный асцит, отсутствие аппетита, слабость, похудание.
Хронический ТВВ может проявлять себя лишь неспецифическими симптомами – общей слабостью, отсутствием аппетита, а в отсутствие грамотной диагностики, что встречается довольно часто, может быть пропущен.
В терапевтической практике чаще приходится наблюдать вялотекущие формы пилефлебита на фоне портального тромбоза. Они характеризуются нерезкими болями в области печени, умеренным лейкоцитозом, длительной субфебрильной температурой тела. Слегка увеличенная печень чувстви- тельна при пальпации. Кровь в случаях вялотекущего пилефлебита оказывалась стерильной. Болезнь обычно принимается за хронический холецистохолангит, хронический аппендицит или другое хроническое воспалительное заболевание какого-либо внутреннего органа. Причина лихорадки обычно становится очевидной только после длительного наблюдения, за время которого у больного появляются увеличение селезенки и признаки более или менее развитого коллатерального кровообращения.
Выделяются следующие стадии ТВВ: 1. Острая: образование тромба; ВВ может быть увеличена. 2. Подострая: визуализируются тромб и мелкие венозные коллатерали; диаметр ВВ может быть увеличен. 3. Хроническая: кавернозная трансформация ВВ; развитие крупных коллатералей в проекции облитерированной ВВ; ВВ уменьшена в диаметре или не визуализируется.
В зависимости от локализации тромба различают три варианта ТВВ: • радикулярная форма (тромбоз селезеночной вены и мезентериальных сосудов); • терминальная форма (тромбозы мелких разветвлений и капилляров ВВ в печени); • стволовой тромбоз (в самом стволе ВВ).
Кровоснабжение кишечника выше уровня ТВВ (по ходу кровотока) остается удовлетворительным до тех пор, пока сохраняется циркуляция по дугообразным сосудам кишечника. Если же они тромбируются, развивается ишемия кишки. Этому, вероятно, способствует отсутствие сосудистых коллатералей. Последствием ишемии может стать некроз кишки с развитием перитонита, полиорганной недостаточности, а в четверти случаев – летального исхода даже после резекции некротизированного участка кишки [9, 21].
Напротив, ниже уровня тромбоза клинически значимых нарушений функции печени не развивается, поскольку ее кровоснабжение поддерживается благодаря увеличению притока крови по печеночной артерии (вследствие расширения ее ветвей) и развитию портальных коллатералей, из которых формируется кавернома [7, 19]. Коллатеральные вены развиваются в течение нескольких дней и образуют каверному, при диагностике часто ошибочно трактуемую как сосудистая опухоль, или аномалия развития. Коллатеральные вены могут изменять вид анатомических структур, примыкающих к тромбированному участку ВВ, в частности желчных протоков, желчного пузыря, поджелудочной железы, антральной части желудка, 12-перстной кишки. При диагностических исследованиях это приводит к ошибочной диагностике опухолей, панкреатитов, холециститов. Кроме того, изменения в желчных протоках, вызванные развитием коллатералей, могут приводить к развитию желтухи. Давление в системе ВВ увеличивается; развивается картина ПГ.
Ультразвуковое исследование
Тромбоз воротной вены (ТВВ) все чаще распознается с помощью УЗИ. Абдоминальный сепсис и снижение портального кровотока в результате паренхиматозной болезни печени являются основными причинами.
Рисунок 8: Тромбоз воротной вены. Продольная косая сонограмма у 36-летней женщины с историей атрофии зрительного нерва Лебера (наследственная зрительная нейроретинопатия) и злоупотреблением алкоголя, у которой были неспецифические жалобы на плохое самочувствие и неопределенные боли в животе. Изображение показывает асцит и яркую печень (ожирение). Воротная вена имеет линейную эхогенную структуру, проходящую по длине воротной вены (сплошная стрелка). В печени присутствует кистозное образование (открытая стрелка).
Рисунок 9: Тромбоз воротной вены. Энергетическая допплерограмма печени показывает кровоток вокруг дефекта внутрипросветного наполнения в воротной вене (P).
Рисунок 10: Тромбоз воротной вены. Спектральная доплеровская сонограмма печени, полученная у того же пациента, что и на предыдущем изображении, показывает воротную вену (курсор), которая не демонстрирует кровоток.
Рисунок 11: Тромбоз воротной вены. Продольная косая сонограмма была получена у 28-летней женщины, которая была направлена на УЗИ желчного пузыря. Изображение показывает несколько сосудистых канальцевых структур у ворот печени, которые наводят на мысль о кавернозной трансформации.
Рисунок 12: Тромбоз воротной вены. Цветная допплеровская сонограмма, полученная у того же пациента, что и на предыдущем изображении, показывает кровоток в кавернозном образовании.
Рисунок 13: Тромбоз воротной вены. Цветная допплерография селезенки, полученная у того же пациента, что и на предыдущих 2 изображениях, показывает умеренную спленомегалию с варикозным расширением вен в селезенке. Эндоскопические данные подтвердили наличие варикозного расширения вен пищевода.
Рисунок 14: Ультразвуковая цветная допплерография изображает васкуляризованный портальный тромб.
Рисунок 15: Ультразвуковая цветная допплерография изображает васкуляризованный портальный тромб.
Рисунок 16: Эхогенный частично реканализированный тромб воротной вены. Пациентка 36-летняя женщина с идиопатическим хроническим тромбозом воротной вены продолжительностью 2 года. У нее холестатическая желтуха.
На сонограммах в воротной вене могут присутствовать эхогенные поражения. Может быть изображен сгусток с переменной эхогенностью. Сгусток обычно имеет умеренную эхогенность, но если он образовался недавно, он может быть гипоэхогенным.
Открытые сосуды могут иметь повышенную внутрипросветную эхогенность из-за образования скопления эритроцитов, что делает медленную кровь слегка эхогенной. Повышенная или пониженная эхогенность может наблюдаться в просвете воротной вены.
ТВВ устраняет обычный сигнал венозного кровотока из просвета портальной вены во время импульсной или цветовой допплерографии. Цветовые доплеровские изображения потока могут показать обтекание тромба, который частично блокирует вену. Однако, если поток медленный, доплеровский сигнал может быть не обнаружен. Цветной поток может присутствовать в других небольших коллатеральных сосудах.
Может возникнуть неполная окклюзия. Это характерно для опухолевого поражения. Альтернативно, может произойти тромболитическая реканализаци. Также можно обнаружить кавернозные мальформации, спонтанные шунты, спленоренальные и портосистемные коллатерали. Может быть очевидной основная причина: гепатоцеллюлярная карцинома, метастазы, цирроз печени, новообразования поджелудочной железы.
Предполагается, что утолщение воротной вены с сужением ее просвета, вызвано портальным флебитом. Это считается предшественником ТВВ у пациентов с острым панкреатитом. Диаметр воротной вены больше 15 мм в 38% случаев ТВВ.
Диагностика ТВВ
Необходимость использования визуализирующих методов исследования определяется отсутствием специфических признаков ТВВ и потребностью в выявлении уровня нарушения венозного оттока. Основными диагностическими методами в данном случае являются ультразвуковое (УЗИ) и допплеровское исследования, компьютерная (КТ), магнитно-резонансная томографии (МРТ) и ангиография.
УЗИ позволяет выявить ТВВ лишь в том случае, когда в просвете ВВ визуализируются участки повышенной эхогенности, обусловленные наличием тромбов. При увеличении размеров ВВ можно только предположить ПГ, т. е. этот признак не является диагностическим. Обнаружение венозных коллатералей с большей достоверностью подтверждает диагноз ПГ.
Допплеровское УЗИ дает возможность выявить строение ВВ и печеночной артерии. Диагностическая ценность и результаты исследования зависят от опыта врача и качества анализа деталей изображения. Наибольшую сложность представляют исследования цирротически измененной печени и у пациентов с избыточным весом [2, 19]. При цветном допплеровском картировании (ЦДК) качество визуализации ТВВ повышается. Технически правильно проведенное ЦДК позволяет диагностировать обструкцию ВВ так же достоверно, как ангиография. С ЦДК удается выявить естественные внутрипеченочные портосистемные шунты. Это наиболее дешевый, эффективный и неинвазивный метод. Его высокие чувствительность и специфичность отмечаются у пациентов с обширными тромботическими поражениями и полным закрытием просвета сосудов. В то же время наличие остаточного кровотока по ВВ увеличивает вероятность технической ошибки при оценке результатов исследования [5, 19].
С целью снижения риска подобных ошибок при диагностике ТВВ для определения скорости портального кровотока применяют дуплексное ультразвуковое сканирование. Этот метод представляет собой сочетание допплеровского ультразвукового сканирования с традиционным УЗИ, что позволяет врачу увидеть структуру кровеносных сосудов. Дуплексное сканирование показывает движение крови по сосудам и позволяет измерять скорость кровотока. Этот метод также позволяет определять диаметр сосудов и выявлять их закупорку. К наиболее современным и точным методам визуализации относятся КТ, венография и МРТ.
КТ может дать информацию о состоянии стенок сосудов, поражении печени (например, с формированием кавернозных узлов) и показать протяженность тромбоза [5, 15].
После введения контрастного вещества появляется возможность определить просвет ВВ и выявить ВРВ, расположенные в забрюшинном пространстве, а также перивисцеральные и параэзофагеальные вены. ВРВ пищевода выбухают в его просвет, и это выбухание после введения контрастного вещества становится более заметным.
КТ в сочетании с артериальной портографией позволяет выявлять пути коллатерального кровотока и артериовенозные шунты. Портография через внутреннюю яремную вену – инвазивный, но очень точный метод диагностики. Он позволяет оценивать протяженность тромбоза, его точную локализацию и выраженность тромботического стеноза ВВ.
МРТ позволяет очень четко визуализировать сосуды и изучать их. Этот метод применяют для определения просвета шунтов, а также для оценки состоятельности портального кровотока. Результаты МРТ более надежны, чем данные допплеровского УЗИ [5, 15, 19].
Венография используется для верификации диагноза в тех случаях, когда вышеописанные методы исследования не позволяют однозначно подтвердить или исключить предполагаемый ТВВ. В то же время, если каким-либо методом установлена проходимость ВВ, подтверждение этого с помощью венографии не является обязательным. Венография также позволяет выявлять дефект наполнения ВВ или ее ветвей, свидетельствующий о сдавлении извне объемным образованием [5].
В клинической практике для диагностики портальных тромбозов обычно комбинируют два метода, чтобы преодолеть недостатки каждого из них. При диагностике ТВВ следует обратить внимание на коагулограмму: повышение содержания фибриногена, появление активированного фибриногена, увеличение протромбинового индекса, уменьшение времени свертывания крови.
Предпочитаемые методы исследования
Предпочтительные исследования включают дуплексную допплерографию и / или цветную допплерографию, компьютерную томографию, магнитно-резонансную ангиографию и артериальную портографию или спленопортографию.
Рисунок 1: Тромбоз воротной вены.Верхняя брыжеечная ангиограмма показывает коллатеральные сосуды на воротной части печени, но нет открытой воротной вены. Обратите внимание, что в результате асцита печень смещается от грудной клетки. У этого пациента была тяжелая печеночная недостаточность, и он умер через 72 часа после визуального исследования. Посмертное исследование показало ранний цирроз, молниеносный пиогенный холангит, множественные абсцессы печени, тромбоз воротной вены и селезенки и левой желудочной вены.
Опухоль в воротной вене может иметь вид, идентичный тромбозу, но этот вид встречается гораздо реже, чем у других. Тромб может быть частичным или полным. Он также может быть смешан с мягким тромбом.
Взрослые, у которых острый ТВВ вторичен по отношению к абдоминальному сепсису, могут полностью восстановиться, и сосуд может быть повторно проанализирован с успешным лечением основного сепсиса.
Невизуализация воротной вены убедительно свидетельствует об окклюзии. В этом случае воротную вену можно рассматривать как полосу эхо-сигналов высокого уровня у воротной части печени.
Развитие ТВВ может ускорить необходимость экстренной эндоскопии для склеротерапии варикозных вен, TIPS, хирургического создания портокавального шунта, трансъюгулярного или трансгепатического портомезентериального тромболизиса и тромбэктомии или даже резекции. Однако ТВВ может осложнить склеротерапию. Тонкоигольная аспирационная биопсия ТВВ может быть выполнена под цветным доплеровским сонографическим контролем для оценки терапевтической эффективности.
Ранние осложнения трансъюгулярного внутрипеченочного портосистемного шунта (TIPS), которые можно обнаружить с помощью ультрасонографии, включают следующее:
- внутрибрюшинное кровоизлияние,
- тромбоз шунта,
- гематома шеи,
- нарушение кровоснабжения печени,
- ТВВ,
- окклюзия печеночной артерии,
- инфаркт печени,
- неудачное развертывание стента,
- неадекватное расширение стента,
- расширение стента,
- обструкция желчных путей.
Исследователи, рассматривающие результаты пациентов с циррозом печени, перенесшим TIPS, отметили, что, хотя достигается увеличение скорости кровотока в воротной вене и снижение портальной гипертензии, состояние гиперкоагуляции сохраняется и может вызвать расширение остаточного ТВВ или ретромбоз.
ТВВ также может прерывать перфузию печени, вызывая ишемию гепатоцитов и гормональную депривацию, что может привести к гибели гепатоцитов, исчезновению паренхимы и, в конечном итоге, к ухудшению фиброза и функции печени, что приводит к увеличению смертности.
Лечение ТВВ
Ведение пациентов с ТВВ зависит от начала заболевания (острое или хроническое), клиники, этиологических факторов, приведших к ТВВ, возраста и других факторов. Осложнения ТВВ – асцит, кровотечение из ВРВ – лечатся так же, как и при ЦП с ПГ.
При остром ТВВ рекомендуется антикоагулянтная терапия, которая приводит к полному или частичному восстановлению просвета ВВ у 70–80 % больных [5, 12, 15].
Спонтанный лизис тромба при ТВВ возможен, однако встречается очень редко. Антикоагулянтная терапия не увеличивает риска кровотечений, зато снижает риск инфаркта кишечника, который является жизнеугрожающим. Частота рецидивов ТВВ варьируется от 6 до 40 % [2, 21], поэтому некоторые авторы рекомендуют проводить антикоагулянтную терапию в течение 6 месяцев [10, 21].
Тромболизис через транспеченочный доступ при остром ТВВ является методом, позволяющим избегать побочных эффектов системной антикоагулянтной терапии. Тромболизис может проводиться и системно, особенно в случаях острого тотального или субтотального окклюзирования ВВ [9, 10].
К сожалению, до сих пор нет четкого практического руководства по назначению антикоагулянтов у больных с ТВВ. Как выбрать правильный антикоагулянт? Какие дозы следует применять? Когда прекращать антикоагулянтную терапию? Какие противопоказания существуют к применению антикоагулянтов? Для того чтобы ответить на эти вопросы, необходимы большие рандомизированные исследования.
Хирургические методы лечения включают чреспеченочную ангиопластику, тромболизис с последующим трансюгулярным внутрипеченочным портосистемным шунтированием (TIPS), тромбэктомию с локальной инфузией фибринолитика. Если больному планируется шунтирование, предпочтительнее проводить дистальное спленоренальное шунтирование [5, 10]. Спленэктомии следует избегать, поскольку она сама является этиологическим фактором развития ТВВ. Основные методы медикаментозного и хирургического лечения ТВВ представлены в табл. 2.
. Основные методы лечения ТВВ.
Тромбоз воротной вены: современный взгляд на вопросы этиопатогенеза, профилактики и лечения
Тромбоз воротной вены (ТВВ) – это форма венозного тромбоза, вызывающего нарушение или прекращение кровотока в воротной вене. Распространенность ТВВ составляет около 1% в общей популяции, наиболее часто встречается на фоне цирроза печени, воспалительных заболеваний брюшной полости и гепатоцеллюлярной карциномы. Различают полный и частичный тромбоз, а также острую и хроническую форму ТВВ. Острая форма может проявляться ишемией и инфарктом кишечника вследствие распространения тромба на мезентериальные сосуды. Хроническая форма чаще бессимптомная в силу включения компенсаторных механизмов, таких как дилатация печеночной артерии и развитие сети коллатералей. Проявлениями хронического ТВВ могут быть кровотечения из желудочно-кишечного тракта как следствие портальной гипертензии и билиопатия. Методами диагностики при ТВВ являются допплерсонография, компьютерная томография и магнитно-резонансная томография с контрастированием. Антикоагулянтная терапия считается терапией выбора при остром ТВВ. При хроническом ТВВ рекомендованы мониторинг и профилактика кровотечения из варикозно расширенных вен пищевода (ВРВП), при необходимости медикаментозный тромболизис. ТВВ является предиктором смертности при трансплантации печени.
Таблица. Системные факторы тромбоза воротной вены (AASLD, 2009)
Рисунок. Главные сосуды портальной системы печени
Эпидемиология
Тромбоз воротной вены (ТВВ) подразумевает полную или частичную окклюзию просвета сосуда, дренирующего русло органов желудочно-кишечного тракта. Впервые ТВВ был описан в 1868 г. у пациента со спленомегалией, асцитом и варикозно расширенными венами пищевода (ВРВП) [1].
ТВВ диагностируется у 5–10% пациентов с портальной гипертензией в развитых странах и у 30–35% пациентов в развивающихся странах из-за высокой частоты инфекционных осложнений, предрасполагающих к ТВВ [2].
Распространенность ТВВ среди пациентов с циррозом печени (ЦП), выявляемая при аутопсии, составляет 6–64%, по результатам ультразвуковой диагностики – 5–24% [3]. Риск развития тромбоза тесно связан с тяжестью заболевания печени и составляет менее 1% случаев у больных с компенсированным ЦП, 8–25% случаев у больных, которые являются кандидатами на трансплантацию печени [4, 5].
По результатам 24 000 вскрытий, выполненных в Швеции в 1970–1982 гг., распространенность ТВВ в общей популяции составилa 1%. При этом на долю ЦП пришлось 28%. Наиболее частой причиной тромбоза стало злокачественное поражение печени (первичное – 23%, вторичное – 44%). В 10% случаев ТВВ был вызван инфекционным и воспалительным заболеванием органов брюшной полости, в 3% – миелопролиферативной болезнью. Интересно, что в 14% случаев причины тромбоза не выявлены [6].
Этиология
В качестве этиологических факторов возникновения тромба в системе воротной вены выделяют интраабдоминальные (локальные), на долю которых приходится около 70% случаев ТВВ, и системные – 30% случаев ТВВ.
Согласно данным Американской ассоциации по изучению заболеваний печени (American Association for the Study of Liver Diseases – AASLD) 2009 г., к интраабдоминальным
факторам относят [7]:
- цирроз печени;
- рак органов брюшной полости;
- неонатальный омфалит. Катетеризация пупочной вены;
- дивертикулит, аппендицит;
- панкреатит;
- язву двенадцатиперстной кишки;
- холецистит;
- туберкулезный лимфаденит;
- воспалительные заболевания кишечника;
- цитомегаловирусный гепатит;
- механическую травму сосудов в системе воротной вены;
- спленэктомию, колэктомию, гастрэктомию, холецистэктомию;
- трансплантацию печени;
- травмы брюшной полости;
- трансъюгулярное внутрипеченочное портосистемное шунтирование, TIPS (transjugular intrahepatic portosystemic shunt).
Для гепатолога наиболее важными являются вопросы: чем объясняется развитие ТВВ при ЦП? Существуют ли предикторы его развития в зависимости от степени тяжести по критериям Чайлда – Пью или MELD? Говоря о патоморфологических причинах развития ТВВ, необходимо помнить, что одна из основных причин – снижение кровотока в воротной вене вследствие прогрессирующего фиброза. В последнее время все больше данных говорят в пользу «протромботического дисбаланса», развивающегося при ЦП (в противовес традиционным представлениям о печеночной коагулопатии). Действительно, нарушение белково-синтетической функции печени проявляется уменьшением продукции как антикоагулянтных, так и прокоагулянтных факторов (за исключением фактора VIII). Развитию ТВВ способствуют также снижение активности тромбомодулина (мощный антикоагулянт, активатор белка С), увеличение уровня прокоагулянтного фактора VIII в плазме, неэффективный фибринолизис вследствие снижения уровня плазминогена и повышения уровня ингибитора активатора плазминогена [8, 9].
Злокачественные заболевания органов брюшной полости (чаще рак печени и поджелудочной железы) становятся причиной ТВВ в 21–24% случаев. Это связано, с одной стороны, с гиперкоагуляцией, ассоциированной с неопластическим процессом, с другой – с прямoй инвазиeй или сдавливанием сосуда массой опухоли и нарушением кровотока [7].
К менее распространенным интраабдоминальным (локальным) факторам относятся лимфаденопатия, синдром системной воспалительной реакции, травмы сосудов при хирургических вмешательствах (TIPS, спленэктомия, трансплантация печени, абляция при гепатоцеллюлярной карциноме и др.) [10].
К системным
факторам развития ТВВ относят ряд врожденных и приобретенных состояний (см. таблицу).
Мутация фактора V и белка С – наиболее частые врожденные патологии, предрасполагающие к ТВВ. Роль дефицита белка S и антитромбина III не до конца изучена. У пациентов с ЦП определенную роль в развитии тромбоза играет мутация протромбинового гена (в то время как в общей популяции она считается клинически незначимой). Отметим, что среди системных факторов в этиологии ТВВ превалируют приобретенные тромбофилические расстройства по сравнению с врожденными генетическими дефектами коагуляции [11]. Существует формула определения происхождения коагулопатии при ТВВ при наличии сопутствующего заболевания печени. Если соотношение белка С, или белка S, или антитромбина к (фактор II + фактор X)/2 менее 70%, предположительно причиной ТВВ стал генетически обусловленный врожденный дефицит антикоагулянтов [10] .
По данным ряда авторов, от 22 до 48% случаев ТВВ считается первичной манифестацией миелопролиферативного заболевания. Точечная мутация 1849G → T в гене, кодирующем тирозин-протеинкиназы JAK2, является высокоспецифической и позволяет говорить о наличии миелопролиферативного заболевания как причины ТВВ [7].
Патофизиология ТВВ и осложнений
Как известно, воротная вена образуется путем слияния селезеночной и верхней брыжеечной вен. Тромб может сформироваться в интрапеченочной части воротной вены, что встречается при раке печени и ЦП, с последующим распространением процесса на внепеченочную часть сосуда.
Тромбоз может возникнуть в селезеночной вене на фоне воспалительного процесса в брюшной полости (чаще хронического панкреатита) и распространиться на воротную вену. Но обычно местом тромбоза становится воротная вена в месте слияния двух вен (см. рисунок) [12].
Осложнения ТВВ связаны с распространением тромба на брыжеечные вены и кишечные аркады. Тромбоз в кишечных аркадах, с одной стороны, нарушает их функционирование как механизма компенсации в результате коллатерального кровообращения, поддерживающего нормальное кровоснабжение тонкой кишки, с другой – способен привести к рефлекторному сужению артериол с последующей ишемией соответствующего участка тонкой кишки. К тяжелым осложнениям интестинальной ишемии относится инфаркт кишечника, который наблюдается у 5% больных с острым ТВВ [13].
Интересен тот факт, что ТВВ не приводит к изменению функции печени. При этом, как правило, в показателях, указывающих на гепатодепрессию, нет отклонений. Однако, согласно экспериментальным исследованиям, ТВВ может вызвать определенные гистологические изменения в печени. Так, лигирование портальных вен у крыс приводило к апоптозу гепатоцитов и сопровождалось усилением митотической активности в перфузируемых участках. При этом выраженность апоптоза зависела от степени лигирования воротной вены. Этим феноменом объясняется положительный эффект эмболизации ветвей воротной вены при обширных резекциях печени: за счет атрофии «эмболизированного» участка происходит гипертрофия оставшейся части печени, вследствие чего повышается эффективность хирургического вмешательства [14, 15].
В то же время описаны механизмы, благодаря которым при нарушении портального кровотока (на его долю приходится 2/3 кровоснабжения печени) не происходит значимых изменений функций печени. Во-первых, в ответ на снижение портального кровотока отмечается расширение печеночной артерии, что способствует увеличению притока крови к печени по артериальному руслу. Во-вторых, развивается сеть коллатералей, по которой кровь попадает в печень, обходя «блок» в воротной вене. Kоллатеральные вены приобретают вид кавернозного сосудистого образования – «портальной каверномы», период формирования которой составляет в среднем пять недель. При эндоскопической ретроградной холангиогепатографии кавернозная мальформация портальной вены выглядит как губкоподобная масса под печенью. Не следует забывать, что кавернома способна вызвать компрессию желчных протоков (портальную билиопатию). В процесс могут быть вовлечены как внутри-, так и внепеченочные желчные протоки. В большинстве случаев портальная билиопатия не имеет клинических проявлений, хотя в 10–20% случаев, особенно у пожилых больных, может манифестировать желтушным синдромом, холангитом, холециститом [16, 17].
Клиническая картина, диагностика
Симптомы, которые можно наблюдать при остром ТВВ
, разнообразны: внезапная острая боль в животе, вздутие, диарея, ректальное кровотечение, тошнота, рвота. Характерно наличие признаков системного воспалительного ответа: фебрильной лихорадки, повышения уровня острофазовых белков. Однако показатели функциональных проб печени остаются в пределах нормы. Если тромбоз не распространяется на мезентериальные сосуды, то процесс, как правило, обратим в силу включения компенсаторных механизмов (коллатерального кровообращения) или воротной вены [7].
Клиницист должен помнить, что на фоне острого тромбоза может развиться пилефлебит – гнойный тромбофлебит воротной вены как следствие инфекции органов, дренируемых воротной веной или прилегающих к ней (например, желчных протоков). Пилефлебит начинается тромбофлебитом вен, дренирующих очаги инфекции, с распространением на воротную и брыжеечные вены. Кроме того, развитию пилефлебита способствует окклюзия сосуда тромботическими массами [18, 19].
В клинической картине хронического ТВВ
можно выделить ряд синдромов и состояний: с одной стороны, преобладают проявления портальной гипертензии, при этом первой манифестацией хронического ТВВ в 20–40% случаев считают кровотечения из ВРВП и желудка, с другой – могут развиваться билиарная колика, желтуха, холангит, холецистит, панкреатит (портальная билиопатия), а также гиперспленизм с последующей панцитопенией и энцефалопатией, которые можно рассматривать как осложнения [7].
Часто течение хронического ТВВ бессимптомное. Его диагностика возможна только в случае развития осложнений или при ультразвуковом исследовании (УЗИ) брюшной полости.
В диагностике ТВВ важная роль принадлежит УЗИ, чувствительность и специфичность которого составляют 60–100%. При этом имеют место визуализация солидного гиперэхогенного материала в просвете воротной вены или ее ветвях, наличие коллатеральных сосудов и каверномы. Допплерография выявляет отсутствие кровотока в просвете сосуда [18].
Чувствительность эндоскопического УЗИ – 81%, специфичность – 93%. Такое исследование позволяет обнаружить небольшие неокклюзирующие тромбы, а также опухолевую инвазию сосуда. Но у этого метода есть «слепая зона»: дистальная часть верхней брыжеечной вены и интрапеченочная часть воротной вены не визуализируются [19].
Такие современные методы, как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) дают возможность не только обнаружить наличие тромба, но и выявить причины тромбоза, диагностировать осложнения (например, ишемию и инфаркт кишечника).
В рекомендациях AASLD стандартом диагностики острого ТВВ признана КТ. Так, при подозрении на острый ТВВ рекомендуется проводить КТ с контрастированием. В случае лихорадки на фоне острого тромбоза целесообразно проведение бактериологического посева крови для выявления септического пилефлебита. При подозрении на хронический ТВВ рекомендуется проведение допплерографии, КТ или МРТ с контрастированием [20].
Лечение ТВВ
Основные направления лечения при установлении диагноза:
- предотвращение распространения тромба по брыжеечным венам;
- достижение реканализации сосуда;
- лечение осложнений, ассоциированных с портальной гипертензией (в частности, кровотечения из ВРВП) и портальной билиопатией.
При остром ТВВ
медикаментозный тромболизис считается терапией выбора. По данным четырех ретроспективных исследований, у пациентов с острым ТВВ, которым проводили антикоагулянтную терапию в течение шести месяцев, полная реканализация была достигнута в 50% случаев, частичная – в 40%. Только 10% пациентов оказались резистентны к проводимой терапии.
Антикоагулянтная терапия показана прежде всего при сопутствующем тромбозе брыжеечных вен. По мнению ряда экспертов, при инфаркте кишечника антикоагулянтная терапия, предшествующая хирургическому вмешательству, улучшает прогноз и выживаемости пациентов. Чем раньше она начинается, тем лучше результаты. При введении антикоагулянтов в течение первой недели проходимости воротной вены достигали в 60%. Та же терапия, начатая неделю спустя, была успешной в 25% случаев [7, 20].
Согласно рекомендациям AASLD (2009) всем пациентам с острым ТВВ следует проводить антикоагулянтную терапию продолжительностью не менее трех месяцев. Терапия начинается с низкомолекулярного гепарина с последующим переходом на пероральные антикоагулянты. Общая длительность терапии определяется индивидуально в зависимости от достигнутого результата и наличия тромбофилических расстройств.
При подозрении на септический пилефлебит антибактериальная терапия назначается незамедлительно.
Показанием для неотложного хирургического вмешательства является развитие инфаркта кишечника: проводятся лапаротомия и резекция некротизированного участка кишки [20].
Что касается выбора оптимальной тактики лечения при хроническом ТВВ,
единого мнения среди клиницистов нет. С одной стороны, хронический ТВВ часто ассоциируется с протромботическими расстройствами (возрастает риск развития интестинальной ишемии и инфаркта кишечника), с другой – антикоагулянтная терапия сопряжена с высоким риском кровотечения.
Принимая во внимание сопутствующую портальную гипертензию, всем пациентам с хроническим ТВВ рекомендовано проведение эндоскопического исследования для исключения наличия ВРВП. У 30% больных с хроническим ТВВ в отсутствие ЦП развивается по меньшей мере один эпизод кровотечения из ВРВП. При хроническом ТВВ рекомендации по лечению и профилактике ВРВП совпадают с таковыми при портальной гипертензии вследствие ЦП (профилактическое назначение бета-блокаторов при ВРВП 2-й стадии, эндоскопическое лигирование – при ВРВП 3–4-й стадии).
Согласно рекомендациям AASLD (2009) антикоагулянтная терапия больным с хроническим ТВВ может проводиться в отсутствие ЦП, при обеспечении профилактики кровотечений из ВРВП и желудка и наличии повышенного риска развития венозных тромбозов.
При желтухе и других проявлениях портальной билиопатии может быть проведено стентирование билиарных протоков [20].
Отметим, что наиболее противоречивым и сложным остается вопрос о тактике лечения больных с ТВВ при наличии ЦП. Нужно ли таким пациентам проводить антикоагулянтную терапию? Аргументами в пользу тромболизиса могут служить следующие доводы:
хронические заболевания печени можно рассматривать как протромботические состояния, при которых в печени активируются процессы коагуляции, что в свою очередь способствует процессу фиброгенеза. Вместе с тем в экспериментальных исследованиях показано, что антикоагулянтная терапия при хронических заболеваниях печени способна ингибировать процессы фиброгенеза;
у больных ЦП часто развивается тромбоз интрапеченочных участков печеночной (70%) и портальных (30%) вен с последующей атрофией печени и потерей части функционирующих гепатоцитов;
при ЦП наблюдается замедление кровотока в воротной вене, что создает дополнительные условия для формирования тромба.
Кроме того, имеются данные о восстановлении кровотока в воротной вене без развития желудочно-кишечных кровотечений при проведении антикоагулянтной терапии у данной категории больных. Однако эти исследования включают небольшое число наблюдений, как правило неконтролируемых, и их результаты не могут считаться статистически достоверными [21].
Существует ли альтернатива медикаментозному тромболизису? В настоящее время в качестве альтернативы активно обсуждают инвазивный прямой и непрямой тромболизис.
При прямом тромболизисе
, который более сложен с технической точки зрения, антикоагулянт доставляется непосредственно в место тромбоза (в воротную или брыжеечную вену) через трансъюгулярный шунт или чрескожный трансгепатический путь с последующим отсасыванием тромба, баллонной дилатацией или стентированием. Прямой тромболизис осуществляется при остром ТВВ, пока не сформировалась сеть коллатеральных сосудов.
При непрямом тромболизисе
проводится катетеризация бедренной или лучевой артерии с последующей доставкой антикоагулянта (например, урокиназы) в верхнюю брыжеечную вену. Непрямой тромболизис может способствовать лизису тромба, стимулированию коллатерального ангиогенеза и улучшению клинической картины [22].
Обратите внимание: указанные выше малоинвазивные методы интервенционной радиологии могут быть использованы только в случае острого и подострого тромбоза воротной и верхней брыжеечной вен в отсутствие признаков некроза кишечника, перфорации или перитонита.
Прямая тромбэктомия
как альтернатива медикаментозному тромболизису при ТВВ не рекомендуется из-за риска развития ретромбоза и послеоперационных осложнений. Однако тромбэктомия при длительности тромбоза менее 30 дней (путем чрескожного трансгепатического подхода) может иметь ряд преимуществ.
При хроническом ТВВ методом выбора может быть «хирургическая декомпрессия»
– шунтирование, к которому прибегают при неэффективности лечения осложнения портальной гипертензии (кровотечения из варикозно расширенных вен) медикаментозными или эндоскопическими методами (эндолигирование и склеротерапия). Вместе с тем надо помнить, что в 37% случаев ТВВ сопровождается тромбозом в селезеночных и брыжеечных венах. Следовательно, указанный метод в этом случае считается нерадикальным. К преимуществам шунтирования относят возможность курации портальной билиопатии, гиперспленизма.
Существует несколько вариантов шунтирования: спленоренальное, мезокавальное, илеоренальное «бок в бок», наложение шунта между верхней брыжеечной и портальной венами, TIPS [18].
ТВВ как диагностический и прогностический фактор
Еще один важный клинический момент – возможность использования факта развития ТВВ в качестве прогностического критерия при различных состояниях. Так, наряду с возрастом и показателями шкалы MELD развитие ТВВ служит дополнительным предиктором неблагоприятного прогноза после трансплантации печени.
Еще недавно ТВВ был абсолютным противопоказанием для трансплантации печени. Первые сведения об успешной трансплантации печени у пациентов с ТВВ появились в 1985 г. [23]. В настоящее время ТВВ можно рассматривать в качестве показания для трансплантации при неэффективности консервативных или хирургических методов лечения (по аналогии с пациентами с энцефалопатией, гипоксией и гипертензией легочной артерии).
Заключение
Долгое время считалось, что тромбоз воротной вены – редкая патология. Однако уже в 1970-е гг. в исследованиях была продемонстрирована существенная частота встречаемости ТВВ (1%) в общей популяции, что, вероятно, обусловлено совершенствованием методов диагностики (КТ, МРТ с контрастированием). Клинические проявления ТВВ крайне разнообразны – начиная с бессимптомного течения при хроническом тромбозе и заканчивая ишемией и инфарктом кишечника при остром тромбозе с включением мезентериальных сосудов. При остром ТВВ проводится антикоагулянтная терапия с целью предотвращения распространения тромба на мезентериальные сосуды и реканализации существующего тромба. Альтернативой медикаментозному тромболизису можно считать прямой и непрямой тромболизис с введением антикоагулянта непосредственно в воротную или брыжеечную вену. Вопрос лечения хронического тромбоза остается дискутабельным: из-за отсутствия контролируемых исследований рекомендации при хроническом ТВВ совпадают с таковыми при лечении портальной гипертензии у больных ЦП. В некорригируемых случаях портальной билиопатии и гиперспленизма возможно проведение различных видов шунтирования.
Прогноз заболевания
Исход тромбоза различен. К благоприятным относят асептический аутолиз тромба, возникающий под влиянием протеолитических ферментов лейкоцитов. Мелкие тромбы могут полностью подвергаться асептическому аутолизу. Чаще тромбы, особенно крупные, замещаются соединительной тканью, т. е. организуются. Врастание соединительной ткани в тромб начинается в области головки со стороны интимы сосуда, далее вся масса тромба замещается соединительной тканью, в которой появляются щели или каналы, выстланные эндотелием, происходит т. н. канализация тромба. Позже выстланные эндотелием каналы превращаются в сосуды, содержащие кровь, в таких случаях говорят о васкуляризации тромба, что нередко восстанавливает проходимость сосуда для крови. Однако организация тромба не всегда заканчивается его канализацией и васкуляризацией. Возможны обызвествление тромба, его петрификация; в венах при этом иногда возникают камни – флеболиты [3, 9, 10, 13].
К неблагоприятным исходам тромбоза относят: • отрыв тромба или его части и превращение в тромбоэмбол, который является источником тромбоэмболии; • септическое расплавление тромба, возникающее при попадании в тромботические массы пиогенных бактерий, что ведет к тромбобактериальной эмболии сосудов различных органов и тканей (при сепсисе). Прогноз при ТВВ полностью определяется этиологией данного заболевания. У взрослых с ТВВ 10-летняя выживаемость составляет, по разным данным, 38–60 % [9, 21]. Пациенты погибают в основном от осложнений фоновых заболеваний (ЦП, рак печени). Смертность от кровотечений из ВРВ у пациентов с ТВВ без ЦП не превышает 5 %, в то время как при ЦП этот показатель равняется 30–70 % [9,21].
В заключение следует отметить, что ТВВ является серьезным заболеванием, нуждающимся в немедленной диагностике и интенсивном лечении с целью профилактики осложнений, таких как формирование кавернозной трансформации и прогрессирование ПГ. Выживаемость пациентов с портальными тромбозами напрямую зависит от быстроты и тщательности диагностики, использования современных методов инструментального и лабораторного обследования и визуализации тромбоза, оценки сопутствующих тромбофилических состояний, увеличивающих риск возникновения осложнений. Ранняя антикоагулянтная и антиагрегантная терапия способствует реперфузии тромбированных участков вен портальной системы и, несмотря на риск возникновения желудочно-кишечных кровотечений, необходима пациентам с ТВВ, а также с диагностированной ПГ и кавернозной трансформацией ВВ.
Практические основы
Тромбоз воротной вены (ТВВ) все чаще распознается с помощью УЗИ. Снижение портального кровотока, вызванное заболеванием паренхимы печени и сепсисом в брюшной полости (т. е. инфекционным или восходящим тромбофлебитом), являются основными причинами.
ТВВ является частым осложнением цирроза печени, и его распространенность увеличивается с тяжестью заболевания печени: от 1% у пациентов с компенсированным циррозом печени до 8-25% у кандидатов на трансплантацию печени.
Правильный диагноз и характеристика ТВВ важны для прогноза и дальнейшего лечения. Тромбоз воротной вены является плохим прогностическим показателем, который обнаруживается при диагностике у 10-40% пациентов с гепатоцеллюлярной карциномой (ГЦК). Выживаемость составляет примерно 2-4 месяца.
CEUS позволяет детально визуализировать микроциркуляторное русло печеночной системы, очаговые поражения печени и тромбоз воротной вены. Злокачественные тромбы имеют тот же паттерн усиления, что и опухоль, из которой они возникли, включая быстрое повышение артериальной фазы и медленное или слабое вымывание в воротной вене.
Лечение тромбофлебита поверхностных вен
Основные лечебные мероприятия сводятся к эластической компрессии (эластический бинт или компрессионный трикотаж), назначении лекарственных препаратов.
Из лекарственных средств применяются флеботропные препараты (детралекс, флебодиа), антиагреганты (тромбо-АСС), противовоспалительные препараты (вольтарен). Местно применяют лиотон-гель.
Всем пациентам необходимо УЗИ вен для исключения сопутствующего тромбоза глубоких вен и уточнения распространенности тромбофлебита поверхностных вен.
Причины тромбоза в системе верхней полой вены
Причины тромбоза в системе верхней полой вены – в основном те же, что и других венозных тромбозов. Может, также, развиться как осложнение катетеризации вен (кубитальный, подключичный катетер), иногда возникает как следствие длительного сдавления или неудобного положения верхней конечности (например, во сне).
Наиболее часто встречается тромбоз подмышечной или подключичной вены (синдром Педжета-Шреттера). В течение суток возникает отек всей верхней конечности с подушкообразным отеком кисти. Могут быть небольшие распирающие боли. Цвет конечности не изменен, либо слегка цианотичный.