Клиническая картина
Проявления кардиопатии отличаются, в зависимости от ее формы. Для застойной разновидности болезни характерны следующие признаки:
- болевые ощущения давящего и ноющего характера в груди, не купируемые «Нитроглицерином»;
- появление признаков цианоза на лице (посинения кожи);
- деформация грудной клетки из-за гипертрофии сердца (появление «сердечного горба»).
Признаки застойной кардиопатии прогрессируют крайне быстро. Постепенно болезнь приводит к ограничению возможности двигаться.
Рестриктивная форма патологии проявляется следующими симптомами:
- болевые ощущения в области сердца;
- одышка при любой физической активности;
- отеки лица;
- рост живота.
Диагностируется рестриктивная разновидность болезни преимущественно в тропиках. Физическая активность больного значительно снижается из-за усугубляющегося состояния.
Гипертрофический вид недуга имеет ярко выраженную симптоматику:
- острая боль в груди;
- проявление аритмии;
- постоянная одышка;
- потеря сознания;
- головокружение.
Постепенно развивающаяся сердечная недостаточность усугубляет состояние больного. В запущенных случаях даже при легкой физической нагрузке возможен летальный исход.
Для ишемической кардиопатии свойственны такие симптомы:
- аритмия;
- болевые ощущения в сердце;
- частая одышка;
- общая слабость;
- нехватка кислорода;
- чрезмерное потоотделение;
- побледнение кожного покрова;
- потеря сознания.
Симптомы становятся более выраженными при физической нагрузке. Сердечная недостаточность из-за ишемии быстро прогрессирует и может привести к отрыву тромба и летальному исходу.
Проявление вторичного типа патологии зависит от локализации и выраженности первичного патологического процесса. Чаще всего она выражается следующими симптомами:
- чрезмерная потливость;
- отеки;
- ощущение сдавливания в области сердца;
- кашель;
- частая одышка.
Вторичная кардиопатия у детей обычно прогрессирует по мере развития первичного заболевания. Во время диагностики врачи видят ее в виде нарушения целостности миокарда.
Функциональная разновидность проявляется признаками вегетососудистой дистонии:
- предобморочное состояние;
- приступы одышки;
- аритмии (преимущественно тахикардии, экстрасистолии);
- чрезмерное потоотделение.
Развитие болезни зависит от степени перегрузки ребенка. Если проблему не выявить своевременно, то избежать серьезных патологических изменений миокарда не удастся.
Обнаружить кардиопатию как у новорожденных, так у детей в подростковом периоде, затруднительно. Симптомы, свойственные болезни, чаще всего приписывают прочим патологиям сердечно-сосудистой системы. Поставить точный диагноз врач может лишь с помощью комплексного инструментального обследования.
Осложнения
Малая аномалия развития сердца (кардиопатия) опасна не только своими проявлениями, но и осложнениями. Они способны сформироваться при несвоевременном установлении диагноза и отсутствии лечения. При дисплатической кардиопатии возможны следующие последствия:
- стенокардия;
- ишемическая болезнь сердца;
- артериальная гипертензия;
- перикардит;
- отек легких;
- аритмия;
- тромбоз;
- хроническая сердечная недостаточность.
Наиболее распространенным осложнением считается аритмия. Она появляется практически у 10% от всего числа заболевших детей. Кардиопатия приводит к нарушению нормальной проводимости электрических импульсов в кардиомиоцитах. В результате сердечные сокращения становятся нерегулярными. Чаще всего отмечается ускорение количества ударов в минуту.
При расширении желудочков, когда заболевание протекает длительно, кровь в полостях застаивается. Создаются условия для формирования сгустков.
Наибольшую опасность представляют тромбы, которые попадают в кровоток (эмболы) и со временем они могут проникнуть в сосуды узкого диаметра. Такая особенность характерна для легочной и мозговой ткани. Закупорка просвета в них приведет к тробоэмболии.
Причины
Кардиопатия у детей преимущественно развивается по таким причинам:
- Генетика. Кардиомиоциты (клетки сердца) состоят из белков. Они принимают участия во всех процессах, выполняемых сердечной мышцей. Закладывается информация о структуре клеток сердца на генетическом уровне. Если у малыша есть дефектный ген, то существует вероятность неправильного развития основного органа. В этом случае речь идет о первичной форме кардиопатии.
- Инфекционная или токсичная природа. На развитие кардиопатии могут влиять токсины и инфекции, попадающие в организм. Выявляют их не сразу из-за частого отсутствия выраженных симптомов. Нарушения работы клапанов или коронарных сосудов не выявляются.
- Аутоимунные сбои. Нарушения в работе иммунной системы в основном возникают из-за инфекций, токсинов и гормональных всплесков. Организм начинает уничтожать собственные клетки, тем самым вызывая вторичные патологии.
- Фиброз (кардиосклероз). Замещение тканей сердца соединительными волокнами приводит к нарушению сократительной способности из-за потери эластичности. Наиболее часто возникает фиброз после пережитого инфаркта миокарда, поэтому его природа преимущественно вторичная.
Перечисленные случаи считаются основными, но врачам удается лишь купировать их проявления. Устранить причины фактически невозможно из-за отсутствия эффективных средств лечения.
Среди патологий сердечно-сосудистой системы, оказывающих влияние на развитие кардиопатии, можно выделить наиболее основные:
- гипертоническая болезнь;
- ишемия сердца;
- амилоидная дистрофия (сбой в белковом обмене);
- нарушения в эндокринной системе;
- отравление токсинами;
- болезни соединительных тканей.
Характеристика заболевания
Основная функция сердечной мышцы заключается в ритмичном сокращении, что обеспечивает выталкивание крови по сосудам и наполнение полостей органа. Такая способность обеспечивается благодаря кардиомиоцитам. Непрерывное их функционирование поддерживает обмен веществ на необходимом для работы уровне.
Под действием неблагоприятных факторов, со временем представленные процессы нарушаются. Это проявляется формированием структурных изменений, что заканчивается ослаблением сократительной способности.
Функциональная кардиопатия
При провисании митрального клапана и обилии сухожильных нитей врач ставит диагноз функциональная кардиопатия. Подобные нарушения в строении сокращенно называются МАРС (малыми аномалиями развития сердца). Они способствуют возникновению приступов аритмии при физической активности. Если ребенок будет продолжать перенапрягаться (на физкультуре, при игре с друзьями, занимаясь на секции), то со временем начнет развиваться сердечная недостаточность.
Составление схемы лечения кардиологом потребуется при наличии у ребенка стойкой аритмии и проявлений митральной регургитации (обратного оттока крови). В качестве средств лечения врачом будут назначены медикаменты на основе магния и антиаритмические препараты. Не менее важно составить график дня, чтобы убрать нагружающие сердце мероприятия.
При выявлении функциональной кардиопатии, независимо от ее тяжести, родители должны оградить своего ребенка от физических и умственных перегрузок и соблюдать все рекомендации кардиолога. Самостоятельно использовать препараты для коррекции ритма сердца, а также увеличивать или уменьшать указанные в схеме лечения дозировки недопустимо. Сердечная мышца ребенка еще не до конца не окрепла, а наличие патологических изменений в структуре миокарда лишь усугубляет ситуацию, поэтому только врач может назначать курс терапии и изменять его.
Для насыщения сердца полезными веществами потребуется изменить рацион питания ребенка. Из него желательно убрать сладости, фаст-фуд и другую вредную пищу в пользу овощей и фруктов, богатых витаминами и микроэлементами.
Что это такое?
Под термином «диспластическая кардиопатия» понимают группу нарушений в сердечной мышце не воспалительного происхождения. Патология формируется при недостаточном обмене веществ в миокарде. Кардиопатия нередко устанавливается при наличии порока митрального клапана или обнаружении дополнительной хорды (сухожилие) в левом желудочке.
Эластичные волокна стенки сердца постепенно замещаются на соединительную ткань, не обладающую такой способностью. Заболевание сопровождается функциональными и структурными изменениями в миокарде.
Патологии коронарных артерий, створок клапанов и артериальной гипертензии в начальной стадии не наблюдается. Со временем, при ослаблении компенсаторных возможностей миокарда, присоединяются осложнения.
Вторичная форма болезни
Вторичная кардиопатия у детей является следствием другого патологического процесса. Зачастую причиной его развития становятся следующие состояния организма:
- гормональные перестройки;
- нарушения обменных процессов;
- отравление токсическими веществами.
Лечение вторичной формы патологии назначается лечащим врачом после обследования, целью которого является определение истинной причины развития. Суть терапии будет основана на коррекции питания, снижении нагрузок на сердце и устранение основного патологического процесса.
Наши возможности
При подозрении или ранее выявленной атипичной желудочковой хорде рекомендованы следующие обследования:
- Эхокардиография – наиболее информативный метод диагностики различных патологий сердца. В ходе исследования врач оценивает структуру и сократимость миокарда, работу клапанов, движение крови в камерах сердца и другие показатели.
- ЭКГ покоя – базовое исследование для оценки сердечного ритма. Не требует специальной подготовки.
Все диагностические тесты вы можете пройти в любом из отделений KinderKlinik с последующей консультацией специалиста.
Нужна консультация?
Записаться
Форма обратного вызова
Заявка отправлена, мы свяжемся с вами скоро
Прогноз
Кардиопатия у детей имеет благоприятный прогноз лишь при раннем выявлении. Своевременно остановленный патологический процесс позволит ребенку прожить до старости, но ему придется соблюдать рекомендации специалистов и вести здоровый образ жизни. При позднем выявлении кардиопатии возможно развитие осложнений, приводящих в инвалидности и летальному исходу.
Хирургическое лечение (в случае успеха) продлевает жизнь больному, способно устранить основную причину развития кардиопатии. Минусом операции является высокий риск летального исхода. По статистике, на операционном столе во время хирургического вмешательства на сердце умирает каждый 6 человек.
Кардиопатия в последние годы диагностируется все чаще. Специалисты утверждают, что вина лежит на ухудшающейся экологии и употреблении ненатуральных продуктов. В детском возрасте ее можно остановить без смертельных для организма осложнений, если начать лечение своевременно. Основу терапии составляют антиаритмические и магнийсодержащие препараты, коррекция образа жизни. Тяжелые случаи требуют оперативного вмешательства.
Синдром соединительнотканной дисплазии сердца у детей
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки. По современным представлениям синдром соединительнотканной дисплазии определяют как самостоятельный синдром полигенно-мультифакториальной природы, проявляющийся внешними фенотипическими признаками в сочетании с диспластическими изменениями соединительной ткани и клинически значимой дисфункцией одного или нескольких внутренних органов (В. А. Гаврилова, 2002).
Под термином «дисплазия соединительной ткани сердца» (ДСТС) подразумевается аномалия тканевой структуры, в основе которой лежит генетически детерминированный дефект синтеза коллагена. Синдром ДСТС был выделен в самостоятельную нозологическую форму на симпозиуме в г. Омске (1990), посвященном проблеме врожденной дисплазии соединительной ткани. Проблема синдрома ДСТС привлекает к себе внимание в связи с большим риском развития таких осложнений, как нарушения ритма и проводимости сердца, инфекционный эндокардит, тромбоэмболия различных сосудов и внезапная сердечная смерть.
Высокая частота синдрома ДСТС при различных заболеваниях свидетельствует о системности поражения, что связано с «вездесущностью» соединительной ткани, составляющей строму всех органов и тканей.
Диспластическое сердце — сочетание конституциональных, топографических, анатомических и функциональных особенностей сердца у человека с дисплазией соединительной ткани (ДСТ). В западной литературе используется термин «миксоидная болезнь сердца» (Morales A. B., Romanelli B. E. A., 1992), однако эта формулировка используется преимущественно зарубежными авторами.
Частота диспластического сердца составляет 86% среди лиц с первичной недифференцированной ДСТ (Г. Н. Верещагина, 2008).
По современным представлениям к синдрому ДСТС относят пролапсы клапанов сердца, аневризмы межпредсердной перегородки и синусов Вальсальвы, эктопически крепящиеся хорды митрального клапана и многие другие.
В основе патологии лежит неполноценность внеклеточного матрикса, его коллагеновых структур.
Диспластическое сердце формируют:
I. Конституциональные особенности — «капельное», «висячее» сердце, поворот его вокруг сагиттальной и продольной оси.
II. Костно-вертебральные дисплазии и деформации со сдавлением, ротацией, смещением сердца и перекрутом крупных сосудов: по данным Урмонаса В. К. и др. (1983). Деформации грудной клетки и позвоночника приводят к развитию торако-диафрагмального синдрома, ограничивающего работу всех органов грудной клетки.
III. Особенности строения сердца и сосудов:
- избыточность ткани створок митрального, трикуспидального и аортального клапанов;
- пролабирование створок митрального клапана (ПМК) с регургитацией;
- миксоматозная дегенерация створок, хорд, клапанного кольца;
- вальвулярно-вентрикулярная диссоциация;
- двустворчатый аортальный клапан;
- удлинение, избыточная подвижность хорд;
- эктопически крепящиеся хорды;
- повышенная трабекулярность левого желудочка (ЛЖ);
- открытое овальное окно;
- аневризма межпредсердной перегородки (небольшая);
- дилятация синусов Вальсальвы;
- вентрикуло-септальные особенности ЛЖ: транзиторный систолический валик верхней трети межжелудочковой перегородки (МЖП), S-образный изгиб МЖП;
- извитость, гипоплазия, аплазия, фибромускулярная дисплазия коронарных артерий;
- аневризмы коронарных артерий;
- миокардиальные мостики;
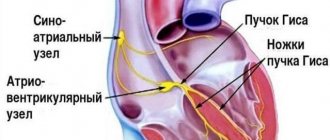
- аномалии проводящей системы;
- расширение проксимальной части аорты, легочного ствола;
- гипоплазия аорты, погранично узкий корень аорты, гипоплазия легочного ствола;
- системная несостоятельность венозной стенки — варикозное расширение вен верхних и нижних конечностей, малого таза, вульвы, варикоцеле.
IV. Патология органов дыхания со снижением жизненной емкости легких:
- диффузная и буллезная эмфизема;
- множественные свищи;
- повторные спонтанные пневмотораксы;
- бронхоэктазы;
- кистозная гипоплазия легких.
Миксоматозная дегенерация створок, хорд, подклапанных структур — генетически детерминированный процесс разрушения и утраты архитектоники коллагеновых и эластических структур соединительной ткани с накоплением в рыхлом фиброзном слое кислых мукополисахаридов. При этом признаки воспаления отсутствуют. В основе — дефект синтеза коллагена III типа, что приводит к истончению фиброзного слоя, створки увеличены, рыхлые, избыточные, края закручены, иногда определяется бахрома. Первичный локус аутосомно-доминантного миксоматоза при ПМК локализован в хромосоме 16. Morales A. B. (1992) выделяет миксоидную болезнь сердца.
В популяционных исследованиях феномен ПМК выявлен у 22,5% детей в возрасте до 12 лет. У детей с ДСТ ПМК обнаруживается значительно чаще — у 45–68%.
Клинические проявления ПМК у детей варьируют от минимальных до значительных и определяются степенью соединительнотканной дисплазии сердца, вегетативными и психоневрологическими отклонениями.
Большинство детей старшего возраста жалуются на кратковременные боли в грудной клетке, сердцебиение, одышку, ощущение перебоев в сердце, головокружение, слабость, головные боли. Боли в сердце дети характеризуют как колющие, давящие, ноющие и ощущают в левой половине грудной клетки без какой-либо иррадиации. Они возникают в связи с эмоциональным напряжением и сопровождаются, как правило, вегетативными нарушениями: неустойчивым настроением, похолоданием конечностей, сердцебиением, потливостью, проходят самопроизвольно или после приема седативных средств. Отсутствие в большинстве случаев ишемических изменений в миокарде по данным комплексного обследования позволяет расценить кардиалгии как проявление симпаталгии, связанной с психоэмоциональными особенностями детей с ПМК. Кардиалгии при ПМК могут быть связаны с региональной ишемией папиллярных мышц при их чрезмерном натяжении. С нейровегетативными нарушениями также связаны сердцебиение, ощущение «перебоев» в работе сердца, «покалывание», «замирание» сердца. Головные боли чаще возникают при переутомлении, переживаниях, в утренние часы перед началом занятий в школе и сочетаются с раздражительностью, нарушением сна, тревогой, головокружением.
При аускультации характерными признаками пролапса митрального клапана являются изолированные щелчки (клики), сочетание щелчков с позднесистолическим шумом, изолированный позднесистолический шум, голосистолический шум.
Происхождение шума связано с турбулентным током крови, связанным с выбуханием створок и вибрацией натянутых хорд. Позднесистолический шум выслушивается лучше в положении лежа на левом боку, усиливается при проведении пробы Вальсальвы. Характер шума может меняться при глубоком дыхании. На выдохе шум усиливается и иногда приобретает музыкальный оттенок. Нередко сочетание систолических щелчков и позднего шума наиболее отчетливо выявляется в вертикальном положении после физической нагрузки. Иногда при сочетании систолических щелчков с поздним шумом в вертикальном положении может регистрироваться голосистолический шум.
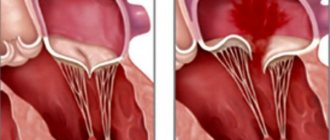
Голосистолический шум при первичном пролапсе митрального клапана наблюдается редко и свидетельствует о наличии митральной регургитации. Этот шум занимает всю систолу и практически не меняется по интенсивности при перемене положения тела, проводится в подмышечную область, усиливается при проведении пробы Вальсальвы.
Основными методами диагностики ПМК являются двухмерная Эхо-КГ и допплерография. ПМК диагностируют при максимальном систолическом смещении створок митрального клапана за линию кольца митрального клапана в парастернальной продольной позиции на 3 мм и более. Наличия изолированного смещения передней створки за линию кольца митрального клапана в четырехкамерной верхушечной позиции недостаточно для диагностики ПМК, это служит основной причиной его гипердиагностики.
Эхо-КГ-классификация миксоматозной дегенерации (МД) (Г. И. Сторожаков, 2004):
- МД 0 — признаков нет.
- МД I — минимально выраженная: утолщение створок 3–5 мм, аркообразная деформация митрального отверстия в пределах 1–2 сегментов. Смыкание створок сохранено.
- МД II — умеренно выраженная: утолщение створок 5–8 мм, удлинение створок, деформация контура митрального отверстия, его растяжение, нарушение смыкания створок. Митральная регургитация.
- МД III — резко выраженная: утолщение створок больше 8 мм, створки удлинены, множественные разрывы хорд, значительное расширение митрального кольца, смыкание створок отсутствует. Многоклапанное поражение. Дилятация корня аорты. Митральная регургитация.
Степень регургитации при ПМК зависит от наличия и выраженности миксоматозной дегенерации, количества пролабирующих створок и глубины пролабирования.
Степени регургитации:
- 0 — регургитация не регистрируется.
- I — минимальная — струя регургитации проникает в полость левого предсердия не более чем на одну треть предсердия.
- II — средняя — струя регургитации достигает середины предсердия.
- III — тяжелая — регургитация по всему левому предсердию.
В состоянии покоя митральная регургитация (МР) первой степени диагностируется у 16–20%, вторая степень — у 7–10% и третья степень — у 3–5% детей с ПМК.
Прогноз больного с ПМК определяет степень митральной регургитации. При этом любая степень пролабирования приводит к изменениям перфузии миокарда, изменениям чаще в области передней стенки ЛЖ и межжелудочковой перегородки (Нечаева Г. И., Викторова И. А., 2007)).
Тяжелые осложнения при ПМК у детей встречаются нечасто. Ими являются: жизнеугрожаемые аритмии, инфекционный эндокардит, тромбоэмболия, острая либо хроническая митральная недостаточность и даже внезапная смерть.
Острая митральная недостаточность возникает из-за отрыва сухожильных нитей от створок митрального клапана (синдром «болтающегося» клапана — loppy mitral valve), в детском возрасте наблюдается казуистически редко и в основном связана с травмой грудной клетки у больных на фоне миксоматозной дегенерации хорд. Основным патогенетическим механизмом острой митральной недостаточности является легочная венозная гипертензия, возникающая из-за большого объема регургитации в недостаточно растяжимое левое предсердие. Клиническая симптоматика проявляется внезапным развитием отека легких.
У детей митральная недостаточность при ПМК протекает чаще всего бессимптомно и диагностируется при допплерэхокардиографическом исследовании. В последующем при прогрессировании регургитации появляются жалобы на одышку при физической нагрузке, снижение физической работоспособности, слабость, отставание в физическом развитии.
Факторами риска развития «чистой» (не воспалительной) митральной недостаточности при синдроме пролабирования по данным двухмерной эхокардиографии являются:
- Дилятация левого атриовентрикулярного отверстия.
- Пролапс преимущественно задней митральной створки.
- Утолщенность задней митральной створки.
ПМК является высоким фактором риска возникновения инфекционного эндокардита. Абсолютный риск возникновения заболевания выше, чем в популяции, в 4,4 раза.
Диагностика инфекционного эндокардита при ПМК представляет определенные трудности. Поскольку створки при пролапсе избыточно фестончатые, это не позволяет выявить начало формирования бактериальных вегетаций по данным эхокардиографии. Поэтому основное значение в диагностике эндокардита играют: 1) клиническая симптоматика инфекционного процесса (лихорадка, ознобы, сыпь, и другие симптомы), 2) появление шума митральной регургитации и факт обнаружения возбудителя при повторных высевах крови.
Частота внезапной смерти при синдроме ПМК зависит от многих факторов, основными из которых являются электрическая нестабильность миокарда при наличии синдрома удлиненного интервала QT, желудочковых аритмий, сопутствующая митральная недостаточность, нейрогуморальный дисбаланс.
Риск внезапной смерти при отсутствии митральной регургитации низкий и не превышает 2:10 000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50–100 раз.
В большинстве случаев внезапная смерть у больных с ПМК носит аритмогенный генез и обусловлена внезапным возникновением идиопатической желудочковой тахикардии (фибрилляции) или на фоне синдрома удлиненного интервала QT.
В редких случаях в основе внезапной сердечной смерти у больных с ПМК может лежать врожденная аномалия коронарных артерий (аномальное отхождение правой или левой коронарной артерии), приводящая к острой ишемии миокарда и его некрозу.
Таким образом, основными факторами риска внезапной смерти у детей с синдромом ПМК являются: желудочковые аритмии III–V градации по Lown; удлинение корригированного интервала QT более 440 мс; появление ишемических изменений на ЭКГ во время физической нагрузки; кардиогенные обморочные состояния в анамнезе.
ДСТС являются одними из неблагоприятных факторов, предрасполагающих к развитию аритмических осложнений в детском и подростковом возрасте, в том числе гемодинамически значимых. В структуре нарушений ритма у детей с ДСТС чаще выявляются наджелудочковая экстрасистолия в патологическом количестве и желудочковая экстрасистолия, взаимосвязанные со степенью кардиальной дисплазии (Гнусаев С. Ф., соавт., 2006).
Морфологическими проявлениями синдрома ДСТС у детей с сопутствующей патологией почек, по данным Домницкой Т. М., Гавриловой В. А. (2000), являются: шаровидная или треугольная форма сердца, закругление верхушки сердца, увеличение массы сердца в 1,4–2,5 раза, утолщение и укорочение хорд митрального клапана, отхождение хорд в виде веера, гипертрофия сосочковых мышц, воронкообразная форма митрального клапана, открытое овальное окно. Миксоматозная дегенерация створок атриовентрикулярных клапанов наблюдалась у большинства больных с синдромом ДСТС и заболеваниями органов мочевой системы (частота ее колебалась от 66,7% до 77%). Фиброэластоз эндокарда был выявлен у 10 детей анализируемой группы.
В популяции детей наиболее часто выявлялись смещение септальной створки трехстворчатого клапана в полость желудочка в пределах 10 мм, нарушенное распределение хорд передней створки митрального клапана, дилятация синусов Вальсальвы, увеличенная евстахиева заслонка более 1 см, дилятация ствола легочной артерии, ПМК, диагонально расположенные трабекулы в полости левого желудочка.
Тактика ведения детей с первичным ПМК различается в зависимости от степени выраженности пролабирования створок, характера вегетативных и сердечно-сосудистых изменений. Основными принципами лечения являются: 1) комплексность; 2) длительность; 3) учет направленности функционирования вегетативной нервной системы.
Обязательным является нормализация труда, отдыха, распорядка дня, соблюдение правильного режима с достаточным по продолжительности сном.
Вопрос о занятиях физкультурой и спортом решается индивидуально после оценки врачом показателей физической работоспособности и адаптивности к физической нагрузке. Большинство детей при отсутствии митральной регургитации, выраженных нарушений процесса реполяризации и желудочковых аритмий удовлетворительно переносят физическую нагрузку. При наличии врачебного контроля им можно вести активный образ жизни без каких-либо ограничений физической активности. Детям можно рекомендовать плавание, лыжи, коньки, катание на велосипеде. Не рекомендуются спортивные занятия, связанные с толчкообразным характером движений (прыжки, борьба каратэ и др.). Обнаружение у ребенка митральной регургитации, желудочковых аритмий, изменений обменных процессов в миокарде, удлинения интервала QT диктует необходимость ограничения физической активности и занятий спортом. Этим детям разрешается занятие лечебной физкультурой под контролем врача.
Лечение строится по принципу общеукрепляющей и вегетотропной терапии. Весь комплекс терапевтических мероприятий должен строиться с учетом индивидуальных особенностей личности больного и функционального состояния вегетативной нервной системы.
Важной частью комплексного лечения детей с ДСТС является немедикаментозная терапия: психотерапия, аутотренинг, физиотерапия (электрофорез с магнием, бромом в области верхнешейного отдела позвоночника), водные процедуры, иглорефлексотерапия, массаж позвоночника. Внимание врача должно быть направлено на санацию хронических очагов инфекции, по показаниям проводится тонзиллэктомия.
Медикаментозная терапия должна быть направлена на: 1) лечение вегетативно-сосудистой дистонии; 2) предупреждение возникновения нейродистрофии миокарда; 3) психотерапию; 4) антибактериальную профилактику инфекционного эндокардита.
При умеренных проявлениях симпатикотонии назначается фитотерапия седативными травами, настойка валерианы, пустырника, сбор трав (шалфей, багульник, зверобой, пустырник, валериана, боярышник), обладающий одновременно легким дегидратационным эффектом. При наличии изменений процесса реполяризации на ЭКГ, нарушениях ритма проводятся курсы лечения препаратами, улучшающими обменные процессы в миокарде (панангин, карнитин, Кудесан, витамины). Карнитин назначают в дозе 50 мг/кг в сутки на 2–3 мес. Карнитин выполняет центральную роль в липидном и энергетическом обмене.
Являясь кофактором бета-окисления жирных кислот, он переносит ацильные соединения (жирные кислоты) через митохондриальные мембраны, предупреждает развитие нейродистрофии миокарда, улучшает его энергетический обмен. В наших исследованиях 35 детям с экстрасистолией (более 15 в одну минуту) в состав комплексной терапии был включен карнитин. По окончании лечения у 25 детей экстрасистолия значительно уменьшилась, у 10 детей — не определялась.
Отмечен благоприятный эффект от применения препарата Коэнзим Q10®, который значительно улучшает биоэнергетические процессы в миокарде и особенно эффективен при вторичной митохондриальной недостаточности.
Ранняя диагностика ДСТ у детей позволяет осуществлять соответствующую реабилитационную терапию и предотвращать прогрессирование заболевания. Одним из наиболее ярких терапевтических результатов является эффективное лечение детей с ДСТ (главным образом с ПМК) при помощи магнийсодержащего препарата магния оротата — Магнерот®. Выбор препарата был обусловлен известными свойствами иона магния, отмечающимися у антиаритмических препаратов I и IV класса (мембраностабилизирующие и антагонисты кальция), а также отсутствием побочных эффектов, которые могут появляться при применении традиционной антиаритмической терапии. Учитывалось также и то, что действующим веществом препарата является магния оротат, который, индуцируя синтез протеинов, участвуя в обмене фосфолипидов, являющихся составной частью клеточных мембран, необходим для фиксации внутриклеточного магния (Громова О. А., 2007).
Препарат Магнерот® применялся в виде монотерапии в дозе 40 мг/кг в сутки в течение первых 7 дней приема, затем по 20 мг/кг в сутки в течение 6 месяцев. Результатом лечения явилось уменьшение на 20–25% глубины пролабирования створок митрального клапана и уменьшение степени регургитации на 15–17%. Терапия препаратом Магнерот® не влияла на размеры левых отделов сердца и сократимость миокарда, показатели которых до лечения находились в пределах нормы.
В исследованиях, проведенных Е. Н. Басаргиной (2008), выявлен антиаритмический эффект препарата Магнерот®. При проведении суточного мониторирования ЭКГ у детей 2-й и 3-й групп было отмечено уменьшение количества желудочковых комплексов на 50% и более у 18 (27,7%) больных. Причем у 6 детей отмечено исчезновение желудочковой аритмии или уменьшение количества желудочковых комплексов до 30–312 за сутки. У 14 (21,5%) детей количество желудочковых комплексов уменьшилось не менее чем на 30%. У двух больных отмечено увеличение количества желудочковых экстрасистол до 30% от исходного уровня. Таким образом, антиаритмическая эффективность препарата Магнерот® составила 27,7%. Подобные результаты ранее получены и в других исследованиях (Домницкая Т. М. и соавт., 2005).
В то же время редкие суправентрикулярные и желудочковые экстрасистолы, если не сочетаются с синдромом удлиненного интервала QT, как правило, не требуют назначения каких-либо антиаритмических препаратов.
Таким образом, дети с синдромом ДСТС нуждаются в своевременной диагностике с использованием допплерэхокардиографии, электрокардиографии, в ряде случаев суточного мониторирования ЭКГ, назначении индивидуальной терапии и наблюдении детским кардиологом.
Терапия препаратом Магнерот® у детей с синдромом ДСТС приводит к уменьшению признаков пролапса клапанов, частоты выявления митральной регургитации, уменьшению выраженности клинических проявлений вегетативной дисфунуции, частоты желудочковых аритмий, сопровождается повышением уровня внутриэритроцитарного магния.
Литература
- Земцовский Э. В. Диспластические синдромы и фенотипы. Диспластическое сердце. Спб: «Ольга». 2007. 80 с.
- Гаврилова В. А. Синдром дисплазии соединительной ткани сердца у детей с заболеваниями органов мочевой системы. Автореф. дисс. д.м.н. М., 2002.
- Morales A. B., Romanelli B., Boucek R. J. et al. Myxoid heart disease: an assessment of extravalvular cardiac pathology in severe mitrae valve prolapse // Hum.Pathol. 1992, v. 23, № 2, p. 129–137.
- Верещагина Г. Н. Системная дисплазия соединительной ткани. Клинические синдромы, диагностика, подходы к лечению. Методическое пособие для врачей. Новосибирск, 2008, 37 с.
- Урмонас В. К., Кондрашин Н. И. Воронкообразная грудная клетка. Вильнюс: Мокслас, 1983, 115 с.
- Гнусаев С. Ф. Значение малых аномалий сердца у здоровых детей и при сердечно-сосудистой патологии. Автореф. дисс. д.м.н., М., 1996.
- Белозеров Ю. М., Гнусаев С. Ф. Пролапс митрального клапана у детей. М.: Мартис, 1995. 120 с.
- Сторожаков Г. И., Верещагина Г. С., Малышева Н. В. Оценка индивидуального прогноза при пролапсе митрального клапана // Кардиология, 2004, 4, с. 14–18.
- Нечаева Г. И., Викторова И. А. Дисплазия соединительной ткани: терминология, диагностика, тактика ведения пациентов. Омск: Изд-во «Типография Бланком», 2007. 188 с.
- Гнусаев С. Ф., Белозеров Ю. М., Виноградов А. Ф. Клиническое значение малых аномалий сердца у детей // Российский вестник перинатологии и педиатрии. 2006, № 4. С. 20–24.
- Домницкая Т. М., Гаврилова В. А. Синдром дисплазии соединительной ткани сердца у детей с заболеваниями мочевой системы / Материалы Второго Съезда педиатров-нефрологов России. М., 2000. С. 159.
- Громова О. А, Гоголева И. В. Применение магния в зеркале доказательной медицины и фундаментальных исследований в терапии // Фарматека. 2007, т. 146, № 12, с. 3–6.
- Басаргина Е. Н. Синдром дисплазии соединительной ткани сердца у детей // Вопросы современной педиатрии. 2008, т. 7, № 1, 129–133.
- Домницкая Т. М., Дьяченко А. В., Куприянова О. О., Домницкий М. В. Клиническая оценка использования оротата магния улиц молодого возраста с синдромом дисплазии соединительной ткани сердца // Кардиология. 2005; 45 (3): 76–81.
С. Ф. Гнусаев, доктор медицинских наук, профессор
ГОУ ВПО Тверская ГМА Росздрава, Тверь
Контактная информация об авторе для переписки
Методы диагностики
При подозрении на кардиопатию у ребенка врач проводит внимательный осмотр и опрашивает родителей о наличии симптоматики. Первичный осмотр делает педиатр, но более тщательная диагностика проводится под контролем кардиолога.
Детская кардиология использует следующие методы для диагностики сердечных патологий:
- Эхокардиография. Исследование заключается в обследовании грудной клетки при использовании ультразвукового аппарата. С его помощью специалист определяет параметры сердечной мышцы и его структурных элементов. Другое наименование процедуры – УЗИ сердца. Процедура позволяет выявить диспластическую патологию без применения других методов.
- ЭКГ. Электрокардиограмма регистрирует электрические сигналы, образующиеся при работе сердца. Аппарат фиксирует частоту сердечных сокращений, описывает физическое состояние сердца, указывает на наличие аритмичных движений.
- Фонокардиография. Этот метод является дополнением к УЗИ и ЭКГ. Он позволяет зафиксировать шумы, которые появляются при работе сердечной мышцы.
Дополнительно ребенку могут назначить анализы крови на определение генетических отклонений. В некоторых случаях нужно определить причину возникновения патологии. Для этого ему дают направление на общий анализ крови, КТ, МРТ.