Как часто встречается экстрасистолия?
Считается, что экстрасистолия в некоторые периоды жизни наблюдается у каждого человека. При однократной записи ЭКГ в группе здоровых лиц она обнаруживается в 1,5-5% случаев. Суточное мониторирование выявляет наджелудочковые экстрасистолии в 14-91% и желудочковые экстрасистолии у 46-89% здоровых лиц . Хотя большинство из них представлено единичными экстрасистолами, могут выявляться и сложные формы.
Как часто врачи сталкиваются с экстрасистолиями?
Врачи ежедневно сталкиваются с этим диагнозом. Экстрасистолии диагностируются у 50-70% всех пациентов с нарушением ритма, с ишемической болезнью сердца и сердечной недостаточностью.
Причины возникновения ЖЭС
ЖЭС — это всегда вторичное нарушение ритма сердца, а, значит, есть какая-то первопричина. Вот ее надо найти врачу, и на нее воздействовать.
Причины могут быть разные: от стресса и наличия вредных привычек – курения, алкоголя, переедания, до патологий сердечно-сосудистой системы – ИБС, стенокардия, гипертония, кардиомиопатия, пороки сердца, миокардит. Также причина может быть в патологиях других внутренних органов – легких, желудочно-кишечного тракта, онкологических заболеваниях.
Насколько желудочковая экстрасистолия опасное заболевание?
Обычно врачи никогда не говорят пациенту, что его жизни что-то угрожает, пока не проведут всестороннюю диагностику и не выявят первопричину заболевания. Бывают экстрасистолы безопасные, которые не стоит даже начинать лечить, бывают те, которые требуют немедленных действий!
Какая диагностика ЖЭС?
Главное — понять, угрожает ли экстрасистолия жизни пациента, может ли привести к самому грозному осложнению — внезапной сердечной смерти!
Сначала врач фиксирует жалобы пациента, потом направляет на функциональные исследования сердца. В первую очередь, на ЭКГ в 12 отведениях, затем на суточное холтеровское мониторирование, УЗИ сердца. Для исключения коронарной патологии — нагрузочные тесты. В зависимости от полученных результатов, можем назначить КТ, МРТ, гастроскопию, анализы крови, внутрисердечное электрофизиологическое исследование или генетическое обследование.
Всем ли пациентам показано лечение?
Не каждая ЖЭС требует коррекции. Иногда, наоборот, не стоит ее трогать, так как терапия может нанести еще больший вред здоровью.
Выбор тактики лечения зависит от того, есть ли у пациента органические поражения сердца или оно структурно нормальное.
В лечении необходимо добиваться трех целей: уменьшения симптомов, устранения гемодинамических нарушений, улучшения прогноза.
Но ключевая цель — профилактика внезапной сердечной смерти. Необходимо подчеркнуть, главное — определить, имеется ли у пациента на фоне экстрасистолии риск внезапной сердечной смерти.
Подходы и методики лечения
ЖЭС имеет вторичную природу, поэтому в начале лечения важно определить первичное заболевание и воздействовать на него.
Далее, это назначение лекарственных препаратов, в том числе антиаритмических, седативных, препаратов калия, магния.
При неэффективности лекарственной терапии назначается радиочастотная аблация или имплантация кардиовертер-дефибриллятора, если аритмия прогностически опасная.
Если нет поражения сердца, пациентам рекомендуется смена образа жизни. Исключение перееданий, тяжелой пищи, алкоголя, курения. Иногда экстрасистолия может уйти даже после отдыха, поездки в отпуск.
Желудочковая экстрасистолия — симптомы и лечение
После обнаружения у пациента желудочковой экстрасистолии лечение должно быть выбрано с учётом симптомов и наличия опасных видов экстрасистол.
Тактика ведения пациентов с желудочковой экстрасистолией залючается в следующем:
- наблюдение без назначения медикаментозных препаратов больных с доброкачественной ЖЭС, которая субъективно хорошо переносится (рекомендуется изменить образ жизни, питаться сбалансированно, исключить факторы провоцирующие возникновение аритмии, скорректировать физическую нагрузку и пр.);
- при функциональной желудочковой экстрасистолии (экстрасистолии, вызванной внесердечными болезнями) и экстрасистолиии, связанной с патологиями сердца, назначается медикаментозная терапия, направленная на лечение основного заболевания;
- лечение антиаритмическими препаратами;
- применение хирургического лечения (радиочастотная абляция аритмогенного участка миокарда, пересадка сердца).
Выделяют несколько основных направлений лечения в зависимости от течения, формы и выраженности ЖЭС.
1. Если у человека нет жалоб, а при исследовании выявляются редкие одиночные мономорфные преждевременные желудочковые комплексы, не вызывающие нарушения гемодинамики, особой терапии не требуется. В этом случае пациенту стоит отказаться от кофеинсодержащих и спиртных напитков, исключить курение, наладить режим дня, обеспечить полноценный сон и отдых. Если есть какие-либо нарушения функций организма, связанные с недостаточной подвижностью, нужно увеличить физическую активность в соответствии с возможностями организма. В то же время необходимо исключить чрезмерные физические нагрузки (поднятие тяжестей, занятия тяжёлой атлетикой). В рацион питания необходимо включать продукты, богатые калием и магнием: они оказывают благоприятное влияние на сердечно-сосудистую систему.
| Продукты, содержащие калий | Продукты, содержащие магний |
| ⠀•⠀курага; ⠀•⠀какао-порошок; ⠀•⠀отруби пшеничные; ⠀•⠀изюм; ⠀•⠀семена подсолнечника; ⠀•⠀орехи (кедровые, миндаль, арахис, грецкие); ⠀•⠀бобовые (горох, чечевица, фасоль); ⠀•⠀картофель в мундире; ⠀•⠀авокадо; ⠀•⠀белые грибы; ⠀•⠀бананы; ⠀•⠀цитрусовые плоды; ⠀•⠀капуста брюссельская и кольраби; ⠀•⠀молоко и кисломолочная продукция; ⠀•⠀крупы (овсяная, гречневая, перловая, рис); ⠀•⠀фрукты (персики, груши, арбуз, яблоки, чернослив, абрикосы, дыня); ⠀•⠀цикорий; ⠀•⠀овощи (морковь, шпинат, зеленый лук, баклажаны, огурцы); ⠀•⠀куриные яйца; ⠀•⠀рыба и мясо; ⠀•⠀яблочный сок. | ⠀•⠀масло (кунжутное, льняное, арахисовое); ⠀•⠀сыр (голландский, пошехонский, козий, с плесенью); ⠀•⠀творог (обезжиренный и нежирный, творожные сырки); ⠀•⠀горький шоколад; ⠀•⠀почти все виды мяса; ⠀•⠀рыба (палтус, осётр, окунь, пикша, треска, сайра); ⠀•⠀утиные яйца; ⠀•⠀крупы (геркулес, нут, горох, гречка, коричневый рис, чечевица); ⠀•⠀фрукты и ягоды (черешня, киви, ананас, фейхоа, малина, груша, персик, хурма); ⠀•⠀многие сорта чая (например, «Иван-чай») и соки; ⠀•⠀имбирь; ⠀•⠀горчица; ⠀•⠀ваниль. |
2. При выявлении приступов экстрасистолии, которые сопровождаются клинической симптоматикой, но не нарушают гемодинамику и имеют доброкачественное течение, в первую очередь назначают бета-адреноблокаторы («Бисопролол», «Метопролол»). Иногда, особенно при функциональной желудочковой аритмии на фоне вегето-сосудистой дистонии и стрессовых состояний, в комплексном лечении помогают препараты с седативным («Валемидин», «Валериана») и противотревожным действием («Стрезам», Адаптол), препараты магния («Магнерот», «Магне В6 форте»). Необходимо подчеркнуть, что количество ЖЭС учитывается при определении степени её злокачественности. Частая (до 1000 и более в сутки) желудочковая экстрасистолия сама по себе, даже при отсутствии очевидного заболевания сердца, является показанием к проведению антиаритмической терапии.
Частая ЖЭС, появление парных, политопных экстрасистол нарушает движение крови по сосудам, поэтому для снижения риска появления фибрилляции желудочков и остановки сердца назначаются антиаритмические препараты. Предпочтительнее использование антиаритмиков I класса, и лишь при их неэффективности — «Амиодарона» или «Соталола». Параллельно обязательно применяются препараты для лечения основного заболевания, вызвавшего экстрасистолию[10]. Для оценки результатов лечения, как правило, проводится суточное ЭКГ-мониторирование. Снижение числа ЖЭС на 75-80 % свидетельствует об эффективности терапии.
3. При ЖЭС злокачественного характера необходимо назначение высокоэффективных препаратов, таких как «Амиодарон» и «Соталол». Иногда их сочетают с поддерживающими дозами бета-адреноблокаторов. Лечение обычно проводится в условиях стационара, под контролем ЭКГ. В стационаре больше возможностей, чтобы скорректировать гемодинамику и значительно уменьшить риск летального исхода у больных с нарушениями ритма сердца.
Антиаритмики I класса не следует принимать, если у больного имеются следующие патологии:
- выраженные признаки сердечной недостаточности (низкая фракция выброса по данным эхокардиографии);
- острые формы ишемической болезни сердца (острый инфаркт, прогрессирующая стенокардия);
- перенесённый инфаркт миокарда (особенно при его давности менее 6-12 месяцев);
- стенокардия III и IV функциональных классов (особенно при доказанном коронарном атеросклерозе);
- выраженная гипертрофия левого желудочка с толщиной более 14 мм и/или правого желудочка (по данным эхокардиографии);
- хроническая сердечная недостаточность III-IV класса по NYHA (Нью-Йоркской ассоциации кардиологов) и/или фракция выброса левого желудочка менее 35 %;
- выраженная дилятация (расширение камеры) левого желудочка, кардиомегалии;
- активный миокардит;
- блокада ножек пучка Гиса;
- выраженная брадикардия и др.
Если у пациента нет этих противопоказаний и наблюдается умеренно выраженная патологии сердца, то можно рассмотреть применение препаратов I класса[10].Нужно отметить, что антиаритмические лекарства могут обладать проаритмогенным действием, т. е. вызывать более опасную аритмию, поэтому их может назначить только врач и только при соответствующих показаниях.
Появились работы, которые показали возможность благоприятного действия «Омакора» на желудочковую аритмию, в частности у пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью[6]. Добавление этого препарата к антиаритмикам повышает эффективность лечения желудочковых аритмий. Если проблема связана с нарушением электролитного баланса, то больному назначаются «Магния сульфат» или «Калия хлорид».
Практически важным является вопрос о длительности антиаритмической терапии. У пациентов со злокачественными желудочковыми аритмиями терапия антиаритмиками должна проводится неопределённо долго, в большинстве случаев пожизненно. При менее злокачественных нарушениях ритма лечение должно продолжаться до нескольких месяцев с возможностью постепенной (ввиду опасности синдрома «рикошета») его отмены. После прекращения постоянной терапии больному даются рекомендации всегда носить с собой успешно использованный антиаритмик и принимать его в случае возобновления перебоев в работе сердца.
4. При желудочковой экстрасистолии возможно хирургическое лечение. Показанием к оперативному вмешательству являются:
- частая (от нескольких тысяч до 20-30 тысяч в сутки) желудочковая экстрасистолия с идентифицированным аритмогенным очагом;
- неэффективность или невозможность длительного приёма антиаритмиков в сочетании с плохой переносимостью или неблагоприятным прогнозом.
Высокая активность очага позволяет обнаружить его при составлении карты электрической активности сердца и провести радиочастотную абляцию (РЧА) этой зоны миокарда[11]. Суть методики РЧА заключается в том, что пациенту через сосуд крупного калибра вводится катетер, который проводится под контролем аппаратуры до самого сердца. Сначала с помощью особой методики диагностируют очаг патологической импульсации, а затем воздействуют на место эктопического возбуждения радиочастотным импульсом, что приводит к его уничтожению.
Возможна также установка элктрокардиостимулятора (ЭКС). ЭКС представляет собой устройство с электродами, которые в ходе операции крепятся к желудочку и предсердию. Электроды создают электронные импульсы, заставляющие миокард сокращаться. Кардиостимулятор, по сути, заменяет синусовый узел, отвечающий за ритмичность. Он избавляет человека от экстрасистолии и позволяет вернуться к полноценной жизни.
При острой и хронической ишемической болезни сердца развитие желудочковой аритмии напрямую связано с ишемией миокарда. В связи с этим хирургическая реваскуляризация миокарда (стентирование, аорто-коронарное шунтирование) может улучшить электрическую стабильность и снизить вероятность развития желудочковых нарушений ритма.
У больных с высокой вероятностью внезапной смерти и застойной сердечной недостаточностью главным методом лечения остается пересадка сердца.
Архів
О. Й. Жарінов, В. О. Куць Національна медична академія післядипломної освіти ім. П. Л. Шупика МОЗ України
Шлуночкова екстрасистолія (ШЕ) — найбільш поширене порушення серцевого ритму, яке може істотно впливати на якість життя хворих, бути маркером структурно-функціональних змін міокарда та свідчити про небезпеку виникнення небезпечних для життя аритмій серця. Удосконалення стратегії ведення хворих із ШЕ насамперед пов’язане з розвитком концепції “стратифікації ризику”, тобто поділу пацієнтів на групи залежно від ступеня ризику смерті від усіх причин і, зокрема, раптової серцевої смерті (РСС). Крім того, активно впроваджуються сучасні інструментальні методи діагностики аритмій серця, передусім — амбулаторне моніторування ЕКГ. У клінічній практиці існує очевидна потреба у створенні узгоджених рекомендацій з ведення хворих з ШЕ, узагальненні діагностичних та терапевтичних підходів.
ЕТІОЛОГІЯ
Появу ШЕ можуть викликати будь-які структурні захворювання серця. Особливо часто її виявляють у хворих на гострий інфаркт міокарда (ІМ) та хронічну ІХС. Утім, екстрасистолія може виникати також при інших ураженнях міокарда, у тому числі субклінічних. У багатьох хворих з екстрасистолією доступними інструментальними методами дослідження не знаходять будь-яких ознак ураження серця.
Поширені причини та фактори, асоційовані з ШЕ:
- Хвороби міокарда, ендокарда та вінцевих артерій серця: ІХС, міокардити, міокардіофіброз, кардіоміопатії, вади серця, артеріальна гіпертензія або гіпотензія, серцева недостатність (СН);
- Електролітний дисбаланс (гіпокаліємія, гіперкаліємія, гіпомагніємія, гіпокальціємія), порушення кислотно-лужної рівноваги;
- Гіпоксія: захворювання легень, легенева гіповентиляція (наприклад, під час операції);
- Травматичні впливи: травма грудної клітки, операція на серці, катетеризація порожнин серця, травми головного і спинного мозку;
- Порушення вегетативної регуляції: нейроциркуляторна дистонія, неврози, діенцефаліт, симпатичні гангліоніти та трунцити, психоемоційне напруження;
- Патологічні рефлекси, зумовлені захворюваннями органів травлення (виразкова хвороба, жовчно-кам’яна хвороба, панкреатит, діафрагмальна кила, коліти й ентероколіти, особливо коли вони супроводжуються метеоризмом, запорами або порушеннями електролітного балансу); дистрофічні зміни в шийному і грудному відділах хребта (остеохондроз, спондилоартроз); хвороби бронхів та легень, особливо ті, що супроводжуються виснажливим кашлем; аденома простати;
- Діагностичні процедури: ендоскопія (бронхоскопія, гастроскопія, лапароскопія, цистоскопія, кольпоскопія, ректоскопія), пункція, масаж каротидного синуса, натискання на очні яблука, затримка дихання на глибокому вдиху;
- Алергія: харчова, медикаментозна, мікробна, професійна, побутова;
- Фармакодинамічна та токсична дія медикаментів, таких як серцеві глікозиди, хінідин, новокаїнамід, засоби для наркозу, морфін, глюкокортикоїди, препарати калію, кальцію, трициклічні антидепресанти, похідні фенотіазину, адреноміметики.
Основні електрофізіологічні механізми екстрасистолії — re-entrу (зворотний вхід збудження) та післядеполяризації. В основі виникнення екстрасистол можуть лежати також механізми асинхронного відновлення збудливості міокарда та патологічного автоматизму.
ОБСТЕЖЕННЯ ХВОРИХ
Обстеження хворих з ШЕ включає методи, які забезпечують діагностику порушення серцевого ритму, визначення клінічного та прогностичного значення аритмії, вибір лікування та оцінку його ефективності.
Анамнез.
При опитуванні хворого з’ясовують таку інформацію: суб’єктивні прояви аритмії (серцебиття, перебої в роботі серця, поштовхи або “завмирання” серця, дискомфорт у грудях, відчуття нестачі повітря, задишка, запаморочення, синкопальні стани), давність виникнення порушення ритму; фактори, що провокують аритмію (фізичне навантаження, психоемоційний стрес, певний час доби, положення тіла, прийом їжі, алкоголь, куріння); перенесені останнім часом захворювання; фонова кардіальна патологія; попередній прийом антиаритмічних препаратів (ААП).
Клінічне обстеження.
Виявлення аритмій при аускультації серця або при пальпації периферичних артерій; наявність клінічних ознак СН.
Лабораторні методи дослідження.
Визначення вмісту калію, натрію, креатиніну в сироватці крові, активності тиреотропного гормону.
ЕКГ.
Основні ЕКГ-ознаки шлуночкових екстрасистол (ШЕ):
- Передчасна поява розширеного та деформованого відносно основного ритму комплексу QRS без передуючого йому зубця Р, за винятком пізніх екстрасистол, перед якими реєструються зубці Р, що не мають електрофізіологічного зв’язку з ШЕ;
- Найчастіше — наявність повної компенсаторної паузи.
Форма ШЕ залежить не лише від локалізації джерела екстрасистолії, а й від швидкості та шляху поширення імпульсу у шлуночках. Тому ЕКГ дає змогу орієнтовно встановити розміщення ектопічного вогнища за морфологією екстрасистолічного комплексу. Якщо ШЕ має вигляд блокади правої ніжки і лівої передньої гілки пучка Гіса, її джерело міститься в системі лівої задньої гілки пучка Гіса, тобто в задній стінці лівого шлуночка; якщо ШЕ має вигляд блокади правої ніжки і задньої нижньої гілки пучка Гіса, її джерело розміщене в лівій передній гілці пучка Гіса; якщо ШЕ має вигляд повної блокади лівої ніжки пучка Гіса, то її джерело — у правій ніжці пучка Гіса. Комплекс QRS лівошлуночкової екстрасистоли у правих грудних відведеннях має моно- або біфазну форму: R, qR, RR’, RS, Rs а в лівих — rS або QS. Комплекс QRS правошлуночкової екстрасистоли у правих грудних відведеннях має форму rS або QS, а в лівих — R (табл. 1). Якщо ШЕ виникає в ділянці міжшлуночкової перегородки, як звичайно, її тривалість і форма незначно відрізняються від комплексу QRS основного ритму. Форма QRS типу rSR’ у відведенні V1 характерна для екстрасистоли з лівої половини міжшлуночкової перегородки, а тип R або qR у відведенні V6 — для екстрасистол з правої половини перегородки. Спрямованість комплексу QRS екстрасистолічного комплексу у всіх грудних відведеннях уверх дозволяє припустити локалізацію джерела ШЕ в базальних відділах серця, а спрямованість комплексу QRS униз — у ділянці верхівки. У складних для топічної діагностики випадках точне джерело екстрасистоли не вказують, обмежившись висновком про наявність ШЕ.
Таблиця 1. Характерні форми комплексів ШЕ у грудних відведеннях ЕКГ при базальній, проміжній та верхівковій їх локалізації
| Локалізація екстрасистол | Форми комплексів ШЕ у відведеннях ЕКГ | ||||||
| V1 | V2 | V3 | V4 | V5 | V6 | ||
| Правошлуночкові | Базальні | Rs, RS | RS | R | R | R | R |
| Проміжні | rS, QS | rS | rS | rS, RS | R | R | |
| Лівошлуночкові | Верхівкові | rS, QS | rS, QS | rS | rS | rS, RS | Rs, RS |
| Базальні | R | R | R | R | Rs | RS, Rs | |
| Проміжні | R, qR, RR’, RS, Rs | R, Rs | RS | RS, rS | rS | rS, QS | |
| Верхівкові | RS, Rs | rS, RS | rS | rS | rS | rS | |
| Базальні | R | R | R | R | R | R | |
| Верхівкові | rS | rS | rS | rS | rS | rS | |
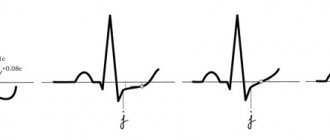
Інтервали зчеплення монотопних ШЕ однакові, незважаючи на те що їх форма може бути різною (у цьому випадку вони є поліморфними). Коливання інтервалів зчеплення монотопних екстрасистол звичайно не перевищують 0,06–0,10 с. Політопні ШЕ мають різні за тривалістю інтервали зчеплення і, як правило, різну форму комплексів QRS. Дві екстрасистоли поспіль називаються парними (рис. 1), а три–п’ять — груповими, “залповими” (рис. 2), або пробіжками шлуночкової тахікардії — ШТ. Виділяють також ранні і дуже ранні ШЕ („R на Т”) (рис. 3). Екстрасистолія може бути нерегулярною (монотопна або політопна), а її поява з певною закономірністю визначається як алоритмія (бігемінія, тригемінія, квадригемінія тощо). Інтерпольовані ШЕ реєструються між двома нормальними комплексами QRS, як звичайно, — на фоні брадикардії.
Рисунок 1.
Поодинока і парна політопна шлуночкова екстрасистолія.
Рисунок 2.
Групова політопна шлуночкова екстрасистолія.
Рисунок 3.
Рання шлуночкова екстрасистолія „R на Т”.
Шлуночкову екстрасистолію на фоні фібриляції передсердь необхідно диференціювати з аберантними шлуночковими комплексами. Вкорочений кардіоцикл при фібриляції передсердь, який закінчується аберантним шлуночковим комплексом, на відміну від передекстрасистолічного інтервалу, не супроводжується компенсаторною паузою, і йому передує подовжений інтервал RR. Аберантні комплекси QRS, як правило, мають форму блокади правої ніжки пучка Гіса різного ступеня виразності у відведенні V1 (rSR’, rSr’), а лівошлуночкові екстрасистоли — форму R, RS, Rs, qR, RR’ або Rr’ (табл. 2).
Таблиця 2. Диференціальна діагностика суправентрикулярних екстрасистол з аберацією внутрішньошлуночкової провідності і шлуночкових екстрасистол
| Ознаки | Суправентрикулярна екстрасистолія з аберацією | Шлуночкова екстрасистолія |
| Морфологія QRS у відведенні V1: | ||
| rSR’, rsR’ | Характерно | Не характерно |
| qR, R, rR’ з розщепленням на висхідному коліні | Дуже рідко | Не характерно |
| qR, R, RS, Rsr’, RR’ з розщепленням на низхідному коліні | Не характерно | Характерно |
| rS, QS | Не характерно | Характерно |
| Морфологія QRS у відведенні V6: | ||
| qRS | Характерно | Не характерно |
| rS, QS | Не характерно | Характерно |
| Переважання позитивних або негативних зубців комплексу QRS у всіх грудних відведеннях | Не характерно | Характерно |
ІНШІ МЕТОДИ ІНСТРУМЕНТАЛЬНОЇ ДІАГНОСТИКИ
Холтерівське моніторування (ХМ) ЕКГ дозволяє реєструвати ЕКГ без обмеження рухового режиму хворого протягом 24 годин і більше з наступним автоматизованим аналізом запису. Оцінюються загальна кількість екстрасистол за час спостереження, їх розподіл протягом доби, зв’язок з фізичним або емоційним навантаженням, ЧСС, прийомом їжі, зміною положення тіла, перехідними епізодами ішемії міокарда.
ХМ ЕКГ — „еталонний” метод діагностики відносно нечастої екстрасистолії, а також оцінки тяжкості ШЕ, виявлених під час реєстрації ЕКГ. ХМ ЕКГ дозволяє точніше, ніж короткочасна реєстрація ЕКГ, здійснювати якісну та кількісну оцінку порушень серцевого ритму внаслідок значно більшої кількості оцінюваних ектопічних комплексів. Поодинокі ШЕ є досить частою знахідкою при ХМ ЕКГ у практично здорових осіб.
Порівняння циркадних змін кількості екстрасистол та частоти серцевих скорочень (ЧСС) дозволяє відокремити тахі- і брадизалежні форми екстрасистолії. Одним з найбільш поширених добових типів розподілу екстрасистолії є „вагусний” (вагозалежний, або „нічний”), коли передчасні комплекси реєструються більш ніж в 1,5 разу частіше в пасивний період доби, на фоні сповільнення синусового ритму. Вагозалежна ШЕ частіше трапляється у молодих людей без ознак патології серця, нерідко вона є випадковою знахідкою і не відчувається хворими. Така форма екстрасистолії переважно не потребує антиаритмічної терапії. При „адренергічному” (симпатозалежному, або „денному” типі) середня кількість екстрасистол за годину в 1,5 разу більша в активний період доби, а екстрасистоли часто пов’язані з прискоренням синусового ритму. „Адренергічний” тип ШЕ більш характерний для літніх людей, особливо з ІХС, гіпертонічною хворобою, вадами серця, дилятаційною і гіпертрофічною кардіоміопатіями, міокардіофіброзом. На відміну від „вагусного” типу, така екстрасистолія не є доброякісною і часто потребує призначення ААП, передусім β-блокаторів і аміодарону. Дуже часто відсутній зв’язок кількості екстрасистол з періодом доби і ЧСС. Можна також спостерігати „гектичний” тип розподілу екстрасистол зі значними коливаннями їх кількості від години до години. Така висока ектопічна активність протягом короткого проміжку часу інколи може бути пов’язана з рецидивуючою ішемією міокарда. Загалом застосування ХМ ЕКГ істотно збільшує можливості виявлення екстрасистолії і парасистолії, встановлення змінності її форм і варіантів.
Метод ХМ ЕКГ дозволяє оцінювати зміни варіабельності серцевого ритму за добу. Зокрема, зниження стандартного показника варіабельності серцевого ритму — стандартного відхилення інтервалів RR протягом доби (SDNN) — нижче 50 мс свідчить про дисбаланс вегетативної регуляції серцевого ритму і є одним із предикторів виникнення РСС у хворих з післяінфарктним кардіосклерозом, систолічною дисфункцією лівого шлуночка (ЛШ) і серцевою недостатністю та збереженим синусовим ритмом. Найбільш потужним провісником ризику життєво небезпечної аритмії було поєднання низької варіабельності серцевого ритму із зниженою фракцією викиду (ФВ) ЛШ і порушеною чутливістю барорефлексу (дослідження ATRAMІ, 1998). Наголосимо, що часта ШЕ є обмеженням для оцінки часових і спектральних показників варіабельності серцевого ритму.
При ХМ ЕКГ звертають увагу також на тривалість і варіабельність інтервалу зчеплення, а також тривалість інтервалу Q-T. Привертає увагу оцінка добових коливань коригованого інтервалу QT, адже навіть при його нетривалому збільшенні може збільшуватися тривалість „вразливого” періоду серцевого циклу і схильність до виникнення пароксизмів „пірует-тахікардії”.
Повторне ХМ ЕКГ на фоні лікування дозволяє оцінити ефективність призначеної терапії. З огляду на виражені спонтанні коливання частоти виникнення аритмій серця розроблено такі критерії ефективності антиаритмічної терапії у хворих з ШЕ: а) зменшення загальної кількості ШЕ за добу більш ніж на 50–75%; б) зменшення кількості парних і ранніх ШЕ на 90% і більше; в) повне усунення епізодів ШТ; г) при поліморфній ШЕ — зменшення кількості морфологічних типів екстрасистол до 1–2. Оцінюючи адекватність лікування антиаритмічним препаратом, крім перерахованих критеріїв, потрібно також враховувати особливості його впливу на синусовий ритм, провідність, частоту ішемічних епізодів.
Інтерпретація даних ХМ ЕКГ щодо оцінки ефективності антиаритмічної терапії при ШЕ має певні обмеження. При застосуванні ААП 1-го класу за класифікацією V. Wіllіams ефективність за вказаними кількісними критеріями не дозволяє передбачити поліпшення прогнозу виживання хворих при тривалому лікуванні. Більше того, використання деяких препаратів (флекаїніду, енкаїніду) у контрольованих дослідженнях асоціювалося з істотним збільшенням імовірності РСС. Зважаючи на це, лікування пацієнтів із тяжким структурним ураженням міокарда (дисфункція ЛШ після перенесеного ІМ або при дилятаційній кардіоміопатії, з/без СН) починають із терапії етіопатогенетичного спрямування: коригують ішемію та гемодинамічні порушення. За наявності дисфункції ЛШ і частих симптомних ШЕ до базисної превентивної терапії (інгібітори ангіотензин-перетворюючого ферменту (АПФ), β-адреноблокатори, аспірин, статини) додають аміодарон або соталол — засоби з доведеною ефективністю у профілактиці злоякісних шлуночкових аритмій. Зазначимо, що β-адреноблокатори й аміодарон можна призначати емпірично з огляду на доведену здатність цих препаратів поліпшувати прогноз виживання хворих і незалежно від змін кількості порушень серцевого ритму. У цих ситуаціях ХМ ЕКГ доцільно здійснити в динаміці для оцінки перебігу порушень серцевого ритму на фоні антиаритмічної терапії. А в ситуаціях, коли застосування ААП визначається передусім клінічною вагомістю порушень ритму, а не їх прогностичним значенням, визначальним критерієм ефективності препарату є зменшення симптомів, спричинених аритмією. Наголосимо також, що найбільш ефективним засобом профілактики РСС у пацієнтів з критеріями її високого ризику є імплантація внутрішнього кардіовертера-дефібрилятора.
Проби з фізичним навантаженням
(проба Мастера, степ-тест, велоергометрія, тредміл-тест) можуть провокувати появу ШЕ під час навантаження і в ранньому відновлювальному періоді внаслідок підвищення активності симпатоадреналової системи, збільшення викиду катехоламінів, розвитку тканинної гіпоксії, ацидозу. У хворих на хронічну ІХС під час велоергометрії ШЕ виявляють у 60% обстежених, а їх частота нерідко корелює зі зміщенням сегмента ST (рис. 4). Під впливом фізичного навантаження може змінитися кількість і градація екстрасистолії: збільшення кількості екстрасистол під час навантаження при високій ЧСС або в першу хвилину після його закінчення свідчить про її можливий зв’язок з ІХС; “доброякісні” екстрасистоли звичайно зникають під час навантаження та відновлюються через 3–5 хвилин після його закінчення. Потрібно зважати на діагностичні обмеження проби з навантаженням: у частини хворих не вдається спровокувати екстрасистолію, діагностовану раніше; в 11–40% пацієнтів зі здоровим серцем при фізичному навантаженні з’являється поодинока екстрасистолія, а в 5% — парна; у деяких хворих при фізичному навантаженні можуть зникати навіть групові та ранні екстрасистоли.
Рисунок 4.
Правошлуночкова екстрасистола на фоні горизонтальної депресії сегмента ST.
Ортокліностатична проба
дозволяє уточнити характер екстрасистолічної аритмії: стабільна екстрасистолія існує у спокої та при функціональних пробах; лабільна екстрасистолія напруги з’являється або посилюється при ортостатичній пробі і стандартному навантаженні потужністю 50 Вт; лабільна екстрасистолія спокою зникає при ортостатичній пробі та фізичному навантаженні потужністю 50 Вт і з’являється після переходу в горизонтальне положення. Вважається, що лабільна екстрасистолія напруги і стабільна екстрасистолія скоріше за все пов’язані з наявністю захворювання серця і/або стійкого субстрату аритмії, а лабільна екстрасистолія спокою, як правило, є функціональною (вагусною).
Ехокардіографія
здійснюється для уточнення впливу як ШЕ, так і ААП на стан гемодинаміки. Метод дозволяє оцінити розміри порожнин серця в систолу і діастолу, фракцію викиду, товщину стінок серця, масу міокарда ЛШ, співвідношення кінцево-діастолічного об’єму і маси міокарда ЛШ, виявити зони гіпо- і акінезії, локальні гіпертрофії, клапанні вади, феномен “постекстрасистолічного підсилення”, дисплазію міокарда правого шлуночка. Зменшення ФВ ЛШ менше 40% у хворих на ІХС асоціюється з підвищенням ризику РСС. Серцевий викид можна точніше визначити з допомогою радіоізотопної вентрикулографії або коронаровентрикулографії.
Внутрішньосерцеве ЕФД
є сучасним методом діагностики порушень ритму та провідності серця, визначення показань для кардіостимуляції, радіочастотної катетерної абляції та імплантації кардіовертера-дефібрилятора. Дослідження виконується у спеціально обладнаних лабораторіях. У хворих із ШЕ абсолютних показань для проведення внутрішньосерцевого ЕФД немає. Це дослідження може бути здійснене лише при необхідності встановлення зв’язку порушень ритму серця з синкопальними та передсинкопальними станами. Хворим із безсимптомним перебігом екстрасистолії ЕФД не показане.
КЛІНІЧНЕ ТА ПРОГНОСТИЧНЕ ЗНАЧЕННЯ
Клінічне значення ШЕ в основному визначається її типом і градацією, наявністю симптомів, характером основного захворювання, ступенем ураження серця і функціональним станом міокарда.
Шлуночкові екстрасистоли в осіб без структурного ураження серця не є загрозливими для життя. Їх виявляють при ХМ ЕКГ у більшості практично здорових осіб усіх вікових груп, причому у 10% вони політопні і рідко — групові. Загалом ШЕ не обов’язково вказують на супутню кардіальну патологію, а за відсутності серцевого захворювання не є провісником підвищення захворюваності і смертності. З іншого боку, у хворих з вираженим структурним ураженням серця та дисфункцією міокарда, особливо на фоні післяінфарктного кардіосклерозу або СН, виявлення частої ШЕ є додатковим прогностично несприятливим фактором.
Ектопічна активність шлуночків відзначається у 75–90% хворих на гострий інфаркт міокарда в перші 72 години захворювання і зумовлює високу частоту РСС в цей час, але не корелює зі смертністю протягом року. Наявність ШЕ в більш пізній період захворювання вказує на несприятливий тривалий прогноз. Так, частота ШЕ менше 1 за годину спостерігається у 50% хворих при виписці зі стаціонару і вказує на дворічну смертність близько 5%. При більш частій ШЕ (1–10 за годину), що спостерігається у 20% хворих, смертність досягає 20%. Короткі пароксизми ШТ спостерігаються у 12% хворих, а смертність від усіх причин сягає до 30% протягом першого року після перенесеного ІМ. Поява життєво небезпечних аритмій серця після ІМ зумовлена поєднанням рецидивуючої ішемії з метаболічними та електролітними розладами. Важливими факторами, що сприяють аритмогенезу, є СН і стенозуючий коронарний атеросклероз.
Парні і політопні ШЕ трапляються у 70–90% хворих із СН, а короткі епізоди ШТ — у 40–80%. У цьому випадку шлуночкові порушення серцевого ритму є несприятливим прогностичним фактором, причому 33–47% усіх випадків смерті хворих із СН припадає на РСС. Аритмогенними факторами при СН є дисфункція лівого шлуночка (ФВ < 45%), ішемія міокарда, гіпоксія, електролітні розлади, а також аритмогенні ефекти застосованих терапевтичних засобів, особливо серцевих глікозидів, діуретиків і периферичних вазодилятаторів.
Дуже високою є частота ШЕ у хворих на дилятаційну кардіоміопатію. Так, часті і політопні ШЕ спостерігаються у 80–90% хворих, короткі епізоди ШТ — у 20–60%. Частота РСС сягає 10% на рік, на неї припадає половина від усіх випадків смерті. Приблизно в 50% хворих виявляють передсердні екстрасистоли. Формування аритмій пов’язане з наявністю вираженої дисфункції ЛШ і СН.
Шлуночкові екстрасистоли реєструють у 50–65% хворих на гіпертрофічну кардіоміопатію з обструкцією вихідного тракту ЛШ, у тому числі парні ШЕ — у 32%, а пароксизми ШТ — у 14–25%. Частота РСС у цих пацієнтів становить 2,5–9% на рік. Передсердна екстрасистолія трапляється рідше, ніж шлуночкові порушення ритму. Причини та фактори, які сприяють аритмогенезу: клітинна дезорганізація в різних ділянках міокарда, гіпоксія, гіпокаліємія, обструкція вихідного тракту ЛШ, діастолічна дисфункція ЛШ, СН, аритмогенні впливи препаратів, інтенсивні фізичні навантаження.
Ризик РСС внаслідок шлуночкових порушень ритму особливо зростає у хворих з аритмогенною дисплазією правого шлуночка, вродженим або набутим синдромом подовженого інтервалу QT, клапанними вадами серця (включаючи пролапс мітрального клапана), артеріальною гіпертензією.
Про ступінь небезпеки, пов’язаної з ШЕ, можуть свідчити деякі особливості ЕКГ. Як звичайно, не є загрозливими екстрасистоли з конфігурацією блокади лівої ніжки пучка Гіса і вертикальним положенням електричної осі передчасного комплексу QRS (тип Розенбаума) або коли комплекс QRS екстрасистоли у всіх грудних відведеннях спрямований уверх і нагадує графіку синдрому Вольфа-Паркінсона-Уайта типу А (тип Вольфа). Комплекс QRS таких екстрасистол не має додаткових розщеплень, його амплітуда становить 20 мм і більше, тривалість може бути до 0,12 с, а сегмент ST і асиметричний зубець Т спрямовані дискордантно до основного зубця шлуночкового комплексу. Перегородкові ШЕ з вузькими комплексами QRS частіше спостерігаються у молодих людей за відсутності структурного ураження серця і рідко є симптомними. Потенційно загрозливі ШЕ здебільшого виникають на фоні структурного ураження серця, мають форму блокади правої ніжки пучка Гіса, незначну амплітуду комплексу QRS (часто до 10 мм) з додатковими розщепленнями, а тривалість його більше 0,12–0,14 с. Можуть спостерігатися аномалії реполяризації: горизонтальна депресія сегмента ST і конкордантне спрямування симетричного, загостреного зубця Т.
КЛАСИФІКАЦІЇ ШЛУНОЧКОВОЇ ЕКСТРАСИСТОЛІЇ
Згідно з рекомендаціями Асоціації кардіологів України, створеними на основі Міжнародної класифікації хвороб Х перегляду, виділяють такі види екстрасистолії: передсердна, атріовентрикулярна, шлуночкова (поодинока — до 30 за годину, часта — 30 і більше за годину, алоритмія, поліморфна, парна, рання — типу „R на Т”).
В Україні при інтерпретації даних ХМ ЕКГ у хворих із шлуночковими порушеннями ритму традиційно використовують класифікацію B. Lown і M. Wolf (1971). Згідно з цією класифікацією розрізняють 5 класів шлуночкових екстрасистол: 1) мономорфна, <� 30 за годину; 2) мономорфна, > 30 за годину; 3) поліморфна; 4) парна (4а) і пробіжки шлуночкової тахікардії (4b); 5) рання („R на T”). Ця класифікація була розроблена для систематизації шлуночкових порушень серцевого ритму у хворих на гострий ІМ, але не відповідає потребам стратифікації ризику та вибору тактики диференційованого лікування в післяінфарктних пацієнтів. Докладніше варіанти шлуночкових порушень серцевого ритму відображені у класифікації R. Myerburg (1984), яку зручно застосовувати при інтерпретації результатів ХМ ЕКГ (табл. 3). Наголосимо, що при стратифікації ризику в післяінфарктних хворих вагомою є вже кількість ШЕ понад 10 на годину. До аритмій „високих градацій” зараховують парні ШЕ і пароксизми ШТ будь-якої тривалості. Причому стійка ШТ, незалежно від клінічних симптомів і характеру структурного захворювання серця, розглядається як злоякісне порушення ритму, тоді як прогностичне значення нестійкої ШТ сильно залежить від основного захворювання серця і функціонального стану міокарда. Морфологічний тип ШТ також визначає суттєві відмінності механізмів виникнення і тактики ведення хворих, зокрема, застосування ААП і катетерних методів лікування.
Таблиця 3. Систематизація шлуночкових порушень серцевого ритму за R. Myerburg (1984)
| Кількість екстрасистол | Форми шлуночкових аритмій | Морфологія шлуночкових тахікардій | ||
| Ступінь тяжкості | Кількість | Ступінь тяжкості | Характеристики | |
| 0 | Немає | 0 | Немає | •Мономорфна •Поліморфна •„Пірует” •З вихідного тракту правого шлуночка •Двоспрямована |
| 1 | Рідко (<1 за год.) | 1 | Поодинокі, мономорфні | |
| 2 | Нечасто (2–9 за год.) | 2 | Поодинокі, поліморфні | |
| 3 | Проміжна (10–29 за год.) | 3 | Парні, пробіжки (2 або 3–5 комплексів) | |
| 4 | Часта (30–59 за год.) | 4 | Нестійка шлуночкова тахікардія (від 6 комплексів до 29 с) | |
| 5 | Дуже часта (≥ 60 за год.) | 5 | Стійка шлуночкова тахікардія (≥ 30 с) | |
Добре відома прогностична класифікація шлуночкових аритмій, запропонована J. T. Bіgger (1993), що поділяє шлуночкові аритмії на безпечні (доброякісні), небезпечні для життя (злоякісні, летальні) і потенційно небезпечні (потенційно летальні).
- Безпечні (доброякісні) аритмії — будь-які ШЕ (рідкісні, часті, політопні, парні), а також короткі епізоди ШТ за відсутності кардіальної патології, що не викликають порушення гемодинаміки. Прогноз при цих ША такий самий, як у здорової популяції. Показань для антиаритмічної терапії немає.
- Небезпечні для життя (злоякісні) шлуночкові аритмії — епізоди ШТ, що призводять до порушення гемодинаміки або фібриляції шлуночків (ФШ). Ці аритмії, як правило, спостерігаються у хворих із вираженим структурним ураженням серця (ІХС, застійна СН, кардіоміопатії, вади серця) і порушенням скоротливості ЛШ. У цих хворих ШЕ є лише частиною спектра шлуночкових порушень ритму. Досить часто у них також виявляють нестійкі та стійкі ШТ.
- Потенційно небезпечні (потенційно злоякісні) шлуночкові аритмії — часті, політопні, парні ШЕ, короткі епізоди ШТ у хворих із структурними ураженнями серця (ІХС, СН, кардіоміопатії, вади серця), що не призводять під час порушення ритму до виражених змін гемодинаміки. Маркером більшої ймовірності виникнення життєво небезпечних аритмій серця у цих хворих є систолічна дисфункція ЛШ (ФВ ЛШ <� 45%).
ПРИНЦИПИ ВЕДЕННЯ ХВОРИХ
Тактика ведення хворих із ШЕ залежить від: а) структурного захворювання серця; б) частоти виникнення екстрасистол, наявності групових екстрасистол або супутніх пароксизмів тахіаритмії; в) клінічних симптомів, пов’язаних з аритмією. Показаннями для призначення β-блокаторів і/або інших ААП є такі клінічні ситуації: 1) прогресуючий перебіг захворювання серця з істотним збільшенням кількості ШЕ; 2) часті, політопні, парні, групові та ранні („R на T”) ШЕ, загрозливі щодо подальшого виникнення пароксизмальної ШТ і ФШ; 3) алоритмія (бі-, три-, квадригемінія), короткі пробіжки ШТ, які супроводжуються ознаками СН; 4) ШЕ на фоні захворювань, які супроводжуються збільшенням ризику життєво небезпечних аритмій (пролапс мітрального клапана, синдром подовженого інтервалу Q-T тощо); 5) виникнення або збільшення частоти ШЕ під час нападів стенокардії або гострого ІМ; 6) збереження ШЕ після припинення приступу ШТ і ФШ; 7) екстрасистоли на фоні аномальних шляхів проведення (синдромів Вольфа-Паркінсона-Уайта та Клерка-Леві-Крістеско).
Хворі з доброякісною ШЕ спеціальної антиаритмічної терапії не потребують, але необхідне динамічне спостереження, тому що в частини з них, за даними Фремінгемського дослідження, ШЕ може бути дебютом серцевого захворювання. При екстрасистолії в осіб молодого віку без структурного ураження серця, особливо тій, яка зникає під час фізичного навантаження, ААП звичайно не призначають. При суб’єктивній непереносимості екстрасистолії показані раціональна психотерапія, седативні засоби, транквілізатори або антидепресанти. Тривалість лікування залежить від медичних показань і коливається від трьох тижнів до 2–3 місяців. У випадку досягнення стійкого седативного й антиаритмічного ефекту добова доза препарату протягом кожних 6–7 днів зменшується на одну третину до повної відміни. Якщо екстрасистолія виникає на фоні вегетативної дисфункції з ознаками симпатоадреналової активації, показані β-адреноблокатори, а при домінуванні ваго-інсулярних симптомів — М-холінолітики (атропін, препарати беладони, ітроп). Хворі з захворюваннями внутрішніх органів і екстрасистолією насамперед потребують адекватного лікування основного захворювання. У всіх випадках обстеження спрямоване на виявлення та усунення потенційних провокуючих факторів екстрасистолії (таких як споживання кофеїну, певні життєві ситуації), а також супутніх порушень (артеріальна гіпертензія).
При поодиноких монофокусних ШЕ у хворих із серцево-судинними захворюваннями без порушень гемодинаміки і коронарного кровообігу призначати ААП не потрібно. Стриманий підхід до призначення ААП зумовлений тим, що ризик побічних ефектів при медикаментозному лікуванні “доброякісних” аритмій більший, ніж позитивні наслідки лікування. Ведення таких хворих полягає передусім у лікуванні основного захворювання, а також використанні седативних засобів і методів психотерапії при суб’єктивній непереносимості аритмії.
Потенційно злоякісні шлуночкові аритмії звичайно виникають на фоні структурного захворювання серця, наприклад, ІХС або після перенесеного ІМ. У таких хворих з ШЕ різних градацій існує небезпека виникнення в подальшому пароксизмів ШТ, тріпотіння або фібриляції шлуночків. Зважаючи на це, хворі з потенційно злоякісними шлуночковими аритміями передусім потребують адекватного лікування основного захворювання. З цією метою здійснюється корекція стандартних факторів ризику ІХС (артеріальна гіпертензія, куріння, гіперхолестеринемія, цукровий діабет), призначаються засоби, ефективність яких доведена у хворих з ІХС (аспірин, β-адреноблокатори, статини) і при СН (інгібітори АПФ, β-адреноблокатори, антагоністи альдостерону). При поєднанні кардіальної патології з частою ШЕ високих градацій добирають адекватну антиаритмічну терапію. Препаратами вибору найчастіше є β-адреноблокатори, особливо за наявності додаткових показань: ІХС, артеріальної гіпертензії, синусової тахікардії. Високу ефективність цих препаратів пов’язують з їх антиангінальною, антиаритмічною та брадикардитичною дією. За необхідності β-адреноблокатори поєднують з ААП І класу (пропафенон, етмозин, етацизин, дизопірамід) з урахуванням доцільності їх подальшого тривалого застосування.
Гіпотеза про профілактичну ефективність ААП І класу при ШЕ для запобігання раптовій смерті була переглянута після оприлюднення результатів дослідження CAST (1989). Прийом флекаїніду та енкаїніду в післяінфарктних хворих з безсимптомними ШЕ високих градацій супроводжувався достовірним збільшенням ризику раптової смерті порівняно з плацебо. Вказаний феномен пов’язують з аритмогенною і негативною інотропною дією ААП І класу. Водночас негативні підсумки дослідження CAST та інших досліджень ефективності ААП І класу не виключають можливості їх ефективного нетривалого використання для лікування ШЕ у хворих на ІХС, а також при інших причинах шлуночкових аритмій.
При недостатній ефективності β-адреноблокаторів і ААП І класу призначають аміодарон — найбільш потужний з існуючих антиаритмічних засобів з найнижчою ймовірністю аритмогенних ефектів. Аміодарон застосовують при резистентності до інших ААП; крім того, він є препаратом вибору у хворих з життєво небезпечними та клінічно вираженими аритміями на фоні тяжкого структурного захворювання серця. Обнадійливі результати отримано при застосуванні аміодарону у хворих з частою ШЕ після перенесеного ІМ у мета-аналізі АТМА (1997). У групах хворих, які отримували аміодарон, істотно зменшувалась імовірність РСС, але не спостерігали достовірного зменшення загальної смертності. Аміодарон — препарат вибору для лікування шлуночкових аритмій та запобігання їм у хворих із систолічною дисфункцією міокарда і СН. Використання аміодарону в малих дозах (200 мг на добу) дозволяє зменшити до мінімуму кількість некардіальних побічних ефектів. Альтернативним засобом лікування хворих із шлуночковими аритміями на фоні ІХС є соталол — ААП ІІІ класу з β-блокуючими властивостями.
Висока ефективність аміодарону і соталолу при лікуванні хворих зі злоякісними шлуночковими аритміями не свідчить про відсутність проблеми безпеки цих засобів. ААП ІІІ класу подовжують коригований інтервал Q-T, безпечна межа якого становить 440–460 мс. Якщо показники інтервалу Q-Tс перевищують вказані межі, діагностують набутий синдром подовженого інтервалу Q-T. Характерним та специфічним проявом цього стану є поліморфна ШТ (пірует-тахікардія), яка може трансформуватися у ФШ. Ризик розвитку аритмогенної дії соталолу найбільший у перші три дні прийому препарату. Загалом аритмогенні ефекти соталолу спостерігаються частіше, ніж при застосуванні аміодарону.
ПІДСУМКИ
Шлуночкова екстрасистолія — найбільш поширене у клінічній практиці порушення ритму серця. Вона може виникати при багатьох кардіальних і екстракардіальних захворюваннях, бути випадковою знахідкою у практично здорових осіб. Комплекс сучасних інструментальних і лабораторних методів обстеження пацієнтів із ШЕ спрямований на встановлення її причин та механізмів, кількості і градації, клінічного і прогностичного значення, здійснення стратифікації ризику. Загальна стратегія ведення хворих із ШЕ і, зокрема, доцільність її усунення з допомогою ААП визначаються залежно від співвідношення потенційної користі лікування для усунення аритмій, поліпшення прогнозу виживання і ризику виникнення аритмогенних та інших побічних ефектів терапії.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
- Амбулаторне моніторування ЕКГ. Сучасні технології, діагностичні можливості, показання: Метод. посібник / Бобров В. О., Жарінов О. Й., Куць В. О. та співавт. — Львів: Медицина світу, 2004. — 68 с.
- Бобров В. О., Жарінов О. Й. Шлуночкові аритмії (механізми розвитку, вплив дисфункції міокарда, прогностична оцінка, диференційоване лікування). — Львів, 1995. — 122 с.
- Дабровски А., Дабровски Б., Пиотрович Р. Суточное мониторирование ЭКГ.— М.: Медпрактика, 2000. — 208 с.
- Дослідження варіабельності серцевого ритму в кардіологічній практиці: Метод. реком. / Бобров В. О., Чубучний В. М., Жарінов О. Й. та співавт. — К: Укрмедпатентінформ, 1999. — 25 с.
- Кушаковский М. С. Аритмии сердца. — СПб.: ИКФ “Фолиант”, 1998. — 640 с.
- Орлов В. Н. Руководство по электрокардиографии. — М.: Медицинское информационное агентство, 2003. — 526 с.
- Стратифікація ризику і профілактика раптової серцевої смерті: Метод. реком. / Бобров В. О., Жарінов О. Й., Сичов О. С. та співавт. — К: Укрмедпатентінформ, 2002 . — 39 с.
- Функциональная диагностика в кардиологии / Под ред. Л. А. Бокерия, Е. З. Голуховой, А. В. Иваницкого. — М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН, 2002. — Т. 1 — 427 с., т. 2 — 296 с.
Симптомы аритмического синдрома
Клиническая картина экстрасистолии в основном складывается из субъективных ощущений и характеризуется такими симптомами как:
- чувство перебоев в работе сердца, его замираний;
- ощущение удара сердца о грудную клетку;
- тревога, нехватка воздуха;
- слабость, снижение работоспособности;
- бледность, потливость, чувство жара.
Главная опасность экстрасистолии заключается в их способности переходить в более серьёзные нарушения ритма, такие как пароксизмальная тахикардия и мерцательная аритмия.
Применение градаций для лечения экстрасистолии
Указание степени аритмии в формулировке диагноза имеет очень важное значение. Именно от этого будет зависеть тактика лечения, которую выберет доктор.
Так, присутствие у пациента экстрасистол первой градации говорит о функциональном характере возникающих неправильных сокращений. У около 60—70 % людей наблюдается подобное явление, и это считается абсолютной нормой. Единственное, что требуется, — проводить периодическую проверку ЭКГ. Тем не менее при наличии каких-либо симптомов сердечно-сосудистых патологий следует пройти дополнительное обследование, так как это может быть одним из первых признаков заболевания.
При обнаружении второй градации без нарушения гемодинамики показано немедикаментозное лечение: аутотренинг, психотерапия, избегание факторов риска. Если же есть сопутствующие симптомы или замечено появление полиморфных очагов (третья градация), требуется назначение соответствующего курса противоаритмических препаратов.
Наконец, четвертая, пятая, а также рефрактерная к консервативной терапии третья степень, особенно при гемодинамических нарушениях, требуют проведения хирургического лечения. В данном случае могут быть показаны такие оперативные вмешательства, как катетерная радиочастотная абляция или имплантация кардиостимулятора.
Данная классификация также используется для построения прогноза. Угрожающей считается желудочковая экстрасистолия 3—5-й градации по Лауну. Это так называемые злокачественные аритмии. Они характеризуются высоким риском внезапной смерти. В этом случае следует перевести пациента в отделение реанимации и интенсивной терапии.
Имеет значение и локализация очагов. Прогноз менее благоприятный при наличии левожелудочковых аритмий.
Разновидности экстрасистолии
Экстрасистолия классифицируется по расположению аномального очага активности на:
- желудочковую;
- желудочково-предсердную;
- предсердную.
По причине возникновения:
- экстрасистолия функционального генеза – в результате употребления никотина, алкоголя, нервного перенапряжения;
- экстрасистолия органического генеза – инфаркт миокарда, кардиомиопатия, пороки сердца, ишемическая болезнь сердца;
- экстрасистолия токсического генеза — как результат употребления некоторых лекарственных препаратов, при длительном лихорадочном состоянии.
Также различают:
- бигеминию – характеризуется возникновением экстрасистолы сразу за нормальным сокращением;
- тригеминию – за одним нормальным сокращением идут две экстрасистолы, либо за двумя нормальными сердечными комплексами следует одна экстрасистола;
- квадригеминия – происходит три нормальных сокращения, а за ними следует внеочередное сокращение.
Принцип классификации
Существует множество факторов, которые характеризуют то или иное заболевание. Что касается экстрасистол, то выделяют следующие их признаки:
- количество эктопических участков (моно-, политопные);
- форма аритмии (моно-, полиморфные);
- частота возникновения (редкие, умеренно частые, частые);
- локализация (право-, левожелудочковые);
- закономерность сокращений (упорядоченные, неупорядоченные);
- периодичность (спонтанные, регулярные).
В соответствии с этими параметрами было предложено немало вариантов: по Биггеру, Майербургу. Однако наиболее практичной и востребованной оказалась классификация по Лауну-Вольфу. Желудочковая экстрасистолия по Лауну определяется с помощью так называемых градаций, каждой из которых присвоена одна цифра:
- 0 — аритмии отсутствуют за последние 24 часа наблюдения;
- I — фиксируется не более 30 аритмий в течение часа мониторинга, монотопные и мономорфные;
- II — больше 30 в час того же типа;
- III — появляются полиморфные экстрасистолы;
- IVа — спаренные мономорфные;
- IVб — парные полиморфные;
- V — характерно наличие вентрикулярной тахикардии (экстрасистолы, которые возникают более 3 раз подряд).