Нейропротективная терапия при хронической ишемии мозга
Новые демографические тенденции сегодня приобретают особую актуальность в гериатрической практике. Во второй половине XX века значительно изменился возрастной состав населения. Улучшение социально-экономических условий, качества медицинской помощи в индустриально развитых странах привело к существенному увеличению ожидаемой продолжительности жизни. Результатом этого стало значительное увеличение числа лиц пожилого и старческого возраста. По данным Всероссийской переписи населения 2010 года в нашей стране проживают около 47 млн человек пожилого возраста, 71,8% составляют лица в возрасте старше трудоспособного [1]. Наиболее быстрорастущую возрастную группу в странах Европы составляют престарелые люди старше 80 лет.
Основной контингент больных, посещающих поликлинику в нашей стране, — это лица пожилого возраста. Так, на 1 больного в возрасте 50 лет и старше приходится от 1,7 до 3,6 заболевания (в то время как для лиц 70 лет и старше — 5–7 заболеваний). Наиболее часто жалобы, с которыми обращаются к врачу пожилые пациенты, связаны с проявлениями цереброваскулярной болезни (инсомния, депрессия, когнитивные расстройства), обострения хронических соматических заболеваний, побочными явлениями от частого и порой неконтролируемого использования лекарственных препаратов [1].
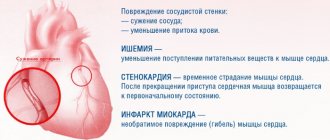
Цереброваскулярные заболевания (ЦВЗ) — одна из основных причин летальности и стойкой утраты трудоспособности больных. Согласно классификации нарушений мозгового кровообращения, принятой в нашей стране в 1958 г., дисциркуляторная энцефалопатия (ДЭП) является основной клинической формой хронической сосудистой мозговой недостаточности [2–4]. Несмотря на то, что в Международной статистической классификации болезней и проблем, связанных со здоровьем, IХ и Х пересмотров ДЭП как нозология отсутствует и ее заменил термин «ишемия мозга (хроническая) (ХИМ)» — МКБ-10, класс IX «Болезни системы кровообращения» (I00-I99), I67.8 — «Другие уточненные поражения сосудов мозга: 1) острая цереброваскулярная недостаточность 5-бромо-2’-дезоксиуридина (БДУ) и 2) ишемия мозга (хроническая)», по-прежнему широко используется термин «дисциркуляторная энцефалопатия».
Определение. ХИМ — особая разновидность сосудистой церебральной патологии, обусловленная медленно прогрессирующим диффузным нарушением кровоснабжения головного мозга с постепенно нарастающими разнообразными дефектами его функционирования [5]. ДЭП — хроническая прогрессирующая форма цереброваскулярной патологии, характеризующаяся развитием многоочагового или диффузного ишемического поражения головного мозга [3, 4, 6, 7]. ДЭП, как и инсульт, представляет собой цереброваскулярный синдром [2] — синдром хронического прогрессирующего поражения головного мозга сосудистой этиологии, который развивается в результате повторных острых нарушений мозгового кровообращения и/или хронической недостаточности кровоснабжения головного мозга [8].
Для клинической картины ДЭП характерно [4]: 1) прогрессирующее нарастание когнитивных нарушений (снижение памяти, внимания, интеллекта), достигающих на последних этапах уровня деменции, которая проявляется сочетанием выраженных нарушений когнитивных функций, личностными изменениями со значительным затруднением обычной социальной активности и невозможности продолжать работу; 2) постепенное нарастание эмоционального оскудения, потеря интереса к жизни; 3) постепенное нарастание нарушений координации и ходьбы, дестабилизация темпа и ритма движений, склонность к падениям; в выраженных случаях ходьба становится невозможной, несмотря на отсутствие парезов; 4) подкорковый синдром: олигобрадикинезия, гипомимия, ахейрокинез, повышение мышечного тонуса по экстрапирамидному типу (по типу синдрома паркинсонизма); 5) различной выраженности псевдобульбарный синдром: дизартрия, дисфагия, насильственный смех и плач, симптомы орального автоматизма; 6) снижение силы в конечностях, легкие парезы при выраженном поражении головного мозга; 7) постепенное появление нарушений контроля функции тазовых органов.
Выделяют три стадии ДЭП: I — легкую, или умеренную (компенсация), II — выраженную (субкомпенсация), III — резко выраженную (декомпенсации) [9, 10]. Для ДЭП I ст. характерны [4]: жалобы на повышенную утомляемость, частые головные боли, раздражительность, умеренные нарушения памяти (прежде всего оперативной), умеренное снижение работоспособности, нарушения сна, которые сопровождаются достаточно стойкими объективными расстройствами в виде анизорефлексии, дискоординаторных явлений, легких глазодвигательных нарушений, симптомов орального автоматизма. Имеется рассеянная неврологическая симптоматика, и выявленные нарушения носят субсиндромальный характер [9]. Для ранних стадий ДЭП наиболее характерна сосудистая депрессия и эмоциональная лабильность, а, как известно, эмоциональные расстройства могут оказывать неблагоприятное влияние на когнитивную сферу [8]. Постепенное прогрессирование заболевания и усугубление симптоматики являются мощнейшим фактором социальной дезадаптации [1].
При неадекватном лечении ДЭП прогрессирует и переходит в ДЭП II ст., при которой отмечавшаяся рассеянная неврологическая симптоматика формируется в отдельный доминирующий синдром, который наиболее существенно снижает профессиональную и социальную адаптацию больного [4, 9]. Появляются тревожные и депрессивные реакции, когнитивные расстройства усугубляются, снижается мыслительная продукция, волевая активность, ухудшается профессиональная память, отмечается вязкость мышления, сужение круга интересов, снижение критики и изменение личности. Нарушаются циркадианные ритмы в виде дневной сонливости при плохом ночном сне. Для ДЭП II ст. характерно: углубление нарушений памяти и снижение функции внимания, нарастание интеллектуальных и эмоциональных расстройств, значительное снижение работоспособности. Несколько реже имеются жалобы на хроническую утомляемость, головную боль и другие проявления астенического синдрома. У части больных выявляются легкие подкорковые нарушения и изменения походки (она становится шаркающей, семенящей). Более отчетливо проявляется очаговая симптоматика в виде оживления рефлексов орального автоматизма, центральной недостаточности лицевого и подъязычного нервов, координаторных и глазодвигательных расстройств, пирамидной недостаточности, амиостатического синдрома [4].
При ДЭП III ст. количество жалоб уменьшается, что обусловлено снижением критики больных к своему состоянию, выраженность интеллектуально-мнестических и неврологических расстройств нарастает, наблюдаются немотивированные поступки, неадекватные реакции, эмоциональные расстройства характеризуются дистимически-дисфорическим фоном настроения с раздражительностью, недовольством окружающим и слабодушием. Для этой стадии характерны: четко очерченные дискоординаторный, амиостатический, психоорганический, псевдобульбарный, пирамидный синдромы. Чаще наблюдаются пароксизмальные состояния — падения, обмороки, эпилептические припадки. Основное отличие ДЭП III ст. от ДЭП II ст. заключается в том, что при ДЭП III ст. в клинике наблюдается несколько достаточно выраженных синдромов, тогда как при ДЭП II ст. явно преобладает какой-либо один из них [4, 9].
Схематично соотношение удельного веса жалоб и неврологической симптоматики на разных стадиях ДЭП изображено на рис.
Диагностика ДЭП возможна при наличии следующих критериев [4]: 1) объективно выявляемые нейропсихологические или неврологические симптомы; 2) признаки ЦВЗ, включающие факторы риска (артериальная гипертензия, гиперлипидемия, сахарный диабет, нарушения сердечного ритма и др.), и/или анамнестические признаки, и/или инструментально подтвержденные признаки поражения мозговых сосудов или вещества мозга; 3) свидетельства причинно-следственной связи между (1) и (2); 4) соответствие динамики нейропсихологического и неврологического дефицита особенностям течения ЦВЗ (тенденция к прогрессированию с чередованием периодов резкого ухудшения, частичного регресса и относительной стабилизации); 5) соответствие выявляемых при компьютерной томографии/магнитно-резонансной томографии изменений вещества мозга сосудистого генеза ведущим клиническим проявлениям; 6) исключение других заболеваний, способных объяснить клиническую картину.
Диагностические критерии ДЭП [11]: 1) наличие признаков (клинических, анамнестических, инструментальных) поражений головного мозга; 2) наличие признаков острой или хронической дисциркуляции (клинических, анамнестических, инструментальных); 3) наличие причинно-следственной связи между нарушениями и развитием клинической, нейропсихологической, психиатрической симптоматики; 4) клинические и параклинические прогрессирования сосудистой мозговой недостаточности.
Течение ДЭП и прогноз. Выделяют стабильное, медленно прогрессирующее (с пароксизмами и преходящими нарушениями мозгового кровообращения и без сосудистых эпизодов), приступообразное, быстро прогрессирующее течение. Стабильное и медленно прогрессирующее более характерны для ДЭП I ст., которая может продолжаться в течение 7–12 лет. При быстро прогредиентном варианте ДЭП II или III ст. развиваются менее чем за 5 лет болезни. Клинический прогноз ДЭП III ст. неблагоприятен, на этой стадии заболевания больные нередко нуждаются в уходе, а иногда полностью беспомощны в быту.
Когнитивные нарушения являются ключевым проявлением ДЭП, которое во многом определяет тяжесть состояния больных. Они могут служить важнейшим диагностическим критерием ДЭП и являются, возможно, лучшим ориентиром для оценки динамики заболевания [2]. На ранней стадии ДЭП преобладают умеренные нейродинамические нарушения в виде замедленности, аспонтанности, снижения работоспособности, истощаемости, ослабления концентрации внимания. Тем не менее, такие пациенты в целом хорошо справляются с тестами, не предусматривающими учета времени выполнения, это соответствует легкой степени когнитивных нарушений [2]. Дальнейшее прогрессирование когнитивного дефекта при ДЭП сопряжено с развитием деменции, при которой когнитивный дефицит (независимо от двигательных и других симптомов!) приводит к ограничению повседневной активности и хотя бы частичной утрате бытовой независимости [2].
Лечение пациентов с ДЭП — сложная медико-социальная проблема и, по сути, ограничено терапевтическим воздействием на проявления ДЭП I и II ст. Основными направлениями ведения данных больных являются купирование развившейся декомпенсации патологического процесса, профилактика прогрессирования заболевания, в том числе инсульта, снижение выраженности когнитивных расстройств, неврологического дефицита [10, 11]. Наиболее эффективной мерой по предупреждению дальнейшего прогрессирования заболевания является воздействие на сосудистые факторы риска, прежде всего правильная гипотензивная терапия, коррекция углеводного и липидного обменов, изменения сосудистого тонуса, повышения церебральной перфузии, улучшения метаболизма мозговой ткани [2].
Основой терапии, направленной на улучшение самочувствия пациента с ДЭП и улучшение качества его жизни, являются препараты, воздействующие на мозговое кровообращение на микроциркуляторном уровне (вазоактивные препараты), и препараты, улучшающие обменные процессы в головном мозге (ноотропные средства). Вазоактивные препараты улучшают кровоснабжение головного мозга за счет расширения сосудов микроциркуляторного русла. К ним относятся: блокаторы фосфодиэстеразы (такие как пентоксфиллин), в том числе растительного происхождения (гинкго билоба); кальциевые блокаторы, эффект которых наиболее выражен в том случае, если кровоток нарушен в бассейне позвоночных артерий, кровоснабжающих ствол мозга; α-адреноблокаторы, действующие на рецепторы сосудистой стенки. Ноотропные средства позволяют повысить нейрональную пластичность, таким образом, увеличить адаптационные возможности нервных клеток и снизить их подверженность воздействию повреждающих факторов за счет улучшения обменных процессов в нейронах. Ноотропные препараты оказывают позитивное влияние на высшие интегративные функции мозга, облегчают процессы обучения, консолидацию памяти.
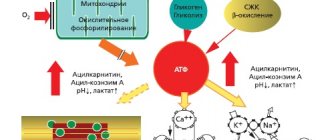
Сегодня нейротрофичность, нейропротекция, нейропластичность и нейрогенез рассматриваются как фундаментальные нейробиологические процессы, участвующие в реализации эндогенной защитной активности, а также в попытках противодействовать патофизиологическим повреждающим механизмам и стимулировании эндогенного восстановления. Классическая концепция нейропротекции подразумевает подавление отдельного патофизиологического механизма при использовании соответствующего препарата [12]. Действие различных препаратов направлено на усиление окисления глюкозы в митохондриях (Актовегин), торможение окисления длинноцепочечных жирных кислот, что увеличивает синтез аденозинтрифосфорной кислоты (АТФ) и нейтрализацию радикалов кислорода, продукция которых в условиях ишемии нарастает [13].
На сегодняшний день существует несколько фармакологических групп препаратов нейрометаболического типа действия. Их условно можно разделить на классические, используемые в течение нескольких десятилетий для лечения больных с когнитивными нарушениями, и препараты, относительно недавно получившие широкое распространение в практике реабилитации больных с сосудистыми заболеваниями головного мозга, а первоначально предложенные для лечения болезни Альцгеймера. К первой группе относятся Актовегин, пирацетам, пиридитол и церебролизин [6]. Одним из препаратов, обладающим широким спектром фармакологических эффектов (антигипоксантным, антиоксидантным), является Актовегин, препарат который оказывает нейротрофическое действие. Антиоксидантный и антиапоптотический механизмы действия лежат в основе нейропротективных свойств Актовегина. Он не только улучшает транспорт глюкозы и поглощение кислорода, но и стимулирует их утилизацию, что улучшает кислородный метаболизм даже в условиях гипоксии.
Нарушение когнитивных функций (дефицит внимания, его концентрации, нарушение способности быстрой ориентации в меняющейся обстановке; снижение памяти, особенно на текущие события; замедленность мышления, быстрая истощаемость при напряженной умственной работе, сужение круга интересов) — одно из наиболее часто встречающихся проявлений ЦВЗ. Лечение когнитивных нарушений при ДЭП должно, прежде всего, включать меры по предупреждению дальнейшего повреждения мозговых сосудов и вещества мозга, улучшению и долгосрочной стабилизации когнитивных функций, коррекции других клинических проявлений заболевания [2]. На I и II ст. ДЭП когнитивные нарушения присутствуют в 88% случаев. Для улучшения когнитивных функций применяется широкий спектр ноотропных и нейропротекторных препаратов [8].
Проведено двойное слепое плацебо-контролируемое исследование по оценке терапевтического влияния препарата Актовегин (таблетированная форма, содержащая 200 мг активного вещества) на мнестико-интеллектуальные способности у больных с ЦВЗ [14]. В исследование были включены 120 пациентов с ЦВЗ, средний возраст пациентов составил около 67 лет (60–72 года), длительность заболевания в среднем — 2,5 года. Все пациенты были рандомизированы на 3 группы: группа 1 (n = 40), принимавшие Актовегин по 3 таблетки 3 раза/день; группа 2 (n = 40) — плацебо, из них: 20 пациентов принимали по 2 таблетки 3 раза/день, 20 пациентов — по 3 драже 3 раза/день; группа 3 (n = 40) — Актовегин по 2 таблетки 3 раза/день. Продолжительность терапии составила 12 недель, с оценкой динамики состояния до начала терапии, после 4, 8 и 12 недели лечения. Для оценки клинической эффективности Актовегина использовались тесты, оценивающие мнестико-интелектуальные функции (память, синтетические и аналитические способности, концентрация внимания, запонимание). В ходе исследования показана высокая эффективность (92%) 12-недельной терапии Актовегином форте на мнестико-интеллектуальные способности у больных ЦВЗ. Таким образом, таблетированную форму Актовегина можно рекомендовать для длительного амбулаторного лечения пожилых пациентов с ДЭП.
Проведено многоцентровое исследование по оценке эффективности Актовегина у 1549 пациентов пожилого возраста с нарушением церебральных функций [15]. Средний возраст больных составил 74,1 года. Пациенты, включенные в исследование, получали лечение по стандартной схеме: 2 недели в/в инъекций 10 мл раствора Актовегина, а затем 4 недели перорального приема таблеток Актовегина, покрытых оболочкой (по 2 табл. 3 раза/день). Пациенты обследовались до начала терапии, через две недели после в/в терапии и через 4 недели пероральной терапии. Все исходные значения сравнивались с результатами через 2 и через 6 недель терапии, результаты, полученные через 2 недели, также сравнивались с результатами после 6 недель лечения. Через 4 недели от начала терапии Актовегином в 80% случаев отмечено улучшение общего состояния: уменьшение выраженности (или прекращении) головной боли, головокружения, беспокойства и чувства страха, улучшение памяти и концентрации внимания (по данным психологического тестирования). В 10,9% отмечены нежелательные эффекты препарата (ощущение жара и тошноты), которые наблюдались в первую, парентеральную фазу терапии. В исследовании показана практическая значимость комбинированной терапии: старт-терапии с в/в 10 мл Актовегина для достижения быстрого и хорошего ответа, с последующим продолжением перорального приема драже Актовегина форте). Предложенная схема лечения Актовегином может быть рекомендована для длительной терапии пожилых пациентов с органическим синдромом.
В ряде клинических исследований показано, что применение препарата Актовегин положительно влияет на когнитивные функции, улучшает психологические и поведенческие реакции, а также наиболее эффективно при легких и умеренных когнитивных нарушениях. В настоящее время разработаны и широко используются терапевтические схемы лечения ЦВЗ с назначением Актовегина: по 10 мл (400 мг) на 200 мл физраствора в/в капельно курсом 7–10 дней, затем по 1–2 драже (200–400 мг) 3 раза/день внутрь в течение 1–2 месяцев, при наличии мнестико-интеллектуальных нарушениях у лиц пожилого возраста — до 12 недель по 2–3 драже 3 раза/день. Повторные курсы через 6–8 месяцев [16].
В профилактике и терапии умеренных когнитивных расстройств сосудистого генеза показана высокая эффективность нейрометаболических препаратов, среди которых препарат Цераксон (цитиколин) [17–19]. Препарат обладает целевым воздействием на ключевые звенья процессов гибели нервных клеток сосудистой, травматической, токсической и другой этиологии. Поскольку Цераксон является естественным метаболитом биохимических процессов в организме и сочетает в своем спектре действия нейромедиаторные и нейрометаболические эффекты. Важнейшим из них является активация биосинтеза мембранных фосфолипидов нейронов мозга, в первую очередь фосфатидилхолина. Цитиколин может коррегировать когнитивные нарушения уже на начальных этапах их проявлений у пациентов с ДЭП [18], его применение способствует регрессу когнитивных нарушений, уменьшает сопутствующие эмоционально-аффективные и поведенческие расстройства. Цераксон способен потенцировать действие других лекарственных средств при лечении острой цереброваскулярной патологии, в том числе тромболитиков, антиагрегантов и нейротрофиков [17]. Схема назначения препарата Цераксон: по 1000 мг 10 дней в/м или в/в один раз в день, затем внутрь раствор Цераксона 2 мл 3 раза/день в течение 3 месяцев [18] или по схеме [20]: ежедневно в дозе 3 мл 2 раза в день на протяжении 6 месяцев. Длительность нейропротекции может длиться до 12 месяцев.
Заключение
Умеренные и выраженные когнитивные нарушения цереброваскулярной природы могут служить эквивалентом ДЭП, выявляются у 3–16 лиц старше 60 лет [2]. Основным в лечении пациента с ДЭП I или II ст. в амбулаторно-поликлинических условиях является купирование развившейся декомпенсации патологического процесса, профилактика прогрессирования заболевания, в том числе инсульта, снижение выраженности когнитивных расстройств и неврологического дефицита [21].
В ряде проведенных исследований показана высокая клиническая эффективность назначения препаратов Актовегин и Цераксон в качестве длительной нейропротекции у больных дисциркуляторной энцефалопатией.
Литература
- Шавловская О. А. Медико-социальные аспекты пожилого возраста / Статьи Всероссийской научно-практической конференции с Международным участием «Общество и здоровье: современное состояние и тенденции развития». 2013, т. 2, с. 365–371.
- Левин О. С. Применение экстракта Ginkgo biloba (EGb 761) для лечения когнитивных нарушений при дисциркуляторной энцефалопатии // РМЖ. 2009, т. 17, № 20, с. 1356–1361.
- Максудов Г. А. Дисциркуляторная энцефалопатия. В кн.: Сосудистые заболевания нервной системы. Под ред. Е. В. Шмидта. М.: Медицина, 1975, С. 501–512.
- Темникова Е. А. Использование препарата Омарон в практике врача терапевта при работе с пациентами старческого возраста // РМЖ. 2009, т. 17, № 20, 1345–1356.
- Путилина М. В. Современные представления о терапии тревожно-депрессивных расстройств при хронической ишемии головного мозга // РМЖ. 2011, № 9, с. 569–573.
- Поляков И. А., Малоземов И. В., Степанова Н. С. Антиоксидантная терапия в комплексном лечении дисциркуляторной энцефалопатии // Terra Medica Nova. 2009, № 4–5, с. 22–24.
- Штульман Д. Р., Левин О. С. Неврология. Справочник практического врача. М.: МЕДпресс-информ, 2008, 1025 с.
- Захаров В. В., Локшина А. Б. Когнитивные нарушения при дисциркуляторной энцефалопатии // РМЖ. 2009, т. 17, № 20, с. 1325–1329.
- Дадашева М. Н., Подрезова Л. А., Шучалин О. Г. и др. Алгоритм терапии дисциркуляторной энцефалопатии у больных с артериальной гипертензией в общей врачебной практике // РМЖ. 2009, т. 17, № 20, с. 1320–1324.
- Кадыков А. С., Шахпаронова Н. В. Сосудистые заболевания головного мозга. Миклош, 2006, 192 с.
- Дамулин И. В., Парфенов В. А., Скоромец А. А., Яхно Н. Н. Нарушения кровообращения в головном и спинном мозге. В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н. Н. Яхно, Д. Р. Штульман. М., 2003. С. 231–302.
- Шахпаронова Н. В., Кадыков А. С. Антиоксидантная терапия при цереброваскулярных заболеваниях // РМЖ. 2010, т. 18, № 26, с. 1570–1572.
- Асташкин Е. И. Влияние Актовегина на энергетический обмен клеток при ишемии. Труды ММА им. И. М. Сеченова. М., 2009: 1–4.
- Янсен В., Брукнер Г. В. Лечение хронической цереброваскулярной недостаточности с использованием драже Актовегин форте (двойное слепое плацебо-контролируемое исследование) // РМЖ. 2002. Т. 10. № 12–13. С. 543–546.
- Летцел Х., Шиктигер У. Применение Актовегина у пожилых пациентов с органическими синдромами. Мультицентровое исследование 1549 пациентов // РМЖ. 2003. Т. 11. № 25. С. 1428–1431.
- Шавловская О. А. Применение Актовегина при нейропротективной терапии больных с цереброваскулярными заболеваниями // Журнал неврологии и психиатрии им. С. С. Корсакова. 2013, т. 113, № 6, с. 74–76.
- Бойко А. Н., Кабанов А. А. Цитоколин: новые возможности нейропротекции и фармакотерапии при заболеваниях нервной системы // Фарматека. 2007, № 15, С. 42–48.
- Путилина М. В. Особенности комбинированной нейропротекторной терапии острых нарушений мозгового кровообращения // РМЖ. 2009, т. 17, № 4, с. 261–267.
- Путилина М. В., Шабалина Н. И. Возможности ранней коррекции легких и умеренных когнитивных расстройств у пациентов с дисциркуляторной энцефалопатией // Лечащий Врач. 2010, № 9, с. 100–103.
- Шавловская О. А. Нейропротективная терапия неврологического дефицита при цереброваскулярной патологии // Практикующий врач сегодня. 2012, № 3, с. 39–44.
- Шавловская О. А. Эффективность препаратов антиоксидантного типа действия в терапии легких и умеренных когнитивных расстройств // РМЖ. 2013, т. 21, № 10, с. 476–480.
О. А. Шавловская, доктор медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Контактная информация
Д. Молчанов*
Болезнь Альцгеймера (БА) – первичное дегенеративное заболевание головного мозга, возникающее обычно у лиц старше 50 лет и характеризующееся прогрессирующим снижением интеллекта, нарушением памяти и изменением личности. Первое описание клинической картины этой патологии сделал в 1907 г. Alois Alzheimer, но расшифровка причин её развития стала возможной лишь в конце ХХ века благодаря серии сложных иммунопатохимических и генетических исследований. Несмотря на определённые успехи в поиске эффективных средств фармакотерапии БА, это заболевание по-прежнему занимает одну из лидирующих позиций в списке патологических состояний центральной нервной системы, приводящих к тяжёлой инвалидизации и социальной дезадаптации больных. Учитывая тенденцию к увеличению продолжительности жизни населения в развитых странах и связанный с этим рост заболеваемости БА, следует ожидать, что эта проблема сохранит свою актуальность в ближайшем будущем. Программа ІІІ Национального конгресса неврологов, психиатров и наркологов Украины традиционно была насыщена докладами ведущих учёных по вопросам оказания помощи больным с нарушениями когнитивных функций, в т. ч. обусловленными процессами нейродегенерации. Предлагаем вниманию читателей обзор выступлений авторитетных европейских специалистов, признанных экспертами в сфере изучения возможностей профилактики и лечения болезни Альцгеймера. Новыми экспериментальными и клиническими данными в отношении патогенеза БА и применения фармакологической нейропротекции у лиц с возрастными когнитивными нарушениями поделился в своём выступлении доктор медицинских наук Антон Альварес (EuroEspes Biomedical Research Center, Испания). На сегодняшний день не найдено возможности радикально влиять на процесс прогрессирования сенильной нейродегенерации, проявляющийся клиникой БА, несмотря на заметные достижения в расшифровке механизмов формирования данной патологии. Поэтому в современной фармакотерапии БА поиск направлен на открытие новых средств, способных замедлять прогрессирования этого процесса. Потенциал профилактики и лечения БА сегодня связан с использованием терапевтических агентов, способных влиять на факторы риска развития заболевания, модифицировать его течение, а также уменьшать степень функционального дефицита. Знание основных биомаркеров БА позволяет адекватно оценивать клинический потенциал отдельных препаратов в экспериментах. Так, основным патоморфологическим проявлением нейродегенерации при БА является отложение β-амилоида (Ab) в сенильных бляшках. β-Амилоид образуется из белка предшественника амилоида, представляющий собой один из протеинов, входящих в состав клеточных мембран. В нормальных условиях белок предшественник амилоида метаболизируется до нескольких фрагментов, одним из которых является β-амилоид. Образование β-амилоида возможно в виде двух форм – Aβ40 и Aβ42, различающихся между собой по количеству аминокислотных остатков и весу. Более тяжёлая форма Aβ42 быстро образует нерастворимый агрегат, в настоящее время этой форме амилоида придают особое значение. Образование и отложение β-амилоида, гиперфосфорилирование тау-протеина, накопление патологических протеинов, повышение активности окислительных ферментов в свою очередь приводят к гиперпродукции свободных радикалов. Тяжесть когнитивных нарушений при БА соответствует выраженности патоморфологических изменений – количеству сенильных бляшек, нейрофибриллярных отложений и утраченных синапсов. О степени замедления процесса отложения Aβ под влиянием терапии исследователи судят путём измерения концентрации данного вещества в цереброспинальной жидкости, а также с помощью метода позитронно-эмиссионной томографии. Гибель нейронов, сопровождающаяся атрофией определённых участков головного мозга, при БА также может быть оценена методами нейровизуализации. О метаболической активности структур ЦНС судят, изучая обмен глюкозы в нервной ткани. Оценка клинической эффективности средств фармакотерапии БА осуществляется по стандартизованным шкалам, позволяющим определить степень и темп снижения когнитивных функций, а также выраженность некогнитивной симптоматики на фоне лечения. При этом длительность наблюдения за больными для объективной оценки эффекта проводимой терапии должна составлять не менее 1-2 лет. Отдельно хотелось бы остановиться на иммунотрофических механизмах прогрессирования БА, один из которых связан со снижением содержания в организме инсулиноподобного фактора роста (IGF-I) и одновременным повышением уровня фактора некроза опухоли (TNFα). Инсулиноподобный фактор роста оказывает влияние на процессы нейропротекции, в то время как фактор некроза опухолей потенцирует процессы воспаления и нейротоксичности. Роль дисбаланса этих эндогенных веществ в патогенезе нейродегенерации подтверждена во множестве экспериментальных работ. Так, в исследовании Carro и соавт. (2002) показано, что периферическое введение инсулиноподобного фактора роста замедляет образование β-амилоида у грызунов, в то время как фактор некроза опухоли оказывает действие, противоположное эффектам IGF-I. В 2006 г. этим же коллективом исследователей доказано, что блокада IGF-I рецепторов в хориоидальном сплетении вызывает БА-подобную нейропатию у мышей. Повышение уровня TNFα на фоне снижения IGF-I в плазме крови при умеренных когнитивных расстройствах и БА показано в нашем исследовании (A. Alvarez и соавт., 2007). Таким образом, в настоящее время имеются экспериментальные предпосылки использования фармакологических агентов, способных устранять иммунотрофический дисбаланс, с целью замедления процессов нейродегенерации при БА. В этой связи большой интерес представляет применение Церебролизина – нейропротектора с доказанной клинической эффективностью. Церебролизин представляет собой уникальный пептидергический препарат с активностью, аналогичной действию естественных нейротрофических факторов. Нейротрофические свойства Церебролизина доказаны работами многих исследователей: S. Shimazu и соавт. (1992), T Satou. и соавт. (1993), E. Masliah и соавт. (1999), M. Hartbauer и соавт. (2001), Y. Tatebayashi и соавт. (2003). К сегодняшнему дню также накоплена обширная доказательная база в отношении способности Церебролизина замедлять нейродегенерацию при БА. В работах Akay и соавт. (1992) продемонстрирован его нейротрофический эффект на холинергические нейроны, которые особенно подвержены дегенерации при этой патологии. Albretch и соавт. в 1993 г. показали способность препарата повышать выживаемость нейронов в изолированной культуре, а также активировать ветвление дендритов. Способность Церебролизина замедлять нейродегенерацию и апоптоз, индуцированные β-амилоидом и липополисахаридами (LPS), была доказана в нашей экспериментальной работе A. Alvarez и соавт. (1999) и в следующем году показано, что Церебролизин подавляет индуцированную Aβ и LPS активацию микроглии. В 1999 г. Lombardi и соавт. продемонстрировали снижение выработки провоспалительного интерлейкина 1a, вызванной липополисахаридной активацией микроглии на фоне введения Церебролизина. В исследовании Rockenstein и соавт. (2002), проведенном на грызунах, показано, что введение Церебролизина достоверно уменьшает отложение патологического амилоида в ткани фронтальной коры головного мозга и сохраняет целостность синапсов по сравнению с плацебо. В более поздней работе (2006) этим же авторам удалось объяснить механизм, благодаря которому реализуется указанный эффект препарата. Длительное применение Церебролизина замедляет фосфорилирование белка предшественника амилоида (АРР) в цепи созревания β-амилоида, тем самым прерывается патологический процесс, логическим завершением которого является потеря синаптических связей между нейронами серого вещества и накопление патологических протеинов. Кроме того, нами было показано, что Церебролизин обладает дозозависимой способностью к восстановлению иммунотрофического баланса нервной ткани за счёт нормализации уровней IGF-I и TNFβ, роль которых в патогенезе БА была рассмотрена выше, при этом наиболее выраженный эффект наблюдался при использовании доз 30 и 60 мл. Это свойство препарата также может изменять течение БА, приводя к замедлению её прогрессирования. Таким образом, к доклиническим свидетельствам способности Церебролизина модифицировать течение БА можно отнести результаты экспериментальных исследований, продемонстрировавших его способность уменьшать отложение в нервной ткани амилоида, замедлять нейрональную дегенерацию и потерю синапсов, а также снижать микроглиальную активацию. Сегодня также имеются убедительные клинические доказательства эффективности данного нейротрофического препарата при БА. В работах Bae и соавт. (2000), Moessler и соавт. (2000), Ruether и соавт. (2001), Rainer и соавт. (2002), Panisset и соавт. (2002), а также нашего авторского коллектива показана способность Церебролизина улучшать когнитивные функции, уменьшать выраженность некогнитивных симптомов, повышать активность повседневной жизни и глобального функционирования больных с возраст-зависимой деменцией. В этом году проведённое нами совместно с профессором Мурешану (Румыния) исследование продемонстрировало феномен повышения индекса биоэлектрической активности мозга за счёт усиления мощности a и b ритма на фоне терапии Церебролизином, а также была показана прямая корреляционная связь между этим показателем и улучшением когнитивных функций у пациентов с сосудистой деменцией при оценке умственных нарушений по шкале ADAScog. Двойное слепое плацебо контролированное исследование трёх дозировочных режимов Церебролизина у 279 пациентов с БА лёгкой и средней степени тяжести (A. Alvarez и соавт., 2006) продемонстрировало, что выраженность когнитивных нарушений, оцениваемых по шкале ADAScog, в наибольшей степени уменьшалась при использовании дозы 10 мл/сут на протяжении 12 нед терапии, в то время как дозировки 30 и 60 мл/сут при такой же длительности терапии существенно не влияли на когнитивную сферу больных. Подобные терапевтические различия дозировок Церебролизина по степени влияния на когнитивные функции в пользу дозы 10 мл/сут даёт систематический обзор крупнейшей библиотеки доказательной базы данных – Cochrane Database (таблица). При этом способность Церебролизина улучшать когнитивные функции сравнима, а в некоторых исследованиях превышает таковую ингибиторов холинэстеразы. При анализе способности Церебролизина повышать ежедневную активность пациентов отмечено, что сравнимый положительный эффект оказывали дозы 10 и 30 мл/сут. В то же время максимальное и достоверное уменьшение выраженности нейропсихиатрических симптомов отмечалось в группе больных, получавших дозу 60 мл/сут. Резюмируя полученные в нашем исследовании данные, следует отметить, что положительный клинический эффект при БА присущ всему спектру терапевтических доз Церебролизина, однако выраженность этого эффекта различается по отношению к отдельным показателям нейрофункционального статуса больных. При анализе безопасности Церебролизина отмечено отсутствие достоверных различий между тремя терапевтическими группами (10, 30 и 60 мл/сут) и группой плацебо по частоте побочных эффектов, использованию вспомогательных препаратов и изменению лабораторных показателей. Следует также отметить, что терапевтические преимущества Церебролизина сохранялись в течение 3 мес. после окончания курса лечения, подтверждая тем самым модифицирующий и стабилизирующий эффект Церебролизина на течение БА. Результаты исследования позволяют сделать вывод о целесообразности и безопасности применения этого нейропротектора в лечении БА лёгкой и средней степени тяжести. Анализ возможностей патогенетической фармакотерапии при БА продолжил профессор Дафин Мурешану (Department of Neurology University of Medicine and Pharmacy, Cluj Napoca, Румыния). Патологический процесс при БА являет собой особый вид нейродегенерации, характеризующийся прогрессивной потерей пресинаптических терминалей нейронов, которая начинается в гиппокампе и постепенно распространяется на большинство участков коры головного мозга. Именно потеря синаптических связей является морфологическим субстратом всего континуума когнитивных (от лёгкого мнестического дефицита до выраженной деменции) и моторных расстройств. Нейроморфологическому паттерну БА соответствует клинический паттерн, получивший название ретрогенеза, то есть обратного развития функций высшей нервной деятельности человека от состояния зрелости до статуса, характерного для раннего детства. Концепция ретрогенеза получила множество подтверждений. Так, картина метаболической активности головного мозга у больного в поздней стадии БА при проведении позитронно-эмиссионной томографии мало чем отличается от таковой у нормально развивающегося грудного ребёнка. Фундаментальные причины нейродегенерации альцгеймеровского типа лежат в плоскости молекулярной химии нервной ткани. Ключевым моментом патогенеза БА является генетически обусловленный дефект процессинга внутриклеточных протеинов, приводящий к образованию и накоплению в нейронах их нейротоксичных форм (b-амилоид, а именно Ab42). Многочисленные бляшки, состоящие из отложений патологического амилоида, вызывают дегенерацию нейронов и их отростков. Из дополнительных факторов, способствующих гибели нейронов, следует отметить свободнорадикальное окисление, эксайтотоксичность, хроническое воспаление, патологический апоптоз. Прогрессирующее уменьшение плотности нейронов и атрофия структур головного мозга до определённого момента времени компенсируется благодаря непрерывному процессу регенерации нервной ткани, составляющими которого являются нейротрофика, нейропластичность и нейропротекция. Нейротрофика определяет процессы пролиферации, миграции, дифференциации и выживания. Нейропластичность характеризуется постоянно протекающими процессами регенерации в случаях естественных либо патологических повреждений, в то время как нейропротекция включает разнообразные механизмы, направленные против факторов агрессии. Целью современной фармакотерапии БА является потенцирование защитных и нейрорегенераторных механизмов с одновременным угнетением факторов, способствующих потере нейрональных связей. Современные возможности лечения пациентов с БА включают три стратегии: симптоматическую, болезнь-модифицирующую и превентивную. Первая включает применение антихолинэстеразных средств, облегчающих передачу нервных импульсов в холинергических синапсах, а также модуляторов глутаматергической системы, без оказания влияния этой группой средств на течение болезни. Вторая заключается в назначении природных антиоксидантов (витамина Е, экстракта Гинкго билоба), активаторов эндогенных нейротрофических факторов, ингибиторов синтеза белка предшественника β-амилоида и других средств, влияющих на патогенез и прогрессирование деменции, большинство из которых находится в стадии экспериментального изучения. Профилактика деменции – ещё более сложное направление, связанное с коррекцией факторов риска и включающее лечение артериальной гипертензии, антигиперлипидемическую терапию (влияния на сосудистые причины прогрессирующей когнитивной дисфункции), применение противовоспалительных средств, заместительной гормональной терапии у женщин и др. Перспективные разработки ведутся в направлении синтеза универсальных молекул, сочетающих в себе все три стратегии лечения. Возможно, в ближайшем будущем будут созданы препараты, обладающие свойствами нескольких классов препаратов, например ингибиторов холинэстеразы, селективных ингибиторов моноаминоксидазы, агонистов М2 рецепторов, антиоксидантов и нейропротекторов. Но пока этот потенциал не раскрыт, наиболее перспективным направлением терапии БА остаётся применение средств, обладающих нейротрофическими и нейропротективными свойствами. Однако результаты научного поиска в данном направлении также нельзя считать однозначными. На сегодня описано более 160 нейротрофических факторов и факторов роста с нейротрофическими свойствами, экспериментальным путём составлены профили их дефицита при различных нейродегенеративных заболеваниях. Известны также десятки цитопротекторов, которые, к сожалению, не подтвердили своей клинической эффективности при БА (A. Lise Labiche, C. James Grotta, 2004). Совершенно очевидно, что прерывая лишь одну реакцию сложнейшего патохимического каскада этого заболевания, невозможно существенно замедлить процесс нейродегенерации и, соответственно, повлиять на клиническое течение деменции. Следовательно, выход снова следует искать в применении препаратов направленного действия, ярким представителем которых является Церебролизин – комбинация целого ряда нейротрофических и нейропротективных факторов природного происхождения (низкомолекулярных нейропептидов, фосфолипидов, нейротропных витаминов, эссенциальных микроэлементов). Предпосылки к применению Церебролизина при деменции связаны с наличием у этого комплексного препарата специфических механизмов замедления процесса нейродегенерации. Ключевым моментом является способность Церебролизина ингибировать фосфорилирование белка предшественника патологического β-амилоида, подтверждённая в экспериментальных исследованиях. На сегодняшний день доказательная база по клиническому применению Церебролизина как болезнь-модифицирующего средства при БА включает результаты исследований, проведённых независимо друг от друга различными коллективами во многих странах мира (E. Ruether, 1994, 2001; M. Rainer, 1997; SY. Bae, 2000; S. Xiao, 2000; M. Panisset, 2000; A. Alvarez, 2003, 2006). Обнадеживающие данные шести завершённых клинических исследований, подтверждающих способность Церебролизина модифицировать течение БА, объединены в специальном обзоре Департамента здравоохранения США (U. S. Department of Health and Human Services), посвященном фармакологическому лечению деменции. Следует отметить, что этот официальный документ объективно отражает точку зрения экспертов авторитетной организации на перспективы применения современных нейропротекторов для профилактики и терапии деменции, а данные, касающиеся применения Церебролизина, демонстрируют возрастающий интерес исследователей и практиков к этому хорошо известному препарату.
* Здоров’я Украïни 2007 год.
Современные концепции нейроцитопротекторной терапии
В настоящее время и фармакологи, и врачи рассматривают нейроцитопротекторы как лекарственные средства, обладающие свойствами повышать выживаемость нейронального клеточного кластера (совокупность нейронов, клеток глии и их рецепторно-синаптического аппарата) в условиях острой и хронической ишемии/гипоксии и других патологических воздействий. Данная группа лекарств объединена не единым механизмом действия, а только названием, которое переводится как «защита нервных клеток», и поскольку речь идет именно о нервных клетках, то сегодня и это название, и сами препараты прочно вошли в клиническую практику только врачей-неврологов [1-3]. Это значительно удлиняет путь к полноценной и эффективной нейропротекции для пациентов, которые обращаются с сосудистыми проблемами к терапевтам, кардиологам, сосудистым хирургам и врачам общей практики [3]. Между тем механизмы не просто нейро-, но, прежде всего, цитопротекторного действия многих таких препаратов позволяют с успехом применять их у пациентов с сосудистой коморбидностью, приводящей к прогрессирующей церебральной недостаточности, как это имеет место при патологии сердца, периферических сосудов, артериальной гипертонии, системных заболеваниях, сопровождающихся эндотелиальной дисфункцией. Все эти патологические состояния ведут к острой или хронической церебральной гипоперфузии (ишемии) и, следовательно, к расстройствам тканевого метаболизма [3].
Эффективность цитопротекторов, действующих на основе разных механизмов, может быть объяснена большим числом ишемических дисбалансов (или аутокоидозов), названных так потому, что в состав их каскадных реакций вовлекается большое число аутокоидов — дизрегуляторов внутриклеточного и внутритканевого гомеостаза, которые вырабатывает сам организм в ответ на первичную гипоксию/ишемию. Метаболический, оксидантный, медиаторный, цитокиновый, некробиотический и апоптозный дисбалансы при острой или хронической ишемии протекают с разной скоростью, но в итоге приводят к поэтапной гибели участков ткани мозга разных размеров — очагов больших размеров при инсультах, лакунарных очагов при хронической ишемии мозга (ХИМ) и «малых» инсультах [1, 3]. При этом известно, что отдельные звенья ишемического каскада можно замедлить или блокировать нейроци-топротекцией — своевременными воздействиями, направленными на церебральные повреждения, вызванные ишемией для предотвращения и/или коррекции функционально-морфологических изменений со стороны церебральных и соматических систем организма [3].
Актуальность широкого применения нейроцитопротекторной терапии связана с наблюдающимся в последние годы увеличением числа больных с острой и хронической церебральной ишемией, атрофическими и нейродегенеративными процессами, обусловленными инсультом, стенозирующими процессами в брахиоцефальных артериях (БЦА), сахарным диабетом, артериальной гипертонией, болезнью Альцгеймера. И если острая сосудистая церебральная ишемия обусловливает высокую летальность и быструю инвалидизацию, то хроническая ведет к неуклонному развитию деменции и снижению качества жизни пациентов как пожилого, так и среднего, в том числе работоспособного, возраста и их близких [4], что в свою очередь оборачивается колоссальными социально-экономическими потерями и требует разработки более эффективных средств и методов лечения и профилактики [4].
Постишемическому церебральному разрушению в качестве средств лечения и профилактики можно противопоставить реальный «заслон», которым могут стать нейропластичность и нейрорегенерация. Именно создание препаратов нейротрофического действия несколько десятилетий назад заложило основы нейропротективной терапии. В те годы на мировом и отечественном фармакологических рынках был широко известен только один нейро-протектор — церебролизин. И для врачей, и для огромного числа пациентов церебролизин был и остается испытанным препаратом с высокой клинической эффективностью. К настоящему моменту препарат успешно прошел оценку временем. Благодаря высокой эффективности, низкому числу побочных явлений, успешному применению при неврологических заболеваниях разного генеза (ХИМ, инсульт, черепно-мозговая травма, умеренные когнитивные расстройства, сосудистая деменция, болезнь Альцгеймера), церебролизин занимает важное место в списке современных нейропротекторов. Многолетняя «хорошая клиническая история» препарата сегодня подтверждена не только многочисленными клиническими исследованиями, но и экспериментальными данными, а также многоцентровыми двойными слепыми плацебо-контролируемыми исследованиями последних лет, проводившимися с соблюдением всех стандартов надлежащей клинической практики (GCP) [5-12].
В основу разработки церебролизина как препарата, предназначенного для пептидергической нейропротекции, был положен фармакологически правильный путь использования защищенного комплекса пептидов и аминокислот, обладающих нейротрофическим действием. Нейропротекторное действие созданного австрийскими фармакологами пептидо-аминокислотного комплекса реализуется его положительным влиянием на несколько этапов постишемического нейронального повреждения [8]. Ведь нейропептиды, подобно медиаторам, цитокинам, гормонам и другим продуктам жизнедеятельности самого организма, участвуют в передаче клеткам биологически важной информации, облегчая вне-, внутриклеточные и внутритканевые взаимодействия, а также способствуют активации репаративных и регенераторных клеточных механизмов. Большинство нейропептидов способно активировать образование различных факторов роста (таких как NGF) и их рецепторов (BDNF, Trk и др.). Более того, пептидергические средства способны влиять на «глубинные» процессы, не только плазмона, но и ядра клеток, регулируя динамическое равновесие «весов» внутриклеточного гомеостаза, на одной чаше которых пролиферация клеток, а на другой — апоптоз. Как типичный представитель класса нейропептидов, церебролизин оказывает ингибирую-щее действие на образование FAS-лигандов — сигнальных систем, активирующих апоптоз, что обеспечивает защиту и компенсацию функций нейронов и глиальных клеток, стимулирует образование новых нейрональных связей и обеспечивает и самим клеткам, и их рецепторной активности трофическую поддержку [1-3, 8, 9]. Современные представления связывают основной механизм молекулярного действия церебролизина именно с предупреждением апоптоза — «программируемой» клеточной смерти [3, 8].
Церебролизин представляет собой естественно сбалансированную смесь, состоящую из 15% пептидов с низким молекулярным весом (до 10 000 Д) и набора основных аминокислот и олигопептидов, получаемую из свиного мозга путем специализированной ферментативной обработки. Нейротрофины, содержащиеся в препарате, проявляют действие, сходное с эффектами нейротрофических факторов, а аминокислоты, составляющие до 85% церебролизина, становятся частью питательной среды, необходимой для выживания нейронов. Большинство аминокислот, содержащихся в препарате, воздействуют на NMDA-рецепторы, опосредующие передачу нервного возбуждения через синапсы, либо являются нейротрансмиттерами (глутамат, аспартат) или их предшественниками. Они же могут модулировать рецепторные функции — глицин, серии, аргинин и лизин. Исследования химического состава подтвердили, что церебролизин содержит более 100 коротких пептидов и белков с молекулярной массой до 5800 Д. Среди них выявлено наличие физиологически активных пептидов: тиролиберина, глутатиона, энкефалина и коллагена [3,6-11]. В составе препарата обнаружены также отдельные аминокислоты или небольшие олигопептиды, представляющие собой отдельные блоки и аминокислотные «мотивы» нейротрофинов, определяющие его терапевтические свойства и разнообразие нейротрофи-ноподобных эффектов [3,11].
Открытие в 50-х годах прошлого века ростового фактора нервов и интерес к изучению нейротрофинов послужили поводом для зарождения идеи нейротрофической терапии и частично объяснили механизмы действия церебролизина, заключающиеся в активации и пролиферации глиальных клеток и ранней дифференцировке корковых структур головного мозга [5-8, 11]. Важность этих наблюдений стала очевидной после классических работ, подтвердивших in vivo, что введение церебролизина новорожденным крысам стимулирует рост нейронов гиппокампа, способствуя ветвлению дендритов и увеличению числа синаптических контактов [8, 9, 11, 12]. Более того, современная концепция предупреждения старения с использованием «малых пептидов» говорит о возможностях коррекции возрастных изменений веществами, активирующими тирозинкиназные рецепторы структур мозга, к которым как раз и относится церебролизин [9].
Долгое время дискутировался вопрос об эффективных дозировках церебролизина, пока в многочисленных клинических исследованиях не было установлено, что эффекты церебролизина являются дозозависимыми. Доказательства этой зависимости были обнаружены при проведении экспериментальных работ, в ходе которых было показано, что при инкубации церебролизина с антителами к ростовым факторам выявлено специфическое дозозависимое увеличение связывания с нейротрофическими факторами — CNTF, GDNF, IGF-1(2) и цилиарным нейротрофическим фактором (CNTF). Перерасчет доз в клинических условиях показал, что для достижения оптимального эффекта доза церебролизина должна быть большой. А при изучении «лестницы» доз (0,5, 2,5 и 5 мг/кг) в эксперименте и клинике оказалось, что эффективная доза препарата составляет 2,5 мг/кг в сутки [3, 7-14].
В клинических исследованиях церебролизина, проведенных в разные годы, приняло участие более 3000 больных. В большом числе исследований на фоне применения церебролизина получены достоверные позитивные клинические результаты, выражавшиеся улучшением общего состояния пациентов, расширением социальных контактов, увеличением независимости от посторонней помощи и повышением уровня интеллектуальных возможностей. По данным мультицентровых испытаний церебролизина, у больных в остром периоде каротидного ишемического инсульта при назначении церебролизина в дозах 30 мл в сутки регистрировали более быстрый регресс неврологических симптомов, достоверное улучшение функционального восстановления и навыков самообслуживания в отдаленном постинсультном периоде. В последнем рандомизированном мультицентровом двойном слепом плацебо-контролируемом исследовании эффективности церебролизина при ишемическом инсульте CASTA были выявлены достоверное снижение летальности и более быстрый регресс очаговой симптоматики у больных с тяжелым течением заболевания при суточной дозировке препарата 20 мл. Аналогичные исследования показали, что еще более эффективной и хорошо переносимой является доза 50 мл в сутки [8, 9, 11]. Также выявлены системные эффекты церебролизина: отмечено, что препарат потенцирует действие гипотермии и снижает частоту гнойно-септических осложнений при ишемическом инсульте.
В ряде исследований показана эффективность лечения церебролизином синдрома умеренных когнитивных расстройств у пациентов в возрасте 40-50 лет на основании динамики изменений шкал Тинетти, Маттиса, ADAS-Cog и др. Курсовое лечение в течение 20 дней в дозе 10 мл препарата внутривенно приводило как сразу после завершения курса, так и отсроченно — через 3 мес — к значительному улучшению общего когнитивного статуса, двигательной активности, снижению функций расстройства памяти и внимания [15]. Позитивный эффект терапии был также установлен у больных с сосудистой деменцией [16-21]. Лечение церебролизином способствовало улучшению когнитивных проявлений и нормализовывало параметры ЭЭГ, ассоциированные с когнитивной активностью мозга, выражавшиеся в том числе в снижении θ- и δ- и увеличении α-волн. Через 3 и 6 мес показатели по краткой шкале оценки психического статуса MMSE были достоверно выше у пациентов, получавших церебролизин по сравнению с контролем.
Фундаментальные исследования последних лет позволили уточнить механизмы многокомпонентного действия церебролизина. Среди таких механизмов большая роль отводится защите от окислительного стресса и апоптоза. Так, сравнительное изучение влияния церебролизина на микроглию [22, 23] показало, что введение препарата позволяет блокировать стимулирующие апоптоз воспалительные изменения глиальных клеток. Прямые доказательства антиапоптотического действия церебролизина были получены при изучении культуры корковых нейронов. На модели цитотоксического стресса, вызываемого пониженным содержанием сыворотки в среде, установлено стимулирующее влияние церебролизина на аксональный рост клеток телэнцефа-лона, максимально выраженное на 4-8-е сутки развития эмбриона. Препарат защищал нейроны от дегенерации, моделируемой в искусственной среде с ограниченным содержанием аминокислот. В этих экспериментах под влиянием церебролизина снижалось число клеток с деструктированным в ядре хроматином [24].
Церебролизин, стабилизируя уровень ионов кальция в клетках, способствует сохранению синтеза белков и предотвращает нейроапоптоз, вызываемый глутаматом. Длительность протективного действия препарата была прослежена в период от 48 ч до 2 нед, иллюстрируя широкие возможности его применения как в рамках «терапевтического окна», так и за его пределами. Контроль деструкции ДНК показал более высокую антиапоптотическую активность церебролизина в сравнении с нейротрофическими факторами BDNF, FGF-2 или фракцией аминокислот. Церебролизин втрое снижал число апоптотированных клеток культуры Р12 феохромоцитомы после стрессорного воздействия, а его добавление в культуру ткани как до, так и после глутаматного отравления резко ослабляло цитоморфологическую картину разрушения ДНК ядер нейронов, обеспечивая их защиту от апоптоза [25,26].
В последних экспериментальных исследованиях [12, 26] показано, что церебролизин потенцирует нейрогенез при нейрональной ишемии за счет нескольких механизмов. Специфичность действия на стволовые клетки из неишемизированных и ишемизированных зон мозга демонстрировали зависимые от дозы препарата эффекты пролиферации. Под влиянием церебролизина снижалось число TUNNEL-позитивных клеток на границе ишемизированной зоны. Важным в свете рассмотрения нейротрофических механизмов действия церебролизина оказывается тот факт, что под его влиянием активировалась система сигнальных белков PI3K/Akt, сопряженная с тирозинкиназной рецепторной сигнализацией, типичной для нейротрофинов.
Большое число клинических и экспериментальных исследований продемонстрировали эффективность церебролизина при терапии болезни Альцгеймера. Так, комбинация церебролизин+донепезил была использована в рандомизированном многоцентровом исследовании у пациентов с мягкой и умеренной формами болезни Альцгеймера, которым проводили циклические курсы терапии с добавлением аспирина в течение 24 нед [27]. Результаты показали эффективность данной комбинации, хотя число побочных эффектов было несколько выше, чем при монотерапии. Серия клинических исследований среди больных с деменцией различной этиологии, проведенных, начиная с середины 80-х годов, показала, что внутривенные инфузии церебролизина в дозе 30 мл в сутки (курс 28 дней) приводили к заметному улучшению когнитивных показателей [28].
Исследования группы Е. Ruether и соавт. [29-31] были выполнены с участием пациентов с болезнью Альцгеймера. По данным общего клинического впечатления и сравнительной оценки эффективности терапии по шкале ADAS-cog (Alzheimer’s Disease Scale-cognitive subpart) в группе получавших церебролизин отмечены существенные улучшения показателей в сравнении с плацебо. Необходимо отметить, что клиническая эффективность терапии возрастала по мере утяжеления клинической картины заболевания, т.е. результат был аналогичен данным, полученным в ходе исследования эффективности церебролизина при остром инсульте. Так, у больных с тяжелым течением заболевания по показателям общего клинического впечатления (CGI) и ADAS-cog к окончанию курса лечения выявлено увеличение показателей CGI на 65% (против 24,5% для плацебо) и в 4,1 раза по шкале ADAS-cog. Повторный курс терапии церебролизином, проведенный через 8 нед после окончания первого курса, показал высокую поддерживающую эффективность церебролизина, существенно отличавшуюся от показателей в группе плацебо.
Другое исследование [32] подтвердило значительное улучшение показателей по шкалам CGI и ADAS-cog, а также шкале оценки деменциальной нетрудоспособности (Disability Assessment for Dementia). Эффект церебролизина сохранялся после прекращения курса терапии в течение по меньшей мере еще 12 нед. Последующие исследования, проводимые в рамках рандомизированных двойных слепых плацебо-контролируемых испытаний, подтвердили эффективность длительной (24 нед) терапии церебролизином при мягкой и умеренной формах болезни Альцгеймера [33]. Метаанализ 6 рандомизированных исследований при лечении мягкой и умеренной стадий болезни Альцгеймера [34] достоверно подтвердил позитивное влияние церебролизина (внутривенные инфузии по 30 мл препарата в течение 4 нед), оцениваемое по данным основных клинических тестов.
Современная концепция «мягкого когнитивного снижения» (МКС, англ. — mild cognitive impairment) предусматривает превентивный подход к терапии деменции. А поскольку 15-20% населения в возрасте 65 лет обнаруживают признаки МКС, постепенно трансформирующегося в деменцию, проблема представляется особенно актуальной. Использование церебролизина в терапии МКС принесло достаточно ощутимые результаты. В процессе 2-летней терапии — повторные курсы через каждые полгода, при которых пациенты получали 20 инфузии по 30 мл церебролизина — было выявлено достоверное улучшение когнитивных показателей [35].
Клинико-лабораторное обоснование высокой эффективности церебролизина было получено в последние годы группой A.Alvarez и соавт. [36]. При исследовании пациентов с болезнью Альцгеймера и синдромом МКС выявлен повышенный уровень TNF-a и сниженный IGF-1 в сыворотке крови этих больных. В двойном слепом рандомизированном исследовании (инфузии церебролизина в дозе 10, 30 и 60 мл длительностью 12 нед) было обнаружено снижение уровня TNF-ct и достоверное увеличение IGF-1 в сыворотке крови у пациентов с болезнью Альцгеймера. Снижение TNF-a шло параллельно с нормализацией когнитивного статуса пациентов. Повышение содержания IGF-I было достоверно значимым при дозе церебролизина 50 мл и коррелировало со значительным улучшением неврологического статуса больных. Эти результаты впервые связали терапевтический эффект церебролизина с изменениями содержания нейротрофинов в крови пациентов с когнитивными расстройствами.
Как известно, для болезни Альцгеймера характерны изменения подструктур глутаматного рецептора (GluRl) в гиппокампе, которые ведут к нарушению синаптического взаимодействия. Церебролизин, вводимый «возрастным» крысам, увеличивал плотность GluRl в исследованных регионах гиппокампа, что обусловливало положительные изменения результатов тестов поведения, обучения и памяти у экспериментальных животных. В серии экспериментальных работ, выполнявшихся на 5-месячных мышах с трансгенной моделью болезни Альцгеймера [37], установлено, что церебролизин тормозил образование амилоидных отложений во фронтальной коре, снижал уровень пептида А-Β1-42, стимулировал регенерацию синапсов и ограничивал фрагментацию ДНК в ядрах нейронов. Эти эффекты сопровождались улучшением синаптической консолидации нейронов фронтальной коры мозга, ликвидацией дефицита показателей обучения и памяти. Протективное действие церебролизина относилось также к ослаблению периваскулярного микроглиоза и астроглиоза и иллюстрировалось пониженной экспрессией маркеров, характерных для цереброваскулярного амилоидоза. При использовании новой генетической модели нейрофибриллярной и нейродегенеративной патологии нарушения вызывались у АРР-трансгенных мышей введением мутантам tau-содержащей конструкции. На этом фоне терапия церебролизином приводила к значительному снижению уровня фосфорилирования tau, защищая клетки гиппокампа от деструктивных изменений. На культуре прогениторных клеток зубчатого ядра крысы фактор роста фибробластов (FGF-2) имитировал элементы нейродегенеративной феноменологии: дозозависимо снижал уровень цитоскелетного белка МАР2 и увеличивал содержание белка tau. Церебролизин, вводимый животным внутрибрюшинно, напротив, стимулировал дифференцировку активированных прогениторных клеток гиппокампа и снижал признаки апоптоза. Исследования на культуре нервных клеток позволили сделать общий вывод о том, что церебролизин способствует: 1) модуляции микроокружения развивающихся клеток гиппокампа; 2) увеличению нейрогенеза; 3) функциональному созреванию нейрональной сети за счет тормозящего влияния на апоптотические процессы. В работе Е. Rockenstein и соавт. [37] церебролизин, вводимый трансгенным мышам в течение 1 и 3 мес, значительно увеличивал в субгранулярной зоне гиппокампа число нейробластов, а также ядерных антигенов нейрональной пролиферации, что свидетельствовало о стимулированном нейрогенезе. Таким образом, терапия церебролизином способствует активации нейрогенеза у мышей с модельной трансгенной АРР-патологией за счет участия в пластической компенсации.
Один из существенных механизмов плейотропной активности церебролизина связан со стимуляцией нейрогенеза. В первых публикациях по церебролизину продемонстрировано действие гидролизатов из мозга на рост нервных волокон в культуре [5-8]. Получены результаты, ценность которых становится все более очевидной с позиций современной нейробиологии, основанных на представлениях о роли нейрогенеза в пластическом обеспечении функций мозга. Было установлено, что церебролизин ускоряет развитие мозга у молодых крыс; этот феномен сопровождается активацией и пролиферацией глиальных элементов и ранней дифференцировкой корковых структур мозга. В физиологических условиях, как было установлено в этих исследованиях, стимулированные нейробласты из субвентрикулярной области мигрировали в ольфакторную область, где они дифференцировались в нейроны [38]. В условиях фокальной ишемии нейробласты мигрировали в пограничные регионы ишемического поражения, замещая поврежденные клетки [39, 40].
Исходя из приведенного выше обзора клинических и экспериментальных данных, можно констатировать, что терапевтическое действие церебролизина определяется его способностью защищать церебральные структуры при ишемической и нейродегенеративной патологии за счет: 1) противодействия оксидантным и апоптотическим процессам; 2) организации новых синаптических связей и активации нейропластичности; 3) коррекции патохимических реакций в клетках и отделах мозга, затронутых патологическим процессом; 4) блокады активации микроглии и ослабления провоспалительных реакций в сосудистом эндотелии и нервной ткани; 5) стимуляции активности нейрональных стволовых клеток, их трансформации, дифференцировки и миграции в поврежденные зоны мозга. Кроме того, современные фундаментальные исследования позволяют рассматривать церебролизин как средство для поддержания и улучшения ментальных функций в условиях «нормального» старения и, что особенно важно, для превентивной терапии старения вообще [9].
Таким образом, церебролизин является многофункциональным лекарственным средством, использующим эволюционно выработанные общебиологические механизмы репарации, которые и обеспечивают успех его применения при разных патологических состояниях.
Литература
- Афанасьев В.В., Румянцева С А., Лукьянова И.Ю. и др. Нейропротек-ция при ишемическом инсульте. Мат. конференции «Скорая медицинская помощь, 2009». Ст-Петербург2009.
- Румянцева С.А., Афанасьев В.В., Силина Е.В. Патофизиологические основы комплексной нейропротекции. Журн неврол и психиат 2009; 109:3:64-68.
- Румянцева С.А., Ступин ВА., Афанасьев В.В. и др. Критические состояния в клинической практике. М: МИГ. Медицинская книга 2011; 752.
- Скворцова В.И., Стаховская Л.B. Эпидемиология инсульта в РФ. Материалы научно-практической конференции «Острые нарушения мозгового кровообращения». Иркутск 2011; 7-14.
- Sommer Н., Quandt J. Zur Wirkung cincs Hirnhydrolysatcs auf zcntral-ncrvocsc Strukturcn untcr Bcrucksichtigung clcktronoptischcr Ergcbnissc. Schwciz Arch Ncurol Ncurochir Psychiat 1973; 112: 373-386.
- Lindner G., Grosse G., Mutinies H., Kirsche W Effects of brain extract and hydrolysatc on nerve tissue in vitro. Z Mikrosk Anat Forsch 1975; 89: 5: 815-823.
- Ukraintseva S.V., Arbeev K.G., Michalsky A.I., Yashin A.I. Antiaging treatments have been legally prescribed for approximately thirty years. Ann N Y AcadSci 2004; 1019:64-69.
- Громова О А., Третьяков В.Е., Мошковский СА. и др. Олигопегггидная мембранная фракция церебролизина. Журн неврол психиат 2006; 106:7:68-70.
- Гомазков О.А. Старение мозга и нейротрофическая терапия. М: Изд-во Икар 2011; 180.
- Crook Т.Н., Ferris S.H., Alvarez XA. etal. Effects of N-PEP-12 on memory among older adults. Int Clin Psych op harmacol 2005; 20: 2: 97-100.
- Chen H., Tung Y.C, Li B. etal. Trophic factors counteract elevated FGF-2-induccd inhibition of adult neurogencsis. Ncurobiol Aging 2007; 28: 1148- 1162.
- Zhang Ch., Chopp M., Cu Y. et ah Ccrcbrolysin enhances neurogencsis in the ischemic brain and improves functional outcome after stroke. J Ncuro-scicncc Research 2010; 88: 15: 3275-3328.
- Tatebayashi Y., Lee Mh., Li L. etal. The dentate gyrus neurogencsis: a thcr-aupcutic target for Alzheimer disease. Acta Ncuropathol 2003; 105: 225- 232.
- Satou T, Itoh T, Ohde H. etal. Ncurotrophic effects of FPF-1070 (Ccrcbrolysin) on cultured neurons from chicken embryo dorsal root ganglia, ciliary ganglia, and sympathetic trunks. J Neural Transm 2000; 107: 11: 1253-1262.
- Дамулин И.В., Коберская К.Н., Мхитарян Э.А. Влияние церебролизина на умеренно выраженные когнитивные нарушения при дисциркуляторной энцефалопатии (клинико-электрофизиологическое исследование). Журн неврол и психиат 2007; 107:5: 32-38.
- Muresanu D.F, Alvarez X.A., Moessler Н. et al. A pilot study to evaluate the effects of Ccrcbrolysin on cognition and qEEG in vascular dementia: cognitive improvement correlates with qEEG acceleration. J Ncurol Sci 2008; 267: 1-2: 112-119.
- Верещагин Н.В., Суслина ЗА., Тимербаева C.JI. и др. Лечение и предотвращение когнитивной дисфункции у пациентов с артериальной ги-пертензией и атеросклерозом: результаты рандомизированного двойного слепого плацебо-контролируемого испытания церебролизина. Тер арх 2001; 73:4:22-27.
- Xiao S., Yan Н., Yao P. and the Ccrcbrolysin Study Group. Efficacy of FPF 1070 (Ccrcbrolysin) in Patients with Alzheimer’s Disease. Clin Drug Invest 2000; 19:43-53.
- Tapu M., Bicu D., Tapu F., Stovicek O. The efficacy of ccrcbrolysin in vascular dementia. J Neurological Sciences 2009; 283: 1-2: 286.
- GuekhtA.B., Moessler H., Novak PH., Gusev E.I. On behalf of the Ccrcbrolysin Investigators. Ccrcbrolysin in Vascular Dementia: Improvement of Clinical Outcome in a Randomized, Double-Blind, Placebo-Controlled Multiccntcr Trial. J Stroke Ccrcbrovasc Dis 2010; 23.
- Чуканова Е.И. Влияние церебролизина на клинические проявления и течение дисциркуляторной энцефалопатии. Журн неврол и психиат 2005; 1:42-45.
- Lombardi V.R., Windisch M., Garcia M., Cacabelos R. Effects of Ccrcbrolysin on in vitro primary microglial and astrocytc rat cell cultures. Methods Find Exp Clin Pharmacol 1999; 21: 5: 331-338;
- Alvarez X.A., Lombardi V.R., Fernandez-Novoa L. etal. Ccrcbrolysin reduces microglial activation in vivo and in vitro: a potential mechanism of ncuro-protcction. J Neural Transm Suppl 2000; 59: 281-292.
- Hartbauer M., Hutter-Paier В., Skofitsch G., Windisch M. Antiapoptotic effects of the peptidcrgic drug ccrcbrolysin on primary cultures of embryonic chick cortical neurons. J Neural Transm 2001; 108: 4: 459-473.
- Gutman В., Hutter-Paier В., Skofitsch G et al. In vitro models of brain ischemia: the peptidcrgic drug Ccrcbrolysin protects chick cortical neurons from cell death. Ncurotoxity Res 2002; 4: 1: 59-65.
- Schauer E., Wronski R., Patockova J. etal. Ncuroprotcction of ccrcbrolysin in tissue culture models of brain ischemia: post lesion application indicates a wide therapeutic window. J Neural Transm 2006; 113: 7: 855-868.
- Doppler E., Alvarez A., Cacabelos R. et al. Syncrgistic treatment effects with Ccrcbrolysin and donepczil: Results from a randomized, double-blind, multiccntcr trial to compare safety and efficacy of Ccrcbrolysin, donepczil and a combination treatment in patients with probable Alzheimer’s disease. Alzheimer’s and Dementia 2009; 5: 4: Suppl 1: 248-249.
- Suchanek-Frohlich H., Wunderlich E. Randomisicrtc Doppclblind-Placebo-Vcrglcich sstudi с mit cincm Amino-saurc-Pcptid-Extrakt. Dcr Prak-tischcArzt 1987; 41: 11: 1027-1034.
- RuetherE., Husmann R., KinzJerE. etal. A28-wcck, double-blind, placebo-controlled study with Ccrcbrolysin in patients with mild to moderate Alzheimer’s disease. Int Clin Psychopharmacol 2001; 16: 5: 253-263.
- Ruether E., Ritter R., Apecechea M. et al. Sustained improvements in patients with dementia of Alzheimer’s type (DAT) 6 months after termination of Ccrcbrolysin therapy. J Neural Transm Suppl 2000; 107: 7: 815-829.
- Bae C.Y., Cho C.Y., ChoK. etal. A double-blind, placebo-controlled, multiccntcr study of Ccrcbrolysin for Alzheimer’s disease J Am Gcriat Soc 2000; 48: 12: 1566-1571.
- Muresanu D.F, Rainer M., Moessler H Improved global function and activities of daily living in patients with AD: a placebo-controlled clinical study with the ncurotrophic agent Ccrcbrolysin. J Neural Transm Suppl 2002; 62: 277-285.
- Alvarez X.A., Cacabelos R., Laredo M. etal. A24-wcck, double-blind, placebo-controlled study of three dosages of Ccrcbrolysin in patients with mild to moderate Alzheimer’s disease. EurJ Ncurol 2006; 13: 1: 43-54.
- Wei Z.H., He Q.B., Wang H. et al. Mcta-analysis: the efficacy of nootropic agent Ccrcbrolysin in the treatment of Alzheimer’s disease. J Neural Transm 2007; 114:5:629-634.
- Гаврилова С.И., Федорова Я.Б., Колыхалов И.В. и др. Терапевтический потенциал церебролизина в превентивной терапии болезни Альцгей-мера. Журн неврол и психиат 2008; 108: 8:24-28.
- Alvarez X.A., Sampedro С, Cacabelos R. et al. Induced TNF-alpha and increased IGF-I levels in the scrum of Alzheimer’s disease patients treated with the ncurotrophic agent Ccrcbrolysin. Int J Ncuropsychopharmacol 2009; 17: 1-6.
- Rockenstein E., Mante M., Adame A., Crews L. etal. Effects of Ccrcbrolysin on neurogencsis in an APP transgenic model of Alzheimer’s disease. Acta Ncuropathol 2007; 113: 3: 265-275.
- Alvarez-Buylla A., Herrera D.G., Wichterle H. The subvcntricular zone: source of ncuronal precursors for brain repair. Prog Brain Res 2000; 127: 1-11.
- Jin K., Minami M., Lan J.Q. et al. Neurogencsis in dentate subgranular zone and rostral subvcntricular zone after focal cerebral ischemia in the rat. Proc NatlAcadSci USA 2001; 4710-4715.
- Arvidsson A., Collin T., Kirik D. et al. Ncuronal replacement from endogenous precursors in the adult brain after stroke. Nat Mcd 2002; 8: 963-970.