Врожденный порок сердца у новорожденных – что это такое?
Заболевание врожденный порок сердца подразумевает под собой анатомическую патологию или дефект (нарушение) развития сердца и/или крупных сосудов, а также клапанного аппарата, что приводит к сердечным перегрузкам, недостаточности миокарда сердечных камер и изменениям кровотока.
Врожденными пороки сердца у детей называют тогда, когда патологии сформировались еще до рождения ребенка, во время внутриутробного периода развития плода.
Чаще всего, врожденный порок сердца у будущих новорожденных формируется в промежутке между второй и восьмой неделями беременности.
Такое заболевание, как врожденный порок сердца встречается относительно не редко. Из каждой тысячи родившихся малышей подобный диагноз ставят шести-восьми детям.
Особенности ведения беременности при пороках сердца
Ведение беременности у женщин с пороками сердца, как уже было сказано выше, проводится с участием нескольких специалистов. Оно требует не только координированной деятельности специалистов женской консультации, но и дисциплинированного поведения самой женщины: ранней постановки на учет в женской консультации, своевременного посещения врачей и сдачи анализов, полного обследования, своевременного комплексного лечения.
Если есть возможность, то, конечно, лучше доверить свое здоровье крупному медицинскому центру, специализирующемуся на данной проблеме. Это может быть отделение для женщин с сердечно-сосудистой патологией при институте или специализированное отделение на базе крупного роддома, где грамотные специалисты, имеющие опыт ведения пациенток с такой патологией, смогут эффективно помочь.
Течение беременности у женщин с пороками сердца имеет свои особенности. Часто встречаются такие осложнения, как гестозы (осложнения беременности, проявляющиеся появлением отеков, белка в моче, повышением артериального давления), которые характеризуются скрытым течением и плохо поддаются лечению. Беременность у таких пациенток часто осложняется угрозой прерывания — число самопроизвольных абортов и преждевременных родов значительно превышает средние показатели. Кроме того, течение беременности может осложняться нарушением маточно-плацентарного кровотока, что приводит к гипоксии (кислородному голоданию) или задержке внутриутробного развития плода. Высок также риск отслойки плаценты. Накопление тромбов в плаценте ведет к выключению части плаценты из кровотока и усилению кислородного голодания плода.
По всем приведенным выше причинам женщины с пороками сердца и, другой патологией сердечно-сосудистой системы за время беременности должны быть госпитализированы в стационар не менее трех раз:
Первая госпитализация — на 8-10-й неделе беременности для уточнения диагноза и решения вопроса о возможности сохранения беременности. Вопрос о прерывании беременности до 12 недель решают в зависимости от выраженности порока, функционального состояния системы кровообращения и степени активности ревматического процесса.
Вторая госпитализация — на 28-29-й неделе беременности для наблюдения за состоянием сердечно-сосудистой системы и, при необходимости, для поддержания функции сердца в период максимальных физиологических нагрузок. Это обусловлено тем, что именно в этот период в норме значительно возрастает нагрузка на сердце (один из периодов максимальной физиологической нагрузки) — почти на треть увеличивается так называемый сердечный выброс, в основном за счет увеличения частоты сердечных сокращений.
Третья госпитализация — на 37-38-й неделе для подготовки к родам и выбора метода родоразрешения, составления плана родов.
При появлении признаков недостаточности кровообращения, обострения ревматизма, возникновении мерцательной аритмии (частого неритмичного сокращения сердца), гестоза или выраженной анемии (снижения количества гемоглобина) и других осложнений необходима госпитализация независимо от срока беременности.
Вопрос о прерывании беременности на более поздних сроках является достаточно сложным. Нередко врачам приходится решать, что менее опасно для больной: прервать беременность или позволить ей развиваться дальше. В любых случаях при появлении признаков недостаточности кровообращения или каких-либо сопутствующих заболеваний больная должна быть госпитализирована, подвергнута тщательному обследованию, лечению.
Если же ситуация не требует таких кардинальных мер, беременная должна соблюдать максимальную осторожность. Прежде всего необходимо позаботиться о достаточном отдыхе и продолжительном, 10-12-часовом сне. Полезен дневной 1-2-часовой сон. Достаточно эффективными средствами лечения и профилактики являются лечебная физкультура, утренняя гимнастика, прогулки на свежем воздухе. Комплекс утренних упражнений должен быть самым простым, не приводящим к чрезмерным перенапряжениям, усталости.
Питание необходимо сделать максимально разнообразным, полноценным, с повышенным содержанием белковых продуктов (до 1,5 г/кг массы тела). Необходим прием поливитаминов. Кроме того, врач может назначить сеансы гипербарической оксигенации (сеансы в барокамере, куда под давлением подается воздух с повышенным содержанием кислорода), общее ультрафиолетовое облучение.
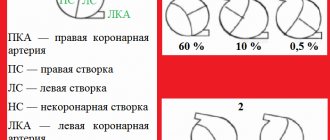
Классификация врожденных пороков сердца у детей:
- С неизмененным или мало измененным легочным кровотоком (аномалии расположения сердца, патологии дуги аорты, стеноз аорты, атрезия клапана аорты, недостаточность клапана легочного ствола, стеноз, атрезия и недостаточность митрального клапана, сердце с тремя предсердиями, патологии артерий и проводящей системы).
- С гиперволемией малого круга кровообращения: Без раннего цианоза (открытый проток в артериях, дефектные перегородки между желудочками или предсердиями, аортолегочный свищ, синдром Лютамбаше).
- С цианозом (атрезия с дефектом перегородки между желудочками, открытый проток в артериях с легочной гипертензией и кровотоком в аорту из легочного ствола).
- Без цианоза (изолированный стеноз легочного ствола).
Существует еще и классификация врожденных пороков сердца у новорожденных, более понятная для простого обывателя:
- Так называемые «синие» пороки (сопровождаются ранним цианозом (синей кожей); среди них – тетрада Фалло, атрезия легочной артерии, транспозиция магистральных сосудов).
- Так называемые «белые» или «бледные» пороки (могут сопровождаться бледностью кожных покровов или протекать без ярко выраженных симптомов и обнаружиться в случайном порядке при профилактическом обследовании ребенка; среди них – дефекты перегородок между желудочками и предсердиями).
Врожденные пороки развития сердца являются распространенной группой врожденных аномалий плода и наиболее частой причиной неонатальной смертности. Сегодня рождаемость детей с врожденными пороками сердца составляет 0,7—1,7%. Ежегодно в России рождается около 35 тыс. детей с врожденными аномалиями сердечно-сосудистой системы. В последние годы эта цифра растет (в основном за счет улучшения диагностики и соответственно увеличения частоты случаев распознавания) [1]. Заболевания бывают несовместимыми с жизнью, а бывают такими, которые могут привести к пожизненной инвалидности. Комплексная задача оказания медицинской помощи заключается в ранней диагностике и лечении данной патологии [2—4]. Существует большая группа аномалий развития плода, в том числе и пороки развития сердца, которые вызывают необратимые нарушения, затрудняющие хирургическую коррекцию после рождения ребенка. В таких случаях оптимальным решением становится внутриутробное вмешательство [5—7].
Цель данной работы — изучение внутриутробной оперативной коррекции пороков развития сердца.
При подготовке к публикации были осуществлены литературный поиск, а также систематизация и анализ информации из источников научной литературы, расположенной в базах PubMed, eLIBRARY.RU, CyberLeninka.
Для проведения внутриутробных операций на сердце плода необходимо учитывать детальные сведения об особенностях топографической анатомии сердца в целом и внутрисердечных структур плода в частности.
Сердце у плода занимает большую часть грудной полости. К особенностям синтопии сердца человека в пренатальном онтогенезе можно отнести наличие вокруг сердца нефункционирующих внутриутробно легких, большого по размерам тимуса, прилежащих сзади к сердцу пищевода и нисходящей аорты, а также тесное соседство с проходящими в грудной полости блуждающими и диафрагмальными нервами. Рассматривая сердце в целом, можно отметить, что оно располагается своей большей частью спереди от фронтальной плоскости тела. По отношению к срединной сагиттальной плоскости тела сердце расположено следующим образом: пятая часть, представленная преимущественно правым предсердием, справа от нее, а остальной объем — слева от срединной сагиттальной плоскости. При этом слева располагается часть правого, весь левый желудочек и левое предсердие. Сердце наиболее удалено от задней и правой стенок грудной полости [8, 9].
Использование во время беременности некоторых методов лучевой диагностики позволило с большой долей вероятности определять внутриутробную патологию плода. В современной клинической практике, помимо ультразвукового исследования, применяются магнитно-резонансная томография, компьютерная томография, а также фетальная эхокардиография. Кроме того, большую роль в области пренатальной диагностики играет фетоскопия [10—13].
Фетальные пороки сердца часто сопровождаются хромосомными аномалиями, при этом чаще наблюдается поражение левых отделов сердца [14—17]. В связи с этим при выявлении наличия аномалий развития сердца необходимо дополнительное генетическое исследование, которое осуществляется сегодня во многих развитых странах мира [18, 19].
С высокой долей вероятности врожденные пороки сердечно-сосудистой системы можно обнаружить на 16-й неделе беременности, а на 21—22-й неделе практически в 100% случаев можно идентифицировать тип врожденного порока [20—23]. Осуществить внутриутробную коррекцию возможно преимущественно на 22—32-й неделе в зависимости от вида порока [4, 10, 24, 25].
Сердечные пороки, поддающиеся фетальному вмешательству, отличаются тем, что они могут быстро прогрессировать от легкой до тяжелой степени во время беременности. Это приводит к тому, что во время рождения ребенка развиваются значительное необратимое повреждение миокарда и гипоплазия сосудов и клапанов. В этой уникальной группе поражений сердца обычно существует ограниченное по времени окно, позволяющее провести внутриутробное вмешательство, когда негативные эффекты на рост и функцию сердца считаются потенциально обратимыми [26—28].
В настоящее время внутриутробные вмешательства на сердце в основном выполняются при критическом аортальном стенозе, атрезии легочной артерии, критическом стенозе легочной артерии с интактной межжелудочковой перегородкой, гипоплазии левых или правых отделов сердца [29—32]. Данные заболевания приводят к постплацентарной гипоксии и, как следствие, к внутриутробной смерти плода или спонтанному аборту. Одной из задач внутриутробных вмешательств является предотвращение необратимых изменений левого и правого желудочков, а также других структур сердца, что в конечном итоге ведет к улучшению постнатальных исходов [33—36].
Существует два основных способа оперативного доступа: открытый (рассечение передней брюшной стенки и матки) и фетоскопический (доступ к сердцу плода осуществляется при помощи эндоскопа). Сегодня преимущество отдается именно фетоскопическому способу из-за его малой травматичности и минимизации риска преждевременных родов и физиологического стресса у плода [20, 35, 37, 38].
При открытом доступе хирургическое вмешательство осуществляют под общей анестезией. Доступ в матку проводят путем широкой лапаротомии: разрез на передней брюшной стенке составляет 10—12 см, разрез на матке — 5—7 см. Края раны на матке клипируют для предотвращения кровотечения. Плод частично обнажают и выводят в рану, придерживаясь правила «как можно больше внутри матки, как можно меньше снаружи», и выполняют необходимые манипуляции. Во время операции проводят всесторонний мониторинг состояния не только матери, но и плода. После операции осуществляют торможение сократительной активности матки с помощью введения токолитиков [38—40].
При фетоскопии операция может выполняться под местной, регионарной или общей анестезией. Важную роль в успешном вмешательстве играет оптимальное положение плода. Премедикацию плода проводят через пуповину раствором фентанила, атропина и панкурония для его обездвиживания. Выполняют 1,5—2-сантиметровые разрезы, через которые в брюшную полость и матку беременной женщины вводят троакар и с его помощью осуществляют соответствующие манипуляции. Место введения троакаров определяют под контролем эхографии. Принцип фетоскопического метода: через пупочные сосуды в кровеносную систему плода вводят специальный проводник (полая трубка), который, пройдя через ряд сосудов, достигает его сердца. Впоследствии через этот проводник вводят миниатюрные инструменты, с помощью которых осуществляется операция [14, 15, 41, 42]. Для клапанных вмешательств необходим доступ через верхушку желудочка сердца. После прохождения в левый или правый желудочек заводят проводник с катетером и баллоном, который устанавливают в стенозированном клапане. Затем производят раздувание баллона и расширение суженного клапанного отверстия. Кроме того, при необходимости может быть установлен стент [43, 44].
Первым показанием для внутриутробной коррекции является критический аортальный стеноз и развивающийся синдром гипоплазии левых отделов сердца, который приводит к минимальному кровотоку на аортальном клапане или полному его отсутствию, из чего следует дисфункция левого желудочка, его дилатация, праволевый сброс через дефект межпредсердной перегородки или открытое овальное окно, а также ретроградный кровоток в дуге аорты. По мере уменьшения перфузии миокарда происходят его ишемия, некротизирование и образование рубцов. Рост левого желудочка замедляется и в конечном итоге прекращается. Все это ведет к тому, что левосторонние структуры сердца не могут поддерживать системную циркуляцию [45—47]. Гипоплазия левого желудочка хорошо переносится внутриутробно, так как артериальный проток в полной мере поддерживает перфузию органов и тканей плода. Однако после родов закрытие протока приводит к системной гипоперфузии, ацидемии и смерти, как правило, в течение нескольких дней. Выходом из этой ситуации может стать проведение баллонной вальвулопластики аортального клапана. Потенциальное преимущество фетального сердечного вмешательства при развитии синдрома гипоплазии левых отделов сердца заключается в уменьшении нагрузки на левый желудочек для профилактики прогрессирующей дисфункции и гипоплазии левых отделов сердца [48—51].
Основной принцип вальвулопластики аортального клапана плода идентичен подобному у младенцев, детей и взрослых, однако имеет и существенные особенности. Различия в значительной степени обусловлены доступом к плоду и связанными с ним рисками для матери и плода.
Для получения доступа к плоду необходимо такое его положение, при котором грудная клетка будет направлена кпереди своей левой стороной. Это положение может быть достигнуто следующим образом: во-первых, матери до начала процедуры следует занять позицию на левом боку, во-вторых, необходимо производить нежные манипуляции на плоде через материнскую брюшную стенку, чтобы не нарушить его положение, и, в-третьих, необходима стабилизация плода в идеальном положении с использованием 19-калибровочной иглы. Далее плоду подают внутримышечный паралитический препарат, который обеспечивает прекращение спонтанного движения [52—55].
Чрескожный доступ к сердцу плода осуществляют под контролем ультразвука. Канюля с расположенным внутри нее катетером пересекает следующие структуры: материнскую брюшную стенку, стенку матки, амниотическую жидкость, грудную стенку плода и его сердце, а затем переходит на аортальный клапан. Плаценты следует избегать, если это возможно, но при необходимости можно использовать и трансплацентарный доступ. Как только канюля достигает грудной стенки плода, ее наконечник направляется к верхушке левого желудочка, которая прокалывается быстрым движением, чтобы свести к минимуму повреждения сердца. Вблизи аортального клапана обнажается катетер с расположенным на его конце баллоном. При аккуратном перемещении проволока проходит по клапану и фиксируется в восходящей аорте. Затем баллон последовательно надувают с целью расширения просвета клапана аорты. Антеградный поток обычно восстанавливается немедленно и часто сопровождается быстрым, заметным улучшением функции левого желудочка [55—58].
Постнатальные результаты сильно варьируют и в значительной степени зависят от степени повреждения левого желудочка перед вмешательством. В ретроспективном исследовании, проводившемся в Стэнфордском университете, обнаружили, что вальвулопластика в середине беременности может эффективно улучшить деятельность левого желудочка плода [59—61]. Австрийский хирург W. Arzt с помощниками выполнили 24 процедуры у 23 плодов на 21—26-й гестационной неделе развития с аортальным стенозом [10]. Технический успех был получен в 67% случаев, внутриутробная гибель плода — в 13%. Восстановление бивентрикулярного кровотока наблюдалось в 30% случаев. Следует отметить, что в 50% случаев после операции возникают брадикардия и/или дисфункция правого желудочка. В качестве профилактики брадикардии вводят адреналин и бикарбонат натрия через баллонный катетер во время операции. Несмотря на то что бивентрикулярный кровоток достигается не во всех случаях, функционирующий левый желудочек может поддерживать системную циркуляцию для выполнения дальнейших послеродовых операций. Таким образом, успех внутриутробной вальвулопластики при критическом стенозе аортального клапана зависит от сердечной структурной патологии пациента, сложности оборудования, используемого в ходе выполнения процедуры, а также от опыта операционной команды [36, 43, 62, 63].
Вторым показанием для внутриутробного вмешательства является атрезия легочной артерии или критический стеноз легочной артерии у плода с интактной межжелудочковой перегородкой и развивающимся синдромом гипоплазии правого желудочка. Данная патология характеризуется фиброзно-мышечной атрезией правого желудочкового оттока, тяжелой правой желудочковой гипоплазией и коронарной аномалией. Определяется кровоток слева направо через открытый артериальный проток в систему легочной артерии [64—67]. Выходом может служить легочная вальвулопластика, однако данная процедура является крайне сложной в техническом плане. Фетальная легочная вальвулопластика может привести к возобновлению роста правого желудочка, восстановлению антеградного кровотока через правое сердце, увеличению роста источников энергии и достижению бивентрикулярной циркуляции [68, 69].
Легочная вальвулопластика проводится под местной или общей анестезией. При ультразвуковом контроле в амниотический мешок вводят иглу, через которую направляют проволочный проводник диаметром 0,014 дюйма, который проходит через легочный клапан. Затем вводят баллонный катетер и накачивают для расширения стенотического клапана. Были осуществлены исследования, в ходе которых применяли коронарный баллонный катетер: он был направлен в левую легочную артерию, а затем был удален через перфорированный клапан с последующими надуваниями. Как сообщает в своей работе хирург S. Yuan, ссылаясь на результаты исследования хирурга Polat и его команды, из 27 новорожденных младенцев, перенесших внутриутробную легочную вальвулопластику на 25-й гестационной неделе, у 8 пациентов наблюдали небивентрикулярные исходы, а у 19 обследованных фиксировали бивентрикулярное кровообращение, что соответствует 70,4% [36, 70, 71]. Успешные перфорации легочного клапана обеспечивают значительный рост правого желудочка, а также трикуспидального и легочного клапанов. Внутриматочная легочная вальвулопластика при атрезии легочной артерии облегчает антеградный кровоток правого желудочка, обусловливая правильный рост сердца и улучшение послеродовой выживаемости с бивентрикулярной циркуляцией [36, 72, 73]. Следует отметить, что плоды со значительной миокардиопатией из-за хронической гипертрофии правого желудочка не являются хорошими кандидатами для данной процедуры, поскольку у них нет резервов желудочков, чтобы положительно реагировать на вальвулопластику. Однако трансплацентарное введение тербуталина может помочь улучшить функцию сердца в подобных случаях [74, 75].
Третьим показанием к внутриутробному вмешательству на сердце является синдром гипоплазии левых отделов сердца с интактной межпредсердной перегородкой или рестриктивным дефектом межпредсердной перегородки [76]. Данная патология является вариантом синдрома гипоплазии левых отделов сердца, в ходе которого поток крови через овальное окно ограничен или отсутствует вследствие аномального закрытия отверстия или аномального утолщения предсердной перегородки. Дефект перегородки сопровождает синдром гипоплазии левых отделов сердца примерно в 22% случаев [68, 77]. При наличии интактной или рестриктивной предсердной перегородки при синдроме гипоплазии левых отделов сердца имеется внутриутробная гипертензия предсердий, приводящая к постоянному повреждению легочной сосудистой системы, паренхимы легких и лимфатической системы. После родов увеличивается сосудистое сопротивление в легких и замедляется кровоток в легочных сосудах, что приводит к тому, что оксигенированная легочная венозная кровь не проникает в системное кровообращение. Одновременно с этим давление в левом предсердии резко возрастает, обусловливая легочные венозные перегрузки и дыхательную недостаточность. В конечном итоге это приводит к гипоксемии, респираторному и метаболическому ацидозу и, как следствие, к быстрой гибели ребенка. Коррекция дефектов межпредсердной перегородки во внутриутробном периоде может прервать или облегчить повреждение легких и обеспечить более благоприятный постнатальный прогноз [78—81].
При описанном поражении сердца возможно выполнение баллонной вальвулопластики, а также расширение овального окна, создание или расширение дефекта межпредсердной перегородки (септостомия) для облегчения сброса оксигенированной крови слева направо и улучшения кровотока по легочным венам, что приведет к нормализации оксигенации организма [38, 82].
Для предсердной септостомии плода используют чреспредсердный доступ под контролем ультразвука [83, 84]. Канюлю с расположенным внутри катетером 18-го или 19-го калибра продвигают аналогично: она проходит через материнскую брюшную стенку, стенку матки, амниотическую жидкость, грудную стенку плода и его сердце. Прокалывают правое предсердие, где через межпредсердную перегородку в левое предсердие или легочную вену вводят проволоку 0,014 дюйма с баллоном на конце. Для создания дефекта в перегородке после выхода баллона всю систему оттягивают назад до тех пор, пока баллон не натянет межпредсердную перегородку. Затем его несколько раз раздувают до достижения необходимого диаметра, при необходимости возможна установка стента в дефект [68, 83, 85].
Таким образом, септостомия предсердий при синдроме гипоплазии левых отделов сердца с интактной межпредсердной перегородкой или рестриктивным дефектом межпредсердной перегородки может защитить плод от повреждения паренхимы легких. Кроме того, внутриматочная предсердная септостомия может в значительной степени снизить потребность в послеродовых вмешательствах [61, 86—88].
Еще одним видом внутриутробного вмешательства является кордоцентез. Это инвазивная процедура, в ходе которой с помощью тонкой иглы проводят пункцию пуповины с целью получения крови для лабораторных исследований или введения лекарственных препаратов плоду, в том числе для лечения болезней сердца. Введение лекарственных препаратов плоду с помощью методики кордоцентеза называется фетотерапией [89—91]. Примером фетотерапии является трансплацентарное введение дигоксина, который улучшает функцию сердца плода и поддерживает длительную и успешную беременность. Показанием для использования дигоксина является устойчивая тахиаритмия плода, которая может привести к застойной сердечной недостаточности и, как следствие, преждевременной смерти. Дигоксин восстанавливает функцию миокарда, нормализуется синусовый ритм. В докладе, выполненном командой хирурга К. Zhou, сообщалось, что в течение 14-месячного наблюдения не наблюдалось повторного возникновения аритмии, не отмечалось и неврологического дефицита, замедленного роста и развития [13, 92—94].
Одной из главных проблем при проведении эндоскопических операций является плохая видимость вследствие недостаточной прозрачности околоплодных вод. Эту проблему частично решили немецкие врачи из Медицинского университета Бонна: они предложили закачивать в околоплодную жидкость углекислый газ, безвредный для плода. Благодаря такому подходу отпадает необходимость в замене околоплодных вод [35, 95]. Современные методы визуализации также способны в полной мере обеспечить полный обзор для хирурга.
Сегодня уровень доступности коррекции ишемической болезни сердца, врожденных и приобретенных пороков сердца достиг определенных высот [36, 96, 97], однако внутриутробное лечение пороков в России выполняется только в Санкт-Петербурге в Федеральном центре сердца, крови и эндокринологии им. В.А. Алмазова (единичные операции), в Иркутске и Екатеринбурге [14].
Таким образом, внутриутробные операции на сердце являются наиболее перспективным направлением пренатальной хирургии. Они позволяют улучшить функцию сердца плода, в большинстве случаев нормализуя постнатальный бивентрикулярный кровоток, минимизируя смертельный исход для плода, тем самым увеличивая выживаемость новорожденных. В то же время данный вид операций является крайне сложным. Для улучшения технического успеха подобных вмешательств и их результатов требуется хорошо подготовленная многопрофильная команда со сложным оборудованием, поэтому такие операции проводят только в специализированных крупных медицинских учреждениях. Дальнейшее развитие внутриутробной хирургии может значительно улучшить показатели последующих оперативных вмешательств у пациентов с врожденными пороками сердца.
Сведения об авторах
Скоробогачев Р.В. — студент ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России; https://orcid.org/0000-0002-1229-7011
Белехова Д.А. — студентка ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России; https://orcid.org/0000-0002-8662-1216
Белова Е.А. — врач-методист ФГБОУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России; https://orcid.org/0000-0003-0270-1153
Белов Д.В. — ассистент кафедры госпитальной хирургии ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, врач сердечно-сосудистый хирург ФГБОУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России; https://orcid.org/0000-0003-4985-9716
Пешиков О.В. — к.м.н., доцент кафедры анатомии и оперативной хирургии ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России; https://orcid.org/0000-0001-8906-2133
Автор, ответственный
запереписку:
Пешиков Олег Валентинович — https://orcid.org/0000-0001-8906-2133; e-mail
Как цитировать:
Скоробогачев Р.В., Белехова Д.А., Белова Е.А., Белов Д.В., Пешиков О.В. Показания и способы внутриутробного вмешательства при оперативной коррекции пороков развития сердца. Оперативная хирургия и клиническая анатомия (Пироговский научный журнал).
2019;3(2):25-33. https://doi.org/10.17116/operhirurg2019302125
Симптомы врожденных пороков сердца у новорожденных
Клиническая картина проявлений болезни зависит от вида врожденного порока сердца у новорожденных, видами нарушений гемодинамики и кровообращения.
Чаще всего сразу после рождения ребенка (или вскоре после этого – в первые дни, недели, месяцы жизни) начинают проявляться «синие» пороки, которые невозможны без проявления главного симптома – цианоза (синюшной кожи). Однако похожими симптомами могут отличаться и «белые» пороки. И те, и другие относятся к серьезным врожденным порокам сердца у новорожденных, которые необходимо лечить (вплоть до применения операции на врожденном пороке сердца) во избежание дальнейших осложнений или даже летального исхода.
Симптомы врожденного порока сердца у новорожденного, которые нельзя игнорировать:
- Синюшный или голубоватый оттенок кожных покровов, губ, ушных раковин (цианоз), который может проявляться как в состоянии покоя, так и во время кормления, плача.
- Наоборот – возможны бледность, нездоровый белый цвет кожи, холодные конечности.
- Одышка.
- Отеки (вокруг глаз, на животе и ногах).
- Низкая прибавка в весе (вызвана одышкой малыша, которая не позволяет ему полноценно питаться во время грудного вскармливания).
- Тахикардия (учащенное сердцебиение).
- Шумы в сердце (этот симптом может выявить только врачи при прослушивании сердца ребенка).
Как проявляются заболевания клапанов сердца
Чаще всего жалобы пациентов неспецифичны: одышка, учащенный пульс, аритмия, быстрая утомляемость, синюшность, головокружение.
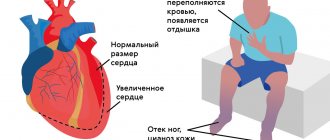
Выраженность и характер симптомов зависят от расположения пораженного клапана. При пороках клапанов левой половины сердца (митральный и аортальный) в первую очередь страдают легкие, т.к. в их сосудах застаивается кровь, что проявляется одышкой. Так же возникают признаки недостаточного кровоснабжения всех органов и систем, в первую очередь, головного мозга и самого сердца. Возникает головокружение, обмороки, стенокардия. При нарушении работы клапанов правой половины сердца (трикуспидальный и клапан легочной артерии), происходит застой крови в сосудах большого круга кровообращения, т.е. страдают все органы, кроме легких. Развиваются отеки голеней и стоп, асцит (жидкость в брюшной полости), увеличение печени и т.д (УВЕЛИЧИВАЕТСЯ ПЕЧЕНЬ И Т.Д.).
Пороки клапанов сердца опасны своими осложнениями и влиянием на организм, поэтому главная профилактика патологических состояний – это регулярные обследования и лечение заболеваний, ведущих к формированию клапанных дефектов.
Причины, вызывающие врожденный порок сердца у новорожденных
Точных причин заболевания врожденный порок сердца ученые не могут назвать до сих пор.
Однако радует тот факт, что большинство из них поддаются хирургическому исправлению. Операция на врожденном пороке сердца дает ребенку возможность нормального развития и роста.
Благодаря серии исследований, ученые все же смогли вывести ряд факторов, которые увеличивают риск возникновения врожденного порока сердца у новорожденных:
- Вирусный (если ребенок был зачат или вынашивался первые три месяца беременности во время вирусной эпидемии; особенно опасны вирусы гриппа и краснухи).
- Экологический (проживание родителей в экологически неблагополучных районах).
- Воздействие на плод ионизирующей радиации.
- Генетический (наследственная предрасположенность).
- Вредные привычки родителей (особенно страшны алкоголизм и наркотическая зависимость матерей).
- Аутоиммунные или тяжелые хронические заболевания у родителей (наиболее частый негативный эффект дает системная красная волчанка или диабет у будущей матери).
- Прием некоторых лекарственных препаратов во время беременности (с этанолом в составе, талидомид, амфетамины, противосудорожные препараты, триметадион, литий, прогестагены).
- Возраст матери старше 35-37 лет.
Возможные осложнения врожденного порока сердца у новорожденных
Иногда встречаются случаи, когда при диагнозе врожденный порок сердца новорожденный не обнаруживает никаких признаков болезни.
Отсутствие симптомов может продолжаться вплоть до возраста начальной школы. В этом возрасте любой врожденный порок сердца у детей проявляет себя. Ребенок начинает отставать в физическом развитии от своих сверстников, задыхаться во время физических упражнений, бледнеет или синеет кожа. Не только плохие физические показатели, но и проблемы с обучением, эмоциональные расстройства – все это может быть вызвано одним заболеванием.
К сожалению, ребенку с заболеванием врожденный порок сердца в дальнейшем необходим пожизненный контроль над состоянием здоровья ввиду возможного развития осложнений и сопутствующих болезней. Даже если в раннем возрасте была сделана операция, она не является панацеей на всю жизнь. К тому же, всю жизнь будет необходимо строгое дозирование физических нагрузок.
Врожденные пороки сердца у детей могут осложняться другими болезнями.
Среди них:
- Сердечная недостаточность
- Ранние затяжные пневмонии
- Высокая легочная гипертензия
- Эндокардит
- Синкопе (потери сознания)
- Стенокардия
- Инфаркт миокарда
- Приступы одышки и посинения
Самодиагностика
Для самостоятельной диагностики состояния сердечно-сосудистой системы проводят функциональные пробы: Мартине-Кушелевского, Котова-Дешина, Руфье, с 15-секундным бегом в максимально быстром темпе и другие. Ознакомиться с методикой проведения проб можно в соответствующих статьях в Интернете.
Это простые тесты для приблизительной оценки адаптации сердца и сосудов к нагрузкам. В школах и университетах их проводят в специальных медицинских группах по физкультуре для контроля самочувствия и натренированности обучающихся.
Диагностика заболевания врожденный порок сердца у новорожденных
Естественно, чем раньше обнаруживается врожденный порок сердца у новорожденных и начинается своевременное лечение, тем благоприятнее прогноз. Однако из-за отсутствия четко выраженных симптомов и, соответственно, не проведенного вовсе лечения есть случаи летального исхода среди детей до 1 года жизни (изредка – и старше).
Обычно во время профилактических осмотров врач в обязательном порядке прослушивает сердце малыша. Если там слышатся шумы – это повод для детального обследования сердца (хотя и не обязательно симптом ВПС).
Для этого родителей с ребенком направляют к специалистам более узкого профиля – кардиологу и кардиохирургу.
При подозрении на сердечный порок родителям малыша не нужно сразу обращаться к интернет-поисковикам с запросом «операция врожденный порок сердца». Не все пороки требуют радикального хирургического вмешательства. И главное – сначала установить правильный диагноз.
Изменения, характерные для врожденного порока сердца у новорожденного, обнаруживают следующие методы исследований:
- Рентгеновский снимок грудной клетки (а также вентрикулография – рентген с введением контраста).
- Эхокардиография (с помощью ультразвука исследуют состояние сердечной мышцы, клапанов, кровоток в сердечных полостях).
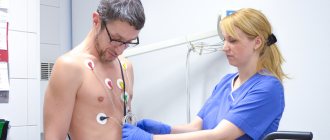
- Электрокардиограмма – ЭКГ (или методы на ее базе: стресс-ЭКГ (тредмил-тест, велоэргометрия), холтер-мониторинг ЭКГ).
Если указанные выше методы обследования обнаружили наличие серьезного заболевания – врожденный порок сердца, то дальнейшая диагностика проводится в кардиохирургическом отделении в стационарной форме. Хирурги при необходимости проводят обследование с помощью таких процедур, как ангиокардиография и зондирование сердечных камер.
Современное высокотехнологическое медицинское оборудование позволяет провести полное комплексное обследование сердца и сосудов, чтобы установить наиболее точный диагноз и выбрать необходимую лечебную тактику.
Диагностика
На каждом приеме педиатр проводит аускультацию (выслушивание фонендоскопом) и осмотр грудной клетки, чтобы проверить работу сердца у ребенка, даже если пациент обратился по поводу ОРВИ. Патологический шум легко аускультируется кардиологом. Он указывает на проблемы с сердцем, даже если пациента ничего не беспокоит или он не придает значения некоторым симптомам (кроме того, дети иногда боятся сообщать о своих проблемах и беспокойствах).
Основные диагностические методы в кардиологии:
- ЭКГ (оценка проведения электрического импульса по сердечной мышце);
- Суточное мониторирование ЭКГ;
- УЗИ сердца;
- Эхо-КГ (исследование морфологии и функционального состояния сердца);
- Допплер-эхо-КГ (изучение тока крови в камерах сердца и магистральных сосудах);
- Обзорная рентгенография грудной клетки (определение размеров и расположения сердечной тени);
- Коронарография (изучение коронарных сосудов);
- КТ;
- МРТ.
Важно вовремя выявить заболевание: чем раньше начать лечение, тем лучше эффект от него. Однако большинство нарушений можно обнаружить только с помощью специального оборудования. Кроме того, младенец не в состоянии озвучить жалобы, поэтому без инструментальной диагностики в педиатрии не обойтись.
Лечение при диагнозе врожденный порок сердца у новорожденных
Методы лечения зависят от типа порока сердца:
- Малоинвазивные процедуры
- Радикальная хирургическая операция
- Трансплантация сердца
- Медикаментозная терапия
- Длительная терапия
Если сердечные пороки не имеют очень серьезной формы, можно обойтись малоинвазивными процедурами. Их суть в том, что тонкий катетер через бедренную вену вводится в сердце, а внутри катетера к дефекту доставляют необходимые инструменты.
Самый радикальный, но эффективный метод лечения заболевания врожденного порока сердца – операция. Это традиционное открытое вмешательство со вскрытием грудной клетки и самого сердца. Большинство подобных операций проводятся с применением аппарата искусственного кровообращения. После операции на сердце ребенка ждет длительный и тяжелый период восстановления, однако иногда она является единственно возможным способом излечения.
Пересадка (трансплантация) сердца применяется в самых тяжелых случаях, в которых традиционная хирургическая операция беспомощна при тяжелом врожденном пороке сердца.
Медикаментозная терапия применяется в основном во вспомогательных целях, улучшая работу сердца и кровотока.
Длительная терапия подразумевает несколько последовательных операций на врожденном пороке сердца.
Ведение родов при пороке сердца
Вопрос врачебной тактики в родах имеет особое значение. Лучший выбор — ранняя госпитализация в 36-37 недель беременности. План родоразрешения составляется консультативно с участием акушера, кардиолога или терапевта и анестезиолога. Выбор метода строго индивидуален для каждой больной в зависимости от ситуации.
Современная медицина располагает достаточным арсеналом диагностических средств для того, чтобы вовремя предотвратить осложнения беременности у женщин с пороками сердца. Обычно применяются следующие методики:
- Электрокардиография — регистрация электрических явлений, возникающих в сердечной мышце при ее возбуждении. Это исследование позволяет зарегистрировать изменения в сердечной мышце по изменению электрической импульсации.
- Фонокардиография — метод регистрации звуков (тоны и шумы), возникающих в результате деятельности сердца. Его применяют для оценки работы сердца и распознавания нарушений, в том числе пороков клапана.
- Эхокардиография (ультразвук сердца). Ее применяют для изучения кровообращения и кардиодинамики (работы сердца), определения размеров и объемов полостей сердца, оценки функционального состояния сердечной мышцы. Метод безвреден для матери и плода.
- Пробы с нагрузкой используют для оценки функционального состояния сердечной мышцы. Пробы с нагрузкой на велоэргометре применяют и при обследовании беременных — во время этой пробы пациенту снимают ЭКГ при различной интенсивности физических нагрузок.
- Исследование функции внешнего дыхания и кислотно-щелочного состояния крови предполагает изучение емкости легких и насыщения крови кислородом в покое и при нагрузке. Исследование позволяет определить, насколько адекватна насыщенность крови кислородом, т.е. насколько сердце справляется с нагрузкой на данный момент.
- Исследования крови — обычно достаточно стандартного анализа, который проводится при обследовании всех беременных. Однако в данном случае врач обращает особое внимание на состояние свертывающей системы крови.
- УЗИ плода, кардиотокография, которые регулярно проводятся после 28 недель для оценки состояния плаценты и плода. Эти исследования помогают выяснить, не страдает ли плод от недостатка кислорода и питательных веществ. Кроме того, УЗИ плода позволяет выявить возможные пороки развития ребенка еще до его рождения и принять соответствующие меры — от срочной операции после родоразрешения до прерывания беременности.
Преимущество остается за естественным методом родоразрешения. При компенсированном пороке сердца проводится терапия, направленная на профилактику сердечной недостаточности и поддержку сердца, профилактика отека легких, при возможности аритмии — ЭКГ-контроль. Проводится адекватное обезболивание родов, так как страх и боль приводят к дополнительной нагрузке на сердце.
Реклама
Как правило, наиболее тяжелый период родов — потуги (период изгнания плода) — стараются укорачивать с помощью эпизиотомии — рассечения промежности. Выключение потуг (наложение акушерских щипцов) проводят при нарушении кровообращения.
Многие врачи считают, что родоразрешение в срок с помощью кесарева сечения уменьшает нагрузку на сердечно-сосудистую систему и снижает смертность среди беременных, страдающих пороками сердца.
Кесарево сечение при пороке сердца проводится в следующих случаях:
- при активном ревматическом процессе (повышении температуры, появлении болей в соответствующих органах, характерных изменениях в анализах);
- при резко выраженном пороке сердца с выраженной недостаточностью левого желудочка и отсутствии эффекта от проводимой медикаментозной терапии;
- при сочетании порока сердца с акушерской патологией, требующей хирургического родоразрешения.
Успешному родоразрешению больных, страдающих тяжелыми врожденными и приобретенными пороками сердца, может способствовать ведение родов в условиях гипербарической оксигенации.
После рождения плода и отхождения последа наблюдается прилив крови к внутренним органам (и в первую очередь к органам брюшной полости) и уменьшение циркуляции крови в сосудах головного мозга и сосудах, питающих сердечную мышцу. Поэтому для предупреждения ухудшения состояния сразу после рождения ребенка женщине вводят средства, обеспечивающие нормальную работу сердца.