Заболевания печени + повышенное давление
Многие гипертоники с заболеваниями печени стараются пить как можно меньше таблеток, чтобы «пощадить больную печень». Но гипертония – заболевание не менее опасное, чем гепатит или ожирение печени.
Статья по теме Как помочь печени после отпуска? Подходящее лечение найти можно. Нужно лишь тщательно, вместе с опытным доктором выработать тактику. Сейчас есть целый ряд препаратов от гипертонии, которые практически не действуют на печень.
Гипертоники также обязательно должны курсами принимать гепатопротекторы. Этот класс лекарств защищает печень от лекарственной нагрузки.
Смотрите также: Лекарство для печени →
При этом сочетании заболеваний полезна фитотерапия. И для печени, и для нормализации артериального давления будут полезны изюм, черноплодная рябина, черешня, черная смородина, курага, арбузы. Вместо обычного чая и кофе желательно пить отвары плодов шиповника, боярышника, а также чаи из перечной мяты и листьев мелиссы.
Почему возникает печеночная недостаточность?
При печеночной недостаточности важно проводить лечение, направленное на ее причину. Поэтому врач должен провести тщательное обследование и разобраться, что привело к нарушению функции печени у пациента.
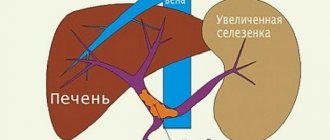
Чаще всего причиной развития печеночной недостаточности становится цирроз – состояние, при котором нормальная ткань печени погибает и замещается фиброзной. К наиболее распространенным причинам цирроза относят вирусные гепатиты B и C, хроническое чрезмерное употребление алкоголя. Причиной печеночной недостаточности может стать неалкогольная жировая болезнь печени (НЖПБ) – избыточное накопление жиров в ткани органа. НЖБП нередко сопутствует сахарному диабету, метаболическому синдрому (повышенное артериальное давление, ожирение, повышенный уровень глюкозы и холестерина в крови). По оценкам экспертов, в настоящее время во всем мире этой патологией страдают 1,46 миллиарда взрослых людей.
Наиболее частые причины острой печеночной недостаточности:
- Вирусные гепатиты.
- Прием некоторых лекарственных препаратов: противогрибковых, противосудорожных, антибиотиков, синтетических аналогов гормонов, антидепрессантов, применение ацетаминофена (парацетамола) часто или в больших дозах.
- Прием некоторых веществ и биологически активных добавок, например, экстракта зеленого чая.
- Аутоиммунный гепатит – заболевание, при котором нарушается работа иммунной системы, и начинают вырабатываться антитела против печеночных клеток (гепатоцитов
). В результате в ткани печени развивается хроническое воспаление. - Болезнь Вильсона – врожденное заболевание, при котором нарушается обмен меди и развивается тяжелое поражение центральной нервной системы, печени и других внутренних органов.
- Другие заболевания, связанные с нарушением обмена веществ и поражением кровеносных сосудов.
Заболевания печени + камни в желчном пузыре
| Важно | |
При сочетании заболеваний печени с любыми другими недугами нужно придерживаться следующих рекомендаций:
| |
Желчнокаменная болезнь – прямая угроза для здоровья печени. Ведь если маленький камешек сдвинется с места и закупорит проток, желчи будет некуда деваться. Появится желтуха, а клетки печени станут быстро разрушаться. Так что не стоит затягивать решение вопроса об операции по удалению камней.
В некоторых случаях с проблемой можно справиться и без помощи хирурга. В последние годы появились препараты с двойным действием. Они разжижают желчь, растворяя песок в желчном пузыре, и при этом защищают от повреждения печень.
Кроме того, при сочетании гепатитов с желчнокаменной болезнью желательно отказаться от сборов из лекарственных трав с желчегонным действием. Они заставляют печень работать с удвоенной силой, вырабатывая желчь. Но перегрузка клеток печени может привести к их гибели, да и вероятность попадания мелких камушков в протоки также возрастает.
Статья по теме
Алкоголь, лекарства или переедание? Что приводит к ожирению печени При таком сочетании заболеваний очень важно правильное питание. Есть нужно часто, 4–6 раз в сутки. Ужин должен быть легким – не более 20% от общего объема пищи. Все продукты лучше всего употреблять в теплом виде. Нежелательно есть жирную свинину, икру, мясо гуся и утки, яичный желток и жирные молочные продукты. И для печени, и для состава желчи полезны гречневая, овсяная и другие каши, нежирные творог и кефир.
Артериальная гипертензия (АГ) в Российской Феде-рации (РФ), как и во всех странах с развитой экономикой, является одной из актуальных медико-социальных проблем. Это обусловлено широкой распространенностью, высоким риском развития осложнений и недостаточным контролем в масштабе популяции. Распространенность АГ среди взрослого населения составляет примерно 40 %, что предопределяет высокую частоту возникновения сердечно-сосудистых осложнений (ССО), в т. ч. с летальным исходом [1, 2]. Артериальная гипертензия является ведущим фактором высокой смертности населения от заболеваний сердечно-сосудистой системы, в 3–4 раза увеличивая риск развития ишемической болезни сердца (ИБС) и инсульта [3, 4].
По результатам исследования, проведенного в рамках целевой федеральной программы “Профилактика и лечение артериальной гипертонии в Российской Федерации”, распространенность АГ среди населения в 2009 г. составила 40,8 % (у мужчин – 36,6 %, у женщин – 42,9 %). Осведомленность больных АГ о наличии у них заболевания составляет 83,9–87,1%. Принимают антигипертензивные препараты (АГП) 69,5 % больных АГ, из них эффективно лечатся 27,3 %, а контролируют артериальное давление (АД) на целевом уровне 23,2 % [5].
Основной целью лечения больных АГ является максимальное снижение риска развития ССО и смерти от них. Для достижения этой цели требуются снижение АД до целевого уровня, коррекция всех модифицируемых факторов риска (курение, нарушение липидного обмена, гипергликемия, ожирение), предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней, а также лечение ассоциированных и сопутствующих заболеваний (ИБС, сахарного диабета – СД и др.).
В рекомендациях Всероссийского научного общества кардиологов [6] отмечено, что целевой уровень АД должен быть менее 140/90 мм рт. ст., а при хорошей переносимости назначенной терапии целесообразно снижение АД до более низких значений.
Пациентам с высоким и очень высоким риском ССО необходимо снижать АД до 140/90 мм рт. ст. и менее в течение 4 недель. При условии хорошей переносимости рекомендуется дальнейшее снижение АД до 130–139/80–89 мм рт. ст. При проведении антигипертензивной терапии следует иметь в виду, что пациентам с СД, пожилым больным и лицам, уже имеющим ССО, бывает трудно достичь уровня систолического АД < 140 мм рт. ст. При плохой переносимости снижения АД рекомендуется достижение целевого уровня АД в несколько этапов. На каждом этапе АД снижают на 10–15 % от исходного уровня за 2–4 недели с последующим перерывом для адаптации пациента к более низким величинам АД. Следующий этап снижения АД и, соответственно, усиление антигипертензивной терапии (а именно увеличение дозы и/или числа принимаемых препаратов) возможны только при условии хорошей переносимости уже достигнутых величин АД. Если переход на следующий этап вызывает ухудшение состояния пациента, целесообразно вернуться на предыдущий уровень еще на некоторое время.
Таким образом, снижение АД до целевого уровня происходит в несколько этапов, число которых индивидуально и зависит как от исходного уровня АД, так и от переносимости антигипертензивной терапии. Использование такой этапной схемы снижения АД с учетом индивидуальной переносимости, особенно пациентами с высоким и очень высоким риском ССО, позволяет достигать целевого уровня АД и избегать эпизодов гипотонии, с которыми связано увеличение риска развития инфаркта миокарда и мозгового инсульта. При достижении целевого уровня АД необходимо учитывать нижнюю границу снижения САД до 110–115 и ДАД до 70–75 мм рт. ст., а также следить за тем, чтобы в процессе лечения не происходило увеличения пульсового АД у пожилых пациентов, что возникает главным образом за счет снижения ДАД [6].
В настоящее время для лечения АГ рекомендовано пять основных классов АГП: ингибиторы ангиотензинпревращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина II (АРА), блокаторы кальциевых каналов (БКК), β-адреноблокаторы (β-АБ), диуретики (см. таблицу). В качестве дополнительных классов для комбинированной терапии могут использоваться α-АБ, агонисты имидазолиновых рецепторов и прямые ингибиторы ренина.
При выборе препарата врач должен учитывать многие факторы, наиболее важными из которых являются наличие у больного факторов риска; поражение органов-мишеней; ассоциированные клинические состояния, поражения почек, МС, СД и другие сопутствующие заболевания, ограничивающие применение АГП:
- предыдущие индивидуальные реакции больного на препараты различных классов;
- вероятность взаимодействия с лекарствами, которые пациенту назначены по другим поводам;
- социально-экономические факторы, включая стоимость лечения.
При выборе АГП в первую очередь необходимо оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации. Из результатов многоцентровых рандомизированных исследований следует, что ни один из основных классов АГП не имеет существенного преимущества в плане как снижения АД, так и эффективности снижения риска ССО и смерти от них. При назначении любого из основных классов АГП есть свои «за» и «против».
В каждой конкретной клинической ситуации необходимо учитывать особенности действия АГП различных классов, обнаруженные при проведении рандомизированных исследований. Выбор того или иного АГП должен основываться на результатах больших клинических исследований, в которых доказана высокая эффективность и безопасность применения пациентами именно этого препарата в подобной клинической ситуации.
Однако рекомендуемые стандарты и программы лечения АГ не всегда учитывают состояние органов пищеварения, хотя метаболизм многих лекарственных средств начинается и осуществляется именно там. По данным ЦНИИГ за три года (1999–2001), в гепатологических отделениях были обследованы и пролечены 1200 больных циррозом печени (ЦП), среди них гипертоническая болезнь I–III стадий встречалась среди 18,4 % больных (практически у каждого 5-го больного ЦП имелась АГ).
Все группы лекарственных препаратов, применяющихся в лечении АГ, оказывают различное влияние на органы пищеварения. Это могут быть положительные эффекты. Например, использование β-АБ для профилактики кровотечения из варикозно-расширенных вен пищевода при ЦП, БКК при ахалазии кардии. Известно и отрицательное действие кардиологических препаратов: эрозивно-язвенное поражение желудка при применении ацетилсалициловой кислоты, усиление проявлений гастроэзофагеальной рефлюксной болезни на фоне приема БКК (группы дигидропиридинов). В связи с этим необходима рациональная фармако-, а иногда и многоцелевая монотерапия (возможность использовать системные эффекты одного лекарства для одновременной коррекции нарушенных функций нескольких органов или систем).
У больных хроническими заболеваниями печени жирорастворимые препараты могут кумулироваться, вызывая нежелательные эффекты, тогда как концентрация водорастворимых средств у пациентов без гепаторенального синдрома остается близкой к стандартной [7–9]. При заболеваниях печени пролекарства в рекомендуемых дозах не могут оказывать достаточного гипотензивного эффекта больным АГ, и для достижения целевого уровня АД требуется увеличение разовых и суточных доз препарата. Поэтому при лечении АГ у лиц с патологией органов пищеварения необходимо учитывать все фармакологические особенности антигипертензивных препаратов различных групп.
Тиазидные и тиазидоподобные диуретики подразделяются на два поколения. Первое включает производные бензотиадиазина (гидрохлоротиазид) и хлорталидон, второе поколение – производные хлорбензамида (индапамид). Тиазидные диуретики слабо метаболизируются в печени и почти полностью выводятся почками в неизменном виде. В отличие от тиазидных диуретиков индапамид подвергается метаболизму в печени, поэтому с осторожностью должен применяться при лечении больных АГ с патологией печени. Строгий контроль показан больным ЦП, особенно с отеками или асцитом, т. к. повышается риск развития метаболического алкалоза и возможно усиление проявлений печеночной энцефалопатии.
С другой стороны, длительный прием диуретиков пациентами с дефицитом магния из-за нарушения его всасывания (рвоты, диареи, алкогольного поражения печени, резекции кишечника) может приводить к гипомагниемии, при которой уровень магния в сыворотке крови опускается ниже 0,75 ммоль/л. В связи с этим при лечении диуретиками необходим контроль уровня магния в крови при данных сопутствующих заболеваниях.
Ко второй группе АГП относятся БКК, которые являются вазодилататорами непрямого действия. Общее свойство БКК – липофильность, объясняющая их хорошую всасываемость (90–100 %) в желудочно-кишечном тракте (ЖКТ), и единственный путь элиминации из организма – метаболизм в печени. В печени БКК полностью метаболизируются до неактивных метаболитов, которые выводятся через почки и ЖКТ. Этими общими фармакокинетическими свойствами БКК объясняется замедление их выведения из организма с возрастом, при дисфункции печени, но практически не изменяется при почечной недостаточности. Поэтому лицам старше 60–65 лет и больным ЦП разовую дозу или кратность приема БКК рекомендуется уменьшать.
С другой стороны, БКК снижают тонус нижнего пищеводного сфинктера [10, 11]. При нарушении функции нижнего пищеводного сфинктера отсутствует полноценный барьер для рефлюкса кислого содержимого желудка в пищевод, что может обусловливать развитие эзофагита. Так как заброс кислого желудочного содержимого в пищевод может вызывать кровотечение из варикозно-расширенных вен (желудочно-пищеводный рефлюкс особенно опасен для больных ЦП), применение дигидропиридинов нежелательно при ЦП, осложненном варикозным расширением вен пищевода [12].
К третьей группе АГП относятся β-АБ, которые в зависимости от их растворимости в жирах и воде подразделяются на жирорастворимые (или липофильные), водорастворимые (гидрофильные) и жироводорастворимые. Липофильные β-АБ (бетаксолол, карведилол, метопролол, пропранолол, тимолол, небиволол и др.) быстро и полностью (более 90 %) всасываются в ЖКТ, обычно метаболизируются в печени (80–100 %) [13–15].
В печени они подвергаются метаболизму путем гидроксилирования и конъюгирования, превращаясь в метаболиты, которые эскретируются почками после превращения в водорастворимые вещества. У больных ЦП со сниженным печеночным кровотоком и печеночно-клеточной недостаточностью данные препараты способны к кумуляции в организме, т. к. они находятся в крови более продолжительное время из-за уменьшения активности печеночных ферментов, обусловливая большую частоту побочных эффектов [16–20]. По этой причине разовые дозы или кратность приема липофильных β-АБ необходимо уменьшать для лиц со сниженным печеночным кровотоком (т. е. для пожилых лиц, больных сердечной недостаточностью или ЦП).
Гидрофильные β-АБ (атенолол, надолол, соталол и др.) неполностью (30–70 %) и неравномерно всасываются в ЖКТ и обычно незначительно (0–20 %) метаболизируются в печени, а следовательно, не требуют изменения дозы и поэтому могут использоваться для лечения больных АГ с патологией печени. При применении метопролола больным ЦП необходимо снижать дозу препарата во избежание кумулятивных эффектов и связанных с ним побочных эффектов. Использование гидрофильного атенолола коррекции дозы не требует [21].
Некоторые препараты растворяются как в жирах, так и в воде (ацебутолол, бисопролол, пиндолол) и имеют два пути элиминации – печеночный метаболизм и почечную экскрецию. Такой сбалансированный клиренс данных β-АБ обусловливает безопасность при лечении больных АГ с сопутствующей патологией печени и низкую вероятность их взаимодействия с препаратами, тормозящими активность микросомальных ферментов печени.
С другой стороны, β-АБ способны оказывать многообразное воздействие на функции органов пищеварения.
В частности, они уменьшают кровоток по печеночной и мезентериальным артериям, повышают тонус нижнего сфинктера пищевода, усиливают перистальтику пищевода, желудка и кишечника. Основанием к применению β-АБ при гастроэзофагеальном рефлюксе и грыже пищеводного отверстия диафрагмы является их способность повышать тонус нижнего сфинктера пищевода и тем самым предотвращать гастроэзофагеальный рефлюкс, а также стимулировать моторику пищевода и снижать частоту развития рефлюкс-эзофагитов. Еще в 1980 г.
D. Lebrec и соавт. сообщили, что длительное применение пропранолола в дозе, которая уменьшает частоту сердечных сокращений на 25 %, снижает риск развития повторного кровотечения из варикозно-расширенных вен пищевода у больных портальной гипертензией. По сводным данным различных исследований, длительное применение β-АБ больными ЦП приводит к снижению числа эпизодов первого или повторного кровотечения в среднем на 44 % (по сравнению с контрольной группой), уменьшению смертности от кровотечения – на 42 % и общей смертности – на 24 %.
Профилактическая эффективность (в частности, пропранолола и надолола) не зависит от этиологии и тяжести ЦП. Одним из предполагаемых механизмов снижения давления в системе воротной вены, возможно, является уменьшение кровотока по печеночной и мезентериальной артериям в результате снижения сердечного выброса (β1-адреноблокада) и вазоконстрикции (β2-адреноблокада).
Среди других возможных механизмов называют следующие:
- повышение тонуса нижнего сфинктера пищевода, что приводит, с одной стороны, к уменьшению желудочно-пищеводного рефлюкса, с другой – к сдавлению коллатеральных сосудов, кровоснабжающих варикозные узлы;
- подавление активности ренин-ангиотензиновой системы и связанной с ней секреции альдостерона, обычно повышенной при ЦП, особенно при наличии асцита [22].
Поэтому β-АБ могут применяться для профилактики кровотечений из варикозно-расширенных вен пищевода. При давлении в воротной вене более 12 мм рт. ст. следует начинать терапию β-АБ независимо от степени расширения вен, стремясь поддерживать давление на уровне не выше 12 мм рт. ст. [23].
На основании вышеперечисленного можно сделать следующее заключение: гидрофильные β-АБ являются препаратами выбора для больных АГ с патологией печени.
К четверной группе АГП относятся ИАПФ. Несмотря на общий механизм действия, ИАПФ различаются по химической структуре, наличию в молекуле дополнительных функциональных групп, природе пролекарства, активности и фармакинетическому профилю, что очень важно учитывать при лечении пациентов с различной патологией органов пищеварения [24].
В настоящее время наиболее известны следующие ИАПФ: каптоприл, эналаприл, беназеприл, фозиноприл, лизиноприл, моэксиприл, периндоприл, квинаприл, рамиприл и трандолаприл [25, 26]. В гастроэнтерологической практике наибольший интерес представляет классификация, которая учитывает данные о физико-химических свойствах и фармакокинетических особенностях ИАПФ. Печень – основное место биотрансформации неактивных ИАПФ в активные диацидные метаболиты. Поэтому тяжелые заболевания печени могут оказывать существенное влияние на фармакокинетику неактивных ингибиторов. Например, у больных ЦП максимальная концентрация квинаприла уменьшается на 70 %. Теоретически при ЦП наиболее безопасны квинаприл и лизиноприл, которые не метаболизируются в печени. В связи с этим становится особенно актуальным использование АГП, не метаболизирующихся в печени, способных обеспечить больным АГ с патологией ЖКТ адекватный контроль АД в течение 24 часов [27].
При тяжелых заболеваниях печени уменьшается не только биотрансформация неактивных ИАПФ, но и превращение их активных диацидных метаболитов в неактивные соединения. Поэтому трудно предсказать изменения плазменных концентраций активных диацидных метаболитов различных неактивных ИАПФ у больных ЦП. Например, в отличие от квинаприла плазменные концентрации диацидного метаболита трандолаприла – трандолаприлата – у пациентов с патологией печени выше, чем у здоровых лиц. Поэтому больным ЦП рекомендуется увеличивать дозу квинаприла, но уменьшать дозу трандолаприла.
Липофильные ИАПФ (каптоприл) обладают самостоятельной фармакологической активностью, но в печени подвергаются дальнейшим превращениям с образованием фармакологически активных дисульфидов, которые выводятся путем почечной экскреции. Липофильные пролекарства (фармакологически неактивные) становятся активными диацидными метаболитами после метаболизма в печени, затем трансформируются в неактивные соединения [28]. У лиц с патологией печени оба этих процесса нарушены, а при снижении кровотока в печени отмечается задержка конверсии пролекарства в его активную форму при первом прохождении через нее [29]. Соответственно, при заболеваниях печени препараты, нуждающиеся в трансформации для приобретения активности, действуют слабее [30].
Ингибиторы АПФ этого класса разделяются на три подгруппы в зависимости от преимущественного пути элиминации их активных диацидных метаболитов:
- подкласс А – препараты с преимущественно почечной элиминацией;
- подкласс В – препараты с двумя основными путями элиминации;
- подкласс С – препараты с преимущественно печеночной элиминацией.
Гидрофильные препараты (лизиноприл) не подвергаются метаболизму в организме больного, циркулируют в крови в форме, не связанной с белками плазмы, и подвергаются элиминации через почки в неизмененном виде. Концентрацию их в плазме крови определяют величина принятой дозы, а также скорость абсорбции и скорость экскреции через почки [31–33]. Лизиноприл, представляя собой активное вещество, не требующее биотрансформации в печени, является препаратом выбора для больных патологией печени (что нередко встречается и при МС) и не требует коррекции дозы. Он оказывает пролонгированное антигипертензивное действие. Начало антигипертензивного эффекта наблюдается через 1–3 часа после приема внутрь, пик действия – через 6 часов, продолжительность действия – 24 часа со стабильным действием через 2–4 недели лечения. Показатели фармакокинетики после приема лизиноприла больными ЦП и без патологии печени достоверно не различаются. Таким образом, ЦП меняет фармакокинетику эналаприла и не влияет не фармакокинетические параметры лизиноприла [34, 35].
Некоторые ИАПФ (каптоприл, лизиноприл) непосредственно обладают биологической активностью. Все другие ИАПФ сами по себе являются неактивными веществами, или пролекарствами, т. е. свое действие проявляют после биотрансформации в печени и образования активных метаболитов.
К следующей группе АГП относятся антагонисты рецепторов ангиотензина II (АРА). В зависимости от наличия активного метаболита АРА разделяются на пролекарства (лосартан, кандесартан, тазосартан), которые становятся активными после метаболических превращений в печени, и активные лекарственные вещества (валсартан, ирбесартан, телмисартан и эпросартан), обладающие фармакологической активностью. Соответственно, при лечении АГ лицами с патологией печени предпочтение отдается активным АРА, которые выводятся в неизмененном виде. Данные препараты также не влияют на активность печеночного цитохрома Р450, что определяет низкий риск взаимодействия их с другими препаратами (например, ранитидином).
Таким образом, при патологии органов пищеварения лечение больных АГ препаратами, подвергающимися печеночному метаболизму, следует проводить с осторожностью. Это связано с тем, что данные препараты могут находиться в крови больных более продолжительное время, что может способствовать развитию нежелательных явлений [36, 37]. При лечении больных АГ с патологией печени важно использовать АГП, не метаболизирующиеся в печени и не ухудшающие ее функциональное состояние [38]. Важнейшей задачей лечения больных АГ с патологией органов пищеварения считается выбор наиболее эффективного АГП с учетом функционального состояния ЖКТ.
Заключение
Таким образом, согласно принципам рациональной фармакотерапии (по Д.Р. Лоуренсу), врач должен среди многих других ставить перед собой и такие вопросы:
- Какой должна быть схема медикаментозного лечения с учетом функционального состояния организма (в первую очередь почек, печени)?
- Превосходит ли возможность предполагаемого улучшения вероятность ущерба и опасность возникновения побочного действия лекарственного средства?
Заболевания печени + боли в спине и суставах
При обострении артроза и остеохондроза часто требуются обезболивающие таблетки из группы нестероидных противовоспалительных средств.
Но эти лекарства небезопасны для печени. Поэтому чем меньше таких обезболивающих вы примете внутрь, тем лучше.
Чтобы сократить количество обезболивающих, обратите внимание на физиотерапевтическое лечение. Правильно подобранные курсы процедур дают и обезболивающий, и противовоспалительный эффект.
Ну а в случае, когда без нестероидных противовоспалительных лекарств не обойтись, принимайте их «под прикрытием» таблеток для защиты печени – гепатопротекторов.
Инструкция для путешественников: как спасти печень в отпуске >>
Современные подходы к лечению
Лечение при печеночной недостаточности направлено на борьбу с основным заболеванием, коррекцию патологических состояний, вызванных нарушением работы печени, и профилактику осложнений. Важную роль играет диета.
Печень часто называют «фильтром организма». На самом деле этот орган не только обезвреживает токсичные вещества, но и выполняет ряд других важных функций. Когда они нарушаются, возникают определенные симптомы:
- Синтез белков крови. Если их вырабатывается недостаточно, то жидкость не может удерживаться в кровеносных сосудах, она устремляется в ткани, и возникают отеки.
- Синтез белков, которые принимают участие в кроветворении. Нарушение этой функции проявляется в виде повышенной кровоточивости.
- Синтез желчи и ее выведение в кишечник. При поражении ткани печени и/или нарушении оттока желчи развивается желтуха: кожа и белки глаз больного окрашиваются в желтый цвет.
- Запасание сахара в виде полимера – гликогена.
- Расщепление насыщенных жиров.
Что такое жёлчь и зачем она нужна?
Жёлчь – секрет, вырабатываемый гепатоцитами. Цвет жёлчи от светло-желтого до темно-зеленого. В состав жёлчи входят жёлчные пигменты – билирубин и биливердин, холестерин, жирные кислоты, лецитин, муцин.
Жёлчь является главным участником пищеварения. Она нейтрализует соляную кислоту, попавшую в двенадцатиперстную кишку из желудка, тем самым создавая благоприятные условия для действия панкреатического сока и пристеночного пищеварения в тощей кишке.
Жёлчные кислоты эмульгируют жиры, что позволяет им всасываться в кишечнике.
Жёлчь обладает бактерицидным эффектом, препятствующим размножению патогенной микрофлоры.
Трансплантация печени
Трансплантация печени может быть показана как при острой, так и при хронической печеночной недостаточности. Это единственный радикальный метод лечения. Но к его применению существует ряд ограничений. Во-первых, это серьезное хирургическое вмешательство, которое способны перенести не все пациенты. Во-вторых, сегодня во всем мире не хватает донорских органов, и многие больные подолгу ждут своей очереди.
Решение о пересадке печени принимают при фульминантном гепатите (редкое тяжелое состояние, при котором погибает значительная часть ткани органа – может развиваться при вирусных гепатитах, отравлениях, передозировке лекарств), если пациенту менее 60 лет, и у него ранее не было нарушения функции печени.
Показания к трансплантации при острой печеночной недостаточности могут быть определены с помощью критериев Госпиталя Королевского колледжа:
| При передозировке ацетаминофена (парацетамола) |
|
| При острой печеночной недостаточности, вызванной другими причинами | Протромбиновое время более 100 с или три критерия из списка:
|
Существуют и другие системы критериев, но они не всегда помогают полноценно оценить ситуацию, поэтому в каждом конкретном случае решение нужно принимать индивидуально. Как показывает статистика, средняя выживаемость пациентов с печеночной недостаточностью после трансплантации печени в течение года составляет 70–80%.
Мы вам перезвоним
Сообщение отправлено!
ожидайте звонка, мы свяжемся с вами в ближайшее время
Послеоперационный период
При неосложненном течении послеоперационного периода практикуется ранняя активизация пациента, спустя 3-4 часа после операции. Прием пищи разрешен на вторые сутки. Выписка из стационара производится на 3-4 сутки, и зависит от индивидуального порога болевой чувствительности. Снятие швов не требуется, так как кожные раны ушиваются косметическими швами и рассасывающимися нитками.
Возвращение к привычному образу жизни и физическим нагрузкам возможно на 10–14 сутки, после полного заживления кожных ран.
Внешний вид после лапароскопической холецистэктомии:
Асцит, как осложнение цирроза
Очень часто циррозу сопутствуют такие заболевания, которые представляют собой не меньшую опасность для жизни. Одним из таких заболевания является асцит или брюшная водянка. При такой болезни наблюдается переизбыток жидкости в брюшной полости. Она начинает сильно давить на органы, и по этой причине оттесняется диафрагма, а это приводит к нарушению нормальной сердечной деятельности. Брюшная водянка опасна тем, что нельзя абсолютно предсказать, когда она появится. Часто болезнь диагностируется только тогда, когда жидкость в организме накапливается в таком количестве, что живот выпячивается и это становится видно невооруженным глазом.
Асцит появляется и при заболеваниях органов пищеварения, но если причиной стал цирроз, то болезнь может активироваться буквально за миг, и уже через некоторое время брюшная полость будет наполнена жидкостью. Если человек болен асцитом, то на жизнь ему отпускается три года. Если же больной будет следить за собой, и будет лечиться, то это продлит ему жизнь еще на пять лет. До сих пор ученым не понятно, как начинает развиваться болезнь на определенном этапе цирроза.
Как устроены жёлчевыводящие пути и как они работают?
Жёлчевыводящие пути представляют собой систему протоков, берущих свое начало от гепатоцитов, и постепенно собирающихся в междольковые, сегментарные и правый и левый долевые протоки, которые объединяются в общий печеночный проток.
Одним из этапов жёлчеотведения является ее накопление в резервуаре – жёлчном пузыре. Главной функцией жёлчного пузыря является концентрирование жёлчи и выделение ее в просвет двенадцатиперстной кишки во время пищеварения. Объем этого органа составляет около 80 мл.
Жёлчный пузырь располагается на нижней поверхности печени. Он представляет собой полый мышечный орган, снаружи покрытый серозной оболочкой, а изнутри выстланный слизистой. В строении жёлчного пузыря выделяют дно, тело и шейку пузыря, которая переходит в пузырный проток.
Прогноз выживаемости
Прогноз при печеночной недостаточности зависит от ее типа и характера течения. При хронической печеночной недостаточности на фоне лечения состояние значительно улучшается у 80% больных, а при острой – только у 20–40%. При острой печеночной недостаточности прогноз хуже у людей младше 10 и старше 40 лет, при вирусных гепатитах, при желтухе, которая сохраняется дольше 7 дней.
Лечение печеночной недостаточности должно быть комплексным. В Международной клинике Медика24 применяются все современные методики, лекарственные препараты новейших поколений. В клинике функционируют палаты интенсивной терапии, оснащенные высокотехнологичным оборудованием для мониторинга жизненных функций, проведения ИВЛ и других процедур. Наши опытные врачи подходят индивидуально к лечению каждого пациента, с учетом причин ухудшения функций печени, течения заболевания, нарушений, которые развиваются в организме. Мы готовы помочь в любое время суток, наша клиника работает в режиме 24/7.
Материал подготовлен членом международного общества хирургов онкологов EESG, кандидатом медицинских наук Сергеевым Петром Сергеевичем.
Какие вопросы можно задать доктору на приеме?
- Нужна ли мне операция?
- Можно ли растворить конкременты?
- Почему лучше не растворять конкременты?
- Можно ли удалить просто камни, а пузырь оставить?
- Как измениться моя жизнь после холецистэктомии?
- Будут ли ограничения в питании?
- Будет ли больно после операции?
- Какой будет наркоз?
- Когда я смогу употреблять жирную тяжелую пищу, алкоголь?
- Нужны ли перевязки после выписки из стационара?
Вы можете обратиться в клинику колопроктологии и малоинвазиной хирургии для диагностики и лечения жёлчекаменной болезни. Благодаря соверменным операционным и высококвалифицированному персоналу, в клинике проводятся все виды лечения жёлчекаменной болезни, в том числе роботические операции.
Возможно лечение по полису ОМС.
Запишитесь на консультацию и получите качественное лечение в ближайшее время.
Как диагностировать жёлчекаменную болезнь?
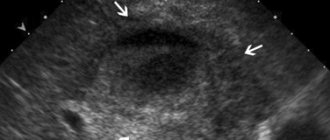
Золотым стандартом диагностики жёлчекаменной болезни является ультразвуковое исследование брюшной полости. Этот метод позволяет выявить конкременты в жёлчном пузыре. Оценить их размеры, форму и локализацию. Важным показателем является толщина стенки жёлчного пузыря. В норме она не превышает 2-3 мм. Утолщение стенки является абсолютным признаком воспалительных изменений – острого холецистита. Важным критерием является диаметр общего жёлчного протока. При наличии конкрементов, его диаметр увеличивается с 3 – 6 до 20 мм.
Магнитно-резонансная томография позволяет увидеть внутри- и внепеченочные жёлчевыводящие протоки, а также главный панкреатический проток. К этому методу диагностики прибегают при подозрении о наличии конкрементов в общем жёлчном протоке. Это необходимо для планирования лечения.
Мультиспиральная компьютерная томография показана при развитии острого билиарного панкреатита. Этот метод диагностики позволяет выявить воспалительные изменения в поджелудочной железе, окружающих ее тканях.
Гастродуоденоскопия — этот метод диагностики особенно ценен при осложненной жёлчекаменной болезни, так как позволяет не только оценить желудок, двенадцатиперстную кишку, но поступление жёлчи через большой дуоденальный сосок. При необходимости гастродуоденоскопия легко превращается из диагностической манипуляции в лечебную. При помощи специальных инструментов можно «прокрасить» жёлчевыводящие пути и извлечь конкременты.
На рисунке стрелкой обозначен конкремент в общем жёлчном протоке. При помощи дуоденоскопа в двенадцатиперстной кишке выполнено рассечение сфинктера Одди. Введено рентгеноконтрастное вещество, позволяющее визуализировать конкремент. При помощи специальной корзинки, выполняется захват и извлечение конкремента.