В процессе диагностики в правом предсердии обнаружили сеть Киари или Хиари, хотя я не ощущал никак особых симптомов. Что она представляет собой, опасна ли для здоровья, будут ли проблемы в будущем и что нужно делать?
Сосудистая сеть Киари (Хиари)
Здравствуйте. Сеть Киари в правом предсердии представляет собой непатологическую подвижную тонкую сетчатую структуру в правом предсердии, которую видно на мониторе УЗИ из любой позиции там, где в предсердие впадает нижняя полая вена. То есть сетка состоит из остатков эмбрионального клапана коронарного синуса, что прикрепляются к евстахиеву клапану нижней полой вены с одной стороны, а с другой – к частям правого предсердия (ПП). Она обнаруживается действительно случайно при диагностике у 1-2% населения.
Если быть точнее, то эта врожденная аномальная структура сердца в виде сетевидной пластинки с дырками – перегородка предсердия – начинается у заслонки венечного синуса (Тебезиева клапана) и заслонки нижней полой вены (Евстахиева клапана). Она в некоторой степени может перегораживать предсердие.
Пластинка может иметь разные положения, но в основном прикрепляется чуть кпереди от Ловерова (межвенозного) бугорка. Сеть Хиари появляется в связи с недостаточной редукцией правого (реже – левого) синусового клапана или из-за ложной перегородки. Удлиненную заслонку Евстахиева клапана и Сеть Хиари считают вариантом нормы.
Диагностика
Чтобы визуализировать сеть Chiari применяют ЭхоКГ-диагностику. При этом используются позиции, в которых одновременно исследуют ПП: апикальную 4КП, модифицированную парастернальную биккавальную позицию и короткую ось на уровне Аок со стороны левого парастернального доступа, но это могут выполнять только профессиональные диагностики.
Также используют позиции субкостальные: 4КП, короткую ось на уровне Аок и длинную ось полой вены снизу. Чтобы оценить место прикрепления сети Хиари, необходимо провести полипозиционное исследование и включить промежуточные позиции прикрепления на евстахиевом и клапане коронарного синуса.
В других возможных местах в одной плоскости сеть может не визуализироваться. Тогда применяют 3D-ЭхоКГ-исследование. Лучше всего оценку устья коронарного синуса удается датчиком из пищевода, а точнее – из его средних отделов.
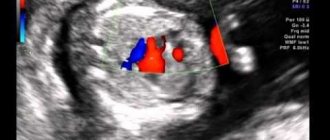
Снимок сети Chiari
Функции и участие в кровообращении
Особенности расположения и строения стенок ПП регулируют выполнение функций камеры:
- Контроль ритма сердечных сокращений, который реализуется за счет конгломерата пейсмекерных клеток, расположенного между устьем верхней ПВ и правым ушком.
- Забор крови со всего организма через системы верхней и нижней полых вен. В их устьях нет клапанов, поэтому ПП наполняется даже при низком венозном давлении.
- Регуляция артериального давления за счет:
- рефлексов от барорецепторов (нервные окончания, реагирующие на снижение кровяного давления в полсти ПП): переданный сигнал в гипоталамус стимулирует выработку вазопрессина, задержку жидкости в организме и стабилизацию показателей;
- натрийуретического пептида, который расширяет периферические сосуды и снижает объем циркулирующей жидкости (путем диуреза) при артериальной гипертонии.
- Депонирование крови (резервуарная функция) обеспечивается правым ушком при перегрузке ПП (избыток жидкости растягивает стенки структуры).
Роль правого предсердия в системной гемодинамике обусловлена:
- сбором венозной крови (ПП – функциональное окончание большого круга гемодинамики);
- наполнением правого желудочка;
- формированием и контролем работы трикуспидального клапана, патологии которого вызывают расстройства в малом и большом круге гемодинамики.
Выраженные дистрофические повреждения стенок ПП ведут к аритмиям, застою крови в периферических сосудах (отеки ног, увеличение печени, жидкость в животе, грудной полости) и системной недостаточности.
Клиника
Сеть Хиари высоко сопряжена с ООО (открытым овальным окном). У 82% пациентов, которым назначают эндоваскулярное закрытие ООО, имеется сеть Хиари или евстахиев клапан. Если имеется ООО, то чаще выявляют право-левое шунтирование крови, чем при отсутствии сети. Сеть, как и клапан, препятствуют закрытию открытого овального окна, тогда может развиться аневризма межпредсердной перегородки (МПП) и парадоксальная эмболия.
В этом случае поток крови будет направляться из нижней полой вены к МПП. При аневризме МПП происходит выпячивание стенки между предсердиями S-образно (изгибаться в обе стороны), вправо или влево. Симптомы при этом не проявляются, а патология через некоторое время исчезает.
В некоторых случаях при наличии сети Chiari у пациентов возникают приступы мигрени. Если у больных развивается инфекционный эндокардит, то болезнь может поразить ткани сети. Они могут иметь вид опухолевого образования, тогда не исключен ложный диагноз.
Если рассматривать сети Хиари, как тромбоэмболические осложнения, то их роль двояка:
- сеть способствует формированию тромбов in situ;
- является ловушкой для тромбоэмболов и предохраняет больного от фатальной ТЭЛА.
Были случаи отрыва фрагментов ткани сети и миграции их в легкие. Аритмогенность сетей Хиари может происходить из-за тесной взаимосвязи САС (симпатико-адреналовой системы) с венозным синусом на некоторых участках, а также в связи с наличием миокардиальных волокон в ретикулярной структуре тканей сети. Исследованиями не подтвержден факт препятствия сетей Chiari кровотоку. Но были случаи, что из-за этих предсердных образований было сложно провести катетеры в коронарный синус или правые отделы сердца.
Тромбозы камер сердца после хирургических вмешательств в условиях искусственного кровообращения (ИК) — редкая и малоизученная патология. Чаще всего данные состояния встречаются при антифосфолипидном синдроме (АФС) и других тромбофилиях.
Основными предрасполагающими факторами для тромбообразования в полостях сердца являются наличие препятствия кровотоку, септальные дефекты (врожденные и приобретенные пороки сердца и магистральных сосудов), нарушения ритма сердца (мерцание, трепетание предсердий), наличие интравенозного катетера, эндокардиальных электродов, изменения свертывающей системы крови, в том числе транзиторные. В ряде наблюдений причина остается не выявленной [5]. К одной из механических причин тромбообразования и патологических тромбоэмболий относят развитую сеть Киари (не полностью редуцированные остатки клапана венозного синуса в правом предсердии (ПП) в области устья нижней полой вены). Она может служить «ловушкой» для тромбоэмболов и в последующем местом формирования тромба [6].
Разные авторы [1—3, 5] для лечения пациентов с тромбозами полостей сердца предлагают использовать консервативную (тромболитическую, антиагрегантную и антикоагулянтную) терапию с разной степенью эффективности, а также хирургическую коррекцию.
В доступной литературе [3, 4] мы нашли описания 4 наблюдений тромбоза ПП с местом фиксации тромба к сети Киари, возникших в отсроченный период после коррекции врожденного порока сердца — дефекта межпредсердной перегородки (МПП) в условиях ИК.
Приводим собственное описание редкого наблюдения тромбоза ПП в области сети Киари после коррекции врожденного порока сердца.
Пациентка К., 14 лет, поступила в ФГБУ ФНЦ трансплантологии и искусственных органов с диагнозом: врожденный порок сердца — дефект МПП. Предъявляла жалобы на слабость, быструю утомляемость при физической нагрузке.
По данным рентгенографии, сердце увеличено в объеме за счет правых отделов, признаки гиперволемии малого круга кровообращения.
На ЭКГ ритм синусовый, частота сердечных сокращений до 80 уд/мин, нормальное положение электрической оси сердца, неполная блокада правой ножки пучка Гиса.
По данным эхокардиографии (масса тела 53 кг, рост 160 см, площадь поверхности тела 1,54 м2): конечный диастолический размер (КДР) правого желудочка (ПЖ) 3,3 см; ПП 3,7×3,6 см; КДР левого желудочка (ЛЖ) 4,3 см, конечный систолический размер (КСР) 2,8 см, фракция изгнания (ФИ) 66%; толщина межжелудочковой перегородки (МЖП) 0,8 см; толщина задней стенки левого желудочка (ЗСЛЖ) 0,8 см; диаметр аорты на уровне фиброзного кольца 1,7 см; давление в легочной артерии (ЛА) 30 мм рт.ст.; скорость кровотока в аорте 0,96 м/с; скорость кровотока в ЛА 1,36 м/с. В области МПП у ее нижнего края при цветовом допплеровском картировании лоцируется турбулентный косонаправленный поток в полость ПП, диаметром до 2,1 см со сбросом крови слева направо.
Коагулограмма до операции: активированное частичное тромбопластиновое время (АЧТВ) 32 с, протромбиновый индекс 86%, фибриноген 2600 мг/л, растворимые комплексы фибрин-мономера (РКФМ) 5 мг%. Агрегация тромбоцитов с адреналином 97% против 72%, c АДФ — 99% против 87%.
Общий анализ крови, общий анализ мочи, биохимический анализ крови без особенностей.
Порок являлся гемодинамически значимым и подлежал хирургической коррекции.
10.01.13 выполнена операция — пластика дефекта МПП заплатой из ксеноперикарда в условиях ИК. Интраоперационно при ревизии дефект МПП без нижнего края, размером 1,8×3,0 см. В области устья нижней полой вены (НПВ) перегородка шириной 5 мм, истончена, с множественными фенестрациями. Выполнено иссечение перфорированной части перегородки. Дефект закрыт заплатой из ксеноперикарда, фиксированной четырьмя П-образными швами (пролен 4/0) по задней полуокружности НПВ и непрерывным обвивным швом по остальному периметру. При проверке МПП герметична.
Послеоперационный период протекал без осложнений. Проводилась антибактериальная, противовоспалительная, десенсибилизирующая терапия. На 8-е сутки в удовлетворительном состоянии пациентка выписана под наблюдение педиатра и кардиолога по месту жительства. По данным контрольного обследования: на ЭКГ ритм синусовый, правильный, частота сердечных сокращений 91 уд/мин, неполная блокада правой ножки пучка Гиса. При эхокардиографии КДР ПЖ 1,8 см; ПП 2,9×3,2 см; КДР ЛЖ 4,3 см, КСР ЛЖ 2,8 см; ФИ 66%; МЖП 0,8 см; давление в ЛА 25 мм рт.ст.; скорость кровотока в аорте 1,1 м/с; скорость кровотока в ЛА 1,12 м/с. Патологические потоки в области МПП не определяются. Рекомендована консультация в клинике через 6 мес.
Дома через 2 мес после выписки в течение 2 дней отмечались эпизоды повышения температуры до 37,3 °С на фоне катаральных явлений. Проводилась симптоматическая терапия с положительным эффектом.
При плановой контрольной эхокардиографии через 6 мес после операции выявлено КДР ПЖ 1,8 см, ПП 4,4×3,8 см, ФИ 67%, область МПП интактна, визуализируется подвижное объемное образование ПП на ножке (2,5×1,7 см), пролабирующее в трехстворчатый клапан (рис.1).
Рисунок 1. Трансторакальная эхокардиография сердца пациентки К. В полости правого предсердия визуализируется объемное образование.
Пациентка в срочном порядке госпитализирована. При поступлении состояние удовлетворительное, жалоб нет. По данным рентгеновской мультиспиральной компьютерной томографии и магнитно-резонансной томографии органов грудной клетки в полости ПП определяется дополнительное мягкотканное образование неправильной «гроздевидной» формы размером 45×30×25 мм, подвижное, нависающее над устьем НПВ и пролабирующее в трехстворчатый клапан (рис. 2).
Рисунок 2. Магнитно-резонансная компьютерная томография пациентки К. Слева — объемное образование в полости правого предсердия, справа — объемное образование, пролабирующее через трехстворчатый клапан в правый желудочек.
Проводилась дифференциальная диагностика между тромбом и новообразованием ПП.
Коагулограмма: АЧТВ 32 с, протромбиновый индекс 82%, фибриноген 3090 мг/л, РКФМ 22 мг%, агрегация тромбоцитов с адреналином 88% против 44%, c АДФ — 86% против 57%, с ристомицином — 94% против 72%, антитромбин-3 97% (норма 75—125%), плазминоген 99% (норма 75—150%), D-димер 523 нг/мл (норма ≤500 нг/мл), протеин C 94% (норма 70—130%).
Повышение уровня D-димера могло указывать на возможное наличие в организме организованного тромба в стадии лизиса. Образование было расценено как флотирующий тромб ПП и пациентка по витальным показаниям (в связи с возможной тромбоэмболией легочной артерии) была оперирована.
Интраоперационно: в связи с риском разрушения тромба и тромбоэмболии легочной артерии канюляция НПВ произведена под контролем зрения через вскрытое ПП. Вмешательство выполняли на работающем сердце (длительность ИК 17 мин) и нормотермии. При ревизии ПП в области устья НПВ выражена сеть Киари, к которой фиксировано многодольчатое образование (4,2×2,9×1,2 см) плотной консистенции, имеющее вид цветной капусты (см. рис. 3 на цв. вклейке).
Рисунок 3. Макропрепарат извлеченного тромба, прикрепленного к сети Киари (на пинцетах). В области пластики МПП интактна, заплата эндотелизирована, связи заплаты с новообразованием нет. Других образований в полости ПП не выявлено. Выполнено иссечение сети Киари единым блоком с образованием.
По данным патоморфологического исследования, иссеченное во время операции образование имело на разрезе пестрый вид от розового до серо-белого цвета с отходящим от него тонким тяжом сети Киари.
При гистологическом исследовании (см. рис. 4 на цв. вклейке)
Рисунок 4. Микроскопическое исследование удаленного образования. а — эритроцитарный тромб, окраска по Массону, ув. 400; б — участок белого (лейкоцитарного) тромба, окраска по Массону, ув. 400; в — участки фибринового тромба в стадии организации, окраска гематоксилином и эозином, ув. 400; г — тесная связь тромба (слева, красная окраска) с сетью Киари (справа, синяя окраска), окраска по Массону, ув. 400; д — организация тромба в области сети Киари, окраска по Массону, ув. 400; е — сеть Киари, окраска по Массону, ув. 100. установлено, что удаленное образование является тромбом смешанного строения: эритроцитарный, лейкоцитарный, фибриновый, степень зрелости которого была различна, от фибриновой сетки до гомогенных эозинофильных глыбок. Основание тромба было прикреплено к сети Киари. В этих участках тромб был в состоянии организации, отмечалась пролиферация клеток соединительнотканного ряда и формирование коллагеновых волокон. Таким образом, имелся рецидивирующий тромбоз сети Киари. Непосредственно сеть Киари представляла собой соединительнотканные волокнистые структуры, покрытые эндотелием.
Послеоперационный период протекал без осложнений. Со 2-х суток после операции профилактически начата антикоагулянтная (фрагмин) и антиагрегантная (кардиомагнил) терапия, с 4-х суток начат прием варфарина. При достижении целевого значения международного нормализованного отношения (МНО) 2,0—2,5 фрагмин отменен. На 7-е сутки удален центральный венозный катетер, сняты швы.
Пациентка обследована для выявления АФС и наследственных тромбофилий. Титры антител к фосфолипидам IgG, фосфолипидам IgM, кардиолипину, IgG, кардиолипину, IgM, b2 гликопротеину I, IgG, b2 гликопротеину I, IgM, аннексину V, IgG, аннексину V, IgM были ниже референсных значений, что позволило исключить АФС. Данных, подтверждающих генетическую патологию (лейденовская мутация, мутация гена протромбина), не получено.
При ультразвуковом исследовании вен нижних конечностей и таза данных, свидетельствующих о тромбозе, не получено.
На 10-е сутки пациентка в удовлетворительном состоянии выписана из стационара под наблюдение кардиолога и гематолога по месту жительства. При выписке АЧТВ 34 с, протромбиновый индекс 59%, фибриноген 3102 мг/л, РКФМ 28 мг%, агрегация тромбоцитов с адреналином 25% против 20%, с АДФ — 78% против 40%, D-димер 1082 нг/мл (<500), МНО 2,79.
При плановом обследовании через 1, 3 и 6 мес после операции данных, подтверждающих новообразование сердца и магистральных сосудов, не получено. Состояние пациентки удовлетворительное, жалоб нет. Продолжается антиагрегантная (кардиомагнил) и антикоагулянтная (варфарин) терапия, МНО поддерживается в пределах 2,0—2,5.
Обсуждение
Приведенное нами наблюдение следует, очевидно, рассматривать как спонтанный тромбоз сети Киари после коррекции врожденного порока сердца в условиях ИК, в отсутствие патологических предпосылок (АФС, тромбофилии). Нельзя исключить фиксацию в сети Киари микроэмбола как пускового момента тромбообразования, хотя сосудистых катетеров в венах нижних конечностей не было.
Для профилактики подобных осложнений все пациенты, имеющие соответствующий анамнез (венозные тромбозы, повторное невынашивание беременности), нуждаются в тщательном дополнительном обследовании в целях выявления коагулопатий, тромбофилий или АФС. Угроза тромбоза полостей сердца в послеоперационном периоде служит поводом к углубленному предоперационному обследованию и соответствующей терапии после операции.
Спорным является вопрос о целесообразности превентивной резекции сети Киари при ее обнаружении во время первичной операции как меры по профилактике послеоперационных тромбозов ПП [6].
Клиническое значение
Изолированно сеть встречается реже, чем в сочетании с коммуникациями между предсердиями. Если ее выявляют, то это дает основание искать ООО и АМПП (аневризмы межпредсердной перегородки) полипозиционным исследованием, используя стандартные и промежуточные позиции.
Клинически из-за патологии возможны тромбоэмболические осложнения (тромб in situ), инфекционный эндокардит, трудности с дифференциальной диагностикой из-за различных внутрипредсердных образований (опухолей, тромбов, кист), возможны сложности при проведении эндоваскулярных доступов к сердцу.
Эхокардиография
На эхокардиографии показана сеть Хиари(CN):
- на панели А – трехстворчатый клапан (TV) смещен в апикальном 4-камерном виде;
- на панели В – она в притоке правого желудочка;
- на панели С – показан ламинарный поток через дефект межпредсердной перегородки.
Волокна сетевидной пластинки
На видео в этой статье можно увидеть работу сердца с наличием сети Хиари.
Аномалия Киари (Синдром Арнольда-Киари)
Наиболее часто в клинической практике встречается аномалия Киари I типа. Она проявляется ликворногипертензионным, церебеллобульбарным и сирингомиелическим синдромами, а также поражением черепно-мозговых нервов. Обычно аномалия Киари I манифестирует в период полового созревания или уже во взрослом возрасте.
Для ликворногипертензионного синдрома, которым сопровождается аномалия Киари I, характерна головная боль в затылке и шейной области, усиливающаяся во время чихания, кашля, натуживания или напряжения мышц шеи. Может наблюдаться рвота, не зависящая от приема пищи и ее характера. При осмотре пациентов с аномалией Киари выявляется повышенный тонус мышц шеи. Среди мозжечковых нарушений наблюдаются нарушение речи (дизартрия), нистагм, мозжечковая атаксия.
Поражение ствола мозга, расположенных в нем ядер черепно-мозговых нервов и их корешков проявляются снижением остроты зрения, диплопией, расстройством глотания, снижением слуха по типу кохлеарного неврита, системным головокружением с иллюзией вращения окружающих предметов, ушным шумом, синдромом сонных апноэ, повторяющимися кратковременными потерями сознания, ортостатическим коллапсом. Пациенты, у которых имеется аномалия Киари, отмечают усиление головокружения и ушного шума при поворотах головой. Поворот головы у таких больных может спровоцировать обморок. Может отмечаться атрофические изменения половины языка и парез гортани, сопровождающийся осиплостью голоса и затруднением дыхания. Возможен тетрапарез с большим снижением мышечной силы в верхних конечностях, чем в нижних.
В случаях, когда аномалия Киари I сочетается с сирингомиелией, наблюдается сирингомиелический синдром: нарушения чувствительности по диссоциированному типу, онемения, мышечные гипотрофии, тазовые нарушения, нейроартропатии, исчезновение брюшных рефлексов. При этом некоторые авторы указывают на несоответствие размера и местонахождения сирингомиелической кисты распространенности расстройств чувствительности, степени выраженности парезов и мышечной гипотрофии.
Аномалия Киари II и Киари III имеют сходные клинические проявления, которые становятся заметны с первых минут жизни ребенка. Аномалия Киари II сопровождается шумным дыханием (врожденный стридор), периодами кратковременной остановки дыхания, двусторонним нейропатическим парезом гортани, нарушением глотания с забросом жидкой пищи в нос. У новорожденных аномалия Киари II проявляется также нистагмом, повышением мышечного тонуса в верхних конечностях, цианозом кожных покровов, возникающим во время кормления. Двигательные расстройства могут быть выражены в различной степени и прогрессировать вплоть до тетраплегии. Аномалия Киари III имеет более тяжелое течение и зачастую является не совместимым с жизнью нарушением развития плода.
Вывод
Сама сеть клинически не имеет существенного значения, но ее часто ассоциируют с патологиями: открытым овальным окном (ООО), внутрипредсердным тромбозом или предсердными аритмиями. Осложняется сетка Хиари тромбозом с последующей тромбоэмболией, но лечения не назначают, поскольку она преграждает продвижение тромба, является рудиментом заслонки коронарного синуса.
Практического значения сетевидная пластинка с дырками не имеет. Но проводят для ее обнаружения необычный диагноз, что не исключает врачебной ошибки. Поэтому важно проводить тщательную эхокардиографию, что при сердечно-сосудистых вмешательствах облегчит преодолеть трудности при проведении катетеризации в коронарный синус или правые отделы сердца.
Эхокардиографическая диагностика сети Хиари
Сеть Хиари представляет собой подвижную, похожую на сетку структуру, которая иногда (в 2% случаев) визуализируется в правом предсердии, прикрепляясь к евстахиеву клапану и другим внутрипредсердным структурам. Эта сеть эмбриологически представляет собой остаток правого клапана венозного синуса и обычно не имеет существенного клинического значения. Однако иногда сеть Хиари может оказаться местом формирования тромбов и опухолей или препятствовать продвижению эмболов и проведению катетера. В статье представлен обзор литературы по данной проблеме и клинические наблюдения двух пациентов с сетью Хиари, которая была диагностирована при эхокардиографическом обследовании. Эти случаи примечательны достаточно большими размерами сети Хиари, а также тем, что на отдельных изображениях сеть Хиари создает впечатление о наличии дополнительного объемного образования в полости правого предсердия. В одном случае это обстоятельство привело даже к госпитализации пациентки. Выявление сети Хиари может быть важным, так как она может быть принята за ряд патологических образований, таких как тромбы, вегетации, опухоли или оторвавшиеся хорды трехстворчатого клапана.
Ключевые слова:
эхокардиография, cеть Хиари, коронарный синус, правое предсердие, echocardiography, Chiari’s network, coronary sinus, and right atrium
Литература:
1.Loukas M., Sullivan A., Tubbs R.S. et al. Chiari’s network: review of the literature // Surg. Radiol. Anat. 2010. V. 32. No. 10. P. 895-901. 2.Bhatnagar K.P., Nettleton G.S., Campbell F.R. et al. Chiari anomalies in the human right atrium // Clin. Anat. 2006. V. 19. No. 6. P. 510-516. 3.McMahon C.J., Nihill M.R., Kovalchin J.P., Lewin M.B. Echocardiographic features of Chiari’s network in association with tricuspid atresia // Tex. Heart Inst. J. 2000. V. 27. No. 3. P. 312-313. 4.Helwig F.C. The frequency of anomalous reticula in the right atrium of the human heart “Chiari network”. Report of eight cases // Am. J. Pathol. 1932. V. 8. No. 1. P. 73-79. 5.Schneider B., Hofmann T., Justen M.H., Meinertz T. Chiari’s network: normal anatomic variant or risk factor for arterial embolic events // J. Am. Coll. Cardiol. 1995. V. 26. No. 1. P. 203-210. 6.Yater W.M. Variations and anomalies of the venous valves of the right atrium of the human heart // Arch. Pathol. 1929. V. 7. P. 418-441. 7.Orbison J.L. Thrombosis of anomalous chordae in the right atrium (Chiari’s network) // Am. Heart J. 1949. V. 37. No. 1. P. 119-122. 8.Teo E.Y., Ittleman F., Hamlin M.P. A Chiari network and difficult cannulation of the coronary sinus for retrograde perfusion // Anesth. Analg. 2010. V. 111. No. 1. P. 79-81. 9.Goldschlager A., Goldschlager N., Brewster H., Kaplan J. Catheter entrapment in a Chiari network involving an atrial septal defect // Chest. 1972. V. 62. No. 3. P. 345-346. 10.Salmeron O., Zarco P., Nunez L. Unusual complication of right catheterization: hooking of the catheter in Chiari’s network // Arch. Inst. Cardiol. Mex. 1966. V. 36. No. 4. P. 387-390. 11.Maruyama T., Kurogouchi F. Entrapment of a tined lead by the Chiari network with preserved atrial sensing ability in a patient with atrioventricular block: a case report // J. Cardiol. 2007. V. 44. No. 6. P. 251-254. 12.Latif F., Peyton M., Laszik Z., Sivaram C.A. Infective endocarditis of a papillary fibroelastoma on Chiari network of right atrium: a case report // J. Am. Soc. Echocardiogr. 2008. V. 21. No. 2. P. 188.e3-188.e4. 13.Mousavi N., Bhagirath K., Ariyarajah V. et al. Chiari network endocarditis: not just an innocent bystander // Echocardiography. 2008. V. 25. No. 6. P. 642-645. 14.Yuen S.T., Dickens P. Sudden death from secondary massive pulmonary embolism derived from marrow emboli trapped by Chiari’s network // Forensic Sci. Int. 1992. V. 52. No. 2. P. 211-214. 15.Powell E.D., Mullaney J.M. The Chiari network and the valve of the inferior vena cava // Brit. Heart J. 1960. V. 22. P. 579-584. 16.Koz C., Yokusoglu M., Baysan O., Uzun M. Giant Chiari network mimics intracardiac tumor in a case of neurofibromatosis // Int. J. Cardiol. 2008. V. 130. No. 3. P. 488-489. 17.Алехин М.Н., Ваниев С.Б., Павлов А.В. и др. Тромбоэмболия сети Хиари и легочной артерии // Кардиология. 2014. № 11. С. 54-57. 18.Clements J., Sobotka-Plojhar M., Exalto N., van Geijn H.P. A connective tissue membrane in the right atrium (Chiari’s network) as a cause of fetal cardiac arrhythmia // Am. J. Obstet. Gynecol. 1982. V. 142. No. 6. P. 709-712. 19.Benbow E.W., Love E.M., Love H.G., MacCallum P.K. Massive right atrial thrombus associated with a Chiari network and a Hickman catheter // Am. J. Clin. Pathol. 1987. V. 88. No. 2. P. 243-248. 20.Jongbloed M.R., Schalij M.J., Poelmann R.E. et al. Embryonic conduction tissue: a spatial correlation with adult arrhythmogenic areas // J. Cardiovasc. Electrophysiol. 2004. V. 15. No. 3. P. 349-355. 21.Haissaguerre M., Jais P., Shah D.C. et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins // N. Eng. J. Med. 1998. V. 339. No. 10. P. 659-666. 22.Kalman J.M., Olgin J.E., Karch M.R. et al. Cristal tachycardias: origin of right atrial tachycardias from the crista terminalis identified by intracardiac echocardiography // J. Am. Coll. Cardiol. 1998. V. 31. No. 2. P. 451-459. 23.Tsai C.F., Tai C.T., Hsieh M.H. et al. Initiation of atrial fibrillation by ectopic beats originating from the superior vena cava: electrophysiological characteristics and results of radiofrequency ablation // Circulation. 2000. V. 102. No. 1. P. 67-74. 24.Prajapat L., Ariyarajah V., Spodick D.H. Abnormal atrial depolarization associated with Chiari network? // Cardiology. 2007. V. 108. No. 3. P. 214-216. 25.Pellett A.A. The Chiari network in an echocardiography student // Echocardiography. 2004. V. 21. No. 1. P. 91-93.
Методы диагностики нарушений
Комплексная диагностика нарушений работы правого предсердия включает:
- рентгенографию органов грудной клетки (диагностируется смещение границ или увеличение размеров сердца);
- электрокардиографию (биоэлектрическая характеристика миокарда, состояние проводящей системы сердца);
- ультразвуковое исследование (ЭхоКГ);
- доплер-диагностика для изучения скорости, объема и наличия препятствий для кровотока.
Широкое распространение обрели функциональные методы, которые оценивают реакцию организма на стрессовые тесты. Например, для ЭКГ-нагрузки используют дозированную ходьбу (тредмил) или велоэргометрию.