Гемостаз
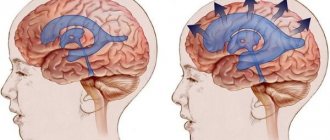
Гемостаз — это последовательность жестко регулируемых процессов, которые поддерживают кровь в жидком агрегатном состоянии и вызывают быстрое формирование локального тромба в месте повреждения сосуда. Тромбоз является патологической формой гемостаза, которая приводит к прижизненному свертыванию крови в сосудах после относительно незначительной травмы [1]. Тромбоэмболические осложнения занимают третье место по частоте причин смерти среди сердечно-сосудистых заболеваний после ИБС и инсульта. Несмотря на существенный прогресс в диагностике, распространенность и смертность от венозных тромбоэмболий существенно не уменьшилась за последние 30 лет [2], что говорит о недостаточной изученности механизмов данного заболевания и несовершенстве его терапии.
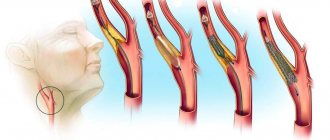
Механизмы возникновения атеросклероза, приводящего к артериальному тромбозу, также остаются не до конца изученными. Целый ряд операций (баллонная ангиопластика, стентирование, аортокоронарное шунтирование) не смог оказать существенного влияния на снижение смертности от сердечно-сосудистых заболеваний. Применение статинов хотя и улучшает качество жизни и снижает риск осложнений сердечно-сосудистых заболеваний, лишь незначительно сокращает количество смертей и повторных инфарктов миокарда [3]. При проведении терапии антикоагулянтами требуется лабораторный контроль за свертываемостью крови. Лечение может сопровождаться геморрагическими осложнениями, связанными со снижением не только свертываемости крови, но и резистентности капилляров, повышением их проницаемости. Эти факторы заставляют искать новые причины, а также методы профилактики и лечения тромбоза сосудов.
В настоящее время принято различать два вида гемостаза: сосудисто-тромбоцитарный и коагуляционный.
Первый относится к остановке кровотечений из сосудов мелкого калибра, о втором говорят при борьбе с кровопотерей из артерий и вен. Данное деление имеет весьма условный характер, поскольку как при повреждении мелких, так и крупных сосудов всегда вместе с образованием тромбоцитарной пробки осуществляется и свертывание крови [4].
Сосудисто-тромбоцитарный гемостаз приводит к образованию тромба и делится на три стадии.
Первой из них является спазм сосудов. Первичный спазм начинается сразу же после повреждения и обусловлен выбросом в кровь катехоламинов, он длится около 10 секунд. Затем наступает вторичный спазм, который происходит за счет активации тромбоцитов и выделения ими вазоконстрикторов: серотонина, тромбоксанов.
Вторая стадия — образование тромбоцитарной пробки. Это происходит посредством адгезии и агрегации тромбоцитов. На данном этапе адгезия обратима, но в результате реакций третьего этапа, которые вызывают выделение простагландинов и тромбоксанов, а также тромбостенина происходит сокращение и уплотнение тромбоцитарной пробки, другими словами — ретракция [4].
Коагуляционный гемостаз происходит за счет факторов свертывания крови и может быть разделен на 3 фазы.
- Первая состоит из реакций, которые вызывают образование протромбиназы по внутреннему или внешнему пути.
- Вторая — переход протромбина в тромбин под действием протромбиназы.
- Третья — превращение фибриногена в фибрин.
На первом этапе происходит образование легкорастворимого фибрина-мономера, который в результате полимеризации и действия XIII фактора превращается в труднорастворимый фибрин-полимер [4].
В основе патологического гемостаза лежат три базовых принципа, сформулированные Вирховым и вошедшие в историю под названием триады Вирхова. Она состоит из патологических изменений внутреннего слоя сосудов, изменения скорости кровообращения и изменения вязкости крови.
Однако с точки зрения современной медицины, это не все факторы, влияющие на тромбообразование. Например, известно, что в развитии тромбоза глубоких вен значимую роль играет иммунная система. Большее значение при этом отводится нейтрофилам. Помимо привычного для всех фагоцитоза они также продуцируют NET (Neutrophil extracellular traps), основной функцией которых является захват и обездвиживание микробов во внеклеточном пространстве. NET состоят из интактных хроматиновых волокон и антимикробных белков. Многоступенчатый процесс образования NET называется «нетоз» (NETosis). После активации некоторые ферменты переносятся из гранул в ядро, вызывают деконденсацию хроматина, разрушают ядерные мембраны и вызывают цитолиз. Активированный эндотелий совместно с нейтрофилами вызывает формирование NET, которые, в свою очередь, являются очень большими структурами и способствуют адгезии тромбоцитов. NET также стимулирует образование и осаждение фибрина. Путем расщепления ингибитора тканевого фактора, стимуляции Xa и связывания XII фактора NET стимулирует внутренний и внешний пути коагуляции. Гистоны, выделяемые при формировании NET, способствуют высвобождению телец Вейбеля-Паладе при активировании эндотелия [5]. Так как иммунная система не участвует в нормальном гемостазе, предотвращение ее активации при тромбозе глубоких вен может быть ключом к лечению данного заболевания. В связи с тем, что эндотелиальный фактор является главным при образовании венозного тромба, подавление его активации может помочь в лечении и профилактике тромбообразования.
Еще одним важным аспектом, влияющим на гемостаз, являются неорганические полифосфаты, которые состоят из линейных полимеров ортофосфата, связанных высокоэнергетическими фосфоангидридными связями. Различают два вида полифосфатных цепей: длинные (до нескольких тысяч фосфатов) и короткие (60–100 фосфатных единиц), которые хранятся в плотных гранулах тромбоцитов и выделяются при их активации. Длинноцепочечные полимеры активируют XII фактор свертывания и повышают стабильность фибрина в тромбе, в то время как короткие полимеры увеличивают активацию V фактора и ингибируют TFPI (Tissue factor pathway inhibitor). Помимо этого, полифосфаты обоих видов так же являются кофакторами для активации тромбина; ослабляют фибринолиз, ухудшая связывание плазминогена с фибрином; уменьшают активность антикоагулянтов, таких как гепарин, прямых ингибиторов тромбина и фактора Xа [6, 7]. Применение антагонистов полифосфатов может быть перспективным подходом для предотвращения гиперкоагуляции, с меньшими побочными эффектами по сравнению с традиционными антикоагулянтными препаратами.
В крови людей находятся микрочастицы, которые выделяются различными клетками (тромбоциты, эндотелий, лейкоциты, эритроциты) после активации или апоптоза и представляют собой небольшие мембранные везикулы. Первоначально они были описаны как «тромбоцитарная пыль», которая высвобождается из активированных тромбоцитов. Вне зависимости от происхождения, все микрочастицы являются прокоагулянтами, поскольку они предоставляют мембранную поверхность для сборки различных компонентов коагуляционного каскада. Также на их поверхности присутствуют анионные фосфолипиды: фосфатидилсерин и прокоагулянтный тканевой фактор, которые являются активаторами свертывания крови. Микрочастицы играют важную роль в нормальном гемостазе [7], но их участие в тромбозе глубоких вен и других заболеваниях, связанных с тромбообразованием, остается недостаточно изученным.
Проблема спонтанного тромбообразования является одной из главных на сегодняшний день. Современные антиагрегантные препараты значительно повышают риск кровотечений, в связи с чем их использование остается ограниченным. Последние исследования позволили более глубоко понять механизмы тромбоза и гемостаза, отличия между ними. Новые тактики и препараты, разработанные на основе этих тактик, могут избирательно ингибировать патологический тромбоз. Все это может стать прекрасной возможностью для развития антиагрегантных препаратов, которые смогут обеспечить эффективное, а главное — безопасное лечение многим пациентам.
Источники
1. V. K. M. M. FRCPath, A. K. A. MBBS, и J. C. A. M. PhD, Robbins Basic Pathology, 10 edition. Philadelphia, Pennsylvania: Elsevier, 2021. 2. J. A. Heit, A. Ashrani, D. J. Crusan, R. D. McBane, T. M. Petterson, и K. R. Bailey, «Reasons for the persistent incidence of venous thromboembolism», Thromb. Haemost., т. 117, вып. 2, сс. 390–400, 26 2021. 3. Н. Е. Николаева, «Относительный избыток животного белка в питании — инициатор развития атеросклеротического процесса», Атеросклероз И Дислипидемии, вып. 2 (27), 2021. 4. Лекция 16. Физиология тромбоцитов. Понятие о гемостазе (сосудисто-тромбоцитарный и коагуляционный гемостаз) 5. T. A. Fuchs, A. Brill, и D. D. Wagner, «Neutrophil Extracellular Trap (NET) Impact on Deep Vein Thrombosis», Arterioscler. Thromb. Vasc. Biol., т. 32, вып. 8, сс. 1777–1783, авг. 2012. 6. J. H. Morrissey, S. H. Choi, и S. A. Smith, «Polyphosphate: an ancient molecule that links platelets, coagulation, and inflammation», Blood, т. 119, вып. 25, сс. 5972–5979, июн. 2012. 7. J. Geddings и N. Mackman, «New players in haemostasis and thrombosis», Thromb. Haemost., т. 111, вып. 04, сс. 570–574, 2014.
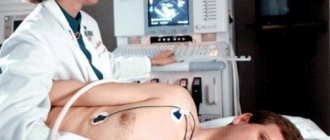
Методы диагностики нарушений системы гемостаза
Для выявления патологии могут применяться следующие методы:
- определение времени кровотечения (по Дюке, по Айви, по Ли — Уайту);
- общий анализ крови с формулой;
- определение агрегации тромбоцитов;
- протромбиновое время (ПТВ) и протромбиновый индекс (ПТИ);
- активированное частичное тромбопластиновое время (АЧТВ) и др.
В зависимости от конкретных нарушений системы гемостаза врач может назначать как отдельные показатели, так и комплексное исследование — коагулограмму. В нее входят такие показатели, как ПТВ, ПТИ, АЧТВ, определение уровня фибриногена и D-димеров и т. д.
Для того чтобы подтвердить или опровергнуть наследственную природу нарушений системы гемостаза назначается генетическое тестирование. Пройти его можно в медико-генетическом .
Подготовка к гемостазиограмме
Забор крови из вены проводится натощак — то есть, последний прием пищи у пациента должен быть за 8-12 часов до процедуры. Утром до анализа можно выпить немного чистой негазированной воды. Накануне теста следует избегать стрессов, физического и умственного переутомления, не употреблять спиртное. Перед взятием крови не курить минимум 2 часа.
Биоматериал на анализ не следует сдавать ранее, чем через 3-5 дней после УЗИ, рентгена или физиопроцедур.
В случае необходимости контроля показателей в динамике следует проводить последующие исследования в идентичных условиях: в той же лаборатории, в то же время суток и т.д.
Важно! За несколько дней до анализа нужно отказаться от медикаментов, особенно тех, что влияют на свертываемость (например, аспирин). Если пациент принимает такие препараты на регулярной основе, необходимо обязательно обговорить этот вопрос с лечащим врачом!
Женщинам нежелательно проходить скрининг во время менструации — реальные данные о гемостазе в этот период могут быть искажены.
Как исследовать свертывание?
Для изучения свертывания создаются различные модели — экспериментальные и математические. Что именно они позволяют получить?
С одной стороны, кажется, что самым лучшим приближением для изучения объекта является сам объект. В данном случае — человек или животное. Это позволяет учитывать все факторы, включая ток крови по сосудам, взаимодействия со стенками сосудов и многое другое. Однако в этом случае сложность задачи превосходит разумные границы. Модели свертывания позволяют упростить объект исследования, не упуская его существенных особенностей.
Попытаемся составить представление о том, каким требованиям должны отвечать эти модели, чтобы корректно отражать процесс свертывания in vivo.
В экспериментальной модели должны присутствовать те же биохимические реакции, что и в организме. Должны присутствовать не только белки системы свертывания, но и прочие участники процесса свертывания — клетки крови, эндотелия и субэндотелия. Система должна учитывать пространственную неоднородность свертывания in vivo: активацию от поврежденного участка эндотелия, распространение активных факторов, присутствие тока крови.
Рассмотрение моделей свертывания естественно начать с методов исследования свертывания in vivo. Основа практически всех используемых подходов такого рода заключается в нанесении подопытному животному контролируемого повреждения с тем, чтобы вызвать гемостатическую или тромботическую реакцию. Данная реакция исследуется различными методами:
- наблюдение за временем кровотечения;
- анализ плазмы, взятой у животного;
- вскрытие умерщвленного животного и гистологическое исследование;
- наблюдение за тромбом в реальном времени с использованием микроскопии или ядерного магнитного резонанса (рис. 4).
Рисунок 4. Формирование тромба in vivo в модели тромбоза, индуцированного лазером. Эта картинка воспроизведена из исторической работы, где ученые впервые смогли пронаблюдать развитие тромба «вживую». Для этого в кровь мыши впрыснули концентрат флуоресцентно меченных антител к белкам свертывания и тромбоцитам, и, поместив животное под объектив конфокального микроскопа (позволяющего осуществлять трехмерное сканирование), выбрали доступную для оптического наблюдения артериолу под кожей и повредили эндотелий лазером. Антитела начали присоединяться к растущему тромбу, сделав возможным его наблюдение.
[7]
Классическая постановка эксперимента по свертыванию in vitro заключается в том, что плазма крови (или цельная кровь) смешивается в некоторой емкости с активатором, после чего производится наблюдение за процессом свертывания. По методу наблюдения экспериментальные методики можно разделить на следующие типы:
- наблюдение за самим процессом свертывания;
- наблюдение за изменением концентраций факторов свертывания от времени.
Второй подход дает несравненно больше информации. Теоретически, зная концентрации всех факторов в произвольный момент времени, можно получить полную информацию о системе. На практике исследование даже двух белков одновременно дорого и связано с большими техническими трудностями.
Наконец, свертывание в организме протекает неоднородно. Формирование сгустка запускается на поврежденной стенке, распространяется с участием активированных тромбоцитов в объеме плазмы, останавливается с помощью эндотелия сосудов. Адекватно изучить эти процессы с помощью классических методов невозможно. Вторым важным фактором является наличие потока крови в сосудах.
Осознание этих проблем привело к появлению, начиная с 1970-х годов, разнообразных проточных экспериментальных систем in vitro. Несколько больше времени потребовалось на осознание пространственных аспектов проблемы. Только в 1990-е годы стали появляться методы, учитывающие пространственную неоднородность и диффузию факторов свертывания, и только в последнее десятилетие они стали активно использоваться в научных лабораториях (рис. 5).
Рисунок 5. Пространственный рост фибринового сгустка в норме и патологии. Свертывание в тонком слое плазмы крови активировалось иммобилизованным на стенке тканевым фактором. На фотографиях активатор расположен слева. Серая расширяющаяся полоса — растущий фибриновый сгусток.
Наряду с экспериментальными подходами для исследований гемостаза и тромбоза также используются математические модели (этот метод исследований часто называется in silico [8]). Математическое моделирование в биологии позволяет устанавливать глубокие и сложные взаимосвязи между биологической теорией и опытом. Проведение эксперимента имеет определенные границы и сопряжено с рядом трудностей. Кроме того, некоторые теоретически возможные эксперименты неосуществимы или запредельно дороги вследствие ограничений экспериментальной техники. Моделирование упрощает проведение экспериментов, так как можно заранее подобрать необходимые условия для экспериментов in vitro и in vivo, при которых интересующий эффект будет наблюдаем.
Анализ крови на гемостаз: основные показания:
- возрастная категория более 50 лет;
- бесплодие;
- прием оральных контрацептивов/непрямых антикоагулянтов, антиагрегантов, гепаринов;
- невынашивание беременности;
- чрезмерно обильные менструации;
- неудавшиеся попытки ЭКО в анамнезе;
- не менее двух замерших беременностей в анамнезе или гестоза тяжелой степени;
- сердечно-сосудистые заболевания;
- признаки чрезмерной кровоточивости;
- предоперационное обследование;
- обследование перед ЭКО, беременностью;
- наличие тромбофилии, гемофилии и пр.;
- оценка функции печени и др.