Сердечный выброс — это понятие, используемое в медицине, которое относится к количеству крови, выбрасываемой сердцем за одну минуту. Технически, он рассчитывается как произведение частоты сердечных сокращений на ударный объем.
Увеличение частоты сердечных сокращений является компенсаторным механизмом увеличения снабжения тканей кислородом.
Факторы, которые влияют на систолический объем — это объем крови, выталкиваемый сердцем в аорту во время периода сокращения, это преднагрузка, постнагрузка и сократительная функция.
Сегодня существует ряд методов, которые позволяют нам получать измерения сердечного выброса очень эффективным и неинвазивным способом. Техника Фика, которая использовалась ранее, была заменена более современными методами.
Анализ пульсовой волны привел к получению непрерывного и минимально инвазивного измерения сердечного выброса. Другие методы, такие как биоремедиация, допплерография или эхокардиография, позволяют нам получать измерения сердечного выброса неинвазивным, быстрым и надежным способом.
Укрепление сердечной мышцы
Digitalis является одним из самых старых препаратов, которые все еще используются, главным образом, в качестве производного, известного как дигоксин (ланоксин). Мышцы желудочков сокращаются, чтобы вывести кровь из сердца. Дигоксин увеличивает силу и быстроту этого сокращения. Это также может помочь контролировать аномальные сердечные ритмы, которые уменьшают EF. Другие препараты аналогичным образом увеличивают действие накачки, таких как милринон (Примакор) и добутамин (Добутрекс). Эти препараты обычно не рекомендуются для сердечной недостаточности и зарезервированы для строго контролируемого лечения острой сердечной недостаточности, которая устойчива к другим методам лечения.
Пациент с низкой фракцией выброса левого желудочка
11 ноября 2017 0
Введение. Лечение хронической сердечной недостаточности (ХСН) является одной из самых социально значимых проблем нашей страны. По данным эпидемиологических исследований в России насчитывается более 8 миллионов человек с симптомами ХСН. Декомпенсация ХСН становится причиной госпитализации в стационары, повышая сердечно-сосудистую смертность и инвалидизируя население трудоспособного возраста. Данный клинически пример показывает возможности современных методик интервенционного лечения ХСН.
Описание случая. Больной И., 59 лет, госпитализирован с жалобами на учащенное неритмичное сердцебиение, сжимающие боли и одышку при минимальной физической нагрузке, отёки нижних конечностей, слабость, снижение работоспособности. В 50 лет была диагностирована фибрилляция предсердий, попыток восстановить синусовый ритм не проводилось. Амбулаторно принимал сердечные гликозиды, бета-адреноблокаторы, ингибиторы АПФ.
Был направлен в ФЦССХ (г. Астрахань) для определения дальнейшей тактики. По данным ЭХО- КС выявлена дилатация левого желудочка (ЛЖ) и левого предсердия (ЛП): ЛП – 52 мм, КДО ЛЖ 297 мл, КСО ЛЖ 178 мл, ФВ ЛЖ 23%, диффузный гипокинез ЛЖ, митральная регургитация 2 степени. На ЭКГ ФП, тахисистолическая форма со средней ЧСЖ 120 в мин. ПБЛНПГ (QRS 158 мс).
Учитывая болевой синдром, а также для исключения ишемического генеза ФП выполнена КАГ: патологии коронарного русла не выявлено. Проведена коррекция медикаментозной терапии: усилена ритм-урежающая терапия, добавлены мочегонные препараты, пероральные антикоагулянты.
При контрольном визите в клинику через 3 месяца, на фоне рекомендованной терапии на ЭХО КС положительная динамика: КДО ЛЖ — 288 мл; КCО ЛЖ — 188 мл; ФВ ЛЖ — 35%, митральная регургитация 2-2,5 ст.
Учитывая низкую ФВ ЛЖ и наличие ПБЛНПГ на фоне оптимальной медикаментозной терапии в течение трёх месяцев, для первичной профилактики внезапной сердечно смерти и лечения ХСН выполнена имплантация СРТ с функцией кардиовертера-дефибриллятора. Операция прошла без особенностей, левожелудочковый электрод был имплантирован в боковую вену сердца. После имплантации пациент был подключен к системе удаленного мониторинга, позволяющей дистанционно получать сообщения от имплантированного устройства в соответствии с запрограммированным графиком передач.
Через 3 месяца проведено тестирование устройства – нарушений работы не выявлено, процент бивентрикулярной стимуляции (БВС) — 74%. Дважды были нанесены немотивированные шоки ввиду неправильной дискриминации ФП с тахисистолическим проведением на желудочки. Субъективно отмечает улучшение самочувствия (уменьшилась одышка, исчезли отеки нижних конечностей). На ЭХО-КС КДО ЛЖ — 208 мл; КCО ЛЖ — 123 мл; ФВ ЛЖ — 41 %, митральная регургитация 2 ст.
Учитывая необходимость 100% БВС, возникновение немотивированных шоков, тахисистолическая форму ФП, резистентную к медикаментозной терапии, выполнено РЧА АВ соединения.
При выписке на 4 сутки при проведении ЭХО-КС отмечен прирост ФВ ЛЖ до 50 % и уменьшение размеров ЛЖ – КДО ЛЖ – 203 мл, КСО ЛЖ – 101 мл.
Обсуждение. У 15% всех больных ХСН имеются признаки электрической диссинхронии (продолжительность комплекса QRS более 120 мсек), которая может быть корригирована при помощи имплантации кардиоресинхронизирующего устройства. Одним из важных условий эффективной СРТ является наличие синусового ритма у больного с ХСН и БЛНПГ. Тактика ведения больных с СРТ и фибрилляцией предсердий (ФП) в ряде случаев неоднозначна и требует индивидуальной оценки с участием команды специалистов (кардиолог, кардиохирург, электрофизиолог, врач функциональной диагностики).
Для полноценной реализации эффектов СРТ требуется приближенная к 100% БВС. При снижении процента БВС, вне зависимости от клинических эффектов СРТ, следует верифицировать причину этого состояния. При медикаментозно-резистентных видах часто рецидивирующих, персистирующих или постоянных аритмий в случае неэффективности РЧА аритмии стратегией выбора, повышающей БВС до 100%, является создание артифициальной предсердно-желудочковой блокады.
Заключение по применению в клинической практике. Практикующие врачи зачастую плохо осведомлены о возможностях интервенционного лечения ХСН, а РЧА АВ соединения многими рассматривается как калечащая, необоснованная процедура. Данный клинический случай иллюстрирует высокую эффективность интервенционного подхода в кардиологии, который в сочетании с оптимальной медикаментозной терапией способен демонстрировать существенные клинические эффекты.
Актуальность проблемы
В последние 20 лет заболеваемость сердечной недостаточностью среди европейцев уменьшается. Но увеличивается число заболевших в средних и старших группах населения из-за роста продолжительности жизни.
По данным европейских исследований (проведение ЭХОКГ), было обнаружено снижение фракции выброса у половины пациентов с симптомной сердечной недостаточностью и у половины асимптомных пациентов.
Пациенты, имеющие сердечную недостаточность, менее трудоспособны, у них снижено качество жизни и ее длительность.
Лечение этих пациентов является наиболее дорогим и для них, и для государства. Поэтому остается актуальным поиск путей профилактики возникновения, ранней диагностики и эффективного лечения болезней сердца.
Проведенные в последние десятилетия исследования доказали эффективность ряда групп препаратов для улучшения прогноза, снижения смертности пациентов с низкой сердечной фракцией:
- ингибиторы аденозинпревращающего фермента («Эналаприл»);
- антагонисты ангиотензина П («Валсартан»);
- бета-блокаторы («Карведилол»);
- блокаторы альдостерона («Спиронолактон»);
- диуретики («Торасемид»);
- «Дигоксин».
Публикации в СМИ
Хроническая систолическая сердечная недостаточность — клинический синдром, осложняющий течение ряда заболеваний и характеризующийся наличием одышки при физической нагрузке (а затем и в покое), быстрой утомляемости, периферических отёков и объективными признаками нарушения функций сердца в покое (например, аускультативные признаки, ЭхоКГ-данные). Статистические данные. Хроническая систолическая сердечная недостаточность возникает у 0,4–2% населения. С возрастом её распространённость увеличивается: у лиц старше 75 лет она развивается в 10% случаев.
Этиология • Сердечная недостаточность с низким сердечным выбросом •• Поражение миокарда: ••• ИБС (постинфарктный кардиосклероз, хроническая миокардиальная ишемия) ••• Кардиомиопатии ••• Миокардиты ••• Токсические воздействия (например, алкоголь, доксорубицин) ••• Инфильтративные заболевания (саркоидоз, амилоидоз) ••• Эндокринные заболевания ••• Нарушения питания (дефицит витамина В1) •• Перегрузка миокарда ••• Артериальная гипертензия ••• Ревматические пороки сердца ••• Врождённые пороки сердца (например, стеноз устья аорты) •• Аритмии ••• Наджелудочковые и желудочковые тахикардии ••• Фибрилляция предсердий • Сердечная недостаточность с высоким сердечным выбросом •• Анемия •• Сепсис •• Артериовенозная фистула.
Факторы риска • Отказ больного от фармакотерапии • Назначение ЛС с отрицательным инотропным эффектом, и бесконтрольный их приём • Тиреотоксикоз, беременность и другие состояния, связанные с увеличением метаболических потребностей • Избыточная масса тела • Наличие хронической патологии сердца и сосудов (артериальная гипертензия, ИБС, пороки сердца и др.).
Патогенез • Нарушается насосная функция сердца, что приводит к уменьшению сердечного выброса • В результате снижения сердечного выброса возникает гипоперфузия многих органов и тканей •• Уменьшение перфузии сердца приводит к активации симпатической нервной системы и учащению ритма сердца •• Уменьшение перфузии почек обусловливает стимуляцию ренин-ангиотензиновой системы. Увеличивается выработка ренина, при этом происходит избыточная продукция ангиотензина II, приводящая к вазоконстрикции, задержке воды (отёки, жажда, увеличение ОЦК) и последующему увеличению преднагрузки на сердце •• Снижение перфузии периферических мышц обусловливает накопление в них недоокисленных продуктов метаболизма, а также гипоксия приводят к выраженной утомляемости.
КЛАССИФИКАЦИИ Классификация XII Всесоюзного съезда терапевтов 1935 г. (Н.Д. Стражеско, В.Х. Василенко). • I стадия (начальная) — скрытая сердечная недостаточность, проявляющаяся только при физической нагрузке (одышкой, тахикардией, быстрой утомляемостью). • II стадия (выраженная) — длительная недостаточность кровообращения, нарушения гемодинамики (застой в большом и малом круге кровообращения), нарушение функций органов и обмена веществ выражены и в покое •• Период А — начало длительной стадии, характеризуется слабо выраженными нарушениями гемодинамики, нарушениями функций сердца или только их части •• Период Б — конец длительной стадии, характеризуется глубокими нарушениями гемодинамики, в процесс вовлекается вся ССС. • III стадия (конечная, дистрофическая) — тяжёлые нарушения гемодинамики, стойкие изменения обмена веществ и функций всех органов, необратимые изменения структуры тканей и органов.
Классификация Нью-Йоркской кардиологической ассоциации (1964) • I класс — обычная физическая нагрузка не вызывает выраженной утомляемости, одышки или сердцебиения • II класс — лёгкое ограничение физической активности: удовлетворительное самочувствие в покое, но обычная физическая нагрузка вызывает утомление, сердцебиение, одышку или боли • III класс — выраженное ограничение физической активности: удовлетворительное самочувствие в покое, но нагрузка менее обычной приводит к появлению симптоматики • IV класс — невозможность выполнения какой-либо физической нагрузки без ухудшения самочувствия: симптомы сердечной недостаточности имеются даже в покое и усиливаются при любой физической нагрузке.
Классификация общества специалистов по сердечной недостаточности (ОСНН, 2002) принята на Всероссийском конгрессе кардиологов в октябре 2002 г. Удобство данной классификации в том, что она не только отражает состояние процесса, но и его динамику. В диагнозе необходимо отражать как стадию хронической сердечной недостаточности, так и её функциональный класс. Необходимо учитывать, что соответствие стадии и функционального класса не вполне чёткое — функциональный класс выставляют при наличии несколько менее выраженных проявлений, чем это необходимо для выставления соответствующей стадии сердечной недостаточности.
• Стадии хронической сердечной недостаточности (могут ухудшаться несмотря на лечение) •• I стадия — начальная стадия заболевания (поражения) сердца. Гемодинамика не нарушена. Скрытая сердечная недостаточность Бессимптомная дисфункция левого желудочка •• IIА стадия — клинически выраженная стадия заболевания (поражения) сердца. Нарушения гемодинамики в одном из кругов кровообращения, выраженные умеренно. Адаптивное ремоделирование сердца и сосудов •• IIБ стадия — тяжёлая стадия заболевания (поражения) сердца. Выраженные изменения гемодинамики в обоих кругах кровообращения. Дезадаптивное ремоделирование сердца и сосудов •• III стадия — конечная стадия поражения сердца. Выраженные изменения гемодинамики и тяжёлые (необратимые) структурные изменения органов-мишеней (сердца, лёгких, сосудов, головного мозга, почек). Финальная стадия ремоделирования органов.
• Функциональные классы хронической сердечной недостаточности (могут изменяться на фоне лечения как в одну, так и другую сторону) •• I ФК — ограничения физической активности отсутствуют: привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и/или замедленным восстановлением сил •• II ФК — незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением •• III ФК — заметное ограничение физической активности: в покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов •• IV ФК — невозможность выполнить какую-либо физическую нагрузку без появления дискомфорта; симптомы сердечной недостаточности присутствуют в покое и усиливаются при минимальной физической активности.
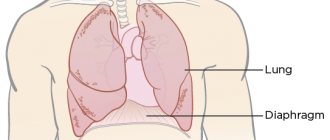
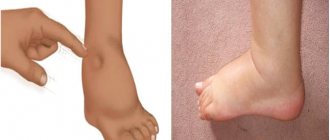
Клинические проявления • Жалобы — одышка, приступы удушья, слабость, утомляемость •• Одышка в начальной стадии сердечной недостаточности возникает при физической нагрузке, а при выраженной сердечной недостаточности — в покое. Она появляется в результате увеличения давления в лёгочных капиллярах и венах. Это уменьшает растяжимость лёгких и увеличивает работу дыхательных мышц •• Для выраженной сердечной недостаточности характерно ортопноэ — вынужденное положение сидя, принимаемое больным для облегчения дыхания при выраженной одышке. Ухудшение самочувствия в положении лёжа обусловлено депонированием жидкости в лёгочных капиллярах, приводящим к увеличению гидростатического давления. Кроме того, в положении лёжа диафрагма приподнимается, что несколько затрудняет дыхание •• Для хронической сердечной недостаточности характерна пароксизмальная ночная одышка (сердечная астма), обусловленная возникновением интерстициального отёка лёгких. Ночью во время сна развивается приступ выраженной одышки, сопровождающийся кашлем и появлением хрипов в лёгких. При прогрессировании сердечной недостаточности может возникать альвеолярный отёк лёгких •• Быстрая утомляемость у больных сердечной недостаточностью появляется вследствие недостаточного снабжения кислородом скелетных мышц •• Больных с хронической сердечной недостаточностью могут беспокоить тошнота, снижение аппетита, боли в животе, увеличение живота (асцит) вследствие застоя крови в печени и системе воротной вены •• Со стороны сердца могут выслушиваться патологические III и IV тоны сердца. В лёгких определяются влажные хрипы. Характерен гидроторакс, чаще правосторонний, возникающий в результате увеличения плеврального капиллярного давления и транссудации жидкости в плевральную полость.
• Клинические проявления сердечной недостаточности существенно зависят от её стадии •• Стадия I — признаки (быстрая утомляемость, одышка и сердцебиение) появляются при обычной физической нагрузке, в покое проявлений сердечной недостаточности нет •• Стадия IIА — имеются невыраженные нарушения гемодинамики. Клинические проявления зависят от того, какие отделы сердца преимущественно поражены (правые или левые) ••• Левожелудочковая недостаточность характеризуется застоем в малом круге кровообращения, проявляющемся типичной инспираторной одышкой при умеренной физической нагрузке, приступами пароксизмальной ночной одышки, быстрой утомляемостью. Отёки и увеличение печени нехарактерны ••• Правожелудочковая недостаточность характеризуется формированием застойных явлений по большому кругу кровообращения. Пациентов беспокоит боль и тяжесть в правом подреберье, уменьшение диуреза. Характерно увеличение печени (поверхность гладкая, край закруглён, пальпация болезненна). Отличительной особенностью сердечной недостаточности IIА стадии считают полную компенсацию состояния на фоне лечения, т.е. обратимость проявлений сердечной недостаточности в результате адекватного лечения •• Стадия IIБ — имеются глубокие нарушения гемодинамики, вовлечена в процесс вся система кровообращения. Одышка возникает при малейшей физической нагрузке. Больных беспокоят чувство тяжести в правой подрёберной области, общая слабость, нарушение сна. Характерны ортопноэ, отёки, асцит (следствие увеличения давления в печёночных венах и венах брюшины — возникает транссудация, и жидкость накапливается в брюшной полости), гидроторакс, гидроперикард •• III стадия — конечная дистрофическая стадия с глубокими необратимыми нарушениями обмена веществ. Как правило, состояние больных в этой стадии тяжёлое. Одышка выражена даже в покое. Характерны массивные отёки, скопление жидкости в полостях (асцит, гидроторакс, гидроперикард, отёк половых органов). На этой стадии возникает кахексия.
Инструментальные данные • ЭКГ: можно выявить признаки блокады левой или правой ножки пучка Хиса, гипертрофии желудочков или предсердий, патологические зубцы Q (как признак перенесённого ИМ), аритмии. Нормальная ЭКГ позволяет усомниться в диагнозе хронической сердечной недостаточности. • ЭхоКГ позволяет уточнить этиологию хронической сердечной недостаточности и оценить функции сердца, степень их нарушения (в частности, определить фракцию выброса левого желудочка). Типичные проявления сердечной недостаточности — расширение полости левого желудочка (по мере прогрессирования — расширение и других камер сердца), увеличение конечного систолического и конечного диастолического размеров левого желудочка, снижение его фракции выброса. • Рентгенологическое исследование •• Возможно выявление венозной гипертензии в виде перераспределения кровотока в пользу верхних отделов лёгких и увеличения диаметра сосудов •• При застое в лёгких выявляют признаки интерстициального отёка (линии Керли в рёберно-диафрагмальных синусах) либо признаки отёка лёгких •• Обнаруживают гидроторакс (чаще правосторонний) •• Кардиомегалию диагностируют при увеличении поперечного размера сердца более 15,5 см у мужчин и более 14,5 см у женщин (либо при кардиоторакальном индексе более 50%). • Катетеризация полостей сердца позволяет выявить увеличение давления заклинивания лёгочных капилляров более 18 мм рт.ст. Диагностические критерии — Фремингемские критерии диагностики хронической сердечной недостаточности, подразделяемые на большие и малые • Большие критерии: пароксизмальная ночная одышка (сердечная астма) или ортопноэ, набухание шейных вен, хрипы в лёгких, кардиомегалия, отёк лёгких, патологический III тон сердца, увеличение ЦВД (более 160 мм вод.ст.), время кровотока более 25 с, положительный «гепатоюгулярный рефлюкс» • Малые критерии: отёки на ногах, ночной кашель, одышка при нагрузке, увеличение печени, гидроторакс, тахикардия более 120 в минуту, уменьшение ЖЕЛ на 1/3 от максимальной • Для подтверждения диагноза хронической сердечной недостаточности необходим либо 1 большой либо 2 малых критерия. Определяемые признаки должны быть связаны с сердечным заболеванием.
Дифференциальная диагностика • Нефротический синдром — наличие в анамнезе отёков, протеинурии, почечной патологии • Цирроз печени • Окклюзионные поражения вен с последующим развитием периферических отёков. Лечение • Необходимо в первую очередь оценить возможность воздействия на причину недостаточности. В ряде случаев эффективное этиологическое воздействие (например, хирургическая коррекция порока сердца, реваскуляризация миокарда при ИБС) может значительно уменьшить выраженность проявлений хронической сердечной недостаточности • В лечении хронической сердечной недостаточности выделяют немедикаментозные и лекарственные методы терапии. Следует отметить, что оба вида лечения должны дополнять друг друга.
Немедикаментозное лечение • Ограничение употребления поваренной соли до 5–6 г/сут, жидкости (до 1–1,5 л/сут) • Оптимизация физической активности •• Умеренная физическая активность возможна и даже необходима (ходьба как минимум по 20–30 мин 3–5 р/нед) •• Полный физический покой следует соблюдать при ухудшении состояния (в покое урежается ЧСС и уменьшается работа сердца).
Лекарственная терапия. Конечная цель лечения хронической сердечной недостаточности — улучшение качества жизни и увеличение её продолжительности.
• Диуретики. При их назначении необходимо учитывать, что возникновение отёков при сердечной недостаточности связано с несколькими причинами (сужением почечных сосудов, увеличением секреции альдостерона, повышением венозного давления. Лечение только диуретиками считают недостаточным. При хронической сердечной недостаточности обычно применяют петлевые (фуросемид) или тиазидные (например, гидрохлоротиазид) диуретики. При недостаточном диуретическом ответе комбинируют петлевые диуретики и тиазиды •• Тиазидные диуретики. Обычно применяют гидрохлоротиазид в дозе от 25 до 100 мг/сут. Следует помнить, что при СКФ почек менее 30 мл/мин использовать тиазиды нецелесообразно •• Петлевые диуретики начинают действовать быстрее, диуретический эффект у них выражен сильнее, но менее продолжителен, чем у тиазидных диуретиков. Применяют фуросемид в дозе 20–200 мг/сут в/в в зависимости от проявлений отёчного синдрома и диуреза. Возможно его назначение внутрь в дозе 40–100 мг/сут.
• Ингибиторы АПФ вызывают гемодинамическую разгрузку миокарда вследствие расширения сосудов, увеличения диуреза, уменьшения давления наполнения левого и правого желудочков. Показаниями для назначения ингибиторов АПФ считают клинические признаки сердечной недостаточности, снижение фракции выброса левого желудочка менее 40%. При назначении ингибиторов АПФ необходимо соблюдать определённые условия по рекомендациям Европейского общества кардиологов (2001) •• Необходимо прекратить приём диуретиков за 24 ч до приёма ингибиторов АПФ •• Следует проводить контроль АД до и после приёма ингибиторов АПФ •• Лечение начинают с малых доз с постепенным их повышением •• Необходимо контролировать функции почек (диурез, относительную плотность мочи) и концентрацию электролитов крови (ионов калия, натрия) при увеличении дозы каждые 3–5 дней, затем каждые 3 и 6 мес •• Следует избегать совместного назначения калийсберегающих диуретиков (их можно назначать только при гипокалиемии) •• Нужно избегать сочетанного применения НПВС.
• Получены первые положительные данные о благоприятном влиянии блокаторов рецепторов ангиотензина II (в частности, лозартана) на течение хронической сердечной недостаточности как альтернативы ингибиторам АПФ при их непереносимости или противопоказаниях к назначению.
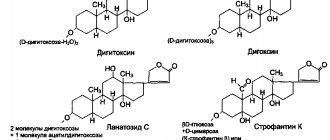
• Сердечные гликозиды оказывают положительное инотропное (увеличивают и укорачивают систолу), отрицательное хронотропное (снижение ЧСС), отрицательное дромотропное (замедление АВ-проводимости) действие. Оптимальной поддерживающей дозой дигоксина считают 0,25–0,375 мг/сут (у пожилых пациентов 0,125–0,25 мг/сут); терапевтическая концентрация дигоксина в сыворотке крови составляет 0,5–1,5 мг/л. Показаниями для назначения сердечных гликозидов являются тахисистолическая форма фибрилляции предсердий, синусовая тахикардия.
• b-Адреноблокаторы •• Механизм благоприятного действия -адреноблокаторов при хронической сердечной недостаточности обусловлен следующими факторами ••• Прямая защита миокарда от неблагоприятного воздействия катехоламинов ••• Защита от индуцированной катехоламинами гипокалиемии ••• Улучшение кровотока в венечных артериях вследствие снижения ЧСС и улучшения диастолического расслабления миокарда ••• Уменьшение воздействия сосудосуживающих систем (например, вследствие уменьшения секреции ренина) ••• Потенцирование вазодилатирующей калликреин-кининовой системы ••• Увеличение вклада левого предсердия в наполнение левого желудочка за счёт улучшения расслабления последнего •• В настоящее время из b-адреноблокаторов для лечения хронической сердечной недостаточности рекомендован к применению карведилол — b1- и a1-адреноблокатор с вазодилатирующими свойствами. Начальная доза карведилола составляет 3,125 мг 2 р/сут с последующим увеличением дозы до 6,25 мг, 12,5 мг или 25 мг 2 р/сут при отсутствии побочного действия в виде артериальной гипотензии, брадикардии, снижения фракции выброса левого желудочка (по данным ЭхоКГ) и других отрицательных проявлений действия b-адреноблокаторов. Рекомендованы также метопролол, начиная с дозы 12,5 мг 2 р/сут, бисопролол по 1,25 мг 1 р/сут под контролем фракций выброса желудочков с постепенным увеличением дозы через 1–2 нед.
• Спиронолактон. Установлено, что назначение антагониста альдостерона спиронолактона в дозе 25 мг 1–2 р/сут (при отсутствии противопоказаний) способствует увеличению продолжительности жизни больных сердечной недостаточностью. • Периферические вазодилататоры назначают при хронической сердечной недостаточности в случае наличия противопоказаний или при плохой переносимости ингибиторов АПФ. Из периферических вазодилататоров применяют гидралазин в дозе до 300 мг/сут, изосорбид динитрат в дозе до 160 мг/сут.
• Другие кардиотонические средства. b-Адреномиметики (добутамин), ингибиторы фосфодиэстеразы назначают обычно на 1–2 нед в конечной стадии сердечной недостаточности либо при резком ухудшении состояния больных.
• Антикоагулянты. Больные с хронической сердечной недостаточностью подвержены высокому риску тромбоэмболических осложнений. Возможна как ТЭЛА вследствие венозного тромбоза, так и тромбоэмболия сосудов большого круга кровообращения, обусловленная внутрисердечными тромбами или фибрилляцией предсердий. Назначение непрямых антикоагулянтов больным с хронической сердечной недостаточностью рекомендовано при наличии фибрилляции предсердий и тромбозах в анамнезе.
• Антиаритмические препараты. При наличии показаний к назначению антиаритмических средств (фибрилляция предсердий, желудочковые тахикардии) рекомендуют использовать амиодарон в дозе 100–200 мг/сут. Этот препарат обладает минимальным отрицательным инотропным эффектом, в то время как большинство остальных препаратов этого класса снижают фракцию выброса левого желудочка. Кроме того, сами антиаритмические средства могут провоцировать аритмии (проаритмический эффект). Хирургическое лечение
• Выбор оптимального метода хирургического лечения зависит от причины, приводящей к сердечной недостаточности. Так, при ИБС во многих случаях выполнима реваскуляризация миокарда, при идиопатическом субаортальном гипертрофическом стенозе — септальная миоэктомия, при клапанных пороках — протезирование или реконструктивные вмешательства на клапанах, при брадиаритмиях — имплантация ЭКС и т.д.
• В случае рефрактерности сердечной недостаточности к адекватной терапии основным хирургическим методом лечения является трансплантация сердца. • Методы механической поддержки кровообращения (имплантация ассисторов, искусственных желудочков и биомеханических помп), ранее предложенные как временные варианты перед трансплантацией, в настоящее время приобрели статус самостоятельных вмешательств, результаты которых сопоставимы с результатами трансплантации. • Для предупреждения прогрессирования дилатации сердца проводят имплантацию устройств в виде сетки, препятствующей избыточному расширению сердца. • При толерантном к лечению лёгочном сердце более целесообразным вмешательством представляется трансплантация комплекса «сердце–лёгкие».
Прогноз. В целом 3-летняя выживаемость больных хронической систолической сердечной недостаточностью составляет 50%. Смертность от хронической систолической сердечной недостаточности составляет 19% в год.
• Факторы, наличие которых коррелирует с плохим прогнозом у больных с сердечной недостаточностью •• Снижение фракции выброса левого желудочка менее 25% •• Невозможность подъёма на один этаж и движения в нормальном темпе более 3 мин •• Снижение содержания ионов натрия плазмы крови менее 133 мэкв/л •• Снижение концентрации ионов калия плазмы крови менее 3 мэкв/л •• Увеличение содержания в крови норэпинефрина •• Частая желудочковая экстрасистолия при суточном мониторировании ЭКГ.
• Риск внезапной сердечной смерти больных с сердечной недостаточностью в 5 раз выше, чем в общей популяции. Большинство больных хронической сердечной недостаточностью погибают внезапно, преимущественно от возникновения фибрилляции желудочков. Профилактическое назначение антиаритмических средств не предупреждает данного осложнения.
МКБ-10 • I50 Сердечная недостаточность
Снижение сопротивления сосудов кровеносным сосудом
Артерии также имеют мышцы. Чем больше они сокращаются, тем меньше канал, через который течет кровь, и тем больше напряжение на сердечной мышце. Ангиотензин, природный гормон, является очень мощным констриктором кровеносных сосудов. Препараты, которые ингибируют образование ангиотензина или блокируют его способность связываться с кровеносным сосудом, помогают расслабить мышцы сосудов и являются основой Руководства Общества сердечной недостаточности Америки. Примеры включают каптоприл (Capoten), эналаприл (Vasotec), валсартан (Diovan) и лозартан (Cozaar). Из-за этой релаксации сердце может вывести больше крови за такт, улучшая EF. Комбинация препаратов гидралазина и изосорбида (Bidil) может быть эффективной у пациентов, которые устойчивы к — или не переносят — ингибиторы ангиотензина.
Расслабление сердечной мышцы
В ответ на снижение EF организм высвобождает такие вещества, как адреналин, которые увеличивают скорость и силу сокращения желудочков. В то время как временные эффективные, хронические возвышения этих соединений вызывают усиление сердечной мышцы и уменьшают ее движение. Бета-блокаторы — это препараты, которые противодействуют этим действиям, уменьшают напряжение в стенке сердца и улучшают способность к сокращению. Три из них рекомендуются карведилол (Coreg), метопролол сукцинат (Toprol XL) и бисопролол (Zebeta).Бета-блокаторы чаще всего используются в комбинации с ингибиторами ангиотензина.
Искусственные клапаны сердца
Рекомендации пациентам с протезированным клапаном сердца 1.6 Мб
Искусственный клапан сердца: 2 основных типа
При нарушении работы какого-либо из 4 клапанов сердца — их сужении (стеноз) или чрезмерном расширении (недостаточности) — существует возможность их замены или реконструкции при помощи искусственных аналогов. Искусственный клапан сердца — это протез, который обеспечивает требуемое направление тока крови за счет прерывистого перекрывания устьев венозных и артериальных сосудов. Основным показанием к протезированию служат грубые изменения створок клапана, приводящие к выраженному нарушению кровообращения.
Применяются два основных типа искусственных клапанов сердца: механические и биологические модели, каждая из которых имеют свои особенности, преимущества и недостатки.
1. Butchart EG et al. Recommendations for the management of patients after heart valve surgery. European Heart Journal. 2005: 26(22); 2465-2471.
Рисунок 1. Два основных типа искусственных клапанов
Механический клапан сердца или биологический протез?
Механический клапан сердца надежен, служит долго и не нуждается в замене, но требует постоянного приема специальных медикаментов, снижающих свертываемость крови.
2. Bonow R.O., Carabello B.A., Kanu C. et al.; American College of Cardiology/American Heart Association Task Force on Practice Guidelines; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions; Society of Thoracic Surgeons. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): developed in collaboration with the Society of Cardiovascular Anesthesiologists: endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. Circulation 2006; 114 (5): e84-231; J Am Coll Cardiol 2006; 48 (3): e1-148.
Биологические клапаны постепенно могут разрушаться. Срок их службы в значительной степени зависит от возраста больного и сопутствующих заболеваний. С возрастом процесс разрушения биологических клапанов существенно замедляется.
Решение о том, какой клапан наиболее оптимален, должно приниматься перед хирургическим вмешательством в ходе обязательной беседы между хирургом и пациентом.
Жизнь с искусственным клапаном сердца
Люди с протезами сердечных клапанов относятся к категории пациентов с очень высоким риском тромбоэмболических осложнений. Борьба с тромбозами — основа стратегии ведения таких пациентов, и именно ее успешность во многом определяет прогноз для больного.
Риск тромбоэмболических осложнений уменьшается при использовании биологических протезов клапанов, но они имеют свои недостатки. Их имплантируют нечасто и преимущественно пожилым людям.
Жизнь с искусственным клапаном сердца требует ряда ограничений. Большинство пациентов с протезированными клапанами — это лица с механическими протезами, которые принадлежат к группе высокого риска развития тромботических осложнений. Пациент вынужден постоянно принимать антитромботические препараты, в абсолютном большинстве случаев — непрямые антикоагулянты (варфарин). Их должны принимать практически все пациенты с механическими клапанами сердца. Выбор биопротеза также не исключает необходимость приема варфарина, особенно у больных с фибрилляцией предсердий. Во избежание опасных кровотечений, постоянно принимающим варфарин пациентам лучше отказаться от повседневной деятельности и развлечений, связанных с повышенным риском получения травм (контактные виды спорта, работа с режущими предметами или с высоким риском падений даже с высоты собственного роста).
К наиболее важным аспектам врачебного наблюдения за пациентом с искусственным клапаном сердца на сегодняшний день относятся:
- контроль свертываемости крови;
- активная профилактика тромбоэмболических осложнений с помощью антикоагулянтов (чаще всего варфарина).
3. Bonow R.O., Carabello B.A., Chatterjee K. et al.; American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 1998 guidelines for the management of patients with valvular heart disease). Endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation 2008;118 (15): e523-661; J Am Coll Cardiol 2008; 52 (13): e1-142.
Важно отметить, что в настоящее время европейские и американские эксперты считают слишком интенсивными те уровни антитромботической терапии, которые раньше рекомендовались для большинства пациентов. Современные подходы к оценке риска позволяют выделить подгруппы лиц с наиболее высоким риском тромбоэмболических осложнений и активной антитромботической терапией. Для других пациентов с протезированными сердечными клапанами достаточно эффективной будет менее агрессивная антитромботическая терапия.
Профилактика тромбозов у пациентов с механическими клапанами сердца
Профилактика тромбоза у пациентов с механическим клапаном сердца требует пожизненной антитромботической терапии.
Интенсивность терапии варфарином зависит от локализации протеза и его типа. Например, в соответствии с рекомендациям ACC/AHA (2008) механический протез аортального клапана требует поддержания МНО в пределах 2,0-3,0 при использования двухлепестковых (двустворчатых) протезов, а также клапана Medtronic Hall (один из самых популярных в мире одностворчатых искусственных клапанов), или в дипазоне 2,5-3,5 для всех остальных дисковых клапанов, а также для шарового клапана Starr–Edwards.
4. Salem D.N., O’Gara P.T., Madias C., Pauker S.G.; American College of Chest Physicians. Valvular and structural heart disease: American College of Chest Physicians Evidence
Механический протез митрального клапана требует удержания МНО в рамках 2,5-3,5 для всех типов клапанов.
Таблица 1. Рекомендуемое значение МНО при механических клапанах сердца
| Позиция клапана сердца | Факторы риска ТЭ-осложнений | |
| отсутствуют | присутствуют | |
| Аортальная | 2,0-3,0 | 2,5-3,5 |
| Митральная | 2,5-3,5 | 3,0-4,0 |
5. Методические рекомендации рассмотрены и рекомендованы ученым советом ФГБУ «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний» СО РАМН 01 июля 2011 г., обновлены 14 января 2014 г.
Однако даже на фоне рекомендованной антитромботической терапии риск тромбоэмболических осложнений у пациентов, перенесших протезирование клапанов сердца, остается на уровне 1-2 %. Результаты большинства клинических исследований свидетельствуют о том, что риск тромбоза выше у пациентов с протезами митральных клапанов (по сравнению с протезами аортальных). Если для пациентов с искусственными аортальными клапанами возможен менее интенсивный режим антикоагулянтной терапии (с целевым МНО 2,0-3,0), то в случае с механическим протезом митрального клапана режим антикоагулянтной терапии должен быть достаточно интенсивным (с целевым МНО 2,5-3,5).
6. Vahanian A., Baumgartner H., Bax J. et al.; Task Force on the Management of Valvular Hearth Disease of the European Society of Cardiology; ESC Committee for Practice Guidelines. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 2007; 28 (2): 230-68.
Вне зависимости от типа используемого искусственного клапана риск тромбоза наиболее высок в первые несколько месяцев после операции – до завершения процессов эпителизации в месте имплантации протеза. Американские эксперты считают целесообразным удерживать МНО в рамках 2,5-3,5 в первые 3 мес. после операции даже для больных с искусственным аортальным клапаном.
Кроме того, удержание МНО в более жестких рамках (2,5-3,5) рекомендуется ACC/AHA при наличии факторов высокого риска тромбоэмболизма вне зависимости от типа протеза и его локализации. К таким факторам относятся мерцательная аритмия, тромбоэмболия в анамнезе, дисфункция левого желудочка (ЛЖ), состояние гиперкоагуляции.
В настоящее время существуют портативные аппараты для самостоятельного определения МНО (по типу систем для контроля уровня сахара у больных диабетом), которые помогают удерживать уровень МНО в необходимом диапазоне. Среди них зарекомендовал себя Coagucheck XS для самостоятельного проведения анализов и немедленного получения результатов ПТВ/МНО. Прибор позволяет получить точные результаты менее чем за минуту, используя при этом всего 8 мкл (одну каплю крови).
Тем не менее, независимо от выбранной стратегии антитромботического лечения после протезирования сердечных клапанов, принципиально важным остается регулярное наблюдение за пациентом, его обучение и тесное сотрудничество с лечащим врачом.
7. Butchart E.G. Antithrombotic management in patients with prosthetic valves: a comparison of American and European guidelines. Heart 2009;95: 430 436.
Это позволяет своевременно корректировать дозы препаратов, а также изменения их тромболитической активности в зависимости от особенностей питания, состояния функции печени и почек пациента.
Профилактика тромбоза у пациентов с биопротезами клапанов
Пациентам с биопротезами клапанов показана менее агрессивная антикоагулянтная терапия, поскольку в большинстве исследований риск тромбоэмболических осложнений у таких больных даже при отсутствии терпи антикоагулянтами составлял в среднем всего 0,7 %.
По мнению американских экспертов добавление варфарина может быть полезным при повышенном риске тромбоэмболий, но не рекомендуется рутинно всем пациентам. При использовании варфарина следует удерживать МНО в рамках 2,0-3,0, если протезирован аортальный клапан, и 2,5-3,5 — если митральный.
Применение варфарина с целевым МНО 2,0-3,0 также может быть целесообразно в первые 3 мес. после операции и у больных с протезом митрального или аортального клапана без факторов риска, учитывая повышенную склонность к тромбообразованию в ранние сроки после протезирования клапана. Особые преимущества от такой стратегии получают пациенты с протезом митрального клапана.
Таблица 2. Рекомендуемое значение МНО при биологических клапанах сердца
| Позиция клапана сердца | Факторы риска ТЭ-осложнений | |
| отсутствуют | присутствуют | |
| Аортальная | 2,0-2,5 | 2,5-3,0 |
| Митральная | 2,5-3,0 | 3,0-3,5 |
| Трикуспидальная | 2,5-3,0 | 3,0-3,5 |
Однако европейские эксперты ESC полагают, что в настоящее время нет достаточно убедительных данных, подтверждающих необходимость длительной антитромботической терапии у пациентов с биопротезами сердечных клапанов, если у этих пациентов нет каких-либо дополнительных факторов риска.
В европейском руководстве использовать варфарин у таких больных рекомендуется только на протяжении первых 3 мес. после операции (целевое МНО — 2,5).
Длительная (пожизненная) антикоагулянтная терапия у пациентов с биопротезами клапанов может быть целесообразной только при наличии факторов высокого риска (например, мерцательной аритмии; в меньшей мере таким фактором риска может выступать сердечная недостаточность с ФВ ЛЖ <30%), утверждается в руководстве ESC6.
Таким образом, и в отношении больных с биопротезами сердечных клапанов европейские эксперты рекомендуют более осторожную тактику антитромботической терапии, в то время как американские специалисты считают оправданным более агрессивный подход. В то же время в США более распространена тенденция минимизировать время нахождения пациента в стационаре и стоимость его лечения, поэтому американские врачи для профилактики тромбоэмболий предпочитают назначать пациентам с биопротезами препараты ацетилсалициловой кислоты. В Европе пока склонны удерживать пациента в стационаре дольше, если это требуется, и применять у данной категории больных варфарин, более требовательный к мониторингу показателей свертывания крови.
Одной из наиболее существенных проблем ведения таких пациентов в условиях отечественного здравоохранения является невозможность адекватного контроля показателей свертывания крови на фоне постоянного приема антикоагулянтов.
Именно показатель МНО рекомендован всеми международными руководствами как необходимый для обеспечения безопасности и эффективности терапии.
Рекомендации пациентам с протезированным клапаном сердца 1.6 Мб
Мышечный насос
Движение крови по венам обеспечивается рядом факторов: работой сердца, клапанным аппаратом вен, «мышечным насосом» и др.Вены верхних и нижних конечностей снабжены клапанами, а глубокие вены окружены мышцами. При физической
нагрузке мышцы действуют как насосы, оказывая давление на вены снаружи. Чем чаще и активнее движения, например при ходьбе, тем эффективнее «насосное действие» мышц. Правда, сокращение мышц, пережимая сосуды, затрудняет кровоток. Но если сокращения носят перемежающийся характер, то уменьшение кровотока во время фазы сокращения эффективно компенсируется за счет кислорода, связанного с миоглобином. Поэтому во время ритмичной нагрузки, возникающей при беге, ходьбе на лыжах, езде на велосипеде, кровоснабжение мышц конечностей намного увеличивается. Сокращение мышц брюшного пресса ведет к вытеснению значительного количества крови из сосудов печени, кишечника и селезенки, увеличивая приток крови к сердцу и тем самым влияя на сердечный выброс.
При сокращении мышц вены в них сжимаются, что немедленно приводит к увеличению притока крови к правому желудочку (мышечному насосу). Увеличение оттока венозной крови из мышц нижних конечностей способствует быстрому заполнению сердца и, кроме того, повышает давление перфузии в нижних конечностях за счет снижения давления в венах голени и ступни.
Активация мышечного насоса сопровождается изменениями в посткапиллярных сосудах (в основном в венах) системного кровообращения.
Физические упражнения вызывают рефлекторное увеличение напряжения стенок венозных сосудов как в работающих, так и в неработающих конечностях. Это напряжение сохраняется в течение всей нагрузки и пропорционально степени ее тяжести.
Лечение хронической ишемической болезни сердца
Ишемическая (коронарная) болезнь сердца (ИБС), развивающаяся вследствие атеросклероза коронарных артерий, является ведущей причиной инвалидности и смертности трудоспособного населения во всем мире. В России распространенность сердечно-сосудистых заболеваний и ИБС растет, а по смертности от них наша страна находится на одном из первых мест в мире, что обусловливает необходимость использования врачами современных и эффективных методов их лечения и профилактики. Среди населения России сохраняется высокое распространение основных факторов риска развития ИБС, из которых наибольшее значение имеют курение, артериальная гипертония, гиперхолестеринемия.
Атеросклероз является главной причиной развития ИБС. Он протекает скрытно длительное время до тех пор, пока не приведет к таким осложнениям, как инфаркт миокарда, мозговой инсульт, внезапная смерть, либо к появлению стенокардии, хронической цереброваскулярной недостаточности, к перемежающейся хромоте. Атеросклероз приводит к постепенному локальному стенозированию коронарных, мозговых и других артерий за счет образования и роста в них атеросклеротических бляшек. Кроме того, в его развитии принимают участие такие факторы, как дисфункция эндотелия, регионарные спазмы, нарушение микроциркуляции, а также наличие первичного воспалительного процесса в сосудистой стенке как возможного фактора формирования тромбоза [1]. Нарушение баланса вазодилатирующих и вазоконстрикторных стимулов также может существенно изменить состояние тонуса коронарных артерий, создавая дополнительный динамический стеноз к уже имеющемуся фиксированному.
Развитие стабильной стенокардии может быть предсказуемым, например, при наличии факторов, вызывающих увеличение потребности миокарда в кислороде, таких, как физическая или эмоциональная нагрузка (стресс).
Пациенты со стенокардией, включая уже перенесших инфаркт миокарда, составляют самую многочисленную группу больных ИБС. Этим объясняется интерес практикующих врачей к вопросам правильного ведения больных стенокардией и выбора оптимальных методов лечения.
Клинические формы ИБС. ИБС проявляется множеством клинических форм: хроническая стабильная стенокардия, нестабильная (прогрессирующая) стенокардия, бессимптомная ИБС, вазоспастическая стенокардия, инфаркт миокарда, сердечная недостаточность, внезапная смерть. Преходящая ишемия миокарда, возникающая обычно в результате сужения коронарных артерий и повышения потребности в кислороде, — основной механизм появления стабильной стенокардии.
Хроническую стабильную стенокардию принято делить на 4 функциональных класса по тяжести симптоматики (Канадская классификация).
Основными целями лечения являются улучшение качества жизни пациента за счет снижения частоты приступов стенокардии, профилактика острого инфаркта миокарда, улучшение выживаемости. Успешным антиангинальное лечение считается в случае полного или почти полного устранения приступов стенокардии и возвращения больного к нормальной активности (стенокардия не выше I функционального класса, когда болевые приступы возникают только при значительных нагрузках) и при минимальных побочных эффектах терапии [2, 3].
В терапии хронической ИБС применяются 3 основных группы препаратов: β-адреноблокаторы, антагонисты кальция, органические нитраты, которые существенно уменьшают количество приступов стенокардии, снижают потребность в нитроглицерине, повышают переносимость физической нагрузки и улучшают качество жизни больных.
Однако до сих пор практикующие врачи неохотно назначают новые эффективные препараты в достаточных дозах. Кроме того, при наличии большого выбора современных антиангинальных и антиишемических препаратов следует исключить устаревшие, недостаточно эффективные. Правильно выбрать метод лечения помогает откровенная беседа с больным, объяснение причины болезни и ее осложнений, необходимости проведения дополнительных неинвазивных и инвазивных методов исследования.
Согласно результатам исследования ATР-survey (Angina Treatment Patterns), в России при выборе антиангинальных препаратов с гемодинамическим механизмом действия в режиме монотерапии предпочтение отдается нитратам (11,9%), затем b-адреноблокаторам (7,8%) и антагонистам кальция (2,7%) [4].
β-адреноблокаторы являются препаратами первого выбора для лечения больных со стенокардией, особенно у больных, перенесших инфаркт миокарда, так как они приводят к уменьшению смертности и частоты повторного инфаркта. Препараты этой группы применяются в лечении больных ИБС более 40 лет.
β-адреноблокаторы вызывают антиангинальный эффект путем снижения потребности миокарда в кислороде (за счет урежения частоты сердечных сокращений, снижения артериального давления и сократительной способности миокарда), увеличения доставки к миокарду кислорода (в силу усиления коллатерального кровотока, перераспределения его в пользу ишемизированных слоев миокарда — субэндокарда), антиаритмического и антиагрегационного действия, снижения накопления кальция в ишемизированных кардиомиоцитах.
Показаниями к применению β-блокаторов являются наличие стенокардии, стенокардия при сопутствующей артериальной гипертонии, сопутствующая сердечная недостаточность, «немая» ишемия миокарда, ишемия миокарда при сопутствующих нарушениях ритма. При отсутствии прямых противопоказаний β-блокаторы назначают всем больным ИБС, особенно после инфаркта миокарда. Цель терапии заключается в улучшении отдаленного прогноза больного ИБС.
Среди β-блокаторов широко применяются пропранолол (80–320 мг/сут), атенолол (25–100 мг/сут), метопролол (50–200 мг/сут), карведилол (25–50 мг/сут), бисопролол (5 -20 мг/сут), небиволол (5 мг/сут). Препараты, обладающие кардиоселективностью (атенолол, метопролол, бетаксолол), оказывают преимущественно блокирующее влияние на β1-адренорецепторы.
Одним из наиболее широко применяемых кардиоселективных препаратов является атенолол (тенормин). Начальная доза составляет 50 мг/сут. В дальнейшем она может быть увеличена до 200 мг/сут. Препарат назначают однократно в утренние часы. При выраженном нарушении функции почек суточная доза должна быть уменьшена.
Другим кардиоселективным β-адреноблокатором является метопролол (беталок). Его суточная доза в среднем составляет 100–300 мг, препарат назначают в 2 приема, поскольку β-блокирующий эффект может прослеживаться до 12 ч. В настоящее время получили распространение пролонгированные препараты метопролола — беталок ЗОК, метокард, продолжительность эффекта которых достигает 24 ч.
Бисопролол (конкор) в сравнении с атенололом и метопрололом обладает более выраженной кардиоселективностью (в терапевтических дозах блокирует только β1-адренорецепторы) и большей продолжительностью действия. Его применяют однократно в сутки в дозе 2,5–20 мг.
Карведилол (дилатренд) оказывает сочетанное неселективное β-, α1-блокирующее и антиоксидантное действие. Препарат блокирует как β1-, так и β2-адренорецепторы, не обладая собственной симпатомиметической активностью. За счет блокады α1-адренорецепторов, располагающихся в гладкомышечных клетках стенки сосудов, карведилол вызывает выраженную вазодилатацию. Таким образом, он сочетает в себе β-адреноблокирующую и вазодилатирующую активность, с чем и связано главным образом его антиангинальное и противоишемическое действие, сохраняющееся при длительном применении. Карведилол оказывает также гипотензивное действие и подавляет пролиферацию гладкомышечных клеток, играющую проатерогенную роль. Препарат способен уменьшать вязкость плазмы крови, агрегацию эритроцитов и тромбоцитов. У пациентов с нарушением функции левого желудочка (ЛЖ) или недостаточностью кровообращения карведилол благоприятно влияет на гемодинамические показатели (уменьшает пред- и постнагрузку), повышает фракцию выброса и уменьшает размеры ЛЖ. Таким образом, назначение карведилола показано в первую очередь больным ИБС, перенесшим инфаркт миокарда, с сердечной недостаточностью, поскольку у этой группы больных доказана его способность существенно улучшать прогноз заболевания и увеличивать продолжительность жизни. При сравнении карведилола (средняя суточная доза 20,5 мг) и атенолола (средняя суточная доза 25,9 мг) было показано, что оба препарата, назначаемые 2 раза в день, одинаково эффективны при лечении больных стабильной стенокардией напряжения [5]. Одним из ориентиров адекватности используемой дозы β-адреноблокаторов является снижение ЧСС в покое до 55–60 уд/мин. В отдельных случаях у больных с тяжелой стенокардией ЧСС в покое может быть снижена менее 50 уд/мин.
Небиволол (небилет) — новый селективный β1-адреноблокатор, стимулирующий также синтез оксида азота (NO). Препарат вызывает гемодинамическую разгрузку сердца: снижает АД, пред- и постнагрузку, повышает сердечный выброс, увеличивает периферический кровоток. Небиволол является b-блокатором с уникальными свойствами, которые заключаются в способности препарата участвовать в процессе синтеза клетками эндотелия релаксирующего фактора (NO). Это свойство придает препарату дополнительный вазодилатирующий эффект. Препарат применяется прежде всего у больных артериальной гипертонией с приступами стенокардии.
Целипролол (200–600 мг/сут) — β-блокатор третьего поколения — отличается от других β-блокаторов высокой селективностью, умеренной стимуляцией β2-адренорецепторов, прямым вазодилатирующим действием на сосуды, модуляцией высвобождения оксида азота из эндотелиальных клеток, отсутствием неблагоприятных метаболических эффектов. Препарат рекомендуется больным ИБС с хроническими обструктивными заболеваниями легких, дислипидемиями, сахарным диабетом, заболеваниями периферических сосудов, вызванными курением табака [6]. Целипролол (200–600 мг/сут), атенолол (50–100 мг/сут), пропранолол (80–320 мг/сут) обладают сопоставимой антиангинальной эффективностью и в одинаковой степени увеличивают толерантность к физической нагрузке больных со стабильной стенокардией напряжения.
β-блокаторам следует отдавать предпочтение, назначая больным ИБС при наличии четкой связи между физической нагрузкой и развитием приступа стенокардии, при сопутствующей артериальной гипертонии; наличии нарушений ритма (суправентрикулярной или желудочковой аритмии), при перенесенном инфаркте миокарда, выраженном состоянии тревоги. Большинство неблагоприятных эффектов β-блокаторов связано с блокадой β2-рецепторов. Необходимость контроля за назначением β-блокаторов и встречающиеся побочные эффекты (брадикардия, гипотония, бронхоспазм, усиление признаков сердечной недостаточности, блокады сердца, синдром слабости синусового узла, чувство усталости, бессонница) приводят к тому, что врач не всегда использует эти препараты. Основными врачебными ошибками при назначении β-адреноблокаторов являются применение малых доз препаратов, назначение их реже, чем нужно, и отмена препаратов при возникновении ЧСС в покое менее 60 уд/мин. Следует также иметь в виду возможность развития синдрома отмены, в связи с чем β-блокаторы необходимо отменять постепенно.
Блокаторы кальциевых каналов (антагонисты кальция). Основной точкой приложения препаратов данной группы на уровне клетки являются медленные кальциевые каналы, по которым ионы кальция переходят внутрь гладкомышечных клеток кровеносных сосудов и сердца. В присутствии ионов кальция происходит взаимодействие актина и миозина, обеспечивающих сократимость миокарда и гладких мышечных клеток. Кроме того, кальциевые каналы задействованы в генерации пейсмекерной активности клеток синусового узла и проведении импульса по атриовентрикулярному узлу.
Установлено, что вазодилатирующий эффект, вызванный антагонистами кальция, осуществляется не только посредством прямого действия на гладкую мускулатуру сосудистой стенки, но и опосредованно, через потенцирование высвобождения оксида азота эндотелия сосудов. Этот феномен был описан для большинства дигидропиридинов и исрадипина, в меньшей степени — для нифедипина и негидропиридиновых препаратов. Для длительного лечения стенокардии из производных дигидропиридинов рекомендуется использовать только пролонгированные лекарственные формы или длительно действующие генерации антагонистов кальция. Блокаторы кальциевых каналов — мощные вазодилататоры, они снижают потребность миокарда в кислороде, расширяют коронарные артерии. Препараты могут применяться при вазоспастической стенокардии, сопутствующих обструктивных легочных заболеваниях. Дополнительным показанием к назначению антагонистов кальция являются синдром Рейно, а также (для фенилалкиламинов — верапамила и бензодиазепинов — дилтиазема) мерцательная аритмия, наджелудочковая тахикардия, гипертрофическая кардиомиопатия. Из антагонистов кальция в лечении ИБС применяются: нифедипин немедленного действия 30–60 мг/сут (по 10–20 мг 3 раза) или пролонгированного действия (30–180 мг однократно); верапамил немедленного действия (80–160 мг 3 раза в день); или пролонгированного действия (120–480 мг однократно); дилтиазем немедленного действия (30–60 мг 4 раза в день) или пролонгированного действия (120–300 мг/сут однократно); долгодействующие препараты амлодипин (5–1 0 мг/сут однократно), лацидипин (2–4 мг/сут).
Активация дигидропиридинами (нифедипин, амлодипин) симпатоадреналовой системы в настоящее время рассматривается как нежелательное явление и считается основной причиной некоторого повышения смертности больных ИБС при приеме короткодействующих дигидропиридинов при нестабильной стенокардии, остром инфаркте миокарда и, по-видимому, при длительном их применении больными стабильной стенокардией напряжения. В связи с этим в настоящее время рекомендуется использовать ретардные и пролонгированные формы дигидропиридинов. Принципиальных различий в характере фармакодинамического действия с препаратами короткого действия они не имеют. За счет постепенного всасывания они лишены ряда побочных эффектов, связанных с симпатической активацией, столь характерных для дигидропиридинов короткого действия.
В последние годы появились данные, свидетельствующие о возможности замедления поражения сосудистой стенки с помощью антагонистов кальция, особенно на ранних стадиях развития атеросклероза.
Амлодипин (норваск, амловас, нормодипин) — антагонист кальция третьего поколения из группы дигидропиридинов. Амлодипин расширяет периферические сосуды, уменьшает постнагрузку сердца. Ввиду того, что препарат не вызывает рефлекторной тахикардии (так как не происходит активация симпатоадреналовой системы), потребление энергии и потребность в кислороде миокарда уменьшаются. Препарат расширяет коронарные артерии и усиливает снабжение миокарда кислородом. Антиангинальный эффект (уменьшение частоты и длительности приступов стенокардии, суточной потребности в нитроглицерине), увеличение толерантности к физической нагрузке, улучшение систолической и диастолической функции сердца при отсутствии угнетающего влияния на синусовый и атриовентрикулярный узел и другие элементы проводящей системы сердца выдвигают препарат на одно из первых мест в лечении стенокардии.
Лацидипин — препарат третьего поколения из класса антагонистов кальция — обладает высокой липофильностью, взаимодействием с клеточной мембраной, а также независимостью тканевых эффектов от его концентрации. Указанные факторы являются ведущими в механизме антиатеросклеротического действия. Лацидипин положительно влияет на эндотелий, тормозит образование молекул адгезии, пролиферацию гладкомышечных клеток и агрегацию тромбоцитов. Кроме того, препарат способен тормозить перекисное окисление липопротеидов низкой плотности, т. е. может воздействовать на один из ранних этапов образования бляшки.
В Европейском исследовании влияния лацидипина на атеросклероз (European Lacidipine Study on Atherosclerosis, ELSA) проводилось сравнение толщины «интима-медиа» сонной артерии у 2334 пациентов с артериальной гипертонией на фоне 4-летней терапии лацидипином или атенололом. У включенных в исследование пациентов сонные артерии исходно были нормальными и/или измененными. Лечение лацидипином сопровождалось достоверно более выраженным по сравнению с атенололом уменьшением толщины «интима-медиа» как на уровне бифуркации, так и общей сонной артерии. На фоне лечения лацидипином по сравнению с атенололом увеличение числа атеросклеротических бляшек у пациентов было меньше на 18%, а количество пациентов, у которых количество бляшек уменьшилось, было на 31% больше [7].
Таким образом, антагонисты кальция наряду с выраженными антиангинальными (антиишемическими) свойствами могут оказывать дополнительное антиатерогенное действие (стабилизация плазматической мембраны, препятствующая проникновению свободного холестерина в стенку сосуда), что позволяет назначать их чаще больным стабильной стенокардией с поражением артерий разной локализации. В настоящее время антагонисты кальция считаются препаратами второго ряда у больных стенокардией напряжения вслед за β-блокаторами. В качестве монотерапии они позволяют добиться столь же выраженного антиангинального эффекта, как и β-блокаторы. Безусловным преимуществом β-блокаторов перед антагонистами кальция является их способность снижать смертность больных, перенесших инфаркт миокарда. Исследования применения антагонистов кальция после инфаркта миокарда показали, что наибольший эффект достигается у лиц без выраженной дисфункции левого желудочка, страдающих артериальной гипертонией, перенесших инфаркт миокарда без зубца Q.
Таким образом, несомненным достоинством антагонистов кальция является широкий спектр фармакологических эффектов, направленных на устранение проявлений коронарной недостаточности: антиангинального, гипотензивного, антиаритмического. Благоприятно сказывается терапия этими препаратами и на течении атеросклероза.
Органические нитраты. В основе антиишемического действия нитратов лежит значительное изменение гемодинамических показателей: снижение пред- и постнагрузки левого желудочка, снижение сосудистого сопротивления, в том числе коронарных артерий, снижение АД и др. Основные показания к приему нитратов — стенокардия напряжения и покоя у больных ИБС (также в целях их предупреждения), приступы вазоспастической стенокардии, приступы стенокардии, сопровождающиеся проявлениями левожелудочковой недостаточности.
Нитроглицерин сублингвально (0,3– 0,6 мг) или аэрозоль нитроглицерина (нитроминт 0,4 мг) предназначены для купирования острых приступов стенокардии из-за быстрого начала действия. При плохой переносимости нитроглицерина для купирования приступа стенокардии можно использовать нитросорбид, молсидомин или антагонист кальция нифедипин, разжевывая или рассасывая таблетки при приеме их под язык.
Органические нитраты (препараты изосорбида динитрат или изосорбида-5- мононитрат) применяют для предупреждения приступов стенокардии. Эти препараты обеспечивают долговременную гемодинамическую разгрузку сердца, улучшают кровоснабжение ишемизированных областей и повышают физическую работоспособность. Их стараются назначать перед физическими нагрузками, вызывающими стенокардию. Из препаратов с доказанной эффективностью наиболее изученными являются кардикет (20, 40, 60 и 120 мг/сут), нитросорбид (40–80 мг/сут), оликард ретард (40 мг/сут), моно мак (20–80 мг/сут), моно мак депо (50 и 100 мг/сут), эфокс лонг (50 мг/сут), моно чинкве ретард (50 мг/сут). Больным стабильной стенокардией I-II ФК возможно прерывистое назначение нитратов перед ситуациями, способными вызвать появление приступа стенокардии. Больным с более тяжелым течением стенокардии III-IV ФК нитраты следует назначать регулярно; у таких больных надо стремиться поддерживать эффект на протяжении всего дня. При стенокардии IV ФК (когда приступы стенокардии могут возникать и в ночное время) нитраты следует назначать таким образом, чтобы обеспечить эффект в течение всех суток [8].
К нитратоподобным препаратам относится молсидомин (корватон, сиднофарм, диласидом), препарат, отличный от нитратов по химической структуре, но ничем не отличающийся от них по механизму действия. Препарат уменьшает напряжение стенки сосудов, улучшает коллатеральное кровоообращение в миокарде, обладает антиагрегационными свойствами. Сопоставимыми дозами изосорбида динитрата и корватона являются соответственно 10 мг и 2 мг. Эффект корватона проявляется через 15–20 мин, продолжительность действия от 1 до 6 ч (в среднем 4 ч). Корватон ретард 8 мг принимают 1-2 раза в сутки, так как действие препарата длится более 12 ч.
Слабой стороной нитратов являются развитие толерантности к ним, особенно при длительном приеме, и побочные эффекты, затрудняющие их использование (головная боль, сердцебиение, головокружение), вызванные рефлекторной синусовой тахикардией. Трансдермальные формы нитратов в виде мазей, пластырей и дисков в силу трудности их дозирования и развития к ним толерантности не нашли широкого применения. Также неизвестно, улучшают ли нитраты прогноз больного стабильной стенокардией при длительном использовании, что делает сомнительным целесообразность их назначения в отсутствии стенокардии (ишемии миокарда).
При назначении препаратов с гемодинамическим механизмом действия пожилым больным следует соблюдать следующие правила: начинать лечение с более низких доз, тщательно контролировать нежелательные эффекты и всегда рассматривать возможность замены препарата при его плохой переносимости и недостаточной эффективности.
Комбинированная терапия. Комбинированная терапия антиангинальными препаратами больных со стабильной стенокардией III-IV ФК проводится по следующим показаниям: невозможность подбора эффективной монотерапии; необходимость усиления эффекта проводимой монотерапии (например, в период повышенной физической активности больного); коррекция неблагоприятных гемодинамических сдвигов (например, тахикардии, вызванной нитратами или антагонистами кальция из группы дигидропиридинов); при сочетании стенокардии с артериальной гипертонией или нарушениями ритма сердца, которые не компенсируются в случаях монотерапии; в случае непереносимости больным общепринятых доз препаратов при монотерапии, при этом для достижения необходимого эффекта можно комбинировать малые дозы препаратов.
Синергизм механизмов действия различных классов антиангинальных препаратов является основой для оценки перспективности их комбинаций. При лечении больного стабильной стенокардией врачи часто используют различные комбинации антиангинальных средств (β-блокаторы, нитраты, антагонисты кальция). При отсутствии эффекта от монотерапии часто назначается комбинированная терапия (нитраты и β-блокаторы; β-блокаторы и антагонисты кальция и др.).
Результаты исследования ATP-survey (обзор лечения стабильной стенокардии) показали, что в России 76% пациентов получают комбинированную терапию препаратами гемодинамического действия, при этом в более чем 40% случаев — комбинацию нитратов и b-блокаторов [4]. Вместе с тем, их аддитивные эффекты подтверждены далеко не во всех исследованиях. В методических рекомендациях Европейского общества кардиологов (1997) указывается, что при неэффективности одного антиангинального препарата лучше сначала оценить действие другого, а уже затем использовать комбинацию [9]. Результаты фармакологических контролируемых исследований не подтверждают, что комбинированная терапия b-адреноблокатором и антагонистом кальция сопровождается положительным аддитивным и синергичным действием у большинства больных ИБС. Назначение 2 или 3 препаратов в комбинации не всегда эффективней, чем терапия одним препаратом в оптимально подобранной дозе [10]. Нельзя забывать о том, что применение нескольких препаратов существенно повышает риск нежелательных явлений, связанных с воздействием на гемодинамику.
Современный подход к комбинированной терапии больных стабильной стенокардией подразумевает преимущество сочетания антиангинальных препаратов разнонаправленного действия: гемодинамического и цитопротективного.
К основным недостаткам отечественной фармакотерапии стабильной стенокардии следует отнести зачастую ошибочный, по современным представлениям, выбор группы антиангинальных препаратов (как правило, назначаются нитраты (в 80%)), частое использование клинически незначимых дозировок и необоснованное назначение комбинированной терапии большим количеством антиангинальных препаратов [4].
Метаболические средства. Триметазидин (предуктал) вызывает ингибирование окисления жирных кислот (путем блокирования фермента 3-кетоацил-коэнзим А-тиолазы) и стимулирует окисление пирувата, т. е. осуществляет переключение энергетического метаболизма миокарда на утилизацию глюкозы. Препарат защищает клетки миокарда от неблагоприятных воздействий ишемии, при этом уменьшается внутриклеточный ацидоз, метаболические расстройства и повреждения клеточных мембран. Однократный прием триметазидина не способен купировать или предотвращать возникновение приступа стенокардии. Его эффекты прослеживаются в основном при проведении комбинированной терапии с другими антиангинальными препаратами или при курсовом лечении. Предуктал эффективен и хорошо переносится, особенно в группах высокого риска развития коронарных осложнений, таких, как больные с сахарным диабетом, лица пожилого возраста и с дисфункцией левого желудочка.
Комбинация предуктала с пропранололом оказалась значительно более эффективной, чем комбинация этого β-блокатора с нитратом. Триметазидин (предуктал 60 мг/сут), предуктал МВ (70 мг/сут) обладают антиишемическим эффектом, однако чаще они применяются в сочетании с основными гемодинамическими антиангинальными препаратами.
В России было проведено многоцентровое простое слепое рандомизированное плацебо-контролируемое в параллельных группах исследование ТАСТ (Trimetazidin in patients with Angina in Combination Therapy), охватившее 177 больных, страдающих стенокардией II-III ФК, частично купируемой нитратами и β-блокаторами с целью оценки эффективности предуктала в комбинированной терапии нитратами или β-блокаторами. Оценка эффективности лечения проводилась согласно следующим критериям: время до появления депрессии сегмента ST на 1 мм в ходе нагрузочных проб, время появления стенокардии, прирост продолжительности нагрузочной пробы. Было установлено, что предуктал достоверно повышал указанные показатели. Существует целый ряд клинических ситуаций, в которых триметазидин, по-видимому, может быть препаратом выбора у больных пожилого возраста, при недостаточности кровообращения ишемического генеза, синдроме слабости синусового узла, при непереносимости антиангинальных средств основных классов, а также при ограничениях или противопоказаниях к их назначению [11].
К числу препаратов, обладающих антиангинальными свойствами, относятся амиодарон и другие «метаболические» препараты (ранолазин, L-аргинин), а также ингибиторы АПФ, селективные ингибиторы ЧСС (ивабрадин, проколаран). Их используют в основном как вспомогательную терапию, назначаемую дополнительно к основным антиангинальным средствам [12, 17].
Проблемой медикаментозного лечения больных ИБС является недостаточная приверженность пациентов избранной терапии и недостаточная готовность их последовательно изменять образ жизни. При медикаментозном лечении необходим надлежащий регулярный контакт врача с больным, информирование больного о сущности заболевания и пользе назначаемых препаратов для улучшения прогноза. Пытаясь повлиять на прогноз жизни больных с помощью медикаментозной терапии, врач должен быть уверен, что предписываемые им лекарственные средства действительно принимаются больным, причем в соответствующих дозах и по рекомендуемой схеме лечения.
Хирургическое лечение. При неэффективности медикаментозной терапии применяются хирургические методы лечения (процедуры по реваскуляризации миокарда), к которым относятся: чрескожная транслюминальная коронарная ангиопластика, имплантация коронарных стентов, операция аортокоронарного шунтирования. У больных ИБС важно определить по клиническим и инструментальным показателям индивидуальный риск, который зависит от соответствующей клинической стадии болезни и проводимого лечения. Так, максимальная эффективность коронарного шунтирования отмечена у больных с наибольшим предоперационным риском развития сердечно-сосудистых осложнений (с тяжелой стенокардией и ишемией, обширными поражениями коронарных артерий, нарушением функции ЛЖ). При низком риске развития осложнений ИБС (поражением одной артерии, отсутствием или незначительно выраженной ишемией, нормальной функцией ЛЖ) хирургическая реваскуляризация обычно не показана до тех пор, пока не будет установлена неэффективность медикаментозной терапии или коронарной ангиопластики. Когда решается вопрос об использовании коронарной ангиопластики или коронарного шунтирования для лечения больных с поражением нескольких коронарных артерий, выбор метода зависит от анатомических особенностей коронарного русла, функции ЛЖ, необходимости достижения полной реваскуляризации миокарда и предпочтений больного [13].
Таким образом, при существующих сегодня способах борьбы с сердечно-сосудистыми заболеваниями (табл.) для врача важно быть в курсе последних достижений медицины и сделать правильный выбор метода лечения.
По вопросам литературы обращайтесь в редакцию.
Д. М. Аронов, доктор медицинских наук, профессор В. П. Лупанов, доктор медицинских наук ГНИЦ профилактической медицины Минздрава РФ, Институт клинической кардиологии им. А. Л. Мясникова Российского кардиологического научно-производственного комплекса Минздрава РФ, Москва