Что такое гомоцистеин
Аминокислоты — это молекулы, из которых состоят белки. В мире насчитывается около 500 различных аминокислот, но для построения всех необходимых различным организмам белков используется всего 22. Такие аминокислоты называют протеиногенными. Все остальные аминокислоты образуются как промежуточные продукты тех или иных реакций.
Гомоцистеин — это промежуточный продукт метаболизма протеиногенных аминокислот метионина и цистеина. Он не поступает в организм с пищей, а образуется из метионина в ходе реакций, необходимых для нормального функционирования нашего организма. Образовавшийся гомоцистеин может превратиться либо снова в метионин, либо в другую важную аминокислоту цистеин. Эти реакции происходят благодаря ферментам, для адекватной работы которых необходимы витамины В6, В12, а также фолиевая кислота.
Таким образом метионин, гомоцистеин, цистеин, некоторые ферменты, а также витамины В6, В12 и фолиевая кислота являются участниками одного процесса. Изменение в работе этих компонентов могут привести к повышению гомоцистеина.
Гены фолатного цикла: где миф и где реальность?
Когда уровень гомоцистеина повышается?
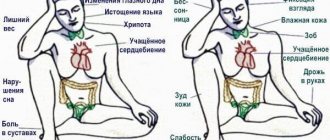
Гипергомоцистеинемия — это повышенное содержание гомоцистеина в крови: выше 15 мкмоль/л.
Почему это происходит?:
- Нарушение работы ферментов. Уровень гомоцистеина повышается, потому что ферменты не могут превращать его в другие аминокислоты. Такие нарушения встречаются редко, но могут привести к серьёзным осложнениям. Например дефект фермента цистатионин-бета-синтазы приводит к изменению хрусталика, проблемам с интеллектом и ранним развитием атеросклероза.
- Недостаток витаминов. Если в организме недостаточно витаминов В6, В9 и В12, то даже ферменты с нормальной активностью не смогут работать правильно. Причиной дефицита витаминов могут быть проблемы с работой кишечника, алкоголизм, заболевания печени и недостаточное поступление витаминов с пищей.
- Нарушение функции почек. Точный механизм неизвестен, но возможно это связано с нарушением выведения гомоцистеина.
Лечение гипергомоцистеинемии
При обнаружении гипергомоцистеинемии проводится специально подобранная терапия высокими дозами фолиевой кислоты и витаминов группы B (В6, B12, B1). Учитывая то, что во многих случаях витаминодефицитное состояние бывает связано с нарушением всасывания витаминов в желудочно-кишечном тракте, лечение, как правило начинают с внутримышечного введения витаминов группы B. После снижения уровня гомоцистеина до нормы (5—15 мкг/мл) назначаются поддерживающие дозы витаминов per os
.
Во время беременности может быть показано проведение антиагрегантной терапии (малые дозы аспирина, выступающего в данном случае в качестве своеобразного витамина беременности, малых доз препаратов гепаринового ряда). При наличии антифосфолипидного синдрома может быть назначено дополнительное лечение.
Гипергомоцистеинемия — патологическое состояние, своевременная диагностика которого в подавляющем большинстве случаев позволяет назначить простое, безопасное и эффективное лечение, в десятки раз снижающее риск осложнений у матери и ребенка.
Теги: беременность, гомоцистеин
Как уровень гомоцистеина связан с генетикой
Разные генетические варианты влияют на работу ферментов. Выделяют несколько основных генов, которые влияют на уровень гомоцистеина: MTHFR, CBS, MTR, MTRR. В данной статье мы разберём ген CBS и MTHFR.
Наследственное заболевание, вызванное мутацией в гене CBS, носит название гомоцистинурия. Ген CBS кодирует фермент цистатионин бета-синтазу, который превращает гомоцистеин в цистатионин. Это один из путей метаболизма гомоцистеина. Наличие дефекта приводит к тому, что реакция не происходит и цепочка последовательных превращений аминокислот нарушается. В результате в крови и в моче повышается уровень гомоцистеина и метионина.
Гомоцистинурия — это редкое заболевание. Хотя в первые годы жизни оно может никак не проявляться, в будущем могут развиться проблемы со зрением, остеопороз, тромбоз и инсульт.
Другой ген, участвующий в метаболизме гомоцистеина, носит название MTHFR. Он влияет на активность фермента, который превращает витамин В9 в активную форму. Активная форма витамина В9 участвует в превращении гомоцистеина в другую аминокислоту — метионин. Таким образом, поддерживается нормальный цикл метаболизма гомоцистеина.
Существуют несколько вариантов гена MTHFR. У людей с вариантами C677T и A1298C активность фермента снижена, что может повлиять на уровень гомоцистеина.
Ряд исследований показывает, что генетический вариант C677T связан с развитием сердечно-сосудистых и неврологических заболеваний. Однако нельзя утверждать, что наличие этого варианта гена становится непосредственной причиной заболеваний. Многие данные расходятся и требуют дальнейшего изучения. Также важно отметить, что на уровень гомоцистеина влияют и другие гены, в том числе ответственные за транспорт витаминов группы B. Поэтому необходимо учитывать все факторы и проводить индивидуальную консультацию с врачом.
Узнать о собственных рисках, связанных с генетикой, можно с помощью Генетического теста Атлас.
Гомоцистеин – предиктор патологических изменений в организме человека
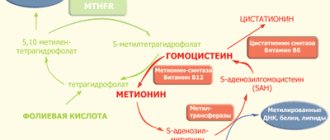
Гомоцистеин (Hcy) – природная серосодержащая аминокислота, не встречающаяся в белках. Hcy – продукт метаболизма метионина (Met) – одной из 8 незаменимых аминокислот организма.
В плазме крови свободный (восстановленный) Hcy присутствует в небольших количествах 1–2% (рис. 1). Примерно 20% находится в окисленном состоянии, преимущественно в виде смешанного дисульфида цистеинил гомоцистеина и гомоцистина. Около 80% Hcy связывается с белками плазмы крови, в основном с альбумином, образуя дисульфидную связь с цистеином–34.
Метаболизм гомоцистеина происходит с участием ряда ферментов, основные из которых: метилентетрагидрофолатредуктаза (МТГФР) и цистатион–β–синтетаза (ЦВС).
Помимо ферментов, важную роль в метаболизме гомоцистеина выполняют витамины В6, В12 и фолиевая кислота.
Met преобразуется в S–аденозилметионин (SAM) при участии фермента метионинаденозилтрансферазы. В результате реакций метилирования, осуществляемых метилтрансферазами, SAM превращается в S–аденозилгомоцистеин (SAH). В дальнейшем SAH подвергается гидролизу посредством SAH–гидролазы с образованием Hcy и аденозина. Этот каскад ферментативных реакций, обозначаемый как трансметилирование, происходит едва ли не в каждой клетке человеческого организма.
SAM–зависимые реакции трансметилирования важны для множества клеточных процессов, таких как метилирование нуклеиновых кислот, протеинов и фосфолипидов.
Существует несколько путей биотрансформации Hcy в организме человека [6]. Он может обратно преобразоваться в Met двумя способами (рис. 2). Во–первых, Met может быть восстановлен из Hcy с помощью метионинсинтазы (MC), использующей в качестве донора метильной группы 5–метил–тетрагидрофолат (5–MeTHF). Этот путь реметилирования распространен повсеместно, в основном в клетках печени, а у некоторых видов в почках. Во–вторых, глицин–бетаин (NNN–триметилглицин) может также повторно метилироваться до Met с участием бетаингомоцистеинметилтрансферазы (БГМТ). Hcy может также превращаться в цистеин. Под действием цистатионин–β–синтазы Hcy и серин образуют цистатионин, который может разрушаться цистатионин–γ–лиазой до цистеина и α–кетобутирата, метаболизируемого далее ферментами до сукцинил–КоА. Эта серия реакций, превращающая Hcy в цистеин, происходит в печени, почках, тонком кишечнике и поджелудочной железе. Hcy также может выводиться из клеток в кровь, но транспортеры этого процесса пока не идентифицированы.
Эти два пути превращения Hcy (реметилирование до Met, требующее наличия фолата и В12, и превращение в цистатионин, требующее пиродоксаль фосфата) координируются S–аденозилметионином, действующим как аллостерический ингибитор метилентетрагидрофолатредуктазы и как активатор цистатионин–b–синтазы.
В многочисленных популяционных исследованиях нижний уровень содержания гомоцистеина обычно определяется достаточно однозначно (5 μмоль/л), а вот верхний предел обычно варьирует между 10 и 20 mмоль/л – в зависимости от возраста, пола, этнической группы и особенностей потребления фолатов.
Различные наследственные и приобретенные нарушения в организме приводят к тому, что Hcy не утилизируется. В этом случае он накапливается в организме и становится для него опасным, вызывая ряд патологических эффектов. Различают несколько форм гипергомоцистеинемии (ГГЦ) [2].
Тяжелая форма ГГЦ (>100
m
моль/л)
Причиной могут быть:
– наследственная гомоцистеинурия, например, вследствие гомозиготности по дефектным генам энзимов биосинтеза метионина – цистатионин–b–синтазе или 5,10–метилентетрагидрофолатредуктазе;
– наследственные нарушения утилизации витамина В12;
– серьезный дефицит витамина В12.
Умеренная форма ГГЦ (30–100
mмоль/л)
Причины:
– тяжелое нарушение функции почек (снижение клиренса гомоцистеина почками);
– умеренный дефицит В12;
– серьезный дефицит фолатов.
Легкая форма ГГЦ (10–30 μмоль/л)
Причинами могут служить:
– ‑гетерозиготность по дефектному гену цистатионин–b–синтазы;
– ‑гомозиготность по замене основания С677Т в гене 5,10–метилентетрагидрофолатредуктазы;
– почечная недостаточность;
– трансплантация почек;
– небольшой дефицит фолата и витамина В12;
– недостаток тироидных гормонов;
– алкоголизм;
– медикаменты.
Метаболизм Hcy сильно зависит от кофакторов – производных витаминов. Поэтому дефицит любого из витаминов (В12, фолиевой кислоты и В6) может привести к ГГЦ.
Генетические мутации также могут вызвать гипергомоцистеинемию, в частности, дефекты энзимов – цистатионин β–синтазы и цистатионин γ–лиазы или метилентетрагидрофолатредуктазы.
При исследовании полиморфизма по гену метилентетрагидрофолат редуктазы (MTHER), связанного с заменой 677С→T, установлено, что у 10–16% популяции наблюдается гомозиготность по варианту ТТ, а носители этого варианта характеризуются повышенным содержанием Hcy. Если же лица, генетически предрасположенные к повышенному уровню Hcy, курят и употребляют много кофе, то они становятся особенно чувствительны к увеличению концентрации Hcy. Генотип c заменой 677С→T в гене MTHER предрасположен к повышенному риску дефектов нервной трубки и сердечно–сосудистых заболеваний [7,8].
Исследованиями в течение последних 15 лет установлено, что гомоцистеин является ранжированным независимым фактором риска сердечно–сосудистых заболеваний (ССЗ) — инфаркта миокарда, инсульта и венозной тромбоэмболии, атеросклероза [9,10]. Полагают, что гипергомоцистеинемия – более информативный показатель развития болезней сердечно–сосудистой системы, чем холестерин [11].
Hcy повреждает стенки сосудов, делая их поверхность рыхлой. На поврежденную поверхность осаждаются холестерин и кальций, образуя атеросклеротическую бляшку. Повышенный уровень Hcy усиливает тромбообразование. Повышение уровня гомоцистеина крови на 5 мкмоль/л приводит к увеличению риска атеросклеротического поражения сосудов на 80% у женщин и на 60% у мужчин.
Тормозя работу противосвертывающей системы, гомоцистеинемия является одним из звеньев патогенеза ранней тромбоваскулярной болезни, при ее наличии увеличивается риск развития тромбозов и глубоких вен. Особому риску подвергаются больные сахарным диабетом.
Показано, что при увеличении уровня Hcy в плазме на 2,5 μмоль/л риск инфаркта миокарда возрастает на 10%, а риск инсульта – на 20% [12]. Повышенный уровень гомоцистеина является серьезным предиктором смертности людей с предшествующими ССЗ или выявленными другими факторами риска [13].
Механизмами влияния гомоцистеинемии на сосуды могут быть повреждения под действием окислительного стресса, нарушения выделения окиси азота, изменения гомеостаза и активации воспалительных путей.
Возможен и вариант, что высокие уровни Hcy являются только маркером ССЗ, то есть связь между ними опосредована другими факторами (нарушением функции почек, дефицитом фолатов и витаминов В12 и В6), которые влияют как на уровень Hcy, так и на развитие сосудистых заболеваний.
Гипергомоцистеинемия часто встречается среди пациентов с хронической почечной недостаточностью (когда функции почек снижены, но не настолько, чтобы требовалась замещающая терапия) и наблюдается почти всегда на конечной стадии почечных заболеваний [14]. Этот факт особенно важен для части пациентов, у которых имеется сердечно–сосудистая недостаточность: риск летального исхода у них повышается в 30 раз по сравнению с основной группой пациентов.
При почечной недостаточности уровни Hcy возрастают, большинство пациентов на диализе (>85%) демонстрируют умеренную степень гипергомоцистеинемии. Клиренс креатинина, определяющий наличие почечной недостаточности, обратно коррелирует с уровнем плазменного Hcy. Исследования, проведенные на здоровых людях и больных диабетом, подтвердили обратную взаимосвязь между уровнем Hcy и функцией почек, а также роль креатинина как маркера почечной недостаточности [15].
Микротромбообразование приводит к нарушению маточного и фетоплацентарного кровообращения, что может быть причиной бесплодия и невынашивания беременности, в связи с чем определение уровня Hcy актуально в акушерской практике для прогнозирования возможных осложнений во время беременности и родов. Изменение уровня Hcy может быть связано с недостатком фолатов, оказывающим множественные эффекты на внутриутробное развитие плода [16]. На более поздних сроках беременности гипергомоцистеинемия является причиной развития хронической фетоплацентарной недостаточности, хронической внутриутробной гипоксии плода, и как следствие – внутриутробной гипотрофии плода. Повышение уровня гомоцистеина – одна из причин рождения детей с пороками развития (дефекты нервной трубки). Ввиду этих обстоятельств рекомендуется проверять уровень гомоцистеина у женщин–рожениц с бывшими ранее акушерскими осложнениями или имеющих родственников, у которых были инсульты, инфаркты и тромбозы в достаточно раннем возрасте.
Имеется целый ряд посылок, указывающих на связь между увеличением содержания гомоцистеина и нарушениями когнитивной функции и психическими расстройствами. Повышение уровня Hcy в крови до 14,5 μмоль/л приводит к двукратному увеличению риска возникновения болезни Альцгеймера в возрасте свыше 60 лет [17]. Показано, что увеличение концентрации Hcy в крови прямо коррелирует с когнитивными расстройствами у лиц пожилого возраста [18].
Среди факторов, влияющих на содержание гомоцистеина в крови, следует выделить описанную выше генетическую предрасположенность к повышению уровня Hcy, курение, диету (употребление большого количества белковых продуктов, кофе, витаминов группы В, фолатов).
Популяционные исследования позволили проанализировать связь пищевых факторов (витаминов группы В, белков и метионина), курения, потребления кофе, биохимических детерминант (содержания в плазме креатинина, В6, В12, фолатов) и других факторов (индекс массы тела, артериальное давление и антигипертензивные препараты) с уровнем гомоцистеина. Кроме кровяного давления, все остальные факторы были связаны с содержанием Hcy. Например, у курящих содержание Hcy было на 1,5 μмоль/л выше, чем у некурящих. Содержание фолатов было наиболее выраженной детерминантой уровня Hcy. Различия в уровне Hcy при самой высокой и самой низкой концентрации фолатов составили 4 μмоль/л, а при действии других факторов находились в интервале 0,5–2,0 μмоль/л. Детерминанты содержания Нcy сильно варьировали в зависимости от пола и возраста, а также от особенностей национальной диеты в разных странах, связанных с содержанием витаминов группы В [19].
Самой частой причиной ГГЦ является дефицит фолиевой кислоты, а также нехватка витамина В
12, которая даже при достаточном поступлении фолиевой кислоты может вести к накоплению гомоцистеина.
Некоторые препараты (например, пеницилламин, циклоспорин, метотрексат, карбамазепин, фенитоин, 6–азауридин, закись азота), могут повышать уровень гомоцистеина. Механизм действия этих факторов обусловлен либо прямым, либо непрямым антагонизмом с ферментами или кофакторами, участвующими в метаболизме Hcy.
Причинами увеличения содержания Hcy в крови может являться и ряд заболеваний (хроническая почечная недостаточность, гипофункция щитовидной железы, В12–дефицитная анемия, онкологические заболевания).
Неоднозначным является влияние физической нагрузки на уровень Hcy. Так, показано [20], что после марафона в организме у бегунов (за исключением профессиональных спортсменов) отмечается резкое повышение содержания Hcy. В других работах повышение концентрации Hcy, наблюдаемое у спортсменов, связывают с диетой [21]. Дозированный прием витаминов В6, В12 и фолиевой кислоты позволяет предупредить возможные осложнения.
Хотя еще точно не доказано, что терапия, снижающая уровни гомоцистеина, уменьшает риск CCЗ, но она является недорогой и продолжает применяться. Целью терапии должно быть снижение уровня гомоцистеина у пациентов с высоким риском сердечных заболеваний до 10 μмоль/л
.
У пациентов с низкой и умеренной формой гипергомоцистенемии можно добиться снижения уровня Hcy до нормального, назначая либо фолиевую кислоту от 0,4 до 5 мг/сут., либо витамин B12 в дозе от 0,5 до 1 мг/сут., либо используя оба препарата. Лечение менее эффективно у пациентов с почечными заболеваниями.
Общепризнанным является применение с целью лечения гомоцистеинемии фолиевой кислоты, фолиевой кислоты в комбинации с витаминами B6 и B12 и комбинации витаминов B6 и B12, применение препаратов типа кардоната (комбинированный препарат, содержащий коэнзимы В1, В6, В12, а также карнитин и лизин). Фолиевая кислота, первоначально обнаруженная в шпинате, присутствует в большинстве растительных продуктов, имеющих листья (потому и называется так, от латинского слова folium – лист), в зеленых овощах, рыбе и печени.
Но есть данные, которые свидетельствуют о том, что терапевтическое вмешательство при повышении уровня Hсy не должно ограничиваться восполнением недостатка витаминов и фолатов и борьбой с общеизвестными факторами риска, такими как курение и избыточное потребление кофе.
Так, показано, что терапия высокими дозами фолиевой кислоты, витаминами В6 и В12 не приводит к снижению смертности и частоты сердечно–сосудистых событий у больных с тяжелой почечной недостаточностью, а потому не может быть рекомендована с этой целью. Более того, при введении экзогенной фолиевой кислоты происходит кратковременное повышение уровня Hcy. Среди возможных причин низкой эффективности витаминотерапии авторы отмечают исключительную клиническую тяжесть и плохой краткосрочный прогноз включенных пациентов, достижение нормальных уровней Hcy только у трети участников, побочные эффекты терапии витаминами, нивелирующие ее полезное действие. Одной из причин неудачи снижения Hcy авторы считают то, что его уровень является маркером, а не причиной ССЗ [22].
Перспективным направлением в лечении гомоцистеинемии может быть применение ингибиторов гидроксиметилглутарил–КоА–редуктазы (статинов). Есть данные, позволяющие предполагать, что снижение уровня гомоцистеина является одним из эффектов применения статинов у пациентов с ССЗ [23].
В заключение следует заметить, что повышение уровня Hcy в крови связано как вообще с увеличением смертности в популяции, так и с заболеваниями сердечно–сосудистой системы, в частности [24]. По некоторым оценкам, если бы удалось снизить уровень Hcy на 40%, то это привело бы к сохранению 8 лет жизни на 1000 мужчин и 4 лет жизни на 1000 женщин. Это обстоятельство стимулирует внедрение мониторинга концентрации Hcy в широкую клиническую практику.
Литература 1. Friedman A.N., Bostom A.G., Selhub J. et al. The kidney and homocysteine metabolism. J.Am Soc. Nephrol.,2001, v. 12, p. 2181–2189. 2. Lentz S.R., Haynes W.G. Homocysteine: Is it a clinically important cardiovascular risk factor? Clev. Clin. J. Med., 2004, v. 71, p. 729–734. 3. Daly S., Cotter A., Molloy A.E., Scott J. Homocysteine and folic acid: implications for pregnancy. Semin. Vasc. Med., 2005,v. 5, p. 190–200. 4. Ciaccio M., Bivona G., Bellia C. Therapeutical approach to plasma homocysteine and cardiovascular risk reduction Therap. and Clin. Risk Manag., 2008, v. 4, p. 219–224. 5. Vollset S.E., Refsum H., Ueland P.M. Population determinants of homocysteine. Am J.Clin Nutr., 2001,v. 73, p. 499–500. 6. Szegedi S.S., Castro C.C., Koutmos M., Garrow T.A. Betaine–homocysteine s–methyltransferase–2 is an s–methylmethionine–homocysteine methyltransferase. J. Biol. Chem., 2008, v. 283, p. 8939–8945. 7. Kraus J.P. Biochemistry and molecular genetics of cystathionine beta–synthase deficiency. Eur. J. Pediatr.,1998, v. 157, p. 50–53. 8. Trabetti E. Homocysteine, MTHFR gene polymorphisms, and cardio–cerebrovascular risk. J. Appl. Genet., 2008, v. 49, p. 267–282. 9. Naess I.A., Christiansen S.C., Romundstad P.R. et al. Prospective study of homocysteine and MTHFR 677TT genotype and risk for venous thrombosis in a general population—results from the HUNT 2 study. Br. J. Haematol., 2008, v. 141, p. 529–535. 10. Moat S.J. Plasma total homocysteine: instigator or indicator of cardiovascular disease? Ann. Clin. Biochem., 2008, v. 45, p. 345–348. 11. Potter K. Homocysteine and cardiovascular disease: should we treat? Clin. Biochem. Rev., 2008, v. 29, p. 27–30. 12. Virtanen J.K., Voutilainen S., Alfthan G. Homocysteine as a risk factor for CVD mortality in men with other CVD risk factors: the Kuopio Ischaemic Heart Disease Risk Factors (KIHD) Study. J. Intl. Med., 2005, v. 257, p. 255–262. 13. Homocysteine Studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta–analysis. JAMA, 2002, v. 288, p. 2015–2022. 14. Bostom A.G., Culleton B.F. Hyperhomocysteinemia in chronic renal disease. J. Am.Soc. Nephrol., 1999, v. 10, p. 891–900. 15. Bostom A.G., Kronenberg F., Schwenger V. et al. Proteinuria and total plasma homocysteine levels in chronic renal disease patients with a normal range serum creatinine: Critical impact of true GFR. J. Am. Soc. Nephrol., 2000, v. 11, p. 305–310. 16. Beaudin A.E., Stover P.J.. Folate–mediated one–carbon metabolism and neural tube defects: balancing genome synthesis and gene expression. Birth. Defects Res. C. Embryo Today., 2007, v. 81, p. 183–203. 17. Kidd P.M. Alzheimer’s disease, amnestic mild cognitive impairment, and age–associated memory impairment: current understanding and progress toward integrative prevention. Altern. Med. Rev., 2008, v. 13, p. 85–115. 18. Schafer J.H., Glass T.A., Bolla K.I. et al. Homocysteine and Cognitive Function in a Population–based Study of Older Adults. J. Am. Geriatr. Soc., 2005, v. 53, p. 381–388. 19. Tolmunen T., Hintikka J., Voutilainen S. et al. Association between depressive symptoms and serum concentrations of homocysteine in men: a population study. Am. J. Clin. Nutr., 2004, v. 80, p. 1574–1578. 20. Real J.T., Merchante A., Gomez J.L. et al. Effects of maraphon running on plasma total homocysteine concentration. Nutr. Metab. Cardiovasc. Dis., 2005, v. 15, p. 134–13 21. Ko??nig D., Bisse E., Deibert P. et al . Influence of training volume and acute physical exercise on the homocysteine levels in endurance–trained men: interactions with plasma folate and vitamin B12. Ann. Nutr. Metab., 2003, v. 47, p. 114–118. 22. Jamison R.L., Hartigan P., Kaufman J.S. et al. Effect of Homocysteine Lowering on Mortality and Vascular Disease in Advanced Chronic Kidney Disease and End–stage Renal Disease. A Randomized Controlled Trial. JAMA., 2007, v. 298, p. 1163–1170. 23. Dierkes J., Luley C., Westphal S. Effect of lipid–lowering and anti–hypertensive drugs on plasma homocysteine levels. Vasc. Health Risk Manag., 2007, v. 3, p. 99–108. 24. Malinow M.R. Plasma concentrations of total homocysteine predict mortality risk. Am. J. Clin. Nutr., 2001, v. 74, p. 3.
Как кофе, курение и алкоголь влияют на уровень гомоцистеина
Считается, что частое употребление кофе повышает уровень гомоцистеина. Однако исследования не дают однозначного результата. Учёные из Сан-Паулу выявили, что у людей, потребляющих 1-3 чашки фильтрованного кофе в день, уровень гомоцистеина ниже, чем у тех, кто выпивает менее одной чашки. Они предполагают, что кофейная кислота может уменьшать количество молекул, повреждающих внутренний слой стенки сосудов.
В другом исследовании показано, что у людей, употребляющих в среднем 4 чашки кофе в день, после трехнедельного отказа от кофе уровень гомоцистеина снизился.
Таким образом, на сегодняшний день нет однозначного мнения на счёт того, как кофе влияет на уровень гомоцистеина.
Узнать, как ваш организм метаболизирует кофе, можно с помощью Генетического теста Атлас.
Другим фактором, связанным с уровнем гомоцистеина, является курение. Группа ученых из Туниса показала, что в крови у курильщиков уровень гомоцистеина повышен, а количество витамина B12 и фолиевой кислоты снижено. При этом у курильщиков со стажем более 20 лет уровень витаминов ниже, чем у тех, кто курил менее 5 лет.
Помимо этого регулярное употребление алкоголя также увеличивает уровень гомоцистеина. В ходе исследования было выявлено, что после двухнедельного употребления красного вина в крови снижался уровень витамина В12 и фолиевой кислоты, а уровень гомоцистеина повышался.
Анализ крови на гомоцистеин
Примерно 80-90% гомоцистеина в крови связано с белком. Около 70% гомоцистеина в почках преобразуется в метионин. Менее 1% гомоцистеина присутствует в свободной форме в крови. []
Измерения общего гомоцистеина в крови является технологически сложным потому, что кровяные клетки выпускают гомоцистеин даже после того, как кровь была взята и находится в пробирке. [, ] По этой причине, очень важно для лаборатории извлечь клетки крови из взятого образца с помощью центрифугирования не позднее 30 минут после забора крови. После этого клетки крови стабилизируются на 4 дня при комнатной температуре.
Из-за изменчивости лабораторных методов для отслеживания уровня гомоцистеина в течение времени важным является использование той же лаборатории для обеспечения соответствия анализов.
Питание с большим количеством белка может значительно повысить уровень гомоцистеина. Таким образом, при сдаче анализа на гомоцистеин важно не принимать пищу в течение 8-14 часов до анализа (воду пить можно). []
Как гомоцистеин провоцирует сердечно-сосудистые заболевания
Высокий уровень гомоцистеина связан с риском развития атеросклероза.
Атеросклероз — это процесс отложения на стенках сосуда холестериновых бляшек, который сопровождается воспалением. Атеросклероз является фактором риска возникновения сердечно-сосудистых заболеваний.
В развитии атеросклероза ключевую роль играет повреждение внутреннего слоя стенки сосуда. Гомоцистеин увеличивает синтез чрезвычайно активных молекул, которые могут повреждать стенку сосуда. Эти молекулы называются активными формами кислорода.
Помимо этого гомоцистеин способен активировать свёртывающую систему крови. Эта система отвечает за образование тромбов при кровотечении. Но в отсутствии повреждения её активность должна подавляться. Повышенный уровень тромбообразования является фактором риска развития инсульта и инфаркта.
Важно отметить, что уровень гомоцистеина не является главной причиной развития этих заболеваний. Он вносит свой вклад вместе с другими факторами риска. Исследования, оценивающие связь гомоцистеина и сердечно-сосудистых заболеваний, ещё продолжаются.
Гомоцистеин и деменция
Деменция — это состояние, при котором происходит нарушение способности мыслить. Деменция проявляется в снижении памяти, внимания, способности выполнять ежедневные действия. Существует много форм деменции, но самой распространённой является болезнь Альцгеймера. Это заболевание, при котором происходит накопление в нейронах аномально сложенных белков, что приводит к нарушению интеллекта. Основная причина развития этого заболевания на сегодняшний день неизвестна. Исследования по всему миру направлены на поиск различных факторов, которые могут играть роль в развитии болезни Альцгеймера. Одна из возможных причин — нарушение работы фолатного цикла. Считается, что высокий уровень гомоцистеина может приводить к повреждению нейронов и вызывать их гибель.
Почему возникает болезнь Альцгеймера и как сон может уберечь от деменции?
Гомоцистеин и беременность
На сегодняшний день изучение того, как уровень гомоцистеина влияет на течение беременности, ещё продолжается. Ранние данные свидетельствовали, что мутация в гене MTHFR, связанная с повышенным уровнем гомоцистеина, может привести к осложнениям во время беременности. Такие осложнения, как преэклампсия, раннее прерывание беременности, нарушение внутриутробного развития связывали с уровнем гомоцистеина.
Однако более современные источники утверждают, что достоверной связи между вариантом гена MTHFR и осложнениями беременности нет.
Как контролировать уровень гомоцистеина
- Ввести в рацион продукты, содержащие витамины В6, В12, фолиевую кислоту;
- Всем женщинам репродуктивного возраста употреблять суточную дозировку фолиевой кислоты 400 мкг в сутки;
- Уменьшить потребление продуктов, содержащих аминокислоту метионин:
- Рыба,
- Мясо,
- Сыр,
- Яйца,
- Орехи.
Любая диета назначается индивидуально, поэтому для изменения своего рациона стоит обратиться к специалисту.
Источники:
- Kim, J., Kim, H., Roh, H., Kwon, Y., Causes of hyperhomocysteinemia and its pathological significance, 2021.
- S. Brustolin, R. Giugliani, and T. M. Félix, Genetics of homocysteine metabolism and associated disorders, 2010.
- Andrey N. Gaiday, Akylbek B. Tussupkaliyev, Saule K. Bermagambetova, Sagira S. Zhumagulova, Leyla K. Sarsembayeva, Moldir B. Dossimbetova, Zhanibek Zh Daribay, Effect of homocysteine on pregnancy: A systematic review, 2021.
- Elena Voskoboevaa, Alla Semyachkinab,, Maria Yablonskayab, Ekaterina Nikolaevab, Homocystinuria due to cystathionine beta-synthase(CBS) deficiency in Russia: Molecular and clinical characterization, 2021.
- Natassia Robinsona, Peter Grabowskib, Ishtiaq Rehman, Alzheimer’s disease pathogenesis: Is there a role for folate?, 2017.
- Nadia Bouzidi, Majed Hassine, Hajer fodha, Mejdi Ben Messaoud, Faouzi Maatouk4, Habib Gamra, Salima ferchichi, Association of the methylene-tetrahydrofolate reductase gene rs1801133 C677T variant with serum homocysteine levels, and the severity of coronary artery disease, 2021.
- NHS, Homocystinuria
Используемая литература
- Bonaa K.H. et al. // N Engl J Med 2006;354(15):1578-88.
- Durga J. et al. // Lancet 2007; 369: 208-16.
- Faria-Neto J.R. et al. // Braz J Med Biol Res 2006;39 (4):455-63.
- Herrmann W. // Clin Lab 2006; 52: 367-374.
- Kazemi M.B. et al. // Angiology 2006;57(1):9-14.
- Kothekar M.A. // Indian J Med Sci 2007;61(6):361-71.
- Lonn E. et al. // N Engl J Med 2006;354(15):1567-77.
- Refsum H., Smith AD. // N Engl J Med 2006;355:207.
- Spence J.D. et al. // STROKE 2005;36(11):2404-09.
- Toole J.F. et al. // JAMA 2004;291:565-75.
- Wald D.S. et al. // BMJ 2006;333:1114-17.
- Yang Q. et al. // Circulation 2006; 113: 1335-1343.
Автор:
Бактышев Алексей Ильич, Врач общей практики (семейный врач), врач ультразвуковой диагностики, главный врач