Функциональная классификация легочной гипертензии
| Класс I | отсутствует ограничение физической активности. Обычная физическая активность не вызывает появление одышки, слабости, боли в грудной клетке, головокружения |
| Класс II | некоторое снижение физической активности. Обычная физическая активность сопровождается появлением одышки, слабости, боли в грудной клетке, головокружения |
| Класс III | выраженное ограничение физической активности. Небольшая физическая активность вызывает появление одышки, слабости, боли в грудной клетке, головокружения |
| Класс IV | неспособность выполнять любую физическую нагрузку без вышеперечисленных клинических симптомов. Одышка или слабость могут присутствовать даже в покое, дискомфорт возрастает при минимальной нагрузке |
Опрос и осмотр пациента
Следует выяснить были ли у пациента эпизоды тромбозов глубоких вен, внезапных отеков ног, тромбофлебиты. У многих больных прослеживается семейный анамнез внезапной смерти, сердечно-сосудистой патологии и повышенной наклонности к тромбообразованию.
Объективным доказательством перенесенной тромбоэмболии легочной артерии (ТЭЛА) становится совпадение по времени клиники тромбоза вен нижних конечностей и появления одышки. В ближайшие месяцы после ТЭЛА у больных можно выявить период, когда состояние остается стабильным и малосимптомным. Это связано с тем, что правый желудочек справляется с нагрузкой и позволяет сохранить хорошую переносимость физических нагрузок до момента развития прогрессирующего ремоделирования легочных сосудов. Практически единственным надежным доказательством перенесенной ТЭЛА могут стать данные перфузионной сцинтиграфии или компьютерной томографии легких, проведенной во время острого эпизода ТЭЛА.
При общем осмотре пациентов с ХТЭЛГ может определяться синюшность (цианоз). При развитии правожелудочковой сердечной недостаточности отмечаются набухшие шейные вены, увеличение печени, периферические отеки, водянка живота.
Неинвазивная диагностика
Электрокардиография(ЭКГ) выявляет признаки гипертрофии и перегрузки правого желудочка, дилатации и гипертрофии правого предсердия (p-pulmonale), отклонение электрической оси сердца вправо.
Рентгенография органов грудной клетки позволяет уточнить этиологию ЛГ: выявить интерстициальные заболевания легких, приобретенные и врожденные пороки сердца, а также судить о тяжести ЛГ. Основными рентгенологическими признаками ЛГ являются выбухание ствола и левой ветви легочной артерии, которые формируют в прямой проекции II дугу по левому контуру сердца, расширение корней легких, увеличение правых отделов сердца. У больных постэмболической легочной гипертензией можно выявить признаки, указывающие на наличие тромбов в крупных ветвях легочной артерии (ЛА)- расширение ствола и главных ветвей ЛА, симптом деформации и укорочения корня. Специфическим признаком является обеднение легочного рисунка в зоне нарушенного кровоснабжения.
Эхокардиография (ЭхоКГ) — УЗИ сердца считается наиболее ценным неинвазивным методом диагностики ЛГ, так как не только позволяет оценить уровень давления в легочной артерии, но и дает важную информацию о причине и осложнениях ЛГ. С помощью этого метода можно исключить поражения митрального, аортального клапанов, болезни миокарда, врожденные пороки сердца с шунтированием крови, приводящие к развитию ЛГ. К сожалению, метод не позволяет дифференцировать постэмболической легочной гипертензии от других форм прекапиллярной ЛГ. Исключение составляют редкие случаи наличия массивных тромбов в стволе и основных ветвях ЛА в непосредственной близости от бифуркации.
Клиническое наблюдение
С целью акцентирования внимания на этой проблеме педиатров, детских кардиологов и пульмонологов приводим интересный клинический случай течения ЛАГ на фоне сочетания БЛД и врожденного порока сердца у ребенка с ЭНМТ при рождении.
Ребенок А. женского пола, от 1-й беременности, протекавшей с угрозой прерывания в первой и второй половине, рожден от 1-х преждевременных родов на 26-й нед. гестации, путем операции «кесарево сечение», с массой 870 г и длиной 34 см, с оценкой по шкале Апгар 4/6 баллов.
С первых часов жизни у девочки отмечалось тяжелое состояние с проявлением синдрома дыхательных расстройств. Проводились реанимационные мероприятия с применением ИВЛ, кислородотерапии, заместительная терапия сурфактантом, режим кувеза. На 2-е сут жизни выявлен гемодинамически значимый открытый артериальный проток (ОАП), применен ибупрофен внутривенно 3 дозы по обычной схеме, без положительного эффекта. В динамике проявления сердечной недостаточности нарастали. В связи с этим ребенок получал сердечные гликозиды, дофаминомиметики, β-адреномиметики (допамин, дигоксин, добутамин). На этой терапии состояние несколько стабилизировалось, хотя оставалось тяжелым. Отмечалась стойкая дыхательная недостаточность III степени, с 3-х сут отмечены анемия (Hb 102 г/л), гематурия, аускультативно в легких выслушивались мелкопузырчатые хрипы и крепитация с обеих сторон. На 8-е сут жизни выявлены рентгенологические изменения в виде двустороннего снижения пневматизации за счет нежных инфильтративных затенений в обоих легких с усилением бронхососудистого рисунка за счет интерстициального компонента (рис. 1), лейкоцитоз (21,0×109/л), имелась отрицательная динамика в анализах крови на 1-й нед. жизни (нарастание лейкоцитоза, СОЭ, снижение гемоглобина).
Был выставлен диагноз: Неонатальная пневмония, двусторонняя, очаговая, тяжелой степени тяжести, стадия инфильтрации. ДН III степени. Микробиологический посев из зева и эндотрахеального аспирата выявил Klebsiella pneumoniae
. Кроме того, у ребенка с отягощенным акушерским анамнезом, артериитом и флебитом пупочных сосудов, анемией, пневмонией регистрировались признаки SIRS (тромбоцитопения, нарушение терморегуляции, воспалительные изменения в крови), которые предполагали ведение его как угрожаемого по неонатальному сепсису. В связи с множеством заболеваний девочка получала комплексную терапию (в т. ч. антибактериальную) и продолжала длительно находиться на ИВЛ (FiO2 0,45; f 40 в 1 мин; piр. 19 мм в. ст.; SaO2 90–92%). Периодически предпринимались попытки снизить параметры ИВЛ, однако из-за стойкой гиперкапнии (pCO2 55 мм рт. ст.) и гипоксии (рО2 24 мм рт. ст.), ацидоза, по данным кислотно-щелочного состава крови (лактат 1,1 ммоль/л; сНСО3 38,2 ммоль/л; ВЕ 12,3 ммоль/л), низких показателей сатурации кислорода экстубировать ребенка не удавалось.
С 28-го дня жизни в соответствии с комплексом критериев [14] был выставлен диагноз: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени. Основным моментом для постановки диагноза стала потребность в кислороде концентрацией более 21% на 28-е сут жизни, кислородозависимость в 36 нед. постконцептуального возраста свидетельствовала о тяжелом течении БЛД. На компьютерной томограмме были выявлены основные признаки БЛД — фиброзные тяжи, «матовое стекло», буллезные вздутия (рис. 2). По поводу заболевания ребенок получал терапию ингаляционным глюкокортикостероидом (ИГКС) будесонидом в дозе 1,0 мг/сут, муко- и бронхолитическую терапию через небулайзер (амброксол, фенотерол, ипратропия бромид).
В возрасте 2,5 мес. жизни подтвержден диагноз: Врожденный порок сердца (ВПС): ОАП. На ЭХО-КГ: ОАП 3,5 мм со сбросом крови в легочную артерию с градиентом 4 мм рт. ст., аневризма межпредсердной перегородки (АМПП) и открытое овальное окно 3,5 мм со сбросом крови справа налево, высокая ЛАГ 89 мм рт. ст. с расширением правого предсердия (ПП) (рис. 3).
На ЭКГ выявлялись признаки перегрузки ПП. Рентгенографически: признаки расширения правых отделов сердца. В гемограмме: анемия Hb 90 г/л, Эр 3,88 × 1012/л, ЦП 0,9, лейкоцитарная формула без признаков воспаления. Глюкоза крови составляла 5,0 ммоль/л, креатинин 51,5 ммоль/л, АЛТ 0,5 мкмоль/л, АСТ 0,94 мкмоль/л. В возрасте 3,5 мес. в Федеральном центре сердечно-сосудистой хирургии (Астрахань) проведена операция по поводу ОАП (лигирование). Ранний послеоперационный период прошел без осложнений.
По поводу выявленной патологии ВПС + ЛАГ ребенок получал комплексную терапию, включающую кислородотерапию, диуретики (спиронолактон под контролем креатинина и калия), силденафил (в дозе 3,5 мг × 4 р./сут), дигоксин в поддерживающей дозе (10 мг/кг/сут), добутамин (1,5 мкг/кг/мин). Состояние ребенка стабилизировалось, одышка уменьшилась, улучшился аппетит, и девочка начала прибавлять в массе тела от 350 г и более за неделю.
Выставлен диагноз: Глубокая недоношенность (26 нед. гестации). БЛД недоношенных, новая форма, тяжелой степени тяжести, дыхательная недостаточность II степени. ВПС: ОАП, сердечная недостаточность IIА стадии, ФК II, малая аномалия развития сердца: открытое овальное окно. Последствия гипоксического поражения ЦНС, синдром угнетения. Ранняя анемия недоношенных средней степени тяжести. Ретинопатия сетчатки обоих глаз III стадии, активная фаза.
Далее на фоне лечения и положительной клинико-лабораторной динамики (прирост весоростовых показателей, отсутствие воспалительных изменений в гемограмме, отрицательные показатели СРБ и ПКТ, отсутствие патологических отклонений остальных биохимических показателей, улучшение показателя SaО2: 94–95%) на 65-й день жизни ребенок был экстубирован и переведен на самостоятельное дыхание. Ингаляционная терапия по поводу тяжелой БЛД ИГКС (будесонидом) была продолжена в прежнем объеме.
На фоне стабилизации состояния в возрасте 5 мес. проведено оперативное лечение ретинопатии недоношенных (в Санкт-Петербургском государственном педиатрическом медицинском университете Минздрава России, отделении патологии новорожденных и детей грудного возраста). После операции в динамике у ребенка сохранялась стойкая дыхательная недостаточность (ЧДД 42–44, при беспокойстве до 85 в минуту; SаО2 90–94%), с которой связана продолжительная кислородная поддержка, общая продолжительность получения воздушно-кислородной смеси составила около 6 мес.
Амбулаторно ребенок наблюдался у педиатра, пульмонолога, кардиолога с диагнозом: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени тяжести, осложненная вторичной высокой легочной гипертензией (89 мм рт. ст.). Состояние после коррекции ВПС (лигирование ОАП, АМПП, открытое овальное окно, эктопическая хорда в полости левого желудочка). Парез левой голосовой связки. Последствия гипоксического поражения ЦНС. Задержка физического и моторного развития. Ретинопатия сетчатки обоих глаз III стадии, активная фаза (оперативное лечение: транспупиллярная лазеркоагуляция сетчатки). Анемия недоношенных средней степени. Белково-энергетическая недостаточность III степени.
На протяжении первого года жизни ребенок имел крайне низкое физическое развитие, дисгармоничное за счет дефицита массы (в 1 год масса 6,0 кг и длина тела 58 см) -6,2SD и -3,2SD по росту и массе соответственно [17]. Обращали на себя внимание повышенная слабость, утомляемость, сухой кашель в течение дня, периодически стридорозное дыхание, одышка в покое смешанного характера от 65 дыхательных движений в минуту в покое, ремиссии и до 82 в минуту в периоды обострения БЛД. Сатурация кислородом в периферической крови при пульсоксиметрии составляла 90–95%. За период наблюдения наиболее тяжелое ухудшение состояния отмечалось дважды в возрасте 6 мес. и 8 мес., что было связано с респираторными инфекциями.
Девочка получала базисную терапию БЛД препаратом будесонид в дозе 1,0 мг/сут с момента установления диагноза непрерывно в течение 6 мес., затем 0,5 мг 1 р./сут в течение 6 мес. В период обострения заболевания доза ИГКС увеличивалась до 2,0 мг/сут, для купирования одышки применялся ипратропия бромид в дозе 0,075 мг (до 6 капель).
При амбулаторном лечении по поводу легочной гипертензии был продолжен курс силденафила в дозе 4 мг/кг/сут × 4 р./сут в течение 2 нед., затем 1 мг/кг/сут в течение 6 мес., спиронолактон 2 мг/кг × 2 р./сут.
За время наблюдения в течение 1 года систолическое давление в легочной артерии (СДЛА) имело положительную динамику. На ЭКГ регистрировался синусовый ритм, миграция водителя ритма, электрическая ось сердца резко отклонена вправо, â=+150°, ЧСС 120–150 в минуту, PQ 0,1. На ЭХО-КГ отмечается: состояние после лигирования ОАП, проток закрыт герметично, пограничные размеры правых камер сердца (правый желудочек 1,77 см; ПП 1,76 см). Глобальная сократимость левого желудочка не нарушена. Фракция выброса SF 60%. Эктопическая хорда в полости левого желудочка. Митральная регургитация 0–I степени. Трикуспидальная регургитация I степени. Легочная артерия 1,46 см, СДЛА 46 мм рт. ст. Перикард без особенностей. Максимальный градиент давления на Ао 8,1 мм рт. ст. Сатурация О2 94%.
На фоне лечения отмечена положительная динамика СДЛА с 89 до 46 мм рт. ст., клинические признаки ЛАГ значительно уменьшились, сохраняются признаки БЛД и последствия гипоксического поражения ЦНС, задержки физического и психомоторного развития, перенесенной коррекции ВПС.
Установление клинического класса и верификация диагноза
Легочные функциональные тесты позволяют выявить обструктивные или рестриктивные изменения с целью дифференциальной диагностики ЛГ и уточнения тяжести поражения легких. Для больных характерно уменьшение диффузионной способности легких в отношении монооксида углерода (40-80% от нормы), небольшое или умеренное снижение легочных объемов, нормальное или незначительно сниженное PaO2 и обычно сниженное из-за альвеолярной гипервентиляции PaСO2.
Вентиляционно-перфузионная сцинтиграфия легких является методом скрининга для исключения хронической тромбоэмболии как причины легочной гипертензии. У больных после тромбоэмболии обнаруживаются дефекты перфузии в долевых и сегментарных зонах при отсутствии нарушений вентиляции. Перфузионная сцинтиграфия исторически стала одним из первых методов обнаружения дефектов перфузии легочной паренхимы при ТЭЛА. Изображения, получаемые при острой ТЭЛА и ХТЭЛГ, существенно различаются. Дефекты перфузии при острой ТЭЛА более четко очерчены и резко контрастируют с нормально функционирующей тканью. При ХТЭЛГ дефекты перфузии очерчены не четко и часто не соответствуют зоне кровоснабжения крупной легочной артерии.
Компьютерная томография и КТ-ангиопульмонография
КТ- картина хронической тромбоэмболии может быть представлена окклюзиями и стенозами легочных артерий, эксцентрическими дефектами наполнения вследствие наличия тромбов, в том числе реканализованных.КТ-ангиопульмонография проводится на спиральных компьютерных томографах в фазу прохождения контрастного вещества через легочное артериальное русло. Из методологических особенностей следует отметить, что исследование должно быть проведено с использованием не менее чем 8- спирального томографа, с минимальным шагом (не более 3 мм) и толщиной среза (не более 1мм). Тщательное сканирование должно охватить оба легких полностью – от верхушек до диафрагмальных синусов. Контрастное усиление правых отделов сердца и легочных артерий должно соответствовать или превышать степень контрастирования левых камер сердца и аорты. Выполнение второй, артериальной фазы сканирования рекомендуется всем больным старше 40 лет, особенно при наличии данных за артериальные тромбозы и ИБС в анамнезе. Современное программное обеспечение позволяет провести реконструкции изображений легочных артерий в любых плоскостях, построить проекции максимальной интенсивности и трехмерные изображения. В большинстве случаев для уточнения характера поражения достаточно проанализировать поперечные срезы с использованием программы просмотра изображений, что позволяет определить наличие изменений не только в долевых и в сегментарных ветвях, но и в ряде субсегментарных артерий. Патологические изменения помимо наличия «старого» тромботического материала могут включать локальные утолщения стенки сосуда, сужения в устье сосудов и на их протяжении, окклюзии, внутрисосудистые структуры в виде мембран и перемычек. При выявлении изменений в нескольких ветвях легочных артерий можно сделать вывод о высокой вероятности тромбоэмболического характера ЛГ. Важно отметить, что разрешающая способность современных КТ-сканеров ограничена и не позволяет определять очень тонкие мембранные и тяжистые структуры в просвете ЛА, особенно если размеры объекта не превышают 2-3 мм. В ряде случаев развивается кальцификация «старого» тромботического материала, и КТ может оказать неоценимую помощь в определении локализации кальциноза. КТ позволяет выявить не только стенотические изменения сосудов легких, но и нарушения перфузии легочной ткани по характеру контрастирования паренхимы. В некоторых случаях контрастирование паренхимы настолько неравномерно, что на сканах определяется мозаичное контрастирование. Четко выраженная мозаичность сегментов обычно свидетельствует о хорошем прогнозе оперативного лечения. Контрастирование исключительно прикорневых зон не является истинной мозаичностью и нередко наблюдается при микрососудистых формах ЛГ. Обеспечивая детальное изображение легочной паренхимы, КТ позволяет диагностировать и другие заболевания легких. Помимо состояния артериального русла, КТ может дать исчерпывающую информацию обо всех внутригрудных структурах, что важно для подтверждения диагноза и построения плана оперативного лечения. Перед выполнением операции следует учитывать состояние легочной паренхимы, бронхиального дерева, легочных вен.
Ангиографическая диагностика
Основными задачами ангиографической диагностики являются определение степени тяжести легочной гипертензии, уточнение характера поражения легочного русла посредством ангиопульмонографии, выявление/исключение коронарной болезни. Проведение катетеризации в изолированном виде без качественной ангиопульмонографии у больного с четкими признаками ХТЭЛГ нецелесообразно. Это исследование должно дать четкую информацию врачам для решения вопроса об операбельности больного и тяжести его состояния. Гемодинамическими критериями постэмболической легочной гипертензии, выявляемыми при катетеризации правых отделов сердца, являются: среднее давление в легочной артерии (ДЛА) выше 25 мм рт. ст., давление заклинивания легочной артерии (ДЗЛА) ≤ 15 мм рт. ст., ЛСС > 2 ЕД. по Вуду (160 дин. сек см-5) при наличии множественных стенозирующих и/или окклюзирующих поражений ветвей легочной артерии различного калибра.
Медицинские интернет-конференции
Первичная легочная гипертензия (ПЛГ) – болезнь Айэрсы – является редким тяжелым прогрессирующим заболеванием неизвестной этиологии и характеризуется неблагоприятным прогнозом [1, 2]. Легочная артериальная гипертензия (ЛАГ) диагностируется при повышении среднего давления в легочной артерии до и более 25 мм рт. ст. в покое и 30 мм рт. ст. при нагрузке [3].
По данным литературы встречаемость идиопатической легочной гипертензии составляет 1 – 1,7 случаев на миллион человек населения [2], причем заболевание встречается чаще у женщин, чем у мужчин почти в 2 раза. Возраст пациентов с таким диагнозом в среднем составляет 36,4 года [1]. Не утешительны данные статистики выживаемости пациентов с ПЛГ – при отсутствии интенсивного лечения средняя продолжительность жизни составляет около 3 лет с момента постановки диагноза [2].
Несмотря на активное изучение проблемы, этиология ПЛГ остается невыясненной, однако исследователи предполагают важную роль генетических нарушений в развитии заболевания [4]. В частности, развитие ПЛГ ассоциируют с мутацией гена BMPR2, локализованном во второй хромосоме, однако патогенетическая связь между данным нарушением и ПЛГ не открыта [11].
Несмотря на то, что факторы, приводящие к запуску патологических изменений в легочных сосудах, точно не установлены, на сегодняшний день исследователи основной в вопросах этиологии и патогенеза данного заболевания считают теорию эндотелиальной дисфункции (ЭД), которая свидетельствует, что повреждение и дисфункция эндотелия легочных сосудов приводит к развитию вазоконстрикции и ремоделированию сосудистого русла. В патогенезе выделяют четыре основных патофизиологических феномена: вазоконстрикция, редукция легочного сосудистого русла, снижение эластичности легочных сосудов, их облитерация вследствие тромбоза и пролиферация гладкомышечных клеток (ГМК). Эти процессы индуцируются возникающим при ЭД дисбалансе выработки вазоактивных медиаторов, который заключается в усиленном синтезе эндотелиоцитами вазоконстрикторных веществ (тромбоксан А2, эндотелин-1) и дефиците выработки вазодилатирующих (NO, простациклин). Играет роль также нарушение работы потенциал-зависимых калиевых каналов ГМК, которое вызывает вазоконстрикцию и пролиферацию ГМК вследствие повышенного внутриклеточного содержания ионов кальция. Ключевое значение в развитии и прогрессировании ЛАГ отводится дефициту NO, который способствует хроническому вазоспазму, клеточной пролиферации, внутрисосудистому тромбообразованию [5].
Таким образом, замыкается порочный круг – прогрессирующее повреждение эндотелия приводит к ремоделированию сосудов [11].
Патологические процессы при ЛАГ затрагивают все слои сосудистой стенки, различные типы клеток (эндотелиальные, ГМК, фибробласты). Структурные нарушения начинаются с артерий мышечного типа и артериол легких. Процесс начинается с гипертрофии и мускуляризации средней оболочки артериол. Кроме того, наблюдается миграция ГМК в интиму сосуда, в которой происходит активная пролиферация клеточных элементов. Сначала утолщение интимы обратимо, однако вскоре развиваются необратимые изменения – фиброз и фиброэластоз. В ряде случаев концентрический фиброз интимы полностью закрывает просвет сосуда. При этом могут определяться плексогенные и плексиморфные структуры, которые, как правило, возникают проксимальнее места обтурации. В адвентиции наблюдается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Секреция медиаторов выраженного сосудосуживающего действия трансформирует состояние сосудистого русла из обычного антикоагулянтного в прокоагулянтное и способствует развитию тромбоза [10, 11].
Современные функциональные исследования с помощью различных неинвазивных методик оценки состояния периферического кровотока не подтверждают генерализацию эндотелиальной дисфункции у пациентов с ПЛГ, однако отмечается повышенная констрикторная способность ГМК [6].
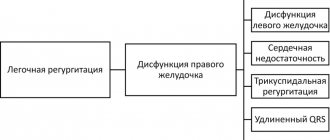
Рост сосудистого сопротивления в малом круге кровообращения (МКК) инициирует возникновение синдрома гипердинамии миокарда с развитием гипертрофии правого желудочка (ПЖ). Данное явление обусловлено физиологической реакцией, описанной Старлингом, которая заключается в увеличении силы сердечного сокращения в ответ на нагрузку объемом или сосудистым выходным сопротивлением [7]. Легочное сердце (ЛС) развивается при первичной или вторичной ЛАГ, возникшей в результате нарушения функции эндотелиоцитов сосудов легких, структурных и функциональных изменений легочных сосудов [8]. В развитии легочного сердца выделяют несколько стадий. В начальную стадию происходит увеличение резистентности легочных сосудов, является следствием ЛАГ. Во вторую стадию выявляются изменения в ПЖ в ответ на повышение легочного артериального давления. Третья стадия заключается в выраженной гипертрофии и дилатации ПЖ, происходят изменения в васкуляризации последнего, может наблюдаться правожелудочковая сердечная недостаточность (ПЖСН) [9].
При формировании ЛС наблюдаются изменения миокарда в виде гипертрофии, дистрофии, атрофии и некроза кардиомиоцитов ПЖ. В мышечных волокнах ПЖ могут наблюдаться атрофически-склеротические процессы, в правом предсердии и ПЖ – выраженный фиброэластоз эндокарда. Реже отмечается расширение полости левого желудочка [12].
Диагностика ПЛГ затруднена, поскольку жалобы пациентов носят неспецифический характер и могут напоминать врожденный порок сердца. В большинстве случаев клинические проявления формируются после развития необратимых изменений в легких. Отмечают слабость, усталость, одышку, кровохарканье, ангинозную боль в области сердца, головокружение, абдоминальный дискомфорт. При осмотре обнаруживаются пульсация шейных вен, гепатомегалия, периферические отеки, асцит. Пальпаторно определяется пульсация в четвертом межреберье слева от грудины, увеличение правого желудочка. Аускультируется усиление второго тона во втором межреберье справа [13].
Консервативное лечение ПЛГ предусматривает, в первую очередь, назначение антагонистов кальция, проведение антикоагулянтной терапии, применение диуретиков при ПЖСН. Силденафила цитрат (действующее вещество «Виагры») имеет одинаковые вазодилатирующие способности как в сосудах гениталий, так и легких, в связи с чем был одобрен в США в качестве препарата для лечения ПЛГ [4]. Возможно и хирургическое лечение – трансплантация органокомплекса «сердце-легкие» [11]. Однако полное устранение ПЛГ на данный момент не представляется возможным, лечение носит поддерживающий характер.
В отдельную категорию относят персистирующую легочную гипертензию новорождённых (ПЛГН) в связи с наличием характерных патогенетических и клинико-морфологических аспектов, связанных с особенностями кровообращения плода и отличающими её от ПЛГ. ПЛГН – заболевание, характеризующееся аномально повышенным давлением в легочных сосудах и, как следствие, право-левым шунтированием крови через овальное отверстие и (или) открытый артериальный проток при отсутствии других пороков сердца. Среди вариантов ПЛГН, в свою очередь, выделяют идиопатическую (первичную) и осложняющую различные неонатальные сердечно-легочные осложнения (вторичную) [14]. ПЛГН встречается в 0,2-0,3 случаях на 1000 новорождённых, однако идиопатический вариант составляет до 20% от всех случаев ПЛГН [15].
Ведущей этиологией идиопатической ПЛГН является длительная внутриутробная гипоксия, которая приводит к ремоделированию сосудистого русла, которое выражается в гиперплазии гладких мышц сосудов, распространяющейся на внутридольковые артерии, что приводит к повышению сосудистого сопротивления [15].
У здоровых новорождённых в ответ на многочисленную стимуляцию, происходящую во время рождения, в том числе на увеличение парциального давления кислорода, изменения pH крови, меняется активность вазоактивных веществ [14]. Основным патогенетическим звеном идиопатической ПЛГН также считается дисбаланс синтеза вазоконстрикторных и вазодилатирующих веществ [15].
Таким образом, первичная легочная гипертензия – редкое и тяжелое, с крайне неблагоприятным прогнозом заболевание. Однако накопившийся клинический опыт предоставляет возможности открывать механизмы его патогенеза и разрабатывать новые методы диагностики и лечения, позволяющие не только продлить жизнь пациентам, но и улучшить ее качество. В этой связи актуальным является описание клинических случаев идиопатической легочной гипертензии.
Клинический случай
Из анамнеза известно, что мальчик Е.Д. родился от пятой беременности (вторые роды), протекающей на фоне угрозы прерывания беременности, отеков беременных, низкой плацентации, частичной прогрессирующей отслойки низкорасположенной плаценты, отягощённого акушерско-гинекологического анамнеза, хронической внутриутробной гипоксии плода. Преждевременные роды при сроке гестации 32-33 недели были разрешены путем операции кесарева сечения в экстренном порядке.
Новорождённый находился в тяжелом состоянии с оценкой по шкале Апгар 4-5-6-6 баллов. Тяжесть состояния была обусловлена дыхательными нарушениями, неврологической симптоматикой на фоне недоношенности и морфофункциональной незрелости. Антропометрические данные ребенка при рождении: масса тела 2530 г, рост 47 см, окружность груди 31 см, окружность головы 33 см.
С рождения находился на ИВЛ. На этапе родильного дома проводилась респираторная, инфузионная, антибактериальная и гемостатическая терапия. С целью дальнейшего обследования, лечения и выхаживания мальчик был переведён бригадой санитарной авиации из роддома в отделение реанимации и интенсивной терапии новорождённых Саратовской Областной Детской Клинической больницы (СОДКБ).
На основании проведенных обследований был поставлен основной конкурирующий клинический диагноз: 1. Врождённая пневмония. 2. Церебральная ишемия 3 степени, острый период. Синдром угнетения. Осложнения: синдром полиорганной недостаточности (отек головного мозга, кома 3 степени; дыхательная недостаточность 3 степени; острая сердечно- сосудистая недостаточность 3 степени; острая почечная недостаточность в стадии олигоанурии; отечный синдром; геморрагический синдром; легочная гипертензия). Сопутствующие заболевания: дефект перимембранозный подтрикуспидальный межжелудочковой перегородки 0,24 см; открытый артериальный проток: 0,30см; открытое функционирующее овальное окно: 0,42см, лево-правый сброс. Фоновый диагноз: респираторный дистресс-синдром новорождённых; недоношенность 32-33 недели.
В условиях проводимой терапии (инотропная поддержка, сурфактанты, увеличение параметров вентиляции до максимально возможных) состояние ребенка оставалось тяжелым с динамикой ухудшения. На фоне прогрессирующей полиорганной недостаточности была отмечена асистолия, констатирована биологическая смерть ребенка.
При вскрытии грудной полости отмечено обычное расположение органов, однако легкие полностью выполняют плевральную полость. Форма сердца конусовидная, расположение обычное. Величина и расположение вилочковой железы без особенностей. В мягких тканях имеются кровоизлияния ярко-красного цвета размерами до 1 см.
При исследовании дыхательных путей отмечены обычных размеров отечные розовые небные миндалины. В просвете гортани, трахеи и бронхов определяется небольшое количество слизистого содержимого. Слизистая оболочка указанных органов отечная, гладкая по всей длине. Листки париетальной и висцеральной плевры гладкие, бледно-розового оттенка. Легкие темно-красного цвета, плотной консистенции, легочная ткань на разрезе однородная, обильно пропитана кровью, при надавливании выделятся жидкая кровь и отечная жидкость. Масса левого легкого 40 грамм, правого легкого 37 грамм. Кусочки, вырезанные из легких, при погружении в воду тонут. На гистологическом исследовании легких в просветах альвеол обнаружены очаговые скопления эритроцитов, формирующиеся гиалиновые мембраны; в сосудах отмечена гипертрофия мышечного слоя артерий и вен более чем на 25%, выявлены пролиферация интимы с фиброзом, а также тромботические массы.
При исследовании органов кровообращения обнаружено небольшое количество желтоватой прозрачной жидкости в сердечной сорочке. Листки перикарда гладкие, блестящие. Сердце массой 20 г. Миокард розово-красный, упругой консистенции. Клапанный и пристеночный эндокард на всем протяжении тонкий, полупрозрачный, блестящий, с сероватым оттенком. Толщина миокарда левого желудочка 0,7 см, правого 0,3 см (норма 0,2 см). Периметр легочного ствола над клапанами 2,2 см, аорты – 1,9 см. Интима аорты гладкая, блестящая, красновато-желтого цвета. В полостях сердца и в крупных сосудах темная жидкая кровь. Клапаны сердца развиты правильно, не изменены. Межжелудочковое сообщение размером 0,2 см; овальное окно размером около 0,3 см открыто; открытый артериальный проток размером 0,3 см. На гистологическом исследовании обнаружены дистрофия и гипертрофия кардиомиоцитов.
При вскрытии полости черепа обнаружено, что твердая мозговая оболочка тонкая, с перламутровым блеском. Мягкие мозговые оболочки отечные, полнокровные. Извилины головного мозга уплощены, борозды сглажены. Боковые желудочки немного увеличены в размерах, содержат прозрачный ярко-желтый ликвор. В полости правого желудочка имеется небольшой сверток крови ярко-красного цвета объемом около 5 мл. Сосудистые сплетения полнокровные, с прозрачным содержимым. Белое и серое вещество больших полушарий различимо, на поверхности разрезов определяются темно-красные точки, легко смываемые водой. Остальные структуры головного мозга без видимых изменений. Масса головного мозга 265 грамм. На гистологическом исследовании выявлено неравномерное кровенаполнение сосудов головного мозга.
При вскрытии брюшной полости выделилось около 5 мл желтой жидкости. Петли тонкого кишечника в нижних отделах темно-красного цвета, немного увеличены в размерах; сосуды кишечника полнокровны. Слизистая тонкого кишечника со сглаженным рисунком, темно-красного цвета. В просвете нижних отделов тонкого кишечника геморрагическое содержимое. Печень массой 105 грамм красного цвета, на поверхности и на разрезе имеет обычную структуру. На гистологическом исследовании печени обнаружена дистрофия гепатоцитов, полнокровие печеночных синусов.
При вскрытии почек отмечено, что на разрезе корковое вещество синюшно-красного цвета, а мозговое – темно-красное; паренхима плотной консистенции; слизистая лоханок гладкая, чистая с единичными мелкими кровоизлияниями. Слизистая оболочка мочеточников и мочевого пузыря без особенностей. На гистологическом исследовании почек обнаружена дистрофия эпителия извитых почечных канальцев, а также неравномерное кровенаполнение сосудов.
При вскрытии остальных органов и систем значимых особенностей выявлено не было.
На основе проведенного вскрытия и гистологического исследования был поставлен патологоанатомический диагноз – первичная легочная гипертензия; осложнения основного заболевания – гипертрофия миокарда правого желудочка сердца; вторичные гиалиновые мембраны; кровоизлияния в легких; паренхиматозная дистрофия внутренних органов.
Обсуждение
В данном случае ПЛГ у новорожденного сочеталась с открытым овальным окном и открытым артериальным протоком, а также перимембранозным дефектом межжелудочковой перегородки, что привело к существенным изменениям гемодинамики в неонатальном периоде. Следствием длительной гипоксии стало ишемическое повреждение различных органов, развитие паренхиматозной дистрофии и полиорганной недостаточности, что и обуславливало тяжесть состояния пациента. Непосредственной причиной смерти больного стала дыхательная недостаточность.
Заключение
Таким образом, ПЛГ – тяжелое прогрессирующее заболевание, плохо поддающееся лечению, – у новорожденных осложняется особенностями гемодинамики и неминуемо приводит к летальному исходу. Изучение этиологии и патогенетических механизмов идиопатической легочной гипертензии позволит найти новые пути помощи больным, страдающим от данной болезни.