Медицина/8. Морфология
К.м.н. Рыбаков А.Г., к.м.н. Лошкарев И.А., к.м.н. Мачинский П.А.,
к.м.н. Тишков С.В.
Мордовский государственный университет им. Н.П. Огарева, Россия
Вариантная анатомия передней соединительной артерии круга Виллизия
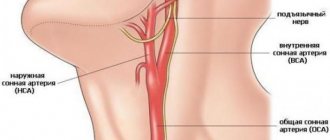
Круг Виллизия представляет собой артериальный анастомоз, расположенный на основании головного мозга в подпаутинном пространстве между передним отделом зрительного перекреста и варолиевым мостом. В виллизиевом круге различают две части: переднюю и заднюю. Переднюю часть образуют начальные отделы двух передних мозговых артерий, отходящих от внутренних сонных артерий и соединяющиеся передней соединительной артерией. Заднюю часть образуют две задние мозговые артерии, которые с помощью парных задних соединительных артерий соединяются с внутренней сонной артерией со своей стороны. Таким образом, в формировании виллизиева круга принимают участие ветви внутренних сонных и позвоночных артерий. Соединительные артерии служат связующим звеном между отделами виллизиева круга.
Наряду с типичным строением артерий основания головного мозга встречаются атипичные разновидности круга Виллизия (1, 2, 8, 9). Варианты и аномалии сосудов артериального круга головного мозга имеют важное значение в неврологической и нейрохирургической практике (3, 4, 5, 7). Среди различных вариантов строения артерий основания головного мозга наиболее гемодинамически неблагоприятными являются аплазия и гипоплазия соединительных артерий. При этом происходит анатомическое и функциональное разобщение виллизиева круга и при нарушении мозгового кровообращения развиваются обширные очаги ишемического поражения головного мозга (1, 6).
Целью нашего исследования являлось изучить варианты строения передней соединительной артерий круга Виллизия.
Исследование выполнено на 124 препаратах артерий основания головного мозга человека. Сосуды артериального круга выделяли методом препарирования.
Результаты исследований. Типичное строение передней соединительной артерии было обнаружено в 94 случаях (75,8 %), различные варианты строения передней соединительной артерии наблюдались в 29 случаях (23,4 %) и в 1 случае (0,8 %) нами обнаружена аневризма передней соединительной артерии.
В типичных случаях передняя соединительная артерия представляет собой стволик длиной 2-4 мм, диаметром 1,5-2,5 мм, который располагается между начальными отделами передних мозговых артерий (рис. 1).
Рис. 1.
Типичное строение передней соединительной артерии (указано стрелкой)
Среди вариантов наиболее часто встречалась срединная артерия мозолистого тела, которая была обнаружена в 10 случаях (8,0 %). Срединная артерия мозолистого тела отходила от передней соединительной артерии и направлялась между правой и левой передними мозговыми артериями вдоль corpus callosum (рис. 2).
Рис. 2.
Срединная артерия мозолистого тела (указано стрелкой)
В 8 случаях (6,5 %) наблюдалась двойная передняя соединительная артерия, которая в виде двух параллельно идущих стволиков соединяла правую и левую передние мозговые артерии (рис. 3а). В 3 случаях (2,4 %) было обнаружено частичное раздвоение передней соединительной артерии. При этом артерия начиналась одним стволиком от передней мозговой артерии с одной стороны, а затем вилкообразно раздваивалась и соединялась с передней мозговой артерией противоположной стороны (рис. 3б).
Рис. 3 А.
Двойная передняя соединительная артерия (указано стрелкой)
Рис. 3 Б.
Частичное раздвоение передней соединительной артерии (указано стрелкой)
видна также срединная артерия мозолистого тела
В 1 случае (0,8 %) наблюдалась тройная передняя соединительная артерия (рис. 4а) и в 1 случае (0,8 %) на месте передней соединительной артерии обнаружена сосудистая сеть (рис. 4б).
В 4 случаях (3,2 %) отмечалась гипоплазия передней соединительной артерии, которая была представлена нитевидной веточкой, расположенной между правой и левой передними мозговыми артериями (рис. 5а). В 5 случаях (4,0 %) передняя соединительная артерия отсутствовала, а передние мозговые артерии соединялись друг с другом по типу анастомоза «бок в бок» (рис. 5б). Указанное соединение располагалось вертикально на протяжении 4-5 мм.
В 1 случае (0,8 %) обнаружена аневризма передней соединительной артерии, которая имела округлую форму и диаметр около 2,5 мм (рис. 6).
Рис. 4 А.
Тройная передняя соединительная артерия (указано стрелкой)
Рис. 4 Б.
Передняя соединительная артерия в виде сосудистой сети (указано стрелкой)
Рис. 5А.
Гипоплазия и частичное раздвоение передней соединительной артерии
(указано стрелкой)
Рис. 5Б.
Передняя соединительная артерия отсутствует, передние мозговые артерии соединяются друг с другом по типу анастомоза «бок в бок» (указано стрелкой)
Рис. 6.
Аневризма передней соединительной артерии (указано стрелкой)
Литература
1. Беленькая Р.М. Инсульт и варианты артерий мозга. М.: Медицина, 1979. – 176 с.
2. Гладилин Ю.А. Анатомические особенности внутренних сонных артерий и артериального круга большого мозга. – Саратов: Изд-во Саратовского медицинского университета, 2008. – 242 с.
3. Крылов В.В., Ткачев В.В., Добровольский Г.Ф. Микрохирургия аневризм виллизиевого многоугольника. – М.: Антидор, 2004. – 160 с.
4. Пуцилло М.В., Винокуров А.Г., Белов А.И. Нейрохирургическая анатомия. Под ред. А.Н. Коновалова. – М.: Антидор, 2002. – 206 с.
5. Alawad A.H., Hussein M.A, Hassan M.A. Morphology and normal variations of the cerebral arterial circle of Willis in Khartoum Diagnostic Centre // Khartoum Medical Journal. – 2009. – Vol. 2, № 2. – P. 215-219.
6. De Silva K., Silva R. et al. Prevalence of typical circle of Willis and the variation in the anterior communicating artery: a study of a Sri Lankan population // Ann. Indian. Acad. Neurol. –2009. – Vol. 12, № 3. – P. 157-161.
7. Gurdal E., Cakmak O. et al. Two variations of the anterior communicating artery: a clinical reminder // Neuroanatomy. – 2004. – Vol. 3. – P. 32-34.
8. Kapoor K., Singh B., Dewan L.I. Variations in the configuration of the circle of Willis // Anat. Sci. Int. – 2008. – Vol. 83, № 2. – P. 96-106.
9. Nayak S.B., Somayaji S.N., Soumya K.V. Variant arteries at the base of the brain //
International Journal of Anatomical Variations. – 2009. – Vol. 2. – P. 60-61.
Медицинские интернет-конференции
О.А. Фомкина – ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России, ассистент кафедры анатомии человека, кандидат медицинских наук; В.Н. Николенко – ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, проректор по научной и инновационной деятельности, профессор кафедры анатомии человека, директор НИИ молекулярной медицины, профессор, доктор медицинских наук; Ю.А. Гладилин – ГБОУ ВПО Саратовский государственный университет им. В.И. Разумовского Минздрава России, доцент кафедры анатомии человека, доктор медицинских наук.
Введение. Изменчивость как общебиологическое явление не теряет своей актуальности и заслуживает внимания многих ученых [1, 2]. Изменчивость показывает пластичность живых систем и связана с реализацией адаптивной стратегии природной популяции. Изучение изменчивости позволяет судить о взаимодействии генотипа с факторами среды в процессе онтогенеза [3].
Отвечая запросам клинической медицины, в настоящее время, требуются детальные сведения не столько о типичном строении или средней анатомической норме органа, сколько обо всем спектре индивидуальной, типовой и сочетанной его изменчивости [2]. Это касается и артериальных сосудов головного мозга.
Предметом настоящего исследования является задняя соединительная артерия (ЗСА). Являясь ветвью мозгового отдела внутренней сонной артерии, она участвует в формировании артериального (Виллизиева) круга мозга. Доказано, что кровь по этой артерии может течь в обоих направлениях [4]. В связи с этим, ЗСА принадлежит важная роль в осуществлении компенсаторного коллатерального кровотока между системами внутренних сонных и позвоночных артерий.
Строение задних соединительных артерий очень варьирует. По сравнению с другими артериями головного мозга они имеют малый диаметр и практически точечный просвет [5-7].
Цель исследования: определить варианты задней соединительной артерии (ЗСА) взрослых людей в зависимости от индивидуальной и сочетанной изменчивости ее морфометрических параметров.
Материалы и методы. Материалом исследования послужили ЗСА, полученные при аутопсии 115 трупов людей в возрасте от 21 до 84 лет, умерших по причинам, не связанным с острой или хронической цереброваскулярной патологией. Всего исследовано 230 образцов артерий. Для изучения морфологии артерии производили поперечные миллиметровые срезы с помощью бритвы. Затем срезы помещали в чашку Петри с физиологическим раствором и под микроскопом с точностью до 0,01 мм измеряли наружный диаметр и толщину стенки артерии. Диаметр просвета артерии представлен в исследовании как разность наружного диаметра и удвоенной толщины стенки артерии.
Полученные данные обрабатывали вариационно-статистическим методом с использованием пакета прикладных программ «Statistica-6» и Microsoft Exsel Windows-XP., Для проверки наличия нормального распределения использовали Тест Колмогорова-Смирнова. Распределение параметров в изученной выборке не отличалось от нормального. В связи с этим для всех параметров определяли минимальное и максимальное значения, среднюю арифметическую (М), ошибку средней арифметической (m), среднее квадратическое отклонение (s), коэффициент вариации (Cv). Для оценки достоверности различий между рядами вариант использовали параметрический критерий (критерий Стьюдента) При этом различия считали достоверными при 95%-м пороге вероятности (р<0,05). При изучении индивидуальной изменчивости, как и большинство исследователей, занимающихся вопросами диапазона анатомической нормы, за среднюю величину признака мы принимали интервал варьирования М±σ. Так как обнаружены статистически значимые половые различия длины, толщины стенки и диаметра просвета ЗСА [6], варианты изменчивости по этим параметрам были рассчитаны отдельно для мужчин и женщин.
Результаты. Средние величины морфометрических параметров ЗСА (230 образцов) без учета пола, возраста и полушария большого мозга составили: 1) длина 12,26±0,19 мм (А=5,30-20,10 мм; s=2,89 мм; Сv=23,6%); 2) наружный диаметр – 1,33±0,02 мм (А=0,80-2,10 мм; s=0,26 мм; Сv=19,2%); 3) толщина стенки – 0,23±0,01 мм (А=0,12-0,40 мм; s=0,06 мм; Сv=26,2%); 4) диаметр просвета – 0,88±0,02 мм (А=0,46-1,46 мм; s=0,25 мм; Сv=28,0%).
Значительная изменчивость морфометрических параметров ЗСА позволила выделить группы вариантов их значений (табл. 1).
По длине ЗСА подразделились на: короткие – длина менее 9,89 мм у мужчин и менее 8,80 мм у женщин; средние по длине – с длиной от 9,90 до 15,72 мм у мужчин и от 8,81 до 11,51 у женщин; длинные – с длинной более 15,73 мм у мужчин и более 11,52 мм у женщин. Средний возраст субъектов с короткими ЗСА был в 1,2 раза больше, чем у людей с длинными артериями – соответственно 51,3±2,9 года и 43,0±2,6 года (р=0,039). Количественное соотношение мужчин и женщин в группе субъектов с короткими артериями – 39,5 и 60,5%; в группе субъектов с длинными артериями – 71,9 и 28,1%.
Исходя из величины наружного диаметра, ЗСА бывают: тонкими – диаметр менее 1,06 мм; среднего диаметра (среднеширокие) – диаметр колеблется в пределах от 1,07 до 1,59 мм и широкими – с диаметром более 1,60 мм. Субъекты с широкими ЗСА были в среднем в 1,2 раза старше людей с тонкими артериями – соответственно 55,0±3,0 года и 45,5±2,1 года (р=0,011). Количественное соотношение мужчин и женщин в группе субъектов с тонкими артериями – 59,0 и 41,0%; в группе субъектов с широкими артериями представительство мужчин и женщин одинаковое – по 50%.
По толщине стенки ЗСА подразделились на: тонкостенные – толщина стенки менее 0,17 мм у мужчин и менее 0,14 мм у женщин; средние по толщине – с толщиной стенки от 0,18 до 0,30 мм у мужчин и от 0,15 до 0,25 мм у женщин; толстостенные – с толщиной стенки более 0,31 мм у мужчин и более 0,26 мм у женщин. Средний возраст субъектов с толстостенными ЗСА был в 1,7 раза больше, чем у людей с тонкостенными артериями – соответственно 69,2±2,3 года и 40,7±2,5 года (р=1·10-6). Количественное соотношение мужчин и женщин в группе субъектов с тонкостенными артериями – 25,7 и 74,3%; в группе исследованных с толстостенными артериями – 78,9 и 21,1%.
В зависимости от величины диаметра просвета, нами выделены ЗСА: с узким просветом – диаметр просвета менее 0,58 мм у мужчин и менее 0,68 мм у женщин; со средним просветом – диаметр просвета, варьирует от 0,59 до 1,07 мм у мужчин и от 0,69 до 1,19 мм у женщин; с широким просветом – диаметр просвета превышает 1,08 мм у мужчин и 1,20 мм у женщин. Возраст субъектов с узким и широким просветом ЗСА существенно не различался – соответственно 51,2±2,5 года и 45,6±3,1 года (р=0,163). Количественное соотношение мужчин и женщин в группе исследуемых с узким просветом ЗСА – 75,6 и 24,4%; в группе исследованных с широким просветом ЗСА – 43,6% и 56,4%.
Отмечено, что примерно 71,9% всех тонких ЗСА обладали узким, а 28,2% – средним по величине просветом. При этом тонкие ЗСА в 23,1% случаев имели тонкую, в 5,2% случаев толстую и в 71,8% случаев среднюю толщину стенки (табл. 2).
Среднеширокие артерии в 87,1% случаев характеризовались средним по величине диаметром просвета; в 7,7% случаев такие ЗСА имели узкий, а в 5,2% широкий диаметр просвета. Среднеширокие артерии, как правило, обладали средней по величине толщиной стенки (67,1% наблюдений); тонко- и толстостенные ЗСА также встречались в этой группе – соответственно в 12,9 и 20% случаев.
Широкие ЗСА в 86,1% имели широкий и в 13,9% случаев средний диаметр просвета. При этом в 13,9% случаев они являлись тонко- или толстостенными, а в остальных 72,2% характеризовались средней по толщине стенкой.
Сочетанная изменчивость морфометрических параметров ЗСА позволила выделить 18 ее типов. Наиболее часто встречаются среднеширокие ЗСА со средней величиной толщины стенки и средним просветом (43,0%). К редким типам (частота встречаемости менее 1%) относят тонкие ЗСА (со средней толщиной стенки и диаметром просвета, с тонкой стенкой и узким просветом, толстой стенкой и узким просветом, толстой стенкой и средним просветом); ЗСА со средним наружным диаметром, толстой стенкой и широким просветом; широкие ЗСА с толстой стенкой и средним просветом (рис. 1). Тонкостенные ЗСА на нашем материале никогда не обладали широким диаметром просвета.
Рис. 1.Частота встречаемости типов ЗСА,% (НД – наружный диаметр, ТС – толщина стенки, ДП – диаметр просвета): 1 – средние по НД, ТС и ДП; 2 – тонкие со средней ТС и узким ДП; 3 – широкие со средней ТС и широким ДП; 4 – средние по НД, с толстой стенкой и средним ДП; 5 – средние по НД с тонкой стенкой и средним ДП; 6 – тонкие с тонкой стенкой и средним ДП; 7 – средние по НД с толстой стенкой и узким ДП; 8 – средние по НД, с тонкой стенкой и широким ДП; 9 – средние по НД, ТС с узким ДП; 10 – широкие с тонкой стенкой и широким ДП; 11 – широкие со средней толщиной стенки и средним ДП; 12 – широкие с толстой стенкой и широким ДП; 13 – тонкие со средней ТС и средним просветом; 14 – средние по НД, с толстой стенкой и широким ДП; 15 – тонкие с тонкой стенкой и узким ДП; 16 – тонкие с толстой стенкой и узким ДП; 17 – тонкие с толстой стенкой и средним ДП; 18 – широкие с толстой стенкой и средним ДП.
Обсуждение. Подавляющее большинство работ, затрагивающих ЗСА, посвящено вариантам ее развития: аплазия, гипоплазия, наличие сосудистой сети на месте артерии и пр. [5, 8, 9]. Сведения, посвященные индивидуально-типологической изменчивости морфометрических параметров ЗСА нами представлены впервые.
В результате проведенного исследования выявлено, что морфологические параметры ЗСА (длина, наружный и внутренний диаметр, толщина стенки) характеризуются значительной индивидуальной изменчивостью. Коэффициент вариации изученных параметров варьирует от 19,2% (наружный диаметр) до 28,0% (диаметр просвета). По каждому из параметров нами выделены 3 группы артерий: I – с величиной признака меньше средней (<�М-σ); II – со средней величиной признака (М±σ); III – с величиной признака больше средней (>М+σ). Четкой закономерности по преобладанию в крайних группах изменчивости (I и II группах) мужчин или женщин не обнаружено. Так, среди субъектов с короткими, тонкостенными артериями и артериями с широким просветом – преобладают женщины, а среди субъектов с длинными, тонкими, толстостенными артериями и артериями с узким просветом преобладают мужчины. В группе исследованных с широкими ЗСА процентное представительство мужчин и женщин одинаковое.
Средний возраст субъектов, ЗСА которых по величине их наружного диаметра, толщины стенки и диаметра просвета относятся к III группе, статистически достоверно в 1,2-1,7 раза больше, чем у людей с ЗМА, относящихся к I группе изменчивости. Средний возраст мужчин и женщин с короткими ЗСА (I группа), наоборот, в 1,2 раза больше, чем у людей с длинными ЗСА (III группа). Возраст субъектов с ЗСА, имеющих узкий или широкий просветы, существенно не различался.
Заключение. Таким образом, анализ индивидуальной изменчивости длины, наружного и внутреннего диаметров и толщины стенки ЗСА позволил выделить по каждому из параметров 3 группы вариантов артерий: со средней величиной признака, с величиной признака меньше и больше средней. Сочетанная изменчивость морфометрических параметров ЗСА позволила выделить 18 ее типов.
Полученные данные дополнят и упорядочат имеющиеся сведения о размерных характеристиках ЗСА, что имеет значение для лучшего понимания исследуемой области нейроморфологии, а также может быть полезно при моделировании кровотока в артериальном круге мозга.
Варианты развития артерий головного мозга и эпилепсия
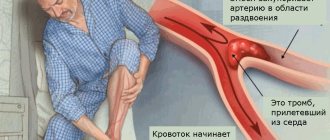
Сложившиеся представления о механизмах развития церебральной ишемии подразумевают возникновение несоответствия между имеющимся кровоснабжением и потребностями мозговой ткани. К наиболее важным достижениям в области клинической ангионеврологии относится современная концепция гетерогенности ишемического инсульта, в основе которой лежит представление о многообразии причин и механизмов развития острого очагового ишемического повреждения мозга. Величина обратимого и необратимого повреждения мозга в значительной степени зависит от состояния гемодинамического, коллатерального, перфузионного и метаболического резервов мозга. Патологическая извитость магистральных артерий головы — наследственно детерминированная функциональная неполноценность соединительной ткани — встречается не менее чем у 10 % населения. Среди основньгх форм поражений интракраниальных артерий выделяют перегибы и петлеобразования, аневризматические расширения артерий, артериовенозные аневризмы. Чрезмерная извилистость сосудов способствует формированию в них тромбов. У 71 % больных с окклюзией артерий отмечен извитой ход сосудов. Недоразвитие артерий головного мозга в виде гипоплазии или стеноза задней нижней мозжечковой артерии и/или базилярной артерии, редко нижняя передняя мозжечковая артерия и извитость позвоночной артерии являются причинами снижения слуха и глухоты. Слабые анастомозы артерий головного мозга вызывают церебральную ишемию после дискэктомии шейного отдела позвоночника. При болезнях Паркинсона и Альцгеймера нейровизуализационные и патологоанатомические исследования в 20-30 % случаев обнаружили цереброваскулярные поражения, а в основе деменции может быть сосудистое заболевание головного мозга. Структурные изменения сосудов головного мозга, снижение скорости кровотока и наличие в 30 % стеноза в средней мозговой артерии могут стать предпосылками развития инсульта у больных с синдромом апноэ во сне.
При аномалии Киммерле необходимо учитывать наличие врожденных изменений позвоночных артерий. Диспластические нарушения в области краниовертебрального перехода в 2 раза чаще отмечены при патологической извитости позвоночных артерий, в меньшей степени за счет гипоплазии позвоночных артерий. До 51,9 % больных с мальформацией Киари и сирингомиелией имеют особенности строения артериального круга большого мозга. Извитости, асимметрии и гипоплазии позвоночных артерий с признаками нарушения кровотока характерны для вертебробазилярной недостаточности вследствие шейной дорсопатии и отмечены в 76,6 % случаев при центральном вестибулокохлеарном синдроме.
Артериальное русло головного мозга оказывается пораженным и при таких системных заболеваниях организма, как ревматоидный артрит, узелковый полиартериит, болезнь Такаясу, болезнь Шенлейна-Геноха, При проведении стоматологических манипуляций у больных с болезнью Штурге-Вебера или Реклингхаузена как типичных нейрофиброматозов возможно развитие угрожающего кровотечения. Первичное поражение церебральных артерий в виде васкулита и эндартериита лежит в основе развития нейросифилиса и приводит к вторичному страданию нервной ткани и возникновению инфарктов в головном мозге. Церебральный васкулит и герпетический церебральный васкулит могут развиться на фоне герпетической инфекции. При ишемических инсультах в 70 % наблюдений в ткани головного мозга, наряду с изменениями, обусловленными острым нарушением мозгового кровообращения, отмечаются очаговые поражения, сходные с изменениями при менингоэнцефалитах, вызванных опоясывающим и простым герпесом.
Изменения строения артерий головного мозга необходимо учитывать при оценке онкологических метастазов, а также у 40 % больных с тяжелой черепно-мозговой травмой при выявлении травматических субарахноидальных кровоизлияний и сопутствующего ангиографического вазоспазма.
По ходу выполнения изысканий по изучению взаимосвязи вариантов артерий головного мозга человека с цереброваскулярными расстройствами в рамках острых нарушений мозгового кровообращения и хронической ишемии головного мозга у нас сложились наблюдения о взаимосвязи вариантов строения и топографии артерий головного мозга человека с рядом других нозологических единиц. В этой связи мы представляем результаты собственных исследований о вариантах развития артерий головного мозга человека с различными видами эпилепсий.
Нами было проанализировано состояние артериального русла головного мозга 748 амбулаторных и стационарных пациентов от 22 лет до 81 года, находившихся на обследовании и лечении в неврологических и нейрохирургическом отделениях ОКБ № 2 им. профессора И.Н. Аламдарова г. Астрахани в период 1983-1998 гг., неврологических отделениях Городской больнтщы № 3 и Городской больницы № 4 г. Тамбова, нейрохирургическом отделении Тамбовской областной больницы, реабилитационно-оздоровительном комплексе семьи «Б. Липовица», неврологических кабинетах и в дневных стационарах Городской больницы № 4, Узловой поликлинике на ст. Тамбов ОАО «РЖД» и ЦДЛ ООО «Тамбовмедсервис», а также в амбулатории «Домашний доктор» (г. Тамбов) в течении 1998-2009 гг.
Всем пациентам проводилось комплексное клинико-инструментальное исследование, включающее данные клинического обследования невролога, терапевта и офтальмолога, стандартные лабораторные данные, электрокардиографию, флюорографию или обзорную рентгенографию органов грудной клетки. По показаниям были проведены консультации и обследования у нейрохирурга, гинеколога, отоларинголога, кардиолога, эндокринолога и психотерапевта; исследование когнитивной сферы по краткой шкале оценки психического статуса или миниисследование психического статуса, транскраниальная допплерография, электроэнцефалография. Всем пациентам были вьшолнены магнитно—резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА).
Согласно полученным данным, варианты строения и топографии артериального круга большого мозга верифицированы всего в 27 случаях (61,4 % наблюдений) из 44 больных с эпилепсией или энцефалопатиями с ведущими эпилептиформными синдромами. Среди проанализированной группы пациентов с различными видами эпилепсий выявлены следующие варианты строения и топографтии артериального круга большого мозга: 1) изгиб обеих передних мозговых артерий у 1 (3,7 %) пациента; 2) гипоплазия левой позвоночной артерии у 2 (7,4 %) пациентов; 3) задняя трифуркация обеих внутренних сонных артерий и передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 3 (11,1 %) пациентов; 4) передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 6 (22,2 %) пациентов (рис. 1); 5) гипоплазия правой позвоночной артерии, аплазия задней соединительной артерии справа у 4 (14,8 %) пациентов; 6) гипоплазия правой позвоночной артерии, гипоплазия базилярной артерии у 5 (18,5 %) пациентов (рис. 2); 7) передняя трифуркация левой внутренней сонной артерии, гипоплазия задней соединительной артерии` гипоплазия правой задней мозговой артерии у 3 (11,1 %) пациентов;  извитость обеих позвоночных артерий у 2 (7,4 %) пациентов; 9) гипоплазия и извитость обеих позвоночных артерий у 1 (3,7 %) пациента, Ниже приведены достаточно показательные клинические наблюдения из совокупности собственных исследований.
извитость обеих позвоночных артерий у 2 (7,4 %) пациентов; 9) гипоплазия и извитость обеих позвоночных артерий у 1 (3,7 %) пациента, Ниже приведены достаточно показательные клинические наблюдения из совокупности собственных исследований.
Пример 1. Пациентка Н., 54 лет, наблюдается в Узловой поликлинике на ст. Тамбов ОАО «РЖД» с диагнозом: энцефалопатия как неуточненная (эпилептическая и дисциркуляторная) с полиморфными пароксизмами (по типу паралича Тодда) на фоне аномалий строения артерий головного мозга. Жалобы на шум в голове, шаткость при ходьбе, приступы слабости в правых конечностях и потери сознания. Неврологически: в сознании менингознаков нет, когнитивные функции снижены, эмоционально лабильна, зрачки d = s, конвергенция ослаблена, легкая слабость мимических мышц справа, парез правой кисти до 4 баллов, чувствительных нарушений нет, сухожильные рефлексы повышены d > s, в позе Ромберга пошатывание, координаторные пробы выполняет с промахиванием DetS, тремор век. Окулист: гипертонический ангиосклероз сосудов сетчаток обоих глаз. Терапевт: гипертоническая болезнь II степени, степень тяжести артериальной гипертонии II, категория риска 3. БАК: холестерин — 4,5 ммоль/л, β-липопротеиды — 3,5 г/л, креатинин — 69 мкмоль/л, мочевина — 7,9 ммоль/л. Протромбин — 88 %, фибриноген — 4.25 г/л. ЭКГ: син, ритм 80 в мин., нормальное положение ЭОС. МРТ и МРА: отображены на рисунке 1. Амбулаторное лечение: пирацетам, глицин, кавинтон, циннаризин, аминалон, энап, престариум, индопамин. Прошла курс лечения в дневном стационаре: мексидол, магния сульфат, престариум, индопамид, милдронат, эналаприл. Жалобы сохранились прежние. Неврологически — в сознании менингознаков нет, когнитивные функции снижены, черепные нервы без динамики парез правой кисти до 4,5 баллов, в пробе Ромберга пошатывание, координаторные пробы с интенцией с обеих сторон. Консультирована в Тамбовской психиатрической больнице, где поставлен диагноз: последствия органического поражения ЦНС сложного генеза с полиморфными пароксизмами. ЭЭГ: выраженные общемозговые изменения биори биоэлектрической активности, α-активности практически нет. По всем регионам полири менее 5 мкв. Регионарность, реакция активации отсутствуют, усвоения нет. Стойкая дезорганизация деятельности срединных структур. Заинтересованность левой височной области, где выявлен очаг медленноволнового раздражения. Низкое функциональное состояние коры с высокой чувствительностью ее к гипоксии, со снижением порога возбудимости ствола. Одиночные разряды заднестволовых отделов. Сосудистые влияния выражены. Катамнез: на фоне приема депакина-хроно жалобы значительно уменьшились, приступов не отмечено.
Пример 2. Пациент ВН., 21 год, наблюдается в Узловой поликлинике на ст. Тамбов ОАО «РЖД» с диагнозом: эпилепсия с полиморфными церебральными пароксизмами и когнитивными нарушениями. Наблюдается с детства — жалобы на приступы с потерей сознания. После начала лечения с 14 лет в неврологическом отделении Тамбовской областной детской больницы состоял на учете с диагнозом: эпилепсия, парциальные приступы с вторичной генерализацией. ЭЭГ (Психиатрия и наркология, 17.04.02): пароксизмальной активности не выявлено, Неустойчивый α-ритм. Дисфункция диэнцефальной области. Сосудистые влияния с повышенной вегетативной возбудимостью (15.06.04): ОМИ умеренные, но стойкие, с низкоамплитудной дизритмией. Регионарность нечеткая. Реакция активации снижена, усвоения нет. Грубой медленноволновой или пароксизмальной активности не выявлено. Снижена реактивность коры. Высокая вегетативная возбудимость. Сосудистые влияния 22.02.05: по сравнению с 15.06.04, положительная динамика. Общемозговые изменения умеренные, регуляторного характера. Умеренная дисфункция диэнцефальной области с усилением ее активности. Появился неустойчивый α-ритм, фрагментарный. Улучшилась реактивность коры. Несколько повысилась чувствительность коры к РФС, что приводит к снижению порога возбудимости заднестволовых структур. Пароксизмальных тенденций коры нет. Повышена вегетативная возбудимость. МРТ и МРА: отображены на рисунке 2. Неврологически: в сознании менингознаков нет, когнитивные функции несколько снижены, эмоционально лабилен, дистальный гипергидроз, тремор век и вытянутых пальцев рук, зрачки d = s, конвергирует, слабость мимических мышц справа, в позе Ромберга легкое пошатывание, координаторные пробы выполняет, парезов, чувствительных нарушений нет, сухожильные рефлексы d = s, симптом Бабинского слабоположителен с обеих сторон, Эпилептолог: когнитивные расстройства вследствие эпилепсии. Постоянно получает финлепсин (приступы связывает с нерегулярным приемом препарата).
Таким образом, считаем необходимым, сделать следующие выводы. 1. Варианты строения и топографии артериального круга большого мозга могут рассматриваться в качестве предикторов эпилептиформных феноменов структур головного мозга. 2. При различных церебральных пароксизмах, очевидно, есть целесообразность в исследовании артериального круга большого мозга. 3. Варианты строения и топографии артериального круга большого мозга в каждом конкретном случае следует рассматривать с точки зрения малых аномалий развития.
Ишемический инсульт в бассейне задних мозговых артерий: проблемы диагностики, лечения
И.А. ХАСАНОВ, Э.И. БОГДАНОВ
Республиканская клиническая больница МЗ РТ, г. Казань
Казанский государственный медицинский университет
Хасанов Ильдар Акрамович
врач неврологического отделения для больных с острыми нарушениями мозгового кровообращения
420064, г. Казань, ул. Оренбургский Тракт, д. 138, тел. (843) 237-35-47, e-mail
В статье в свете современных данных рассматриваются проблемы диагностики и лечения ишемических инсультов в бассейне задних мозговых артерий (ЗМА) с учетом особенностей их этиологии, клинической картины и данных нейровизуализации.Парные задние мозговые артерии, формирующиеся путем бифуркации базилярной артерии и являющиеся ее терминальными ветвями, служат основными источниками кровоснабжения верхней части среднего мозга, таламусов и задне-нижних частей полушарий головного мозга, включая затылочные доли, медиобазальные отделы височных долей и нижнемедиальные отделы темени.Ишемические инсульты в бассейне задних мозговых артерий составляют, по разным данным, от 5-10 до 25% случаев всех ишемических инсультов.Наиболее частой причиной изолированных инфарктов в бассейне ЗМА является эмболическая окклюзия ЗМА и ее ветвей, которая имеет место примерно в 82% случаев.В 9% случаев в ЗМА выявляется тромбоз in situ, еще в 9% случаев причиной инсульта служат вазоконстрикция, связанная с мигренью, и коагулопатии.Очень редкой причиной инфаркта в данном бассейне может быть и артериальная диссекция, затрагивающая ЗМА.Наиболее частыми и характерными признаками инфарктов в бассейне ЗМА являются зрительные нарушения (гомонимная гемианопсия), центральный парез лицевого нерва, головная боль, нарушения чувствительности, афатические нарушения, гемипарез и ниглект.
Ключевые слова:
ишемический инсульт, инфаркт мозга, задняя мозговая артерия, нейровизуализация, тромболитическая терапия
I.A. KHASANOV, E.I. BOGDANOV
Kazan State Medical University
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Ishemic stroke in a system of posterior cerebral arteries: problems of diagnosis and treatment
In the article on the basis of present knowledge are considered the problems of diagnosis and treatment of ishemic strokes in a system of posterior cerebral arteries (PCA) taking into account their causation, clinical presentation and neuroimaging data.Paired posterior cerebral arteries, which are shaped by basilar artery bifurcation and are its terminal branches, are the main sources of blood supply of the upside of midbrain, thalamus and back and bottom parts of cerebral hemispheres, including occipital lobes, mediobasal branches of temporal lobes and lower medial crown branches.Ishemic strokes in a system of posterior cerebral arteries amount to 5-10% or up to 25% of all ishemic strokes.The most common cause of isolated heart attacks
in a system of PCAistheembolic occlusionof PCAand its branches, which occurs in about 82% of cases.In 9% of cases in PCAisrevealed thrombosis, inother9% of cases the cause of stroke are vasoconstriction associated with migraine, and coagulopathy.A very seldom reason for a heart attack in this system can be artery dissection which affects PCA.The most frequent and characteristic features of heart attacks in a system of PCA are visual impairments (equilateral hemianopsia), central paresis of facial nerve, headache, sensation disorders, aphatic disorders, hemiparesis and neglect.
Key words:
ischemic stroke, cerebrovascular accident, posterior cerebral artery, neuroimaging, thrombolytic therapy.
Ишемические инсульты в бассейне задних мозговых артерий (ЗМА) составляют, по разным данным, от 5-10 до 25% случаев всех ишемических инсультов [1-4]. Они могут явиться причиной целого ряда клинических симптомов, далеко не всегда своевременно и адекватно распознающихся самими пациентами, их родственниками и врачами, ведь остро возникший грубый моторный дефицит, с которым обычно ассоциируется инсульт, в этом случае может быть невыраженным или вовсе отсутствовать. Отсрочка в своевременной диагностике или некорректный диагноз ставят под сомнение возможность проведения больному адекватной терапии (прежде всего тромболизиса), что в свою очередь не может не влиять на исход болезни [5]. Большую роль в постановке диагноза играет возможность использования нейровизуализации, правильный выбор метода и грамотная интерпретация результатов [2]. Видится важным представление и анализ особенностей клинической картины, нейровизуализации и лечения ишемических инсультов в бассейне задних мозговых артерий в свете современных данных.
Наиболее частой причиной изолированных инфарктов в бассейне ЗМА является эмболическая окклюзия ЗМА и ее ветвей, которая имеет место в 82% случаев. При этом кардиогенный генез наблюдается в 41% случаев, в то время как артерио-артериальная эмболия из позвоночных и базилярной артерий — лишь в 32% случаев. У 10% пациентов источник эмболии установить не удается. В 9% случаев в ЗМА выявляется тромбоз in situ. Вазоконстрикция, связанная с мигренью, и коагулопатии являются причинами инфаркта мозга в 9% случаев [6]. Если изолированные инфаркты в бассейне ЗМА в большинстве случаев имеют кардиоэмболическую природу, то вовлечение ствола мозга и/или мозжечка в сочетании с инфарктом в бассейне ЗМА наиболее часто связано с атеросклеротическим поражением сосудов вертебробазилярного бассейна [7, 8]. Очень редкой причиной инфаркта в данном бассейне может быть и артериальная диссекция, затрагивающая ЗМА [9]. Вне зависимости от причины инфаркта обычно он лишь частично захватывает бассейн ЗМА [10, 11].
Парные задние мозговые артерии, формирующиеся путем бифуркации основной артерии и являющиеся ее терминальными ветвями, служат основными источниками кровоснабжения верхней части среднего мозга, таламусов и задне-нижних частей полушарий головного мозга, включая затылочные доли, медиобазальные отделы височных долей и нижнемедиальные отделы темени [10, 12, 13].
На ранних стадиях развития организма человека задняя мозговая артерия представляет собой ветвь внутренней сонной артерии (ВСА) и кровоснабжается из системы каротид, при этом задняя соединительная артерия (ЗСА) исполняет роль ее проксимального сегмента. В последующем кровь в задние мозговые артерии начинает поступать из основной артерии, а ЗСА, являясь ветвью внутренней сонной артерии, становится наиболее значимым анастомозом между каротидным и вертебробазилярным бассейнами. По разным данным, от 17 до 30% взрослых людей имеют фетальный (эмбриональный) тип строения ЗМА, при котором ВСА в течение всей жизни остается основным источником кровоснабжения ЗМА. Фетальный тип строения ЗМА в большинстве случаев наблюдается унилатерально, при этом противоположная ЗМА обычно начинается от асимметрично расположенной, изогнутой базилярной артерии. В случаях, когда обе задние мозговые артерии являются ветвями внутренних сонных артерий, как правило, наблюдаются хорошо развитые крупные задние соединительные артерии, а верхний сегмент базилярной артерии бывает короче, чем обычно (базилярная артерия заканчивается отходящими от нее двумя верхними мозжечковыми артериями). Примерно в 8% случаев обе ЗМА исходят из одной и той же ВСА [7, 8, 12, 14, 15].
ЗСА впадает в ЗМА примерно на 10 мм дистальнее места бифуркации базилярной артерии. Каждую ЗМА условно можно разделить на 3 части: предкоммуникационная часть, или Р1-сегмент по Фишеру, — участок ЗМА проксимальнее места впадения в нее ЗСА, посткоммуникационная часть, или Р2-сегмент, расположенный дистальнее места впадения ЗСА в ЗМА, и конечная (корковая) часть, отдающая ветви к соответствующим областям коры головного мозга [12, 16]. От предкоммуникационной части отходят парамедианная мезенцефалическая, задняя таламоперфорирующая и медиальная задняя хороидальная артерии, участвующие преимущественно в кровоснабжении вентролатеральных ядер таламуса и медиального коленчатого тела. Левая и правая задние таламоперфорирующие артерии могут отходить от общего ствола, называемого артерией Першерона; подобный вариант строения обычно встречается в сочетании с односторонней гипоплазией Р1-сегмента и фетальным строением ЗМА. Ветвями посткоммуникационной части являются педункулярные перфорантные, таламо-геникулятная и латеральная задняя хороидальная артерии, кровоснабжающие латеральное коленчатое тело, дорсомедиальные ядра и подушку таламуса, часть среднего мозга и латеральную стенку бокового желудочка [2, 12, 17]. Основными корковыми ветвями ЗМА являются передняя и задняя височные, теменно-височная и шпорная артерии [10]. Границы водораздела бассейнов средней и задней мозговых артерий значительно колеблются. Обычно границей бассейна ЗМА служит сильвиева борозда, но иногда средняя мозговая артерия кровоснабжает и наружные отделы затылочной доли вплоть до затылочного полюса. При этом ЗМА всегда снабжает кровью участки коры головного мозга в области шпорной борозды, а зрительная лучистость в ряде случаев получает кровь из средней мозговой артерии, соответственно, гомонимная гемианопсия не всегда подразумевает инфаркт в бассейне ЗМА [12].
При ишемических инсультах в бассейне ЗМА в зависимости от локализации окклюзии сосуда, а также от состояния коллатерального кровоснабжения в клинической картине могут выявляться симптомы поражения среднего мозга, таламусов и полушарий головного мозга. В целом до 2/3 всех инфарктов в бассейне ЗМА являются корковыми, таламусы вовлекаются лишь в 20-30% случаев, а средний мозг менее чем в 10% случаев [7, 18, 19]. Соответственно наиболее частым вариантом ишемического инсульта в бассейне ЗМА является изолированный инфаркт полушарий большого мозга, в первую очередь затылочных долей, реже встречается сочетанное поражение таламусов и мозговых полушарий, в небольшом проценте случаев — изолированный инфаркт таламуса и, наконец, комбинация поражения среднего мозга, таламуса и/или гемисфер является наиболее редким вариантом [2].
Иногда наблюдается билатеральное поражение областей мозга, кровоснабжаемых из ЗМА. Это имеет место в первую очередь при синдроме верхушки базилярной артерии (top of the basilar syndrome), который представляет собой эмболическую окклюзию дистального отдела основной артерии и характеризуется угнетением сознания, зрительными нарушениями, глазодвигательными и поведенческими расстройствами, часто без моторной дисфункции [2].
По данным ряда авторов, наиболее частыми и характерными признаками инфарктов в бассейне ЗМА являются зрительные нарушения (до 95% случаев), гомонимная гемианопсия (66,7% случаев), центральный парез лицевого нерва (52% случаев), головная боль, преимущественно в затылочной области (50 случаев), нарушения чувствительности (40% случаев), афатические нарушения (38% случаев), гемипарез (18% случаев) и ниглект (10% случаев). Пациенты обычно имеют комбинацию симптомов [2, 7, 8, 11].
Гомонимная гемианопсия возникает с контрлатеральной стороны при инфарктах в зонах кровоснабжения полушарных ветвей ЗМА вследствие поражения стриарной коры, зрительной лучистости или латерального коленчатого тела. В отсутствие вовлеченности затылочного полюса макулярное зрение остается сохранным. Дефект полей зрения может ограничиваться лишь одним квадрантом. Верхнеквадрантная гемианопсия возникает при инфаркте стриарной коры ниже шпорной борозды или нижней части зрительной лучистости в височно-затылочной области. Нижнеквадрантная гемианопсия — следствие поражения стриарной коры выше шпорной борозды или верхней части зрительной лучистости в теменно-затылочной области. Окклюзия шпорной борозды также может быть ассоциирована с болями в ипсилатеральном глазу. Нарушения зрения могут иметь и более сложный характер, особенно при двустороннем поражении затылочных долей, включая зрительные галлюцинации, зрительную и цветовую агнозию, прозопагнозию (агнозия на знакомые лица), синдром отрицания слепоты (синдром Антона), дефицит зрительного внимания и оптико-моторную агнозию (синдром Балинта). Часто нарушения зрения сопровождаются афферентными нарушениями в виде парестезий, расстройств глубокой, болевой и температурной чувствительности. Последние указывают на вовлечение таламуса, теменной доли либо ствола мозга (вследствие окклюзии проксимальных отделов вертебробазилярного бассейна) [2, 8, 10, 20].
Нейропсихологические нарушения, ассоциированные с инфарктами в ЗМА, значительно варьируют и присутствуют более чем в 30% случаях. Инсульт в бассейне мозолистых ветвей левой ЗМА у правшей, затрагивающий затылочную долю и валик мозолистого тела, проявляется алексией без аграфии, иногда цветовой, предметной или фотографической аномией. Правополушарные инфаркты в бассейне ЗМА нередко вызывают контрлатеральный геминиглект. При обширных инфарктах с вовлечением медиальных отделов левой височной доли или двусторонних мезотемпоральных инфарктах развивается амнезия. Также при моно- или билатеральном мезотемпоральном инфаркте может развиться ажитированный делирий. Обширные инфаркты в бассейне левой задней височной артерии клинически могут проявляться аномией и/или сенсорной афазией. Таламические инфаркты в зонах кровоснабжения пенетрирующих ветвей ЗМА могут вызывать афазию (при заинтересованности левой подушки), акинетический мутизм, глобальную амнезию и синдром Дежерина – Русси (расстройства всех видов чувствительности, грубые дизестезии и/или таламическая боль и вазомоторные нарушения в контрлатеральной половине тела, сочетающиеся с обычно преходящим гемипарезом, хореоатетозом и/или баллизмом). Также инфаркты в бассейне ЗМА могут быть ассоциированы с дискалькулией, пространственной и временной дезориентацией. [6, 12, 21, 22].
Билатеральные таламические инфаркты нередко связаны с глубокой комой. Так, окклюзия артерии Першерона вызывает развитие двусторонних инфарктов в интраламинарных ядрах таламусов, что приводит к тяжелому нарушению сознания [2, 12].
Гемипарез при инфарктах в бассейне ЗМА встречается лишь у 1/5 больных, чаще является легким и преходящим и обычно ассоциирован с вовлечением в патологический процесс ножек мозга [23, 24]. Описаны случаи инфарктов в бассейне ЗМА, когда у больных выявлялся гемипарез без вовлечения ножек мозга. У этих пациентов имело место поражение дистальных отделов ЗМА, в первую очередь заинтересованность таламо-геникулятной, латеральной и медиальной задних хороидальных артерий [23, 25]. Предполагается, что гемипарез при инфарктах в бассейне задних хороидальных артерий может быть связан с поражением кортико-бульбарных и кортико-спинальных трактов, даже при отсутствии видимого поражения внутренней капсулы или среднего мозга по данным нейровизуализации [23]. Существуют мнения, что развитие гемипареза связано со сдавлением внутренней капсулы отечной тканью таламуса [12].
Инфаркты в бассейне ЗМА имитируют инфаркты в каротидном бассейне у 17,8% пациентов [24], особенно при сочетанном поражении поверхностных и глубоких ветвей ЗМА, которое наблюдается приблизительно в 38% случаев [7, 19, 26]. Дифференциальная диагностика бывает затруднена вследствие наличествующих афатических нарушений, ниглекта, сенсорного дефицита, а также обычно легкого и преходящего гемипареза, возникающего вследствие вовлечения пирамидных трактов. Кроме того, нарушения памяти и другие остро возникшие нейропсихологические нарушения могут существенно осложнять обследование таких пациентов [2, 18, 19].
Среди других состояний, нередко клинически имитирующих инфаркты в бассейне ЗМА, следует выделить некоторые инфекционные заболевания (в первую очередь токсоплазмоз), синдром задней обратимой лейкоэнцефалопатии, неопластические поражения, как первичные, так и метастатические, и таламические инфаркты, вызванные тромбозом глубоких мозговых вен [2, 27]. Зачастую при постановке диагноза определяющую роль играют методы нейровизуализации.
Основными требованиями к нейровизуализации в острейшем периоде ишемического инсульта являются быстрота проведения исследования и информативность полученных данных. Главными задачами, стоящими перед врачом при использовании этих методов, являются исключение неишемической причины симптомов у пациента, определение локализации и размеров ишемических очагов и наличия жизнеспособной мозговой ткани, определение состояния церебральных сосудов, выявление отека мозга и смещения срединных структур, а также наличия геморрагического пропитывания ишемических очагов. Эти данные должны помочь в скорейшем определении тактики лечения пациента — возможности проведения внутривенного или внутриартериального тромболизиса, механического удаления бляшки, операции по декомпрессии головного мозга [28, 29].
Компьютерная томография (КТ) обычно не выявляет ишемические изменения в паренхиме мозга в течение первых нескольких часов от начала инсульта, времени, наиболее важном для начала терапии, а иногда даже и в более поздние сроки заболевания. Особенно затруднительна визуализация задних отделов мозга вследствие артефактов, обусловленных костями черепа. Однако при инсультах в бассейне ЗМА, как и при инсультах в бассейне средней мозговой артерии, в ряде случаев КТ может показывать гиперинтенсивный сигнал от самой ЗМА, что является наиболее ранним признаком инсульта в ее бассейне и выявляется в 70% случаях в течение первых 90 минут от начала заболевания и в 15% случаях в сроки от 12 до 24 часов. Данный признак появляется за счет визуализации кальцифицированного эмбола или атеротромбоза in situ. На стандартной КТ плоскость срезов параллельна орбито-меатальной линии (линии, соединяющей наружный угол глаза с наружным слуховым проходом и далее идущей к первому шейному позвонку). Исходя из хода СМА ее просвет обычно визуализируется на одном срезе, что позволяет легко выявить гиперденсную СМА, особенно при наличии атрофических изменений мозга. Ход ЗМА более сложен. Обычно проксимальный ее сегмент восходит латерально вокруг ножек мозга и, достигая обводной цистерны, идет горизонтально внутрь к височной доле, в непосредственной близости от намета мозжечка. Циркулярная часть (Р1- и Р2-сегменты) заканчивается в квадригеминальной цистерне, где начинается кортикальная часть ЗМА. Только Р2-сегмент идет параллельно срезу внутри обводной цистерны и, соответственно, гиперденсность, при ее наличии, наиболее вероятно может быть обнаружена в этой области. Впоследствии КТ-признаки ишемических изменений проявляются в виде участков гипоинтенсивности в паренхиме головного мозга [2, 3, 30].
Магнитно-резонансная томография (МРТ) позволяет более точно определить наличие и характер ишемических изменений в головном мозге при инсульте. Получение диффузионно-взвешенных изображений (DWI) позволяет выявлять ранние ишемические изменения, часто в течение часа от начала симптомов, и определять локализацию и распространенность очагов более точно, чем КТ [2]. Совместное использование режимов DWI, ADC и FLAIR позволяет дифференцировать острые, подострые и хронические ишемические изменения в паренхиме мозга, а также отличать цитотоксический отек мозга, наблюдающийся при ишемическом инсульте, от вазогенного отека при синдроме задней обратимой лейкоэнцефалопатии и гипертонической энцефалопатии [2, 27, 31, 32].
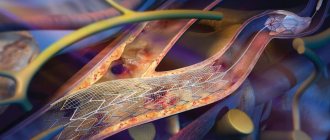
В неинвазивной диагностике стено-окклюзивного поражения крупных экстра- и интракраниальных артерий немалую роль играет КТ ангиография (КТА). Эта методика позволяет выявить степень стеноза, морфологию бляшки, а также наличие артериальной диссекции как при поражениях сосудов вертебробазилярного, так и каротидного бассейнов. Кроме того, оцениваются анатомические особенности коллатералей и вариантов циркуляции ЗМА [2, 33, 34]. Дополнительную информацию о сосудистой анатомии можно получить с помощью МР ангиографии с контрастированием, которая в сочетании с КТА позволяет оперировать данными, которые раньше можно было получить только с помощью классической ангиографии. Кроме того, эти методы имеют значение в оценке эффективности тромболитической терапии в случае артериальной реканализации [2].
В настоящее время тромболитическая терапия ишемического инсульта может применяться при поражении артерий как каротидного, так и вертебробазилярного бассейнов. Тем не менее все существующие на сегодняшний день руководства по проведению тромболизиса ориентированы в первую очередь на сосудистую катастрофу в каротидном бассейне, в первую очередь средней мозговой артерии; это связано прежде всего с наличием у таких пациентов явного неврологического дефицита в виде грубых парезов и нарушений чувствительности. Типичный функциональный дефицит у больного с инфарктом в бассейне ЗМА в острейшем периоде не всегда расценивается врачом как инвалидизирующий. Оценка неврологического дефицита по шкале инсульта национального института здоровья (NIHSS), являющаяся одним из критериев отбора пациентов для тромболитической терапии, обычно не в состоянии в полной мере отразить тяжесть состояния больного с инфарктом в вертебробазилярном бассейне [7]. По отношению к изолированному дефекту зрительных полей при остром инфаркте в бассейне ЗМА вообще не существует каких-либо рекомендаций [2]. Поэтому тромболитическая терапия у больных с инфарктами в бассейне ЗМА используется недостаточно широко. Тем не менее, учитывая, что гемипарез в ряде случаев является значительной клинической составляющей инфарктов в бассейне ЗМА, таким пациентам при отсутствии противопоказаний обоснованно проводится системный и/или внутриартериальный тромболизис [35].
При сравнении профилей эффективности и безопасности внутривенного тромболизиса, проводимого в течение первых трех часов от появления симптомов, у пациентов с инфарктами в каротидном бассейне и инфарктами в бассейне ЗМА значимой разницы в безопасности и исходе лечения обнаружено не было [7]. При этом, по данным ряда авторов, при проведении внутривенной тромболитической терапии при ишемических поражениях в вертебробазилярном бассейне, и в частности ЗМА, возможно расширение терапевтического окна до 6,5-7 часов и даже больше по сравнению с 4,5 часами при инфарктах в каротидном бассейне [36, 37].
Проведение внутриартериального тромболизиса при окклюзии средней мозговой артерии рекомендуется в течение не позднее 6 часов от начала симптомов, при окклюзии основной артерии — не позднее 12 часов [28]. При этом на сегодняшний день не существует четких рекомендаций по временным пределам при проведении внутриартериального тромболизиса у пациентов с поражением ЗМА [15]. N. Meier и соавт. (2011) описали 9 случаев внутриартериального тромболизиса у пациентов с окклюзией ЗМА в течение первых 6 часов от начала заболевания. Через 3 месяца после лечения функциональная независимость (по модифицированной шкале Ренкина 0-2 балла) была выявлена у 67% пациентов, что соотносится с аналогичными данными по каротидному бассейну [15].
Установленный на ранних сроках диагноз ишемического инсульта в бассейне ЗМА позволяет врачу своевременно определить тактику лечения пациента и рассмотреть при отсутствии противопоказаний возможность проведения тромболитической терапии, что, несомненно, делает прогноз для больного более благоприятным.
ЛИТЕРАТУРА
1. Brandt T., Steinke W., Thie A., Pessin M.S., Caplan L.R. Posterior cerebral artery territory infarcts: clinical features, infarct topography, causes and outcome. Multicenter results and a review of the literature // Cerebrovasc. Dis. — 2000. — Vol. 10. — P. 170–182.
2. Finelli P. Neuroimaging in acute Posterior Cerebral Artery Infarction // The Neurologist. — 2008. — Vol. 14. — P. 170-180.
3. Krings T., Noelchen D., Mull M. et al. The hyperdense posterior cerebral artery sign // Stroke. — 2006. — Vol. 37. — P. 399-403.
4. Hill M.D. Posterior cerebral artery stroke // e-medicine, 2005.
5. Хасанов И.А. Особенности инфарктов в бассейне задних мозговых артерий // Неврологический вестник. — 2012. — Т. XLIV, вып. 3. — С. 69-74.
6. Caplan L. Posterior Circulation Ischemia: Then, Now, and Tomorrow: The Thomas Willis Lecture-2000 // Stroke. — 2000. — Vol. 31. — P. 2011-2023.
7. Breuer L., Huttner H.B., Jentsch K. et al. Intravenous Thrombolysis in Posterior Cerebral Artery Infarctions // Cerebrovasc Dis. — 2011. — Vol. 31. — P. 448-454.
8. Caplan L., Bogousslavsky J. Posterior cerebral artery syndromes // Cerebrovascular Disease: Pathology, Diagnosis and Management. — 1998. — P. 1028.
9. Caplan L., Estol C., Massaro A. Dissection of the posterior cerebral arteries // Arch Neurol. — 2005. — Vol. 62. — P. 1138-1143.
10. Бразис П. Топическая диагностика в клинической неврологии / П. Бразис, Д. Мэсдью, Х. Биллер — М.: МЕДпресс-информ, 2009. — 736 с.
11. Caplan L. Posterior Circulation disease: Clinical Findings, Diagnosis and Management / Boston, MA: Butterworth-Heinemann, 1996. — 533 p.
12. Бер М. Топический диагноз в неврологии по Петеру Дуусу / М. Бер, М. Фрот-шер. — М.: Практическая медицина, 2009. — 468 с.
13. Tatu L., Moulin T., Bogousslavsky J. et al. Arterial territories of the human brain // Neurology. — 1998. — Vol. 50 — P. 1699-1708.
14. de Monye C., Dippel D.W., Siepman T.A. et al. Is a fetal origin of the posterior cerebral artery a risk factor for TIA or ischemic stroke? A study with 16-multidetector-row CT angiography // J. Neurol. — 2008. — Vol. 255 — P. 239-245.
15. Meier N., Fischer U., Schroth G. Outcome after thrombolysis for acute isolated posterior cerebral artery occlusion // Cerebrovasc. Dis. — 2011. — Vol. 328. — P. 79-88.
16. Phan T., Fong A., Donnan G. et al. Digital map of posterior cerebral artery infarcts associated with posterior cerebral artery trunk and branch occlusion // Stroke. — 2007. — Vol. 38. — P.1805-1811.
17. Chaves C.J. Posterior cerebral artery. Stroke syndromes. 2nd edition / Chaves C.J., Caplan L.R. Cambridge, New York: Cambridge University Press. — 2001. — 747 p.
18. Cals N., Devuyst G., Afsar N. et al. Pure superficial posterior cerebral artery territory infarction in the Lausanne Stroke Registry // J. Neurol. — 2002. — Vol. 249. — P. 855-861.
19. Kumral E., Bayulkem G., Atac C., Alper Y. Spectrum of superficial posterior cerebral artery territory infarcts // Eur. J. Neurol. — 2004. — Vol. 11. — P. 237-246.
20. Ng Y.S., Stein J., Salles S.S. et al. Clinical characteristics and rehabilitation outcomes of patients with posterior cerebral artery stroke // Arch. Phys. Med. Rahabil. — 2005. — Vol. 86. — P. 2138-43.
21. Brandt T., Thie A., Caplan L. et al. Infarkte in Versorgungsgebiet der A. cerebri Posterior // Nervenarzt. — 1995. — Vol. 66. — P. 267-274.
22. Savitz S.I., Caplan L.R. Vertebrobasilar disease // N. Engl. J. Med. — 2005. — Vol. 352. — P. 2618-26.
23. Finelli P. Magnetic Resonance Correlate of Hemiparesis in Posterior Cerebral Artery Infarction // Journal of Stroke and Cerebrovascular Disease. — 2008. — Vol. 17. — P. 378-381.
24. Maulaz A.B., Bezerra D.C., Bogousslavsky J. Posterior cerebral artery infarction from middle cerebral artery infarction // Arch. Neurol. — 2005. — Vol. 62. — P. 938-941.
25. Neau J.-P., Bogousslavsky J. The syndrome of posterior choroidal artery territory infarction // Ann. Neurol. — 1996. — Vol. 39. — P. 779-788.
26. Lee E., Kang D.W., Kwon S.U., Kim J.S. Posterior cerebral artery infarction: diffusion-weighted MRI analysis of 205 patients // Cerebrovasc. Dis. — 2009. — Vol. 28. — P. 298-305.
27. Богданов Э.И., Хасанов И.А., Мамедов Х.И. и др. Cиндром задней обратимой лейкоэнцефалопатии у больных с преэклампсией и эклампсией // Неврологиче-ский журнал. — 2011. — № 5. — С. 35-40.
28. Adams H., Del Zoppo G., Alberts M. et al. Guidelines for the early management of adults with ischemic stroke // Stroke. — 2007. — Vol. 38. — P. 1655-1711.
29. Wahlgren N., Ahmed N., Davalos A. et al. Thrombolysis with alteplase for acute ischemic stroke & the Safe implementation of thrombolysis in stroke — monitoring study (SITS-MOST): an observational study // Lancet. — 2007. — Vol. 369. — P. 275-282.
30. Berge E., Nakstad P.H., Sandset P.M. Large middle cerebral artery infarctions and the hyperdense middle cerebral artery sign in patients with atrial fibrillation // Acta Radiol. — 2001. — Vol. 42. — P. 261-268.
31. Covarrubias D.J., Leutmer P.H., Caumpeau N.G. Posterior reversible leukoencephalopathy syndrome: prognostic utility of quantitative diffusion-weighted MR image // AJNR Am J. Neuroradiol. — 2002. — Vol. 23, N 6. — P. 1038-1048.
32. Garg R. Posterior leukoencephalopathy syndrome // Postgrad. Med. J. — 2001. — Vol. 77, N 903. — P. 24-28.
33. Choi C., Lee D., Lee J. et al. Detection of intracranial atherosclerotic steno-occlusive disease with 3D time-of-flight magnetic resonance angiography with sensitivity encoding at 3T // AJNR Am J. Neuroradiol. — 2007. — Vol. 28. — P. 439-446.
34. Lev M., Farkas J., Rodrigues V. et al. CT angiography in the rapid triage of patients with hyperacute stroke to intraarterial thrombolysis: accuracy in the detection of large vessel thrombus // J Comput Assist Tomogr. — 2001. — Vol. 25. — P. 520-528.
35. Ntaios G., Spengos K., Vemmou A. M. et al. Long-term outcome in posterior cerebral artery stroke // European Journal of Neurology. — 2011. — P. 156-162.
36. Forster A., Gass A., Kern R. et al. MR Imaging-Guided Intravenous Thrombolysis in Posterior Cerebral Artery Stroke // AJNR Am J. Neuroradiol. — 2011. — Vol. 32. — P. 419-421.
37. Montavont A., Nighoghossian N., Derex. L et al. Intravenous r-TPA in vertebrobasilar acute infarcts // Neurology. — 2004. — Vol. 62. — P. 1854-1856.