ДМЖП. Кто сталкивался?
@Мама_с_этого_года Всем здравствуйте! Хочу поделиться нашей историей! Моя беременность проходила хорошо, пару раз за беременность была лёгкая простуда никаких серьёзных препаратов не принимала, всё само проходило. По УЗИ у плода тоже никаких отклонений обнаружено не было. Роды были естественные прошли отлично. Нервы начались на второй день после рождения нашего сыночка. При обходе доктор услышал шумок, но тут меня сразу успокоил, что такое бывает, послушает ещё завтра. На следующий день шумок усилился, малыша записали на узи сердца. А дальше всё как во сне, пришёл кардиолог и озвучил диагноз: ВПС- дефект межжелудочковой перегородки перимембранозный 4,5 мм. Слёзы, страх, чтение всех форумов, статьи, в которых написано, что данные дефекты сами не заживают. Через четыре дня нас переводят в Детскую больницу имени Башляевой, там мы проводим три ужасных недели, туда по средам приезжает специалист из Бакулевки и делает экспертное УЗИ, цифры по дефекту, которые озвучивают там вводят меня в полную депрессию — 8,5 мм. Там ребёнка поят лекарствами Верашпирон, Дигоксин. Через три недели намеряют дефект 7,2 мм и выписывают нас домой вставать на учёт у кардиолога в поликлинике. Также в больнице нам сказали, что операция неизбежна до года на открытом сердце. Ещё находясь в больнице, я записалась к кардиологам в Морозовскую и Филатовскую больницы. Дома продолжали давать все лекарства. Сначала приехали на приём в Морозовскую больницу там на УЗИ намерили 5 мм дефекта и сказали, что с ним есть шанс дождаться операции в лет 5 через окклюдер, мы немного выдохнули. В Филатовскую больницу мы записались к Крюкову В.А. он намерил 4,5 мм и сказал, что по своему опыту думает, что у нас дефект должен закрыться. Далее мы записались к Беляевой М.М. также в Филатовской больнице, она намерила также 4,5 мм, но в прогнозах не была столь оптимистична. Решили встать на учёт у неё. А дальше сначала каждый месяц, потом каждые два, три месяца мы ездили на УЗИ и с каждым разом дефект становится меньше. Ребёнок хорошо набирал вес, был активным, абсолютно не было похоже, что у него есть ВПС. Так в 9 месяцев мы опять отправились на очередное УЗИ, которое проводил Корноухов Ю.Ю. и о счастье слова, которые мечтают услышать все родители, ваш ребёнок ЗДОРОВ!!! Представляете, ЗДОРОВ! Затянулся наш дефект за 9 месяцев. Нас все поздравили и отправили с миром домой. При этом врач сказал, что многие родители, услышав такой- же или похожий диагноз спешат делать операцию, а ведь очень часто такие дефекты закрываются и мы тому подтверждения! Вывод: консультируйтесь с несколькими врачами из разных клиник, не спешите принимать серьёзные решения, если время позволяет, также нам сказали, что хороший набор веса у ребёнка положительно сказывается на излечении. Нам 9 месяцев мы весим 11 кг. Ну и конечно Вера и молитвы Богу. Пусть все детки будут здоровы.
Изолированный дефект межжелудочковой перегородки (ДМЖП)
Дефект межжелудочковой перегородки — самый частый врожденный порок сердца. Дефект, т.е. отверстие в перегородке, разъединяющей правый и левый желудочки, бывает единственным нарушением нормального развития сердца, и тогда говорят об изолированном дефекте или частью другого, более сложного порока, например, тетрады Фалло. В этом разделе мы будем обсуждать только изолированные дефекты.
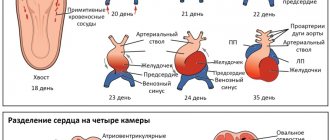
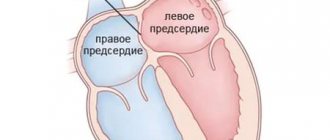
Межжелудочковая перегородка — это мощная мышечная преграда, образующая внутренние стенки как правого, так и левого желудочка, и в каждом — составляющая примерно 1/3 их общей площади. Она так же участвует в процессе сокращения и расслабления сердца при каждом цикле, как и остальные части желудочковых стенок. У плода она образуется из трех составных частей. На 4-5-ой неделе беременности все эти составные части должны точно сопоставиться и соединиться друг с другом, как в конструкторе Лего. Если же этого, по каким-то причинам, не происходит, в перегородке остается отверстие, или дефект. Вскоре после рождения
и установления нормального кровотока в обоих кругах кровообращения, возникает значительная разница в давлении между левым и правым желудочками. И тогда кровь из левого желудочка начинает нагнетаться одновременно и в аорту, т.е. туда, куда и следует, и через дефект — в правый желудочек, где ее быть не должно. Т.е. при каждой систоле происходит сброс слева — направо. В такой ситуации правый желудочек вынужден работать с увеличенной нагрузкой, чтобы перекачать этот лишний объем, да к тому же, уже окисленной крови, снова в легкие и в левые отделы.
Величина сброса зависит от размера и положения дефекта: он может быть небольшим
и почти не сказываться на работе сердца, а может быть огромным, диаметром с устье аорты.
Типы дефектов межжелудочковой перегородки
Несколько слов о типах дефектов. Они могут быть «типичными», т.е. наиболее часто встречающимися, и занимать участок верхней части перегородки. Они могут быть мышечными, т.е. располагаться ближе к верхушке, и, наконец, высокими, под клапанами легочной артерии, единичными или множественными (т.е. больше одного).
Рассмотрим наиболее частый и «хороший» вариант. Ребенок родился нормального веса, доношенным и, конечно, очень красивым. Но вам уже в роддоме сказали, что у него есть «шум в сердце». Если там или где-то рядом есть аппарат для эхокардиографии и детский кардиолог — надо обязательно сделать исследование, чтобы понять, из-за чего этот шум, важно ли это, или — нет, скажется ли это в последующем.
Но вот предположим, что на УЗИ дефект увидели, и диагноз поставлен. Ребенок, однако, выглядит нормально, хорошо ест и прибавляет в весе, ничем не болеет и, собственно, кроме шума в сердце, ни вас, ни его ничего не расстраивает. Запомните: чем громче шум, тем меньше дефект. Это ситуация, к которой замечательно подходит название известной пьесы В.Шекспира «Много шума из ничего». Сброс, который дает этот шум, можно иногда даже прощупать, если положить ладонь на левую сторону грудной клетки ребенка. Но для того, чтобы успокоиться, надо убедиться, что шум обязан
только небольшому дефекту
межжелудочковой перегородки и ничему другому. А для этого надо, чтобы вас наблюдал детский кардиолог, и каждые три месяца производили снятие электрокардиограммы и УЗИ.
В большинстве случаев, примерно в 65-75%, такие дефекты закрываются сами, спонтанно, и, если не появились дополнительные симптомы, можно спокойно ждать 4-5 и даже более лет. Но, если ребенок достиг школьного возраста, оставаясь бессимптомным, то вам, тем не менее, могут операцию предложить. Дело в том, что при заболевании ребенка какой-либо детской инфекцией или даже при простом удалении испорченного зуба при наличии дефекта межжелудочковой перегородки возможно развитие эндокардита, т.е. воспалительного процесса внутренней оболочки сердечных камер. И, хотя такая вероятность очень мала — всего 1-2% случаев, она существует. В таком случае дефект закрывают скорее из профилактических, чем клинических соображений и никто не доказал, что этого не нужно делать.
Однако, прежде чем дать согласие на операцию, в таком случае, пожалуйста, не обижая никого
, постарайтесь узнать, какой опыт имеется в том лечебном учреждении, куда вы обратились, какие там результаты операций, какова степень риска.
Поскольку состояние ребенка практически нормальное, а риск любого вмешательства всегда есть, то надо спокойно взвесить все. Нет, мы далеки от того, чтобы призвать вас отказаться от операции. Мы только хотим посоветовать быть очень обстоятельными, ведь никто никогда письменных гарантий вам не даст: операция есть операция, даже если ее производят в рентгенохирургическом кабинете (как вам, скорее всего, и предложат) и осложнения всегда возможны, а вы подпишете документ, подтверждающий ваше согласие. И окончательное решение — это ваша ответственность.
И еще — никогда не внушайте такому ребенку, что у него —
больное сердце.
Не ограждайте его от доступных ему физических нагрузок,
не делайте из него «инвалида».
Излишнее «оберегание» и запреты могут привести к самым неблагоприятным последствиям в формировании его характера.
Но это — отдельная тема, и она касается не только ДМЖП.
Большие дефекты — это уже другая история, гораздо более опасная. Сразу после первого вздоха ребенка поток крови из левого желудочка делится на два — в аорту и в дефект, и они равны по объему! В тяжелой ситуации оказывается не только сердце, но и сосуды легких: правые отделы и сосуды легких переполняются возросшим объемом лишней крови, поступающей через дефект. Важнейшими показателями такого развития событий является давление в легочной артерии и величина сброса. Эти данные дает сегодня УЗИ и, конечно, зондирование полостей сердца. Повышение давления в малом круге говорит о легочной гипертензии — самом грозном последствии большого сброса слева — направо. Внешне все более или менее образуется. Включаются многочисленные механизмы компенсации: увеличивается мышечная масса желудочков, приспосабливаются и сосуды легких, вначале принимая в себя излишний объем крови, потом — утолщая стенки артерий и артериол, делая их более плотными и менее эластичными. Этот период — опасный, т.к. состояние ребенка может клинически существенно улучшиться, но это улучшение обманчиво, и момент оперативного вмешательства может быть упущен. Если эта ситуация продолжается довольно долго — несколько месяцев или лет, то в какой-то момент давления в правом и левом желудочках — сравниваются во все фазы сердечного цикла и сброса через дефект уже не происходит
. А потом давление в правом желудочке может оказаться
выше,
чем в левом и тогда начинается так называемый «
обратный сброс
», или венозная кровь будет через дефект поступать в артериальную систему — в большой круг. Больной
«синеет».
Мы нарисовали эту картину, чтобы было понятно, что такой порок, как дефект межжелудочковой перегородки, который очень просто и безопасно закрыть на
ранних стадиях
, становится пороком, при котором закрытие теряет свой смысл, и оперировать уже поздно. Речь тут идет, напомним, только о
больших дефектах
или о тех случаях, когда отверстий в перегородке — несколько. К счастью, это бывает значительно реже, чем в большинстве случаев.
На что же надо обращать внимание, чтобы вовремя избежать такого развития событий?
Все сказанное выше относится только к дефектам межжелудочковой перегородки, протекающим абсолютно без жалоб, у вполне здоровых (в остальном) детей без каких-либо других признаков недостаточности сердца. На что при этом пороке надо обращать внимание?
Главный показатель периода новорожденности — прибавка веса. Предположим, грудной ребенок ест плохо, и поэтому мало прибавляет в весе. Аппетит у него нормальный, но из-за одышки ему трудно сосать, а ведь пока это его главная и довольно тяжелая работа. Он много плачет, потому что никогда не может насытиться. У детей постарше на этом фоне случаются частые простуды, которые становятся длительными и могут переходить в воспаление легких. Так может продолжаться несколько месяцев, и, если причина — ДМЖП, такой ребенок должен быть под постоянным наблюдением кардиолога, а если явления не проходят, вероятно, он будет получать сердечные препараты в виде дигоксина или наперестянки — старый добрый препарат, улучшающий работу сердца, а может быть, даже легкие мочегонные средства. У него сейчас — признаки сердечной недостаточности, с которой можно бороться консервативно. Но только пока.
Когда же надо закрывать такой большой дефект?
На фоне лекарственной терапии симптомы могут пройти или значительно уменьшиться. Но если ничего не меняется, если размеры сердца увеличиваются и размеры дефекта на УЗИ остаются прежними – надо обращаться к хирургам.
В первые несколько месяцев жизни дефекты межжелудочковой перегородки, даже большие, могут уменьшиться или закрыться самостоятельно. Если ребенку лучше не становится — ждать нельзя, поскольку ситуация может перейти в ту, которую мы описали вначале, и оперировать будет уже поздно.
Самые лучшие результаты
хирургии бывают после устранения больших ДМЖП в возрасте
до двух-двух с половиной лет
, когда у ребенка есть признаки сердечной недостаточности. Тогда еще все процессы обратимы. Сердце быстро понимает, что ему теперь намного легче, чем раньше. Оно быстро уменьшается в размерах и кровоток в обоих кругах нормализуется.
После операции ребенок практически здоров и нет никаких оснований причислять его к группе так называемых «инвалидов детства», как это иногда делают в лечебных учреждениях. Он может все
, и быстро забудет о том, что с ним было, и кроме рубца на груди, ему об этом ничего не будет напоминать.
Итак, вам предлагают операцию, которая теперь уже необходима
и абсолютно показана. Только она излечит ребенка и уберет от вас постоянное чувство угрозы его жизни. Оперирующий хирург расскажет вам, о чем идет речь в вашем случае, и что он собирается делать. Технические трудности (например, необходимость закрытия не одного, а нескольких дефектов) могут сделать операцию более сложной и продолжительной. При необычной, редкой ситуации хирург обязательно все вам объяснит, а ваша задача — попытаться понять все, что вам скажут, задать нужные вопросы и успокоиться.
Операция устранения дефекта межжелудочковой перегородки относится к открытым
, поскольку нужно вскрыть полости сердца, и поэтому она делается с применением искусственного кровообращения.
Дефекты межжелудочковой перегородки закрывают ушиванием отверстия (т.е. просто накладывают несколько швов) или, чаще всего, с помощью заплатки из синтетического (или специальным образом обработанного биологического) материала, который быстро покрывается собственной тканью сердца.
Сейчас применяют и рентгенохирургические методы закрытия дефектов, но это не всегда возможно, зависит от анатомической локализации дефекта, да и квалификации рентгенохирурга тоже. Традиционная операция по поводу дефектов межжелудочковой перегородки — одна из самых частых и отработанных в хирургии врожденных пороков сердца, а результаты ее — отличные. Так что при наличии показаний сомневаться вам не надо.
Радикальную операцию можно сделать не всегда. При очень большом дефекте у ребенка слишком малого веса, истощенного, с признаками сердечной недостаточности, которая не поддается консервативному лечению, сам фактор большой операции с искусственным кровообращением может быть опасным, особенно, когда речь идет о детях первых месяцев жизни
. И тогда есть выход: разбить хирургическое лечение на два этапа – вначале помочь сердцу улучшить его состояние, а затем уже окончательно закрыть дефект.
Можно уменьшить сброс из левого желудочка в правый путем увеличения сопротивления выбросу из правого желудочка. Этим мы достигнем, снижения давления в системе легочной артерии, во-первых, ниже искусственно созданного препятствия кровотоку, выравним давление в правом и левом желудочках выше него (препятствия) и, в результате, и уменьшается объем самого сброса. А достигается это просто: на легочную артерию выше ее клапанов накладывают манжетку, которая сузит артерию примерно в ½ просвета.
Препятствие кровотоку, созданное искусственно, дает нам желаемый гемодинамический результат. Вторую операцию делается через несколько месяцев, не больше. Ни в коме случае нельзя ждать несколько лет, хотя состояние ребенка может и не внушать уже никаких опасений.
Однако послеоперационный период после операции суживания легочной артерии очень непростой, дети тяжело переносят это вспомогательное вмешательство, и именно поэтому сейчас мы стремимся к одномоментной радикальной коррекции порока. Даже тяжелые дети быстрее выходят из состояния сердечной недостаточности после радикальной коррекции порока, все угрожающие жизни симптомы постепенно исчезают.
Операция сужения легочной артерии — «вспомогательная». Она должна быть на вооружении там, где нет условий для безопасного проведения и выхаживания деток радикальной коррекции
.
Заключительный этап лечения состоит из удаления этой манжеты
и
закрытия дефекта
. Она делается уже в условиях искусственного кровообращения и не сопряжена с большим риском, особенно когда между ней и первым этапом прошел относительно небольшой срок.
Подведем итог. ДМЖП — частый врожденный порок, который может сопровождаться ранним появлением сердечной недостаточности, а в дальнейшем развитием необратимой легочной гипертензии.
Хирургическое лечение является единственным методом и позволяет полностью устранить порок и его последствия. Оно должно быть своевременным, а сама операция – безопасной. Операция может быть элективной или неотложной, но почти никогда экстренной. В некоторых случаях ее можно разделить на два этапа с промежутком в 6-12 месяцев. Появление у ребенка признаков «обратного сброса» при изолированном ДМЖП – признак упущенного времени. И при всех современных методах обследования такое осложнение никак и ничем не может быть оправдано, а часть вины ляжет и на вас, так как вы тоже не замечали или не хотели замечать того, что момент был упущен.
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации
Лечение дефекта
Лечение не требуется в двух случаях: если дефект состоит из мышечной ткани (вне зависимости от размера и локализации от него можно ожидать самостоятельного закрытия), а также, если отверстие небольшое, а ребенку не более двух лет. Маленькие повреждения могут затягиваться в раннем детском возрасте – поэтому требуется только наблюдение.
Остальным пациентам необходима специфическая операция – закрытие дефекта межжелудочковой перегородки. Несмотря на то, что процедуру стараются провести как можно раньше, иногда требуется выждать некоторое время. В таком случае назначают поддерживающую медикаментозную терапию, призванную снизить нагрузку на сердечную мышцу и поддержать сосуды. Существует два принципиально разных подхода к хирургии: эндоваскулярное лечение и открытая операция. Последний вариант сложный технически – требуется специальное оборудование для поддержания искусственного кровообращения, а реабилитационный период может протекать с осложнениями.
Врожденные пороки сердца у детей с синдромом Дауна
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Преимущества эндоваскулярной операции
Это относительно молодой метод лечения – эндоваскулярные операции на сердце стали возможны в 21 веке. Эндоваскулярным называют лечение, которое не требует хирургического полостного вмешательства. Операцию выполняют с помощью специального устройства, которое называется окклюдер.
Эндоваскулярное лечение подходит большей части пациентов с дефектом межжелудочковой перегородки. Операцию можно проводить для детей, если они достигли веса в 5 кг – у тех, кто меньше, недостаточный просвет сосудов. Если позволяет состояние пациента, то процедуру лучше провести как можно быстрее. Для детей рекомендованный интервал – от 1 года до 3.
Для проведения манипуляций требуется рентгенооперационная – это стерильное помещение, оснащенное специальным оборудованием для контроля над манипуляциями хирурга. Окклюдер – это устройство, которое раскрывается и выполняет функцию заплатки. Его помещают в катетер, который проводят к сердцу через крупный сосуд. Таким образом, не требуется никаких разрезов или повреждений. Достаточно одного прокола в месте введения катетера – обычно это бедро или верхняя конечность. Правильно установленный окклюдер перекрывает патологический сброс крови из одного желудочка в другой. Если он установлен неправильно или смещается после операции, достаточно повторить все манипуляции снова и установить его в нужное положение.
Продолжительность процедуры – не более 2-3 часов. Длительная госпитализация не требуется – достаточно наблюдения в течение суток в палате интенсивной терапии. Еще через 24 часа пациента выписывают из больницы. После этого требуются регулярные консультации у кардиолога и проведение контрольно-диагностических мероприятий для того, чтобы убедиться, что окклюдер не смещается. Осложнения случаются крайне редко, большая часть приходится на первые сутки. В течение полугода окклюдер покрывается клетками сердца и полностью «приживается». После этого риски минимальны.
Публикации в СМИ
Дефект межжелудочковой перегородки (ДМЖП) — ВПС с наличием сообщения между правым и левым желудочками.
Этиология • Врождённые пороки (изолированный ДМЖП, составная часть комбинированного ВПС, например тетрада Фалло, транспозиция магистральных сосудов, общий артериальный ствол, атрезия трёхстворчатого клапана и др.) • Существуют данные об аутосомно-доминантном и рецессивном типах наследования. В 3,3% случаев у прямых родственников больных с ДМЖП также обнаруживают этот порок • Разрыв межжелудочковой перегородки при травмах и ИМ.
Статистические данные • ДМЖП составляет 9–25% всех ВПС • Выявляют у 15,7% живорождённых детей с ВПС • Как осложнение трансмурального ИМ — 1–3% • 6% всех ДМЖП и 25% ДМЖП у грудных детей сопровождаются открытым артериальным протоком, 5% всех ДМЖП — коарктацией аорты, 2% врождённых ДМЖП — стенозом клапана аорты • В 1,7% случаев межжелудочковая перегородка отсутствует, и такое состояние характеризуют как единственный желудочек сердца • Соотношение мужского и женского пола — 1:1.
Патогенез. Степень функциональных нарушений зависит от величины сброса крови и общего лёгочного сосудистого сопротивления (ОЛСС). При сбросе слева направо и отношении лёгочного минутного объёма кровотока к системному (Qp/Qs) менее 1,5:1 лёгочный кровоток возрастает незначительно, и повышения ОЛСС не происходит. При больших ДМЖП (Qp/Qs более 2:1) значительно увеличиваются лёгочный кровоток и ОЛСС, и давления в правом и левом желудочках выравниваются. По мере увеличения ОЛСС возможно изменение направления сброса крови — он начинает происходить справа налево. Без лечения развиваются правожелудочковая и левожелудочковая недостаточность и необратимые изменения лёгочных сосудов (синдром Айзенменгера).
Варианты ДМЖП • Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, часто закрываются самопроизвольно • Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы, бывают множественными, фенестрированными и часто закрываются самопроизвольно • Надгребневые (ДМЖП выносящего тракта правого желудочка, 5%) располагаются выше наджелудочкового гребня, часто сопровождаются аортальной недостаточностью аортального клапана, самопроизвольно не закрываются • Открытый АВ-канал (10%) обнаруживают в задней части межжелудочковой перегородки, около места прикрепления колец митрального и трёхстворчатого клапанов, часто встречается при синдроме Дауна, сочетается с ДМПП типа ostium primum и пороками развития створок и хорд митрального и трёхстворчатого клапанов, самопроизвольно не закрывается • В зависимости от размера ДМЖП выделяют малые (болезнь Толочинова–Роже) и большие (более 1 см или половина диаметра устья аорты) дефекты.
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки.
• Объективно • Бледность кожных покровов • Борозды Харрисона • Усиление верхушечного толчка, дрожание в области левого нижнего края грудины • Патологическое расщепление II тона в результате удлинения периода изгнания правого желудочка • Грубый пансистолический шум у левого нижнего края грудины • При надгребневых ДМЖП — диастолический шум аортальной недостаточности.
Инструментальная диагностика
• ЭКГ: признаки гипертрофии и перегрузки левых отделов, а при лёгочной гипертензии — и правых.
• Яремная флебография: высокоамплитудные волны A (сокращение предсердия при ригидном правом желудочке) и, иногда, волна V (трикуспидальная регургитация).
• ЭхоКГ •• Гипертрофия и дилатация левых отделов, а при лёгочной гипертензии — и правых •• Визуализация ДМЖП в допплеровском и В-режиме •• Диагностика сопутствующих аномалий (клапанных пороков, коарктация аорты и др.) •• Определяют систолическое давление в правом желудочке, степень сброса крови и Qp/Qs •• Взрослым проводят чреспищеводную ЭхоКГ.
• Рентгенография органов грудной клетки •• При небольших ДМЖП — нормальная рентгенологическая картина •• Выбухание дуги левого желудочка, усиление лёгочного сосудистого рисунка •• При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
• Радионуклидная вентрикулография: см. Дефект межпредсердной перегородки.
• Катетеризация камер сердца •• Показана при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных •• Вычисляют Qp/Qs •• Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии.
• Левая вентрикулография, коронарная ангиография: визуализация и количественная оценка сброса, диагностика ИБС при наличии симптомов или перед операцией.
Медикаментозное лечение. При бессимптомном течении и нормальном давлении в лёгочной артерии (даже при больших дефектах) возможно консервативное лечение до 3–5 лет жизни. При застое в малом круге кровообращения — периферические вазодилататоры (гидралазин или нитропруссид натрия), уменьшающие сброс слева направо. При правожелудочковой недостаточности — диуретики. До и в течение 6 мес после неосложнённой хирургической коррекции ДМЖП — профилактика инфекционного эндокардита.
Хирургическое лечение
Показания • При бессимптомном течении — если к 3–5 годам жизни не происходит самопроизвольного закрытия дефекта, хотя лучших результатов достигают при оперативном лечении в возрасте до 1 года • Сердечная недостаточность или лёгочная гипертензия у детей младшего возраста • У взрослых отношение Qp/Qs составляет 1,5 и более.
Противопоказания: см. Дефект межпредсердной перегородки.
Методы оперативного лечения. Паллиативное вмешательство — сужение лёгочного ствола манжетой, проводят при необходимости экстренной операции детям с массой тела менее 3 кг, при сопутствующих пороках сердца и малом опыте клиники по радикальной коррекции порока в раннем возрасте. При травматическом дефекте в области мембранозной части межпредсердной перегородки возможно ушивание дефекта. В остальных случаях проводят пластику дефекта заплатой из аутоперикарда или синтетических материалов. При постинфарктном ДМЖП проводят пластику дефекта с одномоментным коронарным шунтированием.
Специфические послеоперационные осложнения: инфекционный эндокардит, АВ-блокада, желудочковые аритмии, реканализация ДМЖП, недостаточность трёхстворчатого клапана.
Прогноз. У 80% пациентов с большими ДМЖП происходит спонтанное закрытие дефекта в течение 1 мес, у 90% — в возрасте до 8 лет, известны единичные случаи спонтанного закрытия ДМЖП в возрасте между 21 и 31 годами. При небольших дефектах продолжительность жизни существенно не меняется, но увеличивается риск инфекционного эндокардита (4%). При ДМЖП средних размеров сердечная недостаточность обычно развивается в детском возрасте, тяжёлую лёгочную гипертензию встречают редко. Большие ДМЖП без градиента давления между желудочками в 10% случаев приводят к развитию синдрома Айзенменгера, большинство таких больных умирают в детском или подростковом возрасте. Неотложное хирургическое вмешательство необходимо 35% детей в течение 3 мес после рождения, 45% — в течение 1 года. Материнская смертность во время беременности и родов при синдроме Айзенменгера превышает 50%. При постинфарктном ДМЖП через 1 год при отсутствии хирургического лечения выживают 7% больных. Госпитальная летальность после сужения лёгочной артерии — 7–9%, 5-летняя выживаемость — 80,7%, 10-летняя — 70,6%. Летальность при хирургическом лечении постинфарктных ДМЖП — 15–50%. Госпитальная летальность при закрытии изолированных врождённых ДМЖП с низким ОЛСС — 2,5%, с высоким ОЛСС — менее 5,6%.
Сокращения. Qp/Qs — отношение лёгочного минутного объёма кровотока к системному. ОЛСС — общее лёгочное сосудистое сопротивление.
МКБ-10 • Q21.0 ДМЖП
дмжп у плода
Всем привет. Девчонки, сразу скажу, что история с печальным концом. Думайте сами читать или нет. Этот пост посыл каждой женщине, которая во время беременности сталкивается с различными диагнозами и приговорами. Чтобы это не было, нужно жить дальше. Не спрашивая, за что всё это, а анализируя, для чего всё это. Итак, если вы хотите услышать историю об увеличенном ТВП, биопсии хориона, приговоре генетиков и прерывании беременности на сроке 13-14 недель, то слушайте.
Постараюсь не углубляться в эмоции и чувства, хреново так, аж выть хочется…
Сейчас лежу в роддоме (в гинеколоческом отделении) и пишу этот пост. Когда-то мечтала, что напишу в январе-феврале 2021 года, когда буду рожать, что ТВП на первом скрининге это не так страшно и всё хорошо. Но вот пишу на полгода раньше, а значит…
Мне 37. Счастливая семья. Сын и дочь. Красивые талантливые дети. С мужем обожаем друг друга. И вот решили всей семьёй родить «маленькое счастье». К этому малышу готовились с мужем, как никогда: витаминчики, правильное питание, спорт, анализы (про пить/курить не пишу, этого в нашей жизни не было). В общем, готовы. Дети ждут с нетерпением. И вот, 5 июня — подарок судьбы. Почти 2 месяца эйфории. Совместных обсуждений, планов. 23 июля — первый удар. Скрининг в перинатальном центре, ТВП 5 мм. ДМЖП плода. Направление 27 июля в МОНИИАГ. 24,25,26 июля — читаем, читаем, читаем, что, у кого, как. Много случаев хороших. А плохих. Будут ли про них писать все женщины, прошедшие это? Хочется делиться радостью, а не горем. Тем не менее, мы отбросили в сторону все негативные прогнозы. Хромосомные отклонений у нас быть не может, а сердечко, сердечко мы решили вылечить своей любовью. 27 июля я с волнением, но без паники поехала в МОНИИАГ. Коридоры безнадёжья. Коридоры надежд. Нас в этот день было человек 25. Вызывали на Узи. После этого смотрели анализ крови, который на скрининге делали и отправляли в коридор ждать. Потом каждую женщину вызывали и генетик объясняла, что им не нравится. Почти всем предлагали сделать биопсию ворсин хориона/ амниоцентез/ кордоцентез. В этот же день. Почти вся толпа перемещаться постепенно от 10 кабинета к 5. Согласились почти все. Пока сидели, немного разговаривали. Все разные девчонки. От 20 до 45. Кто плакал, кто думал, кто торопился. У всех своя история. Но одна надежда. Я старалась всех подбодрить. Все сидели и выискивать в интернете только одно: скрининг, узи, твп, биопсия, ошибка, последствия и т.д… Тогда я и решила, что напишу, когда всё будет хорошо, чтобы поддержать девчонок в таких ситуациях. Не получилось. В процедуре биопсии страшного ничего нет. Именно физически. Минуту вся процедура. Я укол не почувствовала, но когда набирали жидкость, как будто что-то большое из меня вынули. Такое неприятное ощущение. Но очень быстро. Потом посидели минут 10 в коридорчике, слабость небольшая. Поехала на работу. Это был понедельник. Про звонок генетиков я даже не думала, я была уверена, что всё в порядке. Вторник, среда, четверг — обычные рабоче-семейные дни. В пятницу 31 июля пошла сдавать мочу перед плановый посещением ЖК (на 3 августа запись). Забегала к своей гине , сказала, что не звонили, но я же знаю, что всё отлично. Поехала на работу, зашла в магазин. Звонок. «Вас беспокоят генетики. К сожалению, у малыша 13-я лишняя хромосома. Вам нужно приехать в понедельник 3 августа за заключением. Всё. На автомате. Поехала домой, сказала мужу. Не пишу эмоции. Мы просто умерли. Пришлось ехать на работу. Забыв про все свои должностные обязанности, на работе первым делом полезла в интернет. 13-я хромосома. Синдром Патау. Один из самых страшных. Нет, не со мной, не с нами. Ребёнок в муках рождается и в муках умирает. И ни одной положительный истории. В тот день, когда я забирала дочку из садика, она выбежала ко мне, я в неё вцепилась и начала рыдать. Рыдать от счастья, что у меня родились двое здоровых детей, что у меня есть моя семья. Я рыдала от счастья. И рыдала от горя, от безысходности, что не дано нам третьего счастья… Если бы это касалось только меня. А тут, малыш, который обречен и, конечно же, моя семья, счастьем и благополучием которой я не могу так рисковать… Выходные старалась держаться. С семьёй дома — любая боль притупляется . И вот 3 августа, еду в МОНИИАГ. Дают заключение и согласие на прерывание. Я всё ещё надеюсь, что мне скажут, что это ошибка. Я ставлю подпись, не вижу где. Глаза не видят от слез. Как? Как такое могло произойти? Случайность, генетическая случайность. Неправильное деление яйцеклетки и всё… Генетики подписали приговор мне, а я — нашему малышу. Мальчику-Васильку… Дальше в родной Воскресенск в ЖК, направление в стационар. Всё в тумане. В стационар пришла в 16.00, отдала документы все, спросили, есть ли справка на ковид (мазок и антитела). Без них, оказываются, не принимают. Пришёл дежурный врач и сказал, что здесь экстренный случай, можно без этих справок, приходите завтра с вещами к 8.00. 4 августа в 8.00 я в приемном отделении. Берут документы, спрашивают справки на ковид. Объясняю, что вчера сказали без них приходить. А сегодня нельзя так. Вот так. Иду в платную лабораторию и за 4500 сдаю два анализа. Принимают. Всё долго. В 11.00 я в палате. Одна. Обречёнка. В 12.00 осмотр врача. Срок 13-14. Чистить не берётся. Подписываю соглашение о медикаментозно прерывании. Дают первую таблетку в 12.30. В упаковке 3 шт. Пить через сутки. Выдаёт строго врач и наблюдает, как я её пью. Дальше ничего. Я просто лежу и реву до ночи. От тоски по своим. От моего предательства. От несправедливости. Ночью вроде заснула. Проснулась в 4 утра, как я обычно дома встаю. Очень тошнит. Пока сделала все процедуры, походила. В 7 утра пришли, сказали идти сдать кровь. У меня вены хорошие, всегда переношу хорошо. Первый раз я потеряла сознание от сдачи крови. Может, потому что голодная (вчера не ела ничего, я и забыла), может, нервы, может, действие лекарства. Кровь добирали, уложив на кушетку и проткнув другую руку. Вот так. Слабость сильная, довели до палаты. Я вырубилась, как убитая и проспала 2 часа. В 9.00 позвали на завтрак. Я встала. Очень хотела есть. Но не смогла. Тошнит. 10 ложек геркулеса заставила себя съесть, силы нужны. Сладкий чай. Потом находила по палате 6000 шагов. Потом меня направили в соседний корпус на флюорографию. Я погуляла, даже зашла в магазин купить водички. Пришла и начала писать этот пост. В 12.30 мне дали ещё одну таблетку. В 13.00 я пообедала немного. Сейчас лежу голова сильно болит и пока на этом всё…
Девчонки! Я всё равно хочу поддержать каждую из вас!!! Не падайте духом!!! Цените, что есть!!! И те, кому ещё только предстоит пройти испытания! Держитесь, девочки!!!
Я знаю, что у меня в эти дни случится ещё много неприятного и грустного и хреново мне, очень хреново. Но я знаю, что дома меня ждут и любят!!! А уж как я люблю и ценю…
Счастья вам, девочки!!!